Eigenschaften/WirkungenATC-Code
R03DX10
Wirkungsmechanismus
Bei Benralizumab handelt es sich um einen humanisierten, afukosylierten, monoklonalen Antikörper (IgG1, Kappa). Benralizumab bindet mit hoher Affinität (16 pM) und Spezifität an die Alpha-Untereinheit des humanen Interleukin-5-Rezeptors (IL-5Rα). Der IL-5-Rezeptor wird besonders auf den Oberflächen von eosinophilen und basophilen Granulozyten exprimiert. Das Fehlen von Fukose im Fc-Teil von Benralizumab führt zu einer Bindung mit hoher Affinität (45,5 nM) an FcγRIII-Rezeptoren auf Immuneffektorzellen wie beispielsweise den natürlichen Killerzellen (NK). Diese Bindung führt zu einer verstärkten, antikörperabhängigen zellvermittelten Zytotoxizität (ADCC) und folglich zur Apoptose von Eosinophilen und Basophilen.
Die eosinophile Entzündung trägt bei eosinophilen Asthmaformen und bei EGPA wesentlich zur Pathogenese der Erkrankung bei.
Pharmakodynamik
Wirkung auf Eosinophile im Blut
Die Behandlung mit Benralizumab bei Asthmapatienten führt innerhalb von 24 Stunden nach der ersten Dosis zu einer beinahe kompletten Depletion der Eosinophilen im Blut, welche während der gesamten Behandlungsperiode erhalten bleibt. Die Depletion der Eosinophilen im Blut wird begleitet von einer Reduktion von eosinophilen Granula-Proteinen im Serum, Eosinophil-derived Neurotoxin (EDN), und dem eosinophilen kationischen Protein (ECP) sowie einer Reduktion der Basophilen im Blut.
In den klinischen Studien 1 (SIROCCO) und 2 (CALIMA) verminderte sich nach der subkutanen Verabreichung der empfohlenen Benralizumab-Dosis die Eosinophilenanzahl im Blut auf einen medianen Absolutwert von 0 Zellen/μl, was einer medianen Verringerung von 100% entspricht (siehe «Klinische Wirksamkeit»). Dieses Ausmass der Verminderung wurde beim ersten Beobachtungszeitpunkt sowie nach 4 Wochen Behandlung festgestellt und blieb während des gesamten Behandlungszeitraums erhalten.
Über die gesamte 56-wöchige Extensionsphase (Studie 4, BORA) hinweg wurde eine Aufrechterhaltung der Eosinophilen-Depletion beobachtet, was in Einklang mit Befunden aus den früheren Studien steht.
Bei Patienten mit EGPA entsprach die Depletion der Eosinophilen im Blut der Wirkung, die in den Asthmastudien beobachtet wurde. Die Depletion der Eosinophilen im Blut wurde beim ersten Beobachtungszeitpunkt eine Woche nach Behandlung beobachtet und hielt über die gesamte 52wöchige Behandlungsphase an.
Wirkung auf Eosinophile in der Atemwegsschleimhaut
Die Wirkung von Benralizumab auf Eosinophile der Atemwegsschleimhaut von Asthmapatienten mit erhöhter Anzahl Eosinophiler im Sputum (≥2,5%) wurde in einer 12wöchigen, Phase-1, randomisierten, doppelblinden, Placebo-kontrollierten, klinischen Studie mit Benralizumab 100 oder 200 mg subkutan evaluiert. In dieser Studie gab es eine mediane Verminderung der Eosinophilen in der Atemwegsschleimhaut gegenüber der Baseline um insgesamt 96% in der mit Benralizumab behandelten Gruppe im Vergleich zur Verringerung um 47% in der Placebo-Gruppe (p=0,039).
Klinische Wirksamkeit
Asthma
Die Wirksamkeit von Fasenra wurde in 3 randomisierten, doppelblinden, Placebo-kontrollierten, klinischen Studien von 28- bis 56-wöchiger Dauer an Patienten ab 12 Jahren untersucht.
In diesen Studien wurde Fasenra mit einer Dosis von 30 mg einmal alle 4 Wochen für die ersten 3 Dosen und anschliessend alle 4 oder 8 Wochen als Zusatztherapeutikum zur Standardbehandlung verabreicht und vergleichend zur Standardbehandlung mit Placebo untersucht.
Die beiden Placebo-kontrollierten Exazerbationsstudien Studie 1 (SIROCCO) und Studie 2 (CALIMA) hatten eine Dauer von 48 bzw. 56 Wochen und es nahmen insgesamt 2'510 Patienten (Erwachsene oder Jugendliche ab 12 Jahren) mit unkontrolliertem Asthma teil. Davon wurden 822 Patienten mit der beantragten Dosis behandelt. In der Krankengeschichte der Patienten mussten in den vergangenen 12 Monaten mindestens 2 Asthma-Exazerbationen aufgetreten sein, die eine orale oder systemische Kortikosteroidbehandlung erforderten. Zudem musste eine ACQ-6 Auswertung von 1,5 oder höher beim Screening, sowie eine verringerte Lungenfunktion bei Baseline (vor Bronchodilatation forciertes Expirationsvolumen in 1 Sekunde (FEV1) < 80% bei Erwachsenen und < 90% bei Jugendlichen) vorliegen. Patienten der Studie 1 hatten eine reguläre Behandlung mit hochdosierten inhalierten Kortikosteroiden ICS, Patienten in Studie 2 eine ICS-Behandlung mit mittlerer oder hoher Dosis in Kombination mit lang wirksamen Beta-Agonisten (LABA). Die mittlere Anzahl von Exazerbationen im vorausgegangenen Jahr war 3 und die durchschnittliche vorhergesagte «vor Bronchodilatation» FEV1 war 57,5%. Die Patienten wurden nach geographischer Lage, Alter und Eosinophilenanzahl im peripheren Blut stratifiziert (≥300 Zellen/μl oder < 300 Zellen/μl).
An der Placebo-kontrollierten Studie 3 (ZONDA) zur Reduktion oraler Kortikosteroide (OCS) nahmen insgesamt 220 Asthmapatienten (61% Frauen; Durchschnittsalter 51 Jahre) teil, 73 davon wurden mit der beantragten Dosis behandelt. In die Studie wurden Patienten eingeschlossen, die täglich mit OCS (7,5–40 mg pro Tag) behandelt wurden und zusätzlich regelmässig hochdosierte ICS und LABA mit oder ohne zusätzliche Bedarfsmedikamente einnahmen, um die Asthmakontrolle aufrechtzuerhalten. Die Studie umfasste einen 8wöchigen Run-in-Zeitraum, in dem die OCS auf die minimal wirksame Dosis titriert wurden, ohne die Asthmakontrolle zu verlieren. Die mittlere OCS-Dosis bei Baseline lag bei allen Behandlungsgruppen auf ähnlichem Niveau. Die Patienten mussten eine Eosinophilenanzahl im peripheren Blut von mindestens 150 Zellen/μl sowie mindestens eine Exazerbation in den vergangenen 12 Monaten aufweisen. Die mittlere OCS-Dosis bei Baseline lag bei 10 mg (Bereich 8–40 mg) bei allen 3 Behandlungsgruppen. An der einarmigen Studie 6 (PONENTE) zur Reduktion der OCS nahmen insgesamt 598 Patienten (64% weiblich; Durchschnittsalter 53 Jahre) teil, die alle mit der beantragten Dosis behandelt wurden. Die mittlere OCS-Dosis bei Baseline betrug 10 mg (Bereich 5–60 mg).
Während zwei Dosisschemata in den Studien 1, 2 und 3 untersucht wurden, ist das empfohlene Dosisschema von Fasenra alle 4 Wochen für die ersten 3 Dosen und danach alle 8 Wochen (siehe «Dosierung/Anwendung»).
Exazerbationen
Den primären Endpunkt für Studie 1 (SIROCCO) und Studie 2 (CALIMA) stellte die jährliche Häufigkeit klinisch signifikanter Asthma-Exazerbationen bei solchen Patienten dar, die bei Baseline einen Eosinophilenwert im Blut von mindestens 300 Zellen/μl aufwiesen und die hochdosierte ICS und LABA inhalierten. Eine klinisch signifikante Asthma-Exazerbation wurde als eine Verschlechterung des Asthmas definiert, bei der aufgrund des Asthmas mindestens 3 Tage lang orale/systemische Kortikosteroide verwendet werden mussten, und/oder eine stationäre Aufnahme erfolgte, bei der eine Behandlung mit oralen/systemischen Kortikosteroiden notwendig war und/oder die Notaufnahme aufgesucht werden musste. Für Patienten, die orale Kortikosteroide als Erhaltungstherapie einnahmen, wurde eine klinisch signifikante Asthma-Exazerbation wie folgt definiert: Kurzzeitige Erhöhung der vorher stabilen oralen/systemischen Kortikosteroide über mindestens 3 Tage oder Gabe einer einzelnen Depot-Injektion eines Kortikosteroids.
In beiden Studien 1 und 2 zeigten Patienten mit mindestens 300 Zellen/μl Eosinophile im Blut unter Fasenra eine signifikante Verringerung der jährlichen Exazerbationsrate verglichen mit Placebo (Tabelle 1). Änderung der durchschnittlichen FEV1 gegenüber der Baseline wurde in beiden Studien gemessen und hat zumindest numerische Vorteile zu jedem Zeitpunkt ab 4 Wochen gezeigt (siehe Abbildung 1). Die Wirkung wurde bis zum Ende der gesamten Behandlung, wie in Tabelle 1 gezeigt, erhalten.
Tabelle 1. Ergebnisse für die jährliche Exazerbationsrate und Lungenfunktion am Ende der Behandlung von Studie 1 (SIROCCO) und 2 (CALIMA) gegen die Anzahl der Eosinophilen.
|
|
Studie 1
|
Studie 2
| |
Fasenra
|
Placebo
|
Fasenra
|
Placebo
| |
Anzahl der Eosinophile im Blut ≥300 Zellen/μla
|
n=267
|
n=267
|
n=239
|
n=248
| |
Klinisch signifikante Exazerbationen
| |
Rate
|
0,74
|
1,52
|
0,73
|
1,01
| |
Differenz
|
-0,78
|
-0,29
| |
Rate ratio (95% KI)
|
0,49 (0,37; 0,64)
|
0,72 (0,54; 0,95)
| |
p-Wert
|
< 0,001
|
0,019
| |
FEV1 vor Bronchodilatation (Liter)
| |
Durchschnitt Baseline
|
1,660
|
1,654
|
1,758
|
1,815
| |
Verbesserung gegenüber der Baseline
|
0,398
|
0,239
|
0,330
|
0,215
| |
Differenz (95% KI)
|
0,159 (0,068; 0,249)
|
0,116 (0,028; 0,204)
| |
p-Wert
|
0,001
|
0,010
|
a Intent-to-Treat (ITT)-Population (Patienten unter Behandlung von hochdosierten ICS und Eosinophilen im Blut ≥300 Zellen/μl).
Eine kombinierte Analyse der Studien 1 und 2 zeigte eine stärkere Verminderung der Exazerbationsrate mit zunehmender Anzahl Eosinophilen im Blut bei Baseline. Ebenfalls hat eine kombinierte Analyse eine grössere Verbesserung von FEV1 bei Patienten mit zunehmender Anzahl Eosinophiler im Blut gezeigt.
Für Studie 1 (SIROCCO) war die Rate der Exazerbationen, die eine stationäre Aufnahmen und/oder einen Besuch der Notaufnahme erforderte, für Patienten unter Fasenra im Vergleich zu Placebo 0,09 versus 0,25 (Rate ratio 0,37, 95% KI: 0,20, 0,67, p ≤0,001). Diese Rate war für Studie 2 (CALIMA) 0,12 versus 0,10 (Rate ratio 1,23; 95% KI: 0,64; 2,35; p=0,538). Studie 2 zeigte diesbezüglich numerisch keine Vorteile für Fasenra. Allerdings war die Ereignisrate zu gering, um Schlussfolgerungen zur Wirkung von Fasenra auf schwere Exazerbationen ziehen zu können, die stationäre Aufnahmen und/oder Besuche der Notaufnahme erforderten.
Abbildung 1. Mittlere Änderung gegenüber der Baseline FEV1 vor Bronchodilatation (Liter), Studie 1 (SIROCCO) und 2 (CALIMA)
Studie 1
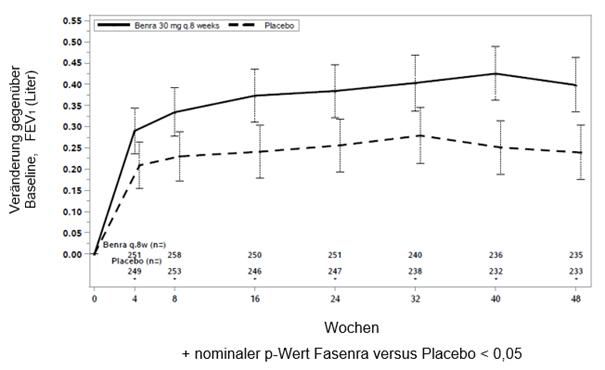
Studie 2
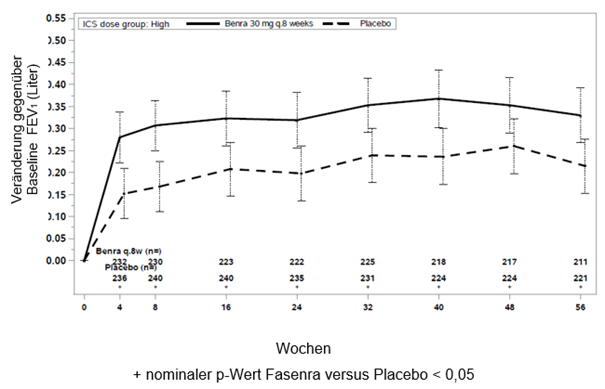
Die Anzahl an Patienten, bei denen mindestens eine Exazerbation auftrat, war unter Fasenra niedriger im Vergleich zu Placebo (35% vs 51% in Studie 1 und 40% vs 51% in Studie 2), und die Zeit bis zur 1. Exazerbation war länger für Fasenra in beiden Studien (Hazard ratio 0,60; 95% KI: 0,46; 0,78 und Hazard ratio 0,73; 95% KI: 0,55; 0,95 entsprechend in Studie 1 und 2).
Zusätzlich wurde am Ende der Behandlung eine Verbesserung der mittleren Änderung des morgendlichen und abendlichen Peak Expiratory Flow (PEF) gegenüber der Baseline bei Patienten unter Fasenra im Vergleich zu Placebo beobachtet.
In beiden Studien 1 und 2 trat bei Patienten, die Fasenra erhalten hatten, eine statistisch signifikante Reduktion an Asthmasymptomen auf (Gesamt Asthma-Score) in Vergleich zu Patienten, die Placebo erhalten hatten. Eine konsistente Verbesserung in Bezug auf Fasenra wurde im Zuge des Asthmakontrollfragebogens (Asthma Control Questionnaire-6: ACQ-6) und des standardisierten Asthmafragebogens zur Lebensqualität für Personen ab 12 Jahren (Standardised Asthma Quality of Life Questionnaire for 12 Years and Older: AQLQ(S)+12) erhalten (Tabelle 2).
Tabelle 2. Behandlungsunterschied als mittlere Änderung gegenüber der Baseline des Asthmasymptom-Score, ACQ-6 und AQLQ(s)+12 am Ende der Behandlunga
|
Wirksamkeitsvariable
|
Studie 1
(SIROCCO)
|
Studie 2
(CALIMA)
| |
Fasenra
na=267
|
Placebo
na=267
|
Fasenra
na=239
|
Placebo
na=248
| |
Gesamter Asthmasymptom-Scoreb
| |
Durchschnittliche Baseline
|
2,68
|
2,74
|
2,76
|
2,71
| |
Verbesserung gegenüber Baselineb
|
-1,30
|
-1,04
|
-1,40
|
-1,16
| |
Differenz (95% KI)
|
-0,25 (-0,45; -0,06)
|
-0,23 (-0,43; -0,04)
| |
p-Wert
|
0,012
|
0,019
| |
ACQ-6
| |
Durchschnittliche Baseline
|
2,81
|
2,90
|
2,80
|
2,75
| |
Verbesserung gegenüber Baseline
|
-1,46
|
-1,17
|
-1,44
|
-1,19
| |
Differenz (95% KI)
|
-0,29 (-0,48; -0,10)
|
-0,25 (-0,44; -0,07)
| |
AQLQ(S)+12
| |
Durchschnittliche Baseline
|
3,93
|
3,87
|
3,87
|
3,93
| |
Verbesserung gegenüber Baseline
|
1,56
|
1,26
|
1,56
|
1,31
| |
Differenz (95% KI)
|
0,30 (0,10, 0,50)
|
0,24 (0,04; 0,45)
|
a Patientenanzahl (n) variiert leicht auf Grund der Patientenanzahl, für welche Daten für die jeweilige Variable vorhanden waren. Die angegebenen Resultate basieren auf den letzten verfügbaren Daten für jede Variable.
b Asthmasymptom-Score: Gesamt-Score von 0 (niedrigste) bis 6 (höchste); Tag- und Nacht-Zeit Asthmasymptom-Score von 0 (niedrigste) bis 3 (höchste) Symptome. Individuelle Tag- und Nacht-Zeit Scores waren ähnlich.
Untergruppen Analysen nach Exazerbationsvorgeschichte
Eine Analyse der Subgruppen aus Studie 1 und 2 identifizierte eine höhere Exazerbationsrate in der Vorgeschichte als potentiellen Prädiktor für ein verbessertes Ansprechen auf die Behandlung mit Benralizumab. Die Exazerbationsrate kann alleine oder kombiniert mit einer höheren Baseline-Anzahl von Eosinophilen im Blut zur Identifikation von Patienten herangezogen werden, welche ein besseres Ansprechen auf die Benralizumab Behandlung erreichen könnten.
In beiden Studien zeigten Patienten, die innerhalb von 12 Monaten vor der Fasenra-Randomisierung 3 oder mehr Exazerbationen hatten, eine grössere Senkung der Exazerbationsrate, als Patienten mit weniger als 3 vorherigen Exazerbationen (siehe Tabelle 3).
Tabelle 3: Exazerbationsrate und Lungenfunktion (FEV1) am Behandlungsende nach Anzahl der Exazerbationen im vorherigen Jahr, Studie 1 (SIROCCO) und 2 (CALIMA) (Intent-to-Treat Population)
|
|
Studie 1
|
Studie 2
| |
|
Fasenra (N=267)
|
Placebo (N=267)
|
Fasenra (N=239)
|
Placebo (N=248)
| |
Baseline mit 2 Exazerbationen
| |
n
|
164
|
149
|
144
|
151
| |
Exazerbationsrate
|
0,57
|
1,04
|
0,63
|
0,62
| |
Differenz
|
-0,47
|
0,01
| |
Inzidenzrate
(95% KI)
|
0,55
(0,37; 0,80)
|
1,01
(0,70;1,46)
| |
Durchschnittliche Veränderung FEV1 vor Bronchodilatation
|
0,343
|
0,230
|
0,266
|
0,236
| |
Inzidenzrate
(95% KI)
|
0,113
(-0,002; 0,228)
|
0,029
(-0,079; 0,137)
| |
Baseline mit mehr als 3 Exazerbationen
| |
n
|
103
|
118
|
95
|
97
| |
Exazerbationsrate
|
0,95
|
2,23
|
0,82
|
1,65
| |
Differenz
|
-1,28
|
-0,84
| |
Inzidenzrate
(95% KI)
|
0,43
(0,29; 0,63)
|
0,49
(0,33; 0,74)
| |
Durchschnittliche Veränderung FEV1 vor Bronchodilatation
|
0,486
|
0,251
|
0,440
|
0,174
| |
Inzidenzrate
(95% KI)
|
0,235
(0,088; 0,382)
|
0,265
(0,115; 0,415)
|
Hinsichtlich der Asthmasymptome wiesen Patienten mit einer Vorgeschichte von 3 oder mehr Exazerbationen in den 12 Monaten vor der Randomisierung am Ende der Behandlung mit Fasenra in Studie 1 bzw. 2 mittlere Score-Differenzen von -0,32 und -0,41 im Vergleich zur Baseline auf (Studie 1 95% KI: -0,62, -0,01; Studie 2 95% KI: -0,73, -0,09). Patienten mit einer Vorgeschichte von 2 Exazerbationen in den 12 Monaten vor der Randomisierung zeigten am Ende der Behandlung mit Fasenra in Studie 1 bzw. 2 mittlere Punktzahl-Differenzen hinsichtlich der Asthmasymptome von -0,22 und -0,12 im Vergleich zur Baseline (Studie 1: 95% KI: -0,49; -0,04; Studie 2: 95% KI: -0,37; -0,13).
Studien zur Verringerung der Oralen Kortikosteroid (OCS)-Anwendung
Die Studien ZONDA (Studie 3), eine Placebo-kontrollierte Studie, und PONENTE (Studie 6), eine offene Studie, beurteilten die Wirkung von Fasenra in Bezug auf die Verringerung der Anwendung von oralen OCS als Erhaltungstherapie.
In Studie 3 war der primäre Endpunkt die prozentuale Verringerung der OCS-Dosis bei Studienabschluss in den Wochen 24–28 gegenüber der Baseline, bei gleichzeitig fortgesetzter Asthmakontrolle. Im Vergleich zu Placebo konnten die mit Fasenra behandelten Patienten die tägliche Erhaltungsdosis oraler Kortikosteroide bei gleichzeitiger Erhaltung der Asthmakontrolle stärker senken. Eine Verringerung der OCS-Dosis von 50% oder mehr wurde bei 48 Patienten (66%) beobachtet, welche Fasenra erhielten, verglichen zu 28 Patienten (37%), welche Placebo erhielten. Die Tabelle 4 fasst die Ergebnisse der Studie 3 zusammen.
Tabelle 4. Wirkung von Fasenra auf die Verringerung der OCS-Dosis, Studie 3 (ZONDA)
|
|
Fasenra
N=73
|
Placebo
N=75
| |
Wilcoxon-rank sum test (primäre Analysemethode)
| |
Mediane prozentuale Verringerung der täglichen OCS-Dosis gegenüber Baseline (95% KI)
|
75 (60; 88)
|
25 (0; 33)
| |
Wilcoxon-rank sum test, p-Wert
|
< 0,001
|
| |
Proportional Odds Model (Empfindlichkeitsanalyse)
| |
Prozentuale Reduktion der OCS im Vergleich zur Baseline bis Woche 28
| |
≥90%
|
27 (37%)
|
9 (12%)
| |
≥75%
|
37 (51%)
|
15 (20%)
| |
≥50%
|
48 (66%)
|
28 (37%)
| |
> 0%
|
58 (79%)
|
40 (53%)
| |
Keine Änderung oder keine Verringerung an OCS
|
15 (21%)
|
35 (47%)
| |
Odds Ratio (95% KI)
|
4,12 (2,22; 7,63)
|
| |
Reduktion der täglichen OCS-Dosis auf 0 mg/Tag*
|
22 (52%)
|
8 (19%)
| |
Odds Ratio (95% KI)
|
4,19 (1,58; 11,12)
|
| |
Reduktion der täglichen OCS-Dosis auf ≤5 mg/Tag
|
43 (59%)
|
25 (33%)
| |
Odds Ratio (95% KI)
|
2,74 (1,41; 5,31)
|
| |
Exazerbationsrate
|
0,54
|
1,83
| |
Rate ratio (95% KI)
|
0,30 (0,17; 0,53)
|
| |
Exazerbationsrate, die stationäre Aufnahmen/Besuche der Notaufnahme erforderten
|
0,02
|
0,32
| |
Rate ratio (95% KI)
|
0,07 (0,01; 0,63)
|
|
*Nur Patienten mit optimierter Baseline OCS-Dosis von 12,5 mg oder weniger konnten eine 100% Reduktion der OCS-Dosis während der Studie erreichen.
Zusätzlich wurden in Studie 3 die Lungenfunktion, der Asthmasymptomscore, der ACQ-6 und der AQLQ(S)+12 untersucht. Die Resultate waren vergleichbar zu den Resultaten aus Studie 1 und 2.
In die Studie 6 wurden 598 erwachsene Patienten mit schwerem Asthma (Eosinophilenzahl im Blut von ≥150 Zellen/μl bei Aufnahme in die Studie oder ≥300 Zellen/μl in den letzten 12 Monaten, wenn die Eosinophilenzahl im Blut bei Aufnahme in die Studie < 150 Zellen/μl betrug) aufgenommen, die von oralen Kortikosteroiden abhängig waren. Primäre Endpunkte waren der Anteil an Patienten, die unter Aufrechterhaltung der Asthmakontrolle die OCS absetzen konnten, und der Anteil an Patienten, die unter Aufrechterhaltung der Asthmakontrolle und unter Berücksichtigung der Nebennierenfunktion eine finale OCS-Dosis von 5 mg oder weniger erreichten. Der Anteil an Patienten, die die OCS-Erhaltungstherapie absetzen konnten, betrug 62,9%. Der Anteil an Patienten, die eine finale OCS-Dosis von 5 mg oder weniger erreichten (unter Aufrechterhaltung der Asthmakontrolle und ohne Einschränkung der Nebennierenfunktion), betrug 81,9%. Die Wirkungen auf die OCS-Reduktion waren unabhängig von der Eosinophilenzahl im Blut bei Aufnahme in die Studie (einschliesslich Patienten mit einer Eosinophilenzahl im Blut von < 150 Zellen/μl) vergleichbar und wurden über einen zusätzlichen Zeitraum von 24 bis 32 Wochen aufrechterhalten. Die jährliche Exazerbationsrate war in Studie 6 vergleichbar mit der in den vorhergehenden Studien berichteten Rate.
Langzeit-Extensionsstudien
Die Langzeitsicherheit von Fasenra wurden im Rahmen einer doppelblinden, randomisierten, 56-wöchigen Extensionsstudie der Phase 3 mit Parallelgruppen beurteilt (Studie 4, BORA). Die Langzeitsicherheit von Fasenra wurde zudem in der offenen Sicherheits-Extensionsstudie MELTEMI (Studie 5) untersucht (siehe «Unerwünschte Wirkungen»).
In Studie 4 (BORA) wurden 2123 erwachsene und jugendliche Patienten (ab 12 Jahren) aus den Studien 1 (SIROCCO), 2 (CALIMA) und 3 (ZONDA) aufgenommen. Davon wurden 842 Patienten mit Fasenra mit der genehmigten Dosierung behandelt.
Studie 4 (BORA) diente primär der Untersuchung der Langzeitsicherheit und -verträglichkeit von Fasenra. Zudem wurde der weitere Verlauf der jährlichen Exazerbationsrate, Lungenfunktion, ACQ-6, AQLQ(S)+12 sowie der OCS-Dosis beobachtet. Dabei wurde die in den beiden vorherigen Studien evaluierten Dosierungsschemata angewendet.
Die in den vorherigen Studien 1 und 2 im Vergleich zu Placebo festgestellte geringere Exazerbationsrate und OCS-Dosis war auch im zweiten Jahr unter Anwendung des genehmigten Dosierungsschemas zu verzeichnen. Die in den vorherigen Studien 1 und 2 festgestellten Verbesserungen bei der Lungenfunktion, ACQ-6 und AQLQ(S)+12 blieben ebenfalls im zweiten Jahr unter Anwendung des genehmigten Dosierungsschemas erhalten.
In Studie 5 wurde die Langzeitsicherheit bei 226 Patienten untersucht, die mindestens eine Dosis von Fasenra im empfohlenen Dosierungsschema erhielten. Die jährliche Exazerbationsrate in Studie 5 (0,47) war vergleichbar mit der in den Studien 1 (0,74), 2 (0,73) und 4 (0,46).
Eosinophile Granulomatose mit Polyangiitis (EGPA)
Bei Patienten mit EGPA im Alter ab 18 Jahren wurden die Wirksamkeit und Sicherheit von Fasenra in einer randomisierten, doppelblinden, aktiv kontrollierten klinischen Nichtunterlegenheitsstudie mit 52wöchiger Behandlungsdauer beurteilt. Insgesamt 140 Patienten mit rezidivierender oder refraktärer Erkrankung wurden randomisiert. Fasenra 30 mg wurde im Vergleich zu Mepolizumab 300 mg subkutan alle 4 Wochen zusätzlich zur Basistherapie mit Prednisolon/Prednison mit oder ohne immunsuppressive Therapie beurteilt. Die OCS-Dosis wurde nach Ermessen des Prüfarztes ausgeschlichen. Patienten, die zu Beginn der Studie aktiv mit Cyclophosphamid oder Rituximab behandelt wurden, waren ausgeschlossen.
Die demografischen Daten und Baseline-Merkmale sind in Tabelle 5 aufgeführt.
Tabelle 5. Demografische Daten und Baseline-Merkmale in der EGPA-Studie
|
|
Gesamtpopulation (N=140)
| |
Mittleres Alter (Jahre)
|
52
| |
Weiblich (%)
|
60
| |
Weiss (%)
|
79
| |
Zeit seit der EGPA-Diagnose, Jahre, Mittelwert (SD)
|
5,2 (5,64)
| |
≥1 bestätigtes Rezidiv in den letzten 2 Jahren (%)
|
79
| |
Refraktäre Erkrankung (%)
|
60
| |
Baseline-Tagesdosis an oralen Kortikosteroidena, mg, Median (Bereich)
|
10 (5–40)
| |
Erhalt von immunsuppressiver Therapieb (%)
|
36
| |
ANCA-positivc (%)
|
29
|
SD = Standardabweichung.
a.Prednison- oder Prednisolon-Äquivalent.
b.Azathioprin, Methotrexat, Mycophenolat.
c.Historisch oder zum Screeningzeitpunkt positiv für antineutrophile zytoplasmatische Antikörper (ANCA).
Remission
Der primäre Endpunkt war der Anteil der Patienten in Remission, definiert als ein Birmingham Vasculitis Activity Score (BVAS) = 0 (keine aktive Vaskulitis) plus Prednisolon-/Prednison-Dosis von ≤4 mg/Tag sowohl in Woche 36 als auch in Woche 48. Wie in Tabelle 6 aufgeführt, zeigte Fasenra eine Nichtunterlegenheit gegenüber Mepolizumab bezüglich des primären Endpunkts. Die Ergebnisse für die kumulierte Dauer der Remission und die Komponenten der Remission sind ebenfalls in Tabelle 6 aufgeführt.
Tabelle 6. Remission und Komponenten der Remission in EGPA
|
|
Remission
(OCS ≤4 mg/Tag +
BVAS=0)
|
OCS ≤4 mg/Tag
|
BVAS=0
| |
Fasenraa
N=70
|
Mepob
N=70
|
Fasenraa
N=70
|
Mepob
N=70
|
Fasenraa
N=70
|
Mepob
N=70
| |
Patienten in Remission nach 36 und 48 Wochen
| |
Patienten, n (%)c
|
40 (58)
|
40 (57)
|
42 (61)
|
41 (58)
|
58 (83)
|
59 (84)
| |
Differenzen in der Remissionsrate, (%)c (95%-KI)
|
1,21
(-14,11; 16,53)
|
--
--
|
2,64
(-12,67; 17,95)
|
--
--
|
-1,17
(-13,27; 10,94)
|
--
--
| |
Kumulierte Dauer über 52 Wochen, n (%)
| |
0 Wochend
|
9 (13)
|
15 (21)
|
9 (13)
|
12 (17)
|
0
|
0
| |
>0 bis <12 Wochen
|
13 (19)
|
10 (14)
|
11 (16)
|
12 (17)
|
0
|
2 (3)
| |
12 bis <24 Wochen
|
8 (11)
|
8 (11)
|
9 (13)
|
8 (11)
|
2 (3)
|
2 (3)
| |
24 bis <36 Wochen
|
20 (29)
|
19 (27)
|
19 (27)
|
18 (26)
|
6 (9)
|
7 (10)
| |
≥36 Wochen
|
20 (29)
|
18 (26)
|
22 (31)
|
20 (29)
|
62 (89)
|
59 (84)
| |
Odds Ratioe
(95%-KI)
|
1,32
(0,72; 2,40)
|
--
--
|
1,27
(0,70; 2,31)
|
--
--
|
1,50
(0,54; 4,15)
|
--
--
|
N = Anzahl der Patienten in der Analyse.
a Fasenra 30 mg alle 4 Wochen.
b Mepolizumab (Mepo) 300 mg alle 4 Wochen.
c Modell-adjustierte Prozentsätze.
d Zu keinem Zeitpunkt eine Remission erreicht.
e Eine Odds Ratio von >1 spricht zugunsten von Fasenra.
Der Anteil der Patienten, die innerhalb der ersten 24 Wochen der Behandlung eine Remission erreichten und bis Woche 52 in Remission blieben, betrug 42 % für Fasenra und 37% für Mepolizumab (Differenz der Responderrate 5,54%, 95%-KI: -9,30; 20,37).
Bei Verwendung einer alternativen Remissionsdefinition von BVAS=0 plus Prednisolon/Prednison von ≤7,5 mg/Tag wurde eine entsprechende Wirksamkeit zwischen den Gruppen für diese Endpunkte beobachtet.
Die Patienten erreichten den primären Remissionsendpunkt in allen vorgegebenen Subgruppen der demografischen Daten und Baseline-Merkmale.
Rezidive
Die Hazard Ratio für die Zeit bis zum ersten Rezidiv (definiert als Verschlechterung von Vaskulitis, Asthma oder sinunasalen Symptomen, die eine Erhöhung der Dosis der Kortikosteroide oder der immunsuppressiven Therapie oder eine Hospitalisierung erforderte) betrug 0,98 (95%-KI: 0,53; 1,82). Rezidive wurden bei 30% der Patienten unter Fasenra und 30% der Patienten unter Mepolizumab beobachtet. Die annualisierte Rezidivrate betrug 0,50 für Patienten unter Fasenra versus 0,49 für Patienten unter Mepolizumab (Rate Ratio 1,03, 95%-KI: 0,56; 1,90). Die Arten der Rezidive waren für Patienten unter Fasenra und Mepolizumab vergleichbar.
Reduktion von oralen Kortikosteroiden
Die durchschnittliche OCS-Tagesdosis in den Wochen 48 bis 52 ist in Tabelle 7 aufgeführt. Eine Reduktion der OCS-Dosis um 100% wurde bei 41% der Patienten unter Fasenra beobachtet, verglichen mit 26% der Patienten, die Mepolizumab erhielten (Differenz 15,69%, 95%-KI: 0,67; 30,71). Eine Reduktion um 50% oder mehr wurde bei 85% der Patienten unter Fasenra beobachtet, verglichen mit 74% der Patienten, die Mepolizumab erhielten (Differenz 10,79%, 95%-KI: -2,25; 23,83).
Tabelle 7. Durchschnittliche Tagesdosis oraler Kortikosteroide in den Wochen 48 bis 52 in EGPA
|
|
Anzahl der Patienten (%)
| |
Fasenraa (N=70)
|
Mepolizumabb (N=70)
| |
0 mg
>0 bis ≤4,0 mg
>4,0 bis ≤7,5 mg
>7,5 mg
|
29 (41)
19 (27)
15 (21)
7 (10)
|
19 (27)
30 (43)
13 (19)
8 (11)
| |
Odds Ratioc (95%-KI)
|
1,38 (0,75; 2,54)
|
--
|
N = Anzahl der Patienten in der Analyse.
a Fasenra 30 mg alle 4 Wochen.
b Mepolizumab 300 mg alle 4 Wochen.
c Eine Odds Ratio von >1 spricht zugunsten von Fasenra.
|


