ZusammensetzungWirkstoffe
Guselkumab, aus gentechnisch veränderten CHO (Chinese Hamster Ovary)-Zellen hergestellt.
Hilfsstoffe
Saccharose, Histidin, Histidinhydrochlorid-Monohydrat, Polysorbat 80, Wasser für Injektionszwecke q.s. ad solutionem pro 1 ml.
Indikationen/AnwendungsmöglichkeitenPlaque-Psoriasis
TREMFYA ist indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer, chronischer Plaque-Psoriasis, die für eine systemische Therapie in Frage kommen.
Psoriasis-Arthritis
TREMFYA ist allein oder in Kombination mit Methotrexat (MTX) indiziert zur Behandlung von erwachsenen Patienten mit aktiver Psoriasis-Arthritis, die auf eine vorgängige Therapie mit einem krankheitsmodifizierenden Antirheumatikum (DMARD) unzureichend angesprochen oder dieses nicht vertragen haben (siehe «Eigenschaften/Wirkungen»).
Dosierung/AnwendungDie Anwendung von TREMFYA sollte unter Anleitung und Aufsicht eines in der Diagnose und Behandlung der indizierten Therapiegebiete erfahrenen Arztes erfolgen.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Plaque-Psoriasis
Die empfohlene Dosis von TREMFYA beträgt 100 mg als subkutane Injektion in Woche 0 und 4, gefolgt von einer Erhaltungsdosis alle 8 Wochen.
Bei Patienten, die nach 16-wöchiger Behandlung kein Ansprechen zeigen, sollte der Abbruch der Behandlung in Erwägung gezogen werden.
Psoriasis-Arthritis
Die empfohlene Dosis von TREMFYA beträgt 100 mg als subkutane Injektion in Woche 0 und 4, gefolgt von einer Erhaltungsdosis alle 8 Wochen.
Bei Patienten, die nach 24-wöchiger Behandlung kein Ansprechen zeigen, sollte der Abbruch der Behandlung in Erwägung gezogen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
TREMFYA wurde in dieser Patientenpopulationen nicht untersucht. Es können keine Dosisempfehlungen gegeben werden.
Patienten mit Nierenfunktionsstörungen
TREMFYA wurde in dieser Patientenpopulationen nicht untersucht. Es können keine Dosisempfehlungen gegeben werden.
Ältere Patienten
Es wurden keine spezifischen Studien bei älteren Patienten durchgeführt. Es wird keine Dosisanpassung bei älteren Patienten empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von TREMFYA bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht. Es liegen keine Daten vor.
Art der Anwendung
TREMFYA ist für die subkutane Injektion bestimmt und soll in das Abdomen oder den Oberschenkel verabreicht werden. Wenn möglich sollten Hautbezirke mit Anzeichen von Psoriasis nicht als Injektionsstelle verwendet werden.
Nach geeigneter Schulung in der Technik der subkutanen Injektion können die Patienten TREMFYA selbst injizieren, wenn ein Arzt dies für angemessen erachtet. Jedoch sollte der Arzt für eine geeignete Nachbeobachtung der Patienten sorgen. Die Patienten sollten angewiesen werden, die vollständige Dosis von TREMFYA gemäss der separat in der Packung beiliegenden «Gebrauchsanweisung» zu injizieren. Für weitere Hinweise zu Vorbereitung und besonderen Vorsichtsmassnahmen bei der Handhabung, siehe «Sonstige Hinweise: Hinweise für die Handhabung».
KontraindikationenSchwere Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Klinisch relevante aktive Infektionen (z.B. aktive Tuberkulose).
Warnhinweise und VorsichtsmassnahmenInfektionen
TREMFYA kann das Risiko für Infektionen erhöhen. Bei Patienten mit einer klinisch bedeutsamen aktiven Infektion sollte die Behandlung mit TREMFYA nicht eingeleitet werden, bevor die Infektion abgeklungen oder angemessen behandelt ist.
Infektionen traten in klinischen Studien bei Plaque-Psoriasis (23% vs. 21% für Placebo; ≤0,2% schwere Infektionen in beiden Gruppen) und bei Psoriasis-Arthritis (21% in TREMFYA- und Placebogruppen; ≤0,8% schwere Infektionen in beiden Gruppen) auf.
Patienten, die in Bezug auf HCV- oder HIV seropositiv waren, solche, die positiv auf eine Hepatitis-B-Infektion getestet wurden, und solche mit chronischen oder rezidivierenden Infektionen in der Vorgeschichte, waren von den klinischen Studien ausgeschlossen.
Patienten unter Behandlung mit TREMFYA sollen angehalten werden, ärztliche Hilfe aufzusuchen, wenn Anzeichen oder Symptome einer klinisch bedeutsamen chronischen oder akuten Infektion auftreten. Wenn ein Patient eine klinisch bedeutsame oder schwerwiegende Infektion entwickelt oder nicht auf die Standardtherapie anspricht, ist der Patient sorgfältig zu überwachen und TREMFYA ist abzusetzen, bis die Infektion abgeklungen ist.
Beurteilung bezüglich Tuberkulose vor der Behandlung
In klinischen Studien entwickelten Patienten mit latenter Tuberkulose (TB), die gleichzeitig mit TREMFYA und mit einer angemessenen TB-Prophylaxe behandelt wurden, keine TB. Vor der Einleitung einer Behandlung mit TREMFYA sind die Patienten bezüglich einer TB-Infektion zu beurteilen. Die Behandlung einer latenten TB ist einzuleiten, bevor TREMFYA verabreicht wird. Patienten, die TREMFYA erhalten, sollten während und nach der Behandlung auf Anzeichen und Symptome einer aktiven TB überwacht werden. TREMFYA darf nicht angewendet werden bei Patienten mit aktiver TB-Infektion. Eine Anti-TB-Therapie vor der Einleitung einer Behandlung mit TREMFYA sollte in Betracht gezogen werden bei Patienten mit der Anamnese einer früheren latenten oder aktiven TB, bei denen ein adäquater Behandlungsverlauf nicht bestätigt werden kann.
Maligne Erkrankungen
In klinischen Studien zeigt die Behandlung mit TREMFYA kein erhöhtes Risiko für maligne Erkrankungen.
Psoriasis-Patienten, die zuvor eine UV-Therapie erhalten haben, sollten vor und während der Behandlung mit TREMFYA gründlich auf das Vorliegen von Hauttumoren untersucht werden.
Begleitende Therapie mit anderen systemischen Immunsuppressiva oder Phototherapie
Die Sicherheit und Wirksamkeit von TREMFYA in Kombination mit Immunsuppressiva, einschliesslich Biologika, oder Phototherapie sind nicht untersucht worden.
Überempfindlichkeit
Nach Markteinführung wurde über schwerwiegende Überempfindlichkeitsreaktionen, inklusive Anaphylaxie, berichtet. Einige schwerwiegende Überempfindlichkeitsreaktionen traten mehrere Tage bis Wochen nach der Behandlung mit Guselkumab auf, einschliesslich Fälle von Urtikaria und Dyspnoe. Wenn eine schwerwiegende Überempfindlichkeitsreaktion auftritt, soll die Verabreichung von TREMFYA umgehend abgebrochen und eine geeignete Therapie eingeleitet werden.
Immunisierungen
Bevor eine Behandlung mit TREMFYA eingeleitet wird, ist die Durchführung aller nötigen Impfungen gemäss den gegenwärtigen Impfrichtlinien abzuschliessen. Es liegen keine Daten zum Ansprechen und Aufrechterhaltung der Antwort auf Totimpfstoffe vor, die vor oder während einer Therapie mit TREMFYA verabreicht wurden. Lebendvakzine sollen nicht gleichzeitig mit TREMFYA verabreicht werden. Ein genügender zeitlicher Abstand zwischen Impfungen mit Lebendimpfstoffen und dem Beginn der Therapie gemäss den aktuellen Impfrichtlinien zu immunsuppressiven Wirkstoffen ist einzuhalten.
Sachdienliche Informationen zur Anwendung von immunsuppressiven Wirkstoffen mit spezifischen Impfstoffen können auch den jeweiligen Fachinformationen entnommen werden.
InteraktionenIn einer Phase-I-Studie bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis waren die nach einer Einzeldosis von Guselkumab beobachteten Veränderungen der systemischen Expositionen (Cmax und AUCinf) gegenüber Midazolam, S-Warfarin, Omeprazol, Dextromethorphan und Koffein klinisch nicht relevant. Dies lässt darauf schliessen, dass Arzneimittelinteraktionen zwischen Guselkumab und Substraten verschiedener CYP-Enzyme (CYP3A4, CYP2C9, CYP2C19, CYP2D6 und CYP1A2) unwahrscheinlich sind. Eine Dosisanpassung ist bei gleichzeitiger Anwendung von Guselkumab und CYP450-Substraten nicht erforderlich.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten während der Behandlung und für mindestens 12 Wochen nach der Behandlung wirksame Methoden zur Empfängnisverhütung anwenden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Guselkumab bei Schwangeren vor. Tierexperimentelle Studien zeigten keine direkte oder indirekte Toxizität mit Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Fötus, Entbindung oder die postnatale Entwicklung (siehe «Präklinische Daten»). Als Vorsichtsmassnahme soll eine Anwendung von TREMFYA während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Guselkumab in die Muttermilch ausgeschieden wird. Es ist bekannt, dass menschliche IgGs in den ersten Tagen nach der Geburt in die Muttermilch übergehen und bald darauf auf niedrige Konzentrationen absinken; daher kann ein Risiko für das gestillte Kind während dieser Zeit nicht ausgeschlossen werden. Unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der TREMFYA-Therapie für die Frau, muss entschieden werden, ob die Behandlung mit TREMFYA zu unterbrechen ist oder auf die Einleitung der Therapie verzichtet werden soll. Bezüglich Angaben zum Übergang von Guselkumab in die Muttermilch von Tieren siehe «Präklinische Daten».
Fertilität
Die Auswirkungen von Guselkumab auf die menschliche Fertilität wurden nicht untersucht. Tierexperimentelle Studien zeigten keine direkten oder indirekten schädigenden Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil von TREMFYA basiert auf Daten von Phase-II und Phase-III Studien mit 3940 Patienten, darunter 2711 Patienten mit Plaque-Psoriasis, die mit TREMFYA 100 mg in den Wochen 0 und 4 und danach alle 8 Wochen (q8w) behandelt wurden, und 1229 Patienten mit Psoriasis-Arthritis, die entweder mit TREMFYA 100 mg in den Wochen 0 und 4 und danach mit q8w oder TREMFYA 100 mg alle 4 Wochen behandelt wurden. 3223 Patienten in Phase-II und Phase-III Plaque-Psoriasis- und Psoriasis-Arthritis-Studien waren mindestens 1 Jahr exponiert, und 1917 bzw. 1482 Psoriasis Patienten mindestens 2 bzw. 3 Jahre, und 1393 bzw. 950 Psoriasis Patienten waren mindestens 4 bzw. 5 Jahre exponiert.
Die häufigste unerwünschte Arzneimittelwirkung waren Atemwegsinfektionen (19,9 pro 100 Patientenjahre).
Auflistung der unerwünschten Wirkungen
Die unerwünschten Wirkungen aus klinischen Studien und aus Erfahrungen nach Markteinführung sind nachfolgend aufgeführt. Die Häufigkeit der unerwünschten Wirkungen basiert auf ihrem Auftreten in kontrollierten und unkontrollierten Abschnitten der klinischen Phase-III Studien bei Psoriasis (VOYAGE 1 und VOYAGE 2) und Psoriasis-Arthritis (DISCOVER 1 und DISCOVER 2) mit dem TREMFYA 100 mg q8w Dosierungsschema. Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklasse und Häufigkeit pro 100 Patientenjahre gemäss folgender Konvention klassifiziert: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1'000 bis <1/100), selten (≥1/10'000 bis <1/1'000), sehr selten (<1/10'000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Atemwegsinfektionen (19,9 pro 100 Patientenjahre).
Häufig: Herpes-simplex-Infektionen, Dermatophytosen, Gastroenteritis.
Erkrankungen des Blutes und des Lymphsystems
Selten: Neutrophilenzahl erniedrigt.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit.
Selten: Anaphylaxie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhö.
Leber- und Gallenerkrankungen
Häufig: Transaminasen erhöht, Bilirubin erhöht.
Erkrankungen der Haut und des Unterhautzellgewebes.
Gelegentlich: Urtikaria, Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Arthralgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle.
Beschreibung ausgewählter unerwünschter Wirkungen
Transaminasen, Bilirubin erhöht
In zwei klinischen Phase-III-Studien zu Psoriasis-Arthritis wurde in der mit TREMFYA behandelten Gruppe in der Placebo-kontrollierten Phase erhöhte Transaminasen (einschließlich Alanin-Aminotransferase (ALT) erhöht, Aspartat-Aminotransferase (AST) erhöht, hepatisches Enzym erhöht, Transaminasen erhöht, Leberfunktionstest abnormal, Hypertransaminasämie) als unerwünschte Wirkung häufiger berichtet (8,4%) als in der Placebogruppe (4,6%). Über einen Zeitraum von 1 Jahr wurden bei 12,3% der Patienten, die mit TREMFYA behandelt wurden, unerwünschte Wirkungen mit erhöhten Transaminase-Werten berichtet. In zwei klinischen Phase-III-Studien zur Psoriasis während des Placebo-kontrollierten Zeitraums betrug die Rate der unerwünschten Wirkungen «Transaminasen erhöht» bei 2,6 % in der mit TREMFYA behandelten Gruppe und bei 1,9 % in der Placebogruppe. In den meisten Fällen war die Erhöhung der Transaminasen leicht und vorübergehend und führte nicht zum Abbruch der Behandlung. Basierend auf Laborwerten wurden in zwei klinischen Phase-III-Studien zu Psoriasis-Arthritis in der mit TREMFYA behandelten Gruppe während des Placebo-kontrollierten Zeitraums Erhöhungen des Bilirubins häufiger berichtet (5.8%) als in der Placebogruppe (2.2%). Es wurden keine Erhöhungen von mehr als dem 3-fachen der oberen Normgrenze beobachtet. Die Bilirubin-Erhöhungen waren im Allgemeinen nicht mit einem Anstieg des direkten Bilirubins verbunden. Über einen Zeitraum von 1 Jahr wurden bei 6,8% der Patienten in der mit TREMFYA behandelten Gruppe unerwünschte Wirkungen mit erhöhtem Bilirubin berichtet. Basierend auf Laborwerten betrug in zwei klinischen Phase-III-Studien zur Psoriasis der Anstieg des Bilirubins während des Placebo-kontrollierten Zeitraums 5,1% in der mit TREMFYA behandelten Gruppe und 5,3% in der Placebogruppe.
Anzahl der Neutrophilen verringert
In zwei klinischen Phase-III-Studien zu Psoriasis-Arthritis wurde in der mit TREMFYA behandelten Gruppe in der Placebo-kontrollierten Phase häufiger von einer verringerten Anzahl der Neutrophilen als unerwünschte Wirkung berichtet (0,9%) als in der Placebogruppe (0%). Über einen Zeitraum von 1 Jahr wurden bei 0,9 % der Patienten in der mit TREMFYA behandelten Gruppe unerwünschte Wirkungen mit verringerten Anzahl der Neutrophilen berichtet. In den meisten Fällen war die Verringerung der Neutrophilenzahl im Blut leicht und vorübergehend, nicht mit einer Infektion assoziiert und führte nicht zum Abbruch der Behandlung. In zwei klinischen Phase-III-Studien zur Psoriasis wurde während des Placebokontrollierten Zeitraums die unerwünschte Wirkung «Neutrophilenzahl erniedrigt» in 0% in der mit TREMFYA behandelten Gruppe und in 0,2% in der Placebogruppe beobachtet.
Gastroenteritis
In zwei klinischen Psoriasis-Phase-III-Studien trat Gastroenteritis während der Placebo-kontrollierten Periode in der mit TREMFYA behandelten Gruppe häufiger auf (1,1%) als in der Placebogruppe (0,7%). Bis Woche 264 berichteten 5,8% aller mit TREMFYA behandelten Patienten über Gastroenteritis. Unerwünschte Ereignisse in Form von Gastroenteritis waren nicht schwerwiegend und führten nicht zum Absetzen von TREMFYA bis zu Woche 264.
Die beobachteten Gastroenteritis-Raten waren in klinischen Phase-III-Studien zur Psoriasis-Arthritis während des Placebo-kontrollierten Zeitraums ähnlich hoch wie die in den klinischen Studien zur Psoriasis.
Reaktionen an der Injektionsstelle
In zwei klinischen Psoriasis-Phase-III-Studien traten bis Woche 48 bei 0,7% der TREMFYA-Injektionen und bei 0,3% der Placebo-Injektionen Reaktionen an der Injektionsstelle auf. Bis Woche 264 waren 0,4% der TREMFYA-Injektionen mit Reaktionen an der Injektionsstelle assoziiert. Reaktionen an der Injektionsstelle waren von leichter bis mittelschwerer Ausprägung. Keines der Ereignisse war schwerwiegend und eines führte zum Absetzen von TREMFYA.
In zwei klinischen Phase-III-Studien zur Psoriasis-Arthritis war bis zu Woche 24 die Anzahl der Patienten, die über 1 oder mehrere Reaktionen an der Injektionsstelle berichteten, gering und in der TREMFYA-Gruppe etwas höher als in der Placebo-Gruppe; 5 (1,3 %) Patienten in der TREMFYA-q8w-Gruppe und 1 (0,3 %) Patient in der Placebo-Gruppe. Über 1 Jahr hinweg betrug der Anteil der Patienten, die über 1 oder mehrere Reaktionen an der Injektionsstelle berichteten, 1,6 % in der TREMFYA-q8w-Gruppe.
Immunogenität
Gepoolte Phase-II- und Phase-III-Analysen bei Patienten mit Psoriasis und Psoriasis-Arthritis zeigten, dass während einer bis zu 52-wöchigen Behandlung 5% (n=145) der mit TREMFYA behandelten Patienten Antikörper gegen das Arzneimittel entwickelten. Von den Patienten, die Antikörper gegen das Arzneimittel entwickelten, hatten ungefähr 8% (n=12) Antikörper, die als neutralisierend eingestuft wurden, was 0,4% aller mit TREMFYA behandelten Patienten entspricht. In gepoolten Phase-III-Analysen in bis zu 264 Behandlungswochen entwickelten etwa 15% der mit TREMFYA behandelten Psoriasis-Patienten Antikörper gegen das Arzneimittel. Von den Patienten, die Antikörper gegen das Arzneimittel entwickelten, hatten etwa 5% Antikörper, die als neutralisierend eingestuft wurden, was 0,76% aller mit TREMFYA behandelten Patienten entspricht. Zu den möglichen Auswirkungen von Antikörpern gegen das Arzneimittel auf die Wirksamkeit und Sicherheit sind aufgrund der geringen Häufigkeit einer Immunogenität keine schlüssigen Aussagen möglich.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIntravenöse Einzeldosen von bis zu 987 mg (10 mg/kg) Guselkumab wurden an gesunde freiwillige Probanden verabreicht, und subkutane Einzeldosen von bis zu 300 mg Guselkumab wurden an Patienten mit Plaque-Psoriasis in klinischen Studien verabreicht, ohne dass eine dosislimitierende Toxizität beobachtet wurde. Im Falle einer Überdosierung ist der Patient auf Anzeichen und Symptome unerwünschter Wirkungen zu überwachen, und es ist unverzüglich eine geeignete symptomatische Behandlung einzuleiten.
Eigenschaften/WirkungenATC-Code
L04AC16
Wirkungsmechanismus
Guselkumab ist ein humaner IgG1λ-mAb, der mit hoher Spezifität und Affinität selektiv an das Interleukin-23 (IL-23)-Protein bindet. IL-23 beeinflusst unter anderem die Differenzierung, Expansion und das Überleben von T-Zell-Untergruppen (z.B. Th17-Zellen) und von Untergruppen der angeborenen Immunzellen sowie die Freisetzung der entzündungsfördernder Zytokine IL-17A, IL-17F und IL-22. Beim Menschen wurde gezeigt, dass die selektive Blockade von IL-23 die Produktion dieser Zytokine eindämmt.
In In-vitro- Modellen wurde gezeigt, dass Guselkumab die Bioaktivität von IL-23 hemmt, indem es dessen Interaktion mit dem IL-23-Rezeptor an der Zelloberfläche blockiert und somit durch IL-23 vermittelte Signal-, Aktivierungs- und Zytokinkaskaden unterbricht.
Pharmakodynamik
Plaque-Psoriasis
In der Haut von Patienten mit Plaque-Psoriasis sind die IL-23-Konzentrationen erhöht. Guselkumab bewirkt durch die Inhibition des Zytokin IL-23-Signalwegs klinische Effekte bei Plaque-Psoriasis durch die Modulierung von Genexpressionsmustern in den betroffenen Hautarealen. Diese lokalen Effekte führen zu einer der Reduktion von Epidermisdicke und T-Zell-Dichte. Zusätzlich wurden in Phase-II- und Phase-III-Studien bei Plaque-Psoriasis bei mit Guselkumab behandelten Patienten im Vergleich zu Placebo reduzierte Serumkonzentrationen von IL-17A, IL-17F und IL-22 beobachtet.
Psoriasis Arthritis
In Phase-III-Studien bei Patienten mit Psoriasis-Arthritis waren die Serumspiegel der Akuten-Phase-Proteine C-reaktives Protein, Serumamyloid A und IL-6 und Th17 Effektorzytokine IL-17A, IL-17F und IL-22 zu Studienbeginn erhöht. Guselkumab senkte den Gehalt dieser Proteine innerhalb von 4 Wochen nach Beginn der Behandlung. Guselkumab reduzierte den Gehalt dieser Proteine bis Woche 24 im Vergleich zur Baseline und auch zum Placebo weiter.
Klinische Wirksamkeit
Plaque-Psoriasis
Die Wirksamkeit und Sicherheit von Guselkumab wurde geprüft in vier randomisierten, doppelblinden, Placebo- und/oder aktiv-kontrollierten Phase-III-Studien bei erwachsenen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die Kandidaten für Phototherapie oder systemische Therapie waren. Zwei Studien (VOYAGE 1 und VOYAGE 2) beurteilten die Wirksamkeit und Sicherheit von Guselkumab versus Placebo und Adalimumab bei 1829 erwachsenen Patienten. In VOYAGE 2 wurde zudem in Woche 28 bei Patienten mit erfolgreichem Ansprechen das Absetzen von Guselkumab und die Wiederbehandlung im Vergleich zur kontinuierlichen Weiterbehandlung untersucht. Patienten, die schon einmal mit Guselkumab oder Adalimumab behandelt worden waren, sowie Patienten mit erythrodermischer Psoriasis, Psoriasis guttata oder pustulöser Psoriasis waren von der Teilnahme an den Studien VOYAGE 1 und VOYAGE 2 ausgeschlossen. Eine weitere Studie (NAVIGATE) beurteilte die Wirksamkeit und Sicherheit von Guselkumab versus Ustekinumab bei 268 erwachsenen Patienten, die ungenügend auf Ustekinumab ansprachen.
In der klinischen Studie (ORION) wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt.
VOYAGE 1 und VOYAGE 2
Patienten, die zu Guselkumab randomisiert wurden, erhielten 100 mg in Woche 0 und 4 und danach alle 8 Wochen bis zu Woche 48 (VOYAGE 1) und Woche 20 (VOYAGE 2). Patienten, die zu Adalimumab randomisiert wurden, erhielten 80 mg in Woche 0 und 40 mg in Woche 1, gefolgt von 40 mg alle 2 Wochen bis zu Woche 48 (VOYAGE 1) bzw. Woche 23 (VOYAGE 2). In beiden Studien erhielten die zu Placebo randomisierten Patienten in Woche 16, 20 und danach alle 8 Wochen 100 mg Guselkumab. In der VOYAGE 1 erhielten alle Patienten, einschliesslich derer, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren, in Woche 52 und danach alle 8 Wochen unverblindet 100 mg Guselkumab. In VOYAGE 2 wurden Patienten, die in Woche 0 zu Guselkumab randomisiert worden waren und in Woche 28 eine Verbesserung des Psoriasis Area and Severity Index (PASI) von mindestens 90% (PASI-90-Ansprechen) erreichten, erneut randomisiert: entweder zur Fortsetzung der Behandlung mit Guselkumab alle 8 Wochen (Erhaltungstherapie) oder zur Gabe von Placebo (Absetzen). Die Patienten in der letzten Gruppe (erneute Randomisierung nach Placebo) wurden nach Verlust von mindestens 50% ihrer PASI-Verbesserung in Woche 28 erneut mit Guselkumab behandelt (Dosierung zum Zeitpunkt der erneuten Behandlung sowie 4 Wochen später und danach alle 8 Wochen). Patienten ohne PASI-90-Ansprechen aus der Guselkumab-Gruppe setzten die Behandlung mit Guselkumab fort. Bei Patienten, die zu Adalimumab randomisiert worden waren und in Woche 28 ein PASI-90-Ansprechen aufwiesen, wurde die Behandlung abgesetzt und die Behandlung mit Guselkumab eingeleitet, wenn in Woche 28 ein Verlust der PASI-Verbesserung um mindestens 50% festgestellt wurde. Patienten, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren und PASI90-Non-Responder waren, erhielten in den Wochen 28, 32 und danach alle 8 Wochen Guselkumab. Alle Teilnehmer erhielten ab Woche 76 alle 8 Wochen unverblindet Guselkumab.
Die Krankheits-Charakteristika bei Baseline der Studienpopulationen in VOYAGE 1 und 2 waren vergleichbar: im Mittel betrug der Anteil der betroffenen Körperoberfläche (BSA) 22% bzw. 24%, der mediane Baseline-PASI-Score betrug 19 in beiden Studien, der Baseline-IGA-Score (Investigator's Global Assessment, Gesamtbeurteilung durch den Prüfarzt) war «mittelschwer» bzw. «schwer» bei 74,6% und 75,5% bzw. 25,1% und 24,5% der Patienten. 19% bzw. 18% der Patienten hatten eine Vorgeschichte einer Psoriasis-Arthritis.
Von allen in VOYAGE 1 und 2 aufgenommenen Patienten hatten 32% bzw. 29% vorher noch nie eine konventionelle systemische Therapie und auch keine Biologika-Therapie erhalten; 54% bzw. 57% hatten vorher schon Phototherapie und 62% bzw. 64% schon eine konventionelle systemische Therapie erhalten. In beiden Studien hatten 21% der Patienten vorher schon eine Biologika-Therapie erhalten; diese umfassten 11%, die mindestens einen Anti-Tumornekrosefaktor-alpha (TNF-α)-Wirkstoff, und rund 10%, die einen Anti-IL-12/IL-23-Wirkstoff erhalten hatten.
Eine Begleitbehandlung mit einer topischen oder systemischen Therapie oder Phototherapie gegen Psoriasis war in der Studie nicht zulässig.
Die Wirksamkeit von Guselkumab wurde beurteilt in Bezug auf den Gesamtbefall der Haut, dem lokalisierten Befall der Kopfhaut, Hände, Füsse und Nägel sowie in Bezug auf die Lebensqualität. Die ko-primären Endpunkte in VOYAGE 1 und 2 waren der Prozentsatz von Patienten, die in Woche 16 einen IGA-Score «abgeheilt» oder «minimal» (IGA 0/1) bzw. ein PASI-90-Ansprechen erreichten Vergleich zu Placebo (siehe Tabelle 1).
Effekte auf die Hautsymptomatik
Die Behandlung mit Guselkumab bewirkte signifikante Verbesserungen der Parameter für die Krankheitsaktivität im Vergleich zu Placebo in Woche 16, und im Vergleich zu Adalimumab in Woche 16 bis 48. Die wichtigsten Wirksamkeitsergebnisse sind in Tabelle 1 unten aufgeführt.
Tabelle 1: Zusammenfassung des klinischen Ansprechens in VOYAGE 1 und VOYAGE 2
|
|
Anzahl Patienten (%)
| |
Placebo (n = 174)
|
VOYAGE 1 Guselkumab (n = 329)
|
Adalimumab (n = 334)
|
Placebo (n = 248)
|
VOYAGE 2 Guselkumab (n = 496)
|
Adalimumab (n = 248)
| |
Woche 16
| |
PASI 75
|
10 (5,7)
|
300 (91,2)a
|
244 (73,1)b
|
20 (8,1)
|
428 (86,3)a
|
170 (68,5)b
| |
PASI 90
|
5 (2,9)
|
241 (73,3)c
|
166 (49,7)b
|
6 (2,4)
|
347 (70,0)c
|
116 (46,8)b
| |
IGA 0/1
|
12 (6,9)
|
280 (85,1)c
|
220 (65,9)b
|
21 (8,5)
|
417 (84,1)c
|
168 (67,7)b
| |
IGA 0
|
2 (1,1)
|
157 (47,7)a
|
88 (26,3)d
|
2 (0,8)
|
215 (43,3)a
|
71 (28,6)d
| |
Woche 48
| |
PASI 75
|
-
|
289 (87,8)
|
209 (62,6)e
|
-
|
-
|
-
| |
PASI 90
|
-
|
251 (76,3)
|
160 (47,9)b
|
-
|
-
|
-
| |
IGA 0/1
|
-
|
265 (80,5)
|
185 (55,4)b
|
-
|
-
|
-
| |
IGA 0
|
-
|
166 (50,5)
|
86 (25,7)b
|
-
|
-
|
-
|
a p <0,001 für den Vergleich zwischen Guselkumab und Placebo.
b p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab für wichtige sekundäre Endpunkte.
c p <0,001 für die Vergleiche zwischen Guselkumab und Placebo für die ko-primären Endpunkte.
d Vergleiche zwischen Guselkumab und Adalimumab wurden nicht durchgeführt.
e p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab.
Es wurden auch Verbesserungen bei Nagel-Psoriasis, Befall der Kopfhaut und palmoplantaren Befall beobachtet, die in Woche 16 im Vergleich zu Placebo statistisch signifikant überlegen waren.
Ansprechen im Lauf der Zeit
Guselkumab zeigte eine schnell einsetzende Wirksamkeit, mit einer signifikant höheren prozentualen Verbesserung des PASI im Vergleich zu Placebo schon in Woche 2 (p <0,001); der Unterschied erreichte ein Maximum um Woche 20 (VOYAGE 1 und 2) und blieb bis Woche 48 (VOYAGE 1) erhalten.
Abbildung 1: Prozentsatz von Patienten, die bis Woche 48 ein PASI-90-Ansprechen erreichten, aufgegliedert nach Visite (Patienten randomisiert in Woche 0) in VOYAGE 1
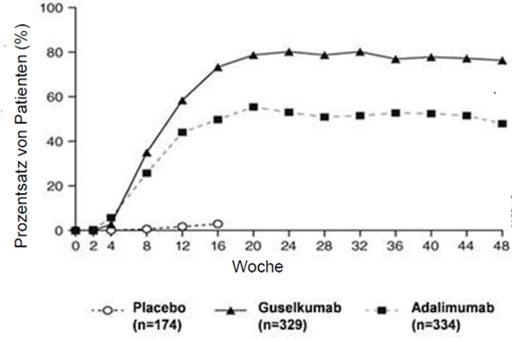
In der VOYAGE 1 blieb das PASI-90-Ansprechen bei Patienten unter fortlaufender Behandlung mit Guselkumab in der unverblindeten Phase von Woche 52 bis Woche 252 erhalten. Bei Patienten, die in Woche 0 in die Adalimumab-Gruppe randomisiert worden waren und in Woche 52 auf Guselkumab umgestellt wurden, erhöhte sich das PASI90-Ansprechen von Woche 52 bis einschliesslich Woche 76 und blieb bis Woche 252 erhalten.
Der Nachweis für die Wirksamkeit und Sicherheit von Guselkumab wurde unabhängig von Alter, Geschlecht, ethnischer Zugehörigkeit, Körpergewicht, Plaquelokalisation, PASI-Baseline-Schweregrad, gleichzeitig bestehender Psoriasis-Arthritis und vorheriger Behandlung mit einem Biologikum erbracht. Guselkumab war wirksam bei Patienten ohne frühere konventionelle systemische Therapie, bei Patienten ohne frühere Biologika-Therapie und bei Patienten mit früherer Biologika-Exposition.
Absetzen der Therapie und anschliessende Wiederaufnahme der Therapie
In VOYAGE 2 erreichten 88,6% der Patienten, die eine Guselkumab-Erhaltungstherapie erhielten, in Woche 48 ein PASI-90-Ansprechen, verglichen mit 36,8% der Patienten, bei denen in Woche 28 die Behandlung abgesetzt worden war (p <0,001). Ein Verlust des PASI-90-Ansprechens wurde schon 4 Wochen nach Absetzen der Guselkumab-Behandlung bei einer medianen Zeitspanne bis zum Verlust des PASI-90-Ansprechens von ungefähr 15 Wochen beobachtet. Von den Patienten, bei denen die Behandlung beendet und anschliessend wieder mit Guselkumab begonnen wurde, hatten 80% bei der Beurteilung 20 Wochen nach Beginn der Wiederbehandlung eine PASI90-Remission erzielt. In der VOYAGE 2 erzielten von 95 Patienten, die randomisiert Guselkumab erhielten und kein PASI90-Ansprechen in Woche 28 erzielten, 36% bzw. 41% ein PASI90-Ansprechen nach 20- bzw. 44-wöchiger Weiterbehandlung mit Guselkumab.
Behandlungsergebnisse in Bezug auf einzelne Krankheitsregionen
In den Studien VOYAGE 1 und VOYAGE 2 wurden bei Patienten unter Behandlung mit Guselkumab in Woche 16 signifikant stärkere Verbesserungen des Befalls der Kopfhaut (ss-IGA), des Befalls der Hände und Füsse (hf-PGA) und des Befalls der Nägel (NAPSI, f-PGA) festgestellt als bei den Patienten in der Placebogruppe.
Gesundheitsbezogene Lebensqualität/von Patienten berichtete Ergebnisse
In VOYAGE 1 und 2 zusammen wurden bei Guselkumab-Patienten signifikant grössere Verbesserungen bei der gesundheitsbezogenen Lebensqualität gemäss Dermatology Life Quality Index (DLQI) und bei den von Patienten berichteten Psoriasis-Symptomen (Juckreiz, Schmerzen, Brennen, Stechen und Spannen der Haut) und Anzeichen (Hauttrockenheit, Risse, Schuppung, Hautablösung oder Abblättern, Rötung und Bluten) gemäss dem Tagebuch Psoriasis Symptoms and Signs Diary (PSSD) beobachtet, verglichen mit Placebo-Patienten in Woche 16.
NAVIGATE
Die Studie NAVIGATE untersuchte die Wirksamkeit von Guselkumab bei Patienten, die in Woche 16 ungenügend auf Ustekinumab angesprochen hatten (d.h. die kein Ansprechen der Qualität «abgeheilt» oder «minimal» erreichten, definiert als IGA ≥2). Die Patienten durften keine frühere Vortherapie mit Guselkumab und/oder Ustekinumab erhalten haben. Alle Patienten erhielten unverblindet Ustekinumab in Woche 0 und 4. In Woche 16 wurden 268 Patienten mit einem IGA-Score ≥2 randomisiert: entweder zur Weiterführung der Ustekinumab-Behandlung alle 12 Wochen oder zur Einleitung der Guselkumab-Behandlung in Woche 16, 20 und danach alle 8 Wochen. Die Charakteristika bei Baseline für die randomisierten Patienten waren ähnlich wie die in VOYAGE 1 und 2 beobachteten.
12 Wochen nach der Randomisierung wies ein höherer Anteil von Guselkumab-Patienten als Ustekinumab-Patienten einen IGA-Score 0/1 und Verbesserung von ≥2 Skalenstufen (31,1% vs. 14,3%, p = 0,001) und ein PASI-90-Ansprechen (48% vs. 23%, p <0,001) auf. Zum Wechsel in umgekehrter Richtung von Guselkumab zu Ustekinumab sind keine Daten verfügbar.
ORION
In der ORION-Studie wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt. In dieser Studie wurden 78 Patienten mit mittelschwerer bis schwerer Plaques Psoriasis randomisiert, um entweder TREMFYA (100 mg in den Wochen 0 und 4 und danach alle 8 Wochen) oder ein Placebo zu erhalten. Die Studienpopulation in der ORION Studie war vergleichbar mit der Studienpopulation in VOYAGE 1 und 2. Die Wirksamkeit, gemessen an IGA-Score (0,1) und PASI 90 in Woche 16 war in den drei Studien ORION, VOYAGE 1 und 2 vergleichbar. Die Patientenakzeptanz und sichere Anwendung des Pens wurden belegt.
ECLIPSE
Die Wirksamkeit und Sicherheit von Guselkumab wurde auch in einer Doppelblindstudie im Vergleich zu Secukinumab untersucht. Die Patienten erhielten randomisiert Guselkumab (N = 534; 100 mg in den Wochen 0, 4 und danach alle 8 Wochen) oder Secukinumab (N = 514; 300 mg in den Wochen 0, 1, 2, 3, 4 und danach alle 4 Wochen). Die letzte Dosisgabe erfolgte in beiden Behandlungsgruppen in Woche 44.
Guselkumab war in Bezug auf den primären Endpunkt des PASI90-Ansprechens in Woche 48 gegenüber Secukinumab überlegen (84,5% gegenüber 70,0%, p < 0,001).
Psoriasis-Arthritis (PsA)
Es wurde gezeigt, dass Guselkumab Anzeichen und Symptome, die körperliche Funktion und die gesundheitsbezogene Lebensqualität verbessert.
DISCOVER 1 und DISCOVER 2
In zwei randomisierten, doppelblinden, Placebo-kontrollierten Phase-III-Studien (DISCOVER 1 und DISCOVER 2) wurden die Wirksamkeit und Sicherheit von Guselkumab im Vergleich zu einem Placebo bei erwachsenen Patienten mit aktiver PsA (≥3 geschwollene und ≥3 druckempfindliche Gelenke und eine Konzentration des C-reaktiven Proteins (CRP) von ≥0,3 mg/dl in der DISCOVER 1 sowie ≥5 geschwollene und ≥5 druckempfindliche Gelenke und eine CRP-Konzentration von ≥0,6 mg/dl in der DISCOVER 2) trotz Anwendung einer Therapie mit einem konventionellen synthetischen (cs) DMARD, Apremilast oder einem nichtsteroidalen Antirheumatikum bewertet. Die Patienten in diesen Studien hatten eine diagnostizierte PsA auf Basis der Klassifikationskriterien für Psoriasis-Arthritis [CASPAR]) mit einer medianen Dauer von 4 Jahren. In beiden Studien waren Patienten mit verschiedenen Unterformen von PsA aufgenommen worden, einschliesslich polyartikulärer Arthritis ohne Vorliegen von Rheumaknoten (40%), Spondylitis mit peripherer Arthritis (30%), asymmetrischer peripherer Arthritis (23%), Einbeziehung der distalen Interphalangealgelenke (7%) und Arthritis mutilans (1%). Aufgrund der wenigen Studienpatienten mit Arthritis mutilans (N=6) sind schlüssige Aussagen zur Wirksamkeit und Sicherheit zu dieser Subgruppe nicht möglich. Bei über 65% und 42% der Patienten lag zu Beginn der Studie eine Enthesitis bzw. Daktylitis vor, und bei über 75% der Patienten waren ≥3% der Körperoberfläche (BSA) von der Psoriasis betroffen. In den Studien DISCOVER 1 und DISCOVER 2 wurden 381 bzw. 739 Patienten bewertet, die eine Behandlung mit 100 mg Guselkumab in Woche 0 und 4 und danach alle 8 Wochen (q8w) oder mit 100 mg Guselkumab q4w oder Placebo erhielten. In Woche 24 erhielten die Patienten, welche Placebo bekamen, Guselkumab 100 mg alle vier Wochen in beiden Studien. Ungefähr 58% der Patienten in beiden Studien erhielten kontinuierlich stabile Dosen von MTX (≤25 mg/Woche).
In beiden Studien war bei über 90% der Patienten vorgängig bereits ein csDMARD angewendet worden. In der Studie DISCOVER 1 hatten 31% der Patienten vorgängig eine biologische Anti-TNFα-Behandlung erhalten. In der Studie DISCOVER 2 war keiner der Patienten vorgängig mit einem Biologikum behandelt worden.
Anzeichen und Symptome
Die Behandlung mit Guselkumab hatte in Woche 24 im Vergleich zu Placebo zu signifikanten Verbesserungen der Indikatoren für die Krankheitsaktivität geführt. Der primäre Endpunkt in beiden Studien war der prozentuale Anteil der Patienten mit einem American College of Rheumatology (ACR)20-Ansprechen in Woche 24. Zwischen den Erhaltungstherapien mit Guselkumab 100 mg alle 4 Wochen bzw. alle 8 Wochen waren betreffend Wirksamkeit keine klinisch relevanten Unterschiede erkennbar. In Tabelle 2 sind die wichtigsten Wirksamkeitsergebnisse gezeigt.
Tabelle 2: Klinisches Ansprechen in der DISCOVER 1 und der DISCOVER 2
|
|
DISCOVER 1 i
|
DISCOVER 2 j
| |
Placebo
|
100 mg q8w
|
Placebo
|
100 mg q8w
| |
(N=126)
|
(N=127)
|
(N=246)
|
(N=248)
| |
ACR20-Ansprechen
| |
Woche 16
|
25.40%
|
52.0% b
|
33.70%
|
55.2% g
| |
Woche 24
|
22.20%
|
52.0% a
|
32.90%
|
64.1% a
| |
ACR50-Ansprechen
| |
Woche 16
|
12.70%
|
22.8% d
|
9.30%
|
28.6% g
| |
Woche 24
|
8.70%
|
29.9% b
|
14.20%
|
31.5% g
| |
ACR70-Ansprechen
| |
Woche 24
|
5.60%
|
11.8% d
|
4.10%
|
18.5% g
| |
DAS 28 (CRP)-LS mean Veränderung gegenüber Baseline
| |
Woche 24 c
|
-0.70
|
-1.43 b
|
-0.97
|
-1.59 b
|
a p < 0,001 (primärer Endpunkt)
b p < 0,001 (wichtiger sekundärer Endpunkt)
c p = 0,006 (wichtiger sekundärer Endpunkt)
d nicht statistisch signifikant p=0,086 (wichtiger sekundärer Endpunkt)
f nominal p < 0,012
g Es wurde keine formelle Prüfung im Rahmen des hierarchischen Prüfverfahrens durchgeführt, nominal p < 0,001 (wichtiger sekundärer Endpunkt)
i einschließlich >90% der Patienten mit früherer csDMARD-Behandlung
j einschließlich 31% der Patienten mit vorheriger biologischer Anti-TNFα-Behandlung
Bei Patienten mit aktiver PsA mit ≥3% BSA-Psoriasis-Beteiligung und einem IGA-Score ≥2 zu Studienbeginn wurden in der Guselkumab-q8w-Gruppe im Vergleich zu Placebo signifikante Verbesserungen der Hautkrankheit beobachtet, ähnlich wie in den Psoriasis-Studien VOYAGE 1 und VOYAGE 2.
Ansprechen im Zeitverlauf
In der Studie DISCOVER 2 wurde in beiden Guselkumab-Gruppen bereits in Woche 4 im Vergleich zu Placebo ein stärkeres ACR20-Ansprechen festgestellt, und der Behandlungsunterschied verstärkte sich im Zeitverlauf bis zum Ende der Woche 24 (Abbildung. 2).
Abbildung. 2: ACR20-Ansprechen nach Besuch bis zum Ende der Woche 24 in der DISCOVER 2
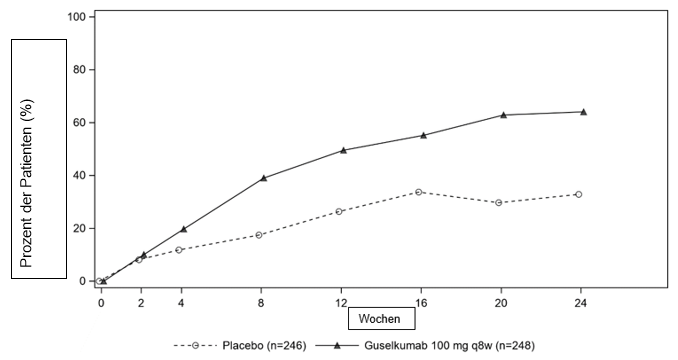
In der Studie DISCOVER 2 wurde bei Patienten, die zu Woche 24 eine kontinuierliche Behandlung mit Guselkumab erhielten, das ACR-20-Ansprechen von Woche 24 bis Woche 52 aufrechterhalten. Bei Patienten, die zu Woche 52 eine kontinuierliche Behandlung mit Guselkumab erhielten, wurde das ACR-20-Ansprechen von Woche 52 bis Woche 100 aufrechterhalten
Das in den Guselkumab-Gruppen festgestellte Ansprechen war ähnlich, unabhängig von der begleitenden Anwendung eines csDMARD, einschliesslich MTX (DISCOVER 1 und 2). Darüber hinaus ergaben sich bei der Untersuchung von Alter, Geschlecht, Ethnie, Körpergewicht und vorgängiger csDMARD-Anwendung (DISCOVER 1 und 2) und vorgängiger Anwendung von biologischen Anti-TNFα (DISCOVER 1) keine Unterschiede zwischen diesen Teilgruppen hinsichtlich des Ansprechens auf Guselkumab.
Das klinische Ansprechen wurde bis zur 52. Woche in DISCOVER 1 und bis zur 100. Woche in DISCOVER 2 aufrechterhalten, wie die Ansprechraten nach ACR 20/50/70 und DAS 28 (CRP) zeigen.
Es gab zu wenige PsA-Patienten mit Arthritis mutilans, um eine aussagekräftige Beurteilung zu machen.
In den Studien DISCOVER 1 und 2 zeigten sich Verbesserungen in allen Komponenten der ACR-Scores, einschliesslich der Schmerzbewertung durch die Patienten.
Die Beurteilung von Daktylitis und Enthesitis wurde auf der Grundlage gepoolter Daten der Patienten mit einer Daktylitis bzw. Enthesitis aus den Studien DISCOVER 1 und 2 durchgeführt (N=160 bzw. 230). Der Anteil der Teilnehmer mit Daktylitis zur Baseline und abgeklungener Daktylitis in Woche 24 war in den mit Guselkumab q8w behandelten Gruppen grösser (59,4%, nominal p<0,001 als bei Placebo-Gabe (42,2%). Der Anteil der Teilnehmer mit Enthesitis zur Baseline und abgeklungener Enthesitis in Woche 24 war in den mit Guselkumab q8w Gruppe grösser (49,6%, nominal p<0,001) als bei Placebo-Gabe (29,4%). In Woche 52 wurden in der Guselkumab-q8w-Gruppe das Abklingen der Dactylitis (81,2%) und das Abklingen der Enthesitis (62,7%) aufrechterhalten. In DISCOVER 2 wurde das Abklingen der Daktylitis und das Abklingen der Enthesitis bis Woche 100 aufrechterhalten.
Radiographisches Ansprechen
In der Studie DISCOVER 2 wurde die Hemmung der Progression der Strukturschädigung radiographisch gemessen und als Veränderung des modifizierten van der Heijde-Sharp (vdH-S)-Scores gegenüber dem Baseline-Wert dargestellt. In Woche 24 zeigte die Guselkumab-q8w-Gruppe numerisch weniger Progression als Placebo (kleinste quadratische Mittelwertänderung (Least square mean change) gegenüber dem Ausgangswert von 0,52 bzw. 0,95, p=0,068). In Woche 52 bzw. in Woche 100 betrug die mittlere Veränderung gegenüber dem Ausgangswert für die Guselkumab-q8w-Gruppe 0,97 bzw. 1,5.
Körperliche Funktion und gesundheitsbezogene Lebensqualität
In den Studien DISCOVER 1 und 2 zeigten mit Guselkumab behandelte Patienten in Woche 24 bei Beurteilung anhand des Fragebogens zur Beurteilung der Gesundheit-Behinderungsindex (Health Assessment Questionnaire-Disability Index, HAQ-DI) eine signifikante Verbesserung (p<0,001) der körperlichen Funktion im Vergleich zu Placebo. Die Verbesserungen des HAQ-DI wurden von Woche 24 bis Woche 52 in DISCOVER 1 und bis Woche 100 in DISCOVER 2 beibehalten.
PharmakokinetikAbsorption
Nach einer subkutan verabreichten Einzeldosis von 100 mg an gesunde Probanden erreichte Guselkumab ungefähr 5,5 Tage nach Verabreichung eine mittlere (± SD) maximale Serumkonzentration (Cmax) von 8,09 ± 3,68 µg/ml.
Steady-State-Serumkonzentrationen von Guselkumab nach subkutanen Verabreichungen von 100 mg Guselkumab in Woche 0 und 4 und danach alle 8 Wochen wurden um Woche 20 erzielt. Die mittleren (± SD) Serum-Talkonzentrationen von Guselkumab im Steady-State (Woche 20) in zwei Phase-III-Studien bei Patienten mit Plaque-Psoriasis betrugen 1,15 ± 0,73 µg/ml bzw. 1,23 ± 0,84 µg/ml.
Die Pharmakokinetik von Guselkumab bei Patienten mit Psoriasis-Arthritis war ähnlich wie bei Patienten mit Psoriasis. Nach subkutaner Gabe von 100 mg TREMFYA in Woche 0 und 4 und danach alle 8 Wochen betrug die mittlere Serum-Talkonzentration von Guselkumab im Steady-State ebenfalls ungefähr 1,2 µg/ml. Nach subkutaner Gabe von 100 mg TREMFYA alle 4 Wochen betrug die mittlere Serum-Talkonzentration von Guselkumab im Steady-State ungefähr 3,8 µg/ml.
Die absolute Bioverfügbarkeit von Guselkumab nach einer subkutan in den Oberschenkel verabreichten Einzeldosis von 100 mg wurde bei gesunden Probanden auf ungefähr 49% geschätzt.
Distribution
Das mittlere Verteilungsvolumen während der terminalen Phase (Vz) nach einer intravenös verabreichten Einzeldosis an gesunde Probanden betrug in allen Studien ungefähr 7 bis 10 l.
Metabolismus
Der genaue Stoffwechselweg, durch den Guselkumab metabolisiert wird, ist noch nicht charakterisiert worden. Da Guselkumab ein humaner IgG-mAb ist, wird erwartet, dass es gleich wie endogenes IgG über katabole Stoffwechselwege zu kleinen Peptiden und Aminosäuren abgebaut wird.
Elimination
Die mittlere systemische Clearance (CL) nach einer intravenös verabreichten Einzeldosis an gesunde Probanden lag in allen Studien im Bereich von 0,288 bis 0,479 l/Tag. Die mittlere Halbwertszeit (t½) von Guselkumab betrug ungefähr 17 Tage bei gesunden Probanden und ungefähr 15 bis 18 Tage bei Patienten mit Plaque-Psoriasis in den Studien.
Populations-Pharmakokinetik-Analysen ergaben, dass die gleichzeitige Anwendung von NSARs, oralen Kortikosteroiden und csDMARDs wie Methotrexat keine Auswirkungen auf die Clearance von Guselkumab hatte.
Linearität/Nicht Linearität
Die Zunahme der systemischen Exposition gegenüber Guselkumab (Cmax und AUC) verlief ungefähr dosisproportional nach einer subkutan verabreichten Einzeldosis in Dosierungen im Bereich von 10 mg bis 300 mg an gesunde Probanden oder Patienten mit Plaque-Psoriasis.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen/Nierenfunktionsstörungen
Es wurden keine spezifischen Studien durchgeführt, um die Auswirkungen einer eingeschränkten Nieren- oder Leberfunktion auf die Pharmakokinetik von Guselkumab zu ermitteln. Es ist zu erwarten, dass die renale Elimination von intaktem Guselkumab, einem IgG-mAb, niedrig und von geringer Bedeutung ist; ebenso ist zu erwarten, dass eine eingeschränkte Leberfunktion die Clearance von Guselkumab nicht beeinflussen wird, da IgG-mAbs hauptsächlich via intrazellulären Katabolismus eliminiert werden.
Ältere Patienten
Populations-Pharmakokinetik-Analysen bei Patienten mit Plaque-Psoriasis und Psoriasis-Arthritis zeigten, dass es keine offensichtlichen Veränderungen gab in der CL/F-Schätzung bei Patienten im Alter von ≥65 Jahren verglichen mit Patienten im Alter von <65 Jahren, was darauf hindeutet, dass für ältere Patienten keine Dosisanpassungen erforderlich sind.
Präklinische DatenBasierend auf konventionellen Studien zur Sicherheitspharmakologie, zur Toxizität bei wiederholter Verabreichung und zur Toxizität hinsichtlich Reproduktion weisen die präklinischen Daten auf keine besonderen Gefahren für den Menschen hin.
Toxizität bei wiederholter Verabreichung
In Studien zur Toxizität bei wiederholter Verabreichung bei Javaneraffen wurde Guselkumab gut toleriert bei intravenöser und subkutaner Verabreichung in Dosen von bis zu 50 mg/kg/Woche während bis zu 5 Wochen i.v. und 24 Wochen s.c. Ausserdem wurden keine unerwünschten pharmakologischen Wirkungen bezüglich Immunotoxizität oder kardiovaskulärer Sicherheit beobachtet während der Durchführung der Studien zur Toxizität bei wiederholter Verabreichung oder einer gezielten pharmakologischen Studie zur kardiovaskulären Sicherheit bei Javaneraffen.
Reproduktionstoxizität
In einer Studie zur kombinierten Untersuchung der Toxizität während der embryofötalen Entwicklung und der prä- und postnatalen Entwicklung erhielten trächtige Javaneraffen (19, 20 bzw. 20 Tiere in den Gruppen, die 0, 10 bzw. 50 mg/kg erhielten) ab dem Beginn der Organogenese bis zum Gebären wöchentliche subkutane Dosen von Guselkumab. Bei einer postnatalen Messung an Tag 28 war Guselkumab in der Muttermilch von Javaneraffen nicht nachweisbar. Bei 1 von 16 Affen in der Kontrollgruppe und bei 3 von 14 Affen in jeder Gruppe, die Guselkumab erhalten hatten, traten unter den Jungen neonatale Todesfälle auf (die Cmax- und AUClast-Werte waren gegenüber den Konzentrationen beim Menschen um das 31- bzw. 8-Fache erhöht). Diese neonatalen Todesfälle wurden einer Vernachlässigung durch die Mutter, einem Trauma oder einer Früh- oder Spätgeburt zugeschrieben, wenngleich ein wirkstoffbedingter Einfluss nicht auszuschliessen war. Bei allen Dosisstufen wurden ausserdem fötale Verluste (Spontanaborte, einschliesslich Totgeburten) beobachtet, die alle innerhalb des historischen Kontrollbereichs in der Prüfeinrichtung lagen, bei denen aber ein wirkstoffbedingter Einfluss nicht auszuschliessen war. Die klinische Relevanz dieser Befunde ist nicht bekannt. Es wurden keine Guselkumab-bedingten Einflüsse auf die funktionelle oder immunologische Entwicklung der Jungtiere ab der Geburt bis zum Alter von 6 Monaten festgestellt.
Es wurden keine präneoplastischen Veränderungen festgestellt bei der histopathologischen Untersuchung von Tieren, die bis zu 24 Wochen behandelt worden waren, oder nach der 12-wöchigen Erholungsphase, während der das Arzneimittel im Serum nachweisbar war. Die Dosisniveaus in tierexperimentellen Studien waren ungefähr bis zu 45-fach höher als die Dosis von 100 mg, die für die Verabreichung an Patienten mit Plaque-Psoriasis vorgesehen ist (basierend auf einem Patienten von 90 kg Körpergewicht), und sie resultierten bei den Affen in maximalen Serumkonzentrationen, die mehr als 100-fach höher waren als die beim Menschen beobachteten.
Mutagenität/Karzinogenität
Es wurden mit Guselkumab keine Studien zur Mutagenität oder Karzinogenität durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibiltätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8 °C) lagern.
Nicht einfrieren.
Die Fertigspritze und den Fertigpen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht schütteln.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Nach der Entnahme von TREMFYA aus dem Kühlschrank, ist die Fertigspritze oder der Fertigpen im Umkarton zu belassen und bis zur Injektion 30 Minuten zu warten, damit die Lösung Raumtemperatur annehmen kann. Die Fertigspritze oder den Fertigpen nicht schütteln.
Vor Gebrauch wird eine Sichtkontrolle der Fertigspritze oder des Fertigpens empfohlen. Die Lösung sollte klar, farblos bis hellgelb sein und kann ein paar kleine, weisse oder durchsichtige Eiweisspartikel enthalten. TREMFYA sollte nicht verwendet werden, wenn die Lösung trüb oder verfärbt ist oder grosse Partikel enthält.
Jede TREMFYA-Packung enthält eine separate Broschüre «Gebrauchsanweisung» mit einer vollständigen Beschreibung der Vorbereitung und Anwendung der Fertigspritze oder des Fertigpens.
TREMFYA enthält keine Konservierungsmittel; deshalb sind in der Spritze oder dem Pen verbleibende nicht verwendete Reste des Arzneimittels zu verwerfen.
Nicht verwendetes Arzneimittel und/oder das Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
TREMFYA wird angeboten als sterile Lösung zur einmaligen Verwendung in
·einer 1 ml Fertigspritze aus Glas mit einer fixierten Nadel und einem latexfreien Nadelschutz, die in einer passiven Nadelschutzvorrichtung eingebaut ist.
·einer 1 ml Fertigspritze aus Glas, die in einem Fertigpen mit einem Nadelschutz eingebaut ist.
Zulassungsnummer66583, 67490 (Swissmedic).
PackungenTREMFYA Injektionslösung in einer Fertigspritze:
Faltschachtel mit 1 Fertigspritze 100 mg/ml [B]
TREMFYA Injektionslösung im Fertigpen:
Faltschachtel mit 1 Fertigpen 100 mg/ml [B]
ZulassungsinhaberinJanssen-Cilag AG, Zug, ZG.
Stand der InformationJuni 2023
|


