ZusammensetzungWirkstoff: Certolizumab pegol, aus gentechnisch veränderten Escherichia coli Bakterien hergestellt.
Hilfsstoffe: Natriumacetat, Natriumchlorid, Wasser für Injektionszwecke.
Galenische Form und Wirkstoffmenge pro EinheitJede Fertigspritze oder jeder Fertigpen mit Cimzia enthält 200 mg Certolizumab pegol in 1 ml als Injektionslösung.
Eine Dosis zu 200 mg benötigt 1 subkutane Injektionslösung zu 1 ml.
Eine Dosis zu 400 mg benötigt 2 subkutane Injektionslösungen zu 1 ml.
Indikationen/AnwendungsmöglichkeitenMorbus Crohn
Cimzia ist indiziert zur Induktion eines klinischen Ansprechens sowie zur Aufrechterhaltung eines klinischen Ansprechens und einer Remission bei Patienten mit aktivem Morbus Crohn, die auf eine konventionelle Behandlung nicht ausreichend angesprochen haben.
Rheumatoide Arthritis
Cimzia ist in Kombination mit Methotrexat (MTX) für die Behandlung der mittelschweren bis schweren, aktiven rheumatoiden Arthritis (RA) bei erwachsenen Patienten angezeigt, wenn das Ansprechen auf langwirksame Antirheumatika (Disease-Modifying Antirheumatic Drugs [DMARDS]) einschliesslich MTX ungenügend war.
In Fällen von Unverträglichkeit gegenüber MTX oder wenn die Fortsetzung der Behandlung mit MTX ungeeignet ist, kann Cimzia als Monotherapie verabreicht werden.
Für Cimzia wurde gezeigt, dass es bei gemeinsamer Verabreichung mit MTX das Fortschreiten von radiologisch nachweisbaren Gelenkschäden reduziert und die körperliche Funktionsfähigkeit verbessert.
Psoriatische Arthritis
Cimzia ist in Kombination mit Methotrexat (MTX) indiziert zur Behandlung aktiver psoriatischer Arthritis von erwachsenen Patienten, welche auf eine Therapie mit krankheitsmodifizierenden Antirheumatika (disease-modifying anti-rheumatic drugs; DMARD) unzureichend angesprochen haben.
Cimzia verbessert die physische Funktionsfähigkeit bei Patienten mit Psoriasis Arthritis.
In Fällen von Unverträglichkeit gegenüber Methotrexat oder wenn die Fortsetzung der Behandlung mit Methotrexat ungeeignet ist, kann Cimzia als Monotherapie verabreicht werden.
Axiale Spondyloarthritis
Cimzia ist indiziert zur Behandlung der schweren aktiven axialen Spondyloarthritis bei erwachsenen Patienten, einschliesslich Patienten mit schwerer aktiver ankylosierender Spondylitis und Patienten mit schwerer aktiver nicht-röntgenologischer axialer Spondyloarthritis, die auf eine konventionelle Therapie unzureichend angesprochen haben oder NSAIDs nicht vertragen. Patienten mit schwerer aktiver nicht-röntgenologischer axialer Spondyloarthritis sollten objektive Anzeichen einer Entzündung im MRI und durch erhöhtes CRP zeigen.
Dosierung/AnwendungDie Therapie sollte von Fachärzten mit Erfahrung in der Diagnose und Behandlung von Erkrankungen, für die Cimzia zugelassen ist, eingeleitet und überwacht werden.
Nach einer angemessenen Schulung in der Injektionstechnik, können Patienten Cimzia selbst injizieren, wenn der behandelnde Arzt dies für angemessen hält und die erforderliche ärztliche Weiterbetreuung gewährleistet ist. Geeignete Injektionsstellen sind Oberschenkel oder Bauchdecke.
Anfangsdosis
Erwachsene (ab 18 Jahren):
Die empfohlene Anfangsdosis von Cimzia bei erwachsenen Patienten beträgt 400 mg (verabreicht in 2 subkutanen Injektionen zu je 200 mg) zu Beginn (Woche 0) und in den Wochen 2 und 4.
Erhaltungsdosis
Erwachsene (ab 18 Jahren):
Morbus Crohn
Cimzia ist zur subkutanen Anwendung bei Erwachsenen bestimmt.
Nach der Anfangsdosis beträgt die empfohlene Erhaltungsdosis von Cimzia bei erwachsenen Patienten mit Morbus Crohn 400 mg alle 4 Wochen.
Rheumatoide Arthritis
Nach der Anfangsdosis beträgt die empfohlene Erhaltungsdosis von Cimzia bei erwachsenen Patienten mit rheumatoider Arthritis 200 mg alle 2 Wochen in Form einer subkutanen Injektion. In Fällen, wo eine Dosis alle 2 Wochen nicht durchführbar ist, hat sich eine Dosis von 400 mg alle 4 Wochen als sicher und wirksam erwiesen (vgl. Abschnitt «Klinische Wirksamkeit»).
Die Behandlung mit MTX sollte, soweit verträglich, während der Behandlung mit Cimzia aufrecht erhalten bleiben.
Psoriatische Arthritis
Nach der Anfangsdosis beträgt die empfohlene Erhaltungsdosis von Cimzia bei erwachsenen Patienten mit psoriatischer Arthritis 200 mg alle 2 Wochen. Bei Ansprechen der Patienten kann als alternative Dosierung 400 mg alle 4 Wochen berücksichtigt werden.
Axiale Spondyloarthritis
Nach der Anfangsdosis beträgt die empfohlene Erhaltungsdosis von Cimzia bei erwachsenen Patienten mit axialer Spondyloarthritis 200 mg alle 2 Wochen oder 400 mg alle 4 Wochen.
Die vorliegenden Daten lassen für die oben genannten Indikationen (rheumatoide Arthritis, psoriatische Arthritis und axiale Spondyloarthritis) vermuten, dass ein klinisches Ansprechen in der Regel innerhalb von 12 Wochen Behandlung erreicht wird. Für Patienten, bei denen innerhalb der ersten 12 Wochen Behandlung keine Anzeichen für einen therapeutischen Nutzen zu beobachten sind, ist die Fortsetzung der Therapie sorgfältig zu überdenken.
Kinder (0-17 Jahre):
Die Anwendung, Sicherheit und Wirksamkeit von Cimzia bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Senioren (>65 Jahre):
Bei der Behandlung älterer Patienten ist Vorsicht geboten. Zur Sicherheit und Wirksamkeit bei älteren Patienten mit Morbus-Crohn und rheumatoider Arthritis liegen Daten in begrenztem Umfang vor; eine populationsbezogene pharmakokinetische Analyse zeigte allerdings keine Alterseffekte.
Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Nierenfunktionsstörung:
Zur Beurteilung der Auswirkungen einer Nierenfunktionsstörung auf die Pharmakokinetik von Certolizumab pegol wurden keine spezifischen klinischen Studien durchgeführt. Die populationsbezogene pharmakokinetische Analyse zeigte jedoch keine von der Kreatinin-Clearance abhängigen Effekte; d.h. eine leichte Nierenfunktionsstörung hat wahrscheinlich keine signifikanten Auswirkungen.
Für eine Dosierungsempfehlung bei Patienten mit Nierenfunktionsstörungen liegen keine ausreichenden Daten vor.
Leberfunktionsstörungen:
Zur Beurteilung der Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Certolizumab pegol wurden keine spezifischen klinischen Studien durchgeführt. Die populationsbezogene pharmakokinetische Analyse liess keine Rückschlüsse bezüglich der Auswirkungen einer Leberfunktionsstörung zu, da diese Analyse nur eine geringe Anzahl von Patienten mit signifikanten Leberfunktionsstörungen umfasste.
Für eine Dosierungsempfehlung bei Patienten mit Leberfunktionsstörungen liegen keine ausreichenden Daten vor.
Dauer der Behandlung bei Morbus Crohn:
Für eine Behandlung, die über 6 Monate hinausgeht, ist die Sicherheit und Wirksamkeit von Cimzia bisher nicht ausreichend belegt.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Diagnose von aktiver Tuberkulose oder anderen schweren Infektionen, wie z.B. eine Sepsis, ein Abszess oder opportunistische Infektionen.
Mässige bis schwere Herzinsuffizienz (NYHA Klasse III/IV).
Warnhinweise und VorsichtsmassnahmenImmunsuppression
Da TNF Entzündungen vermittelt und die zellulären Immunreaktionen moduliert, besteht die Möglichkeit, dass Anti-TNF-Präparate wie Cimzia sich auf die Abwehrkräfte gegen Infektionen und maligne Tumore auswirken. Die Auswirkungen einer Behandlung mit Cimzia auf die Entstehung und den Verlauf von malignen Tumoren sowie aktiven und/oder chronischen Infekten sind nicht vollständig geklärt.
Patienten mit rheumatoider Arthritis zeigen in Folge ihrer Erkrankung und der entsprechenden Arzneimittel möglicherweise keine für eine Infektion typischen Symptome, einschliesslich Fieber. Eine frühe Diagnose jeder Art von Infektion ist daher ausschlaggebend für einen möglichst schnellen Behandlungsbeginn.
Infekte
Die Patienten sind vor, während und nach der Behandlung mit Cimzia sorgfältig in Bezug auf Infekte wie z.B. eine Tuberkulose zu überwachen; hierbei ist die lange Halbwertszeit des Präparats zu berücksichtigen. Da sich die Elimination von Cimzia über eine Dauer von bis zu 5 Monaten erstrecken kann, ist die Überwachung über diesen Zeitraum fortzusetzen.
Bei Patienten mit klinisch bedeutsamen aktiven Infekten, einschliesslich chronischer oder lokalisierter Infektionen, sollte keine Therapie mit Cimzia begonnen werden bis die Infektionen behandelt wurden.
Patienten, bei denen während der Behandlung mit Cimzia eine neue Infektion auftritt, sollten sorgfältig überwacht werden.
Tritt bei einem Patienten eine neue schwere Infektion auf, so sollte die Behandlung mit Cimzia abgesetzt werden, bis der Infekt unter Kontrolle ist. Bei Patienten, deren Anamnese häufig wiederkehrende oder opportunistische Infekte aufweist oder Grunderkrankungen, die für Infekte prädisponieren, sollte der Arzt den Einsatz von Cimzia sorgfältig abwägen.
Bei Patienten, die Anti-TNF-Präparate wie Cimzia erhielten, wurden schwerwiegende Infektionen, Sepsis, Tuberkulose (auch miliare, disseminierte und extrapulmonale Tuberkulose), opportunistische Mykosen, z.B. Histoplasmose, Pneumocystis jiroveci, Herpes zoster, virale und/oder parasitäre Infektionen, sowie auch einige Todesfälle berichtet.
Eine grosse Anzahl dieser berichteten schweren Infektionen traten bei Patienten mit einer immunsuppressiven Begleittherapie auf, die sie zusätzlich zu ihrer Erkrankung möglicherweise für Infekte prädisponiert.
Tuberkulose
Vor Beginn einer Therapie mit Cimzia sind alle Patienten sowohl auf eine aktive als auch auf eine inaktive (latente) Tuberkulose-Infektion zu untersuchen. Diese Untersuchung sollte eine ausführliche Anamnese umfassen, die auf die persönliche Krankengeschichte in Bezug auf Tuberkulose oder eventuelle frühere Kontakte zu Patienten mit aktiver Tuberkulose sowie auf eine vorhergehende und/oder aktuelle immunsuppressive Therapie eingeht.
Bei allen Patienten sollten geeignete Screening-Tests, d.h. ein Tuberkulin-Hauttest oder andere biologische Tuberkulosetests sowie ein Röntgenthorax, durchgeführt werden. Die verschreibenden Ärzte werden auf das Risiko falsch negativer Ergebnisse beim Tuberkulin-Hauttest oder bei anderen biologischen Tuberkulosetests hingewiesen, welche insbesondere bei Patienten mit schwerwiegenden Erkrankungen oder Immunschwäche auftreten können.
Wird eine latente Tuberkulose diagnostiziert, so muss vor Beginn der Behandlung mit Cimzia entsprechend den nationalen Empfehlungen eine geeignete tuberkulostatische Therapie durchgeführt werden.
Die Durchführung einer tuberkulostatischen Therapie ist vor Beginn einer Cimzia-Therapie auch bei Patienten mit latenter oder aktiver Tuberkulose in der Anamnese zu erwägen, bei denen keine angemessene Behandlung bestätigt werden kann. Dies gilt auch für Patienten, bei denen trotz eines negativen Tests auf latente Tuberkulose erhebliche Risikofaktoren für Tuberkulose vorliegen. Wenn der Verdacht einer latenten Tuberkuloseinfektion besteht, sollten vor Beginn der Behandlung mit Cimzia biologische Tuberkulose-Screeningtests erwogen werden, unabhängig von einer BCG-Impfung.
Bei der Diagnose einer aktiven Tuberkulose darf keine Behandlung mit Cimzia begonnen werden.
Bei der Diagnose oder Verdacht einer latenten Tuberkulose oder Vorliegen erheblicher Risikofaktoren ist 1 Monat vor Beginn der Behandlung mit Cimzia eine geeignete Tuberkulose-Prophylaxe einzuleiten. Dabei sollte das Nutzen/Risiko-Verhältnis einer Therapie mit Cimzia sehr sorgfältig abgewogen werden. Die Entscheidung für eine antituberkulöse Therapie beim individuellen Patienten sollte unter Einbezug eines bezüglich Tuberkulose erfahrenen Spezialisten erfolgen.
Trotz einer vorhergehenden oder begleitenden prophylaktischen Behandlung der Tuberkulose sind bei Patienten, die mit TNF-Antagonisten, einschliesslich Cimzia, behandelt wurden, Fälle einer aktiven Tuberkulose aufgetreten. Einige Patienten, deren aktive Tuberkulose erfolgreich behandelt wurde, entwickelten während der Behandlung mit TNF-Antagonisten, einschliesslich Cimzia, wieder eine Tuberkulose.
Patienten sollten dazu angehalten werden, bei Auftreten von Symptomen, die auf eine mögliche Tuberkulose-Infektion hindeuten (z.B. anhaltender Husten, Auszehrung/Gewichtsverlust, leichtes Fieber) während oder nach der Behandlung mit Cimzia einen Arzt zu konsultieren.
Hepatitis B Virus- (HBV-) Reaktivierung
Die Reaktivierung von HBV wurde bei chronischen Trägern dieses Virus beobachtet (d.h. Oberflächen-Antigen positiv), die mit TNF-Antagonisten einschliesslich Cimzia behandelt wurden. Einige Fälle nahmen einen tödlichen Ausgang.
Vor Beginn der Behandlung mit Cimzia sollten Patienten auf eine vorhandene HBV-Infektion untersucht werden. Bei Patienten, die positiv auf eine HBV-Infektion getestet wurden, wird empfohlen, einen in der Behandlung von Hepatitis B erfahrenen Arzt, bzw. Ärztin zu Rate zu ziehen.
Es liegen keine ausreichenden Daten zur Behandlung von HBV-Trägern mit TNF-Antagonisten in Verbindung mit einer virustatischen Therapie vor, die belegen, dass eine HBV-Reaktivierung verhindert wird. HBV-Träger, die eine Behandlung mit TNF-Antagonisten benötigen, sind während der Behandlung und noch mehrere Monate nach Ende der Behandlung engmaschig auf klinische und laborchemische Anzeichen einer aktiven HBV-Infektion zu überwachen, vor allem wenn der Patient gleichzeitig mit Kortikosteroiden behandelt wird.
Bei Patienten, die eine HBV-Reaktivierung entwickeln, ist Cimzia abzusetzen und eine wirksame virustatische Therapie mit geeigneter unterstützender Behandlung einzuleiten. Die Sicherheit der Wiederaufnahme einer Therapie mit TNF-Antagonisten, nachdem die HBV-Reaktivierung unter Kontrolle ist, ist nicht bekannt.
Behandelnde Ärzte müssen daher besonders vorsichtig sein, wenn sie in dieser Situation die Wiederaufnahme der Cimzia-Therapie erwägen, und sollten die Patienten engmaschig überwachen.
Maligne Tumore und lymphoproliferative Störungen
In kontrollierten klinischen Studien zu Cimzia und anderen Anti-TNF-Präparaten wurden bei den mit diesen Präparaten behandelten Patienten mehr Lymphome und andere maligne Tumore beobachtet als in den jeweiligen Kontrollgruppen.
Die Häufigkeit war jedoch gering, und die Nachbeobachtungszeit war bei den Placebopatienten kürzer als bei den mit TNF-Antagonisten behandelten Patienten.
Bei Patienten mit Morbus Crohn oder rheumatoider Arthritis, besonders diejenigen mit einer stark aktiven Krankheit, bei denen eine chronische Exposition zu Immunsuppressiva erforderlich ist, besteht ein höheres Risiko für die Entstehung von Lymphomen als bei der übrigen Population, und dies auch ohne eine Therapie mit TNF-Blockern. Nach dem derzeitigen Kenntnisstand ist ein mögliches Risiko für die Entstehung von Lymphomen oder anderen malignen Tumoren bei mit TNF-Antagonisten behandelten Patienten nicht auszuschliessen.
Zu Patienten mit malignen Tumoren in der Anamnese sowie zur Weiterbehandlung von Patienten, bei denen während der Behandlung mit Cimzia maligne Tumore aufgetreten sind, liegen keine Studien vor. Deshalb ist bei diesen Patienten eine Behandlung mit Cimzia nur mit besonderer Vorsicht in Erwägung zu ziehen.
Im Zusammenhang mit dem Post-Marketing-Einsatz von Anti-TNF-Präparaten bei rheumatoider Arthritis und anderen Indikationen, wurden Fälle von akuter und chronischer Leukämie berichtet. Patienten mit rheumatoider Arthritis weisen möglicherweise ein höheres Risiko (bis 2 mal höher) für die Entwicklung einer Leukämie auf als die übrige Bevölkerung, dies auch ohne Behandlung mit Anti-TNF-Präparaten.
Bei Kindern und Jugendlichen (≤18 Jahre), die eine Behandlung mit Anti-TNF-Präparaten erhielten, wurde maligne Tumore, davon einige mit tödlichem Verlauf, gemeldet. Etwa die Hälfte dieser Fälle waren Lymphome, inklusive Hodgkin's und non-Hodgkin's Lymphome. Die übrigen Fälle umfassten verschiedene andere maligne Tumore, einschliesslich seltener maligner Tumore, die üblicherweise im Zusammenhang mit Immunsuppression stehen und solche, die normalerweise nicht bei Kindern und Jugendlichen auftreten.
Die malignen Tumore traten median nach 30 Monaten Therapie (Bereich von 1 bis 84 Monate) auf. Die meisten Patienten erhielten gleichzeitig Immunsuppressiva. Bei diesen Fällen handelt es sich um Post-Marketing-Meldungen aus verschiedenen Quellen, inklusive Register und spontane Meldungen.
Cimzia ist bei Kindern und Jugendlichen nicht indiziert.
Bei Patienten, mehrheitlich Jugendlichen und jungen Männern mit chronisch-entzündlichen Darmerkrankungen und eine Komedication von TNF-Antagonisten mit Azathioprin oder 6-Mercapturin, wurden Postmarketing-Fälle vom hepatosplenalen T-cell Lymphoma (HSTCl), einem seltenen Typ von T-cell Lymphoma mit einem sehr aggressiven und meist fatalen Krankheitsverlauf, berichtet (siehe «Unerwünschte Wirkungen»).
Melanom und Merkelzellkarzinoma
Melanom und Merkelzellkarzinom sind bei Patienten, die mit TNF-Antagonisten einschliesslich Cimzia behandelt wurden, berichtet worden (siehe «Unerwünschte Wirkungen»). Regelmässige Hautuntersuchungen werden für alle Patienten empfohlen, besonders für solche mit Risikofaktoren für Hautkrebs.
Herzinsuffizienz
In einer klinischen Studie mit einem anderen TNF-Antagonist wurde von einer Verschlechterung der Herzinsuffizienz und erhöhter Mortalität durch kongestive Herzinsuffizienz berichtet.
Fälle von Verschlechterung von kongestiver Herzinsuffizienz wurden auch bei Patienten, die Cimzia erhielten, beobachtet. Cimzia sollte bei Patienten mit milder Herzinsuffizienz (NYHA Klasse I/II) mit Vorsicht eingesetzt werden. Bei Fällen mit mässiger bis schwerer Herzinsuffizienz ist Cimzia kontraindiziert. Die Behandlung mit Cimzia muss abgebrochen werden bei Patienten, die neu eine Herzinsuffizienz entwickeln oder deren Symptome von Herzinsuffizienz sich verschlimmern.
Es gab nur wenige Berichte von kardiovaskulären Vorkommnissen in den Studien zu Morbus Crohn. Cimzia sollte bei älteren Patienten und bei solchen mit Risikofaktoren, die für kardiovaskuläre oder entzündliche Erkrankungen prädisponieren, vorsichtig angewendet werden.
Hämatologische Ereignisse
In Zusammenhang mit Anti-TNF-Präparaten wurden seltene Fälle von Panzytopenien, wie z.B. aplastische Anämie, berichtet. Unerwünschte Ereignisse, die das hämatologische System betreffen, wie z.B. eine medizinisch signifikante Zytopenie (u.a. Leukopenie, Panzytopenie, Thrombozytopenie) wurden in Zusammenhang mit Cimzia selten berichtet. Bei Patienten mit signifikanten hämatologischen Auffälligkeiten in der Krankengeschichte oder zum aktuellen Zeitpunkt ist in Bezug auf eine Behandlung mit Cimzia Vorsicht geboten. Alle Patienten sind dazu anzuhalten, bei Auftreten von Anzeichen bzw. Symptomen, die auf eine mögliche Blutkrankheit oder Infektion hindeuten (z.B. anhaltendes Fieber, Blutergüsse, Blutungen, Blässe) unverzüglich einen Arzt zu konsultieren. Bei Patienten mit nachgewiesenen signifikanten hämatologischen Auffälligkeiten sollte ein Absetzen der Behandlung mit Cimzia erwogen werden.
Neurologische Ereignisse
Der Einsatz von Anti-TNF-Präparaten wurde in seltenen Fällen mit einer Verschlimmerung der klinischen Symptome und/oder der radiographischen Anzeichen einer demyelinisierenden Erkrankung einschliesslich Multipler Sklerose, und mit einer peripheren demyelinisierenden Erkrankung, einschliesslich Guillain-Barré Syndrom, in Verbindung gebracht. Bei der Erwägung einer eventuellen Anwendung von Cimzia bei Patienten mit vorbestehenden oder vor kurzem aufgetretenen demyelinisierenden zentralen oder peripheren Nervensystem-Erkrankungen sollten die verschreibenden Ärzte Vorsicht walten lassen. Bei mit Cimzia behandelten Patienten wurden seltene Fälle von neurologischen Störungen wie z.B. Anfallsleiden, Optikusneuritis, periphere Neuropathie und Querschnittmyelitis berichtet.
Überempfindlichkeit
Nach Verabreichung von Cimzia wurden in seltenen Fällen folgende Symptome berichtet, die möglicherweise eine Überempfindlichkeitsreaktion darstellen: Angiödeme, Dyspnoe, Hypotonie, Ausschläge, Serumkrankheit und Urtikaria. Einige dieser Überempfindlichkeitsreaktionen sind bereits bei der ersten Gabe von Cimzia aufgetreten. Bei Auftreten solcher Reaktionen sollte die Anwendung von Cimzia abgesetzt und eine geeignete Therapie eingeleitet werden.
Zur Anwendung von Cimzia bei Patienten, die eine schwere Überempfindlichkeitsreaktion auf ein anderes Anti-TNF-Präparat zeigten, liegen keine Daten vor; bei diesen Patienten ist entsprechende Vorsicht geboten.
Autoimmunität
Durch die Behandlung mit Cimzia kann es zur Bildung von Autoantikörpern sowie in seltenen Fällen zur Ausbildung eines Lupus-ähnlichen Syndroms kommen. Zeigt ein Patient nach der Behandlung mit Cimzia Symptome, die auf ein mögliches Lupus-ähnliches Syndrom hindeuten, so sollte die Therapie abgesetzt werden. Bei Patienten mit Lupus in der Anamnese ist Vorsicht geboten. Zur Anwendung von Cimzia bei Patienten, die nach Anwendung eines anderen Anti-TNF-Präparats an Lupus oder anderen Autoimmunerkrankungen litten, liegen keine Daten vor.
Immunisierung
Patienten, die mit Cimzia behandelt werden, dürfen geimpft werden, jedoch nicht mit Lebend- oder Lebend-attenuierten Impfstoffen.
Zum Ansprechen auf Lebendimpfungen sowie zur sekundären Übertragung von Infektionen durch Lebendimpfstoffe bei mit Cimzia behandelten Patienten liegen keine Daten vor. Lebendimpfstoffe bzw. attenuierte Impfstoffe sollten nicht zeitgleich mit Cimzia verabreicht werden.
In einer placebokontrollierten klinischen Studie mit Patienten mit rheumatoider Arthritis wurde kein Unterschied bei der Antikörperantwort zwischen der Cimzia-Gruppe und der Placebogruppe festgestellt, wenn Cimzia zusammen mit dem Pneumokokken-Polysaccharid-Impfstoff oder dem Influenza-Impfstoff verabreicht wurde. In beiden Gruppen entwickelte eine etwa gleich grosse Anzahl Patienten protektive Antikörper. Jedoch zeigte sich bei Patienten, die Cimzia zusammen mit Methotrexat nahmen, eine niedrigere humorale Immunantwort als bei denjenigen, denen nur Cimzia verabreicht wurde. Die klinische Relevanz dieser Ergebnisse ist nicht bekannt. Cimzia unterdrückt nicht die humorale Immunantwort auf Pneumokokken-Polysaccharid-Impfstoff und Influenza-Impfstoff.
Gleichzeitige Anwendung mit anderen Biologika
In klinischen Studien wurden bei gleichzeitiger Anwendung von Anakinra (einem Interleukin-1-Antagonisten) oder Abatacept und anderen Anti-TNF-Präparaten, ernsthafte Infektionen beobachtet; dabei war im Vergleich zur alleinigen Anwendung des TNF-Blockers kein grösserer Nutzen erkennbar. Die Art der unerwünschten Ereignisse, welche bei der kombinierten Anwendung von einem anti-TNF-Präparat und Anakinra oder Abatacept zu beobachten waren, lässt vermuten, dass ähnliche Toxizitäten auch bei einer Kombination von Anakinra oder Abatacept mit Cimzia auftreten können. Zur Anwendung von Cimzia in Kombination mit Anakinra oder Abatacept liegen keine Untersuchungen vor; sie ist deshalb nicht zu empfehlen.
Operationen
Die Erfahrung in Bezug auf die Unbedenklichkeit bei operativen Eingriffen bei Patienten unter Cimzia-Behandlung ist begrenzt. Bei der Planung eines operativen Eingriffs sollte die Halbwertszeit von 14 Tagen von Certolizumab pegol berücksichtigt werden. Wenn eine Operation geplant ist, während ein Patient mit Cimzia behandelt wird, muss er engmaschig auf Infektionen überwacht werden, und es sind entsprechende Massnahmen zu ergreifen.
aPPT-In-Vitro-Tests
Es wurden Interferenzen mit bestimmten Koagulationstests, die bei mit Cimzia behandelten Patienten durchgeführt wurden, beobachtet. Cimzia kann bei Patienten ohne Koagulationsstörungen zu falsch erhöhten aPTT-Testergebnissen führen. Es gibt aber keinen Hinweis auf eine Wirkung von Cimzia auf die in-vivo-Koagulation. Bei einer Behandlung mit Cimzia sollten auffällige Ergebnisse von Koagulationstests kritisch betrachtet werden. Es wurden keine Interferenzen mit Tests zur Thrombinzeit (TT) und zur Prothrombinzeit (Patient) beobachtet.
Die folgenden getesteten Reagenzien haben keine Auswirkung auf die aPTT-Testergebnisse: Dade® Actin® FS Activated PTT, Dade® Actin® FSL Activated PTT, HemosiLTM SynthAFax, HemosiLTM SynthASil, Platelin® LS (auch als TriniCLOaPTT HS vertrieben). Es gibt aber möglicherweise weitere Reagenzien.
Dünndarmobstruktion
Das Ausbleiben eines Ansprechens auf die Behandlung eines Morbus Crohn könnte durch das Vorliegen einer fixierten fibrotischen Striktur bedingt sein, welche eine chirurgische Behandlung erfordern könnte.
Ältere Patienten
Bei der Behandlung über 60-jähriger Patienten ist Vorsicht geboten, insbesondere bezüglich Auftretens von Infektionen.
Fertilität bei Männern
In klinischen Tests zur Bestimmung der Auswirkungen einer Einzeldosis von Certolizumab pegol auf die Qualitätsparameter des Spermas (Spermamenge, Spermienanzahl und -konzentration, progressive Motilität, Gesamtmotilität in Prozent, Vitalität und Morphologie) wurden 20 gesunde Männer randomisiert, denen eine einzelne subkutane Dosis von 400 mg Certolizumab pegol oder ein Placebo verabreicht wurde. Beim 14-wöchigen Follow-up konnten im Vergleich zum Placebo keine Auswirkungen der Behandlung mit Certolizumab pegol auf die Qualitätsparameter des Spermas beobachtet werden.
InteraktionenDie gleichzeitige Behandlung mit Methotrexat, Kortikosteroiden, nicht-steroidalen Antirheumatika (NSAR) und Analgetika hatte keinen Einfluss auf die Pharmakokinetik von Certolizumab pegol, wie eine populationspharmakokinetische Analyse von Patienten mit Morbus Crohn und rheumatoider Arthritis gezeigt hat.
Eine gleichzeitige Anwendung von Methotrexat, 6-Mercaptopurin oder Azathioprin hatte keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Certolizumab pegol.
Die Kombination von Cimzia mit Anakinra oder Abatacept wird nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Pharmakokinetik von Certolizumab pegol wurde ebenfalls in einer pharmakokinetischen Interaktionsstudie an 16 Patienten mit rheumatoider Arthritis untersucht, die Methotrexat in stabiler Dosierung (zwischen 5 und 17,5 mg pro Woche) erhielten.
Die gleichzeitige Verabreichung von Certolizumab pegol und Methotrexat zeigte keine signifikanten Auswirkungen auf die Pharmakokinetik von Methotrexat, während die Pharmakokinetik von Certolizumab pegol mit der zuvor bei gesunden Probanden beobachteten vergleichbar war.
Schwangerschaft/StillzeitSchwangerschaft
In tierexperimentellen Untersuchungen mit Ratten von bis zu 100 mg/kg eines pegylierten Fab Fragmentes eines von Nagern stammenden anti-murinen Antikörpers (cTN3 PF) ähnlich Certolizumab pegol wurden keine Anzeichen von maternaler Toxizität oder Teratogenität beobachtet. In einer embryofötalen Entwicklungsstudie traten bei 20 mg/kg spontane Missbildungen der Niere auf, die in den historischen Kontrollen beobachtet wurden, aber nicht Dosis-abhängig waren. Allerdings sind diese Studien zur Beurteilung der Reproduktionstoxizität beim Menschen unzureichend (vgl. Abschnitt «Präklinische Daten»).
Der aktive Plazentatransfer von IgGs wird durch den Fc-Anteil eines Antikörpers bewirkt, der an den neonatalen Fc-Rezeptor (FcRn) ankoppelt. Certolizumab pegol besteht lediglich aus dem Fab-Anteil eines Antikörpers, der Fc-Anteil fehlt. In Reproduktionsstudien bei Ratten trat cTN3 γ1 (vollständiger Ersatzantikörper für Certolizumab mit Fc-Anteil) während der Trächtigkeit auf den Fötus über. Dagegen wurde kein – oder kein messbarer – Übertritt von cTN3 PF (Ersatz-Fab-Fragment für Certolizumab ohne Fc-Anteil) auf den Fötus im Vergleich zu Plasmakonzentrationen bei der Mutter festgestellt, was die Bedeutung von Fc für den Plazentatransfer verdeutlicht.
Daten, die diese Erkenntnis stützen, wurden auch aus einem In-vitro Human-Plazentatransfer-Modell im geschlossenen Kreislauf gewonnen. Die Certolizumab-Konzentrationen im fötalen Kreislauf lagen unterhalb oder nahe an der Nachweisgrenze (0.41 µg/ml).
Bei 10 Schwangeren mit Morbus Crohn, unter Cimzia Behandlung lagen die Konzentrationen im Nabelschnurblut bei <0.41-1.66 µg/ml im kindlichen Blut am Tag der Geburt bei <0.41-1.58 µg/ml sowie im Mutterblut bei 1.87-59.57 µg/ml.
Nichtklinische Studien und klinische Daten legen zwar das Fehlen eines aktiven FcRn-abhängigen Plazentatransfers von Certolizumab pegol nahe, dennoch sollte Cimzia mangels geeigneter und gut kontrollierter Studien für Cimzia bei schwangeren Frauen, ausser bei eindeutiger Indikation, nicht während der Schwangerschaft angewendet werden.
Aufgrund der Inhibition von TNFα könnte Cimzia, während der Schwangerschaft verabreicht, die normale Immunantwort des Neugeborenen beeinträchtigen. Auch wenn die Levels von Certolizumab pegol beim Kleinkind niedrig sind, ist die klinische Relevanz selbst solcher niedrigen Levels nicht bekannt. Die Vor- und Nachteile der Anwendung von Lebend-Impfstoffen in den ersten 12 Lebenswochen sollten mit einem Kinderarzt abgeklärt werden. Hingegen unterdrückt Cimzia die humorale Immunantwort auf tote Impfstoffe bei Erwachsenen nicht.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten einer Schwangerschaft durch geeignete empfängnisverhütende Massnahmen vorbeugen und diese nach Ende der Behandlung mit Cimzia noch mindestens 4 Monate lang anwenden.
Stillzeit
In Tierstudien wurde ein Transfer von cTN3 PF in die Muttermilch von Ratten mit einer Milch-Plasma Ratio von ca. 10% gemessen. Es ist nicht bekannt, ob Certolizumab pegol über die menschliche Muttermilch ausgeschieden wird. Es wird daher empfohlen, Cimzia während der Stillzeit nicht anzuwenden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Unerwünschte WirkungenInsgesamt 1'350 Probanden mit Morbus Crohn sowie 4'049 Patienten mit rheumatoider Arthritis wurden mit Cimzia behandelt. Insgesamt 426 Probanden mit Morbus Crohn und 1'137 Probanden mit rheumatoider Arthritis erhielten ein Placebo.
Die unten aufgeführten Daten stützen sich auf unerwünschte Wirkungen, die im Rahmen dieser kontrollierten Studien sowie der offenen Weiterbeobachtungsstudien beobachtet wurden.
Von den 1'350 Morbus-Crohn-Patienten wurden 498 über einen Zeitraum von 6 Monaten und 122 über einen Zeitraum von 12 Monate behandelt.
In den placebokontrollierten Studien, war die Expositionsdauer bei Patienten mit rheumatoider Arthritis in der Cimzia-Gruppe etwa viermal höher als in der Placebogruppe. Dieser Unterschied liegt vor allem daran, dass Patienten aus der Placebogruppe die Studien eher vorzeitig abbrachen. Darüber hinaus wurde in den Studien RA-I und RA-II obligatorisch ein Studienabbruch in Woche 16 wegen mangelnden Ansprechens auf die Therapie beobachtet. Die Mehrheit dieser Abbrüche betraf die Placebogruppe.
Unerwünschte Wirkungen wurden in den kontrollierten Studien bei 40.4% der Patienten mit Morbus Crohn und 34.0% der Patienten mit rheumatoider Arthritis aus der Cimzia-Gruppe, sowie bei 38.7% der Patienten mit Morbus Crohn und 24.9% der Patienten mit rheumatoider Arthritis aus der Placebogruppe beobachtet. Der Prozentsatz der Patienten, die die kontrollierten Studien auf Grund von unerwünschten Wirkungen abbrachen, betrug 8.2% der Patienten mit Morbus Crohn und 4.4% der Patienten mit rheumatoider Arthritis aus der Cimziagruppe, sowie 6.4% der Patienten mit Morbus Crohn und 2.7% der Patienten mit rheumatoider Arthritis aus der Placebogruppe.
Bei den Patienten mit Morbus Crohn und rheumatoider Arthritis waren die schwersten unerwünschten Reaktionen Infektionen und maligne Tumore (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die häufigsten unerwünschten Ereignisse in kontrollierten klinischen Studien mit Cimzia waren bei Patienten mit Morbus Crohn Kopfschmerzen (12% Cimzia, 17.1% Placebo), Nasopharyngitis (8.9% Cimzia, 7.7% Placebo) und eine Verschlimmerung des Morbus Crohn (8.9% Cimzia, 10.8% Placebo).
In placebokontrollierten Studien zur rheumatoiden Arthritis waren die häufigsten unerwünschten Wirkungen Infektionen und Infestationen bei 14.4% der Patienten aus der Cimzia-Gruppe und 8.0% der Patienten aus der Placebogruppe, allgemeine Befindlichkeitsstörungen und Probleme an der Injektionsstelle bei 8.8% der Patienten aus der Cimzia-Gruppe und 7.4% der Patienten aus der Placebogruppe, sowie Funktionsstörungen der Haut und des Unterhautzellgewebes bei 7.0% der Patienten aus der Cimzia-Gruppe und 2.4% der Patienten aus der Placebogruppe.
Die häufigsten unerwünschten Ereignisse, die zu einem Absetzen von Cimzia bei Patienten mit Morbus Crohn führten, waren eine Verschlimmerung des Morbus Crohn (2.4% Cimzia, 2.1% Placebo), perianale Abszesse (0.8% Cimzia, 0.3% Placebo), Herpes zoster (0.6% Cimzia, 0% Placebo) und Schmerzen im Unterbauch (0.4% Cimzia, 0.3% Placebo).
Die häufigsten unerwünschten Ereignisse, die zu einem Absetzen von Cimzia bei Patienten mit rheumatoider Arthritis (0.3% Cimzia, 0.6% Placebo) führten, waren Tuberkulose-Infektionen (0.3% Cimzia, 0% Placebo), Pneumonie, Hautauschlag, Urtikaria und Pyrexie (alle 0.2% Cimzia, 0% Placebo).
Psoriatische Arthritis
Cimzia wurde in einer placebokontrollierten klinischen Studie (PsA001) an 409 Patienten mit aktiver psoriatischer Arthritis untersucht. Das Sicherheitsprofil für Cimzia bei Patienten mit psoriatischer Arthritis stand im Einklang mit dem Sicherheitsprofil bei rheumatoider Arthritis und der früheren Erfahrung mit Cimzia.
Axiale Spondyloarthritis
Cimzia wurde in einer placebokontrollierten klinischen Studie (AS001) an 325 Patienten mit axialer Spondyloarthritis untersucht. Das Sicherheitsprofil für Cimzia bei Patienten mit axialer Spondyloarthritis stand im Einklang mit dem Sicherheitsprofil bei rheumatoider Arthritis und der früheren Erfahrung mit Cimzia.
Unerwünschte Arzneimittelwirkungen, die bei mit Cimzia behandelten Patienten häufiger auftraten als bei Patienten mit Placebo, sind nachstehend aufgeführt.
Nachstehend sind innerhalb der Organsystemklassen die unerwünschten Wirkungen, bei denen ein ursächlicher Zusammenhang mit Cimzia zumindest «möglich» ist, mit deren Häufigkeit aufgeführt (d.h. Anzahl der Patienten, bei denen diese Reaktion zu erwarten ist) unter Verwendung der folgenden Kategorien:
sehr häufig: >10%; häufig: >1-10%; gelegentlich: >0.1-1%; selten: >0.01-0.1%; sehr selten; <0.01%). Innerhalb jeder Häufigkeitsgruppe werden die unerwünschten Wirkungen in der Reihenfolge abnehmender Häufigkeit aufgeführt.
Infektionen und parasitäre Erkrankungen
Häufig: Bakterielle Infektionen (einschliesslich Tuberkulose (auch miliare, disseminierte und extrapulmonale) und Abszesse); virale Infektionen (einschliesslich Herpes, Papillomavirus und Influenza).
Gelegentlich: Pilz-Infektionen (einschliesslich Pneumozytose, Histoplasmose, Candidose), Sepsis (einschliesslich Multiorganversagen).
Neoplasmen (gut-, bösartige und unspezifische (einschliesslich Cysten und Polypen)
Gelegentlich: Solide Organtumore, gastrointestinale Tumore (inkl. Rektalkrebs, Dünndarmkrebs), benigne Tumore und Zysten (einschliesslich Hautpapillome).
Selten: Präkanzeröse Läsionen (einschliesslich Leukoplakia oris, melanozytärer Naevus), Hämatologische und Lymphsystem-Malignome, nicht-Melanom-Hautkrebs (incl. Basalzellkarzinom), Melanome.
Unbekannt: Merkelzellkarzinom, hepatosplenischen T-Zell-Lymphome.
Blut- und Lymphsystem
Häufig: Leukopenie (einschliesslich Lymphopenie, Neutropenie), eosinophile Störungen.
Gelegentlich: Anämie, Thrombopenie, Leukozytosen, Lymphadenopathie (incl. Lymphadenitis), Thrombozytosen.
Selten: Panzytopenie, Splenomegalie, anormale weisse Blutzellenmorphologie.
Immunsystem
Gelegentlich: Lupus erythematodes, Vaskulitiden, Arzneimittelüberempfindlichkeit, anaphylaktische Reaktion, Neuauftreten oder Verschlechterung einer Psoriasis (einschliesslich palmoplantare pustuläre Psoriasis) und verwandte Erkrankungen, allergische Störungen (einschl. multiple Allergien), Autoantikörper-Positivität.
Selten: Serumkrankheit, Sarkoidose, Raynaud-Syndrom, angioneurotisches Ödem, Panniculitis (inkl. Erythema nodosum).
Endokrine Störungen
Selten: Schilddrüsenerkrankungen.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Elektrolytstörungen (inklusive Hypokalzämie, Hyperkalzämie, Hypokaliämie, Hyponatriämie, Hypernatriämie), Dyslipidämie, Appetitanomalien (einschliesslich Anorexie), Gewichtsveränderungen.
Selten: Hypalbuminämie, Hypoproteinämie, Hyperurikämie, veränderte Blutglukosewerte, Hämosiderose.
Psychiatrische Störungen
Gelegentlich: Angst und Stimmungsschwankungen (einschliesslich assoziierte Symptome).
Selten: Suizidversuch, Delirium, Halluzinationen, Aggression, emotionale Störungen.
Erkrankungen des Nervensystems
Häufig: Sensorische Störungen (inkl. Parästhesie), Kopfschmerzen (einschliesslich Migräne).
Gelegentlich: Tremor, periphere Neuropathie, Schwindel.
Selten: Ageusie, Amnesie, Anfälle (einschliesslich Grand Mal), Schlafstörungen, Demyelinisierungsstörungen (einschliesslich Hirnnerven-Neuritis, extrapyramidale Störungen, multiple Sklerose), Trigeminusneuralgie, Aphasie, mentale Beeinträchtigung, Areflexie, Koordinations-/Gleichgewichtsstörung, Radikulopathie.
Augen
Gelegentlich: Sehstörung (einschl. Sehschwäche), Störungen der Tränensekretion (einschliesslich trockene Augen, tränende Augen), Entzündungen der Augen und der Augenlider, Konjunktivitis, Augen-Pruritus.
Selten: Optikusneuritis, Glaukom, Augenschmerzen, konjunktivale Hämorrhagie.
Erkrankungen des Ohrs und Innenohrs
Gelegentlich: Tinnitus, Schwindel, Ohrenschmerzen.
Selten: Hörverlust.
Herzerkrankungen
Gelegentlich: Ischämische Koronararterienerkrankung (einschliesslich Myokardinfarkt, Angina pectoris), Arrhythmien (einschliesslich Vorhofflimmern), Tachykardie, Palpitationen.
Selten: plötzlicher Herztod, Kardiomyopathien (einschl. Herzinsuffizienz, Herzversagen), Perikarditis, AV-Block.
Gefässerkrankungen
Gelegentlich: Hitzewallungen, Hypotonie, Hypertonie, Hämorrhagie oder Blutungen (beliebiger Bereich), Hyperkoagulabilität (einschliesslich Lungenembolie, Thromophlebitis), Synkope (einschliesslich Bewusstseinsverlust), Ödeme (einschliesslich peripher, fazial), Ekchymose (einschliesslich Hämatome, Petechien).
Selten: venöse Fehlbildung, Arteriosklerose, Phlebitis, Schock, Schlaganfall, Apoplexie, Livedo reticularis, Teleangiektasie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Pleuraerguss (und assoziierte Symptome), Entzündung und Schwellung der Atemwege, Asthma und assoziierte Symptome, chronisch-obstruktive Lungenerkrankung, Dyspnoe, Husten.
Selten: Interstitielle Lungenerkrankungen (inkl. Pneumonitis), nasale Ulcera.
Gastrointestinale Störungen
Häufig: Übelkeit und Erbrechen.
Gelegentlich: Anzeichen und Symptome (einschliesslich Stenose) von Morbus Crohn, Gastrointestinale Ulzeration und Perforation, (aphtöse) Stomatitis, Blähungen, Dyspepsie, Entzündungen des Verdauungstraktes (beliebige Stelle), oropharyngeale Trockenheit.
Selten: Ascites, Darmverschluss, orale Parästhesie, Hypermotilität, Hämorrhoiden, Analfissuren, Schluckschmerzen.
Leber- und Gallenerkrankungen
Häufig: Hepatitis (Erhöhte Leberenzymwerte).
Gelegentlich: erhöhte Blut-Bilirubinwerte, Hepatopathien (einschliesslich Zirrhose), Cholestase.
Selten: Gallenblasenerkrankungen (einschl. Cholelithiasis, Cholezystitis).
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Haarausfall, Dermatitis und Ekzem (auch generalisierte), Schweissdrüsenerkrankungen, trockene Haut, Hyperhidrose, Urtikaria (auch generalisierte), Akne, Photosensitivität, Nagel und Nagelbettanomalien.
Selten: Abschuppung/Abschilferung der Haut, bullöse Erkrankungen, Hautulcera, Pityriasis rosea, schmerzempfindliche Haut, Hautverfärbung, Akute febrile neutrophile Dermatose, Rosacea.
Haarstrukturanomalien Skelettmuskulatur-, Bindegewebe- und Knochenerkrankungen
Häufig: Schmerzen des Bewegungsapparats, Anzeichen und Symptome von Rheumatoide Arthritis.
Gelegentlich: Schmerzen in den Extremitäten, erhöhte Blutwerte der Kreatinphosphokinase, Arthralgie, Muskelstörungen (einschliesslich Muskelspasmen, Myalgie, erhöhter Muskeltonus).
Selten: Geringe Knochenmasse, Osteochondrose, Dupuytren'sche Kontraktur.
Nieren und Harnwegserkrankungen
Gelegentlich: Nierenfunktionsstörung, Nephrolithiasis, Hämaturie, Harnblasen- und Harnröhrensymptome, Abweichende Urinanalysewerte (ausgenommen Hämaturie).
Selten: Nephropathie (einschl. Nephritis).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Störungen des Menstruationszyklus und Uterusblutungen (einschliesslich Amenorrhoe), Beckenschmerzen, Brusterkrankungen.
Selten: Spontanabort, sexuelle Funktionsstörung (einschl. verminderte Libido), Azoospermie, Balanitis, vaginaler Ausfluss.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fieber, Schmerz (beliebige Lokalisation), Asthenie, Pruritus (beliebige Stelle), Reaktionen an der Injektionsstelle (einschl. Schmerz, Quetschung, Hämatom, Rötung, Ödeme, Irritationen, Verfärbungen, Nekrosen, Phlebitis, Ulzera), Erschöpfung.
Gelegentlich: Schüttelfrost, Unwohlsein, grippeähnliche Erkrankungen, Nachtschweiss, Fisteln (beliebige Stelle), veränderte Temperaturwahrnehmung (inkl. Kältegefühl).
Untersuchungen
Gelegentlich: Erhöhte Blutwerte der alkalischen Phosphatase, Verlängerte Gerinnungszeit.
Selten: Harnsäure erhöht.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Fraktur, Hautverletzungen, Wundheilstörung.
In klinischen Studien sind in seltenen Fällen Verletzungen und Erstickungsanfälle aufgetreten.
Beschreibung von ausgewählten unerwünschten Wirkungen
Infektionen
Die Inzidenz von Infektionen in kontrollierten klinischen Studien zu Morbus Crohn betrug bei den mit Cimzia behandelten Patienten 35.8% und bei den mit Placebo behandelten Patienten 30.5%. Bei diesen Infektionen handelte es sich in erster Linie um Nasopharyngitis (8.9% Cimzia, 7.7% Placebo), Harnwegsinfekte (4.8% Cimzia, 5.2% Placebo), Infektionen der oberen Atemwege (4.0% Cimzia, 2.3% Placebo) und Influenza (3.1% Cimzia, 4.5% Placebo). Die Inzidenz von gastrointestinalen Abszessen betrug bei Cimzia 3.8% und bei Placebo 1.2%. In placebokontrollierten klinischen Studien betrug die Infektionsrate bei den mit Cimzia behandelten Patienten 1'053 pro Patientenjahr und bei den Patienten aus der Pacebogruppe 1'065 pro Patientenjahr.
Die Inzidenzrate neuer Fälle von Infektionen in placebokontrollierten Studien zur rheumatoiden Arthritis betrug 1.03 pro Patientenjahr für sämtliche mit Cimzia behandelten Patienten und 0.92 pro Patientenjahr für sämtliche Patienten aus der Placebogruppe. Bei den Infektionen handelte es sich vor allem um Infektionen der oberen Atemwege, Herpesinfektionen, Harnwegsinfektionen und Infektionen der unteren Atemwege.
In den placebokontrollierten Studien zur rheumatoiden Arthritis wurden in der Cimzia-Gruppe mehr schwere Infektionen beobachtet als in der Placebogruppe (0.7 pro Patientenjahr für sämtliche Dosierungen von Cimzia im Vergleich zu 0.02 pro Patientenjahr für Placebo).
Der Anteil der schweren Infektionen betrug 0.07 pro Patientenjahr in der Dosierungsgruppe mit 200 mg alle 2 Wochen und 0.05 pro Patientenjahr in der Dosierungsgruppe mit 400 mg alle 4 Wochen.
Zu den am häufigsten auftretenden schweren Infektionen zählten Pneumonien und Tuberkulose. Ausserdem waren auch invasive opportunistische Infektionen (d.h. Pneumocystis, Nocardia, Histoplasmose und disseminierter Herpes zoster) gehäuft. Es gibt keinen Hinweis auf ein erhöhtes Infektionsrisiko bei kontinuierlicher Exposition über längere Zeit (vgl. Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Maligne Tumore und Merkelzellkarzinom
In klinischen Studien zu Morbus Crohn betrug die Gesamtinzidenz aller Malignen Tumore bei den mit Cimzia behandelten Patienten 0.5% und bei den Patienten aus der Placebogruppe 0.5%. Der einzige Fall eines Lymphoms trat bei einem mit Placebo behandelten Patienten auf. Die Inzidenzrate für das erste Auftreten aller Malignen Tumore einschliesslich Lymphome (jeweils pro 10'000 Patiententage) in der Population, an der die Sicherheit bei Morbus Crohn untersucht wurde, betrug 0.54 für Placebo (N=426) gegenüber 0.24 für Cimzia 400 mg (N=1'350) und 0.22 für Cimzia in beliebiger Dosierung (N=1'564). Darüber hinaus wurde mehr als 10 Monate nach der zweiten und letzten Cimzia-Dosis ein metastasierendes Lungenkarzinom festgestellt.
Die Inzidenzrate für das erste Auftreten (jeweils pro 10'000 Patiententage) aller Ereignisse der Organsystemklasse «Neoplasmen, gut- und bösartige (einschliesslich Zysten und Polypen)» in der Population mit rheumatoider Arthritis betrug 0.26 für Placebo (N=323) gegenüber 0.76 für Cimzia 400 mg (N=337) und 1.24 für Cimzia in beliebiger Dosierung (N=605).
Zu den in den placebokontrollierten und offenen Studien zur rheumatoiden Arthritis beobachteten malignen Tumoren zählten Mamma-Carcinom und Ovarialcarcinom, Basaliom und Lymphom. In den Studien zur rheumatoiden Arthritis traten in der Cimzia-Gruppe Fälle von Lymphomen mit einer Inzidenzrate von 0.05 pro 100 Patientenjahre auf und Fälle von Melanomen mit einer Inzidenzrate von 0.08 pro 100 Patientenjahre. Die Anzahl der angegebenen Fälle ist zu gering, um eine Auswirkung der Behandlung zu erkennen (vgl. Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
In einem Fall trat ein Lymphom ausserdem in der klinischen Studie der Phase III bei psoriatischer Arthritis auf.
Bei Patienten, die mit TNF-Antagonisten einschliesslich Cimzia behandelt wurden, wurden Fälle von Merkelzellkarzinom in der Post-Marketing-Phase beobachtet.
Bei Patienten, die eine Behandlung mit Anti-TNF-Präparaten erhielten, wurden Postmarketing-Fälle vom hepatosplenalen T-cell Lymphoma (HSTCl), einem seltenen Typ von T-cell Lymphoma mit einem sehr aggressiven und meist fatalen Krankheitsverlauf, berichtet. Die Mehrheit der gemeldeten TNF-Antagonisten-Fälle traten in Jugendlichen und jungen Männern mit Morbus Crohn oder Colitis ulcerosa auf. Fast alle Patienten sind vor oder zum Zeitpunkt der Diagnose mit den Immunosuppressiva Azathioprin und/oder 6-Mercaptopurin zusammen mit einem TNF-Antagonist behandelt worden.
Kongestive Herzinsuffizienz
Über neun Fällen von dekompensierter Herzinsuffizienz unter Cimzia (0.1 pro 100 Patientenjahren) wurden in placebokontrollierten- und «open-label» klinischen Studie in Patienten mit rheumatoider Arthritis berichtet.
Antikörper gegen Certolizumab pegol
In klinischen Studien wurden bei rund 4-14% der Patienten Antikörper gegen Cimzia detektiert, einschliesslich neutralisierender Antikörper. Antikörper gegen Cimzia sind mit niedrigeren Wirkstoff-Plasmakonzentrationen assoziiert. Bei einem Teil der Antikörper-positiven Patienten ist die Wirksamkeit entsprechend geringer.
Der Gesamtanteil antikörperpositiver Patienten aus den Morbus-Crohn-Studien war gering (7.9% bei Patienten mit ständiger Exposition gegenüber Cimzia und ca. 6%, bei denen in vitro eine Neutralisation zu erkennen war). Patienten, die begleitend mit Immunsuppressiva behandelt wurden, entwickelten weniger Antikörper als Patienten, die ab Aufnahme in die Studie keine Immunsuppressiva erhielten (3.3% im Vergleich zu 11.1%).
Der Gesamtanteil von Patienten mit Antikörpern gegen Cimzia, die in mindestens einem Fall in placebokontrollierten RA-Studien gefunden wurden, war gering (9.6%; etwa ein Drittel der antikörperpositiven Patienten hatten Antikörper, die in vitro neutralisierend wirkten). Patienten, die begleitend mit Immunsuppressiva (MTX) behandelt wurden, entwickelten weniger Antikörper als Patienten, die ab Aufnahme in die Studie keine Immunsuppressiva einnahmen.
Der Gesamtanteil von Patienten mit Antikörpern gegen Cimzia, die in Phase III bis zu Woche 24 in placebokontrollierten Studien in mindestens einem Fall bei Patienten mit Psoriasis-Arthritis nachgewiesen wurden, betrug 11.7%. Bei Patienten mit Psoriasis-Arthritis stieg der Anteil der Patienten, die positiv mit Antikörpern auf Cimzia reagierten, zwischen Woche 24 und Woche 48 von 11.7% auf 13.6%.
Der Gesamtanteil von Patienten mit Antikörpern gegen Cimzia, die in Phase III bis zu Woche 24 in placebokontrollierten Studien in mindestens einem Fall bei Patienten mit axialer Spondyloarthritis nachgewiesen wurden, betrug 4.4%.
In klinischen Studien zu Morbus Crohn und RA wiesen Patienten mit Antikörpern gegen Certolizumab pegol geringere Plasmakonzentrationen von Certolizumab pegol als Patienten ohne Antikörper auf und bei einigen RA-Patienten eine verringerte Wirksamkeit. Bei Studien zu Morbus Crohn wurde über Antikörper-positive Patienten (N=100) berichtet, dass bei ihnen folgende unerwünschte Ereignisse um mindestens 3% häufiger als bei Antikörper-negativen Patienten (N=1'242) auftraten: Schmerzen im Unterbauch, Gelenkschmerzen, peripheres Ödem, Erythema nodosum, Erythem an der Injektionsstelle, Schmerzen an der Injektionsstelle, Gliederschmerzen und Infektionen der unteren Atemwege.
In der klinischen Studie zu PsA und AxSpA war die Zahl der Patienten mit Antikörpern gegen Cimzia zu gering für eine zuverlässige Bewertung der Auswirkung auf die Wirksamkeit.
Autoantikörper
In klinischen Studien zu Morbus Crohn ergaben sich bei 3.7% der mit Cimzia behandelten Patienten bzw. bei 1.7% der Patienten aus der Placebogruppe, die negative Baseline-ANA-Titer aufwiesen, im Verlauf der Studien positive Titer. Die entsprechenden Werte für Anti-dsDNA betrugen 1.2% für die mit Cimzia behandelten Patienten bzw. 1.8% für Patienten aus der Placebogruppe.
Von den Teilnehmern in der Zulassungsstudie (pivotal study) zur rheumatoiden Arthritis mit negativem ANA bei Ausgangslage entwickelten 16.7% der mit Cimzia behandelten Patienten positive ANA-Titer im Vergleich mit 12.0% der Teilnehmer in der Placebogruppe. Von den Teilnehmern, die bei Ausgangslage anti-dsDNS-Antikörper negativ waren, traten bei 2.2% der Cimzia-Patienten positive anti-dsDNS-Antikörper-Titer im Vergleich zu einem Wert von 1.0% bei den Placebopatienten auf. Sowohl in den plazebokontrollierten als auch den offenen klinischen Nachbeobachtungsstudien zu rheumatoider Arthritis wurden gelegentlich Fälle des lupusähnlichen Syndroms beschrieben. Andere immunvermittelte Erkrankungen wurden selten gemeldet; der Kausalzusammenhang mit Cimzia ist nicht bekannt. Der Einfluss einer langfristigen Behandlung mit Cimzia auf die Entwicklung von Autoimmunkrankheiten ist nicht bekannt.
Reaktionen an der Injektionstelle
In den placebokontrollierten Studien zur rheumatoiden Arthritis kam es bei 5.8% der mit Cimzia behandelten Patienten zu Reaktionen an der Injektionstelle (Erythem, Jucken, Hämatom, Schmerzen, Schwellung oder blaue Flecken) im Vergleich zu 4.8% der Patienten in der Placebogruppe. Über Schmerzen an der Injektionsstelle wurden in den Placebo-kontrollierten Studien zur rheumatoiden Arthritis bei 1.5% der mit Cimzia behandelten Patienten berichtet, ohne dass dies zu einem Studienabbruch geführt hätte.
ÜberdosierungEs wurde kein Fall von Überdosierung bekannt.
Die maximale verträgliche Dosis von Certolizumab pegol wurde nicht ermittelt. In klinischen Studien wurde keine dosislimitierende Toxizität beobachtet. Dabei wurden mehrfache Dosen von bis zu 800 mg (s.c.) bzw. 20 mg/kg (i.v.) verabreicht und gut vertragen. Im Falle einer Überdosierung empfiehlt sich eine engmaschige Überwachung der Patienten auf eventuelle unerwünschte Reaktionen oder Wirkungen, sowie die sofortige Einleitung einer entsprechenden symptomatischen Behandlung.
Eigenschaften/WirkungenATC-Code: L04AB05
Certolizumab pegol ist ein Fab'-Fragment eines rekombinanten, humanisierten Antikörpers. Das Fab'-Fragment wird in Escherichia coli gebildet und dann gereinigt und an Polyethylenglykol (PEG) konjugiert.
Wirkungsmechanismus:
Certolizumab pegol besitzt eine hohe Affinität zu humanem TNF-α mit einem KD-Wert von 90 pM. TNF-α ist ein wichtiges proinflammatorisches Zytokin, das bei Entzündungsprozessen eine entscheidende Rolle spielt. Certolizumab pegol besitzt eine selektive neutralisierende Wirkung auf TNF-α (IC90 von 4 ng/ml bei der Hemmung des humanen TNF-α in einem in vitro L929 murinen Fibrosarcoma-Zytotoxizitätsassay), neutralisiert aber Lymphotoxin-α (TNF-β) nicht.
Certolizumab pegol besitzt nachweislich eine Dosis-abhängige neutralisierende Wirkung auf membranassoziiertes und lösliches humanes TNF. Die Inkubation von Monozyten mit Certolizumab pegol führte zu einer Dosis-abhängigen Hemmung von LPS-induziertem TNF-α sowie zur Bildung von IL-1β in humanen Monozyten.
Certolizumab pegol besitzt keine Fc-Region («fragment crystallizable»), wie sie in einem vollständigen Antikörper normalerweise vorhanden ist; es bindet deshalb kein Komplement und verursacht keine Antikörper-abhängige, zellvermittelte Zytotoxizität. Es führt in-vitro nicht zur Apoptose in humanen, peripheren, aus dem Blut gewonnenen Monozyten oder Lymphozyten oder zu einer Degranulation von Neutrophilen.
Klinische Wirksamkeit:
Morbus Crohn
Die Untersuchung der Wirksamkeit und Sicherheit von Cimzia erfolgte im Rahmen zweier randomisierter, placebokontrollierter Doppelblind-Studien an Patienten im Alter von ≥18 Jahren mit aktivem, mässigem bis schwerem Morbus Crohn, d.h. mit einem Crohn's Disease Activity Index (CDAI) von 220-450 (jeweils einschliesslich). Cimzia wurde in beiden Studien bei einer Dosierung von 400 mg subkutan verabreicht. Dabei war eine stabile Begleitmedikation gegen Morbus Crohn erlaubt.
Studie I
Bei der Studie I (PRECiSE 1) handelte es sich um eine randomisierte, placebokontrollierte Studie an 662 Patienten mit aktivem Morbus Crohn. Cimzia bzw. Placebo wurde in den Wochen 0, 2 und 4, danach alle 4 Wochen bis zur Woche 24 verabreicht. Das klinische Ansprechen (Response) definierte sich als eine Abnahme des CDAI-Werts um mindestens 100 Punkte, eine klinische Remission als absoluter CDAI-Wert von 150 oder weniger. Drei Patienten wurden von der Intent-to-treat- (ITT-) Analyse ausgeschlossen; bei zwei für Cimzia randomisierten Patienten erfolgte keine Dosierung; ein für Placebo randomisierter Patient wurde ausgeschlossen.
Die Ergebnisse in Bezug auf das klinische Ansprechen (Response) sind in Tabelle 1 dargestellt. Der Wirkungseintritt von Cimzia erfolgte in Woche 2. In Woche 6 war die Anzahl der Responder im Vergleich zu Placebo klinisch signifikant; d.h. ein klinisches Ansprechen wurde erzielt. Weiterhin war die Anzahl der Responder sowohl in Woche 6 als auch in Woche 26 klinisch signifikant, was ein anhaltendes Ansprechen zeigte.
Tabelle 1: PRECiSE 1 – Klinisches Ansprechen; gesamte Studienpopulation
|
Zeitpunkt
|
Anzahl (%) der Responder
95%CI
| |
Placebo
(N=328)
|
Cimzia 400 mg
(N=331)
| |
Woche 2
| |
N
|
326
|
328
| |
Responder
|
46 (14.1%)
|
82 (25.0%)§
| |
95%CI
|
10.3%, 17.9%
|
20.3%, 29.7%
| |
Woche 6 (Induktion)
| |
N
|
325
|
327
| |
Responder
|
87 (26.8%)
|
115 (35.2%)*
| |
95%CI
|
22.0%, 31.6%
|
30.0%, 40.3%
| |
Woche 26
| |
N
|
327
|
328
| |
Responder
|
87 (26.6%)
|
122 (37.2%)*
| |
95%CI
|
21.8%, 31.4%
|
32.0%, 42.4%
| |
Wochen 6&26 (anhaltendes Ansprechen)
| |
N
|
325
|
325
| |
Responder
|
52 (16.0%)
|
75 (23.1%)*
| |
95%CI
|
12.0%, 20.0%
|
18.5%, 27.7%
|
§ p-Wert nicht berechnet
* p-value <0.05 logistischer Regressionstest
Die Anwendung von Immunsuppressiva oder Kortikosteroiden zum Baseline-Zeitpunkt hatte keine Auswirkungen auf das klinische Ansprechen auf Cimzia. Cimzia war wirksam in Bezug auf die Induktion und Aufrechterhaltung des Ansprechens in der Subpopulation der mit Infliximab vorbehandelten Patienten (Woche 6: 24.5% vs 20.0%; Wochen 6 und 26: 15.5% vs 10.6% für Cimzia bzw. Placebo).
Cimzia war wirksam in Bezug auf die Induktion und Aufrechterhaltung des Ansprechens in der Subpopulation der nicht mit Infliximab vorbehandelten Patienten (Woche 6: 39.7% vs 29.2%; Wochen 6 und 26: 26.3% vs 17.9% für Cimzia bzw. Placebo). Die Auswirkungen von Morbus Crohn auf den Patienten wurden im Verlauf der Studie mittels eines krankheitsspezifischen Fragebogens, des sog. Inflammatory Bowel Disease Questionnaire (IBDQ), sowie eines Fragebogens (SF-36) zum allgemeinen Gesundheitszustand bewertet.
Anhand des IBDQ (Gesamtwert ≥16 Punkte gegenüber Baseline) zeigte in den Wochen 6, 16 und 26 in der mit Cimzia 400 mg behandelten Gruppe ein grösserer Anteil der Patienten eine klinisch bedeutsame Verbesserung in Bezug auf das Behandlungsergebnis als in der Placebogruppe.
Die mit 400 mg Cimzia behandelten Patienten wiesen in Woche 6, bzw. in den Wochen 6 und 26, im Vergleich zur Placebogruppe eine signifikante Schmerzlinderung (p ≤0.05) gegenüber Baseline anhand des körperlichen Schmerzwerts im Fragebogen SF-36 auf.
Studie II:
Bei der Studie II (PRECiSE 2) handelte es sich um eine randomisierte Studie zum Behandlungsabbruch, die an 668 Patienten mit aktivem Morbus Crohn durchgeführt wurde. Alle in die Studie aufgenommenen Patienten erhielten Cimzia 400 mg in den Wochen 0, 2 und 4; die Bewertung des klinischen Ansprechens erfolgte in Woche 6. Das klinische Ansprechen (Response) definierte sich als eine Abnahme des CDAI-Werts um mindestens 100 Punkte, eine klinische Remission als absoluter CDAI-Wert von 150 oder weniger. Die Responder wurden zu einer Erhaltungstherapie mit Cimzia 400 mg oder Placebo alle 4 Wochen (beginnend mit Woche 8) bis zur Woche 24 randomisiert.
Patienten, die in Woche 6 kein Ansprechen zeigten (Non-Responder) wurden aus der Studie ausgeschlossen. Drei Patienten wurden von der ITT-Analyse ausgeschlossen.
Insgesamt 668 Patienten mit aktivem Morbus Crohn erhielten Cimzia 400 mg als Induktionstherapie nach dem Open-label-Prinzip.
Davon sprachen 428 (64.1%) auf die Behandlung an und wurden in Woche 6 für Placebo (212; ITT 210) bzw. Cimzia 400 mg (216; ITT 215) randomisiert; sie erhielten mindestens eine doppelblinde Injektion. Ein Wirkungseintritt zeigte sich in Woche 2.
Von den Respondern in Woche 6 zeigten 45.1% ein klinisches Ansprechen in Woche 2.
Die Ergebnisse in Bezug auf das klinische Ansprechen (Response) bzw. Remission sind in Tabelle 2 dargestellt. In Woche 26 zeigte in der Cimzia-Gruppe ein signifikant höherer Anteil der Woche-6-Responder ein klinisches Ansprechen bzw. eine klinische Remission als in der Gruppe mit 3 Dosierungen Cimzia + Placebo.
Tabelle 2: PRECiSE 2 – Klinisches Ansprechen (Response) und klinische Remission in der Gesamt-Studienpopulation
|
Zeitpunkt
|
Klinisches Ansprechen (Response)
Anzahl (%)
|
Klinische Remission
Anzahl (%)
| |
|
Cimzia 400 mg × 3
+ Placebo*
N=210
|
Cimzia 400 mg
N=215
|
Cimzia 400 mg × 3
+ Placebo*
N=210
|
Cimzia 400 mg
N=215
| |
Woche 26
Anhaltendes Ansprechen
| |
N
|
210
|
215
|
210
|
215
| |
Responder
|
76 (36.2%)
|
135 (62.8%)
|
60 (28.6%)
|
103 (47.9%)
| |
95% CI
|
29.7%, 42.7%
|
56.3%, 69.3%
|
22.5%, 34.7%
|
41.2%, 54.6%
| |
p-Wert
|
|
<0.001
|
|
<0.001
|
* Diese Tabelle bezieht sich ausschliesslich auf den doppelblinden Teil der Studie.
Abbildung 1: PRECiSE 2 – Klinisches Ansprechen im zeitlichen Verlauf; gesamte ITT-Population
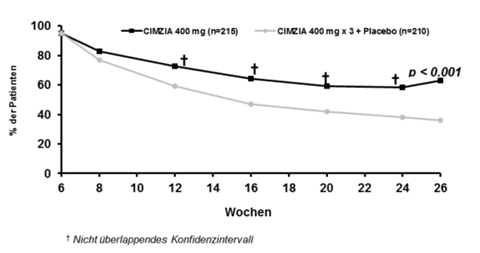
Die Anwendung von Immunsuppressiva oder Kortikosteroiden zum Baseline-Zeitpunkt hatte keine Auswirkungen auf das klinische Ansprechen auf Cimzia. Cimzia war wirksam in Bezug auf die Aufrechterhaltung des Ansprechens bis zur Woche 26 sowohl in der Subpopulation der mit Infliximab vorbehandelten Patienten (44.2% vs 25.5% für Cimzia bzw. Placebo), als auch bei den nicht mit Infliximab vorbehandelten Patienten (68.7% bzw. 39.6%).
Die Auswirkungen von Morbus Crohn auf den Patienten wurden im Verlauf der Studie mittels eines krankheitsspezifischen Fragebogens, des sog. Inflammatory Bowel Disease Questionnaire (IBDQ), sowie eines weiteren Fragebogens (SF-36) zum allgemeinen Gesundheitszustand bewertet.
Anhand des IBDQ (Gesamtwert ≥16 Punkte gegenüber Baseline) zeigte in den Wochen 16 und 26 in der mit Cimzia 400 mg behandelten Gruppe ein grösserer Anteil der Patienten eine klinisch bedeutsame Verbesserung in Bezug auf das Behandlungsergebnis als in der Placebogruppe.
Die mit 400 mg Cimzia behandelten Patienten wiesen in Woche 26 im Vergleich zur Placebogruppe eine signifikante Schmerzlinderung (p ≤0.05) gegenüber Baseline anhand des körperlichen Schmerzwerts im Fragebogen SF-36 auf. Die Ergebnisse in Bezug auf die «körperliche Rollenerfüllung» im Fragebogen waren bei Cimzia besser als bei Placebo; sie waren jedoch nicht statistisch signifikant (p >0.05).
Rheumatoide Arthritis
RA-I, RA-II, RA-III, RA-IV Studien
Die Wirksamkeit und Sicherheit von Cimzia wurden in zwei randomisierten, plazebokontrollierten, doppelblinden klinischen Studien, RA-I (RAPID 1) und RA-II (RAPID 2), bei Patienten ab 18 Jahren mit aktiver rheumatoider Arthritis untersucht. Die Diagnose der Arthritis wurde entsprechend den Kriterien des American College of Rheumatology (ACR) vorgenommen. Jeder Patient hatte mindestens 9 geschwollene und schmerzempfindliche Gelenke und eine aktive RA seit mindestens 6 Monaten vor Studienbeginn. Cimzia wurde in beiden Studien subkutan in Kombination mit MTX p.o. für mindestens 6 Monate verabreicht, wobei MTX in einer stabilen Dosis von mindestens 10 mg pro Woche für zwei Monate gegeben wurde. Es liegen keine Erfahrungen zu Cimzia in Kombination mit anderen DMARDs als MTX vor.
Tabelle 3: Beschreibung der klinischen Studien
|
Studien-Nr.
|
Patientenanzahl
|
Dosisregime
|
Studienziele
| |
RA-I
(52 Wochen)
|
982
|
400 mg (0, 2, 4 Wochen) mit MTX
|
Beurteilung in Bezug auf die Behandlung der Anzeichen und Symptome und Hemmung von Strukturschäden
| |
200 mg oder 400 mg alle 2 Wochen mit MTX
|
Gleichzeitige primäre Endpunkte: ACR 20 nach 24 Wochen und Änderungen gegenüber dem Ausgangswert nach 52 Wochen beim mTSS
| |
RA-II
(24 Wochen)
|
619
|
400 mg (0, 2, 4 Wochen) mit MTX
|
Beurteilung in Bezug auf die Behandlung der Anzeichen und Symptome und Hemmung von Strukturschäden
| |
200 mg oder 400 mg alle 2 Wochen mit MTX
|
Primärer Endpunkt: ACR 20 nach 24 Wochen.
|
mTSS: modified Total Sharp Score
ACR-Ansprechen
Die Ergebnisse der klinischen Studien RA-I und RA-II sind in Tabelle 4 dargestellt. In beiden klinischen Studien wurde im Vergleich zu Placebo ab Woche 1 bzw. 2 ein statistisch signifikant grösseres ACR-20- und ACR-50-Ansprechen erreicht. Das Ansprechen wurde bis Woche 52 (RA-I) und Woche 24 (RA-II) aufrechterhalten. Von den 783 Patienten, die zu Beginn der RA-I zur Verumbehandlung randomisiert wurden, schlossen 508 Patienten 52 Wochen der plazebokontrollierten Behandlung ab und traten in die offene Verlängerungsstudie ein. Von diesen schlossen 427 Patienten 2 Jahre der offenen Nachbeobachtung ab, so dass sich eine Cimzia-Gesamtexposition von insgesamt 148 Wochen ergab. Die beobachtete ACR-20-Ansprechrate zu diesem Zeitpunkt betrug 91%. Die Verminderung (RA-I) des DAS28 (ESR) gegenüber dem Ausgangswert in Woche 52 (RA-I) und Woche 24 (RA-II) war im Vergleich zu Placebo ebenfalls signifikant grösser (p<0.001) und blieb über 2 Jahre in der offenen Verlängerungsstudie zu RA-I erhalten.
Tabelle 4: ACR-Ansprechen in den klinischen Studien RA-I und RA-II
|
|
Studie RA-I
Methotrexat-Kombination
(24 und 52 Wochen)
|
Studie RA-II
Methotrexat-Kombination
(24 Wochen)
| |
Ansprechen
|
Placebo
+ MTX
N=199
|
Cimzia 200 mg
+ MTX alle 2 Wochen
N=393
|
Placebo
+ MTX
N=127
|
Cimzia 200 mg
+ MTX alle 2 Wochen
N=246
| |
ACR 20
| |
Woche 24
|
14%
|
59%**
|
9%
|
57%**
| |
Woche 52
|
13%
|
53%**
|
k. A.
|
k. A.
| |
ACR 50
| |
Woche 24
|
8%
|
37%**
|
3%
|
33%**
| |
Woche 52
|
8%
|
38%**
|
k. A.
|
k. A.
| |
ACR 70
| |
Woche 24
|
3%
|
21%**
|
1%
|
16%*
| |
Woche 52
|
4%
|
21%**
|
k. A.
|
k. A.
| |
Wesentliches klinisches Ansprechena
|
1%
|
13%**
|
|
|
Cimzia vs. Placebo: * p≤0.01, ** p<0.001
a Ein wesentliches klinisches Ansprechen ist definiert als das Erreichen des ACR-70-Ansprechens bei allen Untersuchungen über einen kontinuierlichen Zeitraum von 6 Monaten
Wald-p-Werte werden für den Vergleich zwischen den Behandlungen unter Anwendung der logistischen Regression mit Faktoren für Behandlung und Region angegeben.
Grundlage des prozentualen Ansprechens ist die Zahl der Teilnehmer, die bis zu jenem Endpunkt und Zeitpunkt, der von N verschieden sein kann, Daten (n) liefern.
Radiologisches Ansprechen
In der Studie RA-I wurde der strukturelle Gelenkschaden im Röntgenbild beurteilt und als Veränderung im mTSS und seinen Komponenten, des Erosion Scores und des Gelenkspaltverschmälerung Scores (JSN von Joint Space Narrowing) nach 52 Wochen im Vergleich zum Ausgangswert beurteilt. Patienten unter Cimzia wiesen in Woche 24 und Woche 52 eine signifikant geringere radiologische Progredienz auf als Patienten, die Placebo erhielten (siehe Tabelle 5). In der Placebogruppe wurde nach 52 Wochen bei 52% der Patienten keine Progredienz im Röntgenbild entdeckt (mTSS ≤0.0) im Vergleich zu 69% in der Behandlungsgruppe mit Cimzia 200 mg.
Tabelle 5: Änderungen über 12 Monate in RA-I
|
|
Placebo + MTX
N=199
Mittelwert (SD)
|
Cimzia 200 mg + MTX
N=393
Mittelwert (SD)
|
Cimzia 200 mg + MTX –
Placebo + MTX
mittlerer Unterschied
| |
mTSS
| |
Woche 52
|
2.8 (7.8)
|
0.4 (5.7)
|
-2.4
| |
Erosion Score
| |
Woche 52
|
1.5 (4.3)
|
0.1 (2.5)
|
-1.4
| |
JSN Score
| |
Woche 52
|
1.4 (5.0)
|
0.4 (4.2)
|
-1.0
|
Die p-Werte betrugen <0.001 sowohl für mTSS and den Erosion Score und ≤0.01 für den JSN Score. Eine Kovarianzanalyse (ANCOVA) wurde an die gewichtete Änderung gegenüber der Ausgangslage für jeden Parameter mit Region und Behandlung als Faktoren und Ausgangsrang als eine Kovariate
Von den 783 Patienten, die zu Beginn der RA-I zur Verumbehandlung randomisiert wurden, schlossen 508 Patienten 52 Wochen der plazebokontrollierten Behandlung ab und traten in die offene Verlängerungsstudie ein. Eine andauernde Hemmung der Progredienz der strukturellen Schädigung wurde in einer Subgruppe von 449 dieser Patienten nachgewiesen, die mindestens 2 Jahre lang mit Cimzia behandelt wurden (RA-I und offene Verlängerungsstudie) und von denen zum 2-Jahres-Zeitpunkt auswertbare Daten vorlagen.
Lebensqualität und körperliche Funktionsfähigkeit
In RA-I und RA-II zeigten die Cimzia-Patienten von Woche 1 bis zum Ende der Studien signifikante Verbesserungen im Vergleich zu Placebo (p<0.001) bei der körperlichen Leistung, bewertet anhand des «Health Assessment Questionnaire – Disability Index» (HAQ-DI) Fragebogens, und der Abgeschlagenheit, bewertet anhand der «Fatigue Assessment Scale» (FAS). In beiden klinischen Studien berichteten die Patienten der Cimzia-Gruppe über signifikant grössere Verbesserungen in den SF-36 «Physical and Mental Component Summaries» und allen Domain-Punktwerten. Verbesserungen der körperlichen Leistung und der HRQoL wurden über 2 Jahre in der offenen Verlängerungsstudie von RA-I aufrechterhalten. Mit Cimzia behandelte Patienten zeigten im «Work Productivity Survey» statistisch signifikante Verbesserungen im Vergleich zu Placebo.
Axiale Spondyloarthritis
Die Wirksamkeit und Sicherheit von Cimzia wurden im Rahmen einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AS001) untersucht. Sie umfasste 325 Patienten ≥18 Jahren mit im Erwachsenenalter einsetzender, aktiver axialer Spondyloarthritis seit mindestens drei Monaten, gemäss den Klassifizierungskriterien für axiale Spondyloarthritis der Assessment of Spondyloarthritis International Society (ASAS). Axiale Spondyloarthritis bezeichnet eine Spondyloarthritis mit vorrangig axialer Beteiligung und umfasst die Krankheitssubgruppe ankylosierende Spondylitis sowie die Krankheitssubgruppe mit keinem definitiven Nachweis einer Sakroiliitis in Röntgenleeraufnahmen, bezeichnet als nicht-röntgenologische axiale Spondyloarthritis. Die Studienpopulation mit axialer Spondyloarthritis umfasste sowohl Subpopulationen mit ankylosierender Spondylitis als auch mit nicht-röntgenologischer axialer Spondyloarthritis. Die Patienten zeigten eine aktive Erkrankung, welche definiert wurde durch einen Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) ≥4, Schmerzen der Wirbelsäule ≥4 auf einer numerischen Bewertungsskala (NRS) von 0 bis 10 und erhöhtes CRP oder aktueller Nachweis einer Sakroiliitis mittels Magnetresonanztomographie (MRT). Ausserdem mussten sie gegen mindestens ein NSAID eine Intoleranz oder ein unzureichendes Ansprechen gezeigt haben.
Insgesamt wurden 16% der Patienten zuvor mit einem TNF-Antagonisten behandelt. Die Patienten erhielten eine Initialdosis Cimzia von 400 mg in den Wochen 0, 2 und 4 (für beide Behandlungsarme) oder Placebo gefolgt von entweder 200 mg Cimzia alle zwei Wochen oder 400 mg Cimzia alle vier Wochen oder Placebo. 87.7% der Patienten erhielten begleitend NSAIDs. Der primäre Wirksamkeitsendpunkt war die ASAS20-Ansprechrate in Woche zwölf. 153 Patienten nahmen an einer Bildgebungssubstudie teil.
CRP ist ein sensitiver Marker für Entzündungen und könnte aus anderen Gründen als nicht-röntgenologische axiale Spondyloarthritis erhöht sein. Bei Patienten mit schwerer aktiver nicht-röntgenologischer axialer Spondyloarthritis ohne einen definitiven Beweis von Sakroiliitis auf Röntgenaufnahmen sollte daher ein erhöhter CRP-Wert mit Nachweis einer Sakroiliitis in den SI-Gelenken mittels MRT unterstützt werden.
ASAS -Ansprechen
In der klinischen Studie AS001 erreichten in Woche zwölf 58% der Patienten unter 200 mg Cimzia alle zwei Wochen und 64% der Patienten unter 400 mg Cimzia alle vier Wochen ein ASAS20-Ansprechen, im Vergleich zu 38% unter Placebo (p <0.01).
In der Gesamtpopulation war der Anteil der ASAS20-Responder bei jeder Untersuchung nach Baseline bis Woche 24 klinisch relevant und signifikant höher in der Behandlungsgruppen mit 200 mg Cimzia alle zwei Wochen und 400 mg Cimzia alle vier Wochen als in der Placepogruppe (p≤0.001 bei jeder Untersuchung).
In den Subpopulationen ankylosierende Spondylitis und nicht-röntgenologische axiale Spondyloarthritis wurden ähnliche Ergebnisse erreicht (siehe Tabelle 6).
Die mit Cimzia behandelten Patienten zeigten im Vergleich zu Patienten unter Placebo ausserdem signifikante Verbesserungen bei mehreren Komponenten der Krankheitsaktivität der axialen Spondyloarthritis [Schmerzen (Gesamtschmerzen der Wirbelsäule), Funktionsfähigkeit (BASFI), Entzündung (BASDAI Mittelwert aus Q5/6), Nächtliche Schmerzen der Wirbelsäule, Müdigkeit, BASMI].
Tabelle 6: Wirksames Ansprechen in der klinischen Studie AS001: Reduktion der Anzeichen und Symptome bei den Subpopulationen mit ankylosierender Spondylitis und nicht-röntgenologischer axialer Spondyloarthritis (Prozent der Patienten)
|
Parameter
|
Ankylosierende Spondylitis
|
Nicht-röntgenologische axiale
Spondyloarthritits
| |
|
Placebo
N=57
|
Cimzia - alle
Dosisregime(a)
N=121
|
Placebo
N=50
|
Cimzia - alle
Dosisregime(a)
N=97
| |
ASAS20(b,c)
| |
Woche 12
|
37%
|
60%*
|
40%
|
61%*
| |
Woche 24
|
33%
|
69%**
|
24%
|
68%**
| |
ASAS40(c,d)
| |
Woche 12
|
19%
|
45%**
|
16%
|
47%**
| |
Woche 24
|
16%
|
53%**
|
14%
|
51%**
| |
ASAS 5/6(c,d)
| |
Woche 12
|
9%
|
42%**
|
8%
|
44%**
| |
Woche 24
|
5%
|
40%**
|
4%
|
45%**
| |
Partielle Rremission(c,d)
| |
Woche 12
|
2%
|
20%**
|
6%
|
29%**
| |
Woche 24
|
7%
|
28%**
|
10%
|
33%**
| |
BASDAI 50 (c,d)
| |
Woche 12
|
11%
|
41%**
|
NA
|
NA.
| |
Woche 24
|
16%
|
49%**
|
NA
|
NA
|
(a) Cimzia - alle Dosisregime = Daten für 200 mg Cimzia alle zwei Wochen, nach einer Initialdosis von 400 mg in den Wochen 0, 2 und 4, und 400 mg Cimzia alle vier Wochen, nach einer Initialdosis von 400 mg in den Wochen 0, 2 und 4
(b) Ergebnisse der randomisierten Gruppe
(c) Behandlungsdifferenz: Cimzia 200-Placebo, Cimzia 400-Placebo (entspricht 95% KI und p-Wert) werden mittels eines normalen zweiseitigen Wald-Tests bestimmt. Es wird Non-Responder Imputation (NRI) verwendet.
(d) Full Analysis Set
NA = nicht verfügbar
* p≤0.05, Cimzia vs Placebo
** p<0.001, Cimzia vs Pacebo
Wirbelsäulenbeweglichkeit
Die Wirbelsäulenbeweglichkeit wurde zu Studienbeginn, in Woche 12 und in Woche 24 anhand des BASMI bewertet. Zwischen Patienten unter Cimzia und Patienten unter Placebo konnten bei jeder Untersuchung nach Studienbeginn klinisch bedeutsame und statistisch signifikante Unterschiede gezeigt werden. Die Differenz zu Placebo der mittleren Veränderung des linearen BASMI-Werts gegenüber Baseline betrug bei Patienten unter Cimzia -0.40 Punkte (p<0.001) bis Woche 12 und -0.44 Punkte (p<0.001) bis Woche 24. Die Differenz zu Placebo war in der Subpopulation nicht-röntgenologische axiale Spondyloarthritis höher (-0.60 und -0.59 Punkte bis Woche 12 bzw. Woche 24) als in der Subpopulation ankylosierende Spondylitis (-0.21 und -0.32 Punkte bis Woche 12 bzw. Woche 24).
Entzündungshemmung in der Magnetresonanztomographie (MRT)
In einer Bildgebungssubstudie wurden in Woche 12 die Entzündungsanzeichen mittels MRT untersucht und dargestellt als Änderung gegenüber Baseline im SPARCC (Spondyloarthritis Research Consortium of Canada)-Score für die sakroiliakalen Gelenke und im ASspiMRI-a Score (Berlin-Modifikation) für die Wirbelsäule. Bei Patienten unter Cimzia (alle Dosisregime), der Gesamtpopulation mit axialer Spondyloarthritis sowie in den Subpopulationen ankylosierende Spondylitis und nicht-röntgenologische axiale Spondyloarthritis konnte eine signifikante Hemmung der Entzündungsanzeichen in den sakroiliakalen Gelenken und der Wirbelsäule beobachtet werden, jedoch nicht bei Patienten unter Placebo.
Psoriatische Arthritis
Wirksamkeit und Sicherheit von Cimzia wurden im Rahmen einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten klinischen Studie (PsA001) an 409 Patienten im Alter von ≥18 Jahren mit im Erwachsenenalter erstmals aufgetretener und seit mindestens 6 Monaten gemäss den Klassifizierungskriterien für psoriatische Arthritis (Classification Criteria for Psoriatic Arthritis, CASPAR-Kriterien) aktiver psoriatischer Arthritis beurteilt. Die Patienten wiesen ≥3 geschwollene, schmerzempfindliche Gelenke sowie entweder erhöhte Werte der Akute-Phase-Reaktanten oder Erythrocyte sedimentation rate (ESR) ≥28 mm/Stunden auf. Ausserdem zeigten die Patienten aktive psoriatische Hautläsionen oder wiesen eine dokumentierte Psoriasis-Anamnese auf und hatten mindestens einen erfolglosen DMARD-Behandlungsversuch hinter sich. Die Vorbehandlung mit einem TNF-Antagonisten war zulässig; ungefähr 20% der Patienten wiesen eine vorausgegangene TNF-Antagonisten-Exposition auf. Die Patienten erhielten nach Initialdosen von 400 mg Cimzia in Woche 0, 2 und 4 (in beiden Behandlungsarmen) oder Placebo entweder alle 2 Wochen 200 mg Cimzia bzw. alle 4 Wochen 400 mg Cimzia oder alle 2 Wochen Placebo. Ein Anteil von 72.6% oder 70.2% der Patienten erhielt gleichzeitig NSAIDs oder DMARDs. Die beiden primären Endpunkte bildeten der prozentuale Anteil der Patienten, die bis Woche 12 ein ACR-20-Ansprechen erreichten, sowie die Änderung im modifizierten Sharp-Gesamtscore (modified Total Sharp Score, mTSS) in Woche 24 gegenüber Baseline.
ACR-Ansprechen
Die ACR-20-, ACR-50- bzw. ACR-70-Ansprechraten auf die Behandlung mit Cimzia in der klinischen Studie PsA001 sind in Tabelle 7 aufgeführt. Patienten unter Cimzia wiesen gegenüber Patienten unter Placebo eine statistisch signifikant höhere ACR-20-Ansprechrate in Woche 12 und 24 auf (p<0,001). Ausserdem zeigten Patienten unter Cimzia gegenüber Patienten unter Placebo in Woche 12 und 24 signifikante Verbesserungen in Bezug auf die ACR-50- und ACR-70-Ansprechraten sowie auf die einzelnen ACR-Komponenten (siehe Tabelle 8). Patienten unter Cimzia 200 mg alle 2 Wochen und Patienten unter Cimzia 400 mg alle 4 Wochen sprachen ähnlich auf die Behandlung an.
Patienten mit einer Komedikation von Methotrexat wiesen bei Woche 24 numerisch höhere ACR20, ACR50 und ACR70-Antwortraten (62%, 35% und 26%) auf als Patienten unter Monotherapie (53%, 32% und 20%).
Tabelle 7: ACR-Ansprechen in der klinischen Studie PsA001 (Prozent Patienten)
|
Ansprechen
|
Placebo
N=136
|
Cimzia(a) 200 mg
Q2W
N=138
|
Cimzia(b) 400 mg
Q4W
N=135
| |
ACR 20
| |
Woche 12
|
24%
|
58%**
|
52%**
| |
Woche 24
|
24%
|
64%**
|
56%**
| |
ACR 50
| |
Woche 12
|
11%
|
36%**
|
33%**
| |
Woche 24
|
13%
|
44%**
|
40%**
| |
ACR 70
| |
Woche 12
|
3%
|
25%**
|
13%*
| |
Woche 24
|
4%
|
28%**
|
24%**
|
(a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
* p<0.01, Cimzia vs. Placebo
** p<0.001, Cimzia vs. Placebo
Die Ergebnisse basieren auf der randomisierten Population. Behandlungsunterschied: Cimzia 200 mg – Placebo, Cimzia 400 mg – Placebo (mit entsprechendem 95%-KI und p-Wert) werden mit asymptotischen Standardfehlern anhand eines zweiseitigen Standard-Wald-Tests geschätzt, unter Verwendung der NRI-Methode (Non-Responder-Imputation).
Tabelle 8: Komponenten des ACR-Ansprechens in der klinischen Studie PsA001
|
Parameter
|
Placebo
N=136
|
Cimzia(a)
200 mg Q2W
N=138
|
Cimzia(b)
400 mg Q4W
N=135
| |
|
Baseline
|
Woche 12
|
Woche 24
|
Baseline
|
Woche 12
|
Woche 24
|
Baseline
|
Woche 12
|
Woche 24
| |
Anzahl
schmerzempfindlicher Gelenke
(0–68)(c)
|
19,9
|
16,5
|
17,0
|
21,5
|
11,2*
|
8,5*
|
19,6
|
11,2*
|
9,4*
| |
Anzahl
geschwollener Gelenke
(0–66)(c)
|
10,4
|
8,7
|
9,9
|
11,0
|
4,0*
|
3,1*
|
10,5
|
4,7*
|
3,0*
| |
Ärztl. Gesamtbeurteilung(c, d)
|
58,7
|
44,1
|
42,2
|
56,8
|
24,8*
|
19,6*
|
58,2
|
28,7*
|
21,1*
| |
Patienten-Gesamtbeurteilung(c, d)
|
57,0
|
50,2
|
49,0
|
60,2
|
32,6*
|
31,1*
|
60,2
|
39,6*
|
32,5*
| |
Schmerz(c, e)
|
60,0
|
50,2
|
48,8
|
59,7
|
32,8*
|
31,1*
|
61,1
|
38,6*
|
32,7*
| |
Disability-Index (HAQ)(c, f)
|
1,30
|
1,15
|
1,13
|
1,33
|
0,87*
|
0,81*
|
1,29
|
0,90*
|
0,86*
| |
CRP (mg/l)
|
18,56
|
14,75
|
14,66
|
15,36
|
5,67*
|
4,58*
|
13,71
|
6,34*
|
7,37*
|
(a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(c) LOCF-Ansatz (Last Observation Carried Forward) bei fehlenden Daten, vorzeitigem Studienabbruch oder Placebo-Escape
(d) Patient and Physician Global Assessment of Disease Activity (Globale Beurteilung der Krankheitsaktivität durch den Patienten bzw. den Arzt), VAS-Skala mit 0 = sehr gut und 100 = sehr schlecht
(e) The Patient Assessment of Arthritis Pain, VAS-Skala mit 0 = keine Schmerzen und 100 = sehr starke Schmerzen
(f) HAQ-DI, 4-Punkte-Skala von 0 = keine Behinderung bis 3 = hohe Behinderung
Bei den dargestellten Werten handelt es sich um Durchschnittsangaben.
Die Ergebnisse basieren auf der randomisierten Population (Imputation oder Beobachtung).
* p<0.001, Cimzia vs. Placebo
Der Anteil der ACR-20-Responder war klinisch relevant und lag in den Behandlungsgruppen mit Cimzia 200 mg alle 2 Wochen und Cimzia 400 mg alle 4 Wochen bei allen Studienvisiten nach Behandlungsbeginn bis Woche 24 signifikant höher als in der Placebogruppe (p ≤0.001 bei allen Visiten).
PASI-Ansprechen
Patienten mit einem von psoriatischen Läsionen betroffenen Körperoberflächenanteil von mindestens 3% bei Baseline wurden hinsichtlich der Verbesserung ihrer Hauterscheinungen anhand des Ansprechens nach dem Psoriasis Area and Severity Index (PASI) beurteilt. Wie Tabelle 9 zeigt, betrug der Anteil der Patienten, die in Woche 24 ein PASI-75- und ein PASI-90-Ansprechen erreichten, in beiden Cimzia-Dosierungsgruppen zusammen (200 mg alle 2 Wochen + 400 mg alle 4 Wochen) (n=166) 61% bzw. 42%, gegenüber 15% bzw. 6% in der Placebogruppe (n=86) (p<0.001).
Tabelle 9: PASI-Ansprechrate in der klinischen Studie PsA001
|
Ansprech-Rate
|
Placebo
N=86
|
Cimzia(a)
200 mg Q2W
N=90
|
Cimzia(b)
400 mg Q4W
N=76
|
Cimzia
(alle Dosierungsregime)(c)
N=166
| |
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
| |
PASI 75
|
14%
|
15%
|
47% **
|
62% **
|
47% **
|
61% **
|
47% **
|
61% **
| |
PASI 90
|
5%
|
6%
|
22% **
|
47% **
|
20%*
|
36% **
|
21% **
|
42% **
|
a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Woche, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(c) Cimzia (alle Dosierungsregime) = Daten für Cimzia 200 mg alle 2 Wochen nach Initialdosen von 400 mg in Woche 0, 2 und 4 plus Daten für Cimzia 400 mg alle 4 Wochen nach Initialdosen von 400 mg in Woche 0, 2 und 4
* p-Wert <0.01, Cimzia vs. Placebo
** p-Wert <0.001, Cimzia vs. Placebo
Die Ergebnisse basieren auf der randomisierten Population.
Behandlungsunterschied: Cimzia 200 mg – Placebo, Cimzia 400 mg – Placebo (mit entsprechendem 95%-KI und p-Wert) werden mit asymptotischen Standardfehlern anhand eines zweiseitigen Standard-Wald-Tests geschätzt. Hinweis: Verwendet wird die NRI-Methode (Non-Responder-Imputation).
Patienten, die vor Behandlungsbeginn eine Enthesitis aufwiesen, wurden hinsichtlich der durchschnittlichen Verbesserung des Leeds Enthesitis Index (LEI) beurteilt. Patienten unter Cimzia 200 mg alle 2 Wochen oder 400 mg alle 4 Wochen zeigten eine stärkere Verbesserung der Enthesitis (-1.8; -1.7) als Patienten unter Placebo (-0.9) in Woche 12 (p<0.001 bzw. p<0.01) und Woche 24 (200 mg alle 2 Wochen: -2.0; 400 mg alle 4 Wochen: 1.8; Placebo: -1.1) (p<0.001 bzw. p<0.01).
Die gleichen Dosierungsschemata zeigten auch eine signifikante Reduktion der Daktylitis (mittlere Veränderung vom Ausgangswert -30.40; -45.46) im Vergleich zu Placebo behandelten Patienten (-16.79) in KW 12.
Radiologisches Ansprechen
In der klinischen Studie PsA001 wurde die Progredienz des strukturellen Gelenkschadens von Baseline bis Woche 24 im Röntgenbild beurteilt und als Veränderung im mTSS und seinen Komponenten, im Erosion Score (ES) und im Gelenkspaltverschmälerung-Score (JSN, von Joint Space Narrowing) angegeben. Der mTSS-Score wurde durch Ergänzung um die distalen Interphalangealgelenke für psoriatische Arthritis modifiziert. Mit einer Post-hoc Imputation zeigte es nun folgende Behandlungswirkung: Die Behandlung mit Cimzia hemmte gegenüber der Placebobehandlung in Woche 24 die radiologische Progredienz in Bezug auf die Änderung des mTSS gegenüber Baseline (der LS-Mittelwert [± SE] des Scores betrug 0.28 [± 0.07] in der Placebogruppe, gegenüber 0.06 [± 0.06] in der Cimzia-Gesamtgruppe; p=0.007). Ein statistisch signifikanter Unterschied zu Placebo wurde in der CZP 200 mg Q2W Gruppe beobachtet (p=0.004), nicht aber der CZP 400 mg Q4W Gruppe (p=0.072).
Ansprechen hinsichtlich der körperlichen Funktionsfähigkeit und der gesundheitsbezogenen Endpunkte
In der klinischen Studie PsA001 verzeichneten die mit Cimzia behandelten Patienten ab Woche 2 gegenüber den Patienten der Placebogruppe deutliche Verbesserungen in Bezug auf die körperliche Funktionsfähigkeit (ermittelt anhand des «Health Assessment Questionnaire – Disability Index [HAQ-DI]») sowie auf die Schmerzbelastung (ermittelt anhand des «Patient Assessment of Arthritis Pain [PAAP]» (siehe Tabelle 8). Für PAAP war der Unterschied signifikant nach Woche 1. Die Patienten unter Cimzia verzeichneten eine Verbesserung im Hinblick auf Abgeschlagenheit, bewertet anhand der «Fatigue Assessment Scale (FASCA)» von Woche 2 bis Woche 24 im Vergleich zu Placebo.
Patienten unter Cimzia verzeichneten im Fragebogen zur Psoriasis-Arthritis-bezogenen Lebensqualität (PsAQoL) ab Woche 2 sowie bei allen «Scores» der körperlichen und der psychischen Summenskala des SF-36-Fragbogens von Woche 4 bis Woche 24 signifikante Verbesserungen der gesundheitsbezogenen Lebensqualität.
Mit Cimzia behandelte Patienten erfuhren auf Basis des «Work Productivity Survey» gegenüber Patienten unter Placebo von Woche 4 bis Woche 24 Verbesserungen der durch psoriatische Arthritis bedingten Produktivitätseinschränkungen am Arbeitsplatz und zu Hause.
PharmakokinetikDie Certolizumab pegol-Plasmakonzentrationen waren im Wesentlichen dosisproportional.
Die Pharmakokinetik, die bei Patienten mit Morbus Crohn bzw. rheumatoider Arthritis beobachtet wurde, entsprach den gesunden Probanden.
Die Pharmakokinetik von Certolizumab pegol wurde in einer pharmakokinetischen Kreuzanalyse von Studienpopulationen an 1'580 Probanden, von denen 1'268 Patienten mit Morbus Crohn und 234 Patienten mit rheumatoider Arthritis sowie 78 gesunde Probanden waren, untersucht. Gemäss dem Ergebnis der populationsbezogenen pharmakokinetischen Analyse hatten Alter, Geschlecht, Kreatinin-Clearance und Leukozyten keinen Einfluss auf die Pharmakokinetik von Certolizumab pegol. Auf Grund der geringen Anzahl der Patienten mit signifikanten Leberfunktionsstörungen, erlaubte die populationsbezogene pharmakokinetische Analyse keinen Rückschluss auf die Auswirkung von Leberfunktionsstörungen.
Absorption
Bei subkutaner Anwendung wurden Spitzen-Plasmakonzentrationen von Certolizumab pegol 54-171 Stunden nach der Injektion erreicht. Die Bioverfügbarkeit (F) von Certolizumab pegol beträgt bei subkutaner Anwendung ca. 80% (Streuung: 76%-88%) im Vergleich zur intravenösen Anwendung.
Distribution
Das zentrale Verteilungsvolumen (Vc) wurde in der populationsbezogenen pharmakokinetischen Analyse, die sich weitestgehend auf Daten von Patienten mit Morbus Crohn stützte, auf 4.0 l geschätzt, mit einer interindividuellen Variabilität (% CV) von 16.9%. Das Steady-State-Verteilungsvolumen (Vss) betrug 6.4 l. In einer populationsbezogenen pharmakokinetischen Analyse von Patienten mit rheumatoider Arthritis wurde das scheinbare Verteilungsvolumen (V/F) auf 8.01 l geschätzt. Die komparative Verteilung von Certolizumab pegol im Gewebe wurde bei Ratten nach einer einzelnen intravenösen Dosis bewertet. Die Gewebeverteilung von 125I-CDP870 bei Ratten war ähnlich der eines humanisierten vollständigen IgG-Antikörpers über 48 Stunden. In einer zusätzlichen Ex-vivo-Studie wurde eine potenzielle Kreuzreaktivität von Certolizumab pegol mit Kryosektionen normaler menschlicher Gewebe untersucht. Certolizumab pegol zeigte keine Reaktivität mit einer festgelegten Standardauswahl normaler menschlicher Gewebe.
Metabolismus und Elimination
Durch Pegylierung (kovalente Bindung von PEG-Polymeren an Peptide) wird die Elimination dieser Einheiten aus dem Kreislauf durch verschiedene Mechanismen verzögert, wie z.B. eine geringere renale Clearance, verringerte Proteolyse und verminderte Immunogenität. In klinischen Studien wurden in 7.9% anti-Certoluzimab Antikörper beobachtet (vergleiche «Unerwünschte Wirkungen»).
Bei Certolizumab pegol handelt es sich um ein Fab'-Fragment eines Antikörpers, das mit PEG konjugiert wurde, um die terminale Plasma-Eliminationshalbwertszeit des Fab' derart zu verlängern, dass sie mit der eines Präparats aus vollständigen Antikörpern vergleichbar ist. Die terminale Eliminationshalbwertszeit (t½) betrug bei allen untersuchten Dosierungen ca. 14 Tage. Bei intravenöser Verabreichung an gesunde Probanden lag die Clearance im Bereich zwischen 9.21 ml/h und 14.38 ml/h. Nach subkutaner Anwendung bei gesunden Freiwilligen betrug die Clearance zwischen 10.58 ml/h und 12.13 ml/h; in der populationsbezogenen pharmakokinetischen Analyse von Daten von Patienten mit Morbus Crohn wurde die Clearance in der Gesamtpopulation auf 17.25 ml/h geschätzt, bei einer Variabilität zwischen Probanden von 38.3% (CV) und einer Variabilität zwischen Ereignissen von 16.4%. In einer populationsbezogenen pharmakokinetischen Analyse an Patienten mit rheumatoider Arthritis wurde die Clearance nach s.c.-Dosierung auf 21.0 ml/h geschätzt, wobei die Variabilität zwischen Porbanden 30.8% (VK) und die Variabilität zwischen Ereignissen 22.0% betrug. Die Elimination über die Niere erwies sich als der Eliminationsweg der dekonjugierten PEG-Komponente von Certolizumab pegol.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörung
Zur Beurteilung der Auswirkungen einer Nierenfunktionsstörung auf die Pharmakokinetik von Certolizumab pegol oder seiner PEG-Fraktion wurden keine spezifischen klinischen Studien durchgeführt. Die populationsbezogene pharmakokinetische Analyse an Probanden mit leichten Nierenfunktionsstörungen zeigte jedoch keine von der Kreatinin-Clearance abhängigen Effekte; d.h. eine leichte Nierenfunktionsstörung hat wahrscheinlich keine signifikanten Auswirkungen.
Es gibt keine ausreichenden Daten für eine Dosisempfehlung bei Nierenfunktionsstörungen. Die Pharmakokinetik der PEG-Fraktion (Polyethylenglykol) von Certolizumab pegol hängt wahrscheinlich von der Nierenfunktion ab, wurde aber bei Nierenfunktionsstörungen nicht untersucht.
Leberfunktionsstörungen
Zur Beurteilung der Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Certolizumab pegol wurden keine spezifischen klinischen Studien durchgeführt. Die populationsbezogene pharmakokinetische Analyse liess keine Rückschlüsse bezüglich der Auswirkungen einer Leberfunktionsstörung zu, da diese Analyse nur eine geringe Anzahl von Patienten mit signifikanten Leberfunktionsstörungen umfasste.
Geriatrische Patienten
Morbus Crohn
Spezielle klinische Studien mit älteren Probanden wurden nicht durchgeführt; die populationsbezogene pharmakokinetische Analyse zeigte bei 1'580 Patienten jedoch keine Alterseffekte.
Rheumatoide Arthitis
Es wurden keine speziellen klinischen Studien bei älteren Patienten durchgeführt. Eine populationspharmakokinetische Analyse bei Patienten mit rheumatoider Arthritis, in der 78 Patienten (13,2% des Kollektivs) 65 Jahre oder älter waren und der älteste Teilnehmer 83 Jahre, ergab jedoch keine Hinweise auf einen Alterseffekt.
Pädiatrische Patienten
Zur Anwendung von Certolizumab pegol bei Kindern liegen keine Untersuchungen vor.
Geschlecht
Spezielle klinische Studien zu den Auswirkungen des Geschlechts auf die Pharmakokinetik von Certolizumab pegol wurden nicht durchgeführt; populationsbezogene pharmakokinetische Analysen zeigten bei 1580 mehrheitlich an Morbus Crohn erkrankten Patienten und 1768 Patienten mit rheumatoider Arthritis jedoch keine Geschlechtseffekte.
Rasse/Ethnie
Die populationsbezogene pharmakokinetische Analyse ergab für Kaukasier allgemein einen ca. 15% höheren Clearance-Wert als für Nicht-Kaukasier; dies ist klinisch nicht signifikant. Die pharmakokinetischen Parameter japanischer Probanden waren vergleichbar mit denen kaukasischer Probanden nach subkutaner Verabreichung in drei Dosierungsstufen im Rahmen einer Bioverfügbarkeitsstudie.
Präklinische DatenDie nicht klinischen Hauptstudien zur Sicherheit wurden an Cynomolgus Affen durchgeführt. Histopathologische Untersuchungen an Ratten und Affen ergaben eine Vakuolenbildung in Zellen, vor allem in Makrophagen in zahlreichen Organen (Lymphknoten, Injektionsstelle, Milz, Nebennieren, Uterus, Cervix, Plexux choroidei, sowie in den Epithelzellen des Plexux choroidei). Wahrscheinlich war dies auf zelluläre Aufnahme der PEG-Fraktion zurückzuführen. In-vitro-Funktionsstudien von humanen Makrophagen mit Vakuolen ergab eine Aufrechterhaltung aller untersuchten Funktionen. Studien an Ratten zeigen, dass >90% des verabreichten PEG innerhalb von 3 Monaten nach einer einzelnen Dosis eliminiert war, wobei der Haupteliminationsweg der über die Nieren war.
In vorklinischen Studien wurden keine Mutagenität oder Klastogenität nachgewiesen. Studien zur Kanzerogenität von Cimzia wurden nicht durchgeführt.
Unter Verwendung eines von Nagern stammenden anti-murinen TNF-α-PEGyliertem Fab' (cTN3PF) nach anhaltender TNF-α -Suppression wurden bei Ratten keine unerwünschten Wirkungen auf Indizes für das Wohlbefinden der Muttertiere oder die Fertilität der Weibchen, bzw. für embryofetale sowie peri- und postnatale Reproduktion beobachtet.
Fertilität
Es wurden Auswirkungen auf die Spermabeweglichkeit sowie eine reduzierte Spermiendichte bei männlichen Nagetieren behandelt mit cTN3 PF beobachtet ohne offensichtliche Konsequenz für die Fertilität.
Verteilungsstudien ergaben eine zu vernachlässigende Menge an cTN3PF, die über Plazenta oder Muttermilch in den fetalen oder neonatalen Blutkreislauf übertritt. Es ist derzeit nicht bekannt, ob das Gleiche für Cimzia beim Menschen gilt.
Sonstige HinweiseInkompatibilitäten
Cimzia darf nicht mit einem anderen Arzneimittel gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungsanweisungen
Im Kühlschrank (2–8 °C) lagern. Nicht einfrieren.
In der Originalpackung (Umkarton) vor Licht geschützt aufbewahren.
Hinweise für die Handhabung
Arzneimittel zum Einmalgebrauch. Cimzia sollte erst injiziert werden wenn die Flüssigkeit Raumtemperatur erreicht hat, weshalb die Cimzia Fertigspritze 30 Minuten bzw. der Cimzia Fertigpen 30 bis 45 Minuten vorher aus dem Kühlschrank zu entnehmen ist. Erwärmen Sie die Spritze bzw. den Fertigpen nicht auf eine andere Art und Weise.
Zulassungsnummer60096, 66590 (Swissmedic).
PackungenCimzia: Packung mit 2 gebrauchsfertigen Spritzen und 2 Alkoholtupfern [B].
Cimzia AutoClicks: Packung mit 2 Fertigpens und 2 Alkoholtupfern [B].
ZulassungsinhaberinUCB-Pharma AG, Bulle.
Stand der InformationJuni 2017.
|

