Eigenschaften/WirkungenATC-Code
A10BJ06
Wirkungsmechanismus
Semaglutide ist ein GLP-1-Analogon mit einer Sequenzhomologie von 94 % zum humanen GLP-1. GLP-1 ist ein physiologisches Hormon. Semaglutide wirkt als ein GLP-1-Rezeptor-Agonist, der sich selektiv an den GLP-1-Rezeptor, den Zielrezeptor für natives GLP-1, bindet und diesen aktiviert. GLP-1-Rezeptoren sind im Pankreas, im Gehirn, im Herzen, im Gefässsystem, im Immunsystem und den Nieren exprimiert.
Im Vergleich zum nativen GLP-1 hat Semaglutide eine verlängerte Halbwertszeit von rund 1 Woche, weshalb es zur einmal wöchentlichen subkutanen Injektion geeignet ist. Der Hauptmechanismus der Verlängerung ist die Albuminbindung, die zur verminderten renalen Clearance und zum Schutz gegen metabolische Degradation führt. Darüber hinaus ist Semaglutide stabilisiert gegen Degradation durch das DPP-4-Enzym.
Semaglutide senkt den Blutzuckerspiegel durch die Stimulation der Insulinsekretion und die Verringerung der Glucagonsekretion, wobei beides glucoseabhängig erfolgt. Wenn der Blutzuckerspiegel hoch ist, wird die Insulinsekretion stimuliert und die Glucagonsekretion gehemmt. Der Mechanismus der Verringerung des Blutzuckerspiegels umfasst auch eine minimale Verzögerung der Magenentleerung in der frühen postprandialen Phase. Bei einer Hypoglykämie verringert Semaglutide die Insulinsekretion und beeinträchtigt die Glucagonsekretion nicht.
Semaglutide reduziert das Körpergewicht und die Körperfettmasse mittels einer verringerten Energieaufnahme. Der Mechanismus umfasst einen allgemein verminderten Appetit, der erhöhtes Sättigungs- und vermindertes Hungergefühl einschliesst. Die Insulinresistenz wird reduziert. Dies erfolgt vermutlich durch die Reduktion des Körpergewichts.
Pharmakodynamik
Alle pharmakodynamischen Untersuchungen wurde nach 12 Behandlungswochen (einschliesslich der Dosiseskalation) im Steady State mit einmal wöchentlicher Behandlung mit Semaglutide 1 mg durchgeführt.
Nüchternblutzucker und postprandialer Blutzucker
Bei Patienten mit Diabetes mellitus Typ 2 führte die Behandlung mit Semaglutide 1 mg zur Verringerung des Blutzuckerspiegels, und zwar sowohl hinsichtlich der absoluten Veränderung gegenüber dem Ausgangswert (mmol/l), als auch der relativen Verringerung im Vergleich zum Placebo (%) hinsichtlich des Nüchternblutzuckers (1,6 mmol/l; Verminderung um 22 %), des postprandialen Blutzuckers nach 2 Stunden (4,1 mmol/l; Verminderung um 37 %), des mittleren 24-Stunden-Blutzuckerspiegels (1,7 mmol/l; Verminderung um 22 %) und der postprandialen Blutzuckerspitzen über 3 Mahlzeiten (0,6–1,1 mmol/l) im Vergleich zum Placebo.
Semaglutide verringerte den Nüchternblutzucker nach der ersten Dosis.
Betazellfunktion und Insulinsekretion
Im Vergleich zum Placebo verbesserte Semaglutide nach einem intravenösen Glucose-Bolus die Erst- und Zweitphasen-Insulinantwort um das jeweils 3- und 2-Fache. Nach einem Arginin-Stimulationstest bei Patienten mit Diabetes mellitus Typ 2 erhöhte Semaglutide im Vergleich zum Placebo die maximale sekretorische Kapazität der Betazellen. Darüber hinaus erhöhte die Behandlung mit Semaglutide im Vergleich zum Placebo die Nüchtern-Insulinkonzentration.
Glucagonsekretion
Bei Patienten mit Diabetes mellitus Typ 2 führte Semaglutide zu den folgenden relativen Verringerungen des Glucagons im Vergleich zum Placebo: Nüchternglucagon (8–21 %), postprandiale Glucagonantwort (14–15 %) und mittlerer 24-Stunden-Glucagonspiegel (12 %).
Glucoseabhängige Insulin- und Glucagonsekretion
Semaglutide senkte die hohen Blutzuckerspiegel durch die glukoseabhängige Stimulation der Insulinsekretion und die Hemmung der Glucagonsekretion. Mit Semaglutide war die Insulinsekretionsrate bei Patienten mit Diabetes mellitus Typ 2 vergleichbar mit den gesunden Teilnehmern.
Während induzierter Hypoglykämie veränderte Semaglutide im Vergleich zum Placebo nicht die gegenregulatorischen Reaktionen auf den erhöhten Glucagonspiegel und beeinträchtigte nicht die Senkung des C-Peptids bei Patienten mit Diabetes mellitus Typ 2.
Magenentleerung
Semaglutide verursachte eine geringfügige Verlängerung der frühen postprandialen Magenentleerung und verminderte dadurch die Rate, in der Glukose postprandial in den Kreislauf gelangt.
Appetit, Energieaufnahme und Auswahl von Lebensmitteln
Im Vergleich zum Placebo verminderte Semaglutide die Energiezufuhr aus 3 aufeinanderfolgenden ad libitum Mahlzeiten um 18–35 %. Dies wurde unterstützt durch die von Semaglutide induzierte Unterdrückung des Appetits sowohl im Nüchternzustand als auch postprandial, verbesserte Kontrolle des Essverhaltens, eine Reduktion der Heisshungeranfälle und eine relativ geringe Vorliebe für fettreiche Lebensmittel.
Nüchternblutfette und postprandiale Blutfette
Im Vergleich zum Placebo verringerte Semaglutide die Spiegel der Nüchterntriglyzeride und des VLDL-Cholesterins (Lipoproteine sehr niedriger Dichte) um jeweils 12 % und 21 %. Die postprandiale Triglyzerid- und VLDL-Cholesterinantwort nach einer hochgradig fettreichen Mahlzeit wurde um >40 % verringert.
Die Auswirkung von Semaglutide auf die kardiale Repolarisation wurde in einer ausführlichen QTc-Studie untersucht. Semaglutide verlängert die QTc-Intervalle bei supra-therapeutischen Dosierungen (bis zu 1,5 mg im Steady State) nicht.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von einmal pro Woche angewendetem Ozempic 0,5 mg und 1 mg wurden in sechs randomisierten kontrollierten klinischen Studien mit 7'215 Patienten mit Diabetes mellitus Typ 2 (davon 4'107 mit Ozempic behandelt) untersucht. Das primäre Ziel von fünf Studien (SUSTAIN 1–5) war die Beurteilung der glykämischen Wirksamkeit, während das primäre Ziel einer Studie (SUSTAIN 6) die Beurteilung der kardiovaskulären Sicherheit war.
Die Wirksamkeit und Sicherheit von Ozempic 2 mg einmal wöchentlich wurde in einer Phase-3b-Studie (SUSTAIN FORTE), in die 961 Patienten eingeschlossen wurden, untersucht.
Zusätzlich wurde die Phase-3b-Studie (SUSTAIN 7) mit 1'201 Patienten durchgeführt, um die Wirksamkeit und Sicherheit von Ozempic 0,5 mg und 1 mg einmal wöchentlich gegenüber Dulaglutide 0,75 mg bzw. 1,5 mg einmal wöchentlich zu vergleichen. Die Phase-3b-Studie (SUSTAIN 9) mit 302 Patienten wurde durchgeführt, um die Wirksamkeit und Sicherheit von Semaglutide zusätzlich zu einer bestehenden Therapie mit einem SGLT2-Inhibitor (mit oder ohne Metformin oder Sulfonylharnstoff) bei Patienten mit Diabetes mellitus Typ 2 zu beurteilen.
Die Behandlung mit Ozempic führte im Vergleich zum Placebo und zur Behandlung mit einem aktiven Kontrollpräparat (Sitagliptin, Insulin glargin, Exenatid ER und Dulaglutide) zu anhaltenden, statistisch signifikant grösseren und klinisch bedeutsamen Senkungen des HbA1c-Werts (Abbildung 1) und des Körpergewichts für die Dauer von bis zu 2 Jahren.
Abbildung 1: HbA1c-Wert (%), geschätzte Änderung am Ende der Behandlung gegenüber Ausgangswert in SUSTAIN 1–7+9 (Ozempic 0,5 mg dunkelgrau, Ozempic 1 mg schwarz, Vergleichspräparate weiss und Placebo hellgrau)
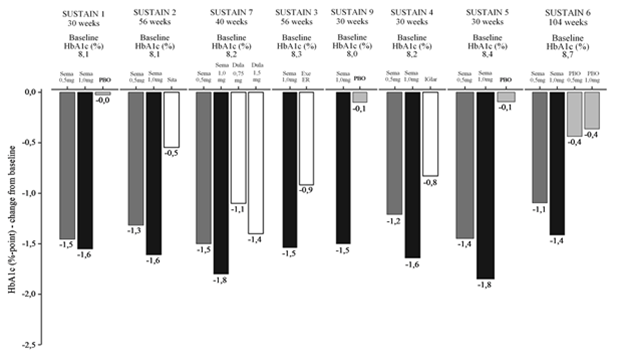
Alter, Geschlecht, ethnische Zugehörigkeit, BMI und Körpergewicht (kg) bei Studienbeginn, Dauer der Diabeteserkrankung und Schweregrad der Einschränkung der Nierenfunktion hatten keine Auswirkung auf die Wirksamkeit von Ozempic.
Die Ergebnisse beziehen sich jeweils auf die Behandlungsphase bei allen randomisierten Teilnehmern (Analysen basierend auf gemischten Modellen für wiederholte Messungen oder multiple Imputation).
Zusätzlich wurde eine 52-wöchige Phase-3b-Studie (SUSTAIN 11) durchgeführt, um die Wirkung von Semaglutide gegenüber Insulin aspart (jeweils als Bolus zu den drei Hauptmahlzeiten) zu untersuchen, beide als Zusatz zu Metformin und optimiertem Insulin glargin (U100).
SUSTAIN 1 – Monotherapie
In SUSTAIN 1 wurden 388 Patienten, die mit Diät und Bewegung unzureichend eingestellt waren, während 30-Wochen doppelblind mit Ozempic 0,5 mg oder Ozempic 1 mg einmal pro Woche oder mit Placebo behandelt.
Tabelle 2: SUSTAIN 1: Ergebnisse in Woche 30
|
|
Ozempic
0,5 mg
|
Ozempic
1 mg
|
Placebo
| |
Intent-to-Treat (ITT) Population (N)
|
128
|
130
|
129
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,1
|
8,1
|
8,0
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-1,5
|
-1,6
|
0,0
| |
Differenz zu Placebo [95 % KI]
|
-1,4 [-1,7, -1,1]a
|
-1,5 [-1,8, -1,2]a
|
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
74b
|
72b
|
25
| |
Differenz (odds ratio) zu Placebo [95 % KI]
|
16,9 [8.4; 33.9]
|
15,7 [8.0; 30.8]
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
89,8
|
96,9
|
89,1
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-3,7
|
-4,5
|
-1,0
| |
Differenz zu Placebo [95 % KI]
|
-2,7 [-3,9, -1,6]a
|
-3,6 [-4,7, -2,4]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN 2 – Ozempic vs Sitagliptin in Kombination mit 1–2 oralen Antidiabetika: Metformin, und/oder Thiazolidinedionen
In SUSTAIN 2 wurden 1231 Patienten während 56 Wochen doppelblind mit Ozempic 0,5 mg, oder Ozempic 1 mg einmal pro Woche oder Sitagliptin 100 mg einmal pro Tag, jeweils in Kombination mit Metformin (94 %) und/oder Thiazolidinedionen (6 %), behandelt.
Tabelle 3: SUSTAIN 2: Ergebnisse in Woche 56
|
|
Ozempic
0,5 mg
|
Ozempic
1 mg
|
Sitaglipin
100 mg
| |
Intent-to-Treat (ITT) Population (N)
|
409
|
409
|
407
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,0
|
8,0
|
8,2
| |
Änderung in Woche 56 gegenüber dem Ausgangswert
|
-1,3
|
-1,6
|
-0,5
| |
Differenz zu Sitagliptin [95 % KI]
|
-0,8 [-0,9; -0,6]a
|
-1,1 [-1,2; -0,9]a
|
-
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
69b
|
78b
|
36
| |
Differenz (odds ratio) zu Sitagliptin [95 % KI]
|
4,2 [3.02; 5.74]
|
7,9 [5,59; 11.22]
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
89,9
|
89,2
|
89,3
| |
Änderung in Woche 56 gegenüber dem Ausgangswert
|
-4,3
|
-6,1
|
-1,9
| |
Differenz zu Sitagliptin [95 % KI]
|
-2,3 [-3,1; -1,6]a
|
-4,2 [-4,9; -3,5]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN 9 – Ozempic vs. Placebo als Zusatz zu einer bestehenden Therapie mit einem SGLT-2-Inhibitor ± Metformin oder SU
In einer 30-wöchigen doppelblinden, placebokontrollierten Studie wurden 302 Patienten mit Diabetes mellitus Typ 2, die mit einem SGLT2-Inhibitor mit oder ohne Metformin oder SU unzureichend eingestellt waren, zu Ozempic 1,0 mg einmal wöchentlich oder Placebo randomisiert.
Tabelle 4: SUSTAIN 9: Ergebnisse in Woche 30
|
|
Ozempic 1 mg
|
Placebo
| |
Intent-to-Treat (ITT)-Population (N)
|
151
|
151
| |
HbA1c (%)
| |
Ausgangswert (mittlerer)
|
8,0
|
8,1
| |
Änderung gegenüber Ausgangswert in Woche 30
|
-1,5
|
-0,1
| |
Differenz zu Placebo [95 % KI]
|
-1,42 [-1,61, -1,24]a
|
-
| |
Patienten (%), die einen HbA1c-Wert <7 % erreichten
|
78,7
|
18,7
| |
Differenz (odds ratio) zu Placebo [95 % KI]
|
27,32b [12,80, 58,30]
|
-
| |
Körpergewicht (kg)
| |
Ausgangswert (mittlerer)
|
89,6
|
93,8
| |
Änderung gegenüber Ausgangswert in Woche 30
|
-4,7
|
-0,9
| |
Differenz zu Placebo [95 % KI]
|
-3,81 [-4,70, -2,93]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN 7- Ozempic vs. Dulaglutid beide in Kombination mit Metformin
In einer 40-wöchigen offenen Studie wurden 1'201 Patienten mit Metformin randomisiert entweder mit Ozempic 0,5 mg oder 1 mg einmal wöchentlich oder Dulaglutid 0,75 mg oder 1,5 mg einmal wöchentlich. In der Studie wurden 0,5 mg Semaglutide mit 0,75 mg Dulaglutid und 1 mg Semaglutide mit 1,5 mg Dulaglutid verglichen.
Tabelle 5: SUSTAIN 7: Ergebnisse in Woche 40
|
|
Semaglutide
0,5 mg
|
Semaglutide
1 mg
|
Dulaglutid
0,75 mg
|
Dulaglutid
1,5 mg
| |
Intent-to-Treat (ITT)-Population (N)
|
301
|
300
|
299
|
299
| |
HbA1c (%)
| |
Ausgangswert (mittlerer)
|
8,3
|
8,2
|
8,2
|
8,2
| |
Änderung gegenüber Ausgangswert in Woche 40
|
-1,5
|
-1,8
|
-1,1
|
-1,4
| |
Differenz zu Dulaglutid [95 % KI]
|
-0,4b
[-0,6, -0,2]a
|
-0,4c
[-0,6, -0,3]a
|
-
|
-
| |
Patienten (%), die einen HbA1c-Wert <7 % erreichten
|
68
|
79
|
52
|
67
| |
Differenz (odds ratio) zu Dulaglutid [95 % KI]
|
2,5
[1.68; 3.64]
|
2,0
[1.28; 3.00]
|
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittlerer)
|
96,4
|
95,5
|
95,6
|
93,4
| |
Änderung gegenüber Ausgangswert in Woche 40
|
-4,6
|
-6,5
|
-2,3
|
-3,0
| |
Differenz zu Dulaglutid [95 % KI]
|
-2,3b
[-3,0, -1,5]a
|
-3,6c
[-4,3, -2,8]a
|
-
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit
b 0,5 mg Ozempic gegenüber 0,75 mg Dulaglutid
c 1 mg Ozempic gegenüber 1,5 mg Dulaglutid
SUSTAIN 3 – Ozempic vs. Exenatide ER beide in Kombination mit Metformin oder Metformin mit Sulfonylharnstoff
In SUSTAIN 3 wurden 813 Patienten, die mit Metformin allein (49 %), mit Metformin plus Sulfonylharnstoffen (45 %) oder mit anderen antidiabetischen Arzneimitteln (6 %) behandelt wurden, während 56 Wochen zusätzlich mit Ozempic 1 mg einmal pro Woche oder mit Exenatid ER 2 mg einmal pro Woche, behandelt. Die Studie war nicht doppelblind.
Tabelle 6: SUSTAIN 3: Ergebnisse in Woche 56
|
|
Ozempic
1 mg
|
Exenatid ER
2 mg
| |
Intent-to-Treat (ITT) Population (N)
|
404
|
405
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,4
|
8,3
| |
Änderung in Woche 56 gegenüber dem Ausgangswert
|
-1,5
|
-0,9
| |
Differenz zu Exenatid [95 % KI]
|
-0,6 [-0,8; -0,4]a
|
-
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
67b
|
40
| |
Differenz (odds ratio) zu Exenatid ER [95 % KI]
|
3,9 [2,80; 5,38]
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
96,2
|
95,4
| |
Änderung in Woche 56 gegenüber dem Ausgangswert
|
-5,6
|
-1,9
| |
Differenz zu Exenatid [95 % KI]
|
-3,8 [-4,6, -3,0]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN 4 – Ozempic vs Insulin Glargin beide in Kombination mit 1–2 oralen Antidiabetika: Metformin oder Metformin und Sulfonylharnstoff
In SUSTAIN 4 wurden 1'089 Patienten, die mit Metformin allein (48 %) oder mit Metformin plus Sulfonylharnstoffen (51 %) behandelt wurden, während 30-Wochen zusätzlich mit Ozempic 0,5 mg einmal pro Woche, Ozempic 1 mg einmal pro Woche oder Insulin glargin einmal pro Tag, behandelt. Die Studie war nicht doppelblind.
Tabelle 7: SUSTAIN 4: Ergebnisse in Woche 30
|
|
Ozempic
0,5 mg
|
Ozempic
1 mg
|
Insulin glargin
| |
Intent-to-Treat (ITT) Population (N)
|
362
|
360
|
360
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,1
|
8,2
|
8,1
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-1,2
|
-1,6
|
-0,8
| |
Differenz zu Insulin glargin [95 % KI]
|
-0,4 [-0,5; -0,2]a
|
-0,8 [-1,0; -0,7]a
|
-
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
57b
|
73b
|
38
| |
Differenz (odds ratio) zu Insulin glargin [95 % KI]
|
2,4 [1,73; 3,28]
|
5,8 [4,08; 8,19]
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
93,7
|
94,0
|
92,6
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-3,5
|
-5,2
|
+1,2
| |
Differenz zu Insulin glargin [95 % KI]
|
-4,6 (-5,3; -4,0)a
|
-6,34 [-7,0; -5,7]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN 5 – Ozempic vs Placebo beide in Kombination mit Basalinsulin
In SUSTAIN 5 wurden 397 Patienten, die mit Basalinsulin mit oder ohne Metformin unzureichend eingestellt waren, zusätzlich mit Ozempic 0,5 mg einmal pro Woche, Ozempic 1 mg einmal pro Woche oder mit Placebo während 30-Wochen behandelt. Die Studie war nicht doppelblind.
Tabelle 8: SUSTAIN 5: Ergebnisse in Woche 30
|
|
Ozempic
0,5 mg
|
Ozempic
1 mg
|
Placebo
| |
Intent-to-Treat (ITT) Population (N)
|
132
|
131
|
133
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,4
|
8,3
|
8,4
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-1,4
|
-1,8
|
-0,1
| |
Differenz zu Placebo [95 % KI]
|
-1,4 [-1,6; -1,1]a
|
-1,8 [-2,0; -1,5]a
|
-
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
61b
|
79b
|
11
| |
Differenz (odds ratio) zu Placebo [95 % KI]
|
14,7 [7,43; 29,02]
|
34,3 [16,59; 70,83]
|
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
92,7
|
92,5
|
89,9
| |
Änderung in Woche 30 gegenüber dem Ausgangswert
|
-3,7
|
-6,4
|
-1,4
| |
Differenz zu Placebo [95 % KI]
|
-2,3 [-3,3; -1,3]a
|
-5,1 [-6,1; -4,0]a
|
-
|
a p <0,0001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
SUSTAIN FORTE – Ozempic 2 mg vs. Ozempic 1 mg
In einer 40-wöchigen doppelblinden Studie wurden 961 Patienten, die mit Metformin mit oder ohne Sulfonylharnstoff (SU) nicht ausreichend eingestellt waren, randomisiert mit Ozempic 1 mg einmal wöchentlich oder Ozempic 2 mg einmal wöchentlich behandelt.
Die Behandlung mit Ozempic 2 mg führte im Vergleich zu Ozempic 1 mg zu einer statistisch überlegenen Senkung des HbA1c-Werts nach 40 Wochen Behandlung.
Tabelle 9: SUSTAIN FORTE: Ergebnisse nach 40 Wochen der Behandlung mit Ozempic 2 mg mit Metformin mit oder ohne SU
|
|
Ozempic 1 mg
|
Ozempic 2 mg
| |
Intent-to-Treat (ITT) Population (N)
|
481
|
480
| |
HbA1c-Wert (%)
| |
Ausgangswert (mittel)
|
8,8
|
8,9
| |
Änderung in Woche 40 gegenüber dem Ausgangswert
|
-1,9 oder -2,0
|
-2,2
| |
Differenz zu Ozempic 1 mg [95 % KI]
|
-
|
-0,2 [-0,4; -0,1]a
| |
Patienten (%), bei denen ein HbA1c-Wert <7 % erreicht wurde
|
58b
|
68b
| |
Körpergewicht (kg)
| |
Ausgangswert (mittel)
|
98,6
|
100,1
| |
Änderung in Woche 40 gegenüber dem Ausgangswert
|
-6,0
|
-6,9
| |
Differenz zu Ozempic 1 mg [95 % KI]
|
|
-0,9 [-1,7; -0,2]c
|
a p <0,001 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
b p <0,0001 für Behandlungsdifferenz, nicht angepasst hinsichtlich der Multiplizität
c p <0,05 (2-seitig) für Überlegenheit, angepasst hinsichtlich der Multiplizität basierend auf hierarchischer Testung von HbA1c-Wert und Körpergewicht
SUSTAIN 11 – Semaglutide gegenüber Insulin aspart (IAsp) als Add-on bei Patienten, welche mit dem Basalinsulin Insulin glargin und Metformin keine ausreichende glykämische Kontrolle erzielen
In einer 52-wöchigen unverblindeten Studie wurden 1748 Patienten, deren Diabetes mellitus Typ2 nach einer 12-wöchigen Run-in Phase unter Insulin glargin und Metformin unzureichend kontrolliert war, 1:1 auf Semaglutide einmal wöchentlich (0,5 mg oder 1,0 mg) oder IAsp dreimal täglich zu den Hauptmahlzeiten randomisiert. Die durchschnittliche Dauer des Diabetes in der Studienpopulation betrug 13,4 Jahre und der mittlere HbA1c-Wert 8,6 %. Der HbA1c-Zielwert lag im Bereich von 6,5–7,5 %.
Die Behandlung mit Semaglutide war der mit IAsp nicht unterlegen. Die mittlere Differenz (Semaglutide – IAsp) in der Senkung des HbA1c [95 % KI] in Woche 52 betrug -0.29 [-0.38, -0.20]. Die HbA1c-Senkung in Woche 52 betrug -1.5 % für Semaglutide vs -1.2 % für IAsp, d.h. die glukosesenkende Wirkung von Semaglutide war numerisch grösser als die von IAsp). Die Anzahl schwerer hypoglykämischer Episoden war in beiden Behandlungsgruppen niedrig und unter Semaglutide (4 Episoden) numerisch geringer als im IAsp-Arm (7 Episoden; HR [95 % KI]: 0.6 [0.2, 2.2]).
Die Behandlung mit Semaglutide senkte das mittlere Körpergewicht bis Woche 52 um 4,1 kg, während es unter IAsp um 2,8 kg anstieg (geschätzter Behandlungsunterschied [95 % KI] zugunsten von Semaglutide: -6,99 kg [-7,41, 6,57]).
Kombination mit Sulfonylharnstoff-Monotherapie
In SUSTAIN 6 (siehe unten) wurde eine Untergruppe, die eine Sulfonylharnstoff-Monotherapie erhielt, in Woche 30 beurteilt. Bei der Ausgangsuntersuchung erhielten 123 Patienten eine Sulfonylharnstoff-Monotherapie. Der HbA1c-Wert lag bei der Ausgangsuntersuchung bei jeweils 8,2 %, 8,4 % und 8,4 % für Ozempic 0,5 mg, Ozempic 1 mg und Placebo. In der Woche 30 betrug die Änderung des HbA1c-Werts jeweils -1,6 %, -1,5 % und 0,1 % für Ozempic 0,5 mg, Ozempic 1 mg und Placebo.
Kombination mit Mischinsulin ± 1–2 OAD
In SUSTAIN 6 (siehe unten) wurde eine Untergruppe, die ein Mischinsulin (mit oder ohne 2 OAD) erhielt, in Woche 30 beurteilt. Bei der Ausgangsuntersuchung erhielten 867 Patienten ein Mischinsulin. Der HbA1c-Wert lag bei der Ausgangsuntersuchung bei jeweils 8,8 %, 8,9 % und 8,9 % für Ozempic 0,5 mg, Ozempic 1 mg und Placebo. In der Woche 30 betrug die Änderung des HbA1c-Werts -1,3 %, -1,8 % und -0,4 %, jeweils für Ozempic 0,5 mg, Ozempic 1 mg und Placebo.
Kardiovaskuläre Sicherheit
SUSTAIN 6 ist eine randomisierte, doppelblinde, klinische Studie, in der die kardiovaskuläre Sicherheit von Semaglutide 0.5 mg und Semaglutide 1 mg 1× pro Woche, mit derjenigen von Placebo bei 3'297 Patienten mit Typ 2 Diabetes mellitus verglichen wurde. In die Studie aufgenommen wurden 2'735 (83 %) Patienten mit einer vorbestehenden kardiovaskulären Erkrankung und 562 (17 %) Patienten mit einem hohen Risiko für kardiovaskuläre Ereignisse. Sowohl Semaglutide als auch Placebo wurden zusätzlich zur bereits vorhandenen antidiabetischen Therapie gegeben. Die Beobachtungsdauer betrug 2 Jahre.
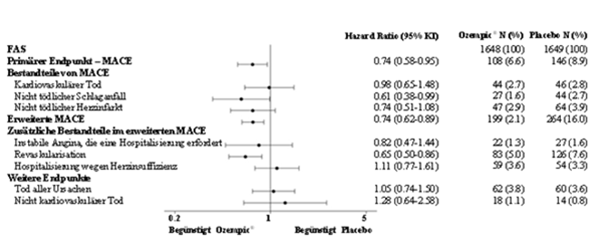
Primärendpunkt war die Zeit von der Randomisierung bis zum ersten Auftreten eines schweren unerwünschten kardiovaskulären Ereignisses (MACE, major adverse cardiovascular event). MACE war definiert als Auftreten einer der drei Komponenten «kardiovaskulärer Tod», «nicht tödlicher Herzinfarkt» oder «nicht tödlicher Schlaganfall». Sekundärendpunkt war die Zeit von der Randomisierung bis zum ersten Auftreten eines erweiterten MACE-Endpunktes. Dieser erweiterte Endpunkt umfasste zusätzlich koronare oder periphere Revaskularisationen, instabile Angina pectoris, die eine Hospitalisierung erforderlich machte, oder Hospitalisierung wegen Herzinsuffizienz. Die Studie war als Non-inferiority-Studie konzipiert. Kriterium für den Non-Inferiority-Entscheid war die Obergrenze von 1.8 des 95 % Konfidenzintervalls für die Hazard Ratio der MACE.
Die Gesamtzahl der primären MACE-Endpunkte betrug 254, davon 108 (6,6 %) unter Semaglutide und 146 (8,9 %) unter Placebo. Die kardiovaskuläre Sicherheit von Semaglutide im Vergleich zu Placebo wurde bestätigt (Abbildung 2 und 3).
Abbildung 2: Kaplan-Meier-Plot hinsichtlich der Zeit bis zum ersten Auftreten des zusammengesetzten Endpunktes: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt und nicht-tödlicher Schlaganfall (SUSTAIN 6)
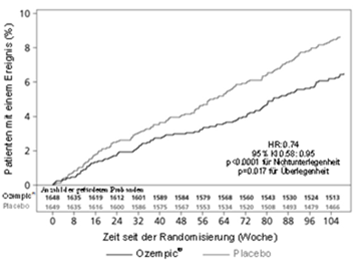
Abbildung 3: Forest-Plot: Analysen der einzelnen Arten kardiovaskulärer Ereignisse (SUSTAIN 6)
Die Differenz des HbA1c-Werts in Woche 104 gegenüber dem Ausgangswert betrug für Semaglutide 0,5 mg -1,1 % vs. -0,4 % für Placebo und -1,4 % für Semaglutide 1 mg vs. 0,4 für Placebo.
|



