Eigenschaften/WirkungenATC-Code
L01XL03
Wirkungsmechanismus
YESCARTA, ein Arzneimittel zur Immuntherapie mit genetisch modifizierten autologen T-Zell-Immuntherapie, bindet an CD19 exprimierende Krebszellen und normale B-Zellen. Nach der Bindung der Anti-CD19-CAR-T-Zellen an die CD19 exprimierenden Zielzellen aktivieren die kostimulierenden Domänen CD28 und CD3-zeta nachgeschaltete Signalkaskaden, die bei den T-Zellen zu Aktivierung, Proliferation, Akquisition von Effektorfunktionen und Sekretion von inflammatorischen Zytokinen und Chemokinen führen. Diese Abfolge von Ereignissen führt zur Apoptose und Nekrose der CD19 exprimierenden Zielzellen.
Pharmakodynamik
Das pharmakodynamische Ansprechen wurde nach der YESCARTA-Infusion untersucht, indem der vorübergehende Anstieg der Zytokine, Chemokine und anderer Moleküle im Blut über einen 4-wöchigen Zeitraum gemessen wurde. Die Konzentrationen der Zytokine und Chemokine wie Interleukin (IL) IL-6, IL-8, IL-10, IL-15, TNF-α, IFN-γ und sIL2Rα wurden analysiert. Der maximale Anstieg wurde in den ersten 14 Tagen nach der Infusion beobachtet, und die Konzentrationen erreichten in der Regel innerhalb von 28 Tagen wieder den Ausgangswert.
Aufgrund der on-target, off-tumour Wirkung von YESCARTA ist nach der Behandlung für einen gewissen Zeitraum eine B-Zell-Aplasie zu erwarten. Unter 73 DLBCL- und PMBCL-Patienten in ZUMA-1 mit auswertbaren Proben zu Studienbeginn hatten 40% nachweisbare B-Zellen; die bei einer Mehrheit der Patienten zu Studienbeginn beobachtete B-Zell-Aplasie wurde auf frühere Therapien zurückgeführt. Nach der YESCARTA-Behandlung sank der Anteil der Patienten mit nachweisbaren B-Zellen: 20% hatten nachweisbare B-Zellen im Monat 3 und 22% nachweisbare B-Zellen im Monat 6.
Die Initiierung der B-Zell-Wiederherstellung wurde erstmals im Monat 9 festgestellt, als 56% der Patienten nachweisbare B-Zellen hatten. Dieser Trend der B-Zell-Wiederherstellung setzte sich im Laufe der Zeit fort, da 64% der Patienten im Monat 18 nachweisbare B-Zellen hatten und 77% der Patienten im Monat 24 nachweisbare B-Zellen hatten.
Unter den 141 Patienten in ZUMA-7 mit auswertbaren Proben zu Studienbeginn hatten 57% nachweisbare B-Zellen. Nach der YESCARTA-Behandlung sank der Anteil der Patienten mit nachweisbaren B-Zellen: 38% hatten nachweisbare B-Zellen im Monat 3 und 41% nachweisbare B-Zellen im Monat 6. Die Initiierung der B-Zell-Wiederherstellung war im Monat 9 zu erkennen, als 58% der Patienten nachweisbare B-Zellen hatten. Dieser Trend der B-Zell-Wiederherstellung setzte sich im Laufe der Zeit fort, da 64% der Patienten im Monat 18 nachweisbare B-Zellen hatten und 85% der Patienten im Monat 24 nachweisbare B-Zellen hatten.
Unter 113 FL-Patienten in ZUMA-5 mit auswertbaren Proben zu Studienbeginn hatten 75% nachweisbare B-Zellen. Nach der YESCARTA-Behandlung sank der Anteil der Patienten mit nachweisbaren B-Zellen: 40% der Patienten hatten nachweisbare B-Zellen im Monat 3. Im Laufe der Zeit wurde eine B-Zell-Wiederherstellung beobachtet, wobei 61% der Patienten im Monat 24 nachweisbare B-Zellen hatten.
Es ist zu beachten, dass Patienten nach dem Fortschreiten der Krankheit nicht weiterverfolgt werden mussten; daher waren die Mehrzahl der Patienten mit auswertbaren Proben Responder.
Klinische Wirksamkeit
Klinische Studie ZUMA-1, Phase 1 und 2 (rezidiviertes oder refraktäres DLBCL, PMBCL und DLBCL, welches aus einem follikulären Lymphom entstanden ist, nach zwei oder mehr systemischen Therapielinien)
Insgesamt wurden 108 Patienten (7 Patienten in Phase 1 und 101 Patienten in Phase 2) mit aggressivem r/r B-Zell-Non-Hodgkin-Lymphom (NHL) in einer offenen, multizentrischen, einarmigen Phase-1/2-Studie mit YESCARTA behandelt.
Basierend auf der WHO-Klassifizierung 2008, welche zum Zeitpunkt der Studie gültig war, wurde die Wirksamkeit an 101 Patienten in Phase 2 mit histologisch bestätigtem DLBCL (N = 77), PMBCL (N = 8), oder DLBCL, welches aus einem follikulären Lymphom (N = 16) entstanden ist, untersucht. Basierend auf der aktuellen WHO-Klassifizierung 2016:
Patienten mit DLBCL in der ZUMA-1 Studie schlossen Patienten mit nicht anderweitig spezifiziertem DLBCL, Patienten mit anderen DLBCL-Subtypen sowie Patienten mit HGBL ein. Dies beruht auf einer retrospektiven, post-hoc Analyse eines Teils der Patienten per «independent pathology review». 47 Patienten konnten im Hinblick auf den MYC-, BCL-2- und BCL-6-Status evaluiert werden. Bei 30 Patienten wurde ein DLBCL mit Doppelexpression (Überexpression von sowohl MYC- als auch BCL-2-Protein) festgestellt; 5 Patienten hatten ein HGBL mit MYC-, BCL-2- oder BCL-6-Gen-Re-Arrangements (Mutation von 2 Genen (double hit) oder 3 Genen (triple hit)); bei 2 Patienten wurde ein nicht anderweitig spezifiziertes HGBL festgestellt. Aufgrund der kleinen Anzahl von HGBL Patienten kann keine Schlussfolgerung zur klinischen Wirksamkeit in dieser Patientenpopulation gezogen werden. 66 Patienten waren im Hinblick auf ihre B-Zell-Subpopulation (germinaler-B-Zell-Typ [GCB] oder aktivierter B-Zell-Typ [ABC]) evaluierbar. 49 dieser Patienten wiesen den GCB-Typ und 17 den ABC-Typ auf.
Geeignete Patienten waren mindestens 18 Jahre alt und wiesen eine refraktäre Erkrankung auf; diese war definiert als progrediente Erkrankung (progressive disease, PD) oder stabile Erkrankung (stable disease, SD) als bestes Ansprechen auf die zuletzt angewendete Therapielinie, oder aber Progression innerhalb von 12 Monaten nach autologer Stammzelltransplantation (ASZT). Patienten, die gegenüber einer Chemotherapie refraktär sind oder nach zwei oder mehr systemischen Therapielinien ein Rezidiv aufweisen, sind im Allgemeinen nicht für eine hämatopoetische Stammzelltransplantation (HSZT) geeignet.
Patienten mussten zuvor mindestens mit einem Anti-CD20-Antikörper sowie einem Anthracyclin enthaltenden Regime behandelt worden sein. Patienten mit einem ZNS-Lymphom, einer vorangegangenen allogenen Stammzelltransplantation oder einer vorherigen Therapie mit Anti-CD19-CAR oder anderen genetisch modifizierten T-Zellen waren ausgeschlossen. Patienten mit ZNS-Erkrankungen (wie z.B. Krampfanfällen oder zerebrovaskulärer Ischämie) in der Anamnese, einer Ejektionsfraktion des Herzens von weniger als 50%, Sauerstoffsättigung von weniger als 92% bei Raumluft oder einer Autoimmunerkrankung, die eine systemische Immunsuppression erfordert, waren ausgeschlossen. Die mediane Dauer der Nachbeobachtung war 27,1 Monate (noch nicht abgeschlossen). ITT war definiert als Anzahl aller Patienten, die einer Leukapharese unterzogen wurden, mITT war definiert als Anzahl aller Patienten, die YESCARTA erhielten.
Demographische Daten der modifizierten intent-to-treat (mITT) Population
Das mediane Alter der mITT-Studienpopulation betrug 58 Jahre (Spanne: 23 bis 76 Jahre); 67% waren Männer, 86% waren weiss, 3% waren asiatischer Abstammung und 4% waren farbig. Der ECOG-Leistungsstatus zum Studienbeginn entsprach bei 42% ECOG 0 und bei 58% ECOG 1. Die mediane Anzahl vorheriger Therapien betrug 3 (Spanne: 1 bis 10); bei 76% der Patienten war die Erkrankung gegenüber einer zweiten oder weiteren Therapielinie refraktär, und 21% waren innerhalb 1 Jahres nach der autologen HSZT rezidiviert. 46% der Patienten wiesen einen Internationalen Prognostischen Index von 3/4 auf, und 85% der Patienten befanden sich im Krankheitsstadium III/IV.
Demographische Daten der intent-to-treat (ITT) Population
Das mediane Alter der ITT-Studienpopulation betrug 58 Jahre (Spanne: 23 bis 76 Jahre), 69% waren Männer, 85% waren weiss, 4% waren asiatischer Abstammung und 4% waren farbig. Der ECOG-Leistungsstatus zum Studienbeginn entsprach bei 41% ECOG 0 und bei 59% ECOG 1. Die mediane Anzahl vorheriger Therapien betrug 3 (Spanne: 1 bis 10); bei 77% der Patienten war die Erkrankung gegenüber einer zweiten oder weiteren Therapielinie refraktär, und 20% waren innerhalb 1 Jahres nach der autologen HSZT rezidiviert. 46% der Patienten wiesen einen Internationalen Prognostischen Index von 3/4 auf, und 85% der Patienten befanden sich im Krankheitsstadium III/IV.
YESCARTA wurde als Einzel-Infusion mit einer Zieldosis von 2 x 106 Anti-CD19-CAR-T-Zellen/kg im Anschluss an ein Chemotherapie-Schema zur Lymphodepletion von 500 mg/m2 intravenösem Cyclophosphamid und 30 mg/m2 intravenösem Fludarabin verabreicht; die Lymphodepletion erfolgte am 5., 4. und 3. Tag vor der Behandlung mit YESCARTA. Alle 108 Patienten, welche mit YESCARTA in ZUMA-1 (Phasen 1 und 2) behandelt wurden, erhielten eine Chemotherapie zur Lymphodepletion. Alle Patienten hatten einen Ausgangswert an weissen Blutkörperchen von ≥1 x 103/μl (d.h. vor der Chemotherapie zur Lymphodepletion). Nur Patienten mit einer absoluten Neutrophilenzahl von ≥1000/μl, einer absoluten Lymphozytenzahl von ≥100/µl und einem Thrombozytenwert von ≥75'000/μl zu Studienbeginn wurden in die Studie einbezogen. Eine Bridging-Chemotherapie zwischen der Leukapherese und der Chemotherapie zur Lymphodepletion war nicht zulässig. Alle Patienten wurden zur Beobachtung und Behandlung von unerwünschten Wirkungen nach der YESCARTA-Infusion für mindestens 7 Tage hospitalisiert.
ZUMA-1 Phase 2
Von 111 Patienten, die einer Leukapherese unterzogen wurden, erhielten 101 YESCARTA. Neun Patienten wurden nicht behandelt, und zwar hauptsächlich aufgrund einer progredienten Erkrankung oder wegen schwerwiegender unerwünschter Wirkungen nach der Aufnahme in die Studie und vor der Lieferung der Zellen. Einer von 111 Patienten erhielt das Arzneimittel wegen eines Herstellungsfehlers nicht. Die mediane Dauer von der Leukapherese bis zur Lieferung des Arzneimittels betrug 17 Tage (Spanne: 14 bis 51 Tage), und die mediane Dauer von der Leukapherese bis zur Infusion betrug 24 Tage (Spanne: 16 bis 73 Tage). Die mediane Dosis betrug 2,0 x 106 Anti-CD19-CAR-T-Zellen/kg.
Der primäre Endpunkt war die objektive Ansprechrate (Objective Response Rate, ORR), bestimmt durch die Prüfärzte. Die sekundären Endpunkte beinhalteten objektive Ansprechrate (ORR), bestimmt durch eine unabhängige Prüfungskommission, Dauer des Ansprechens (Duration of Response, DOR), progressionsfreies Überleben (PFS), Gesamtüberleben (Overall Survival, OS) und die Schwere der unerwünschten Ereignisse. Es wurde vorab festgelegt, dass die ORR bei den ersten 92 Patienten getestet wird; diese war signifikant höher als die vorab festgelegte Rate von 20% (p < 0,0001).
In der primären Analyse (Nachbeobachtung zumindest 6 Monate) betrug die ORR 82%, basierend auf der modifizierten Intention-to-Treat(mITT)-Population, und die Rate des vollständigen Ansprechens (Complete Response, CR) lag bei 54%, ermittelt durch die Prüfärzte (primärer Endpunkt). In der aktualisierten Analyse (Nachbeobachtung zumindest 12 Monate) betrug die ORR 83%, und die CR Rate lag bei 58%, ermittelt durch die Prüfärzte. In der 24-monatigen Nachbeobachtungs-Analyse betrug die ORR 83% und die CR-Rate lag bei 58%, ermittelt durch die Prüfärzte. Die Wirksamkeitsresultate sind in Tabelle 4 unten zusammengefasst. Das mediane OS in der ITT Population betrug 17,4 Monate (95% KI 11,6 – NE). Die 12 und 24 Monats OS Raten waren 59,5% und 47,7%. Das mediane OS wurde in der mITT Population noch nicht erreicht bei beobachteten 50 Ereignissen/101 Patienten. Die 12 und 24 Monats OS Raten waren 60,4% und 50,5%. In einer Analyse über 36 Monate, betrug das Gesamtüberleben in der mITT Population (101 Patienten) 25,8 Monate. In einer Analyse über 60 Monate betrug die Kaplan-Meier Schätzung für die 3-Jahres, 4-Jahres und 5-Jahres OS Raten 47%, 44% bzw. 43%.
Tabelle 4: Zusammenfassung der Wirksamkeitsergebnisse für Phase 2 von ZUMA-1 (24-Monats-Analyse)
|
|
Alle Leukapheresierten (ITT)
Cohort 1 + 2
(N = 111)
|
Alle Behandelten
mITT
Cohort 1 + 2
(N = 101)
| |
|
Bewertung unabhängige Prüfungskommision
|
Bewertung Prüfarzt
|
Bewertung unabhängige Prüfungskommision
|
Bewertung Prüfarzt
| |
ORR (%) [95% KI]
|
68 (58; 76)
|
77 (69; 85)
|
74 (65; 82)
|
83 (74; 90)
| |
CR (%)
|
50
|
55
|
54
|
58
| |
PFS (Monate) [95% KI]
|
9,5 (6,1; 15,4)
|
6,2 (4,0; 12,4)
|
9,1 (5,7; n.a.)
|
5,9 (3,3; 15,0)
| |
DORa, Median (95% KI) in Monaten
|
n.a. (10,9; n.a.)
|
9,0 (3,9; n.a.)
|
n.a. (10,9; n.a.)
|
9,0 (3,9; n.a.)
| |
DOR, CR, Median (95% KI) in Monaten
|
n.a. (n.a.; n.a.)
|
Nicht verfügbar
|
n.a. (n.a.; n.a.)
|
n.a. (12,9; n.a.)
| |
DOR, PR, Median (95% KI) in Monaten
|
2,1 (1,3; 11,1)
|
Nicht verfügbar
|
2,1 (1,3; 11,1)
|
1,9 (1,3; 2,1)
| |
Mediane Nachbeobachtungszeit (Monate)
|
27,1
| |
Minimale Nachbeobachtungszeit (Monate)
|
22,9
| |
OS, Median (Monate) [95% KI]
|
17,4 (11,6; n.a.)
|
n.a. (12,8; n.a.)
| |
6 Monate OS (%) [95% KI]
|
81,1 (72,5; 87,2)
|
79,2 (69,9; 85,9)
| |
12 Monate OS (%) [95% KI]
|
59,5 (49,7; 67,9)
|
60,4 (50,2; 69,2)
| |
24 Monate OS (%) [95% KI]
|
47,7 (38,2; 56,7)
|
50,5 (40,4; 59,7)
|
KI, Konfidenzintervall; CR, vollständiges Ansprechen; DOR, Dauer des Ansprechens; ITT, intention-to-treat; mITT, modifiziertes intention-to-treat); n.a.=Nicht abschätzbar; ORR, objektive Ansprechrate; OS, Gesamtüberleben; PR, partielles Ansprechen.
a Die Dauer des Ansprechens und PFS waren zum Zeitpunkt der SZT für Teilnehmer zensiert, die die SZT während des Ansprechens erhielten
Hinweis: mITT war definiert als alle Patienten, die YESCARTA in einer Mindestdosis von 1x106 CAR-T-Zellen/kg erhielten
Klinische Studie ZUMA-7, Phase 3 (r/r DLCBL und r/r HGBL)
Die Wirksamkeit und Sicherheit von YESCARTA bei erwachsenen Patienten mit r/r DLCBL und r/r HGBL wurden in einer randomisierten, offenen, multizentrischen Phase-3-Studie (ZUMA-7) nachgewiesen. Bei den eingeschlossenen Patienten bestand überwiegend die Diagnose eines nicht anderweitig spezifizierten/nicht weiter klassifizierbaren DLBCLs (69%) und eines High-Grade-B-Zell-Lymphoms (HGBL) (0% mit nicht anderweitig spezifiziertem HGBL und 16% mit MYC / BCL-2 / BCL-6-Gen-Rearrangement (einschliesslich double hit oder triple hit) gemäss Beurteilung des zentralen Labors. 46 Patienten (13%) wurden als «nicht bestätigt» oder «fehlend» kategorisiert, und 10 Patienten (3%) wurden als «andere Lymphome als DLBCL oder HGBL» kategorisiert. Die Patienten wurden nach den molekularen Untergruppen (Keimzentrum-B-Zell-Typ (58%) und aktivierter B-Zell-Typ (7%) sowie «nicht klassifiziert» (9%)) und dem CD19-Expressionsstatus «ja» (77%) und «nein» (7%) gemäss Beurteilung des zentralen Labors weiter kategorisiert. Alle Patienten hatten vorgängig eine Erstlinientherapie mit einer Anthracyclin-haltigen Therapie und monoklonalen Anti-CD20-Antikörpern erhalten, es sei denn, der Tumor war CD20-negativ. Insgesamt erhielten 359 Patienten nach Randomisierung im Verhältnis 1:1 eine einzelne YESCARTA-Infusion oder die Standardtherapie (definiert als 2 bis 3 Zyklen Standard-Chemoimmuntherapie [R-ICE, R-DHAP oder R-DHAX, R-ESHAP oder R-GDP] gefolgt von hochdosierter Therapie [HDT] und autologer Stammzelltransplantation [ASZT] bei Patienten, deren Erkrankung auf die Behandlung ansprach). Die Randomisierung erfolgte stratifiziert 1) gemäss dem Ansprechen auf die Erstlinientherapie (primär refraktär vs. Rezidiv ≤6 Monate vs. Rezidiv > 6 und ≤12 Monate) und gemäss aaIPP («age-adjusted international prognostic index») 0 / 1 vs. 2 / 3. Gründe für den Ausschluss von der Studie waren frühere hämatopoetische Stammzelltransplantation (HSZT), primäres ZNS-Lymphom oder Hirnmetastasen, nachweisbare bösartige Zellen im Liquor und ein Eastern Cooperative Oncology Group (ECOG)-Leistungsstatus von 2 oder höher. Patienten mit aktiven oder schwerwiegenden Infektionen waren ausgeschlossen, jedoch waren Patienten mit einfachen Harnwegsinfektionen und unkomplizierter bakterieller Pharyngitis zugelassen, wenn sie auf eine aktive Behandlung ansprachen. Patienten mit bekannten Infektionen mit dem HIV-, Hepatitis-B- (HBsAG-positiv) oder Hepatitis-C-Virus (Anti-HCV-positiv) waren ausgeschlossen. Der Einschluss von Patienten nach einer erfolgreichen Behandlung von Hepatitis B oder Hepatitis C in der Anamnese war zulässig, wenn keine Viruslast im quantitativen PCR- und/oder Nukleinsäuretest nachweisbar war.
Nach einer Chemotherapie zur Lymphodepletion wurde YESCARTA als einzelne intravenöse Infusion mit einer Zieldosis von 2 x 106 Anti-CD19-CAR-T-Zellen/kg (Höchstdosis: 2 x 108 Zellen) verabreicht. Das Behandlungsschema zur Lymphodepletion bestand aus Cyclophosphamid 500 mg/m² intravenös und Fludarabin 30 mg/m² intravenös, beide verabreicht am 5., 4. und 3. Tag vor YESCARTA. Eine nicht krankheitsmodifizierende Bridging-Therapie, die auf Kortikosteroide beschränkt war, konnte Patienten mit hoher Krankheitslast beim Screening zwischen der Leukapherese und der Chemotherapie zur Lymphodepletion verabreicht werden.
Von den 180 Patienten, die zur Behandlung mit YESCARTA randomisiert wurden, unterzogen sich 178 der Leukapherese, und 170 wurden mit YESCARTA behandelt. Acht Patienten (4%) wurden nach der Leukapherese nicht behandelt, insbesondere wegen progredienter Erkrankung, schwerwiegenden unerwünschten Ereignissen oder Tod. Da eine erneute Gabe für einen Patienten der klinischen Studie einen zweiten Herstellungslauf erforderte, wurden insgesamt 171 Chargen hergestellt. Die mediane Dauer von der Leukapherese bis zur Produktfreigabe betrug 13 Tage (Spanne: 10 bis 24 Tage), und bis zur YESCARTA-Infusion 26 Tage (Spanne: 16 bis 52 Tage). Die mediane Dosis betrug 2,0 x 106 Anti-CD19-CAR-T-Zellen/kg für Patienten mit einem Körpergewicht von < 100 kg (Min: 1,0 x 106 Anti-CD19-CAR-T-Zellen/kg; Max: 2,1, x 106 Anti-CD19-CAR-T-Zellen/kg). Für Patienten mit einem Körpergewicht von > 100 kg betrug die mediane Dosis 200 x 106 Anti-CD19-CAR-T-Zellen. 60 (33%) der behandelten Patienten erhielten eine Bridging-Therapie mit Kortikosteroiden. Alle 170 Patienten, die YESCARTA erhielten, wurden mindestens 7 Tage lang in einer klinischen Einrichtung stationär überwacht. Von den 179 Patienten, die zum Standardtherapie-Studienarm randomisiert wurden, erhielten 64 Patienten (36%) eine HDT-ASZT, einschliesslich 2 Patienten, die eine ASZT ausserhalb der Vorgaben des Prüfplans erhielten.
In der Standardtherapie-Gruppe erhielten 49 Patienten (41%) mit DLBCL und 9 Patienten (35%) mit HGBL eine HD-ASZT.
In der Gesamtpopulation der Studie betrug das mediane Alter 59 Jahre (Spanne: 21 bis 81 Jahre); 66% waren Männer und 83% waren Weisse. Vierundsiebzig Prozent der Patienten hatten ein primäres refraktäres LBCL, und 26% der Patienten hatten innerhalb von 12 Monaten nach der Erstlinientherapie ein Rezidiv erlitten. Die Patienten hatten einen aaIPI-Score von 0–1 (55%) oder 2–3 (45%) und einen ECOG-Leistungsstatus von 0 (54%) oder 1 (46%).
Die mediane tatsächliche Nachbeobachtungszeit betrug 20,07 Monate (Spanne: 0,59 bis 37,75 Monate) in der YESCARTA-Gruppe und 18,23 Monate (Spanne: 0,03 bis 37,26 Monate) in der Gruppe mit Standardtherapie.
Der primäre Endpunkt war das ereignisfreie Überleben (event-free survival, EFS), ermittelt durch verblindete zentrale Auswertung. Das EFS war definiert als die Zeit von der Randomisierung bis zur Krankheitsprogression gemäss Lugano-Klassifikation (Cheson et al., 2014), Beginn einer neuen Lymphom-Therapie oder Tod jeglicher Ursache, je nachdem, was als erstes eintrat. In der Studie wurde eine statistisch signifikante Verbesserung des EFS bei zu YESCARTA randomisierten Patienten im Vergleich zur Standardtherapie gezeigt (HR: 0,398 [95% KI: 0,308; 0,514]). Das ereignisfreie 24-Monats-Überleben betrug 40,5% [95% KI: 33,2; 47,7] im YESCARTA-Arm und 16,3% [95% KI: 11,1; 22,2] im Standardtherapie-Arm.
Die Sekundärendpunkte ORR- und CR-Rate waren bei mit YESCARTA behandelten Patienten signifikant höher, mit einem ORR-Unterschied von 33,1% [95% KI: 23,2; 42,1]) und einem CR-Raten-Unterschied von 33% im YESCARTA-Arm (Tabelle 5). Die mediane DOR betrug im YESCARTA-Arm 26,9 Monate (Spanne: 0 bis 29 Monate), verglichen mit 8,9 Monaten (Spanne: 0 bis 32 Monate) im Standardtherapie-Arm (HR: 0,736 [95% KI: 0,488; 1,108]). Zum Zeitpunkt der primären Analyse des EFS betrug die mediane Studiendauer 24,9 Monate.
Die primäre Analyse des Gesamtüberlebens (OS), ein wichtiger sekundärer Endpunkt, wurde zum im Prüfplan festgelegten Zeitpunkt von fünf Jahren ab Aufnahme des ersten Patienten durchgeführt. Eine statistisch signifikante Verbesserung des OS mit YESCARTA gegenüber der Standardtherapie wurde durch die Reduktion des Sterberisikos von 27,4% (HR: 0,726 [95% KI: 0,540; 0,977]) nachgewiesen. Mit geschätzten 48 Monats-OS-Raten von 54,6% bzw. 46,0% wurde das mediane OS im YESCARTA-Arm im Vergleich zu 31,1 Monaten im Standardtherapie-Arm nicht erreicht. Die mediane Studiendauer liegt bei 47,2 Monaten. Siebenundfünfzig Prozent (57%) der Patienten erhielten eine zelluläre Immuntherapie, nachdem sie auf die Standardtherapie nicht angesprochen oder nach der Randomisierung zur Standardtherapie ein Rezidiv erlitten hatten.
Die Zusammenfassung der Wirksamkeitsergebnisse in der Gesamtpopulation ist in Tabelle 5 aufgeführt. Die Kaplan-Meier Kurve des OS ist in Abbildung 1 dargestellt.
Tabelle 5: Zusammenfassung der Wirksamkeitsergebnisse für ZUMA-7
|
|
YESCARTA
N = 180
|
Standardtherapie
N = 179
| |
EFSa
| |
Anzahl der Ereignisse (%)
|
108 (60)
|
144 (80)
| |
Median, Monate [95% KI]b
|
8,3 [4,5; 15,8]
|
2,0 [1,6; 2,8]
| |
Stratifizierte Hazard Ratio [95% KI]
|
0,398 [0,308; 0,514]
| |
Stratifizierter Log-Rank-p-Wertc
|
< 0,0001
| |
OS
| |
Anzahl der Ereignisse (%)
|
82 (46)
|
95 (53)
| |
Medianes OS, Monate [95% KI]b
|
Nicht erreicht (28,6; n.a.)
|
31,1 (17,1; n.a.)
| |
Stratifizierte Hazard Ratio [95% KI]
|
0,726 (0,540; 0,977)
| |
Stratifizierter Log-Rank-p-Wertc,d
|
0,0168
| |
ORR (%) [95 % KI]a
|
83 [77,1; 88,5]
|
50 [42,7; 57,8]
| |
Odds Ratio [95% KI]
|
5,31 [3,08; 8,90]
| |
p-Wert des stratifizierten CMH-Testsc
|
< 0,0001
| |
Rate des vollständigen Ansprechens (%)
|
65 [57,6; 71,9]
|
32 [25,6; 39,8]
| |
Rate des teilweisen Ansprechens (%)
|
18 [13,0; 24,8]
|
18 [12,6; 24,3]
| |
PFSe
| |
Anzahl der Ereignisse (%)
|
96 (53)
|
103 (58)
| |
Median, Monate [95% KI]b
|
14,7 [5,4; n.a.]
|
3,7 [2,9; 5,3]
| |
Stratifizierte Hazard Ratio [95% KI]
|
0,490 [0,368; 0,652]
|
KI, Konfidenzintervall; CMH, Cochran-Mantel-Haenszel; EFS, Ereignisfreies Überleben; n.a., nicht abschätzbar; OS, Gesamtüberleben; PFS, Progressionsfreies Überleben.
a Ermittelt durch zentrale Auswertung zum Zeitpunkt der primären Analyse des EFS.
b Kaplan-Meier-Methode.
c Einseitige p-Werte. Stratifizierter Log-Rank-Test oder stratifizierter CMH-Test nach Ansprechen auf die Erstlinientherapie (primär refraktär vs. Rezidiv ≤6 Monate nach der Erstlinientherapie vs. Rezidiv > 6 und ≤12 Monate nach der Erstlinientherapie) und dem auf die Zweitlinientherapie bezogenen altersangepassten internationalen prognostischen Index (0 bis 1 vs. 2 bis 3) angepasst.
d Der p-Wert wird mit 0,0249 verglichen, der einseitigen Wirksamkeitsgrenze (Signifikanzniveau) für die primäre OS-Analyse.
e Nach Einschätzung des Prüfarztes.
f Nach Auswertung zum Zeitpunkt der primären Analyse des OS (fünf Jahre ab Aufnahme des ersten Teilnehmers).
Eine anhaltende Wirksamkeit wurde in Subgruppen beobachtet, einschliesslich Ansprechen auf Erstlinientherapie, gemäss Alter bei der Zweitlinientherapie angepasster IPI-Score, ECOG-Leistungsstatus, Alter, Double-Expressor-Lymphom-Status, Erkrankungs-Subtyp HGBL, CD19-Status, B-Symptome, Beteiligung der Milz, extranodal, hohe Tumorlast und Beteiligung des Knochenmarks.
Abbildung 1a. Kaplan-Meier Kurve des Gesamtüberlebens in ZUMA-7 (Vollständiger Analysensatz; primäre Analyse Gesamtüberleben)
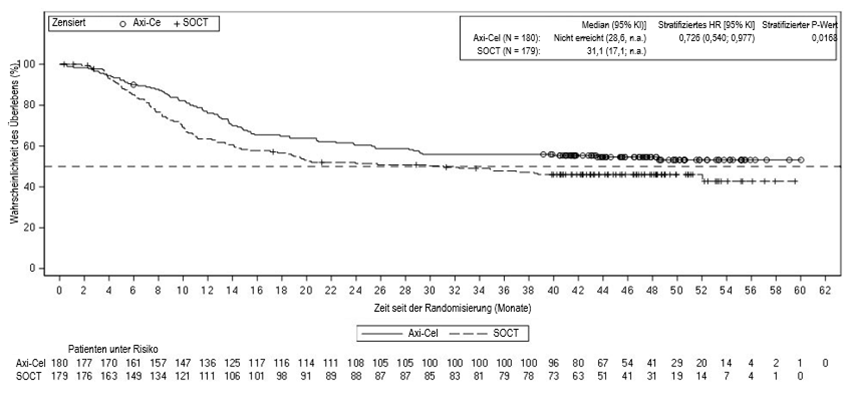
KI, Konfidenzintervall; HR, Hazard Ratio; SOCT, Standardtherapie.
a Patienten, die nicht auf die SOCT ansprachen, konnten ausserhalb der Anforderungen des Protokolls eine anschliessende Lymphom-Behandlung einschliesslich einer Anti-CD19-CAR-T-Zelltherapie erhalten.
Wiederholte Therapie mit YESCARTA
Zum Zeitpunkt der primären OS-Analyse hatten insgesamt 10 Patienten (6%) eine wiederholte Behandlung mit YESCARTA erhalten. Aufgrund der geringen Anzahl an Patienten kann keine Schlussfolgerung bezüglich der Wirksamkeit und Sicherheit gezogen werden.
Nachfolgende Anti-Lymphom-Therapien
Siebenundfünfzig Prozent (57%)der Patienten im Standardtherapiearm erhielten nachfolgend eine zelluläre Immuntherapie ausserhalb des Prüfplans (einschliesslich 55%, die eine autologe Anti-CD19-CAR-Zelltherapie erhielten) nach der Randomisierung.
Acht Prozent (8%) der Patienten im YESCARTA-Arm erhielten nachfolgend eine zelluläre Immuntherapie ausserhalb des Prüfplans (einschliesslich 7%, die eine autologe Anti-CD19-CAR-Zelltherapie erhielten, und einschliesslich der 10 Patienten (6%), die eine wiederholte Behandlung mit YESCARTA erhielten).
Nachfolgende Stammzelltransplantation
Vier Prozent (4%) der Patienten im Standardtherapiearm bzw. 7% der Patienten im YESCARTA-Arm erhielten nachfolgend eine hochdosierte Therapie und autologe Stammzelltransplantation [HDT+ASZT], und 4% der Patienten im Standardtherapiearm bzw. 8% der Patienten im YESCARTA-Arm erhielten nachfolgend eine allogene Stammzelltransplantation (SZT).
Klinische Studie (ZUMA-5), Phase 2, rezidiviertes oder refraktäres FL
Die Wirksamkeit und Sicherheit von YESCARTA bei erwachsenen Patienten mit FL, die mit YESCARTA behandelt wurden, wurden in einer einarmigen, offenen, multizentrischen Phase-2-Studie an Patienten mit rezidiviertem oder refraktärem FL nach WHO-Klassifizierung von 2016 untersucht.
Für die Studie geeignete Patienten waren ≥18 Jahre alt und hatten nach 2 oder mehr vorherigen Therapielinien eine rezidivierte oder refraktäre Erkrankung.
Die vorherige Therapie musste einen gegen CD20 gerichteten monoklonalen Antikörper in Kombination mit einem alkylierenden Mittel umfassen (eine Monotherapie mit einem gegen CD20 gerichteten Antikörper zählte nicht als Therapielinie). Patienten mit SD (ohne Rezidiv) > 1 Jahr nach Abschluss der letzten Therapie waren ausgeschlossen. Patienten mit ZNS-Lymphomen, allogener SZT in der Anamnese oder vorheriger Therapie mit Anti-CD19-CAR- oder anderen genetisch modifizierten T-Zellen waren ausgeschlossen. Patienten mit ZNS-Erkrankungen (wie z.B. Krampfanfälle oder zerebrosvaskuläre Ischämie) in der Anamnese, einer Auswurffraktion des Herzens von weniger als 50% oder einer Sauerstoffsättigung bei Raumluft von weniger als 92% oder mit Autoimmunerkrankungen, die eine systemische Immunsuppression erfordern, waren nicht geeignet. Von der Studie ausgeschlossen waren Patienten mit aktiven oder schwerwiegenden Infektionen, transformierten Lymphomen oder Beteiligung des ZNS.
Zum Zeitpunkt der primären Analyse waren insgesamt 127 FL-Patienten in die Studie aufgenommen worden, einschliesslich 80 Patienten, die 3 oder mehr Therapielinien erhalten hatten, und bei allen war eine Leukapherese durchgeführt worden. Im Zeitraum zwischen dem Datenstichtag zur primären Analyse und dem Datenstichtag zur 24-Monats- Nachbeobachtungs-Analyse wurden keine zusätzlichen FL-Patienten eingeschlossen oder mit YESCARTA behandelt. Die tatsächliche Dauer der Nachbeobachtung betrug 26,55 Monate (Spanne: 0,3 bis 44,3 Monate, Studie noch laufend). Unter den 127 in die Studie aufgenommenen FL-Patienten hatten 80 Patienten 3 oder mehr vorherige Therapielinien erhalten. Die demografischen Daten in der Population, die 3 oder mehr vorherige Therapielinien erhalten hatte, stimmte mit der Gesamtpopulation überein. Eine Zusammenfassung der demografischen Patientendaten ist in Tabelle 6 angegeben.
Tabelle 6: Zusammenfassung der demografischen Daten für FL-Patienten aus ZUMA-5 (24-Monats-Analyse)
|
Kategorie
|
Alle Patienten mit Leukapherese ≥2 vorherige Therapielinien
(N = 127)
|
Alle Patienten mit Leukapherese mit ≥3 vorherige Therapielinien
(N = 80)
| |
Alter (Jahre)
| |
Median (min, max)
|
60 (34; 79)
|
60,5 (34; 79)
| |
≥65
|
31%
|
33%
| |
Männliches Geschlecht
|
59%
|
61%
| |
Ethnische Abstammung
| |
Weisse
|
92%
|
93%
| |
Asiaten
|
2%
|
4%
| |
Farbige
|
3%
|
3%
| |
ECOG-Status
| |
ECOG 0
|
62%
|
58%
| |
ECOG 1
|
38%
|
43%
| |
Hohe Tumorlast gemäss Definition der GELF-Kriterien
|
51%
|
56%
| |
Mediane Anzahl früherer Therapien (min, max)
|
3 (1; 10)
|
4 (3; 10)
| |
Patienten mit refraktärer Erkrankung gegen ≥2 frühere Therapielinien
|
29%
|
24%
| |
Patienten mit Krankheitsstadium III/IV
|
86%
|
88%
| |
Frühere Behandlung mit PI3K-Inhibitor
|
28%
|
43%
| |
Rezidiv < 24 Monate nach erster Anti-CD20-Kombinationschemotherapie
|
56%
|
54%
|
ECOG, Eastern Cooperative Oncology Group; GELF, Groupe d'Étude des Lymphomes Folliculaires.
YESCARTA wurde angewendet als einzelne intravenöse Infusion mit einer Zieldosis von 2 x 106 Anti-CD19-CAR-T-Zellen/kg nach einem Chemotherapieschema zur Lymphodepletion mit Cyclophosphamid 500 mg/m2 intravenös und Fludarabin 30 mg/m2 intravenös, beide verabreicht am 5., 4. und 3. Tag vor YESCARTA. Alle Patienten wurden zur Beobachtung über einen Zeitraum von mindestens 7 Tagen nach der YESCARTA-Infusion hospitalisiert. Die Verabreichung und Überwachung von YESCARTA in ZUMA-5 entspricht dem Vorgehen in ZUMA-1.
Die primäre Analyse wurde durchgeführt, als 84 nacheinander eingeschlossene FL-Patienten ab Beurteilung des ersten Ansprechens mindestens 12 Monate lang nachbeobachtet worden waren. Der primäre Endpunkt war die ORR. Sekundäre Endpunkte waren die CR-Rate, ORR und CR bei Patienten, die 3 oder mehr Therapielinien erhalten hatten, DOR, OS und progressionsfreies Überleben (progression-free survival, PFS) sowie die Inzidenz unerwünschter Ereignisse. Zum Zeitpunkt der primären Analyse wurden drei der 127 eingeschlossenen FL-Patienten nicht behandelt, aufgrund Verletzung der Einschlusskriterien oder Tod vor der Behandlung. Eine 24-Monats-Nachbeobachtungs-Analyse wurde durchgeführt, als 86 FL-Patienten nach der Infusion mindestens 24 Monate lang nachbeobachtet worden waren.
Zum Zeitpunkt der 24-Monats-Nachbeobachtungs-Analyse wurden keine zusätzlichen Patienten einer Leukapherese unterzogen bzw. mit YESCARTA behandelt. Die mediane Zeit von der Leukapherese bis zur Freigabe des Arzneimittels betrug 12 Tage (Spanne: 10 bis 37 Tage), von der Leukapherese bis zur Lieferung des Arzneimittels 17 Tage (Spanne: 13 bis 72 Tage) und von der Leukapherese bis zur YESCARTA-Infusion 27 Tage (Spanne: 19 bis 330 Tage): Die mediane Dosis betrug 2,0 x 106 Anti-CD19-CAR-T-Zellen/kg.
Unter den eingeschlossenen 127 FL-Patienten hatten 80 bereits 3 oder mehr Therapielinien erhalten. Die ORR betrug 91% und die CR-Rate 79%. Die mediane Zeit bis zum Ansprechen betrug 0,99 Monate (Spanne: 0,8 bis 3,1 Monate), die mediane DOR betrug 38,6 Monate und der Anteil der Responder, deren Ansprechen bis Monat 24 anhielt, betrug 55%. Eine Subgruppenanalyse umfasste die ORR bei Patienten, die refraktär waren (89%), sowie Patienten mit einem FLIPI-Score ≥3 (95%), einer hohen Tumorlast (91%), einer Krankheitsprogression innerhalb von 24 Monaten nach der ersten Immuntherapie (91%) und mit einer vorherigen Behandlung mit einem PI3K-Inhibitor (91%). Die wichtigsten Wirksamkeitsergebnisse für FL-Patienten mit 3 oder mehr vorherigen Therapielinien sind in Tabelle 7 zusammengefasst. Neunundzwanzig der 80 FL-Patienten, die 3 oder mehr Therapielinien erhalten hatten, erreichten anfangs eine PR, von denen 19 später eine CR erreichten.
Tabelle 7: Zusammenfassung der Wirksamkeitsergebnisse für FL-Patienten aus ZUMA-5 mit 3 oder mehr vorherigen Therapielinien (24-Monats-Analyse)
|
Kategorie
|
Alle Patienten mit einer Leukapherese
N = 80
| |
ORRa, (%) [95% KI]
|
91% [83; 96]
| |
CR, (%) [95% KI]
|
79% [68; 87]
| |
PR, (%) [95% KI]
|
13% [6; 22]
| |
DORb, Median in Monaten [95% KI]
|
38,6
| |
(Spanne)
|
(24,7; n.a.)
| |
Min, Max, DOR (Monate)
|
(0,0; 38.6)
| |
Anhaltendes Ansprechen (n)
|
44
| |
Rate des anhaltenden Ansprechensc % (95% KI)
|
| |
12 Monate
|
78,1 (66,2; 86,2)
| |
18 Monate
|
72,8 (60,2; 82,0)
| |
24 Monate
|
65,4 (51,2; 76,4)
| |
Progressionsfreies Überleben, Median, Monate [95% KI]
|
40,2 (26,6; n.a.)
| |
Gesamtüberleben, Median (Monate) [95% KI]
|
NE (40,2; n.a.)
| |
Gesamtüberleben, % [95% KI]
|
| |
12 Monate
|
96,2 (88,7; 98,8)
| |
18 Monate
|
91,1 (82,2; 95,7)
| |
24 Monate
|
85,2 (74,7; 91,5)
|
CR, vollständiges Ansprechen; DOR, Dauer des Ansprechens; KI, Konfidenzintervall; n.a., nicht abschätzbar; ORR, objektives Ansprechen; PR, Teilremission.
a. Gemäss der International Working Group Lugano Classification (Cheson 2014), beurteilt durch die unabhängige radiologische Prüfungskommission
b. Unter allen Respondern wird die DOR ab dem Datum des ersten objektiven Ansprechens bis zum Datum der Progression oder des Todes gemessen.
c. Gemessen ab dem Datum des ersten objektiven Ansprechens bis zum Datum der Progression oder des Todes.
|

