ZusammensetzungWirkstoffe
Fampridin.
Hilfsstoffe
Tablettenkern: Hypromellose, mikrokristalline Cellulose, hochdisperses Siliciumdioxid, Magnesiumstearat.
Tablettenüberzug: Hypromellose, Titandioxid (E171), Macrogol 400.
Indikationen/AnwendungsmöglichkeitenFampyra wird zur Verbesserung der Gehfähigkeit von erwachsenen Multiple Sklerose (MS) Patienten mit Gehbehinderung (EDSS 4,0–7,0) angewendet.
Dosierung/AnwendungFampyra ist verschreibungspflichtig und die Behandlung muss durch einen in der Behandlung von MS erfahrenen Arzt begonnen und überwacht werden.
Übliche Dosierung
Die empfohlene Dosis beträgt je eine 10 mg Retardtablette zweimal täglich, im Abstand von 12 Stunden (eine Retardtablette morgens und eine Retardtablette abends). Fampyra darf nicht häufiger oder in höheren Dosen als empfohlen eingenommen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Retardtabletten sind auf nüchternen Magen einzunehmen (siehe «Pharmakokinetik»).
Beginn und Beurteilung der Behandlung mit Fampyra
·Die Erstverordnung sollte auf eine zwei- bis vierwöchige Therapie begrenzt sein, da ein klinischer Behandlungserfolg im Allgemeinen innerhalb von zwei bis vier Wochen nach Behandlungsbeginn mit Fampyra erkennbar sein sollte.
·Zur Beurteilung der Verbesserung nach zwei bis vier Wochen wird die Bewertung der Gehfähigkeit, z.B. durch die Durchführung des Timed 25 Foot Walk-Tests (T25FW), oder die Anwendung der Bewertungsskala Twelve Item Multiple Sclerosis Walking Scale (MSWS-12) empfohlen. Wenn keine Verbesserung beobachtet wird, sollte Fampyra abgesetzt werden.
·Fampyra sollte abgesetzt werden, wenn Patienten keine ausreichende Wirkung berichten.
Wiederholte Beurteilung der Behandlung mit Fampyra
·Wenn der Arzt beobachtet, dass sich die Gehfähigkeit wieder verschlechtert, sollte er eine Unterbrechung der Behandlung in Betracht ziehen und die Wirkung von Fampyra erneut bewerten (siehe oben). Die Neubewertung sollte ein Absetzen von Fampyra und eine Beurteilung der Gehfähigkeit umfassen.
·Fampyra sollte abgesetzt werden, wenn Patienten keine weiteren positiven Wirkungen auf das Gehen erfahren.
·Fampyra muss bei Patienten, die während der Behandlung einen Krampfanfall erleiden, abgesetzt werden (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Nützlicher Labortest zur Überwachung der Patienten
Eine Untersuchung der Nierenfunktion zu Beginn der Behandlung wird empfohlen.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Fampridin wurde nicht bei Patienten mit Leberfunktionsstörungen untersucht. Fampridin wird hauptsächlich über die Niere als unverändertes Arzneimittel eliminiert und es ist nicht zu erwarten, dass eine Beeinträchtigung der Leber die Pharmakokinetik von Fampridin oder die empfohlene Dosis signifikant beeinflusst.
Patienten mit Nierenfunktionsstörungen
Fampyra ist bei Patienten mit mittelschwerer und schwerer Nierenfunktionsstörung (Kreatinin-Clearance <50 ml/min) kontraindiziert (siehe «Kontraindikationen»).
Ältere Patienten
Bei älteren Patienten sollte vor Beginn der Behandlung mit Fampyra die Nierenfunktion überprüft werden. Zur Erkennung einer etwaigen Nierenfunktionsstörung wird bei älteren Patienten eine regelmässige Kontrolle der Nierenfunktion empfohlen (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Fampridin wurde bei Kindern und Jugendlichen unter 18 Jahren nicht geprüft. Es liegen keine Daten vor. Eine Behandlung sollte in dieser Population nicht erfolgen.
Versäumte Einnahme
Das empfohlene Dosierschema sollte immer eingehalten werden. Wenn eine Dosis versäumt wird, darf keine doppelte Dosis eingenommen werden.
Art der Anwendung
Fampyra ist zur oralen Anwendung bestimmt. Die Retardtabletten müssen als Ganzes geschluckt werden. Die Retardtabletten dürfen nicht zerteilt, zerkleinert, aufgelöst, gelutscht oder gekaut werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Gleichzeitige Behandlung mit anderen Arzneimitteln, die Fampridin (4-Aminopyridin) enthalten.
Patienten mit Krampfanfällen in der Vorgeschichte oder Patienten, die gegenwärtig an Krampfanfällen leiden.
Patienten mit mässiger oder schwerer Nierenfunktionsstörung (Kreatinin-Clearance <50 ml/min).
Gleichzeitige Behandlung mit Fampyra und Inhibitoren des organischen Kationentransporters 2 (OCT2), wie z.B. Cimetidin.
Warnhinweise und VorsichtsmassnahmenFampyra sollte nicht in höheren als der empfohlenen Dosis von 10 mg zweimal täglich im Abstand von ungefähr 12 Stunden eingenommen werden.
Risiko für Krampfanfälle
Die Behandlung mit Fampridin erhöht das Risiko für Krampfanfälle (siehe «Kontraindikationen», «Unerwünschte Wirkungen»).
In klinischen Studien mit Fampyra wurde eine dosisabhängige Erhöhung des Risikos für Krampfanfälle in höheren als der empfohlenen Dosis von 10 mg zweimal täglich beobachtet. Deshalb sollte die empfohlene Tagesdosis von Fampyra, 10 mg zweimal täglich im Abstand von 12 Stunden, nicht überschritten werden.
Wenn Faktoren vorliegen, die die Krampfanfallschwelle herabsetzen können, muss Fampyra mit Vorsicht angewendet werden.
Fampyra muss bei Patienten, die während der Behandlung einen Krampfanfall erleiden, abgesetzt werden.
Nierenfunktionsstörungen
Fampridin wird hauptsächlich unverändert über die Nieren ausgeschieden. Patienten mit Niereninsuffizienz haben höhere Plasmakonzentrationen, die zu vermehrten unerwünschten Reaktionen, insbesondere zu unerwünschten neurologischen Wirkungen, führen können.
Die Bestimmung der Nierenfunktion vor der Behandlung und ihre regelmässige Kontrolle während der Behandlung wird für alle Patienten empfohlen (insbesondere für ältere Patienten, deren Nierenfunktion eingeschränkt sein kann). Die Kreatinin-Clearance kann mit der Cockcroft-Gault-Formel berechnet werden. Fampyra darf bei Patienten mit mässiger oder schwerer Nierenfunktionsstörung (Kreatinin-Clearance <50 ml/min) nicht angewendet werden (siehe «Kontraindikationen»).
Bei Patienten mit leichter Nierenfunktionsstörung (Kreatinin-Clearance 50 bis 80 ml/min) sollte Fampyra mit Bedacht eingesetzt und eine regelmässige Kontrolle der Nierenfunktion in Erwägung gezogen werden.
Vorsicht ist geboten, wenn Fampyra zusammen mit Arzneimitteln verordnet wird, die OCT2-Substrate sind, wie z.B. Carvedilol, Propranolol und Metformin.
Gleichzeitige Behandlung mit anderen Formen von Fampridin / 4-Aminopyridin
Fampyra darf nicht gleichzeitig mit anderen Formen von 4-Aminopyridin eingenommen werden (siehe «Kontraindikationen»).
Überempfindlichkeitsreaktionen
Nach Markteinführung gab es Berichte über schwerwiegende Überempfindlichkeitsreaktionen (einschliesslich anaphylaktischer Reaktion), wobei ein Grossteil dieser Fälle in der ersten Behandlungswoche auftrat. Besondere Vorsicht ist geboten bei Patienten mit allergischen Reaktionen in der Vorgeschichte. Bei Auftreten einer anaphylaktischen oder sonstigen schweren allergischen Reaktion sollte Fampyra abgesetzt und die Behandlung nicht wieder aufgenommen werden.
Weitere Warnhinweise und Vorsichtsmassnahmen
Fampyra ist bei Patienten mit kardiovaskulären Rhythmusstörungen und sinuatrialen oder atrioventrikulären Erregungsleitungsstörungen mit Vorsicht anzuwenden (diese Wirkungen sind bei einer Überdosierung zu beobachten).
Das vermehrte Auftreten von Schwindel und Gleichgewichtsstörungen unter Fampyra kann zu einem erhöhten Sturzrisiko führen. Patienten sollten bei Bedarf Gehhilfen benutzen.
In klinischen Studien wurden bei 2,1% der Patienten unter Fampyra niedrige Leukozytenzahlen festgestellt, verglichen mit 1,9% der Patienten unter Placebo. Ferner wurden in den klinischen Studien Infektionen beobachtet (siehe «Unerwünschte Wirkungen»). Eine erhöhte Infektionsrate sowie eine Beeinträchtigung der Immunantwort können nicht ausgeschlossen werden.
InteraktionenStudien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
Die gleichzeitige Behandlung mit anderen Arzneimitteln, die Fampridin (4-Aminopyridin) enthalten, ist kontraindiziert (siehe «Kontraindikationen»).
Fampridin wird in unveränderter Form aktiv über die Nieren ausgeschieden (siehe unter «Pharmakokinetik»). Es besteht die theoretische Möglichkeit einer Wechselwirkung mit anderen renal ausgeschiedenen Arzneimitteln.
Einfluss anderer Substanzen auf die Pharmakokinetik von Fampridin
Organic Cation Transporter 2 (OCT2)
Fampridin wird überwiegend über die Nieren ausgeschieden, wobei die aktive Nierenausscheidung ca. 60% ausmacht (siehe unter «Pharmakokinetik»). OCT2 ist der für die aktive Ausscheidung von Fampridin verantwortliche Transporter. Daher ist die gleichzeitige Behandlung mit Fampridin und OCT2-Inhibitoren, wie z.B. Cimetidin, kontraindiziert (siehe «Kontraindikationen») und es wird vor gleichzeitiger Anwendung von Fampridin und Arzneimitteln, die Substrate von OCT2 sind, wie beispielsweise Carvedilol, Propranolol und Metformin, gewarnt.
In-vitro-Studien haben gezeigt, dass Fampridin ein Substrat und schwacher Inhibitor von OCT2 ist (IC50 67 µM).
Cimetidin
In einer klinischen Einzeldosisstudie erhielten 23 gesunde Probanden den OCT2-Inhibitor Cimetidin 400 mg alle 6 Stunden und gleichzeitig eine Einzeldosis Fampridin 10 mg. Das Test-Referenz Verhältnis für den AUC-Wert war 125,1% (90% KI: 120,5%, 129,8%) aufgrund einer Verringerung der Clearance von Fampridin. Es wird nicht erwartet, dass dieser Anstieg der systemischen Exposition klinisch von Bedeutung ist.
Einfluss von Fampridin auf die Pharmakokinetik anderer Substanzen
CYP2E1
Es gab Hinweise auf eine direkte Hemmung von CYP2E1 durch Fampridin bei einer Konzentration von 30 μM (etwa 12% Hemmung), was etwa der 100-fachen durchschnittlichen Fampridin-Plasmakonzentration entspricht, die nach Einnahme einer 10 mg Retardtablette gemessen wird.
Interferon
Fampridin wurde gleichzeitig mit Interferon-beta angewendet und es wurden keine pharmakokinetischen Arzneimittelwechselwirkungen beobachtet.
Baclofen
Fampridin wurde gleichzeitig mit Baclofen angewendet und es wurden keine pharmakokinetischen Arzneimittelwechselwirkungen beobachtet.
P-Glycoproteintransporter
In-vitro-Studien zeigten, dass Fampridin kein Substrat oder Inhibitor des P-Glycoproteintransporters ist. Es ist unwahrscheinlich, dass Fampridin die Pharmakokinetik von Arzneimitteln beeinflusst, die Substrate für den P-Glykoproteintransporter sind. Es ist unwahrscheinlich, dass die Pharmakokinetik von Fampridin von Arzneimitteln beeinflusst wird, die Inhibitoren des P-Glykoproteintransporters sind.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Fampridin bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Aus Vorsichtsgründen soll Fampyra während der Schwangerschaft oder bei Patientinnen im gebärfähigen Alter ohne Empfängnisverhütung nicht angewendet werden, es sei denn, es ist klar notwendig.
Stillzeit
Es ist nicht bekannt, ob Fampridin beim Menschen oder bei Tieren in die Muttermilch übergeht. Die Anwendung von Fampyra während der Stillzeit wird nicht empfohlen. Es soll entschieden werden, ob das Stillen abgebrochen oder die Einnahme des Arzneimittels unterbrochen werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Fertilität
In tierexperimentellen Studien wurden keine Auswirkungen auf die Fertilität beobachtet (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Da die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durch ZNS-bedingte unerwünschte Wirkungen wie Schwindelgefühl, Vertigo und Krampfanfälle beeinträchtigt werden können, ist Vorsicht geboten.
Unerwünschte WirkungenDie Sicherheit von Fampyra wurde in randomisierten kontrollierten klinischen Studien, in offenen Langzeitstudien und nach der Markteinführung beurteilt.
Unerwünschte Reaktionen sind meistens neurologischer Art und umfassen Krampfanfälle, Schlaflosigkeit, Angst, Gleichgewichtsstörungen, Schwindelgefühl, Parästhesien, Tremor, Kopfschmerzen und Asthenie. Dies entspricht der pharmakologischen Wirkung von Fampridin. Unter den unerwünschten Wirkungen, die in placebokontrollierten Studien an Patienten mit Multipler Sklerose, die Fampyra in der empfohlenen Dosis erhielten, berichtet wurden, hatte Harnwegsinfektion die höchste Inzidenz (bei ca. 12% der Patienten).
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
«Sehr häufig» (≥1/10)
«häufig» (≥1/100, <1/10)
«gelegentlich» (≥1/1000, <1/100)
«selten» (≥1/10'000, <1/1000)
«sehr selten» (<1/10'000)
«nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden)
Innerhalb jeder Häufigkeitsklasse werden die unerwünschten Wirkungen nach abnehmendem Schweregrad geordnet.
Infektionen und parasitäre Erkrankungen
Sehr häufig: Harnwegsinfektionen (12% Fampridin 10 mg; 8,4% Placebo).
Häufig: Influenza1, Nasopharyngitis1, Virusinfektion1.
Erkrankungen des Immunsystems
Gelegentlich: Anaphylaxie, Angioödem, Überempfindlichkeit.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit, Angstzustände.
Erkrankungen des Nervensystems
Häufig: Schwindelgefühl, Kopfschmerzen, Gleichgewichtsstörungen, Parästhesie, Tremor, Vertigo.
Gelegentlich: Krampfanfall, de novo Symptome oder Exazerbation einer Trigeminusneuralgie.
Herzerkrankungen
Häufig: Palpitationen.
Gelegentlich: Tachykardie.
Gefässerkrankungen
Gelegentlich: Hypotonie2.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe, pharyngolaryngeale Schmerzen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Verstopfung, Dyspepsie.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Ausschlag, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Rückenschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Asthenie.
Gelegentlich: Brustkorbbeschwerden2.
1 Siehe «Warnhinweise und Vorsichtsmassnahmen»
2 Diese Symptome wurden im Rahmen von Überempfindlichkeit beobachtet.
Unerwünschte Wirkungen aus der Postmarketingphase
Krampfanfall
Nach Markteinführung gab es Berichte über gelegentlich auftretende Krampfanfälle. Weitere Informationen zu dem Risiko für Krampfanfälle sind in «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen» enthalten.
Die Untersuchung der Ereignisse bei Patienten aus der Studie 218MS401 nach Markteinführung, in der die Sicherheit an 4646 MS-Patienten überprüft wurde, darunter Patienten mit Krampfanfällen in der Anamnese, Patienten mit leichter Nierenfunktionsstörung, Patienten, welche gleichzeitig andere 4-AP-Formulierungen, OCT2-Inhibitoren, OCT2-Substrate, die Anfallsschwelle herabsetzende Medikamente und Antiepileptika/Antikonvulsiva einnahmen, zeigte, dass Art und Umfang der Ereignisse bei diesen Subpopulationen weitestgehend denen der gesamten, mit Fampyra behandelten Sicherheitspopulation entsprach.
Überempfindlichkeit
Nach Markteinführung gab es Berichte über Überempfindlichkeitsreaktionen (einschliesslich Anaphylaxie), die zusammen mit einer oder mehreren der folgenden Nebenwirkungen auftraten: Dyspnoe, Brustkorbbeschwerden, Hypotonie, Angioödem, Ausschlag und Urtikaria. Weitere Informationen zu Überempfindlichkeitsreaktionen sind unter «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen» enthalten.
Ältere Patienten
Bei der Analyse nach Markteinführung anhand der Studie 218MS401, bei der Daten von 589 mit Fampridin behandelten MS-Patienten ≥65 Jahren ausgewertet wurden, die insgesamt 392,1 Patientenjahre repräsentierten, zeigte sich, dass die am häufigsten gemeldeten TEAEs (Treatment Emergent Adverse Events; behandlungsbedingte unerwünschte Ereignisse) bei Patienten <65 Jahren und Patienten ≥65 Jahren in etwa den am häufigsten gemeldeten TEAEs der gesamten mit Fampyra behandelten Sicherheitspopulation entsprachen.
Spezialpopulationen
Trigeminusneuralgie
Bei Patienten mit einer Trigeminusneuralgie in der Vorgeschichte wurde über eine Exazerbation der Trigeminusneuralgie nach Markteinführung berichtet. Dies trat grösstenteils im ersten Monat nach Behandlungsbeginn auf. Nach Absetzen von Fampyra besserten oder erloschen die Symptome gänzlich, mit oder ohne pharmakologische Behandlung der Trigeminusneuralgie. Es gibt auch Berichte über de novo Symptome einer Trigeminusneuralgie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Akute Symptome einer Überdosierung stimmten mit einer Erregung des zentralen Nervensystems überein und umfassten Schwindelgefühl, Verwirrtheit, Nervosität, Schweissabsonderung, Krampfanfälle und Amnesie. Die Schwere der Symptome stand in der Regel eng mit der pharmakokinetischen Exposition in Zusammenhang.
Das Zentralnervensystem betreffende unerwünschte Wirkungen, die bei hohen Dosen von 4-Aminopyridin auftraten, waren Verwirrtheit, Krampfanfälle, Status epilepticus, unwillkürliche und choreoathetoide Bewegungen. Andere unerwünschte Wirkungen bei hohen Dosen waren Herzrhythmusstörungen (beispielsweise supraventrikuläre Tachykardie und Bradykardie) und ventrikuläre Tachykardie als Folge einer möglichen QT-Verlängerung. Es liegen auch Berichte über Hypertonie vor.
Behandlung
Patienten, die eine Überdosis eingenommen haben, sollten unterstützend behandelt werden. Wiederholte Krampfanfälle sollten mit Benzodiazepinen, Phenytoin oder anderen angemessenen Massnahmen gegen akute Krampfanfälle behandelt werden.
Eigenschaften/WirkungenATC-Code
N07XX07
Wirkungsmechanismus
Fampyra ist ein Kaliumkanalblocker. Durch Blockierung der Kaliumkanäle verringert Fampyra das Austreten von Ionenstrom durch diese Kanäle, verlängert so die Repolarisation und verstärkt die Aktionspotentialbildung in demyelinisierten Axonen sowie die neurologische Funktion. Vermutlich werden durch die Verstärkung der Aktionspotentialbildung mehr Impulse im zentralen Nervensystem weitergeleitet.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
Die Wirksamkeit von Fampridin Retardtabletten (10 mg zweimal täglich) zur Verbesserung der Gehfähigkeit bei Patienten mit Gehbehinderung bei allen schubförmig-remittierenden und progressiven Formen der MS wurde in drei randomisierten, doppelblinden, placebokontrollierten, konfirmatorischen Studien der Phase III untersucht (MS-F203, MS-F204 und 218MS305). Der Anteil der Patienten, die eine Verbesserung der Gehfähigkeit zeigten, war unabhängig von einer begleitenden immunmodulatorischen Therapie (einschliesslich Interferone, Glatirameracetat, Fingolimod und Natalizumab). Es wurden keine Unterschiede in der Wirksamkeit basierend auf dem Ausmass der Gehbehinderung, des Alters, dem Geschlecht oder dem Body-Mass-Index festgestellt. Responder / Non-Responder konnten im Allgemeinen innerhalb von 2-4 Wochen nach Behandlungsbeginn identifiziert werden.
Studien MS-F203 und MS-F204
Der primäre Endpunkt in den Studien MS-F203 und MS-F204 war die Ansprechrate im Hinblick auf die Gehgeschwindigkeit, gemessen mit dem «Timed 25 Foot Walk»-Test (T25FW). Ein Responder war definiert als Patient, der bei mindestens drei von vier möglichen Kontrollen in der Doppelblindphase eine konsistent höhere Gehgeschwindigkeit zeigte, als im Vergleich zu dem bei fünf Kontrollen ohne Behandlung erreichten Höchstwert.
Im Vergleich zu Placebo wurden signifikant mehr Patienten, die mit Fampyra 10 mg zweimal täglich behandelt wurden, als Responder gewertet (MS-F203: 34,8% vs. 8,3%, p<0,001; MS-F204: 42,9% vs. 9,3%, p<0,001).
Bei Patienten, die auf Fampyra ansprachen, erhöhte sich die Gehgeschwindigkeit durchschnittlich um 26,3% vs. 5,3% unter Placebo (p<0,001) (MS-F203) und 25,3% vs. 7,8% (p<0,001) (MS-F204).
Die Verbesserung zeigte sich rasch (innerhalb weniger Wochen) nach Beginn der Behandlung mit Fampyra.
Es wurden statistisch und klinisch bedeutsame Verbesserungen der Gehfähigkeit beobachtet, wobei die Messung auf der 12 Elemente umfassenden Gehskala für Multiple Sklerose erfolgte.
Tabelle 1: Studien MS-F203 und MS-F204
|
STUDIE *
|
MS-F203
|
MS-F204
| |
|
Placebo
|
Fampyra
10 mg BID
|
Placebo
|
Fampyra
10 mg BID
| |
Anzahl Patienten
|
72
|
224
|
118
|
119
| |
Stetige Verbesserung
|
8,3%
|
34,8%
|
9,3%
|
42,9%
| |
Unterschied
|
|
26,5%
|
|
33,5%
| |
CI95%
|
|
17,6%, 35,4%
|
|
23,2%, 43,9%
| |
p-Wert
|
|
<0.001
|
|
<0.001
| |
≥20% Verbesserung
|
11,1%
|
31,7%
|
15,3%
|
34,5%
| |
Unterschied
|
|
20,6%
|
|
19,2%
| |
CI95%
|
|
11,1%, 30,1%
|
|
8,5%, 29,9%
| |
p-Wert
|
|
<0,001
|
|
<0,001
| |
Gehgeschwindigkeit
Fuss/Sek.
|
Fuss pro Sek.
|
Fuss pro Sek.
|
Fuss pro Sek.
|
Fuss pro Sek.
| |
Ausgangswert
|
2,04
|
2,02
|
2,21
|
2,12
| |
Endpunkt
|
2,15
|
2,32
|
2,39
|
2,43
| |
Veränderung
|
0,11
|
0,30
|
0,18
|
0,31
| |
Unterschied
|
0,19
|
0,12
| |
p-Wert
|
0,010
|
0,038
| |
Durchschnittliche Veränderung in %
|
5,24
|
13,88
|
7,74
|
14,36
| |
Unterschied
|
8,65
|
6,62
| |
p-Wert
|
<0,001
|
0,007
| |
MSWS-12-Wert (Mittelwert, SEM)
| |
Ausgangswert
|
69,27 (2,22)
|
71,06 (1,34)
|
67,03 (1,90)
|
73,81 (1,87)
| |
Durchschnittliche Veränderung
|
-0,01 (1,46)
|
-2,84 (0,878)
|
0,87 (1,22)
|
-2,77 (1,20)
| |
Unterschied
|
2,83
|
3,65
| |
p-Wert
|
0,084
|
0,021
| |
LEMMT (Mittelwert, SEM)
(Manueller Muskeltest der unteren Extremitäten)
| |
Ausgangswert
|
3,92 (0,070)
|
4,01 (0,042)
|
4,01 (0,054)
|
3,95 (0,053)
| |
Durchschnittliche Veränderung
|
0,05 (0,024)
|
0,13 (0,014)
|
0,05 (0,024)
|
0,10 (0,024)
| |
Unterschied
|
0,08
|
0,05
| |
p-Wert
|
0,003
|
0,106
| |
Ashworth-Score
(Test auf Muskel-Spastizität)
| |
Ausgangswert
|
0,98 (0,078)
|
0,95 (0,047)
|
0,79 (0,058)
|
0,87 (0,057)
| |
Durchschnittliche Veränderung
|
-0,09 (0,037)
|
-0,18 (0,022)
|
-0,07 (0,033)
|
-0,17 (0,032)
| |
Unterschied
|
0,10
|
0,10
| |
p-Wert
|
0,021
|
0,015
|
Studie 218MS305
Die Studie 218MS305 wurde an 636 Patienten mit Multipler Sklerose und Gehbehinderung durchgeführt. Die Dauer der doppelblinden Behandlung betrug 24 Wochen. Im Anschluss an die Behandlung erfolgte eine 2wöchige Nachbeobachtung. Der primäre Endpunkt war eine Verbesserung der Gehfähigkeit, gemessen als Anteil an Patienten mit einer mittleren Verbesserung des MSWS-12-Wertes um ≥8 Punkte gegenüber dem Ausgangswert über eine Zeitdauer von 24 Wochen. In dieser Studie bestand ein statistisch signifikanter Behandlungsunterschied und im Vergleich zu den mit Placebo kontrollierten Patienten zeigte ein grösserer Anteil der mit Fampyra behandelten Patienten eine Verbesserung der Gehfähigkeit (relatives Risiko von 1,38 (95% KI: [1,06, 1,70]). Die Verbesserungen zeigten sich im Allgemeinen innerhalb von 2 bis 4 Wochen nach Einleitung der Behandlung und verschwanden wieder innerhalb von 2 Wochen nach dem Absetzen der Behandlung.
Die mit Fampyra behandelten Patienten zeigten ausserdem eine statistisch signifikante Verbesserung beim Timed Up and Go (TUG)-Test, einem Test zur Beurteilung des statischen und dynamischen Gleichgewichts und der körperlichen Mobilität. Bei diesem sekundären Endpunkt erreichte ein grösserer Anteil der mit Fampyra behandelten Patienten eine mittlere Verbesserung der TUG-Geschwindigkeit um ≥15% gegenüber dem Ausgangswert über eine Zeitdauer von 24 Wochen verglichen mit Placebo. Der Unterschied bei der Berg-Balance-Skala (BBS, einer Skala zur Bewertung des statischen Gleichgewichts) war statistisch nicht signifikant.
Darüber hinaus zeigten Patienten mit Fampyra-Behandlung eine statistisch signifikante mittlere Verbesserung des Körper-Scores der Multiple Sclerosis Impact Scale (MSIS-29) im Vergleich zu Placebo (LSM-Unterschied -3,31, p<0,001).
Tabelle 2: Studie 218MS305
|
24-Wochen-Zeitraum
|
Placebo
N = 318*
|
Fampyra 10 mg
2x täglich
N = 315*
|
Unterschied (95% KI)
p–Wert
| |
Anteil an Patienten mit einer mittleren Verbesserung des MSWS-12-Scores um ≥8 Punkte gegenüber dem Ausgangswert
|
34%
|
43%
|
Risikodifferenz: 10,4%
(3%; 17,8%)
0,006
| |
MSWS-12-Wert
| |
Ausgangswert
|
65,4
|
63,6
|
LSM: -4,14
(-6,22; -2,06)
<0,001
| |
Verbesserung gegenüber dem Ausgangswert
|
-2,59
|
-6,73
| |
TUG
| |
Anteil an Patienten mit einer mittleren Verbesserung der TUG-Geschwindigkeit um ≥15%
|
35%
|
43%
|
Risikodifferenz: 9,2%
(0,9%; 17,5%)
0,03
| |
TUG
| |
Ausgangswert
|
27,1
|
24,9
|
LSM:-1,36
(-2,85; 0,12)
0,07
| |
Verbesserung gegenüber dem Ausgangswert
|
-1,94
|
-3,3
| |
MSIS-29 Körperscore
| |
Ausgangswert
|
55,3
|
52,4
|
LSM: -3,31
(-5,13; -1,50)
<0,001
| |
Verbesserung gegenüber dem Ausgangswert
|
-4,68
|
-8,00
| |
BBS-Wert
| |
Ausgangswert
|
40,2
|
40,6
|
LSM: 0,41
(-0,13; 0,95)
0,141
| |
Verbesserung gegenüber dem Ausgangswert
|
1,34
|
1,75
|
*Intent-to-Treat-Kollektiv = 633; LSM = Mittelwert der kleinsten Quadrate
Abbildung 1: Veränderung des MSWS-12 Scores im Zeitverlauf (LS Mean, ITT Population)
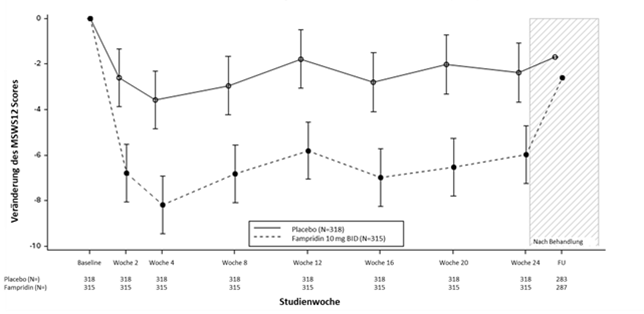
Für fehlende Datenpunkte bei Post-Baseline Besuchen wurde Multiple Imputation angewendet, ausser bei FU wo beobachtete Daten verwendet wurden.
Hinweise:
1.Die Baseline ist definiert als Mittelwert der Screening und Tag 1 Besuche.
2.Durchgezogene Linien bezeichnen den Standardfehler für die mittlere LS-Änderung bei jedem Besuch. Für FU wurde der Mittelwert aufgetragen.
3.Der LS-Mittelwert und der Standardfehler basieren auf dem MMRM-Modell unter Verwendung einer üblichen Varianz-AR (1) -Varianz-Covarianz Matrixstruktur. Behandlung, Zeit und Behandlung nach Zeitinteraktion wurden als erklärende Variablen in das Modell aufgenommen, wobei EDSS, Baseline MSWS-12, Baseline TUG-Geschwindigkeit, Alter und vorangehende Aminopyridin Einnahme als Kovariaten angepasst wurden.
4.Eine negative Veränderung zeigt eine Verbesserung des Gehens an.
Abkürzungen: MSWS-12 = Multiple Sclerosis Walking Scale-12; MMRM = Mixed model for repeated measures; FU = 2 Wochen Follow-up; LS = Least Squares.
Studie 218MS401
Bei der Studie 218MS401 handelte es sich um eine multinationale Phase-IV-Beobachtungsstudie zur Sicherheit und Wirksamkeit von Fampyra in der alltäglichen medizinischen Praxis. Die Studienpopulation umfasste 4646 MS-Patienten (65,75% weiblich; medianes Alter 52,6 Jahre).
Insgesamt entsprach das in dieser Studie beobachtete Sicherheitsprofil (Langzeitsicherheit für bis zu 12 Monate) dem bekannten Sicherheitsprofil von Fampyra und es ergaben sich keine neuen Sicherheitsbedenken.
Die Analyse der Wirksamkeitsdaten nach Markteinführung in Studie 218MS401 zeigte, dass die Langzeitbehandlung mit Fampyra (für bis zu 12 Monate) beständige Verbesserungen der Patienteneinschätzungen zum physischen und psychischen Wohlbefinden gemäss MSIS-29 und der ärztlichen CGI I-Bewertung in Bezug auf das Gehvermögen erbrachten.
PharmakokinetikAbsorption
Fampridin wird nach oraler Anwendung rasch und vollständig aus dem Gastrointestinaltrakt absorbiert. Fampridin ist ein Wirkstoff mit enger therapeutischer Breite. Die absolute Bioverfügbarkeit von Fampyra Retardtabletten wurde nicht untersucht; die relative Bioverfügbarkeit (im Vergleich zu einer wässrigen oralen Lösung) beträgt 95%. Die Fampyra Retardtablette bewirkt eine Verzögerung der Absorption von Fampridin im Vergleich zu einer Formulierung von Fampyra in Lösung. Dies bewirkt einen langsameren Anstieg zu einer niedrigeren Spitzenkonzentration ohne Auswirkung auf die Absorptionsrate.
Bei Einnahme von Fampyra Retardtabletten zusammen mit Nahrungsmitteln beträgt die Verringerung der Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC0-∞) von Fampridin etwa 2-7% (10 mg-Dosis). Diese geringfügige Verringerung der AUC sollte nicht mit einer Verschlechterung der Wirksamkeit einhergehen. Der Anstieg der Cmax beträgt zwischen 15 und 23%. Da es einen klaren Zusammenhang zwischen Cmax und den Nebenwirkungen gibt, wird empfohlen, Fampyra nüchtern einzunehmen.
Distribution
Fampridin ist ein fettlöslicher Wirkstoff und überwindet leicht die Blut-Hirnschranke. Fampridin wird grösstenteils nicht an Plasmaproteine gebunden (97-99%) und weist ein Verteilungsvolumen von 2,6 l/kg auf.
Metabolismus
Fampridin wird durch Oxidation zu 3-Hydroxy-4-Aminopyridin metabolisiert und weiter zu 3-Hydroxy-4-Aminopyridinsulfat konjugiert. In vitro wurde keine pharmakologische Wirkung der Fampridin-Metaboliten gegenüber selektierten Kaliumkanälen festgestellt.
Die 3-Hydroxylierung von Fampridin zu 3-Hydroxy-4-Aminopyridin durch humane Lebermikrosomen wird durch zwei oder mehr Enzyme mit unterschiedlicher Kinetik katalysiert. Ausgehend von Korrelationsanalysen, chemischen Inhibitionsstudien und Inkubation mit rekombinanten humanen CYP-Enzymen, ist Cytochrom P450 Isoenzym 2E1 (CYP2E1) das wichtigste für die 3-Hydroxylierung von Fampridin verantwortliche Enzym.
Die Behandlung von gezüchteten menschlichen Hepatozyten mit Fampridin hatte eine geringe bis gar keine Wirkung auf die Induktion der Enzymaktivitäten von CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2E1 oder CYP3A4/5.
Elimination
Den Haupteliminierungsweg für Fampridin stellt die renale Exkretion dar, wobei etwa 90% der Dosis innerhalb von 24 Stunden als unveränderter Wirkstoff im Urin gefunden wird. Die renale Clearance (CLR 370 ml/min) ist aufgrund der kombinierten glomerulären Filtration und aktiven Ausscheidung durch den renalen OCT2-Transporter wesentlich höher als die glomeruläre Filtrationsrate. Die fäkale Exkretion beläuft sich auf weniger als 1% der verabreichten Dosis.
Linearität/Nicht-Linearität
Fampyra ist durch eine lineare (dosisproportionale) Pharmakokinetik mit einer terminalen Eliminationshalbwertszeit von ca. 6 Stunden gekennzeichnet. Die maximale Plasmakonzentration (Cmax) und zu einem geringeren Umfang die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) nimmt proportional zur Dosis zu. Bei Patienten mit normaler Nierenfunktion gibt es bei Einnahme der empfohlenen Dosis keine Hinweise auf eine klinisch relevante Akkumulation von Fampridin. Bei Patienten mit einer Nierenfunktionsstörung erfolgt die Akkumulation relativ zum Grad der Funktionsstörung.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Fampridin wird primär als unveränderter Wirkstoff über die Nieren ausgeschieden. Bei Patienten, deren Nierenfunktion beeinträchtigt sein könnte, sollte deshalb die Nierenfunktion kontrolliert werden. Es kann davon ausgegangen werden, dass die Konzentrationen von Fampridin bei Patienten mit leichter Nierenfunktionsstörung ca. 1,7- bis 1,9mal höher sind als bei Patienten mit normaler Nierenfunktion. Fampyra ist bei Patienten mit mittelschwerer und schwerer Niereninsuffizienz (siehe «Kontraindikationen») kontraindiziert.
Ältere Patienten
Fampyra wird überwiegend unverändert über die Nieren ausgeschieden, und da sich die Kreatinin-Clearance bekanntermassen mit zunehmendem Alter verringert, sollte bei älteren Patienten eine Kontrolle der Nierenfunktion in Erwägung gezogen werden (siehe «Dosierung/Anwendung»).
Kinder und Jugendliche
Es liegen keine Daten vor.
Geschlecht
Populationspharmakokinetik zeigte, dass die Plasmakonzentration von Fampridin bei weiblichen Patienten im Vergleich zu männlichen Patienten moderat höher war. Dieser moderate Unterschied macht keine Dosisanpassung erforderlich.
Ethnizität
Es gibt nicht genügend Daten über nicht-kaukasische Patienten, um den Effekt der ethnischen Zugehörigkeit auf die Pharmakokinetik von Fampyra zu bewerten.
Präklinische DatenBasierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, Reproduktions- und Entwicklungstoxizität lassen präklinischen Daten keine speziellen Gefahren für den Menschen erkennen.
Sicherheitspharmakologie
Fampridin zeigt keine sicherheitsrelevanten Auswirkungen auf das Herz-Kreislaufsystem bzw. die Atemfunktionen.
Eine pharmakokinetische (PK)-pharmakodynamische (PD) Studie mit Nagetieren untersuchte mittels Elektroenzephalographie (EEG) die Wirkungsschwelle von Fampridin auf die Aktivität des ZNS. In diesem Experiment betrug die Schwellenwert-Plasmakonzentration für die ZNS-Toxizität 109 bis 135 ng/ml, welche durch potenziell subklinische seizurogene Veränderungen in EEGs ermittelt wurde. Dies entspricht einer Exposition des 3,4 bis 4,2-fachen der maximal empfohlenen Dosis von 10 mg BID beim Menschen.
Toxizität bei wiederholter Gabe
Studien zur Toxizität bei Mehrfachdosierung von bis zu einem Jahr offenbarten das ZNS in Ratten und Hunden und die Harnblase als Zielorgane. Nebenwirkungen nach oral verabreichtem Fampridin traten schnell ein, am häufigsten innerhalb der ersten 2 Stunden nach Verabreichung. Die klinischen Symptome nach hohen Einzeldosen oder wiederholten niedrigeren Dosen waren bei allen untersuchten Spezies ähnlich und umfassten Tremor, Krämpfe, Ataxie, Dyspnoe, erweiterte Pupillen, Entkräftung, abnormale Vokalisierung, beschleunigte Atmung und übermässige Speichelbildung. Gangauffälligkeiten und Übererregbarkeit wurden ebenfalls beobachtet. Diese klinischen Symptome waren nicht unerwartet und sind auf die übersteigerte pharmakologische Wirkung von Fampridin zurückzuführen. Darüber hinaus wurden bei Ratten einzelne Fälle von tödlich verlaufenden Harnwegsobstruktionen beobachtet. Die klinische Relevanz dieser Befunde muss noch geklärt werden, aber ein ursächlicher Zusammenhang mit der Behandlung mit Fampridin kann nicht ausgeschlossen werden. Die Sicherheitsmargen betrugen ungefähr das 1,2fache für die AUC24h und das 1,5fache für die Cmax bei Ratten sowie das 1,1fache für die AUC24h und das 3,4fache für die Cmax bei Hunden.
Mutagenität
Die Ergebnisse für Fampridin in vitro [Ames-Test, Maus-Lymphomzellen-Vorwärtsmutationsassay, Chromosomenaberrationstest in Chinese Hamster Ovary (CHO)-Zellen] und in vivo (Maus-Knochenmark-Mikronukleustest, Erythrozyten-Mikronukleustest) waren negativ. Somit zeigt Fampridin kein mutagenes oder klastogenes Potential.
Kanzerogenität
Es wurden Zwei-Jahres-Karzinogenitätsstudien an Mäusen und Ratten durchgeführt. In Mäusen waren die verwendeten Dosen (etwa 2, 12,5 und 80 mg/kg/Tag) mit einer Exposition bis zu dem 11fachen der maximal empfohlenen Dosis von Fampyra im Menschen assoziiert. Es gab keinen Hinweis auf ein karzinogenes Potential.
In Ratten waren die verwendeten Dosen (etwa 2, 6 und 18 mg/kg/Tag) mit einer Exposition bis zu dem 9,7fachen der maximal empfohlenen Dosis von Fampyra im Menschen assoziiert. Es gab bei der 18 mg/kg/Tag Dosis einen Anstieg von Uteruspolypen.
Reproduktionstoxizität
In tierexperimentellen Studien hat die Verabreichung von Fampridin an Ratten zu keinen unerwünschten Wirkungen auf die Fertilität geführt. In Studien zur Reproduktionstoxizität in Ratten und Kaninchen wurden bei Dosen, die für die Mütter toxisch waren, Gewichtsreduktion und verminderte Lebensfähigkeit der Föten und Nachkommen beobachtet. Jedoch wurde kein erhöhtes Risiko für Fehlbildungen und somit kein teratogenes Potenzial beobachtet. Es wurde nicht untersucht, ob Fampridin über die Muttermilch ausgeschieden wird.
In Bezug auf Reproduktionsparameter, Fertilität und Kopulationsindizes nach oraler Gabe von Fampridin mit bis zu 9 mg/kg/Tag, wurden keine nachteiligen Fampridin-bezogenen Wirkungen bei Ratten beobachtet (Exposition entsprach dem 6,9fachen der maximal empfohlenen Dosis von Fampyra im Menschen). Bei allen in der Studie untersuchten Fampridin-Dosen wurden dosisabhängige maternale Toxizitäten beobachtet. Die beobachtete systemische Toxizität umfasste Mortalitäten, klinische Anzeichen, Nekropsiebefunde, verringerte Körpergewichte und Nahrungsaufnahme bei 1 mg/kg/Tag und inhibierte die Gewichtszunahme der Mutter bei 3 mg/kg/Tag und 9 mg/kg/Tag und reduzierte die Lebensfähigkeit der Nachkommen bei 9 mg/kg/Tag.
Die Verabreichung von Fampridin an Tiere während der Schwangerschaft führte bei den Nachkommen zu verminderter Lebensfähigkeit und Wachstum bei einer Dosis, die einer 6,8-fachen Exposition der maximal empfohlenen humanen Dosis von 20 mg/Tag entsprach.
In Reproduktionsstudien an Ratten und Kaninchen wurde Fampridin oral in Dosen von bis zu 10 mg/kg/Tag bzw. 5 mg/kg/Tag während der Organogenese verabreicht. In den Studien an Ratten und Kaninchen wurden keine Hinweise auf Embryotoxizität oder Entwicklungsanomalien gefunden, auch nicht in maternaltoxischen Konzentrationen.
Toxizitätsprüfung mit juvenilen Tieren
In einer Studie erhielten Ratten Fampridin vom 7. Gestations-Tag bis zum 21. Laktations-Tag. Das Überleben der Welpen war vom 1. bis 4. Gestations-Tag reduziert. Vom 4. bis 35. postnatalen Tag wurde eine geringere Gewichtszunahme der Welpen beobachtet. Diese Effekte wurden jedoch nur in der hohen Dosis von 9 mg/kg/Tag beobachtet (reduziert auf 6 mg/kg/Tag während der zweiten Woche der Studie). Die Exposition entsprach dem 6,9- und 4,6fachen der maximal empfohlenen Dosis im Menschen. Bei verschiedenen Verhaltens- und Entwicklungsbewertungen der F1-Jungtiere wurden keine behandlungsbezogenen Effekte beobachtet.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern.
Die Retardtabletten in der Originalverpackung aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer67139 (Swissmedic)
PackungenFolienblister (Alu/Alu).
Jeder Blister enthält 14 Retardtabletten.
Packung mit 56 (4 Blister mit 14) Retardtabletten. B
ZulassungsinhaberinMerz Pharma (Schweiz) AG, 4123 Allschwil
Stand der InformationJanuar 2022
|

