Eigenschaften/WirkungenATC-Code
M09AX10
Wirkungsmechanismus
Risdiplam ist ein Spleissmodifikator der prä-mRNA von SMN2 (survival of motor neuron 2) zur Behandlung von SMA, welche durch einen SMN-Proteinmangel infolge von Mutationen im 5q-Chromosom bedingt ist. Ein Mangel an funktionsfähigem SMN-Protein liegt als pathophysiologischer Mechanismus allen Formen von SMA zugrunde. Risdiplam korrigiert die Spleissung von SMN2 und verschiebt die Balance vom Ausschluss von Exon 7 hin zum Einschluss von Exon 7 in das mRNA-Transkript, sodass grössere Mengen funktionelles und stabiles SMN-Protein gebildet werden. Risdiplam behandelt somit die SMA, indem es die Konzentration funktionellen SMN-Proteins steigert und hoch hält.
Elektrophysiologie des Herzens
Die Wirkung von Risdiplam auf das QTc-Intervall wurde in einer Studie an 47 gesunden erwachsenen Probanden untersucht. Bei der therapeutischen Exposition führte Risdiplam nicht zu einer Verlängerung des QTc-Intervalls.
Pharmakodynamik
Risdiplam verteilt sich gleichmässig auf alle Körperregionen einschliesslich des zentralen Nervensystems (ZNS), da es die Blut-Hirn-Schranke durchdringt, und führt so zur Erhöhung der SMN-Proteinkonzentration im ZNS und im ganzen Körper. Die Konzentrationen von Risdiplam im Plasma und SMN-Protein im Blut spiegeln die Distribution und pharmakodynamischen Wirkungen in Geweben wie Gehirn und Muskeln wieder.
In den klinischen Studien FIREFISH, SUNFISH und JEWELFISH bei Patienten mit infantiler SMA ebenso wie bei Patienten mit späterem SMA-Krankheitsbeginn führte Risdiplam zu einer durchgängigen und anhaltenden Zunahme des SMN-Proteins; im Blut wurde innerhalb von 4 Wochen nach Behandlungsbeginn eine mediane Veränderung gegenüber Behandlungsbeginn auf mehr als das 2-Fache gemessen. Diese Zunahme des SMN-Proteins hatte über den gesamten Behandlungszeitraum von mindestens 24 Monaten Bestand (siehe Rubrik «Eigenschaften/Wirkungen», Klinische Wirksamkeit).
Klinische Wirksamkeit
Die Wirksamkeit von Evrysdi bei der Behandlung von Patienten mit infantiler SMA (SMA Typ 1) und SMA mit späterem Krankheitsbeginn (SMA Typ 2 und 3) wurde in den beiden pivotalen Studien FIREFISH und SUNFISH untersucht; unterstützend kommen Daten aus der JEWELFISH-Studie hinzu. Die Wirksamkeit von Evrysdi bei der Behandlung von präsymptomatischen SMA-Patienten wurde anhand der RAINBOWFISH-Studie beurteilt.
Patienten mit einer klinischen Diagnose mit SMA Typ 4 wurden nicht in klinischen Studien untersucht.
In klinischen Studien wurde die langfristige Wirksamkeit während einer Behandlungsdauer von mindestens 24 Monaten nachgewiesen. Für längere Zeiträume als zwei Jahre liegen nur begrenzte Daten vor.
Infantile SMA
Studie BP39056 (FIREFISH) ist eine unverblindete, 2-teilige Studie zur Untersuchung der Wirksamkeit, Sicherheit, PK und Pharmakodynamik (PD) von Evrysdi bei symptomatischen Typ-1-SMA-Patienten (alle Patienten hatten eine genetisch bestätigte Erkrankung mit 2 Kopien des SMN2-Gens). Teil 1 von FIREFISH war als Dosisfindungsteil der Studie konzipiert. Im konfirmatorischen Teil 2 der FIREFISH-Studie wurde die Wirksamkeit von Evrysdi in der therapeutischen Dosierung untersucht, die anhand der Ergebnisse von Teil 1 ausgewählt wurde (siehe Rubrik «Dosierung/Anwendung»). Patienten aus Teil 1 der Studie nahmen nicht an Teil 2 teil.
Insgesamt wurden 62 symptomatische SMA-Typ-1-Patienten in FIREFISH Teil 1 (n = 21) und Teil 2 (n = 41) eingeschlossen, von denen 58 Patienten die therapeutische Dosis erhielten. Das mediane Alter bei der Erstmanifestation der klinischen Zeichen und Symptome war 1,5 Monate (Bereich: 0,9 bis 3,0 Monate). Das mediane Alter bei Einschluss in die Studie betrug 5,6 Monate (Bereich: 2,2 bis 6,9 Monate). Die mediane Zeitspanne zwischen Symptommanifestation und erster Dosis betrug 3,7 Monate (Bereich: 1,0 bis 6,0 Monate). Von diesen Patienten waren 60 % weiblich, 57 % waren kaukasischer und 29 % asiatischer Abstammung. Bei Baseline lag der mediane CHOP-INTEND-Score bei 23 (Bereich: 8 bis 37) und der mediane HINE-2-Score bei 1 (Bereich: 0 bis 5). Die demographischen Baseline-Merkmale und die Baseline-Krankheitsmerkmale der Patienten, die in Teil 1 eingeschlossen wurden, waren mit jenen der Patienten in Teil 2 vergleichbar.
Der primäre Endpunkt der Studie war der Anteil der Patienten, die nach 12-monatiger Behandlung für mindestens 5 Sekunden in Teil 2 ohne Unterstützung sitzen konnten (BSID-III-Grobmotorik-Skala, Item 22). 29 % der Patienten (n = 12/41, 90-%-KI: 17,9 %, 43,1 %, p<0,0001) haben diesen Meilenstein erreicht.
Die wichtigsten Wirksamkeitsendpunkte der mit Evrysdi in FIREFISH behandelten Patienten (gepoolte Daten aus Teil 1 und Teil 2) sind in der Tabelle 4 aufgeführt.
Tabelle 4: Zusammenfassung der wichtigsten Wirksamkeitsendpunkte nach 12 Monaten und nach 24 Monaten (FIREFISH Teil 1 und Teil 2)
|
Wirksamkeitsendpunkte
|
Monat 12
|
Monat 24
| |
|
Anteil Patienten (90-%-KI)
| |
Motorische Funktion und Entwicklungsmeilensteine
|
n = 58a
| |
BSID-III: Sitzen ohne Unterstützung für mindestens 5 Sekunden
|
32,8 %
(22,6 %, 44,3 %)
|
60,3 %
(48,7 %, 71,2 %)
| |
CHOP-INTEND-Score von 40 oder höher
|
56,9 %
(45,3 %, 68,0 %)
|
74,1 %
(63,0 %, 83,3 %)
| |
Anstieg CHOP-INTEND-Score um ≥4 Punkte gegenüber Baseline
|
89,7 %
(80,6 %, 95,4 %)
|
87,9 %
(78,5 %, 94,2 %)
| |
HINE-2: Patienten mit Ansprechen bei motorischen Meilensteinenb
|
77,6 %
(66,7 %, 86,2 %)
|
82,8 %
(72,5 %, 90,3 %)
| |
Überleben und ereignisfreies Überleben
|
n = 62a
| |
Ereignisfreies Überlebenc
|
87,1 %
(78,1 %, 92,6 %)
|
83,8 %
(74,3 %, 90,1 %)
| |
Überleben
|
91,9 %
(83,9 %, 96,1 %)
|
90,3 %
(81,9 %, 94,9 %)
| |
Nahrungsaufnahme
|
n = 58a
| |
Fähigkeit zur oralen Nahrungsaufnahmed
|
84,5 %
(74,5 %, 91,7 %)
|
82,8 %
(72,5 %, 90,3 %)
|
Abkürzungen: BSID-III: Bayley Scales of Infant and Toddler Development – Third Edition; CHOP-INTEND: Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders; HINE-2: Module 2 of the Hammersmith Infant Neurological Examination.
a Für das Überleben und das beatmungsfreie Überleben wurden die Daten aller Patienten, die in Teil 1 und Teil 2 eine beliebige Dosis von Risdiplam erhalten hatten (n = 62), gepoolt. Für die Wirksamkeitsendpunkte motorische Funktion und Entwicklungsmeilensteine sowie Nahrungsaufnahme wurden die Daten aller Patienten, die die therapeutische Dosis von Risdiplam erhielten (alle Patienten in Teil 2 und diejenigen in der Hochdosis-Kohorte von Teil 1; n = 58) gepoolt.
b HINE-2-Responder-Definition: Ansprechen ist in dieser Analyse definiert als ≥2 Punkte Steigerung (oder höchstmögliche Punktzahl) beim Strampeln ODER ≥1 Punkt Steigerung bei den motorischen Meilensteinen Kopfkontrolle, Umdrehen, Sitzen, Krabbeln, Stehen oder Gehen UND mehr motorische Meilensteine mit Verbesserung als mit Verschlechterung.
c Ein Ereignis erreicht den Endpunkt der permanenten Beatmung definiert als Tracheostomie oder ≥16 Stunden nicht-invasiver Beatmung pro Tag oder Intubation für >21 aufeinanderfolgende Tage in Abwesenheit, oder folgend der Resolution, eines akuten reversiblen Ereignisses. Vier Patienten erreichten den Endpunkt der permanenten Beatmung vor Monat 24. Diese 4 Patienten erreichten eine Steigerung von mindestens 4 Punkten im CHOP-INTEND-Score im Vergleich zur Baseline.
d Umfasst Patienten, die ausschliesslich oral ernährt wurden (41 Patienten nach 12 und 24 Monaten), und solche mit kombinierter Ernährung (oral und Sonde) (8 Patienten nach 12 Monaten und 7 Patienten nach 24 Monaten).
Im Monat 24 erreichten 40 % (23/58) der Patienten, die die therapeutische Dosis erhielten, freies Sitzen für 30 Sekunden (BSID-III, Item 26). Zudem erreichten die Patienten weitere motorische Meilensteine, die anhand von HINE-2 im Monat 24 bestimmt wurden; 78 % der Patienten konnten sich umdrehen (31 % der Patienten konnten sich auf die Seite drehen, 7 % konnten sich von der Bauchlage in die Rückenlage drehen und 40 % konnten sich von der Rückenlage in die Bauchlage drehen) und 28 % der Patienten konnten stehen (16 % freies Stehen und 12 % Stehen mit Unterstützung).
Der Anteil der Patienten, die ohne permanente Beatmung überlebten (ereignisfreies Überleben), lag bei allen Patienten im Monat 24 bei 84 %. Sechs Säuglinge starben (vier innerhalb der ersten drei Monate nach dem Einschluss in die Studie) und ein weiterer Patient brach die Behandlung ab und verstarb 3,5 Monate später. Vier Patienten benötigten im Monat 24 eine permanente Beatmung.
SMA mit späterem Krankheitsbeginn
Studie BP39055 (SUNFISH) ist eine 2-teilige, multizentrische Studie zur Untersuchung der Wirksamkeit, Sicherheit, PK und PD von Evrysdi bei Patienten mit Typ-2- oder Typ-3-SMA im Alter von 2–25 Jahren. Teil 1 war der Dosisfindungsteil der Studie, Teil 2 der randomisierte, doppelblinde, placebokontrollierte, konfirmatorische Teil. Patienten aus Teil 1 der Studie nahmen nicht an Teil 2 teil.
Der primäre Endpunkt war die Veränderung des MFM32-Scores (Motor Function Measure-32) gegenüber Baseline. Der MFM32 ermöglicht die Beurteilung eines breiten Spektrums motorischer Funktionen bei ganz unterschiedlichen SMA-Patienten. Der MFM32-Gesamtscore wird in Prozent (0 bis 100) des möglichen Höchstscores ausgedrückt, wobei höhere Scores für bessere motorische Funktion stehen. Der MFM32 misst motorische Funktionsfähigkeiten, die für wichtige Alltagstätigkeiten von Bedeutung sind. Kleine Veränderungen der motorischen Funktion können grosse Gewinne bzw. Verluste der Funktionsfähigkeit im Alltag bedeuten.
SUNFISH Teil 2
SUNFISH Teil 2 ist der randomisierte, doppelblinde, placebokontrollierte Teil der SUNFISH-Studie mit 180 nicht-gehfähigen Patienten mit Typ-2- (71 %) oder Typ-3-SMA (29 %). Die Patienten erhielten nach Randomisierung im Verhältnis 2:1 entweder Evrysdi in der therapeutischen Dosierung (siehe Rubrik «Dosierung/Anwendung») oder Placebo. Die Randomisierung war nach Altersgruppen stratifiziert (2 bis 5, 6 bis 11, 12 bis 17 und 18 bis 25 Jahre).
Das mediane Alter der Patienten bei Behandlungsbeginn betrug 9,0 Jahre (Bereich: 2 bis 25 Jahre); die mediane Zeitspanne vom Auftreten der ersten SMA-Symptome bis zum Behandlungsbeginn betrug 102,6 Monate (Bereich: 1 bis 275 Monate). Von den 180 in die Studie eingeschlossenen Patienten waren 51 % weiblich, 67 % waren kaukasischer und 19 % asiatischer Abstammung. Bei Baseline lag bei 67 % der Patienten eine Skoliose vor (bei 32 % eine schwere Skoliose). Der mittlere Baseline-MFM32-Score der Patienten betrug 46,1, der mittlere RULM-Score (Revised Upper Limb Module) 20,1. Die demographischen Baseline-Merkmale der Patienten waren insgesamt ausgewogen zwischen der Evrysdi- und der Placebogruppe mit Ausnahme einer Unausgewogenheit bei Patienten mit Skoliose (63,3 % der Patienten in der Evrysdi- und 73,3 % in der Placebogruppe).
Die primäre Analyse in SUNFISH Teil 2, die Veränderung des MFM32-Gesamtscores in Monat 12 gegenüber Baseline, ergab einen klinisch bedeutsamen und statistisch signifikanten Unterschied zwischen den mit Evrysdi behandelten Patienten und denen, die Placebo erhielten. Die Ergebnisse der Primäranalyse und der wichtigsten sekundären Endpunkte sind in Tabelle 5 und Abbildung 1 zusammengefasst.
Tabelle 5: Zusammenfassung der Wirksamkeitsergebnisse bei Patienten mit SMA mit späterem Krankheitsbeginn nach 12-monatiger Behandlung (SUNFISH Teil 2)
|
Endpunkt
|
Evrysdi
(n = 120)
|
Placebo
(n = 60)
| |
Primärer Endpunkt
| |
Veränderung des MFM32-Gesamtscores1 nach 12 Monaten vs. Baseline
LS-Mittelwert (95-%-KI)
|
1,36
(0,61; 2,11)
|
-0,19
(-1,22; 0,84)
| |
Unterschied zu Placebo
Schätzwert (95-%-KI)
p-Wert2
|
1,55
(0,30; 2,81)
0,0156
| |
Sekundäre Endpunkte
| |
Anteil Patienten mit Veränderung des MFM32-Gesamtscores1 um 3 oder mehr nach 12 Monaten vs. Baseline (95-%-KI)
|
38,3 %
(28,9; 47,6)
|
23,7 %
(12,0; 35,4)
| |
Odds Ratio für das Gesamtansprechen (95-%-KI)
Angepasster (unangepasster) p-Wert3,4
|
2,35 (1,01; 5,44)
0,0469 (0,0469)
| |
Veränderung des RULM-Gesamtscores5 nach 12 Monaten vs. Baseline
LS-Mittelwert (95-%-KI)
|
1,61
(1,00; 2,22)
|
0,02
(-0,83; 0,87)
| |
Unterschied zu Placebo, Schätzwert (95-%-KI)
Angepasster (unangepasster) p-Wert2,4
|
1,59 (0,55; 2,62)
0,0469 (0,0028)
|
LS = Least Squares.
1 Gemäss der Regel für fehlende Daten beim MFM32 wurden 6 Patienten von der Analyse ausgeschlossen (Evrysdi n = 115; Placebo-Kontrolle n = 59).2 Datenanalyse nach einem gemischten Modell mit wiederholten Messungen mit Baseline-Gesamtscore, Behandlung, Termin, Altersgruppe, Behandlung-nach-Termin und Baseline-Wert-nach-Termin.3 Datenanalyse mittels logistischer Regression für Baseline-Gesamtscore, Behandlung und Altersgruppe.4 Der angepasste p-Wert wurde für die in die hierarchischen Tests einbezogenen Endpunkte ermittelt und auf der Grundlage aller p-Werte von Endpunkten in der hierarchischen Reihenfolge bis zum aktuellen Endpunkt abgeleitet. Unangepasste p-Werte wurden auf 5-%-Signifikanzniveau getestet.5 Gemäss der Regel für fehlende Daten beim RULM wurden 3 Patienten von der Analyse ausgeschlossen (Evrysdi n = 119; Placebo-Kontrolle n = 58).
Nach Abschluss der 12-monatigen Behandlung erhielten 117 Patienten weiterhin Evrysdi. Zum Zeitpunkt der 24-Monats-Analyse zeigten diese während 24 Monaten behandelten Patienten zwischen Monat 12 und Monat 24 eine weitere Verbesserung ihrer motorischen Funktion. Die mittlere Veränderung gegenüber Baseline betrug beim MFM 32 1,83 (95-%-KI: 0,74-2,92) und beim RULM 2,79 (95-%-KI: 1,94-3,64).
Abbildung 1: Mittlere Veränderung (LS) gegenüber Baseline beim MFM32-Gesamtscore über 12 Monate in SUNFISH Teil 2
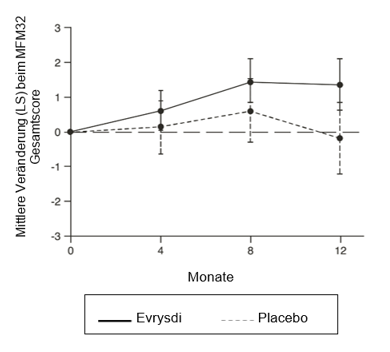
* Fehlerbalken zeichnen das 95%-Konfidenzintervall.
† Der MFM-Gesamtscore wurde gemäß dem Benutzerhandbuch berechnet und als Prozentsatz der maximal möglichen Punktzahl für die Skala ausgedrückt (d.h. die Summe der 32 Itemes Scores geteilt durch 96 und multipliziert mit 100).
SUNFISH Teil 1
Die Wirksamkeit von Evrysdi bei Patienten mit SMA mit späterem Krankheitsbeginn wird auch durch die Ergebnisse von Teil 1 von SUNFISH gestützt, dem Dosisfindungsteil der Studie. In Teil 1 wurden 51 Patienten mit Typ-2- und Typ-3-SMA im Alter von 2 bis 25 Jahren eingeschlossen (darunter 7 gehfähige Patienten). Nach 1-jähriger Behandlung mit der therapeutischen Dosis (der für Teil 2 ausgewählten Dosis) bestand eine klinisch bedeutsame Verbesserung der mittels MFM32 gemessenen motorischen Funktion mit einer mittleren Veränderung gegenüber Baseline um 2,7 Punkte (95-%-KI: 1,5; 3,8). Die Verbesserung beim MFM32 hatte auch nach 2 Jahren unter Evrysdi-Therapie Bestand (mittlere Veränderung um 2,7 Punkte [95-%-KI: 1,2; 4,2]).
In einer explorativen Analyse wurde die mittels MFM beurteilte motorische Funktion zwischen SUNFISH Teil 1 und einer historischen Kohorte mit natürlichem Krankheitsverlauf verglichen (gewichtet nach wichtigen prognostischen Faktoren). Die MFM-Gesamtveränderung gegenüber Baseline nach 1 Jahr und nach 2 Jahren war bei Patienten, die Evrysdi erhielten, grösser als in der natürlichen Verlaufskohorte (nach 1 Jahr: 2,7 Punkte Differenz; p<0,0001; nach 2 Jahren: 4,0 Punkte Differenz; p<0,0001). Die natürliche Verlaufskohorte zeigte eine Abnahme der motorischen Funktion, wie gemäss der natürlichen Progression der SMA zu erwarten ist (mittlere Veränderung nach 1 Jahr: -0,6 Punkte; nach 2 Jahren: -2,0 Punkte).
Präsymptomatische SMA
Die Studie BN40703 (RAINBOWFISH) ist eine offene, einarmige, multizentrische klinische Studie zur Untersuchung der Wirksamkeit, Sicherheit, Pharmakokinetik und Pharmakodynamik von Evrysdi bei Säuglingen ab Geburt bis zum Alter von 6 Wochen (bei der ersten Dosis) mit genetisch bestätigter jedoch noch asymptomatischer SMA.
Die Wirksamkeit bei präsymptomatischen SMA-Patienten wurde in Monat 12 bei 26 Patienten [Intent-to-Treat-(ITT-)Population] untersucht, die mit Evrysdi behandelt wurden. Das mediane Alter dieser Patienten bei der ersten Dosis betrug 25 Tage (Bereich: 16 bis 41 Tage), 62 % waren weiblich und 85 % kaukasischer Abstammung. Acht Patienten, 13 Patienten bzw. 5 Patienten hatten 2, 3 bzw. ≥4 Kopien des SMN2-Gens. Bei Baseline betrug der mediane CHOP-INTEND-Score 51,5 (Bereich: 35,0 bis 62,0), der mediane HINE-2-Score 2,5 (Bereich: 0 bis 6,0) und die mediane Amplitude des muskulären Aktionspotenzials (Compound Muscle Action Potential, CMAP) des Nervus ulnaris 3,6 mV (Bereich: 0,5 mV bis 6,7 mV).
Die primäre Wirksamkeitspopulation (n = 5) umfasste Patienten mit 2 SMN2-Kopien und einer CMAP-Amplitude ≥1,5 mV bei Baseline. Bei diesen Patienten betrug der mediane CHOP-INTEND-Score 48,0 (Bereich: 36,0 bis 52,0), der mediane HINE-2-Score 2,0 (Bereich: 1,0 bis 3,0) und die mediane CMAP-Amplitude 2,6 mV (Bereich: 1,6 mV bis 3,8 mV) bei Baseline.
Der primäre Endpunkt war der Anteil der Patienten in der primären Wirksamkeitspopulation, die in Monat 12 mindestens 5 Sekunden lang ohne Unterstützung sitzen konnten (BSID-III Grobmotorik-Skala, Item 22); dieser Meilenstein wurde von einem statistisch signifikanten und klinisch bedeutsamen Anteil der Patienten im Vergleich zum vorgegebenen Leistungskriterium von 5 % erreicht.
Die wichtigsten Wirksamkeitsendpunkte der mit Evrysdi behandelten Patienten sind in den Tabellen 6 und 7 sowie in Abbildung 2 dargestellt.
Tabelle 6: Sitzen gemäss BSID-III-Item 22 für präsymptomatische Patienten in Monat 12
|
Wirksamkeitsendpunkt
|
Population
| |
|
Primäre Wirksamkeit
(n = 5)
|
Patienten mit 2 SMN2-Kopiena
(n = 8)
|
ITT
(n = 26)
| |
Anteil der Patienten, die mindestens 5 Sekunden lang ohne Unterstützung sitzen (BSID-III, Item 22); (90-%-KI)
|
80 %
(34,3 %, 99,0 %)
p < 0,0001b
|
87,5 %
(52,9 %, 99,4 %)
|
96,2 %
(83,0 %, 99,8 %)
|
Abkürzungen: BSID-III = Bayley Scales of Infant and Toddler Development – Third Edition; KI = Konfidenzintervall; ITT = Intent-to-Treat.
a Patienten mit 2 SMN2-Kopien hatten bei Baseline eine mediane CMAP-Amplitude von 2,0 (Bereich 0,5 – 3,8).
b Der p-Wert basiert auf einem einseitigen, exakten Binomialtest. Das Ergebnis wird mit einem Grenzwert von 5 % verglichen.
Zusätzlich erreichten 80 % (4/5) der primären Wirksamkeitspopulation, 87,5 % (7/8) der Patienten mit 2SMN2-Kopien und 80,8 % (21/26) der Patienten in der ITT-Population 30 Sekunden lang das Sitzen ohne Unterstützung (BSID-III, Item 26).
Die Patienten in der ITT-Population erreichten auch motorische Meilensteine, gemessen anhand der HINE-2 in Monat 12 (n = 25). In dieser Population konnten 96,0 % der Patienten sitzen [1 Patient (1/8 Patienten mit 2 SMN2-Kopien) erreichte eine stabile Sitzposition und 23 Patienten (6/8, 13/13, 4/4 Patienten mit 2, 3 bzw. ≥4 SMN2-Kopien) konnten sich drehen]. Darüber hinaus konnten 84 % der Patienten stehen; 32 % (n = 8) der Patienten konnten mit Unterstützung stehen (3/8, 3/13 bzw. 2/4 Patienten mit 2, 3 bzw. ≥4 SMN2-Kopien) und 52 % (n = 13) der Patienten konnten ohne Hilfe stehen (1/8, 10/13 bzw. 2/4 der Patienten mit 2, 3 bzw. ≥4 SMN2-Kopien). Darüber hinaus konnten 72 % der Patienten hüpfen, laufen oder gehen; 8 % (n = 2) der Patienten konnten hüpfen (2/8 Patienten mit 2 SMN2-Kopien), 16 % (n = 4) konnten laufen (3/13 bzw. 1/4 Patienten mit 3 bzw. ≥4 SMN2-Kopien) und 48 % (n = 12) konnten unabhängig gehen (1/8, 9/13 bzw. 2/4 Patienten mit 2, 3 bzw. ≥4 SMN2-Kopien). Sieben Patienten wurden in Monat 12 nicht auf Gehfähigkeit getestet.
Tabelle 7: Zusammenfassung der wichtigsten Wirksamkeitsendpunkte für präsymptomatische Patienten in Monat 12
|
Wirksamkeitsendpunkte
|
ITT-Population (n = 26)
| |
Motorische Funktion
| |
Anteil der Patienten, die im CHOP-INTEND-Score einen Gesamt-Score von 50 oder höher erreichen (90-%-KI)
|
92 %a
(76,9 %, 98,6 %)
| |
Anteil der Patienten, die im CHOP-INTEND-Score einen Gesamt-Score von 60 oder höher erreichen (90-%-KI)
|
80 %a
(62,5 %, 91,8 %)
| |
Nahrungsaufnahme
| |
Anteil der Patienten mit der Fähigkeit zur oralen Nahrungsaufnahme (90-%-KI)
|
96,2 %b
(83,0 %, 99,8 %)
| |
Nutzung des Gesundheitswesens
| |
Anteil der Patienten ohne Krankenhausaufenthaltec; (90-%-KI)
|
92,3 %
(77,7 %, 98,6 %)
| |
Ereignisfreies Überlebend
Anteil der Patienten mit ereignisfreiem Überleben (90-%-KI)
|
100 %
(100 %, 100 %)
|
Abkürzungen: CHOP-INTEND = Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders; KI = Konfidenzintervall; ITT = Intent-to-Treat.
a Basierend auf n = 25.
b Ein Patient wurde nicht untersucht.
c Krankenhausaufenthalte umfassen alle Krankenhausaufenthalte, die mindestens zwei Tage dauerten und nicht auf die Studienanforderungen zurückzuführen waren.
d Ein Ereignis bezieht sich auf Tod oder dauerhafte Beatmung; dauerhafte Beatmung ist definiert als Tracheostomie oder ≥16 Stunden nicht-invasive Beatmung pro Tag oder Intubation für > 21 aufeinander folgende Tage bei Abwesenheit von oder nach dem Abklingen eines akuten reversiblen Ereignisses.
Abbildung 2: Mediane CHOP-INTEND-Gesamtpunktzahl nach Besuch und SMN2-Kopienzahl (ITT-Population)
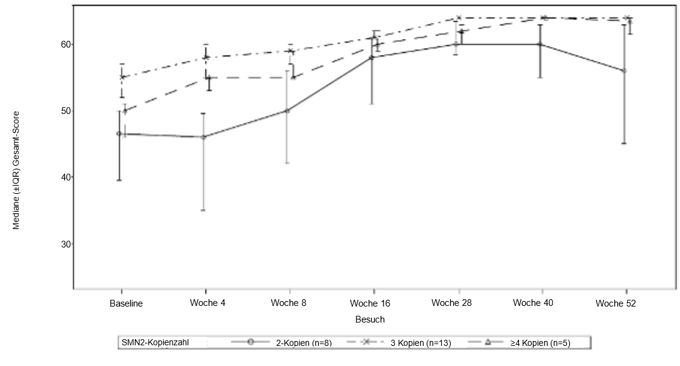
Abkürzungen: IQR – Interquartilbereich; SMN2 = Survival Motor Neuron 2.
Anwendung bei mit anderen modifizierenden Therapien vorbehandelten SMA-Patienten
Studie BP39054 (JEWELFISH) ist eine einarmige, unverblindete Studie zur Untersuchung der Sicherheit, Verträglichkeit, PK und PD von Evrysdi bei Patienten mit infantiler SMA oder SMA mit späterem Krankheitsbeginn im Alter von 6 Monaten bis 60 Jahren, die zuvor andere SMA-Therapien erhalten haben (einschliesslich Nusinersen und Onasemnogene Abeparvovec). Von den 173 Patienten, die Evrysdi erhielten, waren 76 zuvor mit Nusinersen behandelt worden (9 Patienten mit Typ-1-SMA, 43 mit Typ-2-SMA und 24 mit Typ-3-SMA) und 14 Patienten waren zuvor mit Onasemnogen-Abeparvovec behandelt worden (4 Patienten mit Typ-1-SMA und 10 mit Typ-2-SMA). Das mediane Alter der Patienten zu Beginn der Evrysdi-Behandlung betrug 14 Jahre (Bereich 1 - 60 Jahre).
Bei Baseline hatten 83 % der 168 Patienten im Alter von 2 bis 60 Jahren Skoliose (39 % der Patienten hatten eine schwere Skoliose) und 63 % der Patienten hatten einen Score von < 10 Punkten auf der Skala Hammersmith Functional Motor Scale Expanded (HFMSE). In die Studie wurden auch 15 gehfähige Patienten (5 - 46 Jahre) aufgenommen.
Die explorative Wirksamkeit wurde anhand altersgerechter Motorik-Parameter bewertet, einschliesslich der MFM-32- und RULM-Skalen für Patienten im Alter von 2 - 60 Jahren, der BSID-III- und HINE-2-Skalen für Patienten im Alter von unter 2 Jahren und des Sechs-Minuten-Gehtests (6MWT) bei gehfähigen Patienten im Alter von ≥6 Jahren. Bei der Primäranalyse, die nach 24 Behandlungsmonaten durchgeführte wurde, zeigten Patienten im Alter von 2 - 60 Jahren insgesamt eine Stabilisierung der Motorik, gemessen anhand MFM-32 und RULM (n = 137 bzw. n = 133). Patienten unter 2 Jahren (n = 6) konnten motorische Meilensteine wie Kopfkontrolle, selbstständiges Rollen und selbstständiges Sitzen beibehalten oder gewinnen. Die 6MWT-Ergebnisse zeigten eine mittlere Verbesserung von 30,88 Metern (95%-KI: -5,54; 67,29; n = 8). Alle gehfähigen Patienten behielten ihre Gehfähigkeit.
|


