Eigenschaften/WirkungenATC-Code
A16AB25
Wirkungsmechanismus
Olipudase alfa (rekombinante humane saure Sphingomyelinase) ist ein rekombinantes Enzym, welches die Anreicherung von Sphingomyelin (SM) in den Organen von Patienten mit einem Mangel an saurer Sphingomyelinase (ASMD) verringert. Es ist nicht zu erwarten, dass Xenpozyme die Blut-Hirn-Schranke passiert oder zentralnervöse Manifestationen der Erkrankung beeinflusst.
Pharmakodynamik
Für die Bewertung der pharmakodynamischen Aktivität von Xenpozyme bei ASMD-Patienten wurden Ceramid und Lyso-Sphingomyelin (eine deacetylierte SM-Form) herangezogen.
Nach wiederholter Verabreichung von Xenpozyme an erwachsene und pädiatrische Patienten stiegen die Ceramid-Plasmaspiegel nach jeder Dosis (nach der Infusion) vorübergehend an, wobei die Plasmaspiegel im Verlauf des Behandlungszeitraums graduell abnahmen. In der DFI12712/ASCEND-Studie betrug die prozentuale Veränderung der LS-Mittelwerte (Least-Squares-Methode) von Studienbeginn bis Woche 52 (Standardfehler, SE) beim Ceramid-Plasmaspiegel vor der Infusion in der Behandlungsgruppe unter Xenpozyme -36,4 % (5,3) und in der Placebogruppe -0,2 % (5,6). Bei pädiatrischen Patienten gingen die LS-Mittelwerte (Least Squares Means) beim Ceramid-Plasmaspiegel vor der Infusion zwischen Studienbeginn und Woche 52 (SE: 5,1) um 57 % zurück.
Lyso-Sphingomyelin ist im Plasma von erwachsenen und pädiatrischen ASMD-Patienten erheblich erhöht. Nach wiederholter Gabe von Xenpozyme gingen die Plasmawerte von Lyso-Sphingomyelin signifikant zurück, was eine Abnahme des Sphingomyelingehalts in den Geweben widerspiegelt. In der DFI12712/ASCEND-Studie betrug die prozentuale Veränderung der LS-Mittelwerte von Studienbeginn bis Woche 52 (SE) beim Lyso-Sphingomyelin-Plasmaspiegel vor der Infusion in der Behandlungsgruppe unter Xenpozyme -77,7 % (3,9) und in der Placebogruppe -5,0 % (4,2). Bei pädiatrischen Patienten gingen die LS-Mittelwerte beim Lyso-Sphingomyelin-Plasmaspiegel vor der Infusion zwischen Studienbeginn und Woche 52 (SE: 1,3) um 87,2 % zurück.
Der histopathologisch beurteilte Sphingomyelingehalt in der Leber nahm bei erwachsenen Patienten zwischen Studienbeginn und Woche 52 in der Behandlungsgruppe unter Xenpozyme um 92,0 % (SE: 8,1) ab (verglichen mit +10,3 % [SE: 7,8] in der Placebogruppe).
Klinische Wirksamkeit
Die Wirksamkeit von Xenpozyme wurde in 3 klinischen Studien (ASCEND bei erwachsenen Patienten, ASCEND-Peds bei pädiatrischen Patienten und eine Verlängerungsstudie bei erwachsenen und pädiatrischen Patienten) an insgesamt 61 Patienten mit ASMD untersucht.
Klinische Studie bei erwachsenen Patienten
Die Studie ASCEND ist eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Studie der Phase II/III mit wiederholter Dosisgabe bei erwachsenen Patienten mit ASMD Typ A/B und B. Insgesamt 36 Patienten wurden randomisiert im Verhältnis 1:1 einer Behandlung mit Xenpozyme oder Placebo zugewiesen. Die Behandlung wurde in beiden Gruppen als intravenöse Infusion einmal alle 2 Wochen verabreicht. Bei Patienten, die Xenpozyme erhielten, wurde die Dosis von 0,1 mg/kg auf eine Zieldosis von 3 mg/kg erhöht. Die Studie wurde in 2 aufeinanderfolgende Phasen eingeteilt: eine randomisierte, placebokontrollierte, doppelblinde Phase zur Primäranalyse (PAP, primary analysis period) bis Woche 52, an die eine verlängerte Behandlungsphase (ETP, extension treatment period) von bis zu 4 Jahren anschloss.
Patienten, die in der PAP in den Placeboarm randomisiert wurden, wechselten in der ETP auf die aktive Behandlung und wurden auf die Zieldosis von 3 mg/kg auftitriert, während die Patienten im ursprünglichen Xenpozyme-Arm die Behandlung fortsetzten.
Patienten, die in die Studie aufgenommen wurden, hatten eine Diffusionskapazität der Lunge für Kohlenmonoxid (DLco) ≤70 % des Sollwerts, ein Milzvolumen von ≥6-fach der Norm gemäss Magnetresonanztomographie (MRT) und Werte von ≥5 auf der Splenomegalie-bezogenen Skala (SRS). Insgesamt waren die demografischen und krankheitsspezifischen Merkmale zu Studienbeginn bei den beiden Behandlungsgruppen ähnlich. Das mediane Patientenalter betrug 30 Jahre (Spanne: 18-66 Jahre). Das mittlere (Standardabweichung, SD) Alter zum Zeitpunkt der ASMD-Diagnose betrug 18 (18,4) Jahre. Zu Studienbeginn waren bei 9 von 36 erwachsenen Patienten (25 %) neurologische Manifestationen zu erkennen, die mit der klinischen Diagnose ASMD Typ A/B übereinstimmten. Die anderen 27 Patienten wiesen eine klinische Diagnose auf, die mit ASMD Typ B übereinstimmte.
Diese Studie beinhaltete zwei voneinander getrennte primäre Wirksamkeitsendpunkte: die prozentuale Veränderung der DLCO (in % des Sollwerts) und des Milzvolumens (MN; multiples of normal) gemäss MRT von Studienbeginn bis Woche 52.
Sekundäre Wirksamkeitsendpunkte waren die prozentuale Veränderung des Lebervolumens (MN) und der Thrombozytenzahl von Studienbeginn bis Woche 52.
In der Xenpozyme-Gruppe wurden in der 52-wöchigen Phase zur Primäranalyse im Vergleich zur Placebogruppe Verbesserungen bei der mittleren prozentualen Veränderung der DLCO (% des Sollwerts) (p = 0,0004) und dem Milzvolumen (p < 0,0001) sowie dem mittleren Lebervolumen (p < 0,0001) und der Thrombozytenzahl (p = 0,0185) beobachtet. In Woche 26 der Behandlung, dem ersten Zeitpunkt der Endpunktbeurteilung nach Dosisgabe, wurde eine signifikante Verbesserung der mittleren prozentualen Veränderung der DLCO (% des Sollwerts), des Milzvolumens, des Lebervolumens und der Thrombozytenzahl festgestellt.
Die Ergebnisse der Phase zur Primäranalyse bis Woche 52 sind in Tabelle 7 aufgeführt.
Tabelle 7: Mittelwerte (SD) für Wirksamkeitsendpunkte zu Studienbeginn und prozentuale Veränderung der LS-Mittelwerte (SE) von Studienbeginn bis Woche 52
|
|
Placebo (N = 18)
|
Xenpozyme (N = 18)
|
Differenz
[95 %-KI]
|
p-Wert*
| |
Primäre Endpunkte
|
| |
Mittlere DLCO bei Studienbeginn (% des Sollwerts)
Veränderung der DLCO von Studienbeginn bis Woche 52 (in % des Sollwerts)
|
48,5 (10,8)
3 (3,4)
|
49,4 (11,0)
22 (3,3)
|
n. z.
19 (4,8)
[9,3, 28,7]
|
n. z.
0,0004
| |
Mittleres Milzvolumen zu Studienbeginn (MN)
Prozentuale Veränderung des Milzvolumens vom Studienbeginn bis Woche 52
|
11,2 (3,8)
0,5 (2,5)
|
11,7 (4,9)
-39,4 (2,4)
|
n. z.
-39,9 (3,5)
[-47,1, -32,8]
|
n. z.
< 0,0001
| |
Sekundäre Endpunkte
|
| |
Mittleres Lebervolumen zu Studienbeginn (MN)
Prozentuale Veränderung des Lebervolumens von Studienbeginn bis Woche 52
|
1,6 (0,5)
-1,5 (2,5)
|
1,4 (0,3)
-28,1 (2,5)
|
n. z.
-26,6 (3,6)
[-33,9, -19,3]
|
n. z.
< 0,0001
| |
Mittlere Thrombozytenzahl zu Studienbeginn (109/l)
Prozentuale Veränderung der Thrombozytenzahl von Studienbeginn bis Woche 52
|
115,6 (36,3)
2,5 (4,2)
|
107,2 (26,9)
16,8 (4,0)
|
n. z.
+14,3 (5,8)
[2,6, 26,1]
|
n. z.
0,0185
|
* Statistisch signifikant nach Korrektur für multiples Testen
Siebzehn von 18 Patienten, die zuvor Placebo erhielten, und 18 von 18 Patienten, die zuvor in der PAP 52 Wochen lang mit Xenpozyme behandelt wurden, begannen eine bis zu 4-jährige Behandlung mit Xenpozyme bzw. setzten diese bis zu 4 Jahre lang fort. Die anhaltenden Auswirkungen von Xenpozyme auf die Wirksamkeitsendpunkte bis Woche 104 sind in den Abbildungen 1 und 2 sowie Tabelle 8 aufgeführt.
Abbildung 1: Darstellung der LS-Mittelwerte (95 %-KI) der prozentualen Veränderung der DLCO (% des Sollwerts) von Studienbeginn bis Woche 104 – mITT (modified intent-to-treat) Population
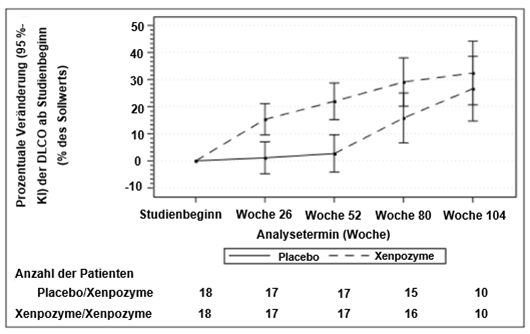
Die senkrechten Balken stellen die 95 %-KI der LS-Mittelwerte dar.
Die LS-Mittelwerte und 95 %-KI basieren auf einem gemischten Modell mit wiederholten Messungen (MMRM, mixed model repeated measures) für die Daten bis zu Woche 104.
Die Patienten der Gruppe Placebo/Xenpozyme erhielten bis Woche 52 Placebo und wechselten danach zu Xenpozyme.
Abbildung 2: Darstellung der LS-Mittelwerte (95 %-KI) der prozentualen Veränderung des Milzvolumens (MN) von Studienbeginn bis Woche 104 – mITT (modified intent-to-treat) Population
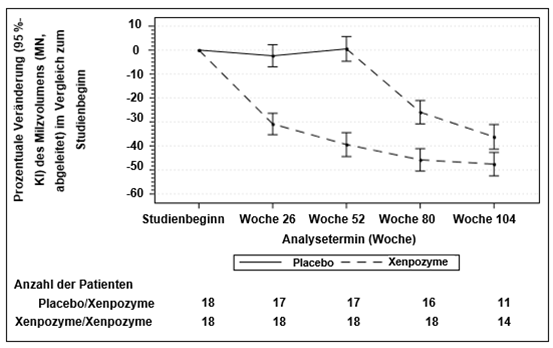
Die senkrechten Balken stellen die 95 %-KI der LS-Mittelwerte dar.
Die LS-Mittelwerte und 95 %-KI basieren auf einem gemischten Modell mit wiederholten Messungen (MMRM) für die Daten bis zu Woche 104.
Die Patienten der Gruppe Placebo/Xenpozyme erhielten bis Woche 52 Placebo und wechselten danach zu Xenpozyme.
Tabelle 8: Prozentuale Veränderung (SE) der LS-Mittelwerte von Studienbeginn bis Woche 104 des Lebervolumens (MN) und der Thrombozytenzahl (109/l) bei mit Xenpozyme über 104 Wochen behandelten Patienten
|
|
Vorherige Olipudase-alfa-Gruppe
| |
|
Woche 52 (Beginn ETP)
|
Woche 104
| |
N
Prozentuale Veränderung des Lebervolumens (SD)
|
17
-27,8 (2,5)
|
14
-33,4 (2,2)
| |
N
Prozentuale Veränderung der Thrombozytenzahl (SD)
|
18
16,6 (4,0)
|
13
24,9 (6,9)
|
N: Anzahl der Patienten
Verlängerungsstudie bei erwachsenen Patienten
Fünf erwachsene Patienten, die an einer unverblindeten Dosissteigerungsstudie mit ASMD-Patienten teilnahmen, setzten die Behandlung in einer unverblindeten Verlängerungsstudie fort und erhielten Xenpozyme für eine Dauer von bis zu > 9 Jahren.
Im Studienverlauf wurden bei Erwachsenen anhaltende Verbesserungen der DLCO (% des Sollwerts), des Milz- und Lebervolumens sowie der Thrombozytenzahl im Vergleich zum Ausgangswert festgestellt (siehe Tabelle 9).
Tabelle 9: Mittlere prozentuale Veränderung (SD) der Wirksamkeitsparameter von Studienbeginn bis Monat 78
|
|
Monat 78
(N = 5)
| |
Prozentuale Veränderung der DLCO (% des Sollwerts) (SD)
|
55,3 % (48,1)
| |
Prozentuale Veränderung des Milzvolumens (SD)
|
-59,5 % (4,7)
| |
Prozentuale Veränderung des Lebervolumens (SD)
|
-43,7 % (16,7)
| |
Prozentuale Veränderung der Thrombozytenzahl (SD)
|
38,5 % (14,7)
|
N: Anzahl der Patienten
Pädiatrische Population
Die Studie ASCEND-Peds (klinische Studie der Phase I/II) ist eine multizentrische, unverblindete Studie mit wiederholter Verabreichung zur Untersuchung der Sicherheit und Verträglichkeit der Gabe von Xenpozyme über 64 Wochen bei pädiatrischen Patienten < 18 Jahren mit ASMD (Typ A/B und B). Darüber hinaus wurden in Woche 52 exploratorische Wirksamkeitsendpunkte in Bezug auf Organomegalie, Lungen- und Leberfunktion sowie Längenwachstum beurteilt.
Bei insgesamt 20 Patienten (4 Jugendliche im Alter von 12 bis < 18 Jahren, 9 Kinder im Alter von 6 bis < 12 Jahren und 7 Säuglinge/Kleinkinder im Alter von < 6 Jahren) wurde die Xenpozyme-Dosis im Rahmen eines Schemas zur Dosissteigerung von 0,03 mg/kg auf eine Zieldosis von 3 mg/kg erhöht. Die Behandlung wurde bis zu 64 Wochen lang als intravenöse Infusion einmal alle 2 Wochen verabreicht. Die in die Studie aufgenommenen Patienten hatten ein Milzvolumen von ≥5-fach der Norm gemäss MRT. Die Patienten waren über alle Altersgruppen von 1,5 bis 17,5 Jahren verteilt und beide Geschlechter waren gleichermassen vertreten. Das mittlere (SD) Alter zum Zeitpunkt der ASMD-Diagnose betrug 2,5 (2,5) Jahre. Zu Studienbeginn waren bei 8 von 20 pädiatrischen Patienten (40 %) neurologische Manifestationen zu erkennen, die mit der klinischen Diagnose ASMD Typ A/B übereinstimmten. Die anderen 12 Patienten wiesen eine klinische Diagnose auf, die mit ASMD Typ B übereinstimmte.
Die Behandlung mit Xenpozyme führte in Woche 52 zu Verbesserungen bei der mittleren prozentualen Veränderung des Sollwerts (%) der DLCO, des Milz- und Lebervolumens, der Thrombozytenzahl und der Entwicklung des Längenwachstums (laut Z-Scores für Körpergrösse) im Vergleich zum Studienbeginn (siehe Tabelle 10).
Tabelle 10: Prozentuale Veränderung (SE) der LS-Mittelwerte oder Veränderung (SD) der Wirksamkeitsparameter von Studienbeginn bis Woche 52 (alle Alterskohorten)
|
|
Ausgangswert
(N = 20)
|
Woche 52
(N = 20)
| |
Mittlere DLCO in % des Sollwerts (SD)
Prozentuale Veränderung des DLCO*-Sollwerts
95 %-KI
|
54,8 (14,2)
|
71,7 (14,8)
32,9 (8,3)
13,4; 52,5
| |
Mittleres Milzvolumen (MN) (SD)
Veränderung des Milzvolumens (MN)
95 %-KI
|
19,0 (8,8)
|
9,3 (3,9)
-49,2 (2,0)
-53,4, -45,0
| |
Mittleres Lebervolumen (MN) (SD)
Prozentuale Veränderung des Lebervolumens (MN)
95 %-KI
|
2,7 (0,7)
|
1,5 (0,3)
-40,6 (1,7)
-44,1, -37,1
| |
Mittlere Thrombozytenzahl (109/l) (SD)
Prozentuale Veränderung der Thrombozytenzahl
95 %-KI
|
137,7 (62,3)
|
173,6 (60,5)
34,0 (7,6)
17,9, 50,1
| |
Mittlere Körpergrösse als Z-Scores (SD)
Veränderung der Z-Scores der Körpergrösse*
95 %-KI
|
-2,1 (0,8)
|
-1,6 (0,8)
0,6 (0,4)
(0,38, 0,73)
|
* Die DLCO wurde bei 9 pädiatrischen Patienten im Alter von ≥5 Jahren untersucht, bei denen der Test durchgeführt werden konnte. Die Veränderung der Körpergrösse (Z-Score) wurde bei 19 pädiatrischen Patienten untersucht.
Die Wirkungen von Xenpozyme auf Milz- und Lebervolumina sowie Thrombozytenzahl und die Körpergrösse (Z-Scores) wurden bei allen in die Studie eingeschlossenen pädiatrischen Alterskohorten beobachtet.
Verlängerungsstudie bei pädiatrischen Patienten
Zwanzig pädiatrische Patienten, die an der ASCEND-Peds-Studie teilnahmen, setzten die Behandlung in einer unverblindeten Verlängerungsstudie fort und erhielten Xenpozyme bis zu > 8 Jahre.
Im Studienverlauf wurden bei pädiatrischen Patienten anhaltende Verbesserungen der Wirksamkeitsparameter (DLCO (% des Sollwerts), Milz- und Lebervolumen, Thrombozytenzahlen, Körpergrösse (Z-Scores) und Knochenalter) bis Monat 48 beobachtet (siehe Tabelle 11).
Tabelle 11: Prozentuale Veränderung der LS-Mittelwerte oder Veränderung (SD) der Wirksamkeitsparameter von Studienbeginn bis Monat 48
|
|
Monat 48
| |
N
Prozentuale Veränderung der DLCO (% des Sollwerts) (SD)
|
5
60,3 (58,5)
| |
N
Prozentuale Veränderung des Milzvolumens (SD)
|
7
-69,1 (4,1)
| |
N
Prozentuale Veränderung des Lebervolumens (SD)
|
7
-55,4 (11,0)
| |
N
Prozentuale Veränderung der Thrombozytenzahl (SD)
|
5
35,8 (42,4)
| |
N
Veränderung der Körpergrösse (Z-Scores) (SD)
|
5
2,3 (0,8)
| |
N
Veränderung des Knochenalters (Monate) (SD)
|
7
18,5 (19,0)
|
N: Anzahl der Patienten
|


