ZusammensetzungWirkstoffe
Semaglutidum
Hilfsstoffe
Natrii salcaprozas corresp. natrium 22.9 mg, povidonum K 90, cellulosum microcristallinum, magnesii stearas
Indikationen/AnwendungsmöglichkeitenRybelsus wird zur Behandlung Erwachsener mit unzureichend kontrolliertem Diabetes mellitus Typ 2 ergänzend zu Diät und Bewegung angewendet:
·als Monotherapie bei Kontraindikation oder Unverträglichkeit für Metformin.
·in Kombination mit anderen blutzuckersenkenden Arzneimitteln.
Siehe «Klinische Wirksamkeit» für Ergebnisse zu den in klinischen Studien untersuchten Kombinationen und zur kardiovaskulären Sicherheit.
Dosierung/AnwendungÜbliche Dosierung
Die Anfangsdosis von Rybelsus beträgt 3 mg einmal täglich. Nach 1 Monat sollte die Dosis auf 7 mg einmal täglich (Erhaltungsdosis) erhöht werden. Falls die blutzuckersenkende Wirkung nach mindestens einmonatiger Behandlung mit der 7-mg-Dosis ungenügend ist, kann die Erhaltungsdosis auf maximal 14 mg einmal täglich erhöht werden.
Patienten, die mit Rybelsus 14 mg einmal täglich behandelt werden, können auf eine subkutane Injektion von 0.5 mg einmal wöchentlich (Ozempic) umgestellt werden. Die Patienten können am Tag nach der letzten Dosis von Rybelsus mit Ozempic beginnen. Patienten, die mit einer einmal wöchentlichen Injektion von Ozempic 0.5 mg s.c. behandelt werden, können auf Rybelsus 7 mg oder 14 mg einmal täglich übergehen. Patienten können bis zu 7 Tage nach der letzten Injektion von Ozempic mit Rybelsus beginnen. Für Ozempic 1 mg gibt es keine Äquivalentdosis zu Rybelsus.
Bei der Anwendung von Rybelsus in Kombination mit Metformin und/oder einem Natrium-Glucose-Cotransporter-2-Hemmer (SGLT2i) oder einem Glitazon kann die aktuelle Dosierung von Metformin und/oder SGLT2i/Glitazon beibehalten werden.
Bei der Anwendung von Rybelsus in Kombination mit einem Sulfonylharnstoff oder Insulin sollte eine Reduktion der Dosis des Sulfonylharnstoffs oder Insulins erwogen werden, um das Hypoglykämierisiko zu reduzieren (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Besondere Patientengruppen
Ältere Patienten (≥65 Jahre alt)
Eine Dosisanpassung ist bei älteren Menschen nicht erforderlich (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Eine Dosisanpassung ist bei Patienten mit eingeschränkter Leberfunktion nicht erforderlich (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Eine Dosisanpassung ist bei Patienten mit eingeschränkter Nierenfunktion nicht erforderlich (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Rybelsus bei Kindern und Jugendlichen unter 18 Jahren wurde nicht untersucht.
Rybelsus ist eine Tablette zur einmal täglichen oralen Anwendung.
Art der Anwendung
Rybelsus sollte auf den nüchternen Magen eingenommen werden. Rybelsus sollte als ganze Tablette mit bis zu einem halben Glas Wasser (120 ml) geschluckt werden. Die Tablette darf nicht zerdrückt oder zerkaut werden. Es muss mindestens 30 Minuten gewartet werden, bevor die erste Mahlzeit, das erste Getränk oder andere orale Arzneimittel eingenommen werden. Eine Wartezeit von weniger als 30 Minuten kann die Absorption von Semaglutide herabsetzen.
Falls eine Dosis vergessen wurde, sollte diese übersprungen werden. Die nächste Dosis sollte am folgenden Tag eingenommen werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenRybelsus sollte nicht bei Patienten mit Diabetes mellitus Typ 1 oder zur Behandlung der diabetischen Ketoazidose angewendet werden. Für mit Insulin behandelte Patienten liegen Berichte vor, dass durch Absetzen oder zu schnelle Reduktion der Dosis von Insulin beim Start der Behandlung mit GLP-1 Rezeptoragonisten eine diabetische Ketoazidose ausgelöst werden kann.
Gastrointestinale unerwünschte Wirkungen und Dehydrierung
Die Anwendung von GLP-1-Rezeptor-Agonisten kann mit unerwünschten gastrointestinalen Wirkungen assoziiert sein. Diese können zu Dehydrierung führen, was in seltenen Fällen eine Verschlechterung der Nierenfunktion verursachen kann.
Akute Pankreatitis
Bei Anwendung von GLP-1-Rezeptor-Agonisten wurde akute Pankreatitis beobachtet. Patienten müssen über die charakteristischen Symptome einer akuten Pankreatitis informiert werden. Wird eine Pankreatitis vermutet, ist Rybelsus abzusetzen; wird eine akute Pankreatitis bestätigt, ist die Behandlung mit Rybelsus nicht erneut aufzunehmen. Bei Patienten mit Pankreatitis in der Vorgeschichte ist Vorsicht geboten.
In Abwesenheit anderer Anzeichen und Symptome einer akuten Pankreatitis sind die Anstiege von Pankreasenzymen allein nicht prädiktiv für eine akute Pankreatitis.
Hypoglykämie
Patienten, die Rybelsus in Kombination mit einem Sulfonylharnstoff oder Insulin behandelt werden, können ein erhöhtes Hypoglykämierisiko haben. Das Hypoglykämierisiko kann durch Reduktion der Sulfonylharnstoff- oder der Insulin-Dosis bei Behandlungsinitiierung mit Rybelsus gesenkt werden.
Risiko thyreoidaler C-Zell-Tumoren
Präklinische Studien mit GLP-1-Rezeptoragonisten an Nagern legen nahe, dass GLP-1-Rezeptoragonisten möglicherweise mit einem erhöhten Risiko von fokalen Hyperplasien der thyreoidalen C-Zellen und C-Zell-Tumoren einhergehen (siehe «Präklinische Daten»).
Es ist nicht bekannt, ob beim Menschen ein Zusammenhang besteht zwischen GLP-1-Rezeptoragonisten und thyreoidalen C-Zell-Tumoren, einschliesslich des medullären Schilddrüsenkarzinoms (medullary thyroid carcinoma, MTC). Patienten mit MTC und Patienten mit multiplem endokrinem Neoplasie-Syndrom vom Typ 2 (MEN 2) in der Anamnese wurden in den klinischen Studien mit Semaglutide nicht behandelt. Vor einer Behandlung mit Rybelsus ist deshalb in diesem spezifischen Kollektiv eine sorgfältige Nutzen-Risiko-Abwägung erforderlich.
Der klinische Wert einer routinemässigen Überwachung des Serum-Calcitonin-Spiegels ist nicht belegt.
Diabetische Retinopathie
Rasche Verbesserung der glykämischen Kontrolle wurde mit temporärer Verschlechterung der diabetischen Retinopathie assoziiert. Langfristige glykämische Kontrolle senkt das Risiko der diabetischen Retinopathie. Patienten mit diabetischer Retinopathie in der Vorgeschichte sollten gemäss klinischen Richtlinien vor Ort überwacht und behandelt werden.
Herzinsuffizienz
Es liegen keine therapeutischen Erfahrungen mit Patienten mit kongestiver Herzinsuffizienz der NYHA-Klasse IV (New York Heart Association) vor. Daher wird die Anwendung von Semaglutide bei diesen Patienten nicht empfohlen.
Patienten nach bariatrischer Chirurgie
Es gibt keine therapeutischen Erfahrungen mit Semaglutide bei Patienten nach bariatrischer Chirurgie.
Gastrointestinale (unerwünschte) Wirkungen
Nach Markteinführung wurde bei Patienten, die mit GLP-1-Rezeptor-Agonisten behandelt wurden, über akute Nierenschäden und eine Verschlechterung der chronischen Nieren-insuffizienz berichtet, die manchmal eine Hämodialyse erforderlich machen können. Einige dieser Ereignisse wurden bei Patienten ohne bekannte zugrunde liegende Nierenerkrankung gemeldet. Die Mehrzahl der gemeldeten Ereignisse trat bei Patienten auf, die bereits unter Übelkeit, Erbrechen, Durchfall oder Dehydrierung litten. Die Nierenfunktion soll überwacht werden, wenn die Behandlung mit Rybelsus bei Patienten, die über schwere unerwünschte Magen-Darm-Reaktionen berichten, initiiert oder auftitriert wird.
Dieses Arzneimittel enthält 22.9 mg Natrium pro Tablette, d. h. 1 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
InteraktionenIn-vitro-Studien haben für Semaglutide ein sehr geringes Potenzial für die Inhibition oder Induktion von CYP-Enzymen und für die Inhibition von Wirkstofftransportern aufgezeigt.
Semaglutide verzögert die Magenentleerung. Dies kann die Resorption anderer gleichzeitig oral angewendeter Arzneimittel beeinflussen.
Es wurden keine klinisch relevanten Arzneimittelwechselwirkungen zwischen Semaglutide und den beurteilten Arzneimitteln beobachtet. Daher ist bei gleichzeitiger Verabreichung mit Rybelsus keine Dosisanpassung erforderlich.
Es ist wichtig, dass Patienten, die gleichzeitig mit Rybelsus und anderen oral verabreichten Arzneimitteln behandelt werden, die Dosierungsanweisungen im «Dosierung» befolgen.
Wirkungen von Rybelsus auf andere Arzneimittel
Levothyroxin
Die Gesamtexposition (AUC) von Thyroxin (angepasst an endogene Spiegel) stieg nach der Verabreichung einer Einzeldosis von 600 µg Levothyroxin gleichzeitig verabreicht mit Semaglutide um 33 % an. Die maximale Exposition (Cmax) war unverändert. Bei Patienten, die gleichzeitig mit Rybelsus und Levothyroxin behandelt werden, sollte eine Überwachung der Schilddrüsenwerte erwogen werden.
Rosuvastatin
Die Gesamtexposition (AUC) von Rosuvastatin war um 41 % und die maximale Exposition (Cmax) um 10 % erhöht. Aufgrund des breiten therapeutischen Index von Rosuvastatin wird das Ausmass der Expositionsänderungen als klinisch nicht relevant angesehen.
Metformin
Die Gesamtexposition (AUC) von Metformin war um 32 % erhöht und die maximale Exposition (Cmax) war unverändert. Aufgrund des breiten therapeutischen Index von Metformin wird das Ausmass der Expositionsänderungen nicht als klinisch relevant angesehen.
Furosemide
Die Gesamtexposition (AUC) von Furosemid war um 28 % erhöht und die maximale Exposition (Cmax) um 34 % verringert. Aufgrund des breiten therapeutischen Index von Furosemid wird das Ausmass der Expositionsänderungen als klinisch nicht relevant angesehen.
Orale Kontrazeptiva
Semaglutide veränderte die Exposition (AUC oder Cmax) bei Kombination mit oralen Kontrazeptiva (Ethinylestradiol und Levonorgestrel enthaltend) nicht.
Warfarin und andere Cumarinderivate
Nach Gabe einer Einzeldosis Warfarin veränderte Semaglutide die Gesamtexposition oder die Cmax von R- und S-Warfarin nicht. Es kam auch nicht zu einer klinisch relevanten Änderung der pharmakodynamischen Wirkungen von Warfarin, gemessen an der International Normalised Ratio (INR). Jedoch wurden Fälle von INR-Senkungen bei gleichzeitiger Anwendung von Acenocoumarol und Semaglutide berichtet. Bei Einleitung einer Semaglutide-Behandlung bei Patienten, die Warfarin oder andere Cumarinderivate einnehmen, wird daher eine regelmässige Überwachung des INR empfohlen.
Digoxin
Semaglutide veränderte die Exposition (AUC oder Cmax) von Digoxin nicht.
Lisinopril
Semaglutide veränderte die Exposition (AUC oder Cmax) von Lisinopril nicht.
Wirkungen anderer Arzneimittel auf Rybelsus
Omeprazol
Bei gleichzeitiger Einnahme mit Omeprazol wurde keine klinisch relevante Veränderung der AUC oder Cmax von Semaglutide beobachtet (z. B. Protonenpumpenhemmer, die den pH-Wert des Magens erhöhen).
Wechselwirkungen mit Nahrungsmitteln
Die gleichzeitige Einnahme von Nahrungsmitteln reduziert die Exposition gegenüber Semaglutide (siehe «Dosierung und Anwendung»).
Schwangerschaft, StillzeitSchwangerschaft
Es liegen begrenzte Daten zur Anwendung von Semaglutide bei schwangeren Frauen vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»).
Aus diesem Grund sollte Rybelsus während der Schwangerschaft nicht verwendet werden. Frauen im gebärfähigen Alter wird empfohlen, während der Behandlung mit Rybelsus zu verhüten. Falls eine Patientin schwanger werden möchte oder schwanger wird, sollte die Behandlung mit Rybelsus abgebrochen werden. Die Behandlung mit Rybelsus sollte aufgrund seiner langen Halbwertszeit mindestens 2 Monate vor einer geplanten Schwangerschaft abgebrochen werden.
Stillzeit
In der Muttermilch stillender Frauen wurden keine messbaren Konzentrationen von Semaglutide gefunden. Salcaprozat Natrium war in der Muttermilch vorhanden, und einige seiner Metaboliten wurden in geringen Konzentrationen ausgeschieden. Da ein Risiko für das gestillte Kind nicht ausgeschlossen werden kann, sollte Rybelsus während der Stillzeit nicht angewendet werden.
Fertilität
Es ist nicht bekannt, ob Semaglutide eine Auswirkung auf die menschliche Fertilität hat. Semaglutide beeinträchtigt die Fertilität männlicher Ratten nicht. Bei weiblichen Ratten wurden bei Dosen, die mit einem mütterlichen Gewichtsverlust einhergingen, eine Verlängerung des Östrus und eine geringe Abnahme der Anzahl der Ovulationen beobachtet (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenSchwindel kann vor allem initial während der Dosistitration auftreten und die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen.
Wenn es zusammen mit Sulfonylharnstoffen oder Insulin verwendet wird, sollten Patienten angewiesen werden, Vorsichtsmassnahmen zu treffen, um Hypoglykämien beim Lenken von Fahrzeugen und Bedienen von Maschinen zu vermeiden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils:
In 10 Phase-3a-Studien erhielten 5'707 Patienten Rybelsus allein oder in Kombination mit anderen blutzuckersenkenden Arzneimitteln. Die Dauer der Behandlung reichte von 26 Wochen bis zu 78 Wochen.
Die in klinischen Studien am häufigsten berichteten unerwünschten Wirkungen waren gastrointestinale Störungen, einschliesslich Übelkeit, Durchfall und Erbrechen. Im Allgemeinen war der Schweregrad dieser Reaktionen leicht bis mittelschwer und von kurzer Dauer.
Tabellarische Auflistung der Nebenwirkungen:
Tabelle 1 führt die unerwünschten Wirkungen auf, die in Phase-3-Studien (weitere Informationen siehe «Eigenschaften/Wirkungen») und Post-Marketing Daten bei Patienten mit Typ 2 Diabetes mellitus berichtet wurden. Die Häufigkeiten der unerwünschten Wirkungen (ausser Komplikationen der diabetischen Retinopathie, siehe Fussnote in Tabelle 1) basieren auf den gepoolten Daten der Phase-3a-Studien, ausgenommen die Studie zu den kardiovaskulären Ereignissen.
Die unerwünschten Wirkungen sind untenstehend nach MedDRA Systemorganklasse und Häufigkeit gemäss folgender Konvention geordnet: Sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000); nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden). Innerhalb der Häufigkeitsbereiche werden die unerwünschten Wirkungen in absteigender Reihenfolge bezüglich ihres Schweregrades angegeben.
Tabelle 1: Häufigkeit unerwünschte Wirkungen von oral verabreichtem Semaglutide
|
MedDRA-Systemorganklasse
|
Sehr häufig
|
Häufig
|
Gelegentlich
|
Selten
|
Nicht bekannt
| |
Erkrankungen des Immunsystems
|
|
|
Überempfindlich-keitc
|
Anaphylaktische Reaktion
|
| |
Stoffwechsel- und Ernährungsstörungen
|
Hypoglykämie bei Anwendung mit Insulin oder SU (Sulfonyl-harnstoffe)*
|
Hypoglykämie bei Anwendung mit anderen OAD
(orale Antidiabetika)*
Verminderter Appetit
|
|
|
| |
Erkrankungen des Nervensystems
|
|
Schwindelgefühl
|
Dysgeusie
|
|
| |
Augenerkrankungen
|
|
Komplikationen der diabetischen Retinopathieb
|
|
|
| |
Herzerkrankungen
|
|
|
Erhöhte Herzfrequenz
|
|
| |
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit
Diarrhö
|
Erbrechen
Bauchschmerzen
Abdominelles Spannungsgefühl
Obstipation
Dyspepsie
Gastritis
Gastroöso-phagealer Reflux
Flatulenz
|
Aufstossen
Verzögerte Magenentleerung
|
Akute Pankreatitis
|
Darmobstruktiond,e
| |
Leber- und Gallen-erkrankungen
|
|
Erhöhte Lipase
Erhöhte Amylase
|
Cholelithiasis
Cholezystitis
|
|
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
Erschöpfung
|
|
|
| |
Untersuchungen
|
|
|
Gewichts-abnahme
|
|
| |
* Hypoglykämie Grad 2 (ADA 2018, <3.0 mmol/l oder <54 mg/dl)
b Komplikationen bei diabetischer Retinopathie setzen sich zusammen aus: Fotokoagulation, Behandlung mit intravitrealen Mitteln, Glaskörperblutung, diabetesbedingte Blindheit (gelegentlich). Die Häufigkeit basiert auf der kardiovaskulären Endpunktstudie mit Semaglutide s.c. aber es kann nicht ausgeschlossen werden, dass das Risiko der diabetischen Retinopathie auch für Semaglutide p.o gilt.
c Sammelbegriff, der auch unerwünschte Wirkungen im Zusammenhang mit Überempfindlichkeitsreaktionen wie Hautausschlag und Urtikaria umfasst.
d Aus Meldungen nach Markteinführung
e Sammelbegriff, der die unerwünschten Ereignisse Darmobstruktion, Ileus und Dünndarmobstruktion umfasst
|
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Hypoglykämie
Sehr häufig – Hypoglykämie bei Anwendung mit Insulin (24 %) oder SU (11 %)
Häufig – Hypoglykämie bei Anwendung mit anderen OAD
Schwere Hypoglykämie wurde vorwiegend beobachtet, wenn Rybelsus zusammen mit einem Sulfonylharnstoff (<0.1 % der Teilnehmer, <0.001 Ereignisse/Patientenjahr) oder Insulin (1.1 % der Teilnehmer, 0.013 Ereignisse/Patientenjahr) verwendet wurde. Bei der Anwendung von Rybelsus in Kombination mit oralen Antidiabetika, ausgenommen Sulfonylharnstoff, wurden wenige Episoden (0.1 % der Teilnehmer, 0.001 Ereignisse/Patientenjahr) beobachtet.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig – Übelkeit (15 %), Durchfall (10 %)
Häufig – Erbrechen
Bei 15 % der Patienten, die mit Rybelsus behandelt wurden, trat Übelkeit auf, bei 10 % Durchfall und bei 7 % Erbrechen. Die meisten Ereignisse waren leicht bis mittelschwer und von kurzer Dauer. Die Ereignisse führten bei 4 % der Patienten zum Behandlungsabbruch. Die Ereignisse wurden am häufigsten in den ersten Monaten der Behandlung berichtet.
Selten – akute Pankreatitis
Unabhängig bestätigte akute Pankreatitis wurde in Phase-3a-Studien bei Semaglutide (< 0.1 %) und Vergleichspräparat (0.2 %) berichtet. In der kardiovaskulären Endpunktstudie betrug die Häufigkeit für unabhängig bestätigte akute Pankreatitis 0.1 % für Semaglutide und 0.2 % für Placebo (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Behandlungsabbruch aufgrund einer unerwünschten Wirkung
Die Inzidenz der Behandlungsabbrüche aufgrund von unerwünschten Wirkungen lag bei Patienten, die mit Rybelsus behandelt wurden, bei 9 %. Die am häufigsten zum Abbruch führenden unerwünschten Wirkungen waren gastrointestinale Störungen.
Erhöhte Herzfrequenz
In den Phase-3-Studien wurde ein mittlerer Anstieg von 2 Schlägen pro Minute mit Rybelsus beobachtet.
Augenerkrankungen
Häufig – Komplikationen der diabetischen Retinopathie
In einer 2-jährigen klinischen Studie mit Semaglutide s.c. mit 3'297 Patienten mit Diabetes mellitus Typ 2 und hohem kardiovaskulären Risiko waren die Komplikationen der diabetischen Retinopathie ein Endpunkt. In dieser Studie traten Komplikationen der diabetischen Retinopathie bei Patienten, die mit Semaglutide s.c. behandelt wurden, häufiger auf (3.0 %) als unter Placebo (1.8 %). Über 80 % der Patienten mit einer Komplikation der diabetischen Retinopathie hatten vor Behandlungsbeginn eine dokumentierte diabetische Retinopathie. Bei Patienten, die keine diabetische Retinopathie in der Vorgeschichte (dokumentiert) hatten, war die Anzahl der Ereignisse unter Semaglutide s.c. und Placebo ähnlich.
In klinischen Studien mit Rebelsus mit einer Dauer von bis zu 18 Monaten mit 6'352 Patienten mit Diabetes mellitus Typ 2 traten unerwünschte Wirkungen im Zusammenhang mit der diabetischen Retinopathie unter Semaglutide (4.2 %) und Vergleichspräparat (3.8 %) in ähnlichem Verhältnis auf.
Immunogenität
Entsprechend den potenziell immunogenen Eigenschaften von protein- oder peptidhaltigen Arzneimitteln können Patienten durch die Behandlung mit Semaglutide Antikörper bilden. Der Anteil der Patienten, deren Test auf gegen Semaglutide gerichtete Antikörper zu einem beliebigen Zeitpunkt nach Behandlungsbeginn positiv war, war 14 (0.5 %). Von diesen 14 Patienten entwickelten 7 Patienten (0.2 % der Gesamtpopulation) Antikörper, die mit nativem GLP-1 kreuzreagierten. Die neutralisierende Aktivität der Antikörper ist derzeit noch ungewiss.
Unerwünschte Wirkungen nach Markteinführung
Erkrankungen der Nieren- und Harnwege: Akute Nierenschädigung (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIn klinischen Studien zeigte sich, dass die Überdosierung mit Semaglutide zu gastrointestinalen Störungen führen kann. Im Falle einer Überdosierung muss die angesichts der klinischen Anzeichen und Symptomen des Patienten geeignete unterstützende Behandlung eingeleitet werden.
Möglicherweise ist angesichts der langen Halbwertszeit von Semaglutide von ca. 1 Woche (siehe «Pharmakokinetik») ein verlängerter Beobachtungs- und Behandlungszeitraum für diese Symptome notwendig. Es gibt kein spezifisches Gegenmittel für eine Überdosierung mit Semaglutide.
Eigenschaften/WirkungenATC-Code:
A10BJ06
Wirkungsmechanismus
Semaglutide ist ein GLP-1-Analogon des an der Regulation der Glukosehomöostase beteiligten humanen Peptids GLP-1. Aufgrund seiner ausgeprägten Albuminbindung verzögert sich die renale Clearance von Semaglutide. Ausserdem ist Semaglutide aufgrund seiner gegenüber dem nativen GLP-1 modifizierten Struktur unempfindlichen gegenüber dem Abbau durch DPP-4.
Semaglutide wirkt als ein Agonist am Zielrezeptor für natives GLP-1. GLP-1-Rezeptoren sind im Pankreas, im Gehirn, im Herzen, im Gefässsystem, im Immunsystem und den Nieren exprimiert. Die Stimulation von GLP-1 Rezeptoren durch Semaglutide führt abhängig vom Blutzuckerspiegel zur Stimulation der Insulinsekretion und zur Hemmung der Glucagonsekretion. Zusätzlich kommt es zur Verzögerung der Magenentleerung in der frühen postprandialen Phase.
Semaglutide reduziert das Körpergewicht und die Körperfettmasse mittels einer verringerten Energieaufnahme. Der Mechanismus umfasst einen allgemein verminderten Appetit, der erhöhtes Sättigungs- und vermindertes Hungergefühl einschliesst. Die Insulinresistenz wird reduziert. Dies erfolgt vermutlich durch die Reduktion des Körpergewichts.
Pharmakodynamik
Rybelsus senkt den Nüchternblutzucker sowie den selbstgemessenen Blutzuckerspiegel. Die Wirkung setzt frühzeitig ein, wobei bei Patienten mit Typ 2 Diabetes mellitus eine Senkung des NBZ (Nüchternblutzucker) in der ersten Woche eintritt.
Alle pharmakodynamischen Untersuchungen wurden nach 12 Behandlungswochen (einschliesslich der Dosiseskalierung) im Steady State mit 1 mg Semaglutide Injektionen einmal wöchentlich durchgeführt.
Nüchternblutzucker und postprandiale Anstiege
Semaglutide reduziert den Nüchternblutzucker und den postprandialen Blutzucker. Bei Patienten mit Typ 2 Diabetes mellitus führte die Behandlung mit Semaglutide zur Verringerung des Blutzuckerspiegels, sowohl hinsichtlich auf absolute Veränderung gegenüber dem Ausgangswert als auch relative Verringerung im Vergleich zum Placebo in Bezug auf Nüchternblutzucker (1.6 mmol/l/29 mg/dl; 22 %), postprandialen Blutzucker nach 2 Stunden (4.1 mmol/l/74 mg/dl; 37 %), mittleren 24-Stunden-Blutzuckerspiegel (1.7 mmol/l/30 mg/dl; Verminderung um 22 %) und postprandiale Blutzuckerexkusionen über 3 Mahlzeiten (0.6–1.1 mmol/l/11–20 mg/dl) im Vergleich zum Placebo.
Betazellfunktion und Insulinsekretion
Semaglutide verbessert die Betazellfunktion. Im Vergleich zu Placebo verbesserte Semaglutide die Erst- und Zweitphasen-Insulinantwort um das 3- bzw. 2-fache und erhöhte die maximale sekretorische Kapazität der Betazellen nach einem Arginin-Stimulationstest bei Patienten mit Typ 2 Diabetes mellitus. Darüber hinaus erhöhte die Behandlung mit Semaglutide die Nüchtern-Insulinkonzentrationen im Vergleich zum Placebo.
Glucagonsekretion
Semaglutide senkt die Nüchtern- und die postprandialen Glucagon-Konzentrationen. Bei Patienten mit Typ 2 Diabetes mellitus führte Semaglutide zu der folgenden relativen Verringerung von Glucagon im Vergleich zum Placebo: Nüchtern-Glucagon (8–21 %), postprandiale Glucagon-Antwort (14–15 %) und mittlerer 24-Stunden-Glucagonspiegel (12 %).
Glucoseabhängige Insulin- und Glucagonsekretion
Semaglutide senkte die hohen Blutzuckerspiegel durch die glukoseabhängige Stimulation der Insulinsekretion und Hemmung der Glucagonsekretion. Mit Semaglutide war die Insulinsekretionsrate bei Patienten mit Typ 2 Diabetes mellitus vergleichbar mit der der gesunden Probanden.
Während einer induzierten Hypoglykämie veränderte Semaglutide im Vergleich zu Placebo die gegenregulatorischen Reaktionen auf den erhöhten Glucagonspiegel und verringerte die Senkung des C-Peptids bei Patienten mit Typ 2 Diabetes mellitus nicht.
Magenentleerung
Semaglutide bewirkte eine geringe Verzögerung der frühen postprandialen Magenentleerung und verminderte dadurch die Glukoserate, die postprandial in den Kreislauf gelangt.
Körpergewicht und -zusammensetzung
Mit Rybelsus wurde eine grössere Gewichtsreduktion erzielt als mit den Vergleichspräparaten (Placebo, Sitagliptin, Empagliflozin und Liraglutide). Der Gewichtsverlust war vorwiegend auf den Verlust von Fettgewebe zurückzuführen, mit einem Verlust an Fettmasse, die dreimal so gross war wie der Verlust an Muskelmasse.
Appetit, Energieaufnahme und Auswahl von Lebensmitteln
Im Vergleich zu Placebo reduzierte Semaglutide die Energiezufuhr aus 3 aufeinanderfolgenden ad libitum Mahlzeiten um 18–35 %. Dies wurde durch eine durch Semaglutide induzierte Unterdrückung des Appetits im nüchternen Zustand sowie durch eine postprandiale, verbesserte Kontrolle des Essens, weniger Hunger und eine relativ geringe Präferenz für fettreiche Nahrung bewirkt.
Nüchternblutfette und postprandiale Blutfette
Semaglutide verringerte im Vergleich zu Placebo die Nüchterntriglyzerid- und die VLDL-Cholesterine (Lipoproteine sehr niedriger Dichte) Konzentration um jeweils 12 % bzw. 21 %. Die postprandiale Triglyzerid- und VLDL-Cholesterinantwort nach einer sehr fettreichen Mahlzeit waren um >40 % verringert.
Kardiale Elektrophysiologie (QTc)
Die Auswirkung von Semaglutide auf die kardiale Repolarisation wurde in einer umfassenden QTc-Studie untersucht. Bei einem durchschnittlichen Expositionsniveau, das die maximal empfohlene Dosis von Rybelsus um das 4-Fache überschritt, verlängerte Semaglutide die QTc-Intervalle in keinem klinisch relevanten Masse.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Rybelsus wurden in acht globalen randomisierten, kontrollierten Phase-3a-Studien untersucht. Das primäre Ziel von sieben Studien war die Beurteilung der glykämischen Wirksamkeit, während das primäre Ziel einer weiteren Studie die Beurteilung der kardiovaskulären Sicherheit war.
Die Phase-3a-Studien umfassten 8'842 randomisierte Patienten mit Typ 2 Diabetes mellitus (5'169 wurden mit Rybelsus behandelt), einschliesslich 1'162 Patienten mit moderater Nierenfunktionsstörung. Die Wirksamkeit von Rybelsus wurde mit Placebo, Empagliflozin, Sitagliptin, Liraglutide und Dulaglutid verglichen.
In allen Studien führte die Behandlung mit Rybelsus zu einer klinisch signifikanten Verbesserung des HbA1c, des Nüchternblutzuckers (NBZ) und des Körpergewichts. Diese Wirkungen wurden bis zu einer Studiendauer von 78 Wochen beibehalten.
Die Wirksamkeit von Rybelsus wurde durch Alter, Geschlecht, Rasse, ethnische Zugehörigkeit, Körpergewicht, BMI, Diabetes-Dauer, Erkrankungen des oberen Gastrointestinaltrakts und Nierenfunktion zu Beginn der Studie nicht beeinflusst.
PIONEER 1 – Monotherapie
In einer 26-wöchigen Doppelblindstudie wurden 703 Patienten mit Typ 2 Diabetes, die durch Diät und Bewegung unzureichend kontrolliert waren, auf Rybelsus 3 mg, Rybelsus 7 mg, Rybelsus 14 mg oder Placebo einmal täglich randomisiert.
Tabelle 2: Ergebnisse einer 26-wöchigen Monotherapie-Studie (PIONEER 1) in der Rybelsus mit Placebo verglichen wurde
|
|
Rybelsus
7 mg
|
Rybelsus
14 mg
|
Placebo
| |
Population (N)1
|
175
|
175
|
178
| |
HbA1c (%)
| |
Ausgangswert2
|
8.0
|
8.0
|
7.9
| |
Änderung gegenüber dem Ausgangswert in Woche 263
|
-1.3
|
-1.5
|
-0.1
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-1.2
[-1.5; -1.0]§
|
-1.4
[-1.7; -1.2]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
72#
|
80#
|
34
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
89.0
|
88.1
|
88.6
| |
Änderung gegenüber dem Ausgangswert in Woche 263
|
-2.5
|
-4.1
|
-1.5
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-1.0
[-1.8; -0.2]§
|
-2.6
[-3.4; -1.8]§
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Daten, die nach Absetzen des Versuchsprodukts oder Beginn der Notfallmedikation erfasst wurden, sind ausgeschlossen.
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Placebo (p<0.05)
|
PIONEER 2 – Rybelsus vs. Empagliflozin, beide in Kombination mit Metformin
In einer 52-wöchigen offenen Studie wurden 822 Patienten mit Typ 2 Diabetes mellitus zu Rybelsus 14 mg einmal täglich oder Empagliflozin 25 mg einmal täglich, beide in Kombination mit Metformin, randomisiert.
Die Behandlung mit Rybelsus 14 mg einmal täglich reduzierte das HbA1c um -1.4 %-Punkte in Woche 26. Die Reduktion war statistisch signifikant grösser als mit Empagliflozin, mit einem geschätzten Behandlungsunterschied von -0.5 %-Punkten [-0.7; -0.4]95 %-KI.
Tabelle 3: Ergebnisse einer 52-wöchigen Studie, in der Rybelsus mit Empagliflozin verglichen wurde (PIONEER 2)
|
|
Rybelsus
14 mg
|
Empagliflozin
25 mg
| |
Population (N)1
|
411
|
410
| |
HbA1c (%)
| |
Ausgangswert2
|
8.1
|
8.1
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-1.3
|
-0.8
| |
Unterschied gegenüber Empagliflozin3
[95 %-KI]
|
-0.5
[-0.7; -0.4]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
72#
|
48
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
91.9
|
91.3
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-4.7
|
-3.8
| |
Unterschied gegenüber Empagliflozin3
[95 %-KI]
|
-0.9
[-1.6; -0.2]§
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Daten, die nach dem Absetzen des Prüfpräparates oder nach der Aufnahme der Behandlung mit der Notfallmedikation erfasst wurden, sind ausgeschlossen
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Empagliflozin (p<0.05)
|
PIONEER 3 – Rybelsus vs. Sitagliptin, beide in Kombination mit Metformin oder Metformin mit einem Sulfonylharnstoff
In einer 78-wöchigen doppelblinden Double-Dummy-Studie wurden 1'864 Patienten mit Typ 2 Diabetes auf Rybelsus 3 mg, Rybelsus 7 mg, Rybelsus 14 mg oder Sitagliptin 100 mg einmal täglich randomisiert, alle in Kombination mit Metformin oder Metformin und Sulfonylharnstoff.
Die Behandlung mit Rybelsus 7 mg und 14 mg einmal täglich reduzierte das HbA1c um -1.1 %-Punkte bzw. -1.4 %-Punkte in Woche 26; die Reduktion war statistisch signifikant grösser als mit Sitagliptin, mit einem geschätzten Behandlungsunterschied von -0.3 %-Punkten [-0.4; -0.2]95 %-KI und -0.6 %-Punkten [-0.7; -0.5]95 %-KI.
Die Reduktion des HbA1c und des Körpergewichts hielt während der gesamten Studiendauer von 78 Wochen an (Tabelle 4).
Tabelle 4: Ergebnisse einer 78-wöchigen Studie, in der Rybelsus mit Sitagliptin verglichen wurde (PIONEER 3)
|
|
Rybelsus
7 mg
|
Rybelsus
14 mg
|
Sitagliptin
100 mg
| |
Population (N)1
|
465
|
465
|
467
| |
HbA1c (%)
| |
Ausgangswert2
|
8.4
|
8.3
|
8.3
| |
Änderung gegenüber dem Ausgangswert in Woche 783
|
-0.7
|
-1.1
|
-0.4
| |
Unterschied gegenüber Sitagliptin3
[95 %-KI]
|
-0.3
[-1.6; -0.2]§
|
-0.7
[-0.8; -0.5]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
50#
|
52#
|
39
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
91.3
|
91.2
|
90.9
| |
Änderung gegenüber dem Ausgangswert in Woche 783
|
-2.7
|
-3.5
|
-1.1
| |
Unterschied gegenüber Sitagliptin3
[95 %-KI]
|
-1.6
[-2.2; -0.9]§
|
-2.4
[-3.0; -1.7]§
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Daten, die nach dem Absetzen des Prüfpräparates oder nach der Aufnahme der Behandlung mit der Notfallmedikation erfasst wurden, sind ausgeschlossen
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Sitagliptin (p<0.05)
|
PIONEER 4 – Rybelsus vs. Liraglutide und Placebo, jeweils in Kombination mit Metformin oder Metformin und einem SGLT2-Inhibitor
In einer 52-wöchigen doppelblinden Double-Dummy-Studie wurden 711 Patienten mit Typ 2 Diabetes auf Rybelsus 14 mg, Liraglutide 1.8 mg s.c. oder Placebo einmal täglich randomisiert, jeweils in Kombination mit Metformin oder Metformin und einem SGLT2-Inhibitor.
Die Behandlung mit Rybelsus 14 mg einmal täglich reduzierte das HbA1c um -1.3 %-Punkte in Woche 26; die Reduktion war statistisch signifikant grösser als mit Placebo und Liraglutide, mit einem geschätzten Behandlungsunterschied von -1.2 %-Punkten [-1.4; -1.0]95 %-KI und -0.2 %-Punkten [-0.3; -0.1]95 %-KI.
Tabelle 5: Ergebnisse einer 52-wöchigen Studie, in der Rybelsus mit Liraglutide und Placebo verglichen wurde (PIONEER 4)
|
|
Rybelsus
14 mg
|
Liraglutide
1.8 mg
|
Placebo
| |
Population (N)1
|
285
|
284
|
142
| |
HbA1c (%)
| |
Ausgangswert2
|
8.0
|
8.0
|
7.9
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-1.2
|
-0.9
|
0.2
| |
Unterschied gegenüber Liraglutid3 [95 %-KI]
|
-0.3
[-0.4; -0.1]§
|
-
|
-
| |
Unterschied gegenüber Placebo3 [95 %-KI]
|
-1.4
[-1.6; -1.2]§
|
-
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
69*
|
63
|
18
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
92.9
|
95.5
|
93.2
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-5,0
|
-3,1
|
-1,2
| |
Unterschied gegenüber Liraglutid3 [95 %-KI]
|
-1.8
[-2.6; -1.0]§
|
-
|
-
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-3.8
[-4.8; -2.7]§
|
-
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Daten, die nach dem Absetzen des Prüfpräparates oder nach der Aufnahme der Behandlung mit der Notfallmedikation erfasst wurden, sind ausgeschlossen
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Liraglutid (p<0.05)
|
PIONEER 5 – Rybelsus vs. Placebo, beide in Kombination mit einem Basalinsulin alleine, Metformin und einem Basalinsulin oder Metformin und/oder einem Sulfonylharnstoff, bei Patienten mit moderater Nierenfunktionsstörung
In einer 26-wöchigen doppelblinden Studie wurden 324 Patienten mit Typ 2 Diabetes und moderater Nierenfunktionsstörung (eGFR 30-59 ml/min/1.73 m2), die auf einer stabilen antidiabetischen Therapie waren, zusätzlich auf Rybelsus 14 mg oder Placebo einmal täglich randomisiert.
Das Wirksamkeits- und Sicherheitsprofil von Rybelsus bei Patienten mit Typ 2 Diabetes und moderater Nierenfunktion entsprach dem allgemein für GLP-1 Rezeptoragonisten beschriebenen.
Tabelle 6: Ergebnisse einer 26-wöchigen Studie, in der Rybelsus bei Patienten mit Typ 2 Diabetes und moderater Nierenfunktionsstörung mit Placebo verglichen wurde (PIONEER 5)
|
|
Rybelsus
14 mg
|
Placebo
| |
Population (N)1
|
163
|
161
| |
HbA1c (%)
| |
Ausgangswert2
|
8.0
|
7.9
| |
Änderung gegenüber dem Ausgangswert in Woche 263
|
-1.1
|
-0.1
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-1.0
[-1.2; -0.8]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
64#
|
21
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
91.3
|
90.4
| |
Änderung gegenüber dem Ausgangswert in Woche 263
|
-3.7
|
-1.1
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-2.7
[-3.5; -1.9]§
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Daten, die nach dem Absetzen des Prüfpräparates oder nach der Aufnahme der Behandlung mit der Notfallmedikation erfasst wurden, sind ausgeschlossen.
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Placebo (p<0.05)
|
PIONEER 7 – Rybelsus vs. Sitagliptin, jeweils in Kombination mit Metformin, SGLT2-Inhibitoren, einem Sulfonylharnstoff oder Glitazon (flexible Dosisanpassungsstudie)
In einer 52-wöchigen, offenen Studie wurden 504 Patienten mit Typ 2 Diabetes zu Rybelsus (flexible Dosisanpassung mit 3 mg, 7 mg und 14 mg einmal täglich) oder Sitagliptin 100 mg einmal täglich, jeweils in Kombination mit 1-2 oralen blutzuckersenkenden Arzneimitteln (Metformin, SGLT2-Inhibitoren, Sulfonylharnstoff oder Glitazon) randomisiert. Die Dosis von Rybelsus wurde alle 8 Wochen basierend auf dem glykämischen Ansprechen des Patienten sowie der Verträglichkeit angepasst. Die Sitagliptin-Dosis von 100 mg war fix. Die Wirksamkeit und Sicherheit von Rybelsus wurden in der Woche 52 beurteilt.
In der Woche 52 lag der Anteil der Patienten, die mit Rybelsus 3 mg, 7 mg und 14 mg behandelt wurden bei 9 %, 30 % und 60 %.
Tabelle 7: Ergebnisse einer 52-wöchigen Studie zur flexiblen Dosisanpassung von Rybelsus im Vergleich zu Sitagliptin (PIONEER 7)
|
|
Rybelsus
Flexible Dosis
|
Sitagliptin
100 mg
| |
Population (N)1
|
253
|
251
| |
HbA1c (%)
| |
Ausgangswert2
|
8.3
|
8.3
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-1.4
|
-0.7
| |
Unterschied gegenüber Sitagliptin3
[95 %-KI]
|
-0.7
[-0.9; -0.5]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
63#
|
28
| |
Körpergewicht (kg)
|
88.9
|
88.4
| |
Ausgangswert2
|
-2.9
|
-0.8
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-2.2
[-2.9; -1.5]§
|
-
| |
Unterschied gegenüber Sitagliptin3
[95 %-KI]
|
28#
|
13
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Sitagliptin (p<0.05)
|
PIONEER 8 – Rybelsus vs. Placebo, beide in Kombination mit Insulin mit oder ohne Metformin
In einer 52-wöchigen doppelblinden Studie wurden 731 Patienten mit unzureichend kontrolliertem Typ 2 Diabetes, die mit Insulin (Basalinsulin, Basal-/Bolusinsulin oder vorgemischtes Insulin) mit oder ohne Metformin behandelt wurden, zu Rybelsus 3 mg, Rybelsus 7 mg, Rybelsus 14 mg oder Placebo einmal täglich randomisiert.
Die Behandlung mit Rybelsus 7 mg und 14 mg einmal pro Tag reduzierte das HbA1c in der Woche 26 um jeweils -1.0 %-Punkte und -1.4 %-Punkte; die Reduktion war statistisch signifikant grösser als mit Placebo, wobei die geschätzte Behandlungsdifferenz bei jeweils -1.0 %-Punkten [-1.2; -0.8]95 %-KI und -1.4 %-Punkten [-1.6; -1.2]95 %-KI lag.
Tabelle 8: Ergebnisse einer 52-wöchigen Studie, in der Rybelsus in Kombination mit Insulin mit Placebo verglichen wurde (PIONEER 8)
|
|
Rybelsus
7 mg
|
Rybelsus
14 mg
|
Placebo
| |
Population (N)1
|
182
|
181
|
184
| |
HbA1c (%)
| |
Ausgangswert2
|
8.2
|
8.2
|
8.2
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-0.8
|
-1.2
|
0.0
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-0.9
[-1.1; -0.6]§
|
-1.3
[-1.5; -1.0]§
|
-
| |
Patienten (%), die einen HbA1c <7.0 % erreichten2
|
47#
|
64#
|
10
| |
Körpergewicht (kg)
| |
Ausgangswert2
|
87.1
|
84.6
|
86.0
| |
Änderung gegenüber dem Ausgangswert in Woche 523
|
-2.9
|
-4.3
|
0.6
| |
Unterschied gegenüber Placebo3
[95 %-KI]
|
-3.5
[-4.5; -2.6]§
|
-4.9
[-5.9; -3.9]§
|
-
| |
1
Full Analysis Set: Alle randomisierten Patienten
2 Beobachtetes Mittel/Anteil
3 Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region. Geschätzt mit einem gemischten Modell für wiederholte Messungen, angepasst an Basiswert, Hintergrundmedikation und Region.
§ Statistisch signifikant (p<0.05)
# Die Wahrscheinlichkeit, das Ziel zu erreichen, war mit Rybelsus statistisch signifikant grösser als mit Placebo (p<0.05)
|
Kardiovaskuläre Sicherheit
Die Kardiovaskulären Effekte von oralem Semaglutide wurden in der kardiovaskulären Outcome-Studie PIONEER 6 untersucht. Zusätzliche Daten zur kardiovaskulären Sicherheit von subkutan injiziertem Semaglutide wurden in der kardiovaskulären Outcome-Studie SUSTAIN 6 erhoben.
PIONEER 6
In dieser doppelblinden Studie wurden 3'183 Patienten mit Typ 2 Diabetes und hohem kardiovaskulären Risiko (2'695 [85 %] Patienten mit vorbestehender Herz-Kreislauf-Erkrankung sowie 488 [15 %] Patienten mit kardiovaskulären Risikofaktoren ohne vorbestehende Herz-Kreislauf-Erkrankung) zusätzlich zur vorbestehenden antihyperglykämischen Therapie randomisiert mit Rybelsus 14 mg einmal täglich oder Placebo behandelt (mittlere Behandlungsdauer 16 Monate). Die Behandlung konnte in beiden Armen gemäss den geltenden Therapierichtlinien intensiviert werden.
Primärer Endpunkt war die Zeit von der Randomisierung bis zum Auftreten des ersten schwerwiegenden kardiovaskulären Ereignisses (MACE: kardiovaskulärer Tod, nicht-tödlicher Herzinfarkt oder nicht-tödlicher Schlaganfall). Das kardiovaskuläre Risikos war bei den mit Semaglutide behandelten Patienten numerisch reduziert.
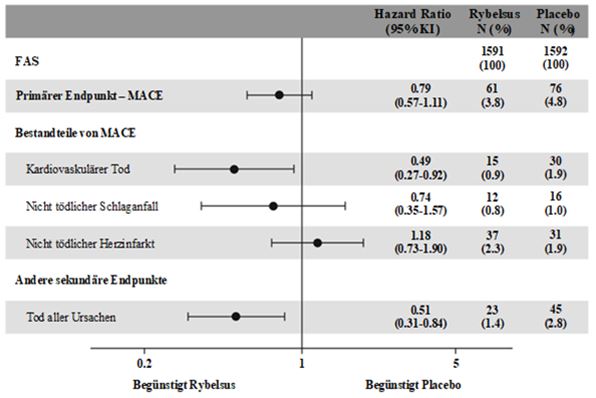
Abbildung 7: Forest-Plot: Behandlungseffekt auf den primären zusammengesetzten Endpunkt MACE, seine Komponenten und alle Todesursachen (PIONEER 6)
Dieser Effekt beruhte primär auf einer Abnahme der kardiovaskulären Mortalität.
SUSTAIN 6
In dieser 104-wöchigen doppelblinden Studie wurden 3'297 Patienten mit Typ 2 Diabetes und hohem kardiovaskulären Risiko (2'735 [83 %] Patienten mit vorbestehender Herz-Kreislauf-Erkrankung sowie 562 [27 %] Patienten mit kardiovaskulären Risikofaktoren ohne vorbestehende Herz-Kreislauf-Erkrankung) zusätzlich zur vorbestehenden antihyperglykämischen Therapie randomisiert mit Semaglutide 0.5 mg s.c., Semaglutide 1 mg s.c. oder Placebo behandelt (mittlere Behandlungsdauer 2 Jahre).
Primärer Endpunkt war die Zeit von der Randomisierung bis zum Auftreten des ersten schwerwiegenden kardiovaskulären Ereignisses (MACE: kardiovaskulärer Tod, nicht-tödlicher Herzinfarkt oder nicht-tödlicher Schlaganfall). Das kardiovaskuläre Risikos war bei den im Mittel über 2 Jahre mit Semaglutide behandelten Patienten reduziert.
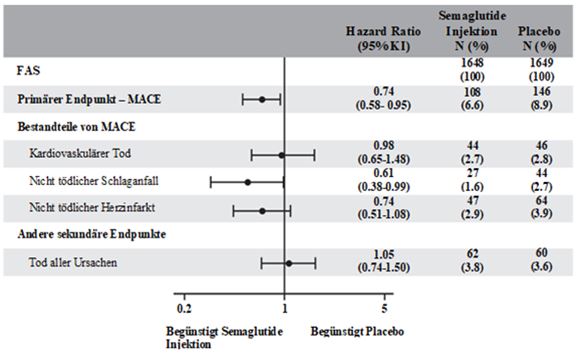
Abbildung 8: Forest-Plot: Behandlungseffekt auf den primären zusammengesetzten Endpunkt MACE, seine Komponenten und alle Todesursachen (SUSTAIN 6)
Die Abnahme des kardiovaskulären Risikos beruhte primär auf eine Verringerung der Anzahl nicht-tödlicher Schlaganfälle. Abweichend von den Ergebnissen der PIONEER-6 Studie für orales Semaglutide wurde für die Behandlung mit subkutan applizierten Semaglutide kein positiver Effekt auf die kardiovaskuläre Mortalität beobachtet.
PharmakokinetikAbsorption
Oral verabreichtes Semaglutide hat eine geringe absolute Bioverfügbarkeit und eine variable Absorption. Die tägliche Einnahme entsprechend der empfohlenen Dosierung in Kombination mit der langen Halbwertszeit reduziert die Fluktuation der Exposition von Tag zu Tag.
Semaglutide ist koformuliert mit Natrium-Salcaprozat, wodurch die Absorption von Semaglutide nach der oralen Verabreichung erleichtert wird. Die Absorption von Semaglutide erfolgt vorwiegend im Magen.
Die Pharmakokinetik von Semaglutide wurde bei gesunden Probanden sowie bei Patienten mit Typ 2 Diabetes umfassend charakterisiert. Bei oraler Gabe trat die maximale Plasmakonzentration von Semaglutide 1 Stunde nach der Verabreichung auf. Die Steady-State-Exposition wurde nach 4–5 Wochen bei einer einmal täglichen Verabreichung erreicht. Basierend auf die populationspharmakokinetsichen Analysen der Daten von Patienten mit Diabetes mellitus Typ 2 betrugen die durchschnittlichen Steady-State-Konzentrationen von Rybelsus 7 und 14 mg jeweils ca. 6.7 nmol/l und 14.6 nmol/l. Die systemische Exposition durch Semaglutide stieg proportional zur Dosis an.
Die Absorption von Semaglutide ist bei Einnahme mit Nahrung oder grösseren Mengen von Wasser vermindert. Eine längere Nüchternzeit nach der Einnahme führt zu einer höheren Absorption.
Die geschätzte absolute Bioverfügbarkeit von Semaglutide nach oraler Verabreichung beträgt weniger als 1 %.
Distribution
Das geschätzte absolute Verteilungsvolumen beträgt bei Patienten mit Typ 2 Diabetes ca. 8 l. Semaglutide ist weitestgehend an Plasmaproteine gebunden (>99 %).
Metabolismus
Semaglutide wird durch die proteolytische Spaltung des Peptidrückgrats und die sequentielle Beta-Oxidation der Fettsäurenseitenketten metabolisiert.
Elimination
Die Elimination von Stoffen, die mit Semaglutide im Zusammengang stehen, erfolgte vorwiegend über Urin und Fäzes. Etwa ca. 3 % der absorbierten Dosis wurde als intaktes Semaglutide über den Urin ausgeschieden.
Mit einer Eliminationshalbwertszeit von ca. 1 Woche wird Semaglutide nach der letzten Dosis bis zu 5 Wochen im Blutkreislauf vorhanden sein. Die Clearance von Semaglutide bei Patienten mit Typ 2 Diabetes lag bei ca. 0.04 l/h.
Durchschnittliches Expositionsniveau für Semaglutide bei oraler und subkutaner Verabreichung
Basierend auf populationspharmakokinetischen Analysen entspricht die durchschnittliche Exposition von Semaglutide 0.5 mg s.c. ungefähr 90 % derjenigen von Rybelsus 14 mg. Die durchschnittliche Exposition von Rybelsus 7 oder 14 mg entspricht ungefähr 60 % bzw. 110 % derjenigen von Semaglutide 0.5 mg s.c.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Eingeschränkte Leberfunktion hatte keine klinisch bedeutsame Auswirkung auf die Pharmakokinetik von Semaglutide. Die Pharmakokinetik von Semaglutide wurde bei Patienten mit leichter, mittelschwerer und schwer eingeschränkter Leberfunktion im Vergleich zu Teilnehmern mit normaler Leberfunktion in einer Studie, bei der in 10 aufeinanderfolgenden Tagen täglich eine Einzeldosis von Semaglutide verabreicht wurde, untersucht.
Nierenfunktionsstörungen
Eingeschränkte Nierenfunktion hatte keine klinisch bedeutsame Auswirkung auf die Pharmakokinetik von Semaglutide. Die Pharmakokinetik von Semaglutide wurde bei Patienten mit leichter, mittelschwerer und schwer eingeschränkter Nierenfunktion sowie bei dialysepflichtigen Patienten mit Nierenerkrankung im Endstadium im Vergleich zu Teilnehmern mit normaler Nierenfunktion in einer Studie, bei der an 10 aufeinanderfolgenden Tagen täglich eine Einzeldosis Semaglutide verabreicht wurde, untersucht. Basierend auf populationspharmakokinetischen Analysen der Daten aus Phase-3a-Studien wurde dies auch für Teilnehmer mit Typ 2 Diabetes sowie eingeschränkter Nierenfunktion nachgewiesen.
Ältere Patienten
Ausgehend von Daten aus klinischen Studien, in denen Patienten bis zum Alter von 92 Jahren
untersucht wurden, hatte das Alter keine Auswirkung auf die Pharmakokinetik von Semaglutide.
Kinder und Jugendliche
Semaglutide wurde bei pädiatrischen Patienten nicht untersucht.
Geschlecht
Das Geschlecht hatte keine klinisch bedeutsame Auswirkung auf die Pharmakokinetik von Semaglutide.
Rasse und ethnische Zugehörigkeit
Rasse (weiss, schwarz oder afro-amerikanisch, asiatisch) und ethnische Zugehörigkeit (Hispanoamerikaner oder Latinos) hatte keine Auswirkung auf die Pharmakokinetik von Semaglutide.
Körpergewicht
Das Körpergewicht hatte einen Einfluss auf die Exposition durch Semaglutide. Höheres Körpergewicht ging mit einer geringeren Exposition einher. Jedoch gewährleistete Rybelsus eine angemessene systemische Exposition bei dem in den klinischen Studien untersuchten Körpergewichtsbereich zwischen 40–188 kg.
Erkrankung des oberen Gastrointestinaltrakts
Eine Erkrankung des oberen Gastrointestinaltrakts (chronische Gastritis und/oder gastroösophagealer Reflux) hatte keine klinisch relevante Auswirkung auf die Pharmakokinetik von Semaglutide. Die Pharmakokinetik wurde bei Patienten mit Typ 2 Diabetes mit oder ohne Erkrankung des oberen Gastrointestinaltrakts untersucht, bei denen an 10 aufeinanderfolgenden Tagen täglich eine Einzeldosis Semaglutide verabreicht wurde.
Dies wurde auch bei den Patienten mit Typ 2 Diabetes mellitus und einer Erkrankung des oberen Gastrointestinaltrakts in den Phase-3a-Studien nachgewiesen.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe oder Gentoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Kanzerogenität
Nicht-letale C-Zelltumoren der Schilddrüse, die bei Nagetieren beobachtet wurden, sind ein Klasseneffekt der GLP-1-Rezeptor-Agonisten. Bei 2-jährigen Karzinogenitätsstudien an Ratten und Mäusen traten bei klinisch relevanten Expositionen C-Zelltumore der Schilddrüse auf. Die C-Zelltumore bei Nagetieren werden durch einen nicht-gentoxischen, spezifisch durch den GLP-1-Rezeptor vermittelten Mechanismus verursacht, für den Nager besonders empfänglich sind. Die Relevanz für den Menschen ist wahrscheinlich gering, kann jedoch nicht komplett ausgeschlossen werden.
Reproduktionstoxizität
In Fertilitätsstudien bei Ratten beeinträchtigte Semaglutide das Paarungsverhalten oder die Fertilität männlicher Ratten nicht. Bei weiblichen Ratten wurden ein längerer Zyklus und eine geringe Verminderung der Gelbkörper (Ovulationen) bei Dosen beobachtet, die mit mütterlichem Gewichtsverlust assoziiert waren.
In embryofötalen Entwicklungsstudien bei Ratten verursachte Semaglutide Embryotoxizität unterhalb klinisch relevanter Expositionen. Semaglutide führte zu deutlichen Reduktionen des mütterlichen Körpergewichts sowie zu Reduktionen des Überlebens und des Wachstums der Embryonen. Bei Föten wurden wesentliche skelettartige und viszerale Missbildungen beobachtet, einschliesslich Auswirkungen auf lange Knochen, Rippen, Wirbel, Schwanz, Blutgefässe und Gehirnventrikel. Mechanistische Beurteilungen verwiesen darauf, dass die Embryotoxizität auf einer durch GLP-1-Rezeptoren vermittelten Beeinträchtigung der Nährstoffzufuhr zum Embryo durch den Dottersack der Ratte beruhte. Aufgrund der Unterschiede in Anatomie und Funktion des Dottersacks bei unterschiedlichen Spezies und aufgrund des Fehlens der GLP-1-Rezeptorexpression im Dottersack bei Nicht-Menschenaffen, gilt es als unwahrscheinlich, dass der bei Ratten beobachtete GLP-1-Rezeptor-vermittelte Mechanismus für Menschen relevant ist. Jedoch kann eine direkte Auswirkung von Semaglutide auf den Fötus nicht ausgeschlossen werden.
Im Rahmen von Studien zur Entwicklungstoxizität bei Kaninchen und Javaneraffen wurden bei klinisch relevanten Expositionen ein häufigerer Verlust von Schwangerschaften und eine leicht erhöhte Inzidenz fötaler Anomalien beobachtet. Die Befunde korrelierten mit ausgeprägtem mütterlichem Gewichtsverlust von bis zu 16 %. Es ist nicht bekannt, ob diese Wirkungen im Zusammenhang mit der verminderten Nahrungsaufnahme mütterlicherseits als direkte Auswirkung von GLP-1 stehen.
Das postnatale Wachstum und die postnatale Entwicklung wurden bei Javaneraffen beurteilt. Neugeborene waren bei der Geburt geringfügig kleiner, erholten sich jedoch während der Stillzeit.
Toxizitätsprüfungen mit juvenilen Tieren
Bei jugendlichen männlichen und weiblichen Ratten verursachte Semaglutide eine verzögerte sexuelle Reife. Diese Verzögerungen hatten weder Auswirkung auf die Fertilität und die reproduktive Kapazität beider Geschlechter noch auf die Fähigkeit der Weibchen eine Schwangerschaft auszutragen.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
In der Original-Blisterverpackung aufbewahren, um den Inhalt vor Feuchtigkeit und Licht zu schützen.
Ausser Reich- und Sichtweite von Kindern aufbewahren.
Zulassungsnummer67446 (Swissmedic)
PackungenTabletten zu 3 mg, 7 mg oder 14 mg in Blister.
3 mg: Packungen zu 30 Tabletten [B]
7 mg: Packungen zu 30 und 90 Tabletten [B]
14 mg: Packungen zu 30 und 90 Tabletten [B]
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationNovember 2024
|


