Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Sie dürfen dieses Arzneimittel nach dem auf der Kartonschachtel angegebenen Verfalldatum («EXP») nicht mehr verwenden.
Breyanzi ist 13 Monate stabil, wenn die ungeöffneten Durchstechflaschen in der Dampfphase des Flüssigstickstoffs bei ≤ -130 °C aufbewahrt werden.
Nach dem Auftauen
Das Arzneimittel sollte sofort nach dem Auftauen verabreicht werden. Die Aufbewahrungszeit und Bedingungen bis zum Gebrauch sollten 2 Stunden bei Raumtemperatur (15 °C – 25 °C) nicht überschreiten.
Besondere Lagerungshinweise
Gefroren aufbewahren und transportieren (≤ -130 °C).
Für Kinder unzugänglich aufbewahren.
Hinweise für die Handhabung
Vorsichtsmassnahmen, die vor der Handhabung oder Verabreichung des Arzneimittels zu treffen sind
Breyanzi enthält menschliche Blutzellen, die mit einem replikationsinkompetenten, selbst-inaktivierenden lentiviralen Vektor genetisch verändert wurden. Die medizinischen Fachpersonen, die Breyanzi handhaben, müssen geeignete Vorsichtsmassnahmen für die Handhabung und Entsorgung treffen (Tragen von Handschuhen und Schutzbrillen), um eine potenzielle Übertragung von Infektionskrankheiten zu vermeiden (siehe Abschnitt «Besondere Vorsichtsmassnahmen für die Entsorgung und sonstige Handhabung»).
Vorbereitung von Breyanzi zur Infusion
Was benötigt wird:
·Schutzkleidung (Handschuhe, Schutzbrille)
·Kryohandschuhe
·Schere
·Schutzunterlage
·Luer-Lock-Spritze
·Alkoholtupfer
·20 Gauge, 1-1 ½ Zoll-Nadel
·Natriumchlorid 9 mg/ml (0,9 %) - Infusionslösung
Vor dem Auftauen der Durchstechflaschen
·Bestätigen Sie das Übereinstimmen der Identität des Patienten mit den Angaben zum Patienten auf dem Versandbehälter und der externen Breyanzi-Kartonschachtel.
·Lesen Sie das RFI-Zertifikat (innerhalb des Versandbehälters befestigt), um Informationen über die Anzahl der Spritzen zu erhalten, die Sie zur Verabreichung der CD8+ und CD4+Zellkomponenten benötigen (Spritzenetiketten werden mit dem RFI-Zertifikat zur Verfügung gestellt). Für jede Zellkomponente gibt es ein separates RFI-Zertifikat.
·Die Breyanzi-Durchstechflaschen dürfen nicht aus der Kartonschachtel herausgenommen werden, wenn die Informationen auf dem patientenspezifischen Etikett nicht mit dem vorgesehenen Patienten übereinstimmen. Bei Unstimmigkeiten zwischen den Etiketten und den Angaben zum Patienten muss die Zulassungsinhaberin unverzüglich kontaktiert werden.
·Öffnen Sie jede innere Kartonschachtel und untersuchen Sie die Durchstechflasche(n) visuell auf Beschädigungen. Wenn die Durchstechflaschen beschädigt sind, wenden Sie sich an die Zulassungsinhaberin.
·Bestätigen Sie im Voraus, wann die Infusion erfolgen soll. Die Startzeit des Auftauens muss dann so angepasst werden, dass Breyanzi für die Infusion zur Verfügung steht, sobald der Patient bereit ist.
·Hinweis: Nachdem die Durchstechflaschen mit den CAR-positiven lebensfähigen T-Zellen (CD8+Zellkomponente und CD4+Zellkomponente) aus der gefrorenen Lagerung entfernt wurden, muss das Auftauen komplett abgeschlossen und die Zellen innerhalb von 2 Stunden verabreicht werden.
·Entnehmen Sie die Durchstechflaschen vorsichtig den Kartonschachteln, platzieren Sie die Durchstechflaschen auf eine Schutzunterlage und tauen Sie sie bei Raumtemperatur auf. Alle Durchstechflaschen gleichzeitig auftauen. Achten Sie darauf, die CD8+ und CD4+ Zellkomponenten getrennt zu halten.
Dosisvorbereitung
·Basierend auf der Konzentration an CAR-positiven lebensfähigen T-Zellen für jede Zellkomponente kann für jede der CD8+ und CD4+ Zellkomponenten mehr als eine Durchstechflasche erforderlich sein, um eine Zieldosis zu vervollständigen. Für jede erhaltene Durchstechflasche der CD8+ oder CD4+ Zellkomponenten sollte eine separate Spritze vorbereitet werden.
Hinweis: Das Volumen zum Aufziehen und Infundieren kann für jede Komponente unterschiedlich sein.
·Jede 5-ml-Durchstechflasche enthält ein extrahierbares Volumen von 4,6 ml CD8+ oder CD4+ Zellkomponenten. Das RFI-Zertifikat für jede Zellkomponente zeigt das Volumen (ml) an, das in jede Spritze aufgezogen werden soll. Verwenden Sie die kleinste Luer-Lock-Spritze, die erforderlich ist (1 ml bis 5 ml), um das angegebene Volumen aus jeder Durchstechflasche aufzuziehen. Eine 5-ml-Spritze sollte nicht für Volumina von weniger als 3 ml verwendet werden.
·Bereiten Sie die Spritze(n) der CD8+- Zellkomponente zuerst vor. Bestätigen Sie, dass die Angaben des Patienten auf dem Etikett der Spritze der CD8+ Zellkomponente den Angaben des Patienten auf dem Etikett der Durchstechflasche der CD8+ Zellkomponente entsprechen. Kleben Sie die CD8-Spritzenetiketten auf die Spritze(n), bevor Sie das erforderliche Volumen in die Spritze(n) aufziehen.
·Wiederholen Sie den Prozess für die CD4+Zellkomponente.
Hinweis: Es ist wichtig zu verifizieren, dass das für jede Komponente aufgezogene Volumen dem im entsprechenden RFI-Zertifikat angegebenen Volumen entspricht.
Die Entnahme des erforderlichen Zellvolumens aus jeder Durchstechflasche in eine separate Spritze sollte unter Beachtung der folgenden Anweisungen durchgeführt werden:
1. Halten Sie die aufgetaute(n) Durchstechflasche(n) aufrecht und drehen Sie die Durchstechflasche(n) vorsichtig um, um das Zellprodukt zu vermischen. Wenn irgendwelche Verklumpungen offensichtlich sind, drehen Sie die Durchstechflasche(n) weiter, bis die Klumpen aufgelöst sind und die Zellen gleichmässig resuspendiert erscheinen.
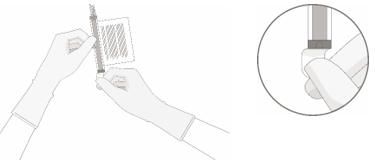
2. Untersuchen Sie die aufgetaute(n) Durchstechflasche(n) visuell auf Beschädigungen oder Undichtigkeiten. Nicht verwenden, wenn die Durchstechflasche beschädigt ist oder die Klumpen sich nicht auflösen; in solch einem Fall kontaktieren Sie die Zulassungsinhaberin. Die Flüssigkeit in den Durchstechflaschen sollte leicht trüb bis trüb, farblos bis gelb oder bräunlich-gelb sein.
3. Entfernen Sie die Polyaluminium-Abdeckung (falls vorhanden) vom Boden der Durchstechflasche und tupfen Sie das Septum mit einem Alkoholtupfer ab. Bevor Sie fortfahren, lassen Sie dieses lufttrocknen.
HINWEIS: Das Fehlen der Polyaluminium-Abdeckung hat keinen Einfluss auf die Sterilität der Durchstechflasche.
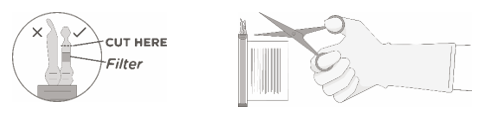
4. Halten Sie die Durchstechflasche(n) aufrecht, schneiden Sie die Versiegelung auf der Schlauchleitung oben auf der Durchstechflasche direkt über dem Filter auf, um die Entlüftungsöffnung auf der Durchstechflasche zu öffnen.
HINWEIS: Achten Sie darauf, die richtige Schlauchleitung mit dem Filter auszuwählen. NUR den Schlauch mit einem Filter aufschneiden.
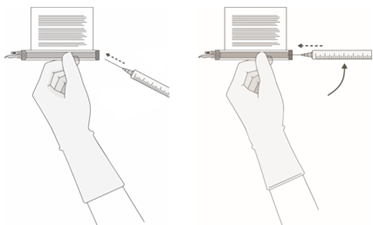
5. Halten Sie eine Nadel (20 Gauge, 1–1,5 Zoll) mit der Öffnung der Nadelspitze entfernt vom Entnahmeport-Septum.
a.Führen Sie die Nadel in einem Winkel von 45–60° in das Septum ein, um das Entnahmeport-Septum zu durchstechen.
b.Erhöhen Sie den Winkel der Nadel schrittweise, während die Nadel in die Durchstechflasche eindringt.
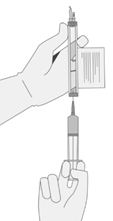
6. OHNE Luft in die Spritze aufzuziehen, langsam das Zielvolumen entnehmen (wie im RFI-Zertifikat angegeben).
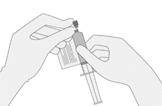
7. Untersuchen Sie die Spritze sorgfältig auf Anzeichen von Ablagerungen, bevor Sie fortfahren. Wenn es Rückstände gibt, wenden Sie sich an die Zulassungsinhaberin.
8. Vergewissern Sie sich, dass das Volumen der CD8+/CD4+ Zellkomponente mit dem für die jeweilige Komponente im RFI-Zertifikat angegebenen Volumen übereinstimmt.
Sobald das Volumen verifiziert ist, entfernen Sie die Spritze/Nadel aus der Durchstechflasche, entfernen Sie vorsichtig die Nadel von der Spritze und verschliessen Sie die Spritze mit einer Schutzkappe. Bewahren Sie die Durchstechflasche weiterhin horizontal auf und geben Sie diese in die Kartonschachtel zurück, um ein Auslaufen der Durchstechflasche zu vermeiden.
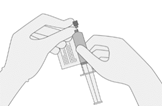

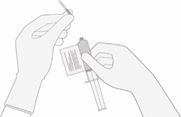
9. Entsorgen Sie nicht verwendete Mengen von Breyanzi sachgemäss (entsprechend den örtlichen Richtlinien zur Biosicherheit).
Verabreichung
·Verwenden Sie KEINEN Leukodepletionsfilter.
·Stellen Sie sicher, dass Tocilizumab und eine Notfallausrüstung vor der Infusion und während der Erholungsphase zur Verfügung stehen.
·Bestätigen Sie, dass die Identität des Patienten mit den Angaben zum Patienten auf dem Spritzenetikett übereinstimmt.
·Sobald die Breyanzi-Komponenten in Spritzen aufgezogen wurden, fahren Sie so bald als möglich mit der Verabreichung fort. Die Gesamtzeit von der Entnahme aus der Gefrierlagerung bis zur Verabreichung an den Patienten sollte 2 Stunden nicht überschreiten.
·Verwenden Sie zur Injektion 9 mg/ml (0,9 %) Natriumchlorid-Infusionslösung, um alle Infusionsschläuche vor und nach jeder Verabreichung von CD8+ oder CD4+Zellkomponenten zu spülen.
·Verabreichen Sie die CD8+ Zellkomponente zuerst. Das gesamte Volumen der CD8+ Zellkomponente wird intravenös bei einer Infusionsrate von etwa 0,5 ml/Minute unter Verwendung des nächstgelegenen Ports oder des Y-Arms verabreicht.
·Wenn mehr als eine Spritze für eine vollständige Zieldosis der CD8+ Zellkomponente erforderlich ist, verabreichen Sie das Volumen in jeder Spritze fortlaufend ohne Pause zwischen der Verabreichung der Spritzeninhalte (es sei denn, es gibt einen klinischen Grund die Dosis anzuhalten, wie z.B. eine Infusionsreaktion). Nachdem die CD8+ Zellkomponente verabreicht wurde, spülen Sie den Schlauch mit einer 9 mg/ml (0,9 %) Natriumchlorid-Infusionslösung.
·Verabreichen Sie die CD4+ Zellkomponente unmittelbar nach Abschluss der Verabreichung der CD8 Komponente mit derselben Vorgehensweise, wie sie für die CD8+ Zellkomponente beschrieben ist. Spülen Sie den Schlauch nach der Verabreichung der CD4+ Zellkomponente ausreichend mit einer 9 mg/ml (0,9 %) Natriumchlorid-Infusionslösung, um den Schlauch und die Länge des IV-Katheters zu reinigen.
·Die Infusionsdauer variiert und wird für jede Komponente normalerweise weniger als 15 Minuten in Anspruch nehmen.
Besondere Vorsichtsmassnahmen für die Entsorgung und sonstige Handhabung
Breyanzi enthält genetisch modifizierte menschliche Blutzellen. Es wird aus autologem Blut des Patienten hergestellt, das mittels Leukapherese gewonnen wird. Das Leukapheresematerial der Patienten und Breyanzi können ein Risiko für die Übertragung infektiöser Viren auf Fachpersonen aus dem Gesundheitswesen bergen, die das Arzneimittel handhaben. Dementsprechend müssen Fachpersonen aus dem Gesundheitswesen beim Umgang mit Leukapheresematerial oder Breyanzi angemessene Vorsichtsmassnahmen treffen (Tragen von Handschuhen und Schutzbrille), um eine mögliche Übertragung von Infektionen zu vermeiden.
Arbeitsflächen, die mit Breyanzi in Kontakt gekommen sind oder in Kontakt gewesen sein könnten, müssen mit einem entsprechenden Desinfektionsmittel dekontaminiert werden. Die örtlichen Richtlinien zur Biosicherheit sollten für nicht verwendetes Arzneimittel oder Abfallmaterial befolgt werden. Alle Materialien, die mit Breyanzi in Berührung gekommen sind (Fest- und Flüssigabfall), sind als potenziell infektiöser Abfall gemäss den örtlichen Richtlinien zur Biosicherheit zu handhaben und zu entsorgen.
| 







