Eigenschaften/WirkungenATC-Code: L04AC16
Wirkungsmechanismus
Guselkumab ist ein humaner IgG1λ-mAb, der mit hoher Spezifität und Affinität selektiv an das Interleukin-23 (IL-23)-Protein bindet. IL-23 beeinflusst unter anderem die Differenzierung, Expansion und das Überleben von T-Zell-Untergruppen (z.B. Th17-Zellen) und von Untergruppen der angeborenen Immunzellen sowie die Freisetzung der entzündungsfördernder Zytokine IL-17A, IL-17F und IL-22. Beim Menschen wurde gezeigt, dass die selektive Blockade von IL-23 die Produktion dieser Zytokine eindämmt.
In der Haut von Patienten mit Plaque-Psoriasis sind die IL-23-Konzentrationen erhöht. In In-vitro- Modellen wurde gezeigt, dass Guselkumab die Bioaktivität von IL-23 hemmt, indem es dessen Interaktion mit dem IL-23-Rezeptor an der Zelloberfläche blockiert und somit durch IL-23 vermittelte Signal-, Aktivierungs- und Zytokinkaskaden unterbricht. Guselkumab bewirkt durch die Inhibition des Zytokin IL-23-Signalwegs klinische Effekte bei Plaque-Psoriasis durch die Modulierung von Genexpressionsmustern in den betroffenen Hautarealen. Diese lokalen Effekte führen zu einer der Reduktion von Epidermisdicke und T-Zell-Dichte. Zusätzlich wurden in Phase-II- und Phase-III-Studien bei mit Guselkumab behandelten Patienten im Vergleich zu Placebo reduzierte Serumkonzentrationen von IL-17A, IL-17F und IL-22 beobachtet.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Guselkumab wurde geprüft in vier randomisierten, doppelblinden, placebo- und/oder aktiv-kontrollierten Phase-III-Studien bei erwachsenen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die Kandidaten für Phototherapie oder systemische Therapie waren. Zwei Studien (VOYAGE 1 und VOYAGE 2) beurteilten die Wirksamkeit und Sicherheit von Guselkumab versus Placebo und Adalimumab bei 1829 erwachsenen Patienten. In VOYAGE 2 wurde zudem in Woche 28 bei Patienten mit erfolgreichem Ansprechen das Absetzen von Guselkumab und die Wiederbehandlung im Vergleich zur kontinuierlichen Weiterbehandlung untersucht. Patienten, die schon einmal mit Guselkumab oder Adalimumab behandelt worden waren, sowie Patienten mit erythrodermischer Psoriasis, Psoriasis guttata oder pustulöser Psoriasis waren von der Teilnahme an den Studien VOYAGE 1 und VOYAGE 2 ausgeschlossen. Eine weitere Studie (NAVIGATE) beurteilte die Wirksamkeit und Sicherheit von Guselkumab versus Ustekinumab bei 268 erwachsenen Patienten, die ungenügend auf Ustekinumab ansprachen.
In der klinischen Studie (ORION) wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt.
VOYAGE 1 und VOYAGE 2
Patienten, die zu Guselkumab randomisiert wurden, erhielten 100 mg in Woche 0 und 4 und danach alle 8 Wochen bis zu Woche 48 (VOYAGE 1) und Woche 20 (VOYAGE 2). Patienten, die zu Adalimumab randomisiert wurden, erhielten 80 mg in Woche 0 und 40 mg in Woche 1, gefolgt von 40 mg alle 2 Wochen bis zu Woche 48 (VOYAGE 1) bzw. Woche 23 (VOYAGE 2). In beiden Studien erhielten die zu Placebo randomisierten Patienten in Woche 16, 20 und danach alle 8 Wochen 100 mg Guselkumab. In VOYAGE 2 wurden Patienten, die in Woche 0 zu Guselkumab randomisiert worden waren und in Woche 28 eine Verbesserung des Psoriasis Area and Severity Index (PASI) von mindestens 90% (PASI-90-Ansprechen) erreichten, erneut randomisiert: entweder zur Fortsetzung der Behandlung mit Guselkumab alle 8 Wochen (Erhaltungstherapie) oder zur Gabe von Placebo (Absetzen). Die Patienten in der letzten Gruppe (Rerandomisierung nach Placebo) wurden bei Verlust von 50% ihrer PASI-Verbesserung in Woche 28 erneut mit Guselkumab behandelt. Patienten ohne PASI-90-Ansprechen aus der Guselkumab-Gruppe setzten die Behandlung mit Guselkumab fort. Bei Patienten, die zu Adalimumab randomisiert worden waren und in Woche 28 ein PASI-90-Ansprechen aufwiesen, wurde die Behandlung abgesetzt und die Behandlung mit Guselkumab eingeleitet, wenn in Woche 28 ein Verlust der PASI-Verbesserung um 50% festgestellt wurde. Patienten aus der Adalimumab-Gruppe, die kein PASI-90-Ansprechen erreicht hatten, erhielten Guselkumab erstmals in Woche 28 und 32 und danach alle 8 Wochen. Alle Patienten wurden nach der ersten Verabreichung der Studienmedikation für bis zu 48 Wochen nachbeobachtet.
Die Krankheits-Charakteristika bei Baseline der Studienpopulationen in VOYAGE 1 und 2 waren vergleichbar: im Mittel betrug der Anteil der betroffenen Körperoberfläche (BSA) 22% bzw. 24%, der mediane Baseline-PASI-Score betrug 19 in beiden Studien, der Baseline-IGA-Score (Investigator's Global Assessment, Gesamtbeurteilung durch den Prüfarzt) war «mittelschwer» bzw. «schwer» bei 74,6% und 75,5% bzw. 25,1% und 24,5% der Patienten. 19% bzw. 18% der Patienten hatten eine Vorgeschichte einer Psoriasis-Arthritis.
Von allen in VOYAGE 1 und 2 aufgenommenen Patienten hatten 32% bzw. 29% vorher noch nie eine konventionelle systemische Therapie und auch keine Biologika-Therapie erhalten; 54% bzw. 57% hatten vorher schon Phototherapie und 62% bzw. 64% schon eine konventionelle systemische Therapie erhalten. In beiden Studien hatten 21% der Patienten vorher schon eine Biologika-Therapie erhalten; diese umfassten 11%, die mindestens einen Anti-Tumornekrosefaktor-alpha (TNF-α)-Wirkstoff, und rund 10%, die einen Anti-IL-12/IL-23-Wirkstoff erhalten hatten.
Eine Begleitbehandlung mit einer topischen oder systemischen Therapie oder Phototherapie gegen Psoriasis war in der Studie nicht zulässig.
Die Wirksamkeit von Guselkumab wurde beurteilt in Bezug auf den Gesamtbefall der Haut, dem lokalisierten Befall der Kopfhaut, Hände, Füsse und Nägel sowie in Bezug auf die Lebensqualität. Die ko-primären Endpunkte in VOYAGE 1 und 2 waren der Prozentsatz von Patienten, die in Woche 16 einen IGA-Score «abgeheilt» oder «minimal» (IGA 0/1) bzw. ein PASI-90-Ansprechen erreichten Vergleich zu Placebo (siehe Tabelle 1).
Effekte auf die Hautsymptomatik
Die Behandlung mit Guselkumab bewirkte signifikante Verbesserungen der Parameter für die Krankheitsaktivität im Vergleich zu Placebo in Woche 16, und im Vergleich zu Adalimumab in Woche 16 bis 48. Die wichtigsten Wirksamkeitsergebnisse sind in Tabelle 1 unten aufgeführt.
Tabelle 1: Zusammenfassung des klinischen Ansprechens in VOYAGE 1 und VOYAGE 2
|
|
Anzahl Patienten (%)
| |
Placebo (n = 174)
|
VOYAGE 1 Guselkumab (n = 329)
|
Adalimumab (n = 334)
|
Placebo (n = 248)
|
VOYAGE 2 Guselkumab (n = 496)
|
Adalimumab (n = 248)
| |
Woche 16
| |
PASI 75
|
10 (5,7)
|
300 (91,2)a
|
244 (73,1)b
|
20 (8,1)
|
428 (86,3)a
|
170 (68,5)b
| |
PASI 90
|
5 (2,9)
|
241 (73,3)c
|
166 (49,7)b
|
6 (2,4)
|
347 (70,0)c
|
116 (46,8)b
| |
IGA 0/1
|
12 (6,9)
|
280 (85,1)c
|
220 (65,9)b
|
21 (8,5)
|
417 (84,1)c
|
168 (67,7)b
| |
IGA 0
|
2 (1,1)
|
157 (47,7)a
|
88 (26,3)d
|
2 (0,8)
|
215 (43,3)a
|
71 (28,6)d
| |
Woche 48
| |
PASI 75
|
-
|
289 (87,8)
|
209 (62,6)e
|
-
|
-
|
-
| |
PASI 90
|
-
|
251 (76,3)
|
160 (47,9)b
|
-
|
-
|
-
| |
IGA 0/1
|
-
|
265 (80,5)
|
185 (55,4)b
|
-
|
-
|
-
| |
IGA 0
|
-
|
166 (50,5)
|
86 (25,7)b
|
-
|
-
|
-
|
a p <0,001 für den Vergleich zwischen Guselkumab und Placebo.
b p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab für wichtige sekundäre Endpunkte.
c p <0,001 für die Vergleiche zwischen Guselkumab und Placebo für die ko-primären Endpunkte.
d Vergleiche zwischen Guselkumab und Adalimumab wurden nicht durchgeführt.
e p <0,001 für den Vergleich zwischen Guselkumab und Adalimumab.
Es wurden auch Verbesserungen bei Nagel-Psoriasis, Befall der Kopfhaut und palmoplantaren Befall beobachtet, die in Woche 16 im Vergleich zu Placebo statistisch signifikant überlegen waren.
Ansprechen im Lauf der Zeit
Guselkumab zeigte eine schnell einsetzende Wirksamkeit, mit einer signifikant höheren prozentualen Verbesserung des PASI im Vergleich zu Placebo schon in Woche 2 (p <0,001); der Unterschied erreichte ein Maximum um Woche 20 (VOYAGE 1 und 2) und blieb bis Woche 48 (VOYAGE 1) erhalten.
Abbildung 1: Prozentsatz von Patienten, die bis Woche 48 ein PASI-90-Ansprechen erreichten, aufgegliedert nach Visite (Patienten randomisiert in Woche 0) in VOYAGE 1
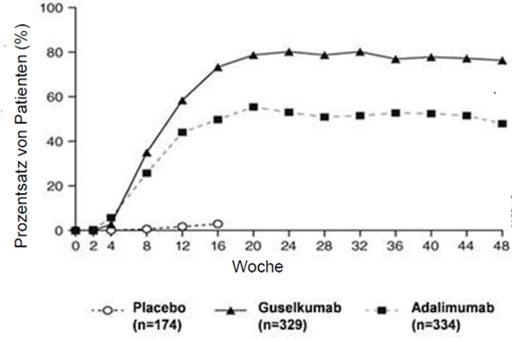
Der Nachweis für die Wirksamkeit und Sicherheit von Guselkumab wurde unabhängig von Alter, Geschlecht, ethnischer Zugehörigkeit, Körpergewicht, Plaquelokalisation, PASI-Baseline-Schweregrad, gleichzeitig bestehender Psoriasis-Arthritis und vorheriger Behandlung mit einem Biologikum erbracht. Guselkumab war wirksam bei Patienten ohne frühere konventionelle systemische Therapie, bei Patienten ohne frühere Biologika-Therapie und bei Patienten mit früherer Biologika-Exposition.
Absetzen der Therapie und anschliessende Wiederaufnahme der Therapie
In VOYAGE 2 erreichten 88,6% der Patienten, die eine Guselkumab-Erhaltungstherapie erhielten, in Woche 48 ein PASI-90-Ansprechen, verglichen mit 36,8% der Patienten, bei denen in Woche 28 die Behandlung abgesetzt worden war (p <0,001). Ein Verlust des PASI-90-Ansprechens wurde schon 4 Wochen nach Absetzen der Guselkumab-Behandlung bei einer medianen Zeitspanne bis zum Verlust des PASI-90-Ansprechens von ungefähr 15 Wochen beobachtet. Von den Patienten, bei denen die Behandlung mit Guselkumab abgesetzt und später wiederaufgenommen worden war, erreichten 84,1% innerhalb von 16 bis 20 Wochen nach Wiederaufnahme der Behandlung mit Guselkumab die PASI90-Antwort.
Behandlungsergebnisse in Bezug auf einzelne Krankheitsregionen
In den Studien VOYAGE 1 und VOYAGE 2 wurden bei Patienten unter Behandlung mit Guselkumab in Woche 16 signifikant stärkere Verbesserungen des Befalls der Kopfhaut (ss-IGA), des Befalls der Hände und Füsse (hf-PGA) und des Befalls der Nägel (NAPSI, f-PGA) festgestellt als bei den Patienten in der Placebogruppe.
Gesundheitsbezogene Lebensqualität/von Patienten berichtete Ergebnisse
In VOYAGE 1 und 2 zusammen wurden bei Guselkumab-Patienten signifikant grössere Verbesserungen bei der gesundheitsbezogenen Lebensqualität gemäss Dermatology Life Quality Index (DLQI) und bei den von Patienten berichteten Psoriasis-Symptomen (Juckreiz, Schmerzen, Brennen, Stechen und Spannen der Haut) und Anzeichen (Hauttrockenheit, Risse, Schuppung, Hautablösung oder Abblättern, Rötung und Bluten) gemäss dem Tagebuch Psoriasis Symptoms and Signs Diary (PSSD) beobachtet, verglichen mit Placebo-Patienten in Woche 16.
NAVIGATE
Die Studie NAVIGATE untersuchte die Wirksamkeit von Guselkumab bei Patienten, die in Woche 16 ungenügend auf Ustekinumab angesprochen hatten (d.h. die kein Ansprechen der Qualität «abgeheilt» oder «minimal» erreichten, definiert als IGA ≥2). Die Patienten durften keine frühere Vortherapie mit Guselkumab und/oder Ustekinumab erhalten haben. Alle Patienten erhielten unverblindet Ustekinumab in Woche 0 und 4. In Woche 16 wurden 268 Patienten mit einem IGA-Score ≥2 randomisiert: entweder zur Weiterführung der Ustekinumab-Behandlung alle 12 Wochen oder zur Einleitung der Guselkumab-Behandlung in Woche 16, 20 und danach alle 8 Wochen. Die Charakteristika bei Baseline für die randomisierten Patienten waren ähnlich wie die in VOYAGE 1 und 2 beobachteten.
12 Wochen nach der Randomisierung wies ein höherer Anteil von Guselkumab-Patienten als Ustekinumab-Patienten einen IGA-Score 0/1 und Verbesserung von ≥2 Skalenstufen (31,1% vs. 14,3%, p = 0,001) und ein PASI-90-Ansprechen (48% vs. 23%, p <0,001) auf. Zum Wechsel in umgekehrter Richtung von Guselkumab zu Ustekinumab sind keine Daten verfügbar.
ORION
In der ORION-Studie wurden die Wirksamkeit, Sicherheit, PK, Immunogenität, Anwendbarkeit und Akzeptanz von per Fertigpen abgegebenem Guselkumab beurteilt. In dieser Studie wurden 78 Patienten mit mittelschwerer bis schwerer Plaques Psoriasis randomisiert, um entweder TREMFYA (100 mg in den Wochen 0 und 4 und danach alle 8 Wochen) oder ein Placebo zu erhalten. Die Studienpopulation in der ORION Studie war vergleichbar mit der Studienpopulation in VOYAGE 1 und 2. Die Wirksamkeit, gemessen an IGA-Score (0,1) und PASI 90 in Woche 16 war in den drei Studien ORION, VOYAGE 1 und 2 vergleichbar. Die Patientenakzeptanz und sichere Anwendung des Pens wurden belegt.
|

