ZusammensetzungWirkstoff
Etofenamat
Hilfsstoffe
Selbsthaftende Schicht: Trimethylsilyliertes Polysilikat Alpha-Hydro-Omega-Hydroxypoly(Dimethylsiloxan) Polykondensat, Dimethicon, Macrogol 400, Olivenöl;
Deckgewebe: Bi-elastisches Polyestergewebe;
Abziehfolie: Fluoropolymer beschichteter Polyester-Film.
Indikationen/AnwendungsmöglichkeitenZur symptomatischen lokalen Behandlung von schmerzhaften und entzündlichen Erkrankungen mit Schwellungen infolge stumpfer Traumen wie Zerrungen, Verstauchungen oder Prellungen (Quetschungen).
Dosierung/AnwendungÜbliche Dosierung
Erwachsene
1 Pflaster wird alle 24 Stunden unter leichtem Druck auf die schmerzende Stelle aufgeklebt.
Es sollte immer nur ein Pflaster pro verletzte Stelle verwendet werden.
Therapiedauer
Die Behandlungsdauer richtet sich primär nach der Schwere der Symptome. Die Anwendung von Lixim Patch sollte entsprechend der Dauer der Therapiestudien, welche die Wirksamkeit dieses Produkts belegen, auf 7 Tage begrenzt werden. Falls nach 7 Tagen keine Besserung eintritt, sollte ein Arzt aufgesucht werden.
Spezielle Dosierungsempfehlungen
Ältere Patienten
Bei älteren Personen ist keine Dosisanpassung notwendig.
Kinder und Jugendliche
Sicherheit und Wirksamkeit von Lixim Patch wurden bei Kindern und Jugendlichen nicht systematisch überprüft. Eine Anwendung wird deshalb nicht empfohlen. Bei Säuglingen und Kleinkindern ist die Anwendung kontraindiziert.
Patienten mit eingeschränkter Leber- oder Nierenfunktion
Lixim Patch wurde bei Patienten mit Leber- oder Niereninsuffizienz nicht spezifisch untersucht. Aufgrund der Art der Anwendung und der nur geringen systemischen Verfügbarkeit des Wirkstoffs ist jedoch nicht zu erwarten, dass in solchen Fällen eine Dosisanpassung erforderlich ist.
Art der Anwendung
Siehe unter «Handhabung von Lixim Patch» am Schluss dieser Fachinformation.
KontraindikationenAnwendung auf geschädigter Haut (z.B. exsudative Dermatitis, Ekzem, infizierte Läsion, Verbrennung oder offene Wunde).
3. Schwangerschaftstrimenon (siehe „Schwangerschaft/Stillzeit“)
Stillzeit.
Säuglinge und Kleinkinder.
Überempfindlichkeit gegenüber dem Wirkstoff Etofenamat oder anderen nichtsteroidalen Antiphlogistika oder gegenüber einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenUm das Auftreten unerwünschter Wirkungen zu minimieren, wird empfohlen, die kürzest notwendige Anwendungsdauer zu wählen.
Lixim Patch darf nur auf unversehrter, gesunder Haut appliziert werden.
Das Pflaster soll nicht in Kontakt mit Schleimhäuten oder Augen kommen.
Falls nach Anwendung des Pflasters ein Hautausschlag auftritt (siehe "Unerwünschte Wirkungen"), soll die Behandlung sofort abgebrochen werden.
Bei Patienten mit Asthma, allergischer Rhinitis oder Nasenpolypen können in seltenen Fällen Bronchospasmus oder Rhinitis auftreten.
Bei Patienten mit chronischer Urtikaria sind allergische Reaktionen möglich.
Da das Pflaster nach Gebrauch noch eine relevante Wirkstoffmenge enthält, ist auf eine sachgerechte Entsorgung zu achten. Kleinkinder und Haustiere sollten auf keinen Fall mit den gebrauchten Pflastern in Kontakt kommen. Eine relevante Überdosierung durch Lutschen oder Kauen gebrauchter Pflaster ist jedoch unwahrscheinlich.
InteraktionenDie systemische Absorption von Etofenamat ist bei der äusserlichen Anwendung in Form eines Pflasters sehr gering, weshalb das Risiko einer klinisch relevanten Arzneimittelinteraktion mit anderen Wirkstoffen vernachlässigbar ist.
Schwangerschaft, StillzeitSchwangerschaft
Nach topischer Anwendung ist die systemische Konzentration von Etofenamat niedriger als nach systemischer Anwendung. In Bezug auf die Erfahrungen von der Behandlung mit nichtsteroidalen Antiphlogistika, welche systemisch aufgenommen werden, wird Folgendes empfohlen:
Die Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die embryo-fetale Entwicklung negativ beeinflussen. Daten aus epidemiologischen Studien deuten auf ein erhöhtes Risiko für Fehlgeburten sowie kardiale Missbildungen und Gastroschisis nach der Anwendung eines Prostaglandinsynthesehemmers in der Frühschwangerschaft hin. Das absolute Risiko für kardiovaskuläre Fehlbildungen nach der Anwendung eines Prostaglandinsynthesehemmers stieg von <1% bis auf etwa 1,5%. Es wird angenommen, dass das Risiko mit der Dosis und der Dauer der Therapie steigt.
Bei Tieren wurde nachgewiesen, dass die Gabe eines Prostaglandinsynthesehemmers zu erhöhtem prä- und postimplantärem Verlust und zu embryofetaler Letalität führt. Ferner wurden bei Tieren erhöhte Inzidenzen verschiedener Missbildungen, einschliesslich kardiovaskulärer Missbildungen beobachtet, die während der Phase der Organogenese einen Prostaglandinsynthesehemmer erhielten (siehe «Präklinische Daten»).
Erstes und zweites Trimenon
Während des ersten und zweiten Schwangerschaftstrimesters sollte Lixim Patch nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. Falls Etofenamat von einer Frau angewendet wird, die versucht schwanger zu werden, oder wenn es während des ersten oder zweiten Schwangerschaftstrimesters angewendet wird, sollte die Dosis so niedrig und die Behandlungsdauer so kurz wie möglich gehalten werden.
Drittes Trimenon
Prostaglandinsynthesehemmer wurden mit einem vorzeitigen Verschluss des Ductus arteriosus Botalli, renalen Komplikationen beim Kind, verstärkter Blutungsneigung bei Mutter und Kind, Wehenhemmung sowie erhöhtem Ödemrisiko bei der Mutter in Verbindung gebracht. Die Anwendung von Lixim Patch ist daher während des letzten Trimenons kontraindiziert.
Stillzeit
Der Metabolit Flufenaminsäure geht in geringen Mengen in die Muttermilch über. Da keine Daten von Studien mit stillenden Müttern vorliegen, ist die Anwendung von Lixim Patch während der Stillzeit kontraindiziert.
Fertilität
Es sind keine Informationen zu potentiellen Einflüssen auf die Fertilität verfügbar.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEntsprechende Studien wurden nicht durchgeführt. Aufgrund der Art der Anwendung und der geringen systemischen Verfügbarkeit des Wirkstoffes ist jedoch nicht zu erwarten, dass Lixim Patch einen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, hat.
Unerwünschte WirkungenNachfolgend sind die unerwünschten Wirkungen nach Organklassen (MedDRA) und Häufigkeit aufgelistet, welche in der Literatur unter der Anwendung von topisch appliziertem Etofenamat beobachtet wurden.
Die Inzidenz wird wie folgt definiert: „sehr häufig“ (≥1/10), „häufig“ (<1/10, ≥1/100), „gelegentlich“ (<1/100, ≥1/1‘000), „selten“ (<1/1‘000, ≥1/10‘000), „sehr selten“ (<1/10‘000).
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: lokale Hautreaktionen, z.B. Hautrötung, Pruritus, brennendes Gefühl, Schwellungen der Haut.
Selten: lokale allergische Reaktionen (Kontaktdermatitis).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: keuchende Atmung.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAufgrund der Art der Anwendung und der geringen systemischen Absorption ist eine Überdosierung unwahrscheinlich.
Eigenschaften/WirkungenATC-Code
M02AA06
Wirkungsmechanismus
Der Wirkstoff Etofenamat ist ein nicht-steroidaler Entzündungshemmer mit analgetischen, antiphlogistischen und abschwellenden Eigenschaften. Er penetriert bei topischer Anwendung durch die Haut in das darunterliegende Gewebe.
Pharmakodynamik
Die pharmakologische Wirkung beruht auf einer Hemmung der Arachidonsäure-Kaskade, wobei durch Etofenamat sowohl die Cyclooxygenase als auch die Lipoxygenase und somit die Entstehung zyklischer Peroxide sowie Hydroxyperoxyfettsäuren gehemmt werden.
Klinische Wirksamkeit
Die Wirksamkeit von Lixim Patch zur Schmerzreduktion wurde in vier randomisierten, doppelblinden, Placebo-kontrollierten Studien an insgesamt n=639 Patienten untersucht, von welchen 398 gegenüber dem aktiven Pflaster und 241 gegenüber Placebo exponiert waren. Eingeschlossen werden konnten erwachsene Patienten im Alter von 18-60 Jahren mit akuter unkomplizierter Sprunggelenksdistorsion sowie Zerrungen, Verstauchungen oder Prellungen infolge stumpfer Traumen. Primärendpunkt war in allen vier Studien die Veränderung des Bewegungsschmerzes nach 72 Stunden auf einer 100mm VAS. Die ersten beiden Studien an insgesamt n=236 Patienten wurden dabei mit zweimal täglicher Anwendung des Pflasters (d.h. Pflasterwechsel alle 12 Stunden) durchgeführt. In der dritten Studie, in welcher 160 Patienten gegenüber Lixim Patch exponiert waren, wurde an je der Hälfte der Patienten die zweimal tägliche bzw. eine einmal tägliche Anwendung (d.h. Pflasterwechsel alle 24 Stunden) untersucht. Die vierte Studie wurde ausschliesslich mit einmal täglicher Anwendung des Pflasters an 180 Patienten durchgeführt (n=120 mit Lixim Patch).
In allen vier Studien konnte gegenüber Placebo eine signifikante Reduktion des Bewegungsschmerzes gezeigt werden (Therapiedifferenz an den gepoolten Daten der beiden Studien mit zweimal täglicher Anwendung 21.7 mm [95% KI 18.20-25.28]; Therapiedifferenz in der dritten Studie bei zweimal täglichem Pflasterwechsel 17.2mm [95% KI 11.7-22.8mm; p<0.0001], bei einmal täglichem Pflasterwechsel 19.1mm [95% KI 14.0-24.2mm; p<0.0001]). In der vierten Studie betrug die Therapiedifferenz 25.0 mm [95%KI 21.3-28.7; p< 0.0001]. Die Befunde für die wesentlichen Sekundärendpunkte waren hierzu konsistent. Bereits nach 12 bis 48 Stunden zeigte Lixim Patch eine signifikante Überlegenheit gegenüber Placebo. Auch die mediane Zeitdauer bis zu einer Reduktion des Bewegungsschmerzes um ≥50% gegenüber Baseline war unter Verum signifikant kürzer als unter Placebo.
PharmakokinetikAbsorption
Etofenamat wird nach lokaler Applikation rasch resorbiert; die relative Bioverfügbarkeit gegenüber einer peroralen Anwendung beträgt ca. 20%.
Die Bioverfügbarkeit von Etofenamat-haltigen Zubereitungen weist eine hohe interindividuellen und intraindividuelle Variabilität auf, die im Wesentlichen durch den Applikationsort, die Hautfeuchtigkeit und andere Faktoren bedingt ist.
Bei einmal täglicher Applikation eines Pflasters Lixim Patch auf das Sprunggelenk lagen bei gesunden Erwachsenen die maximalen Plasmaspiegel an Tag 4 bei 0.164ng/ml für Etofenamat sowie bei 7.47ng/ml für den aktiven Metaboliten Flufenaminsäure. Die Plasmakonzentrationen nach 7tägiger Anwendung wurden ausschliesslich bei Wechsel des Pflasters alle 12 Stunden bestimmt. Hier lag die Cmax für Etofenamat bei 0.36 ng/ml, für Flufenaminsäure bei 14.94 ng/ml.
Distribution
Nach kutaner Applikation sind im Entzündungsgebiet bis zu ca. 25-fach höhere Etofenamat-Spiegel nachweisbar als nach Applikation einer gleich hohen oralen Dosis. Die Verweildauer im entzündeten Gewebe ist für die unveränderte Substanz länger als im Plasma. Im Gewebe liegen nach kutaner Applikation vorwiegend intaktes Etofenamat (bis zu 94%) und nur in geringer Menge das Hydrolyseprodukt Flufenaminsäure und andere Metaboliten vor.
Die Proteinbindung von Etofenamat liegt bei 98-99%.
Metabolismus
Etofenamat wird in der Leber durch Oxidation und Konjugation hauptsächlich in freie und konjugierte Flufenaminsäure, 5-hydroxy- und 4-hydroxy- Flufenaminsäure metabolisiert. Flufenaminsäure besitzt eine vergleichbare pharmakologische Aktivität wie die Muttersubstanz.
Elimination
Die renale Ausscheidungsrate von Etofenamat liegt bei 35%. Der Hauptanteil durchläuft eine biliär-fäkale Elimination in Form von zahlreichen Metaboliten und ihren Konjugaten.
Etofenamat wird mit einer Halbwertszeit von ca. 3.3 Stunden aus dem Plasma eliminiert.
Das Vorliegen eines enterohepatischen Kreislaufs ist wahrscheinlich.
Präklinische DatenIm Tierversuch war lokal appliziertes Etofenamat zumeist nicht toxisch. Hingegen hatten Tiere nach oraler Einnahme hoher Etofenamat-Dosen gastrointestinale Schleimhautulzerationen mit Blutverlust im Magen-Darm-Bereich. Dies ist generell ein bekannter Effekt von NSARs. Unerwünschte Wirkungen auf die Nieren wurden beobachtet.
Die höchste Dosis ohne Effekt (NOAEL) betrug bei Ratten 22 mg/kg Körpergewicht bei oraler Verabreichung und 300 mg/kg Körpergewicht bei dermaler Applikation.
Mutagenität und Kanzerogenität
Die in vitro- und in vivo-Untersuchungen zur Induktion von Gen- und Chromosomenmutationen sowie Kanzerogenitätsstudien mit oraler Gabe verliefen negativ.
Reproduktionstoxizität
Etofenamat passiert die Plazenta. Nach Gabe von maternal toxischen Dosen traten bei Nachkommen von Ratten vermehrt Missbildungen auf (Nierenvergrößerung und zusätzliche Rippen). Eine verspätete Geburt und der vorzeitige Verschluss des Ductus arteriosus Botalli sind bekannte Effekte von NSARs.
Weitere Daten (Lokale Toxizität, Phototoxizität)
Die lokale Verträglichkeit von Pflastern mit 70 mg Etofenamat wurde bei 6 New Zealand White Kaninchen über einen Zeitraum von 7 Tagen untersucht. Sowohl die medizinischen Etofenamat Pflaster als auch die Placebo-Pflaster waren nicht reizend.
Etofenamat (99,6% rein) war bei einem Versuch mit kultivierten Balb/c 3T3 NRU Zellen und UV-Licht nicht phototoxisch.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Ein wiederholtes Öffnen der Verpackung beeinträchtigt die Produktqualität nicht.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Beutel nach Entnahme wieder gut verschliessen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Lixim Patch sollte auf trockener, glatter Haut unter leichtem Zug appliziert werden. Schweiss oder eine starke Behaarung an der Applikationsstelle können die Haftkraft des Pflasters beeinträchtigen. Es ist wichtig, dass das Pflaster fest auf die trockene Haut angedrückt wird.
Die Details zur Art der Anwendung von Lixim Patch sind am Ende dieser Fachinformation aufgeführt.
Nach der Anwendung sollte das Pflaster mit der Klebeseite nach innen zusammengefaltet und gemäss den örtlichen Bestimmungen an einem sicheren, für Kinder unzugänglichen Ort entsorgt werden.
Zulassungsnummer67494 (Swissmedic).
PackungenLixim Patch, Packungen zu 7 Pflastern und 2x7 Pflastern [D].
ZulassungsinhaberinDrossapharm AG, Basel.
Stand der InformationAugust 2024
Handhabung von Lixim Patch
Das Pflaster sollte nur auf trockener, glatter Haut verwendet werden. Schweiss oder eine starke Behaarung an der Applikationsstelle können die Haftkraft des Pflasters beeinträchtigen.
Anleitungsvideo

https://lixim.drossapharm.ch/
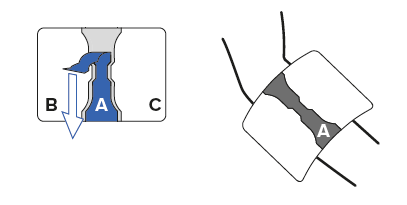
Zuerst wird der Schutzstreifen in der Mitte des Pflasters (A) abgezogen. Dieser Pflasterteil wird direkt auf die schmerzende Stelle gedrückt.
Berühren Sie die Klebeseite des Pflasters nicht mit den Fingern.
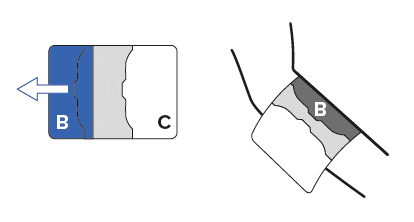
Die äussere Schutzfolie (B) wird von der Pflastermitte gegen aussen abgezogen. Dabei wird die freiwerdende Klebefläche unter leichtem Zug auf die Haut geklebt.
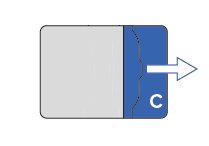
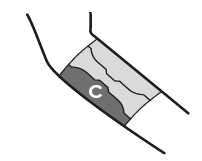
Auf die gleiche Weise wird die andere äussere Schutzfolie (C) entfernt. Die freiwerdende Klebefläche wird ebenfalls unter leichtem Zug auf die Haut geklebt.
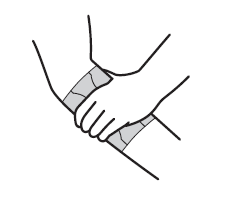
Das Pflaster soll dann für mindestens 30 Sekunden fest auf die Haut gedrückt werden, um eine optimale Haftwirkung zu erzielen.
| 





