ZusammensetzungWirkstoffe
Onasemnogen abeparvovec: Gentherapeutikum, das das humane Survival-Motoneuron- (SMN) Protein exprimiert. Es handelt sich um einen nicht replizierenden rekombinanten adeno-assoziierten Vektor auf der Basis des Virus-Serotyp 9 (AAV9), der die cDNA des humanen SMN-Gens unter der Kontrolle des Cytomegalievirus-Enhancers/Hühner-β-Aktin-Hybrid-Promotors enthält.
Onasemnogen abeparvovec wird durch DNS-Rekombinationstechnologie in menschlichen embryonalen Nierenzellen gebildet.
Besteht aus genetisch verändertem adeno-assoziiertem viralem Vektor vom Serotyp 9 (scAAV9).
Hilfsstoffe
Tromethamin, Magnesiumchlorid, 11.7 mg/ml Natriumchlorid (entspricht 4.6 mg/ml Natrium), Poloxamer 188, Salzsäure (zur pH-Einstellung), Wasser für Injektionszwecke
Indikationen/AnwendungsmöglichkeitenZolgensma ist indiziert zur Behandlung von:
·Patienten mit 5q-assoziierter spinaler Muskelatrophie (SMA) mit einer biallelischen Mutation im SMN1-Gen und einer klinisch diagnostizierten Typ-1-SMA, oder
·Patienten mit 5q-assoziierter SMA mit einer biallelischen Mutation im SMN1-Gen und bis zu 3 Kopien des SMN2-Gens.
Die Therapie darf nur bis zum Alter von zwei Jahren verabreicht werden.
Dosierung/AnwendungZolgensma darf nur in Spital-basierten, spezialisierten neuromuskulären Zentren verabreicht werden. Das behandelnde medizinische Personal muss zwingend Erfahrung mit der Diagnostik und der Behandlung von Patienten mit spinaler Muskelatrophie haben.
Vor der Verabreichung von Onasemnogen abeparvovec sind Ausgangs-Laboruntersuchungen erforderlich, einschliesslich:
·AAV9-Antikörpertestung mit einem entsprechend validierten Test
·Leberfunktion: Alaninaminotransferase (ALT), Aspartataminotransferase (AST),Gesamtbilirubin, Albumin, Prothrombinzeit, partielle Thromboplastinzeit (PTT) und internationales normalisiertes Verhältnis (INR)
·Kreatinin,
·Grosses Blutbild (einschließlich Hämoglobin und Thrombozytenzahl)
Bei der Festlegung des Zeitpunkts der Therapie mit Onasemnogen abeparvovec sind die Notwendigkeit einer engmaschigen Überwachung der Leberfunktion, der Thrombozytenzahl nach der Verabreichung sowie die erforderliche begleitende Kortikosteroidbehandlung zu berücksichtigen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Aufgrund des erhöhten Risikos einer schwerwiegenden systemischen Immunreaktion wird empfohlen, dass die Patienten vor einer Infusion von Zolgensma in ihrem allgemeinen Gesundheitszustand klinisch stabil sind (z.B. Flüssigkeits- und Ernährungszustand, Abwesenheit von Infektionen).
Liegt eine akute oder chronische, unkontrollierte aktive Infektion vor, sollte die Behandlung so lange aufgeschoben werden, bis die Infektion abgeklungen und der Patient klinisch stabil ist. Zum Zeitpunkt der Verabreichung von Onasemnogen abeparvovec dürfen keine klinischen Anzeichen oder Symptome einer Infektion vorhanden sein (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen», Unterabschnitt Systemische Immunreaktionen).
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung und die Chargennummer des angewendeten Arzneimittels eindeutig dokumentiert werden.
Übliche Dosierung
Nur zur Verabreichung als Einzeldosis mittels intravenöser Infusion bestimmt.
Die Patienten erhalten eine Dosis von nominal 1,1 x 1014 vg/kg Onasemnogen abeparvovec. Das Gesamtvolumen wird anhand des Patientenkörpergewichts bestimmt.
In Tabelle 1 ist die empfohlene Dosierung für Patienten mit einem Körpergewicht von 2,6 kg bis 16,0 kg angegeben.
Tabelle 1: Empfohlene Dosierung anhand des Patientenkörpergewichts
|
Patientengewichtsbereich (kg)
|
Dosis (vg)
|
Gesamtvolumen einer Dosis a (ml)
| |
2,6 – 3,0
|
3,3 × 1014
|
16,5
| |
3,1 – 3,5
|
3,9 × 1014
|
19,3
| |
3,6 – 4,0
|
4,4 × 1014
|
22,0
| |
4,1 – 4,5
|
5,0 × 1014
|
24,8
| |
4,6 – 5,0
|
5,5 × 1014
|
27,5
| |
5,1 – 5,5
|
6,1 × 1014
|
30,3
| |
5,6 – 6,0
|
6,6 × 1014
|
33,0
| |
6,1 – 6,5
|
7,2 × 1014
|
35,8
| |
6,6 – 7,0
|
7,7 × 1014
|
38,5
| |
7,1 – 7,5
|
8,3 × 1014
|
41,3
| |
7,6 – 8,0
|
8,8 × 1014
|
44,0
| |
8,1 – 8,5
|
9,4 × 1014
|
46,8
| |
8,6 – 9,0
|
9,9 ×1014
|
49,5
| |
9,1 – 9,5
|
1,05 ×1015
|
52,3
| |
9,6 – 10,0
|
1,10 ×1015
|
55,0
| |
10,1 – 10,5
|
1,16 ×1015
|
57,8
| |
10,6 – 11,0
|
1,21 ×1015
|
60,5
| |
11,1 – 11,5
|
1,27 ×1015
|
63,3
| |
11,6 – 12,0
|
1,32 ×1015
|
66,0
| |
12,1 – 12,5
|
1,38 ×1015
|
68,8
| |
12,6 – 13,0
|
1,43 ×1015
|
71,5
| |
13,1 – 13,5
|
1,49 ×1015
|
74,3
| |
13,6 – 14,0
|
1,54 ×1015
|
77,0
| |
14,1 – 14,5
|
1,60 ×1015
|
79,8
| |
14,6 – 15,0
|
1,65 ×1015
|
82,5
| |
15,1 – 15,5
|
1,71 ×1015
|
85,3
| |
15,6 – 16,0
|
1,76 ×1015
|
88,0
|
a Hinweis: Die Anzahl der Durchstechflaschen pro Kit sowie die erforderliche Anzahl von Kits sind abhängig vom Gewicht. Zur Berechnung des Dosisvolumens wird die Obergrenze des Patientengewichtsbereichs in pädiatrischen Patienten bis zum Alter von zwei Jahren verwendet.
Immunmodulatorisches Therapieregime
Nach der Anwendung von Onasemnogen abeparvovec wird eine Immunreaktion gegen das Kapsid des adeno-assoziierten viralen Vektors vom Serotyp 9 (AAV9) erfolgen, (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). Dies kann zu einer Erhöhung der Leberaminotransferasen, Erhöhungen der Troponin I-Spiegel oder einer Verminderung der Thrombozytenzahlen führen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Zur Abschwächung der Immunantwort wird eine Immunmodulation mit Kortikosteroiden empfohlen. Wenn möglich, sollte der Impfplan des Patienten an die begleitende Kortikosteroid-Gabe vor und nach der Infusion von Onasemnogen abeparvovec angepasst werden (siehe Abschnitt «Interaktionen»).
Vor Beginn des immunmodulatorischen Therapieregimes und vor der Verabreichung von Onasemnogen abeparvovec muss der Patient auf Symptome einer aktiven Infektionskrankheit jeglicher Art untersucht werden.
Es wird empfohlen, 24 Stunden vor der Infusion von Onasemnogen abeparvovec ein immunmodulatorisches Therapieregime nach dem folgenden Schema einzuleiten (siehe Tabelle 2). Abweichungen von diesen Empfehlungen liegen im Ermessen des behandelnden Arztes/der behandelnden Ärztin (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Tabelle 2: Immunmodulatorisches Therapieregime vor und nach der Infusion
|
Vor der Infusion
|
24 Stunden vor Onasemnogen abeparvovec
|
Prednisolon p.o. 1 mg/kg/Tag (oder Äquivalent, wenn ein anderes Kortikosteroid angewendet wird)
| |
Nach der Infusion
|
30 Tage (einschl. Tag der Verabreichung von Onasemnogen abeparvovec),
|
Prednisolon p.o. 1 mg/kg/Tag (oder Äquivalent, wenn ein anderes Kortikosteroid angewendet wird)
| |
Anschliessend 28 Tage:
Bei Patienten mit unauffälligem Befund (normaler klinischer Untersuchungsbefund , Gesamtbilirubin, ALT- und AST-Werte jeweils unter dem 2-Fachen der Normobergrenze (ULN)) am Ende des 30-Tages-Zeitraums:
oder
|
Systemische Kortikosteroide sollten schrittweise ausgeschlichen werden.
Ausschleichende Reduktion der Prednisolon-Dosis (oder Äquivalent, wenn ein anderes Kortikosteroid angewendet wird), z.B. 2 Wochen mit 0,5 mg/kg/Tag und danach 2 Wochen mit 0,25 mg/kg/Tag Prednisolon p.o.
| |
Bei Patienten mit abweichenden Leberfunktionswerten am Ende des 30-Tages-Zeitraums: Fortführung bis die AST- und ALT-Werte unter 2-facher ULN liegen und alle anderen Beurteilungen wieder in den Normalbereich zurückgegangen sind, anschliessend ausschleichende Reduktion über 28 Tage oder länger, falls notwendig.
|
Systemische Kortikosteroide (Äquivalent zu Prednisolon 1 mg/kg/Tag) p.o.
Systemische Kortikosteroide sollten schrittweise ausgeschlichen werden
| |
|
Die Leberfunktion (ALT, AST, Gesamtbilirubin) sollte nach der Infusion von Onasemnogen abeparvovec mindestens 3 Monate lang, und falls klinisch indiziert länger, überwacht werden. Patienten mit sich verschlechternder Leberfunktion und/oder Anzeichen oder Symptomen einer akuten Erkrankung sollten umgehend klinisch untersucht und engmaschig überwacht werden (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
|
Ein pädiatrischer Gastroenterologe oder Hepatologe sollte umgehend zu Rate gezogen werden, wenn Patienten auf das Äquivalent von 1 mg/kg/Tag Prednisolon p.o. nicht adäquat ansprechen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). Falls eine Therapie mit oralen Kortikosteroiden nicht vertragen wird, kann bei klinischer Indikation ein intravenöses Kortikosteroid in Betracht gezogen werden.
Verwendet der behandelnde Arzt / die behandelnde Ärztin ein anderes Kortikosteroid anstelle von Prednisolon sollten gegebenenfalls ähnliche Überlegungen und Ansätze zur ausschleichenden Dosierung nach 30 Tagen angewandt werden.
Besondere Patientengruppen
Patienten mit Leberfunktionsstörungen
Patienten mit einer ALT, einer AST oder einem Gesamtbilirubin (ausser aufgrund einer Neugeborenengelbsucht) > 2 × ULN wurden nicht in klinischen Studien mit Onasemnogen abeparvovec untersucht. Bei Patienten mit eingeschränkter Leberfunktion sollte die Behandlung mit Onasemnogen abeparvovec sorgfältig überlegt werden (siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Eine Dosisanpassung sollte nicht in Betracht gezogen werden.
Patienten mit Nierenfunktionsstörungen
Die Sicherheit und Wirksamkeit von Onasemnogen abeparvovec bei Patienten mit eingeschränkter Nierenfunktion ist nicht erwiesen, und die Therapie mit Onasemnogen abeparvovec sollte sorgfältig überlegt werden. Eine Dosisanpassung sollte nicht in Betracht gezogen werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Onasemnogen abeparvovec bei Frühgeborenen vor Erreichen des vollen Gestationsalters ist nicht erwiesen. Es liegen keine Daten vor. Die Verabreichung von Onasemnogen abeparvovec sollte sorgfältig überlegt werden, da die begleitende Behandlung mit Kortikosteroiden die neurologische Entwicklung ungünstig beeinflussen kann.
In den klinischen Studien wurden Patienten bis zu einem Alter von 6 Monaten (und einem Gewicht von 8.5 kg) behandelt. Es liegen keine kontrollierten Daten von Patienten in einem Alter zwischen 6 Monate und zwei Jahre zum Zeitpunkt der Behandlung vor. Die Sicherheit und Wirksamkeit von Onasemnogen abeparvovec ausserhalb der Studienpopulation kann daher basierend auf den aktuellen Daten nur teilweise nachgewiesen werden, und dies nur bis zu einem Alter von zwei Jahren. Die zurzeit vorliegenden Daten werden im Abschnitt «Eigenschaften/Wirkungen» beschrieben.
Genotyp 0SMN1/1SMN2
Für Patienten mit einer biallelischen Mutation im SMN1-Gen und nur einer SMN2-Kopie liegen keine klinischen Daten vor (siehe Abschnitt «Eigenschaften/Wirkungen»).
AAV9-Antikörper
Bei Patienten, deren prätherapeutische AAV9-Antikörpertiter über 1:50 liegen, sollte keine Dosisanpassung erwogen werden (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). In den klinischen Studien wurden keine Patienten mit einem AAV9-Antikörpertiter über 1:50 behandelt.
Art der Anwendung
Zur intravenösen Verwendung.
Onasemnogen abeparvovec sollte mit einer Spritzenpumpe als einzelne intravenöse Infusion langsam über einen Zeitraum von etwa 60 Minuten verabreicht werden und darf nicht als schnelle intravenöse Infusion oder Bolus appliziert werden.
Das Anlegen eines zweiten («Sicherungs»-) Katheters wird für den Fall einer Blockierung im Primärkatheter empfohlen. Nach Abschluss der Infusion sollte die Leitung mit Kochsalzlösung gespült werden.
Hinweise zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt «Sonstige Hinweise».
Vorsichtsmassnahmen vor der Handhabung bzw. vor der Anwendung des Arzneimittels
Dieses Arzneimittel enthält einen genetisch veränderten Organismus. Bei der Vorbereitung und Verabreichung von Onasemnogen abeparvovec sollte persönliche Schutzausrüstung (d.h. Handschuhe, Schutzbrille, Laborkittel und Ärmelschoner) getragen werden (siehe Abschnitt «Sonstige Hinweise»).
Hinweise zur Zubereitung, Handhabung, versehentlichen Exposition und Entsorgung des Arzneimittels siehe Abschnitt «Sonstige Hinweise».
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt «Zusammensetzung» genannten Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenVorbestehende Immunität gegen AAV9
Nach natürlicher Exposition kann es zur Bildung von Anti-AAV9-Antikörpern kommen. Es gibt mehrere Studien zur Prävalenz von AAV9-Antikörpern in der Gesamtpopulation, die hinsichtlich einer vorherigen AAV9-Exposition in der pädiatrischen Population eine niedrige Rate aufweisen. Die Patienten sollten vor der Infusion von Onasemnogen abeparvovec auf das Vorhandensein von AAV9-Antikörpern getestet werden. Eine Nachtestung kann durchgeführt werden, wenn die AAV9-Antikörpertiter über 1:50 liegen. Es ist noch nicht bekannt, ob oder unter welchen Bedingungen Onasemnogen abeparvovec sicher und wirksam verabreicht werden kann, wenn die Anti-AAV9-Antikörpertiter über 1:50 liegen (siehe Abschnitte «Dosierung/Anwendung» und «Eigenschaften/Wirkungen»).
Fortgeschrittene SMA
Da SMA zu einer fortschreitenden und nicht reversiblen Schädigung der Motoneuronen führt, hängt der Nutzen von Onasemnogen abeparvovec bei symptomatischen Patienten vom Grad der Krankheitslast zum Zeitpunkt der Behandlung ab, wobei eine frühere Behandlung zu einem potenziell höheren Nutzen führt.
Bei Patienten mit ausgeprägter Hypotonie und Ateminsuffizienz bei der Geburt oder zum Zeitpunkt der Behandlung wurde Zolgensma nicht untersucht. Es ist unwahrscheinlich, dass solche Patienten von einer Behandlung mit Zolgensma einen klinisch bedeutsamen Nutzen hätten.
Der behandelnde Arzt/Die behandelnde Ärztin sollte dies berücksichtigen. Zudem wurden Patienten mit intensiver Muskelschwäche und respiratorischer Insuffizienz, Patienten unter Dauerbeatmung und Patienten, die nicht schlucken können, nicht in die klinischen Studien eingeschlossen.
Bei Patienten mit fortgeschrittener SMA, die durch dauerhafte Beatmung am Leben erhalten werden und bei denen die Fähigkeiten zu gedeihen, nicht gegeben ist, ist das Nutzen-Risiko-Profil von Onasemnogen abeparvovec nicht bekannt.
Zur Langzeitwirksamkeit dieses Arzneimittels liegen limitierte Daten vor. (siehe «Eigenschaften/Wirkungen»).
Immunogenität
Nach der Infusion von Onasemnogen abeparvovec erfolgt eine Immunreaktion gegen das Kapsid des adeno-assoziierten viralen Vektors vom Serotyp 9 (AAV9). Dies schliesst trotz des in Abschnitt «Dosierung/Anwendung» empfohlenen immunmodulatorischen Therapieregimes die Bildung von Antikörpern gegen das AAV9-Kapsid und eine T-Zell-vermittelte Immunantwort ein.
Nach der Anwendung von Onasemnogen abeparvovec wurden Fälle immunvermittelter Lebertoxizität berichtet, die sich im Allgemeinen in erhöhten ALT- und/oder AST-Werten, als akute schwere Leberschädigung oder akutes Leberversagen, einschliesslich Fälle mit Todesfolge manifestierten. Eine immunvermittelte Lebertoxizität kann die Anpassung des immunomodulatorischen Regimes in Form einer längeren Anwendungsdauer, einer Dosiserhöhung oder einer Verlängerung der Kortikosteroid-Ausschleichung erfordern. Einzelheiten zum immunmodulatorischen Therapieregime siehe Abschnitt «Dosierung/Anwendung», sowie Unterabschnitte «Lebertoxizität» und «Systemische Immunreaktionen» weiter unten.
Lebertoxizität
·Die Anwendung eines AAV-Vektors kann erhöhte Aminotransferasewerte zur Folge haben, die schwerwiegend sein können.
·Akute schwerwiegende Leberschädigung und akutes Leberversagen sind aufgetreten. Es wurden Fälle von akutem Leberversagen mit tödlichem Ausgang berichtet (siehe Abschnitt «Unerwünschte Wirkungen»).
·Patienten mit einer vorbestehenden Leberfunktionsstörung oder einer akuten Virusinfektion der Leber haben möglicherweise ein erhöhtes Risiko für eine akute schwerwiegende Leberschädigung (siehe Abschnitt «Dosierung/Andwendung»).
·Vor der Infusion sollte immer die Leberfunktion der Patienten durch klinische Untersuchung und Labortests (z.B. hepatische Aminotransferasen AST und ALT, Gesamtbilirubin, Albumin, Prothrombinzeit, PTT und INR (siehe Abschnitt «Dosierung/Anwendung»)) beurteilt werden.
·Um mögliche Aminotransferase-Erhöhungen zu mildern, sollte jeder Patient vor und nach der Onasemnogen abeparvovec-Infusion mit einem systemischen Kortikosteroid behandelt werden (siehe Abschnitt «Dosierung/Anwendung»).
·Die Leberfunktion (ALT, AST, Gesamtbilirubin) sollte nach der Infusion mindestens 3 Monate und zu anderen Zeitpunkten, sofern dies klinisch indiziert ist, überwacht werden
·Patienten mit Testergebnissen, die auf eine sich verschlechternde Leberfunktion hindeuten, und/oder Anzeichen oder Symptomen einer akuten Erkrankung müssen umgehend klinisch von einem Gastroenterologen/Hepatologen beurteilt und engmaschig überwacht werden.
·Die Risiken und Nutzen einer Onasemnogen abeparvovec-Infusion bei Patienten mit einer vorbestehenden eingeschränkten Leberfunktion sollten sorgfältig abgewogen werden.
Nach Applikation von Onasemnogen abeparvovec sollten AST/ALT und totales Bilirubin über einen Zeitraum von einem Monat wöchentlich beurteilt werden, bis zum Ende des Ausschleichens des Kortikosteroids oder bei Bedarf noch länger. Wenn der Patient am Ende des Ausschleichens des Kortikosteroids klinisch stabil und unauffällig ist, sollte die Leberfunktion nach der Verabreichung von Zolgensma und einen weiteren Monat lang alle zwei Wochen überwacht werden. Ein Ausschleichen von Prednisolon sollte erst in Erwägung gezogen werden, wenn AST/ALT Werte unter dem 2-Fachen der Normobergrenze liegen (siehe Dosierung/Anwendung).
Thrombozytopenie
In klinischen Studien zu Onasemnogen abeparvovec wurden vorübergehend verminderte Thrombozytenzahlen beobachtet, die zum Teil die Kriterien einer Thrombozytopenie erfüllten. In den meisten Fällen trat der niedrigste Thrombozytenwert in der ersten Woche nach der Onasemnogen abeparvovec-Infusion auf.
Nach der Markteinführung wurden Fälle mit einem vorübergehenden Abfall der Thrombozytenzahl auf < 50 x 109/l innerhalb von zwei Wochen nach der Verabreichung berichtet.
Die Thrombozytenzahl sollte vor der Infusion von Onasemnogen-Abepavovec ermittelt und während der ersten zwei Wochen nach Infusion engmaschig, danach weiterhin regelmässig überwacht werden, im ersten Monat mindestens wöchentlich und im zweiten und dritten Monat alle zwei Wochen, bis die Thrombozytenzahl wieder auf den Ausgangswert zurückgeht.
Thrombotische Mikroangiopathie
Nach der Markteinführung wurde über Fälle einer thrombotischen Mikroangiopathie (TMA) in den ersten zwei Wochen nach der Infusion von Onasemnogen abeparvovec berichtet (siehe Abschnitt «Unerwünschte Wirkungen»). Die TMA ist durch Thrombozytopenie, mikroangiopathische hämolytische Anämie und akute Nierenschädigung gekennzeichnet. In einigen Fällen wurde die gleichzeitige Aktivierung des Immunsystems (z.B. durch Infektionen, Impfungen) als beitragender Faktor identifiziert.
Anzeichen und Symptome einer TMA sollten umgehend weiter untersucht werden, da TMA einen lebensbedrohlich- bis tödlichen Ausgang haben kann.
Die Thrombozytopenie ist ein Hauptmerkmal der TMA, daher sollte die Thrombozytenzahl während der ersten zwei Wochen nach Infusion genau kontrolliert, und danach regelmässig beobachtet werden (siehe Unterabschnitt «Thrombozytopenie»). Die Patienten sollten auf Anzeichen und Symptome einer TMA wie Hypertonie, eine erhöhte Zahl von blauen Flecken (Blutergüssen), Krampfanfälle oder verminderte Urinausscheidung überwacht werden. Im Falle dass diese Anzeichen und Symptome begleitend zu einer Thrombozytopenie auftreten, sollten weitere diagnostische Abklärungen für hämolytische Anämie und Nierenfunktionsstörung umgehend vorgenommen werden. Bei klinischen Anzeichen, Symptomen und/oder Laborbefunden, die auf eine TMA hinweisen, sollte sofort ein Spezialist konsultiert werden, um die TMA entsprechend der klinischen Indikation zu behandeln.
Erhöhter Troponin-I-Wert
In Tierversuchen mit Mäusen wurde eine kardiale Toxizität beobachtet. Die klinische Relevanz dieser Befunde ist nicht bekannt. Nach der Infusion von Onasemnogen abeparvovec wurden Erhöhungen der kardialen Troponin-I-Spiegel beobachtet (siehe Abschnitt «Unerwünschte Wirkungen»). In abgeschlossenen klinischen Studien wurden nach Verabreichung von Zolgensma keine auffäligen kardialen Befunde beobachtet. Bei Bedarf sollte die Konsultation eines Kardiologen in Betracht gezogen werden.
Systemische Immunreaktionen
Aufgrund des erhöhten Risikos einer schwerwiegenden systemischen Immunreaktion wird empfohlen darauf zu achten, dass die Patienten vor einer Infusion von Onasemnogene Abeparvovec in ihrem allgemeinen Gesundheitszustand klinisch stabil sind (z.B. Flüssigkeits- und Ernährungszustand, Abwesenheit von Infektionen). Die Behandlung sollte nicht eingeleitet werden, wenn zeitgleich aktive Infektionen bestehen. Die Therapie kann initiiert werden sobald die Infektion abgeklungen und der Patient klinisch stabil ist. Dies gilt für akute (wie akute Atemwegsinfektionen oder akute Hepatitis) wie für unkontrollierte chronische Infektionen (wie chronische aktive Hepatitis B) (siehe Abschnitte «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
In klinischen Studien wurden Patienten mit aktiver Infektion von der Teilnahme ausgeschlossen. Das immunmodulatorische Regime (siehe Abschnitt «Dosierung/Anwendung») kann die Immunantwort auf Infektionen (z.B. respiratorische) beeinflussen, was möglicherweise zu schwereren klinischen Verläufen von Infektionen führt. Erhöhte Wachsamkeit bei der Prävention, Überwachung, und Behandlung von Infektionen wird vor und nach der Infusion von Onasemnogene abeparvovec empfohlen. Saisonale prophylaktische Behandlungen, die Infektionen mit dem respiratorischen Syncytial-Virus (RSV) verhindern, werden empfohlen und sollten auf dem neuesten Stand sein. Wenn möglich, sollte der Impfplan des Patienten an die begleitende Kortikosteroid-Gabe vor und nach der Infusion von Onasemnogen abeparvovec angepasst werden (siehe Abschnitt «Interaktionen»).
Der behandelnde Arzt/Die behandelnde Ärztin sollte sich bewusst sein, dass im Zusammenhang mit einer längeren Anwendungsdauer oder einer erhöhten Dosis der Kortikosteroide die Möglichkeit einer Nebenniereninsuffizienz gegeben ist.
Theoretisches Risiko einer Kanzerogenität infolge der Integration des Vektors
Es besteht ein theoretisches Risiko einer Kanzerogenität infolge der Integration der AAV-Vektor-DNA in das Genom.
Zolgensma besteht aus einem nicht-replizierenden AAV9-Vektor, dessen DNA weitgehend in episomaler Form vorkommt. Es besteht die Möglichkeit, dass rekombinante AAV Vektoren mit geringer Häufigkeit zufällig in die menschliche DNA integrieren. Die klinische Relevanz einzelner Vektorintegrationen ist nicht bekannt, es wird aber eingeräumt, dass einzelne Integrationsereignisse potentiell zum Risiko der Entstehung von Tumoren beitragen können.
Infusionsbedingte Reaktionen
Infusionsbedingte Reaktionen, einschliesslich Überempfindlichkeitsreaktionen und Anaphylaxie, sind während und/oder kurz nach der Infusion von Zolgensma aufgetreten (siehe Abschnitt «Unerwünschte Wirkungen»). Zu den Anzeichen und Symptomen können unter anderem Hautausschlag, Urtikaria, Erbrechen, Dyspnoe, Atembeschwerden und/oder Veränderungen der Herzfrequenz und des Blutdrucks gehören. Bei klinischen Anzeichen und Symptomen von infusionsbedingten Reaktionen sollten die Patienten engmaschig überwacht und bei Bedarf behandelt werden.
Freisetzung (Shedding)
Vorübergehend kommt es zu einer Freisetzung (Shedding) von Onasemnogen abeparvovec, hauptsächlich über die Exkremente. Pflegekräfte und Patientenangehörige müssen auf die folgenden Anweisungen zum richtigen Umgang mit dem Stuhl des Patienten aufmerksam gemacht werden:
·Eine gute Handhygiene ist erforderlich für den Fall, dass sie mit den Körperflüssigkeiten und dem Stuhl des Patienten in direkten Kontakt kommen. Diese Anweisungen sind nach der Behandlung mit Onasemnogen abeparvovec mindestens 1 Monat lang einzuhalten.
·Einwegwindeln können in Plastik-Doppelbeutel verschlossen über den Hausmüll entsorgt werden.
Natriumgehalt
Dieses Arzneimittel enthält 75,9 bis 531,3 mg Natrium pro Dosiereinheit, entsprechend 3 bis 26 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Zur Anwendung von Onasemnogen abeparvovec bei Patienten, die hepatotoxische Arzneimittel erhalten oder hepatotoxische Substanzen verwenden, liegen nur begrenzte Erfahrungen vor. Die Sicherheit und Wirksamkeit der Anwendung von Onasemnogen abeparvovec bei diesen Patienten ist nicht erwiesen.
Zur begleitenden Anwendung von 5q-SMA-Targeting-Agentien liegen nur begrenzte Erfahrungen vor. Es liegen keine interpretierbaren Daten zur Wirksamkeit oder Sicherheit einer Kombinationsbehandlung vor.
Andere Interaktionen
Impfungen
Wenn möglich, sollte der Impfplan des Patienten an die begleitende Kortikosteroid-Gabe vor und nach der Infusion von Onasemnogen abeparvovec angepasst werden (siehe Abschnitte «Dosierung/Administration» und «Warnhinweise und Vorsichtsmassnahmen»). Eine saisonale RSV-Prophylaxe wird empfohlen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). Lebendimpfstoffe wie MMR und Varizellen sollten bei Patienten unter einer immunsuppressiven Steroiddosis (d.h. ≥2 Wochen täglicher Gabe von 20 mg oder 2 mg/kg Körpergewicht Prednison oder Äquivalent) nicht angewendet werden.
Schwangerschaft, StillzeitDaten über die Anwendung während der Schwangerschaft oder Stillzeit beim Menschen sind nicht verfügbar, und es wurden keine tierexperimentellen Fertilitäts- oder Reproduktionsstudien durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenOnasemnogen abeparvovec hat keinen oder einen vernachlässigbaren Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheit von Onasemnogen abeparvovec wurde bei 99 Patienten, die Onasemnogen abeparvovec in der empfohlenen Dosis (1,1 x 1014 vg/kg) erhielten, in 5 offenen klinischen Studien untersucht. Unter diesen 99 Patienten war die am häufigsten berichteten Nebenwirkungen nach der Verabreichung waren erhöhte Leberenzyme (24.2%), Lebertoxizität (8.1%), Erbrechen (9.1 %), Thrombozytopenie (6.1%), erhöhtes Troponin (5.1%) und Fieber (5,1 %), siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Tabellarische Liste der Nebenwirkungen
Die mit Onasemnogen abeparvovec aufgetretenen Nebenwirkungen mit einem kausalen Zusammenhang zur Behandlung bei Patienten, die eine intravenöse Infusion mit der empfohlenen Dosis von den 5 offenen klinischen Studien erhalten haben, sind in Tabelle 3 dargestellt. Die Nebenwirkungen sind gemäss MedDRA-Systemorganklassifikation und nach Häufigkeit geordnet angegeben. Die Häufigkeitskategorien basieren auf folgender Konvention: sehr häufig (≥1/10), häufig (≥1/100, < 1/10), gelegentlich (≥1/1'000, < 1/100), selten (≥1/10'000, < 1/1'000), sehr selten (< 1/10'000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 3: Liste der Nebenwirkungen von Onasemnogen abeparvovec
|
Nebenwirkungen nach MedDRA SOC/PT und Häufigkeit
| |
Erkrankungen des Blutes und des Lymphsystems
| |
Häufig
|
Thrombozytopenie1)
| |
Nicht bekannt
|
Thrombotische Mikroangiopathie2)
| |
Herzerkrankungen
| |
Häufig
|
Troponin erhöht6)
| |
Erkrankungen des Gastrointestinaltrakts
| |
Häufig
|
Erbrechen
| |
Leber- und Gallenerkrankungen
| |
Sehr häufig
|
Leberenzyme erhöht5) (24.2%)
| |
Häufig
|
Lebertoxizität3)
| |
Nicht bekannt
|
Akutes Leberversagen2) 4)
| |
Nicht bekannt
|
Akute Leberschädigung2)
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Häufig
|
Fieber
| |
Nicht bekannt
|
Infusionsbedingte Reaktionen 7)
|
1) Thrombotytopenie beinhaltet Thrompozytopenie und Thrombozytenzahl verringert
2) Behandlungsbedingte Nebenwirkungen, die ausserhalb von klinischen Studien vor der Markteinführung, und in der Zeit nach der Markteinführung berichtet wurden.
3) Lebertoxizität beinhaltet hepatische Steatose und Hypertransaminasämie.
4) einschliesslich Fälle mit Todesfolge
5) Leberenzyme erhöht beinhaltet: Alaninaminotransferase erhöht, Ammoniak erhöht, Aspartataminotransferase erhöht, Gamma-Glutamyltransferase erhöht, Leberenzyme erhöht, Leberfunktionstest erhöht und Transaminasen erhöht.
6) Troponin erhöht beinhaltet erhöhtes Troponin, Troponin-I erhöht und Troponin-T erhöht (diese wurde ausserhalb von klinischen Studien und in der Zeit nach der Markteinführung berichtet)
7) Infusionsbedingte Reaktionen gehören nicht zu einer bestimmten Systemorganklasse und umfassen mehrere Anzeichen und Symptome, die während und/oder kurz nach der Infusion auftreten.
Beschreibung ausgewählter Nebenwirkungen
Leber- und Gallenerkrankungen
In klinischen Studien wurden erhöhte Transaminasenwerte, die mehr als das 2-Fache der ULN (und in manchen Fällen > 20 x ULN) betrugen, bei 31 % der mit der empfohlenen Dosis behandelten Patienten beobachtet. Diese Patienten waren klinisch asymptomatisch und keiner der Patienten zeigte eine klinisch signifikante Erhöhung von Bilirubin. Erhöhungen der Serum-Transaminase bildeten sich gewöhnlich unter Prednisolon-Behandlung zurück und die Patienten erholten sich ohne klinische Folgeerscheinungen (siehe Abschnitte «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»). In der Zeit nach der Markteinführung, ausserhalb von klinischen Studien, wurde von Kindern berichtet, die typischerweise innerhalb der ersten zwei Behandlungsmonate mit Onasemnogene-Abeparvovec trotz Einnahme von Kortikosteroiden, vor und nach der Infusion, Anzeichen und Symptome eines akuten Leberversagens (z.B. Gelbsucht, Koagulopathie, Enzephalopathie) entwickelten. Es wurden Fälle von akutem Leberversagen, einschliesslich Fälle mit Todesfolge berichtet.
Vorübergehende Thrombozytopenie
In klinischen Studen wurde eine vorübergehende Verminderung der mittleren Thrombozytenzahl gegenüber dem Ausgangswert (6.1%) an mehreren Zeitpunkten nach der Anwendung beobachtet und klang normalerweise innerhalb von zwei Wochen ab. Die Verminderung der Thrombozytenzahl war in der ersten Woche nach der Behandlung stärker ausgeprägt. Nach der Markteinführung wurden Fälle mit einem vorübergehenden Abfall der Thrombozytenzahl auf < 50 x 109/l innerhalb von zwei Wochen nach der Verabreichung von Onasemnogen abeparvovec berichtet (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»)
Erhöhung der Troponin-I-Spiegel
Nach der Infusion von Onasemnogen abeparvovec wurden Erhöhungen der kardialen Troponin-I-Spiegel bis zu 0,2 µg/l beobachtet. Im abgeschlossenen klinischen Studienprogramm wurden keine klinisch erkennbaren kardialen Befunde nach der Verabreichung von Onasemnogen abeparvovec beobachtet (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Immunogenität
In den klinischen Studien wurden die Anti-AAV9-Antikörpertiter vor und nach der Gentherapie gemessen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»). Alle Patienten, die Onasemnogen abeparvovec erhielten, hatten vor der Behandlung Anti-AAV9-Titer von oder unter 1:50. Mittlere Erhöhungen gegenüber dem Ausgangswert des AAV9-Titers wurden bei allen Patienten an allen Zeitpunkten bis auf einen beobachtet, und zwar in Bezug auf das AAV9-Peptid, was die normale Reaktion auf ein virales Nicht-Autoantigen ist. Einige Patienten zeigten AAV9-Titer, die oberhalb der Quantifizierungsschwelle lagen, die meisten dieser Patienten hatten jedoch keine potenziell klinisch signifikanten Nebenwirkungen. Daher wurde kein Zusammenhang zwischen hohen Anti-AAV9-Antikörpertitern und dem Potenzial für Nebenwirkungen oder Wirksamkeitsparametern festgestellt.
In der klinischen Studie AVXS-101-CL-101 wurden 16 Patienten auf AAV9-Antikörpertiter untersucht: 13 hatten Titer unter 1:50 und wurden in die Studie aufgenommen; drei Patienten hatten Titer über 1:50, zwei von ihnen wurden nach Beendigung des Stillens erneut getestet, ihre gemessenen Titer lagen dann bei weniger als 1:50 und beide wurden in die Studie aufgenommen. Es gibt keine Informationen darüber, ob bei Müttern, die möglicherweise seropositiv für Anti-AAV9-Antikörper sind, das Stillen eingeschränkt werden sollte. Vor der Behandlung mit Onasemnogen abeparvovec hatten alle Patienten einen AAV9-Antikörpertiter kleiner als oder gleich 1:50 und zeigten anschliessend einen Anstieg der AAV9-Antikörpertiter auf mindestens 1:102'400 und bis zu mehr als 1:819'200.
Der Nachweis einer Antikörperbildung hängt stark von der Sensitivität und Spezifität des Tests ab. Darüber hinaus kann die beobachtete Häufigkeit der Antikörper-Positivität (einschliesslich neutralisierender Antikörper) in einem Test durch mehrere Faktoren wie Testmethodik, Probenhandling, Zeitpunkt der Probennahme, Begleitmedikation und Grunderkrankungen beeinflusst sein.
Andere besondere Patientengruppen
Körpergewicht ≥8,5 kg bis ≤21 kg
Die Sicherheit von Zolgensma wurde in einer klinischen Studie nach der Zulassung (COAV101A12306) bei 24 Patienten mit einem Körpergewicht von ≥8,5 kg bis ≤21 kg (medianes Gewicht) untersucht: 15,8 kg). Das Alter der Patienten lag zum Zeitpunkt der Verabreichung zwischen 1,5 und 9 Jahren. 1 der 24 Patienten war zum Zeitpunkt der Verabreichung unter 2 Jahre alt (medianes Alter: 4,9 Jahre). Die Patienten hatten 2 bis 4 SMN2 Kopien. Vor der Behandlung mit Zolgensma hatten 21 Patienten ihre vorherige Behandlung mit Nusinersen oder Risdiplam abgebrochen. Die beobachteten Arten von Nebenwirkungen entsprachen denen der 5 offenen Studien.
Bei der Mehrheit der Patienten (23/24) wurden erhöhte AST- oder ALT-Werte > 2 × ULN beobachtet. Diese Patienten waren klinisch asymptomatisch und wiesen keine erhöhten Bilirubinwerte auf. Die erhöhten AST- und ALT-Werte wurden mit Kortikosteroiden behandelt, in der Regel mit längerer Dauer und/oder höherer Dosis (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Vorübergehende Verminderungen der Thrombozytenzahl, welche die Kriterien für eine Thrombozytopenie erfüllten, wurden bei 20 von 24 Patienten beobachtet (siehe Rubrik «Unerwünschte Wirkungen» Vorübergehende Thrombozytopenie). Alle Patienten hatten vor der Behandlung mit Zolgensma AAV9-Antikörpertiter von weniger als 1:50 und wiesen anschliessend einen Titeranstieg auf mehr als 1:819,200 auf. Positive Anti-SMN-Antikörper wurden bei 4 von 24 Patienten in Woche 52 beobachtet. Es gab keinen eindeutigen Zusammenhang zwischen einem hohen Anti-AAV9-Antikörpertiter oder einer positiven Anti-SMN-Antikörperreaktion und der Sicherheit oder Wirksamkeit von Zolgensma.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIn Bezug auf eine Überdosierung von Onasemnogen abeparvovec liegen keine Daten aus klinischen Studien vor.
Empfohlen werden eine Anpassung der Prednisolon-Dosis und eine engmaschige klinische Beobachtung und Überwachung der Laborparameter (einschliesslich klinische Chemie und Hämatologie) auf eine systemische Immunreaktion (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Eigenschaften/WirkungenATC-Code
M09AX09
Wirkungsmechanismus
Onasemnogen abeparvovec ist eine Gentherapie, die darauf abzielt, eine funktionsfähige Kopie des Survival-Motoneuron-Gens (SMN1) in die transduzierten Zellen einzubringen, um die monogenetische Grundursache der Erkrankung zu behandeln. Durch das Bereitstellen einer alternativen Quelle der SMN-Proteinexpression in Motoneuronen wird voraussichtlich das Überleben und die Funktion der transduzierten Motoneuronen gefördert.
Onasemnogen abeparvovec ist ein nicht-replizierender rekombinanter AAV9-Vektor, der ein AAV9-Kapsid verwendet, um ein stabiles, voll funktionsfähiges menschliches SMN-Transgen bereitzustellen. Die Fähigkeit des AAV9-Kapsids, die Blut-Hirn-Schranke zu überwinden, und Motoneuronen zu transduzieren konnte nachgewiesen werden. Das in Onasemnogen abeparvovec vorhandene SMN1-Gen ist so konzipiert, dass es als episomale DNS im Kern der transduzierten Zellen liegt und in postmitotischen Zellen voraussichtlich über einen längeren Zeitraum stabil exprimiert wird. Es besteht die Möglichkeit, dass rekombinante AAV Vektoren mit geringer Häufigkeit zufällig in die menschliche DNA integrieren. (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Es ist nicht bekannt, dass das AAV9-Virus beim Menschen Krankheiten verursacht. Das Transgen wird als selbst-komplementäres doppelsträngiges Molekül in die Zielzellen eingebracht. Die Expression des Transgens wird durch einen konstitutiven Promotor (Hybrid aus Cytomegalievirus-Enhancer und Hühner-β-Aktin Promotor) ermöglicht, der zu einer kontinuierlichen, anhaltenden SMN-Proteinexpression führt. Der Nachweis des Wirkmechanismus wird durch präklinische Studien und durch Daten zur Biodistribution am Menschen gestützt.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Phase-3-Studie AVXS-101-CL-303 bei Patienten mit Typ-1-SMA
AVXS-101-CL-303 (Studie CL-303) ist eine offene, einarmige Phase-3-Einzeldosisstudie, in der Onasemnogen-Abeparvovoec in der therapeutischen Dosis (1,1 × 1014 vg/kg) intravenös angewendet wird. Es wurden 22 Patienten mit Typ-1-SMA und zwei SMN2-Kopien aufgenommen. Vor der Behandlung mit Onasemnogen abeparvovec benötigte keiner der 22 Patienten die Unterstützung durch nicht-invasive Beatmung (NIV), und alle Patienten konnten ausschliesslich oral ernährt werden (d.h. es bestand keine Notwendigkeit für eine nicht-orale Ernährung). Der durchschnittliche CHOP-INTEND-(Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders-)Score bei Baseline lag bei 32,0 (Bereich 18 bis 52). Das Alter der 22 Patienten zum Zeitpunkt der Behandlung betrug im Durchschnitt 3,7 Monate (Bereich 0,5 bis 5,9 Monaten).
Von den 22 in die Studie aufgenommenen Patienten überlebten 21 Patienten bis ≥10,5 Monate ohne Dauerbeatmung (dies wird als ereignisfreies Überleben bezeichnet), 20 Patienten überlebten bis ≥14 Monate ereignisfrei (co-primärer Wirksamkeitsendpunkt) und 20 Patienten bis 18 Monate.
Drei Patienten brachen die Studie ab. Bei zwei von ihnen trat ein Ereignis (Tod oder Dauerbeatmung) auf, was zu 90,9 % (95 % KI: 79,7 %, 100,0 %) ereignisfreiem Überleben (ohne Dauerbeatmung am Leben) im Alter von 14 Monaten führte, siehe Abbildung 1.
Abbildung 1: Zeit (in Monaten) bis zum Tod oder dauerhafter Beatmung, zusammengefasst aus den Onasemnogen abeparvovec i.v.-Studien (CL-101, CL-302, CL-303, CL-304 2-Kopien-Kohorte)
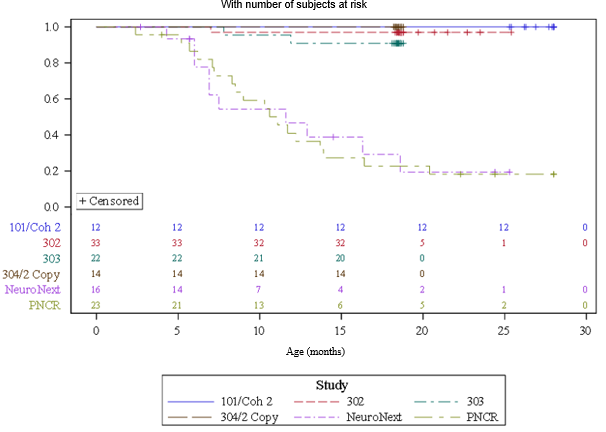
PNCR = Pediatric Neuromuscular Clinical Research, Kohorte im natürlichen, interventionslosen Verlauf (Natural History).
NeuroNext = Exzellenz-Netzwerk für klinische Studien in den Neurowissenschaften, Kohorte im natürlichen Verlauf (Natural History)
Bei den 14 Patienten der Studie CL-303, die den Meilenstein «unabhängiges Sitzen über mindestens 30 Sekunden» zu einem beliebigen Termin während der Studie erreicht haben, betrug das mediane Alter beim erstmaligen Nachweis dieses Meilensteins 12,6 Monate (Bereich 9,2 bis 18,6 Monate).
Bei 13 Patienten (59,1 %) bestätigte sich der Meilenstein «unabhängiges Sitzen über mindestens 30 Sekunden» bei der 18-Monats-Visite (co-primärer Endpunkt, p < 0,0001). Ein Patient erreichte den Meilenstein «unabhängiges Sitzen über 30 Sekunden» im Alter von 16 Monaten, der jedoch bei der 18-Monats-Visite nicht bestätigt werden konnte. Die videobestätigten Entwicklungsmeilensteine für die Patienten in der Studie CL-303 sind in Tabelle 4 zusammengefasst. Drei Patienten erreichten keinen Motorik- Meilenstein (13,6 %) und weitere drei Patienten (13,6 %) erreichten vor dem letzten Studienbesuch im Alter von 18 Monaten eine Kopfkontrolle als maximalen Motorik-Meilenstein.
Tabelle 4: Mediane Zeit bis zum videodokumentierten Erreichen von Motorik-Meilensteinen, Studie CL-303
|
Videodokumentierter Meilenstein
|
Anzahl Patienten, die den Meilenstein erreichten
n/N (%)
|
Medianes Alter bis Erreichen des Meilensteins
(Monate)
|
95 %-Konfidenzintervall
| |
Kopfkontrolle
|
17/20* (85.0)
|
6,8
|
(4,77, 7,57)
| |
Rollt sich vom Rücken auf die Seiten
|
13/22 (59.1)
|
11,5
|
(7,77, 14,53)
| |
Sitzt ohne Unterstützung über 30 Sekunden (Bayley)
|
14/22 (63.6)
|
12,5
|
(10,17, 15,20)
| |
Unterstützungsfreies Sitzen über mindestens 10 Sekunden (WHO)
|
14/22 (63.6)
|
13,9
|
(11,00, 16,17)
|
* 2 Patienten zeigten laut klinischer Beurteilung zu Therapiebeginn eine Kopfkontrolle.
Ein Patient (4,5 %) konnte nach 12,9 Monaten ebenfalls mit Unterstützung gehen. Aufgrund des natürlichen Verlaufs der Erkrankung wurde nicht erwartet, dass Patienten, die die Einschlusskriterien der Studie erfüllten, die Fähigkeit zum Sitzen ohne Unterstützung erlangten. Darüber hinaus waren 18 der 22 Patienten im Alter von 18 Monaten von der Beatmungsunterstützung unabhängig.
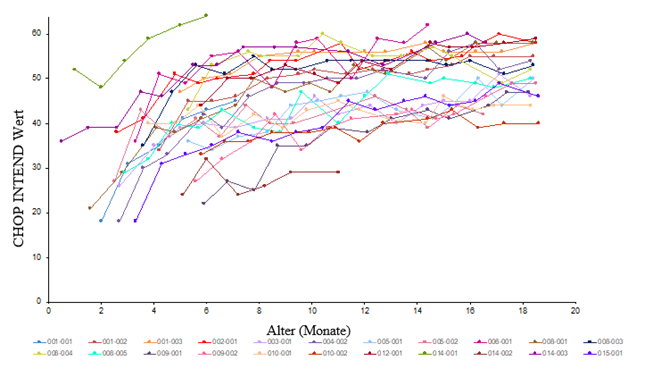
Eine Verbesserung der motorischen Entwicklung wurde auch beobachtet; dabei basierten die Messungen auf dem CHOP INTEND-Test, siehe Abbildung 2. Einundzwanzig Patienten (95,5 %) erreichten einen CHOP-INTEND-Wert ≥40, 14 Patienten (63,6 %) hatten einen CHOP-INTEND-Wert ≥50 und 9 Patienten (40,9 %) hatten einen CHOP-INTEND-Wert ≥58 erreicht. Patienten mit unbehandelter Typ-1-SMA erreichen fast nie einen CHOP-INTEND-Wert ≥40. Trotz eines konstanten Niveaus bei CHOP-INTEND wurden bei einigen Patienten Motorik-Meilensteine erreicht. Es wurde keine klare Korrelation zwischen den CHOP-INTEND-Werten und dem Erreichen von Motorik-Meilensteinen beobachtet.
Abbildung 2: Scores der motorischen Entwicklung nach CHOP-INTEND, Studie CL-303 (n=22)
Phase-3-Studie AVXS-101-CL-302 bei Patienten mit SMA
AVXS-101-CL-302 (Studie CL-302) ist eine offene, einarmige Phase-3-Einzeldosisstudie, in der onasemnogene abeparvovec in der therapeutischen Dosis (1,1 × 1014 vg/kg) intravenös verabreicht wurde. Es wurden 33 Patienten mit Typ-1-SMA und 2 SMN2-Kopien in die Studie eingeschlossen. Vor der Behandlung mit onasemnogene abeparvovec benötigten 9 Patienten (27,3 %) unterstützende Beatmung und 9 Patienten (27,3 %) Sondenernährung. Der mittlere CHOP-INTEND-Wert der 33 Patienten bei Baseline betrug 27,9 (Bereich: 14 bis 55). Das Durchschnittsalter der 33 Patienten betrug zum Zeitpunkt der Behandlung 4,1 Monate (Bereich: 1,8 bis 6,0 Monate).
Von den 33 eingeschlossenen Patienten («Efficacy Completers Population») befand sich ein Patient (3 %), der eine Dosis erhalten hatte, ausserhalb des Altersbereichs gemäss Protokoll und wurde daher nicht in die Intent-to-treat-Population (ITT) aufgenommen. Von den 32 Patienten in der ITT-Population starb ein Patient (3 %) während der Studie aufgrund eines Fortschreitens der Krankheit.
Von den 32 Patienten in der ITT-Population erreichten 14 Patienten (43,8 %) den Meilenstein «Sitzen ohne Unterstützung für mindestens 10 Sekunden» bei irgendeinem Studientermin bis einschliesslich zum Studientermin nach 18 Monaten (primärer Wirksamkeitsendpunkt). Das mediane Alter, bei dem dieser Meilenstein erstmalig erreicht wurde, lag bei 15,9 Monaten (Bereich: 7,7 bis 18,6 Monate). 31 Patienten (96,9 %) in der ITT-Population überlebten ohne dauerhafte Beatmung (d.h. ereignisfreies Überleben) bis zum Alter von ≥14 Monaten (sekundärer Wirksamkeitsendpunkt).
Die zusätzlichen videobestätigten Entwicklungsmeilensteine für Patienten in der «Efficacy Completers Population» der Studie CL-302 bei irgendeinem Studientermin bis zum Studientermin nach 18 Monaten (einschliesslich) sind in Tabelle 5 zusammengefasst.
Tabelle 5: Mediane Zeit bis zum videodokumentierten Erreichen von Motorik-Meilensteinen in der Studie CL-302 («Efficacy Completers Population»)
|
Videodokumentierter Meilenstein
|
Anzahl der Patienten, die den Meilenstein erreichten
n/N (%)
|
Medianes Alter bis zum Erreichen des Meilensteins
(Monate)
|
95-%-Konfidenzintervall
| |
Kopfkontrolle
|
23/30* (76,7)
|
8,0
|
(5,8; 9,2)
| |
Rollt sich vom Rücken auf die Seiten
|
19/33 (57,6)
|
15,3
|
(12,5; 17,4)
| |
Sitzt mehr als 30 Sekunden ohne Unterstützung
|
16/33 (48,5)
|
14,3
|
(8,3; 18,3)
|
*3 Patienten zeigten laut klinischer Beurteilung bei Baseline eine Kopfkontrolle.
Ein Patient (3 %) erreichte die Motorik-Meilensteine Krabbeln, Stehen mit Unterstützung, alleine Stehen, Gehen mit Unterstützung und alleine Gehen bis zum Alter von 18 Monaten.
Von den 33 eingeschlossenen Patienten erreichten 24 Patienten (72,7 %) einen CHOP-INTEND-Wert von ≥40, 14 Patienten (42,4 %) erreichten einen CHOP-INTEND-Wert von ≥50 und 3 Patienten (9,1 %) erreichten einen CHOP-INTEND-Wert von ≥58 (siehe Abbildung 3). Patienten mit unbehandelter Typ-1-SMA erreichen fast nie einen CHOP-INTEND-Wert von ≥40.
Abbildung 3; Werte der motorischen Entwicklung nach CHOP-INTEND in der Studie CL-302 («Efficacy Completers Population»; N=33)*
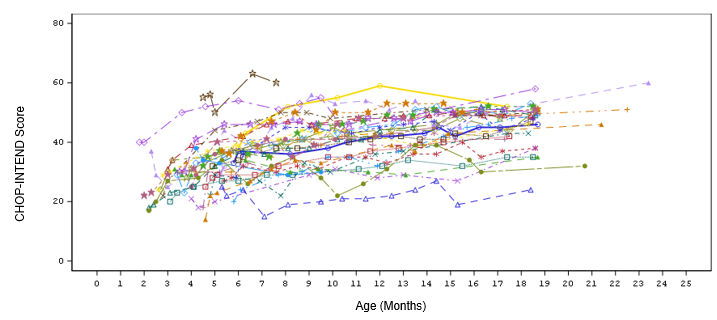
*Hinweis: Der programmgesteuert berechnete Gesamtwert für einen Patienten (
) in Monat 7 (Gesamtwert=3) wird als ungültig betrachtet. Es wurden nicht alle Elemente bewertet und der Gesamtwert hätte auf «fehlend» (d.h. nicht berechnet) gesetzt werden müssen.
Phase-1-Studie AVXS-101-CL-101 bei Patienten mit Typ-1-SMA
Die Ergebnisse aus der Studie CL-303 werden gestützt durch die Studie AVXS-101-CL-101 (Studie CL-101) eine Phase-1-Studie mit Typ-1-SMA Patienten, in der Onasemnogen abeparvovec als einzelne intravenöse Infusion bei 12 Patienten mit einem Körpergewicht von 3,6 kg bis 8,4 kg (Alter 0,9 Monate bis 7,9 Monate) angewendet wurde. Im Alter von 14 Monaten waren alle behandelten Patienten ereignisfrei, d.h. sie überlebten ohne dauerhafte Beatmung, verglichen mit 25 % in der Kohorte im natürlichen Verlauf (Natural History). Am Ende der Studie (24 Monate nach der Verabreichung) waren alle behandelten Patienten ereignisfrei, verglichen mit weniger als 8% in der Natural History, siehe Abbildung 1.
Nach 24 Monaten posttherapeutischer Nachbeobachtung konnten 10 von 12 Patienten ≥10 Sekunden lang ohne Unterstützung sitzen, 9 Patienten konnten ≥30 Sekunden lang ohne Unterstützung sitzen und 2 Patienten konnten ohne Hilfe stehen und gehen. Bei einem von 12 Patienten wurde die Kopfkontrolle als maximaler Motorik-Meilenstein nicht vor dem Alter von 24 Monaten erreicht. Zehn von 12 Patienten aus der Studie CL-101 werden in einer Langzeitstudie (bis zu 7.5 Jahre nach der Verabreichung) weiter beobachtet und alle 10 Patienten waren am 23. Mai 2022 am Leben und benötigten keine dauerhafte Beatmung. Alle der 10 Patienten haben entweder die zuvor erreichten Meilensteine beibehalten oder neue Meilensteine erreicht, darunter Sitzen mit Unterstützung, Stehen mit Hilfe und allein Gehen. Sechs der 10 Patienten erhielten während der Langzeitstudie zu einem Zeitpunkt eine begleitende Nusinersen- oder Risdiplam Behandlung. Das Aufrechterhalten der Wirksamkeit und das Erreichen von Meilensteinen kann daher nicht bei allen Patienten allein auf Onasemnogen abeparvovec zurückgeführt werden. Der Meilenstein «Stehen mit Hilfe» wurde von zwei Patienten, die kein Nusinersen oder Risdiplam erhielten, neu erreicht.
Phase-3-Studie AVXS-101-CL-304 bei Patienten mit präsymptomatischer SMA
Die Studie CL-304 ist eine, globale, offene, einarmige, multizentrische Phase-3-Einzeldosis-Studie mit AVXS-101 i.v. bei präsymptomatischen neugeborenen Patienten bis zu einem Alter von 6 Wochen mit 2 (Kohorte 1, n = 14) oder 3 (Kohorte 2, n = 15) SMN2-Kopien.
Kohorte 1
Die 14 behandelten Patienten mit 2 SMN2-Kopien wurden bis zum Alter von 18 Monaten beobachtet. Alle Patienten überlebten ereignisfrei bis zu einem Alter von mindestens 14 Monaten ohne dauerhafte Beatmung. Alle 14 Patienten erreichten bei irgendeinem Studientermin bis zum Alter von 18 Monaten (primärer Wirksamkeitsendpunkt) den Meilenstein «Sitzen ohne Unterstützung für mindestens 30 Sekunden», und zwar in einem Alter von 5,7 bis 11,8 Monaten. 11 der 14 Patienten erreichten den Meilenstein «Sitzen ohne Unterstützung» im Alter von 279 Tagen oder früher, dem 99. Perzentil für die Entwicklung dieses Meilensteins. Neun Patienten erreichten den Meilenstein «alleine Gehen» (64,3 %). Alle 14 Patienten haben bis zum Alter von 18 Monaten bei irgendeinem Studientermin einen CHOP-INTEND-Wert von ≥58 erreicht. Keiner der Patienten benötigte während der Studie unterstützende Beatmung oder Sondenernährung.
Kohorte 2
Die 15 behandelten Patienten mit 3 SMN2-Kopien wurden bis zum Alter von 24 Monaten beobachtet. Alle Patienten überlebten ereignisfrei bis zum Alter von 24 Monaten ohne dauerhafte Beatmung.
Alle 15 Patienten waren im Alter von 9,5 bis 18,3 Monaten in der Lage, mindestens 3 Sekunden lang ohne Unterstützung allein zu stehen (primärer Wirksamkeitsendpunkt). 14 der 15 Patienten erreichten den Meilenstein «alleine Stehen» im Alter von 514 Tagen oder früher, was dem 99. Perzentil für die Entwicklung dieses Meilensteins entspricht. Vierzehn Patienten (93,3 %) waren in der Lage, mindestens fünf Schritte selbstständig zu gehen. Alle 15 Patienten erreichten in den Bayley-III-Untertests für Grob- und Feinmotorik bei jeder Nachuntersuchung bis zum Alter von 24 Monaten einen Wert von ≥4 innerhalb von 2 Standardabweichungen vom Altersmittelwert. Keiner der Patienten benötigte während der Studie unterstützende Beatmung oder Sondenernährung.
Phase-3-Studie OAV101A12306 bei Patienten mit SMA mit einem Gewicht von ≥8,5 kg bis ≤21 kg
Die Studie OAV101A12306 ist eine abgeschlossene, offene, einarmige, multizentrische Phase-3-Studie zur intravenösen Verabreichung von Zolgensma in der therapeutischen Dosis (1,1 × 1014 vg/kg) bei 24 pädiatrischen Patienten mit SMA mit einem Gewicht von ≥8,5 kg bis ≤21 kg (Mediangewicht: 15,8 kg). Das Alter der Patienten warzum Zeitpunkt der Verabreichung zwischen 1,5 und 9 Jahren. 1 der 24 Patienten war zum Zeitpunkt der Verabreichung noch keine 2 Jahre alt (Median: 4,9 Jahre). Die Patienten hatten 2 bis 4 Kopien von SMN2. Vor der Behandlung mit Zolgensma setzten 21 Patienten ihre vorherige Behandlung mit Nusinersen oder Risdiplam ab.
In Woche 52 betrug die mittlere Veränderung des Gesamtscores der Hammersmith Functional Motor Scale - Expanded (HFMSE) gegenüber dem Ausgangswert 3,7 (18/24 Patienten), was aufgrund der Daten zum natürlichen Verlauf der SMA klinisch bedeutsam ist. Der mittlere Anstieg des Gesamtscores des Revised Upper Limb Module (RULM) lag in Woche 52 bei 2,0 (17/24 Patienten).
In den klinischen Prüfungen ist Onasemnogen abeparvovec bei Patienten mit einer biallelischen Mutation im SMN1-Gen und nur einer SMN2-Kopie nicht untersucht worden.
PharmakokinetikOnasemnogen abeparvovec ist ein virales gentherapeutisches Produkt zur intravenösen Anwendung. Konventionelle klinische pharmakokinetische Studien sind daher nicht zutreffend. Es wurden keine für die Pharmakokinetik zweckdienlichen in vitro Studien mit humanen Zellen, Geweben oder ähnlichen Materialien (humane Biomaterialien) durchgeführt.
Absorption
Nicht zutreffend.
Distribution
Die Biodistribution wurde bei zwei Patienten evaluiert, die 5,7 Monate bzw. 1,7 Monate nach der Infusion von Onasemnogen abeparvovec in einer Dosis von 1,1 x 1014 vg/kg starben. Beide Fälle zeigten, dass die höchsten Werte an Vektor-DNS in der Leber gefunden wurden. Auch in der Milz, im Herz, Pankreas, im Leistenlymphknoten, in den Skelettmuskeln, peripheren Nerven, in der Niere, Lunge, im Darm, in den Keimdrüsen, im Rückenmark, Gehirn und Thymus wurde Vektor-DNS nachgewiesen. Die Immunfärbung gegen das SMN-Protein zeigte eine generalisierte SMN-Expression in spinalen Motoneuronen, Neuronen und Gliazellen des Gehirns sowie in Herz, Leber, Skelettmuskeln und anderen untersuchten Geweben.
Metabolismus
Nicht zutreffend.
Elimination
Es wurden Studien zur Freisetzung des Onasemnogen abeparvovec-Vektors durchgeführt, die die Menge des durch Speichel, Urin und Fäzes aus dem Körper ausgeschiedenen Vektors ermitteln.
Onasemnogen abeparvovec war nach der Infusion in Freisetzungsproben nachweisbar. Die Clearance von Onasemnogen abeparvovec erfolgte vorwiegend über die Fäzes, wobei der grösste Teil innerhalb von 30 Tagen nach der Verabreichung ausgeschieden war.
Präklinische DatenNach intravenöser Verabreichung an neonatalen Mäuse waren Vektor und Transgen weit verteilt, wobei die höchste Expression im Allgemeinen in Herz,Leber, Lunge und Skelettmuskel und eine erhebliche Expression in Gehirn und Rückenmark beobachtet wurden. In pivotalen dreimonatigen Toxikologiestudien an Mäusen waren die Hauptzielorgane der Toxizität Herz und Leber. Die auf Onasemnogen abeparvovec bezogenen Befunde in den Herzventrikeln waren dosisbezogene Entzündung, Ödem und Fibrose. In den Atrien des Herzens wurden Entzündung, Thrombose, Myokarddegeneration/nekrose und Fibroplasie beobachtet.. Eine Dosis ohne beobachtbare schädliche Wirkung (NOAEL) wurde für Onasemnogen abeparvovec in Maus Studien nicht identifiziert, da in der niedrigsten Dosis (1,5 × 1014 vg/kg) Entzündung/Ödem/Fibrose des Ventrikelmyokards und Entzündung des Vorhofs beobachtet wurden. Diese Dosis gilt als die maximal verträgliche Dosis und entspricht etwa dem 1,4-Fachen der empfohlenen klinischen Dosis. Die mit Onasemnogen abeparvovec verbundene Mortalität war in der Mehrheit der Mäuse mit atrialer Thrombose assoziiert und wurde bei einer Dosis von 2,4 × 1014 vg/kg beobachtet. Die Mortalitätsursache bei den übrigen Tieren war unbestimmt, obwohl eine mikroskopische Degeneration/Regeneration in den Herzen dieser Tiere gefunden wurde.
Die Leberbefunde bei den Mäusen umfassten hepatozelluläre Hypertrophie, eine Aktivierung der Kupfferzellen und vereinzelte hepatozelluläre Nekrose. In toxikologischen Langzeitstudien mit intravenöser und intrathekaler Verabreichung von Onasemnogen abeparvovec bei juvenilen nicht-menschlichen Primaten zeigten die Leberbefunde, einschliesslich singuläres Absterben (Nekrose) von Hepatozyten und einer Hyperplasie ovaler Zellen, eine teilweise (i.v.) oder vollständige (i.t.) Reversibilität.
Studien zur Genotoxizität, Karzinogenität und Reproduktionstoxizität wurden mit Onasemnogen abeparvovec nicht durchgeführt.
In einer sechsmonatigen toxikologischen Studie an juvenilen nicht-menschlichen Primaten führte die Verabreichung einer Einzeldosis von Onasemnogen abeparvovec in der klinisch empfohlenen intravenösen Dosis, mit oder ohne Kortikosteroidbehandlung, zu einer akuten, minimalen bis leichten Entzündung mit mononukleären Zellen und neuronaler Degeneration in den Spinalganglien (dorsal root ganglia, DRG) und Trigeminalganglien (TG) sowie zu einer Schädigung der Nervenfasern (axonale Degeneration) und/oder Narben (Gliose) im Rückenmark. Nach 6 Monaten hatten sich diese nicht-progressiven Befunde in den Trigeminalganglien vollständig und in den Spinalganglien und im Rückenmark teilweise zurückgebildet (verminderte Inzidenz und/oder Schwere). Nach intrathekaler Anwendung von Onasemnogen abeparvovec (nicht zugelassene Art der Anwendung) wurden diese akuten, nicht-progressiven Befunde bei juvenilen nicht-menschlichen Primaten mit minimalem bis mässigem Schweregrad festgestellt. Sie bildeten sich nach 12 Monaten teilweise bis vollständig zurück. Diese Befunde bei nicht-menschlichen Primaten hatten keine korrelativen klinischen Beobachtungen zur Folge, daher ist die klinische Relevanz beim Menschen nicht bekannt
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätssstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
24 Monate bei ≤ -60°C
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach dem Auftauen
Nach dem Auftauen darf das Arzneimittel nicht wieder eingefroren werden. Es kann 14 Tage lang bei 2°C bis 8°C gekühlt im Originalkarton gelagert werden.
Haltbarkeit nach dem Öffnen
Nach dem Aufziehen des Dosiervolumens in die Spritze muss es innerhalb von 8 Stunden verabreicht werden. Wenn das Arzneimittel nicht innerhalb von 8 Stunden infundiert wird, muss die Spritze mit dem Vektor entsorgt werden.
Besondere Lagerungshinweise
Im gefrorenen Zustand (≤ -60°C) lagern und transportieren.
Sofort nach Erhalt im Kühlschrank (2°C bis 8°C) lagern.
Zu den Aufbewahrungsbedingungen nach dem Auftauen des Arzneimittels siehe Abschnitt «Haltbarkeit nach dem Auftauen».
Bevor das Produkt im Kühlschrank gelagert wird, ist das Empfangsdatum auf dem Originalkarton zu vermerken.
In der Originalverpackung aufbewahren.
Hinweise für die Handhabung
Dieses Arzneimittel enthält genetisch veränderte Organismen. In Bezug auf die Handhabung und Entsorgung von Onasemnogen abeparvovec sowie bei versehentlicher Exposition sind angemessene Vorsichtsmassnahmen einzuhalten:
·Die Handhabung der Onasemnogen abeparvovec-Spritze muss aseptisch erfolgen und unter sterilen Bedingungen vorbereitet werden.
·Bei der Handhabung und Verabreichung von Onasemnogen abeparvovec sollte persönliche Schutzausrüstung (einschliesslich Handschuhe, Schutzbrille, Laborkittel und Ärmelschoner) getragen werden. Personen mit Hautverletzungen oder Kratzern auf der Haut dürfen nicht mit Onasemnogen abeparvovec arbeiten.
·Verschüttetes Onasemnogen abeparvovec muss mit einem saugfähigen Gaze-Pad aufgewischt werden. Der betroffene Bereich muss mit einer Bleichlösung und anschliessend mit Alkoholtüchern desinfiziert werden. Alle Reinigungsmaterialien müssen doppelt verpackt und gemäss den lokalen Richtlinien zum Umgang mit biologische Abfällen entsorgt werden.
·Alle Materialien, die mit Onasemnogen abeparvovec in Berührung gekommen sein könnten (z.B. Durchstechflasche, alle für die Injektion verwendeten Materialien, einschliesslich steriler Abdecktücher und Nadeln), müssen in Übereinstimmung mit den lokalen Richtlinien zum Umgang mit biologischen Abfällen entsorgt werden.
·Ein versehentlicher Kontakt mit Onasemnogen abeparvovec ist zu vermeiden. Bei Hautexposition muss der betroffene Bereich mindestens 15 Minuten lang gründlich mit Wasser und Seife gereinigt werden. Bei Kontakt mit den Augen muss der betroffene Bereich mindestens 15 Minuten lang gründlich mit Wasser gespült werden.
Erhalt und Auftauen der Durchstechflaschen mit Onasemnogen abeparvovec
·Die Durchstechflaschen werden gefroren (≤ -60ºC) transportiert. Nach Erhalt der Durchstechflaschen sollten diese unverzüglich bei 2°C bis 8°C im Kühlschrank gelagert und in der Originalverpackung aufbewahrt werden. Die Onasemnogen abeparvovec -Therapie muss innerhalb von 14 Tagen nach Erhalt der Durchstechflaschen eingeleitet werden.
·Die Durchstechflaschen müssen vor Gebrauch aufgetaut werden. Onasemnogen abeparvovec ist nur im aufgetauten Zustand zu verwenden.
·Bei Packungskonfigurationen mit bis zu 14 Durchstechflaschen ist das Produkt nach etwa 16 Stunden im Kühlschrank aufgetaut. Alternativ und zum sofortigen Gebrauch kann das Auftauen bei Raumtemperatur erfolgen.
·Bei Packungskonfigurationen mit bis zu 14 Durchstechflaschen ist das Auftauen aus dem gefrorenen Zustand nach etwa 6 Stunden bei Raumtemperatur (20 °C bis 25 °C) abgeschlossen.
·Vor dem Aufziehen des Dosiervolumens in die Spritze das aufgetaute Produkt vorsichtig verwirbeln. NICHT schütteln.
·Sie dürfen dieses Arzneimittel nicht verwenden, wenn Sie nach dem Auftauen und vor der Anwendung Feststoffteilchen oder Verfärbung darin bemerken.
·Nach dem Auftauen das Arzneimittel nicht wieder einfrieren.
·Nach dem Auftauen sollte Onasemnogen abeparvovecso so schnell wie möglich verabreicht werden. Nach dem Aufziehen des Dosiervolumens in die Spritze muss es innerhalb von 8 Stunden verabreicht werden. Wenn das Arzneimittel nicht innerhalb von 8 Stunden infundiert wird, muss die Spritze mit dem Vektor entsorgt werden.
Verabreichung von Onasemnogen abeparvovec an den Patienten
·Zur Verabreichung von Onasemnogen abeparvovec das gesamte Dosiervolumen in die Spritze aufziehen. Vor der Verabreichung gegebenenfalls in der Spritze vorhandene Luft entfernen. Die Dosis wird als intravenöse Infusion über einen Venenkatheter verabreicht.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Richtlinien zum Umgang mit biologischen Abfällen zu beseitigen.
Vorübergehend kann es zu einer Freisetzung (Shedding) von Onasemnogen abeparvovec kommen, hauptsächlich über die Exkremente. Pflegekräfte und Patientenfamilien müssen auf die folgenden Anweisungen zum richtigen Umgang mit Körperflüssigkeiten und dem Stuhl des Patienten aufmerksam gemacht werden:
·Eine gute Handhygiene (Tragen von Schutzhandschuhen und anschliessendes gründliches Händewaschen mit Seife und warmem fliessenden Wasser oder einem Handreiniger auf Alkoholbasis) ist erforderlich für den Fall, dass sie mit den Körperflüssigkeiten und dem Stuhl des Patienten in direkten Kontakt kommen. Diese Anweisungen sind nach der Behandlung mit Onasemnogen abeparvovec mindestens 1 Monat lang einzuhalten.
·Einwegwindeln können in Plastik-Doppelbeutel verschlossen über den Hausmüll entsorgt werden.
Zulassungsnummer67529 (Swissmedic)
PackungenZolgensma Infusionslösung: 1 Karton mit 2 - 14 Durchstechflaschen abgestimmt auf das Körpergewicht des Patienten [A].
Onasemnogen abeparvovec ist in einer Durchstechflasche (10 ml, Crystal-Zenith-Polymer) mit Stopfen (20 mm Chlorbutylkautschuk) und Dichtung (Aluminium, Flip-off) mit farbiger Verschlusskappe (Kunststoff) in zwei verschiedenen Füllvolumengrößen, 5,5 ml oder 8,3 ml, erhältlich.
Die Dosis von Onasemnogen abeparvovec und die genaue Anzahl der für jeden Patienten benötigten Durchstechflaschen werden anhand des Körpergewichts des Patienten berechnet (siehe Abschnitte «Dosierung/Anwendung» und Tabelle 6 unten).
Tabelle 6: Karton-/Kit-Konfigurationen
|
Körpergewicht des Patienten (kg)
|
Durchstechflasche mit 5,5 ml a
|
Durchstechflasche mit 8,3 ml b
|
Durchstechflaschen insgesamt pro Karton
| |
2,6 – 3,0
|
0
|
2
|
2
| |
3,1 – 3,5
|
2
|
1
|
3
| |
3,6 – 4,0
|
1
|
2
|
3
| |
4,1 – 4,5
|
0
|
3
|
3
| |
4,6 – 5,0
|
2
|
2
|
4
| |
5,1 – 5,5
|
1
|
3
|
4
| |
5,6 – 6,0
|
0
|
4
|
4
| |
6,1 – 6,5
|
2
|
3
|
5
| |
6,6 – 7,0
|
1
|
4
|
5
| |
7,1 – 7,5
|
0
|
5
|
5
| |
7,6 – 8,0
|
2
|
4
|
6
| |
8,1 – 8,5
|
1
|
5
|
6
| |
8,6 – 9,0
|
0
|
6
|
6
| |
9,1 – 9,5
|
2
|
5
|
7
| |
9,6 – 10,0
|
1
|
6
|
7
| |
10,1 – 10,5
|
0
|
7
|
7
| |
10,6 – 11,0
|
2
|
6
|
8
| |
11,1 – 11,5
|
1
|
7
|
8
| |
11,6 – 12,0
|
0
|
8
|
8
| |
12,1 – 12,5
|
2
|
7
|
9
| |
12,6 – 13,0
|
1
|
8
|
9
| |
13,1 – 13,5
|
0
|
9
|
9
| |
13,6 – 14,0
|
2
|
8
|
10
| |
14,1 – 14,5
|
1
|
9
|
10
| |
14,6 – 15,0
|
0
|
10
|
10
| |
15,1 – 15,5
|
2
|
9
|
11
| |
15,6 – 16,0
|
1
|
10
|
11
|
a Die Durchstechflasche mit einer nominalen Konzentration von 2 × 1013 vg/ml enthält ein extrahierbares Volumen von mindestens 5,5 ml.
b Die Durchstechflasche mit einer nominalen Konzentration von 2 × 1013 vg/ml enthält ein extrahierbares Volumen von mindestens 8,3 ml.
ZulassungsinhaberinNovartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz
Stand der InformationApril 2025
|