Eigenschaften/WirkungenATC-Code
V03AB38
Wirkungsmechanismus
Andexanet alfa ist eine rekombinante Form des humanen FXa Proteins. Dabei wurde das Protein so abgewandelt, dass ihm die enzymatische Aktivität von FXa fehlt. Das Serin im aktiven Zentrum wurde durch Alanin ersetzt. Dadurch ist das Molekül nicht mehr in der Lage, Prothrombin zu spalten und zu aktivieren. Ferner wurde die γ-Carboxyglutaminsäure (Gla)-Domäne entfernt. Dadurch verliert das Protein die Fähigkeit, durch Anlagerung den Prothrombinasekomplex zu bilden. Damit wurden dem Protein sämtliche antikoagulatorischen Wirkungen entzogen.
Andexanet alfa hebt die Wirkung von FXa-Inhibitoren spezifisch auf. Der primäre Wirkmechanismus besteht zwar in der Bindung und Sequestrierung des FXa-Inhibitors, doch leistet möglicherweise auch die Hemmung der Aktivität des Gewebefaktor-Pathway-Inhibitors (tissue factor pathway inhibitor, TFPI) über die Bindung an den TFPI einen geringeren Beitrag zur Gesamtwirkung. Das Zusammenspiel zwischen Andexanet alfa und TFPI ist noch nicht vollständig charakterisiert. Andexanet alfa bindet direkte FXa-Inhibitoren mit hoher Affinität, sodass sie für die Entfaltung ihrer antikoagulatorischen Wirkungen nicht mehr zur Verfügung stehen.
Pharmakodynamik
Die Wirkungen von Andexanet alfa können durch Assays für die Anti-FXa-Aktivität, die freie Fraktion des FXa-Inhibitors sowie die Thrombinbildung gemessen werden.
Kommerzielle Anti-FXa-Aktivitätstests sind nach der Verabreichung von Andexanet alfa für die Messung der Anti-FXa-Aktivität ungeeignet. Aufgrund der reversiblen Bindung von Andexanet alfa an den FXa-Inhibitor führt die derzeit bei diesen Tests verwendete hohe Probenverdünnung zur Dissoziation des Inhibitors von Andexanet alfa, was fälschlicherweise erhöhte Anti-FXa-Aktivitätsniveaus zur Folge hat. Dadurch wird eine erhebliche Unterschätzung der Aufhebungsaktivität von Andexanet alfa verursacht.
Zusätzlich zu seiner Fähigkeit, an die FXa-Inhibitoren Rivaroxaban und Apixaban, Edoxaban und den ATIII-Enoxaparin-Komplex zu binden, hemmt Andexanet alfa nachweislich die TFPI-Aktivität. Die zur Aufhebung der Anti-FXa-Aktivität und Wiederherstellung der Thrombinbildung benötigten Dosierungen und Dosierungsschemata von Andexanet alfa wurden in Dosisfindungsstudien an gesunden Probanden bestimmt.
Der zeitliche Verlauf der Anti-FXa-Aktivität nach Verabreichung von Andexanet alfa war in den Studien mit gesunden Probanden und den Studien an Patienten mit Blutungen einheitlich.
Die Gabe von Andexanet alfa als Bolus, gefolgt von einer zweistündigen Dauerinfusion, bewirkte eine rasche Abnahme der Anti-FXa-Aktivität (innerhalb von zwei Minuten nach Ende der Bolusgabe); anschliessend blieb die reduzierte Anti-FXa-Aktivität während der gesamten Dauerinfusion erhalten. Die Anti-FXa-Aktivität kehrte etwa zwei Stunden nach dem Ende der Bolusgabe oder Dauerinfusion auf die unter Placebo gemessenen Werte zurück, während die TFPI-Aktivität im Plasma zwischen 72 und 93 Stunden nach der Gabe von Andexanet alfa wieder die Werte vor der Behandlung erreichte.
Die Wiederherstellung der Thrombinbildung nach Andexanet alfa-Gabe war Dosis- und Dosierungsschema-abhängig und korrelierte ab etwa vier Stunden nach Andexanet alfa-Gabe nicht mit der Anti-FXa-Aktivität (siehe «Wiederherstellung der Thrombinbildung» weiter unten).
Der Anstieg der TF-initiierten Thrombinbildung über den Ausgangswert (vor der Antikoagulation) trat innerhalb von 2 Minuten nach einer Bolusverabreichung von Andexanet alfa auf und blieb während der gesamten Dauer der kontinuierlichen Infusion bestehen. Die TF-initiierte Thrombinbildung war bei den direkten FXa-Inhibitoren Rivaroxaban, Apixaban und Edoxaban mindestens 22 Stunden lang und bei Enoxaparin bis zu 15 Stunden lang höher als bei Placebo. Die anhaltende Erhöhung der Thrombinbildung über den Ausgangsbereich hinaus und die anhaltende Erhöhung gegenüber Placebo wurden in einem durch Kontakt aktivierten Thrombinbildungstest (ein Test, der nicht durch die TF-TFPI-Interaktion beeinflusst wird) nicht beobachtet.
Populationspharmakokinetische/pharmakodynamische (PK/PD-)Modellierung und Simulation
PK/PD-Modellierung und Simulationen beruhen auf dem Wechselspiel zwischen der Andexanet alfa- PK und der FXa-Inhibitor-PK sowie auf den Beziehungen zwischen Biomarkern, in diesem Fall Anti- FXa-Aktivität, TFPI-Aktivität und ETP. Hinsichtlich des unterschiedlichen Effekts der Antikoagulantien Apixaban oder Rivaroxaban, der von der Anti-TFPI-Wirkung abhängigen Dauer der Aufhebung der Antikoagulation und der Notwendigkeit einer Dauerinfusion bleiben Unsicherheiten. Die Genauigkeit von Simulationen bei Patienten mit Blutungen ist aufgrund der hohen interindividuellen Variabilität geringer als die bei gesunden Probanden.
Mithilfe von PK/PD-Modellen wurde die Anti-FXa-Wirkung von niedermolekularem Heparin (Enoxaparin 40 mg) charakterisiert, das zur erneuten Antikoagulation nach Aufhebung der FXa-Inhibition durch Andexanet alfa verabreicht wurde. In diesen Simulationen war, unabhängig von der vorherigen Dosis des Antikoagulans, die Anti-FXa-Wirkung von Enoxaparin über 4 Stunden nach dem Ende der Infusion hinaus nicht mehr durch Andexanet alfa beeinträchtigt (siehe Rubrik «Dosierung/Anwendung»). Dieser Zeitraum entspricht der Halbwertszeit von Andexanet alfa (siehe Rubrik «Pharmakokinetik») und der Rückkehr zur Anti-FXa-Aktivität vor der Infusion, die in den klinischen Studien ANNEXA-A und ANNEXA-R gezeigt wurde (siehe Abbildung 1). Die verbleibende Menge Andexanet alfa reicht nicht aus, um die Antikoagulation, die entweder durch den initialen oralen FXa-Inhibitor oder ein nachfolgendes Antikoagulans (unabhängig vom oralen FXa-Inhibitor oder niedermolekularen Heparin) bewirkt wird, aufzuheben.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Andexanet alfa wurde in drei prospektiven, randomisierten, placebokontrollierten Studien an gesunden Probanden (Studie 1: ANNEXA-A, Studie 2: ANNEXA-R, Studie 3: 16-512) und in zwei prospektiven Studien an Patienten mit Blutungen (Studie 4: ANNEXA-4, Studie 5: ANNEXA-I) beurteilt. Die Studien an gesunden Probanden untersuchten die prozentuale Veränderung der Anti-FXa-Aktivität, und die Endpunkte wurden vom EAC (Endpoint Adjudication Committee) festgestellt.
Diese Studien an gesunden Probanden untersuchten die prozentuale Veränderung der Anti-FXa- Aktivität von Baseline bis zum Nadir für die niedrig und die hoch dosierte Therapie mit Bolusgabe, gefolgt von einer Dauerinfusion. Niedrig dosiertes Ondexxya wurde als i.v. 400-mg-Bolus, gefolgt von einer Dauerinfusion von 4 mg/min über 120 Minuten (480 mg), verabreicht (Gesamtdosis aus Bolus plus Dauerinfusion 880 mg). Hoch dosiertes Ondexxya wurde als i.v. 800-mg-Bolus, gefolgt von einer Dauerinfusion von 8 mg/min über 120 Minuten (960 mg), verabreicht (Gesamtdosis aus Bolus plus Dauerinfusion 1760 mg). Der Nadir war definiert als der kleinste Wert, der innerhalb von 5 Minuten nach dem Ende der Dauerinfusion gemessen wurde.
Die Wirksamkeit von Ondexxya wurde in einer multinationalen, prospektiven, einarmigen, offenen Phase-3b/4-Studie (Studie 4, ANNEXA-4) bei Patienten mit akuter schwerer Blutung, die vor kurzem einen FXa-Inhibitor erhalten hatten, beurteilt. Diese Studie untersuchte die prozentuale Veränderung der Anti-FXa-Aktivität von Baseline bis zum Nadir unter der Behandlung zwischen dem Ende der Bolusgabe und dem Infusionsende. Ausserdem untersuchte die Studie die Rate einer wirksamen Hämostase 12 Stunden nach der Behandlung, beurteilt von einem unabhängigen Endpoint Adjudication Committee (EAC), das für die Anti-FXa-Aktivitätsspiegel verblindet war. Thrombotische Ereignisse und Blutungsarten wurden ebenfalls vom EAC festgestellt.
ANNEXA-I (Studie 5) war eine randomisierte, offene Phase-4-Studie mit verblindeter Feststellung der primären Wirksamkeits- und Sicherheitsendpunkte zur Bestimmung der Wirksamkeit und Sicherheit von Andexanet alfa im Vergleich zur üblichen Therapie bei Patienten mit akuter intrakranieller Blutung (ICH) innerhalb von 6 Stunden nach Symptombeginn gemäss Baseline-Scan und innerhalb von 15 Stunden nach Einnahme eines oralen FXa-Inhibitors.
Aufhebung der Antikoagulation bei gesunden Probanden zwischen 50 und 75 Jahren (Studien 14-503 (ANNEXA-A) und 14-504 (ANNEXA-R))
In einer prospektiven, randomisierten, placebokontrollierten Studie erhielten gesunde Probanden mit einem medianen Alter von 56.5 Jahren unter der Behandlung mit Apixaban 5 mg zweimal täglich Andexanet alfa (n = 24) als i.v. 400 mg-Bolusgabe, unmittelbar gefolgt von einer i.v. Infusion über 120 Minuten mit einer Infusionsgeschwindigkeit von 4 mg pro Minute (480 mg) oder Placebo (n = 8).
In einer ähnlich angelegten Studie erhielten Probanden mit einem medianen Alter von 57 Jahren unter der Behandlung mit Rivaroxaban 20 mg täglich Andexanet alfa (n = 26) als i.v. 800 mg-Bolusgabe, unmittelbar gefolgt von einer i.v. Infusion über 120 Minuten mit einer Infusionsgeschwindigkeit von 8 mg pro Minute (960 mg) oder Placebo (n = 13).
Reduktion der Anti-FXa-Aktivität
Primärer Endpunkt sowohl der Studie 14-503 (Apixaban) als auch der Studie 14-504 (Rivaroxaban) war die prozentuale Veränderung der Anti-FXa-Aktivität vom Ausgangswert (Baseline) bis zum Nadirwert nach der Infusion.
Bei den mit Apixaban behandelten Probanden in Studie 14-503 betrug die prozentuale Veränderung der Anti-FXa-Aktivität -92.34% (±2.809% in der Andexanet alfa-Gruppe gegenüber -32.70% (±5.578%) in der Placebogruppe (p <0.0001), wobei letztere die intrinsische Clearance des Antikoagulans widerspiegelt.
Bei den mit Rivaroxaban behandelten Probanden in Studie 14-504 betrug die prozentuale Veränderung der Anti-FXa-Aktivität -96.72% (±1.838%) in der Andexanet alfa-Gruppe gegenüber -44.75% (±11.749%) in der Placebogruppe (p <0.0001), wobei letztere die intrinsische Clearance des Antikoagulans widerspiegelt.
Die zeitlichen Verläufe der Anti-FXa-Aktivität vor und nach der Andexanet alfa-Gabe sind in Abbildung 1 dargestellt. Die Reduktion der Anti-FXa-Aktivität korreliert mit der Wiederherstellung der Thrombinbildung. Die Schwellenwerte der Anti-FXa-Aktivität für die Normalisierung der Thrombinbildung (definiert durch das mittlere endogene Thrombinpotenzial [ETP] und Standardabweichungen) wurden auf 44.2 ng/ml (innerhalb einer Standardabweichung des normalen ETP) geschätzt, basierend auf gepoolten Daten aus den Studien 14-503 und 14-504, wie in der Abbildung angegeben.
Abbildung 1: Veränderung der Anti-FXa-Aktivität (ng/ml) bei den mit Apixaban (A - Studie 14-503) und Rivaroxaban (B - Studie 14-504) antikoagulierten gesunden Probanden
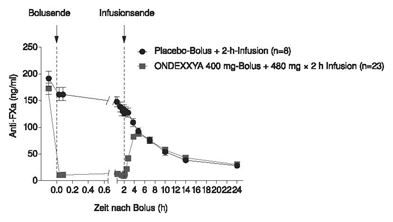
(A)

(B)
Wiederherstellung der Thrombinbildung
Sowohl in Studie 14-503 als auch in Studie 14-504 bewirkte die Behandlung mit Andexanet alfa bei den mit Apixaban bzw. Rivaroxaban antikoagulierten gesunden Probanden im Vergleich zu Placebo zudem eine statistisch signifikante (p <0.0001) Zunahme der Thrombinbildung. Bei alleiniger Bolusgabe bzw. bei Bolusgabe plus Infusion wurde bei den Probanden, die unter Behandlung mit Apixaban niedrig dosiertes Andexanet alfa erhielten, die Wiederherstellung der Thrombinbildung auf Werte innerhalb des Normalbereichs (definiert als eine Standardabweichung von den Ausgangswerten) innerhalb von zwei Minuten erreicht bzw. über 20 Stunden aufrechterhalten. Bei den Probanden unter Behandlung mit Rivaroxaban resultierte die hochdosierte Andexanet alfa-Gabe (Bolus plus Infusion) in einem Anstieg der Thrombinbildung, der über zwei Standardabweichungen lag. Bei den mit Apixaban behandelten Probanden wurde die hochdosierte Andexanet alfa-Gabe und bei den mit Rivaroxaban behandelten Probanden die niedrig dosierte Andexanet alfa-Gabe in diesen Studien klinisch nicht untersucht.
Veränderung der Konzentration an freiem FXa-Inhibitor zum Zeitpunkt des Nadirs gegenüber Baseline
Nach der Andexanet alfa-Bolusgabe betrugen die mittleren Konzentrationen an ungebundenem Apixaban und Rivaroxaban <3.5 ng/ml bzw. 4 ng/ml, und diese Spiegel wurden während der gesamten Dauerinfusion aufrechterhalten. Diese Konzentrationen an ungebundenem FXa-Inhibitor entfalten keine oder eine nur geringe antikoagulatorische Wirkung.
Aufhebung der FXa-Inhibitor-Antikoagulation bei Patienten mit akuter schwerer Blutung (Study 14-505 ANNEXA-4)
In einer multinationalen, prospektiven, einarmigen, unverblindeten Studie wurde Ondexxya bei 477 Patienten unter der Behandlung mit einem FXa-Inhibitor angewendet, die mit einer akuten schweren Blutung vorstellig wurden, von denen 419 Apixaban oder Rivaroxaban erhielten. Die co-primären Endpunkte waren: a) prozentuale Veränderung der Anti-FXa-Aktivität während der Behandlung von Baseline bis zum Nadir zwischen dem Ende der Bolusgabe und dem Infusionsende und b) Rate einer wirksamen Hämostase 12 Stunden nach der Infusion, beurteilt von einer unabhängigen Kommission (endpoint adjudication committee), die für die Anti-FXa-Aktivitätsspiegel verblindet war.
Insgesamt 431 Patienten (90%) waren 65 Jahre alt oder älter, und 315 Patienten (66%) waren älter als 75 Jahre.
Von den 477 Patienten, die Ondexxya erhielten, waren 347 Patienten im Hinblick auf die Wirksamkeit auswertbar, was definiert war als Patienten, die 1) eine Baseline-Anti-FXa-Aktivität von mindestens 75 ng/ml unter Behandlung mit Apixaban oder Rivaroxaban, mindestens 40 ng/ml unter Edoxaban oder mindestens 0.25 I.E./ml unter Enoxaparin aufwiesen und 2) die Eignungskriterien für akute schwere Blutungen erfüllten.
Die mediane (95%-Konfidenzintervall [KI]) Abnahme der Anti-FXA-Aktivität von Baseline bis zum Nadir betrug -93% (-94%, -92%) für Apixaban, und -94% (-95%; -93%) für Rivaroxaban.
Insgesamt 128 Patienten in der ANNEXA-4-Studie waren antikoaguliert und wiesen erhöhte Ausgangswerte der Anti-FXa-Aktivität auf (> 150 ng/ml für Apixaban und > 300 ng/ml für Rivaroxaban). Nach Verabreichung von Ondexxya kam es bei diesen Patienten zu einer Reduktion der Anti-FXa-Aktivität, die im Median 96% für Rivaroxaban und 92% für Apixaban betrug.
Von den 347 Patienten in der Wirksamkeitspopulation waren 340 laut der unabhängigen Kommission im Hinblick auf eine wirksame Hämostase auswertbar. Insgesamt war die hämostatische Wirksamkeit bei 80% der 340 Patienten, bei 79 % der 169 Patienten, die Apixaban erhielten, und bei 80 % der 127 Patienten, die Rivaroxaban erhielten, gut oder ausgezeichnet.
In der Studie ANNEXA-4 traten unter den 477 Patienten in der Sicherheitspopulation 81 (17%) Todesfälle auf. Es gab 41 Todesfälle kardiovaskulärer Ursache im Zusammenhang mit einer Blutung, 20 Todesfälle kardiovaskulärer Ursache ohne Zusammenhang mit einer Blutung, 15 Todesfälle nicht-kardiovaskulärer Ursache und 5 Todesfälle mit unklarer oder unbekannter Ursache. Die durchschnittliche Zeit bis zum Tod betrug 15 Tage nach der Behandlung. Von den 81 verstorbenen Patienten war die Blutungsart bei 60 (74%) eine intrakranielle Blutung, bei 15 (19%) eine gastrointestinale Blutung und bei 6 (7%) eine andere Blutungsart.
Studie 5 ANNEXA-I
ANNEXA-I war eine randomisierte, offene Phase-4-Studie mit verblindeter Feststellung der primären Wirksamkeits- und Sicherheitsendpunkte zur Bestimmung der Wirksamkeit und Sicherheit von Ondexxya im Vergleich zur üblichen Therapie bei Patienten mit akuter intrakranieller Blutung (ICH) mit einem Hämatomvolumen von ≥0,5 bis ≤60 ml innerhalb von 6 Stunden nach Symptombeginn gemäss Baseline-Scan und innerhalb von 15 Stunden nach Einnahme eines oralen FXa-Inhibitors.
Der primäre Endpunkt war die Beurteilung der Wirkung von Ondexxya vs. übliche Therapie auf die Rate einer wirksamen Hämostase, definiert als Veränderung des NIHSS-Scores gegenüber dem Ausgangswert von < 7 nach 12 Stunden UND ≤35% Zunahme des Hämatomvolumens gegenüber dem Ausgangswert in einem wiederholten CT- oder MRT-Scan nach 12 Stunden UND keine verabreichten Notfalltherapien zwischen 3 Stunden und 12 Stunden nach der Randomisierung. Der sekundäre Endpunkt war die prozentuale Veränderung der Anti-FXa-Aktivität vom Ausgangswert bis zum Nadir während der ersten 2 Stunden nach der Randomisierung.
In ANNEXA-I wurden in Frage kommende Patienten im Verhältnis 1:1 für Ondexxya oder die übliche Therapie randomisiert. Die primäre Wirksamkeitspopulation umfasst 452 Patienten, und die für Sicherheits- und Sensitivitätsanalysen verwendete erweiterte Population umfasst 530 Patienten. In der erweiterten Population betrugt das mediane Alter 80 Jahre; 53.8% der Patienten waren männlichen Geschlechts, und 94% der Patienten waren Weisse. Insgesamt 60.4% der Patienten hatten Apixaban erhalten, 29.1% hatten Rivaroxaban erhalten, und 10.0% hatten Edoxaban erhalten. Die häufigsten Indikationen für FXa-Inhibitoren waren Vorhofflimmern (84.7%), Prävention von venösen Thromboembolien (5.3%) und Behandlung von venösen Thromboembolien (4.7%). Die demografischen Merkmale und die Ausgangsmerkmale in der erweiterten Population entsprachen der primären Wirksamkeitspopulation und waren ausgewogen zwischen den Behandlungsgruppen.
In der Ondexxya-Gruppe erhielten die Patienten entweder eine niedrige oder eine hohe Dosis von Ondexxya in Abhängigkeit vom jeweiligen FXa-Inhibitor, der Dosis des FXa-Inhibitors und vom Zeitpunkt der letzten Einnahme des FXa-Inhibitors. Insgesamt 76.0% und 22.1% der Patienten in der Ondexxya-Gruppe erhielten die niedrig bzw. hoch dosierte Therapie. In der Gruppe mit der üblichen Therapie wurden 85.4% der Patienten mit PCC behandelt, 12.4% der Patienten erhielten keine hämostatische Behandlung (Thrombozyten oder Erythrozytenkonzentrate waren erlaubt), und 0.7% der Patienten wurden mit anderen Therapien behandelt.
Die häufigste Blutungsart war die intrazerebrale Blutung (92.2%), die meisten Blutungen waren spontan (87.7%), und das mediane Baseline-Hämatomvolumen betrug 9.9 ml.
Insgesamt 17 Patienten (6.5%) in der Ondexxya-Gruppe und 23 Patienten (8.7%) in der Gruppe mit üblicher Therapie hatten mindestens 1 invasiven intrakraniellen Eingriff. Der häufigste invasive intrakranielle Eingriff war in beiden Behandlungsgruppen eine Schädeltrepanation zur Implantation eines Ventrikelkatheters.
Hämostatische Wirksamkeit
In der primären Wirksamkeitspopulation war Ondexxya der üblichen Therapie überlegen in Bezug auf das Erreichen einer wirksamen Hämostase nach 12 Stunden bei Patienten mit akutem ICH unter Behandlung mit einem direkten oralen FXa-Inhibitor (67.0% vs. 53.1%, Unterschied 13.4% [95%-KI 4.6%, 22.2%], p=0.0032). Eine wirksame Hämostase wurde bei 70.0% vs. 56.3% der Patienten, die Apixaban eingenommen hatten, und bei 56.3% vs. 46.2% der Patienten, die Rivaroxaban eingenommen hatten, in der Ondexxya-Gruppe bzw. der Gruppe mit üblicher Therapie erreicht.
Der Behandlungseffekt war in allen vordefinierten Subgruppen auf der Basis von demografischen Merkmalen und wichtigen Ausgangsmerkmalen allgemein einheitlich.
Veränderung der Anti-FXa-Aktivität vom Ausgangswert bis zum Nadir
In der primären Wirksamkeitspopulation war Ondexxya der üblichen Therapie überlegen in Bezug auf die Reduktion der Anti-FXa-Aktivität von Baseline bis zum Nadir während der ersten 2 Stunden nach der Randomisierung bei Patienten mit akutem ICH unter Behandlung mit einem direkten oralen FXa-Inhibitor (-94.4% vs. -27.5% mediane Reduktion, p < 0.0001). Der mediane Nadir der Anti-FXa-Aktivität unter Behandlung betrug 5.1 ng/ml in der Ondexxya-Gruppe und 80.9 ng/ml in der Gruppe mit der üblichen Therapie. Die mediane Reduktion der Anti-FXa-Aktivität von Baseline bis zum Nadir betrug - 94.1% vs. -20.8% für Patienten, die Apixaban eingenommen hatten, und -96.4% vs. -46.8% für Rivaroxaban in der Ondexxya-Gruppe bzw. der Gruppe mit üblicher Therapie.
Mortalität
Die Anzahl der Patienten, die vor Tag 30 nach der Randomisierung verstarben, war insgesamt ausgewogen zwischen den Behandlungsgruppen: 74 Patienten (28.2%) in der Ondexxya-Gruppe und 70 Patienten (26.4%) in der Gruppe mit üblicher Therapie. Insgesamt 61 Patienten (23.3%) in der Ondexxya-Gruppe und 57 Patienten (21.5%) in der Gruppe mit üblicher Therapie verstarben im Krankenhaus. Blutungsbedingte Todesfälle innerhalb von 72 Stunden nach der Randomisierung wurden bei 14 Patienten (5.3%) in der Ondexxya-Gruppe und 19 Patienten (7.2%) in der Gruppe mit üblicher Therapie berichtet.
Immunogenität
345 mit Andexanet alfa behandelte gesunde Probanden wurden auf mit Andexanet alfa kreuzreagierende Antikörper sowie auf Antikörper gegen Faktor X und FXa untersucht. Unter der Behandlung aufgetretene Anti-Andexanet-alfa-Antikörper wurden bei etwa 10% (35/345) nachgewiesen. Diese Antikörper lagen generell in niedrigen Titern vor, und es wurden keine klinischen Folgen beobachtet. Das Auftreten von Anti-Andexanet-alfa-Antikörpern nach der Behandlung bei den Patienten in der Studie ANNEXA-4 (8.0% bzw. 25/314 Patienten) war vergleichbar mit dem bei gesunden Probanden beobachteten.
In der Studie 14-505 wurden keine neutralisierenden Antikörper gegen Andexanet alfa nachgewiesen. In der Studie 18-513 erwiesen sich 2 Patienten in der Andexanet-alfa-Gruppe an Tag 30 als positiv für Anti-Andexanet-alfa-Antikörper.
Es wurden weder neutralisierende Antikörper noch Antikörper gegen Faktor X oder FXa nachgewiesen.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Keine Daten vorhanden (siehe Rubrik «Dosierung/Anwendung» bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
|
