Eigenschaften/WirkungenATC-Code
L04AB04
Abrilada ist ein Biosimilar.
Bei Adalimumab handelt es sich um einen unter Einsatz einer rekombinanten DNA-Technologie in CHO-Zellen hergestellten humanen monoklonalen Antikörper. Er wurde unter Verwendung der sogenannten Phage-Display-Methode mit humanen schweren und leichten Ketten entwickelt. Dadurch entsteht ein Antikörper mit variablen Regionen der schweren und leichten Ketten ohne tierische Peptidsequenzen, die zur Spezifität für den humanen Tumor-Nekrose-Faktor (TNF) führen sowie mit humanen konstanten IgG1 (schwere Kette) und kappa (leichte Kette) Regionen. Adalimumab bindet mit einer hohen Affinität und Spezifität den löslichen Tumor-Nekrose-Faktor (TNF-α), jedoch nicht Lymphotoxin (TNF-β). Es besteht aus 1330 Aminosäuren und besitzt ein Molekulargewicht von etwa 148 Kilodalton.
Wirkungsmechanismus
Adalimumab bindet spezifisch den TNF und neutralisiert die biologische Funktion des TNF durch die Blockierung seiner Interaktion mit den p55- und p75-TNF-Rezeptoren auf der Zelloberfläche. Bei TNF handelt es sich um ein natürlich vorkommendes Zytokin, das für die normalen Entzündungs- und Immunantworten von Bedeutung ist. Bei Patienten mit rheumatoider Arthritis, Psoriasis-Arthritis oder ankylosierender Spondylitis (Morbus Bechterew) finden sich erhöhte TNF-Spiegel in der Synovialflüssigkeit, und diese spielen eine wichtige Rolle sowohl für die pathologische Entzündung als auch für die Gelenkdestruktion, beides Kennzeichen für eine rheumatoide Arthritis.
Adalimumab moduliert auch biologische Reaktionen, die durch den TNF induziert oder gesteuert werden, unter anderem Veränderungen bei den Spiegeln von Adhäsionsmolekülen, die für die Leukozytenmigration verantwortlich sind (ELAM-1, VCAM-1 sowie ICAM-1 mit einer IC50 von 1-2× 10-10 M).
Pharmakodynamik
Nach einer Behandlung mit Adalimumab wurde im Vergleich zu den Basis-Werten bei den Patienten mit rheumatoider Arthritis ein schneller Rückgang bei den Werten für die Reaktanten der akuten Phase einer Entzündung (C-reaktives Protein [CRP]), bei der Erythrozytensenkungsrate (ESR) sowie bei den Serumcytokinen (IL-6) beobachtet. Die Serumspiegel der Matrix-Metalloproteinasen (MMP-1 und MMP-3), die den Gewebeumbau herbeiführen, der für die Knorpeldestruktion verantwortlich ist, nahmen nach der Gabe von Adalimumab ebenfalls ab. Bei Patienten mit rheumatoider Arthritis, Psoriasis-Arthritis oder Ankylosierender Spondylitis (Morbus Bechterew) werden oft eine leichte bis mässige Anämie, reduzierte Lymphozytenzahlen sowie erhöhte Neutrophilen- und Thrombozytenzahlen festgestellt. Bei den mit Adalimumab behandelten Patienten zeigte sich im Allgemeinen eine Verbesserung bei diesen hämatologischen Anzeichen einer chronischen Entzündung.
Ein schneller Rückgang der CRP-Werte wurde auch bei Patienten mit Morbus Crohn, Colitis ulcerosa, polyartikulärer juveniler idiopathischer Arthritis und Hidradenitis suppurativa nach Behandlung mit Adalimumab beobachtet.
Bei Morbus Crohn-Patienten wurde auch eine Abnahme der Anzahl Entzündungsmarker exprimierenden Zellen im Kolon (nicht statistisch signifikant), einschliesslich einer signifikanten Reduktion der TNF-α Expression beobachtet.
Klinische Wirksamkeit
Rheumatoide Arthritis
Im Rahmen sämtlicher klinischer Studien zur rheumatoiden Arthritis wurde Adalimumab bei mehr als 3000 Patienten untersucht. Einige Patienten wurden über einen Zeitraum von mehr als 60 Monaten behandelt. Wirksamkeit und Verträglichkeit von Adalimumab für die Therapie von rheumatoider Arthritis wurden in fünf randomisierten, doppelblinden und gut kontrollierten Studien untersucht.
In Studie 1 evaluierte man 271 Patienten mit einer mässigen bis schweren aktiven rheumatoiden Arthritis, die ≥18 Jahre alt waren, bei denen die Therapie mit mindestens einem, aber mit nicht mehr als vier krankheitsmodifizierenden Antirheumatika versagt und bei denen Methotrexat in einer Dosierung von 12,5 bis 25 mg (10 mg bei Methotrexat-Intoleranz) jede Woche eine ungenügende Wirksamkeit gezeigt hatte, und deren Methotrexat-Dosis während der Studie bei 10 bis 25 mg jede Woche konstant blieb. Die Patienten hatten ≥6 geschwollene Gelenke und ≥9 druckschmerzhafte Gelenke. Die rheumatoide Arthritis hatte man nach den Kriterien des American College of Rheumatology (ACR) diagnostiziert. Über einen Zeitraum von 24 Wochen verabreichte man jede zweite Woche Dosen in Höhe von 20, 40 bzw. 80 mg Adalimumab oder ein Placebo.
Studie 2 evaluierte 544 Patienten mit einer mässigen bis schweren aktiven rheumatoiden Arthritis, die ≥18 Jahre alt waren und bei denen die Therapie mit mindestens einem krankheitsverändernden Antirheumatikum versagt hatte. Die Patienten hatten ≥10 geschwollene Gelenke und ≥12 druckschmerzhafte Gelenke und waren ebenfalls nach den ACR-Kriterien diagnostiziert worden. Über 26 Wochen wurden mittels subkutaner Injektion 20 bzw. 40 mg Adalimumab alle zwei Wochen abwechselnd mit einem Placebo in der darauffolgenden Woche bzw. in jeder Woche verabreicht. Das Placebo wurde jede Woche über den gleichen Zeitraum gegeben. Die Patienten erhielten keine Begleittherapie mit DMARDs.
In Studie 3 bewertete man 619 Patienten mit einer mässigen bis schweren aktiven rheumatoiden Arthritis, die ≥18 Jahre alt waren, bei denen Methotrexat in einer Dosierung von 12,5 bis 25 mg (10 mg bei Methotrexat-Intoleranz) jede Woche eine ungenügende Wirksamkeit gezeigt hatte und deren Methotrexat-Dosis während der Studie bei 12,5 bis 25 mg jede Woche konstant blieb. Anders als in Studie 1 war für die in der Studie 3 eingeschlossenen Patienten das Versagen einer Therapie mit einem krankheitsmodifizierenden Antirheumatikum (Methotrexat ausgenommen) nicht erforderlich. Die Patienten hatten ≥6 geschwollene Gelenke und ≥9 druckschmerzhafte Gelenke. Die rheumatoide Arthritis war nach den ACR-Kriterien diagnostiziert worden. In dieser Studie gab es drei Gruppen. Die Gruppe 1 erhielt über 52 Wochen in jeder Woche eine Injektion mit Placebo. Der zweiten Gruppe verabreichte man über den Zeitraum von 52 Wochen jede Woche 20 mg Adalimumab. Die dritte Gruppe bekam jede zweite Woche 40 mg Adalimumab abwechselnd mit Placebo-Injektionen in der darauffolgenden Woche. Im Anschluss wurden 457 Patienten in eine bis zu 5 Jahren andauernde offene Fortsetzungsperiode überführt und erhielten jede zweite Woche 40 mg Adalimumab.
Studie 4 bewertete 636 Patienten mit einer mässigen bis schweren aktiven rheumatoiden Arthritis, die ≥18 Jahre alt waren. Diese Patienten erfüllten die ACR-Kriterien für die Diagnose der rheumatoiden Arthritis seit mindestens drei Monaten und hatten ≥6 geschwollene Gelenke und ≥9 druckschmerzhafte Gelenke. Die Patienten waren entweder bisher nicht mit krankheitsmodifizierenden Antirheumatika behandelt oder konnten ihre bereits bestehende rheumatologische Behandlung unter der Voraussetzung fortsetzen, dass diese seit mindestens 28 Tagen stabil war. Die Patienten wurden für eine Behandlung in jeder zweiten Woche mit 40 mg Adalimumab bzw. Placebo über den Zeitraum von 24 Wochen randomisiert.
In Studie 5 bei früher rheumatoider Arthritis wurden 525 erwachsene (≥18 Jahre alt) Patienten mit mässiger bis schwerer, aktiver früher Erkrankung (Krankheitsdauer weniger als 3 Jahre) bewertet, welche Methotrexat naiv waren. In dieser Studie wurde die Wirksamkeit von der Adalimumab/Methotrexat Kombinationstherapie gegenüber Methotrexat Monotherapie verglichen in Bezug auf Reduzierung der Anzeichen, Symptome und Progressionsrate von Gelenkschädigung bei rheumatoider Arthritis beurteilt. Die Patienten wurden zu Adalimumab 40 mg/Methotrexat Kombinationstherapie alle zwei Wochen oder Methotrexat Monotherapie alle zwei Wochen randomisiert. Der Behandlungszeitraum betrug 104 Wochen.
Die Ergebnisse aller fünf Studien werden in der Prozentzahl der Patienten mit einer Besserung der rheumatoiden Arthritis unter Verwendung der ACR-Ansprechkriterien ausgedrückt. Als primärer Endpunkt in den Studien 1, 2 und 3 sowie als sekundärer Endpunkt in Studie 4 galt der Prozentsatz an Patienten, die in Woche 24 bzw. 26 eine ACR20-Ansprechrate erreichten. Der primäre Endpunkt in Studie 5 bei früher rheumatoider Arthritis war der Prozentsatz an Patienten, die in Woche 52 eine ACR50-Ansprechrate erreichten. Studien 3 und 5 hatten als zusätzlichen primären Endpunkt in Woche 52 eine Retardierung des Krankheitsverlaufes (festgestellt durch Röntgenuntersuchungen) einbezogen. In Studie 3 wurde ausserdem als primärer Endpunkt Veränderungen bei der Lebensqualität untersucht.
ACR-Ansprechrate
Der Prozentsatz der mit Adalimumab behandelten Patienten, welche ACR20-, ACR50- und ACR70-Ansprechraten erreichten, war konsistent über die Studien 1, 2, 3 und 4. Die Ergebnisse für 40 mg Adalimumab alle zwei Wochen sind in Tabelle 2 zusammengefasst.
Tabelle 2: ACR-Ansprechraten bei Placebo-kontrollierten Prüfungen (in Prozent der Patienten)
|
Ansprechrate
|
Studie 1a*
|
Studie 2a*
|
Studie 3a*
|
Studie 4
| |
|
Placebo/
MTXc
n=60
|
Adalimumabb/
MTXc
n=63
|
Placebo
n=110
|
Adalimumabb
n=113
|
Placebo/
MTXc
n=200
|
Adalimumabb/
MTXc
n=207
|
Standard
Behandlung/
Placebo
n=318
|
Standard
Behandlung/
Adalimumab
n=318
| |
ACR20
| |
6 Monate
|
13,3%
|
65,1%
|
19,1%
|
46,0%
|
29,5%
|
63,3%
|
34,9%
|
53,0%
| |
12 Monate
|
NA
|
NA
|
NA
|
NA
|
24,0%
|
58,9%
|
NA
|
NA
| |
ACR50
| |
6 Monate
|
6,7%
|
52,4%
|
8,2%
|
22,1%
|
9,5%
|
39,1%
|
11,1%
|
29,2%
| |
12 Monate
|
NA
|
NA
|
NA
|
NA
|
9,5%
|
41,5%
|
NA
|
NA
| |
ACR70
| |
6 Monate
|
3,3%
|
23,8%
|
1,8%
|
12,4%
|
2,5%
|
20,8%
|
3,2%
|
14,9%
| |
12 Monate
|
NA
|
NA
|
NA
|
NA
|
4,5%
|
23,2%
|
NA
|
NA
|
a Studie 1 nach 24 Wochen, Studie 2 nach 26 Wochen und Studie 3 nach 24 und 52 Wochen.
b 40 mg Adalimumab, jede zweite Woche verabreicht
c MTX = Methotrexat
* p<0,01, Adalimumab vs. Placebo
NA = Nicht zutreffend
Die Patienten, die im Rahmen der Studie 2 jede Woche 40 mg Adalimumab erhielten, erzielten nach sechs Monaten ebenfalls statistisch signifikante ACR20-, ACR50- und ACR70-Ansprechraten in Höhe von 53,4%, 35,0% bzw. 18,4%.
In den Studien 1-4 war bei allen individuellen Komponenten der ACR-Ansprechkriterien (Anzahl der druckschmerzempfindlichen und geschwollenen Gelenke, Einschätzung der Krankheitsaktivität und der Schmerzen durch den Arzt und den Patienten, Bewertung laut HAQ Disability Index sowie CRP-Werte [mg/dl]) im Vergleich mit Placebo nach 24 bzw. 26 Wochen eine Verbesserung zu verzeichnen. In der Studie 3 waren diese Verbesserungen auch über 52 Wochen anhaltend. Darüber hinaus hielten die ACR-Ansprechraten bei der Mehrzahl der Patienten, die an der offenen Fortsetzungsperiode teilnahmen, bis Woche 104 an. Die 2-Jahresergebnisse der Studie zeigen, dass bei 24% der mit Adalimumab behandelten Patienten eine klinische Wirkung, definiert als Erhaltung einer ACR70-Ansprechrate über die Dauer von 6 Monaten, erzielt werden konnte. Eine dauerhaft bis zu 5 Jahren anhaltende klinische Wirkung konnte während der nicht-kontrollierten Phase der Studie III gezeigt werden. Die bei Woche 52 beobachtete ACR Ansprechrate konnte aufrechterhalten werden, wenn Adalimumab ohne Unterbrechung über 5 Jahre verabreicht wurde, mit einer ACR20-Ansprechrate von 75,5% bei der Untergruppe von 220 nach 5 Jahren evaluierten Patienten. Die ACR70-Ansprechrate nach 5 Jahren lag bei 34,7%. Bei 25,7% der Patienten konnte die Dosis des gleichzeitig verabreichten Methotrexats und bei 29,9% derjenigen der Kortikosteroide ohne ein Nachlassen der klinischen Wirkung verringert werden.
Die folgende Abbildung 1 illustriert die Dauerhaftigkeit der in Studie 3 verzeichneten ACR20-Ansprechraten auf Adalimumab. Im Rahmen dieser Studie konnten 84,7% der Patienten, die die ACR20-Ansprechkriterien in Woche 24 erreicht hatten, diese bis in Woche 52 halten.
Abbildung 1: ACR20-Ansprechraten über 52 Wochen in Studie 3
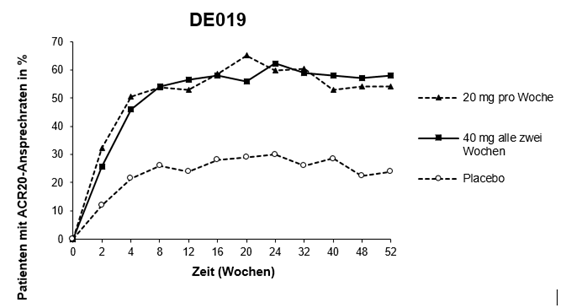
In der Studie 4 zeigten sich die ACR20-Ansprechraten bei den Patienten, die mit Adalimumab plus der Standardtherapie behandelt wurden, als statistisch signifikant besser als bei Patienten, die Placebo plus die Standardtherapie erhielten (p<0,001).
In allen vier Studien erreichten die mit Adalimumab behandelten Patienten die ACR20-, ACR50- und ACR70-Ansprechraten schneller und häufiger als die mit einem Placebo behandelten Patienten. In Studie 1 war ein statistisch signifikanter Unterschied bei den ACR20-Ansprechraten in Woche 1 (erste Untersuchung im Rahmen der Studie) zwischen den mit Adalimumab (26,0%) und den mit Placebo (5,0%) behandelten Patienten zu verzeichnen. Statistisch signifikante Unterschiede bei den ACR20-Ansprechraten wurden auch in den Studien 2, 3 und 4 in Woche 2 (erste Untersuchung im Rahmen der Studie) zwischen den mit Adalimumab (36,4%, 29,1% bzw. 33,7%) und den mit Placebo (7,3%, 13,0% bzw. 8,6%) behandelten Patienten beobachtet. Ein ähnliches Muster stellte man auch in allen vier Studien für die Zeit bis zum Erreichen der ersten ACR50- bzw. ACR70-Ansprache fest.
Für einige Patienten, die nicht gleichzeitig Methotrexat nehmen, könnte eine Erhöhung der Dosierungsfrequenz von Adalimumab auf 40 mg pro Woche einen zusätzlichen Nutzen bringen. Das hat sich im Rahmen einer offenen Langzeitstudie bestätigt, in der man für die Patienten, die nur unvollständig auf das Arzneimittel ansprachen, die Dosisfrequenz von 40 mg jede zweite Woche auf 40 mg pro Woche erhöhte.
In Studie 5 führte die Kombinationstherapie von Adalimumab und Methotrexat bei Patienten mit früher rheumatoider Arthritis, die Methotrexat naiv waren, zu rascher einsetzenden und signifikant höheren ACR-Ansprechraten in Woche 52 als Methotrexat Monotherapie, wobei die Ansprechraten bis Woche 104 aufrechterhalten blieben (siehe Tabelle 3).
Tabelle 3: ACR-Ansprechrate in Studie 5 (in Prozent der Anzahl der Patienten)
|
Ansprechrate*
|
MTX
n=257
|
Adalimumab/MTX
n=268
| |
ACR20
| |
Woche 52
|
62,6%
|
72,8%
| |
Woche 104
|
56,0%
|
69,4%
| |
ACR50
| |
Woche 52
|
45,9%
|
61,6%
| |
Woche 104
|
42,8%
|
59,0%
| |
ACR70
| |
Woche 52
|
27,2%
|
45,5%
| |
Woche 104
|
28,4%
|
46,6%
|
* p<0,05, Adalimumab/Methotrexat versus Methotrexat für ACR20
* p<0,001, Adalimumab/Methotrexat versus Methotrexat für ACR50 und 70
Alle einzelnen Kriterien der ACR-Ansprechrate zeigten unter der Adalimumab/Methotrexat Therapie eine Verbesserung in Woche 52, die bis Woche 104 aufrechterhalten blieb. Im Verlauf der Zweijahres-Studie erreichten 48,5% der Patienten, welche Adalimumab/Methotrexat Kombinationstherapie erhielten, eine bedeutende klinische Ansprechrate (ACR70 für sechs Monate) im Vergleich zu 27,2% der Patienten, welche Methotrexat Monotherapie erhielten (p<0,001).
Tabelle 4: DAS28 Ansprechraten in Studie 5 bei früher rheumatoider Arthritis
|
DAS28 Ansprechen
|
MTX
n=257
|
Adalimumab/MTX
n=268
| |
Mittlere Abweichung von Baseline
| |
Baseline (Mittelwert)
|
6,3
|
6,3
| |
Woche 52 (Mittelwert ± SD)
|
-2,8 ± 1,4
|
-3,6 ± 1,3*
| |
Woche 104 (Mittelwert ± SD)
|
-3,1 ± 1,4
|
-3,8 ± 1,3*
| |
Remission (DAS28<2,6)
| |
Woche 52 (Prozent von Anzahl Patienten)
|
20,6%
|
42,9%*
|
* p<0,001, Adalimumab/Methotrexat versus Methotrexat
Radiologisches Ansprechen
In Studie 3, in der bei den mit Adalimumab behandelten Patienten die mittlere Dauer der Erkrankung an rheumatoider Arthritis etwa 11 Jahre betrug, wurde der strukturelle Gelenkschaden radiologisch bewertet und als Veränderung im modifizierten Sharp-Gesamtscore (TSS) und seiner Komponenten, dem Erosions-Score und dem joint space narrowing score = JSN (Score, der die Verengung des Gelenkraums bewertet) ausgedrückt. Ein statistisch signifikanter Unterschied hinsichtlich einer Veränderung im modifizierten Sharp-Gesamtscore sowie beim Erosions-Score wurde nach 6 Monaten beobachtet und blieb bis zu Monat 12 erhalten. Nach 52 Wochen zeigten die mit Adalimumab/Methotrexat behandelten Patienten weniger radiologische Veränderungen als Patienten, die nur Methotrexat erhalten hatten. Diese Wirkung im Sinne einer Verlangsamung der Progression struktureller Schäden konnte über 5 Jahre aufrechterhalten werden.
Von den ursprünglich mit 40 mg Adalimumab alle 2 Wochen behandelten Patienten wurden 55% nach 5 Jahren radiologisch untersucht. Die Verlangsamung der Progression struktureller Schäden konnte aufrechterhalten werden, und bei 50% dieser verbleibenden Patienten konnte das Fortschreiten der strukturellen Schädigung ganz aufgehalten werden, wie sich durch eine Veränderung im TSS von null oder weniger feststellen liess. Patienten, die während der Doppelblindphase der Studie mit Methotrexat behandelt worden waren, zeigten minimale Progression struktureller Schädigung, wenn sie während des offenen Teils der Studie mit Adalimumab behandelt wurden.
Tabelle 5: Radiologische Veränderung über 12 Monate in Studie 3 mit Hintergrundbehandlung Methotrexat
|
|
Placebo
n=200
|
Adalimumaba
n=207
|
Unterschied zwischen
Adalimumaba und Placebo
|
p-Wert
| |
Veränderung beim modifizierten Sharp-Gesamtscore (Mittel)
|
2,7
|
0,1
|
-2,6
|
=0,001b
| |
Veränderung bei Erosionen (Mittel)
|
1,6
|
0,0
|
-1,6
|
=0,001
| |
Keine neuen Erosionen (% der Patienten)
|
46,2
|
62,9
|
16,7
|
=0,001
| |
Veränderung beim JSN-Score (Mittel)
|
1,0
|
0,1
|
-0,9
|
=0,002
|
a 40 mg, verabreicht jede zweite Woche
b auf Grundlage der mittleren Werte, gemessen anhand des TSS
In Studie 5 bei früher rheumatoider Arthritis hatten die mit Adalimumab behandelten Patienten eine mittlere Krankheitsdauer der rheumatoiden Arthritis von weniger als 9 Monaten und hatten zuvor kein Methotrexat erhalten. Strukturelle Gelenkschädigung wurde radiologisch ermittelt und als Änderung im modifizierten Total Sharp Score ausgedrückt. Die Resultate nach Woche 52 sind in Tabelle 6 ersichtlich. Eine statistisch signifikante Änderung bezüglich modifiziertem Total Sharp Score und Erosionsscore wurde in Woche 52 beobachtet und blieb bis Woche 104 aufrechterhalten.
Tabelle 6: Radiologische mittlere Abweichungen in Woche 52 in Studie 5
|
|
MTX n=257
95% CI
|
Adalimumab/MTX
n=268
95% CI
|
p-Wert*
| |
Total Sharp Score
|
5,7 (4,2-7,3)
|
1,3 (0,5-2,1)
|
<0,001
| |
Erosion Score
|
3,7 (2,7-4,7)
|
0,8 (0,4-1,2)
|
<0,001
| |
JSN Score
|
2,0 (1,2-2,8)
|
0,5 (0-0,1)
|
<0,001
|
* Vergleich zwischen Adalimumab/Methotrexat und Methotrexat mittels Mann-Whitney U test
Der prozentuelle Anteil von Patienten ohne Progression (Zunahme gegenüber Baseline im modifizierten Total Sharp Score ≤0,5) war signifikant höher unter Adalimumab/Methotrexat Kombinationstherapie im Vergleich zu Methotrexat Monotherapie in Woche 52 (63,8% respektive 37,4%, p<0,001) und in Woche 104 (61,2% respektive 33,5%, p<0,001).
Im Rahmen der offenen Fortsetzungsperiode der Studie 3 wurden 77% der ursprünglich mit Adalimumab behandelten Patienten nach 2 Jahren radiologisch bewertet. Die Hemmung des Fortschreitens der strukturellen Schädigung hielt an. 54% der untersuchten Patienten zeigten keine Progression der strukturellen Schädigung entsprechend einer TSS Änderung von 0 oder weniger.
Lebensqualität und körperliche Funktionsfähigkeit
Für die Bewertung der Lebensqualität in Bezug auf den Gesundheitszustand, die in Studie 3 einen vorgeschriebenen Endpunkt nach 52 Wochen darstellte, verwendete man in allen vier adäquaten und gut kontrollierten Prüfungen den im Health Assessment Questionnaire (HAQ = Fragebogen zur Bewertung des Gesundheitszustandes) enthaltenen Behinderungsindex. In allen vier Studien zeigten sich für sämtliche Dosierungen/Therapiepläne von Adalimumab im Vergleich mit Placebo statistisch signifikante, stärkere Verbesserungen beim HAQ Disability Index von den Baseline-Werten bis Monat 6. In Studie 3 belief sich die mittlere Verbesserung (CI) des HAQ zwischen Baseline und Woche 52 auf -0,60 (-0,65, -0,55) bei mit Adalimumab/Methotrexat behandelten Patienten und auf -0,25 (-0,33, -0,17) bei mit Plazebo/Methotrexat behandelten Patienten (p<0,001). Bei 82% der mit Adalimumab/Methotrexat behandelten Patienten, bei denen in Woche 52 eine Verbesserung des HAQ von 0,5 oder mehr erzielt werden konnte, blieb diese Verbesserung bis Monat 60 der offenen Fortsetzungsperiode aufrechterhalten.
In Studie 5, der kontrollierten Studie bei früher rheumatoider Arthritis im Vergleich zu Methotrexat, war die Verbesserung im HAQ Disability Index und der physischen Komponente des SF-36 in Woche 52 grösser (p<0,001) unter Adalimumab/Methotrexat Kombinationstherapie als unter Methotrexat Monotherapie und blieb bis Woche 104 aufrechterhalten.
Ausserdem wurde die allgemeine Lebensqualität bezogen auf den Gesundheitszustand in allen vier adäquaten und gut kontrollierten Prüfungen mit Hilfe des Short Form Health Survey (SF-36 = Analyse des Gesundheitszustandes in Kurzform) bewertet. In allen vier Studien zeigten sich für sämtliche Dosierungen/Injektionsfrequenzen von Adalimumab im Vergleich mit Placebo statistisch signifikante, stärkere Verbesserungen bei den summarischen Scores für die physischen Komponenten des SF-36 von den Baseline-Werten bis Monat 6, die in Studie 3 bis zur Woche 52 aufrechterhalten werden konnten. Die summarischen Scores für die mentalen Komponenten des SF-36 in den Studien 2 und 4 lagen ebenfalls, verglichen mit Placebo, im Monat 6 für Adalimumab statistisch signifikant höher. Die auf Schmerzen und Vitalität bezogenen Scores des SF-36 wiesen in allen vier Studien für die Dosierung 40 mg Adalimumab jede zweite Woche im Vergleich mit dem Placebo eine statistisch signifikant stärkere Verbesserung von der Baseline auf Monat 6 aus. Diese Ergebnisse wurden durch die im Rahmen der Functional Assessment of Chronic Illness Therapy (FACIT = funktionelle Bewertung der Therapie von chronischen Erkrankungen) ermittelten Scores gestützt, nach denen sich für alle drei analysierten Studien eine statistisch signifikante Abnahme der Ermüdung in Monat 6 zeigte, die in Studie 3 bis zur Woche 52 aufrechterhalten werden konnte. SF-36 wurde bis zur Woche 156 (3 Jahre) gemessen, und die Verbesserung blieb bei den in der Studie verbleibenden Patienten über diesen Zeitraum erhalten.
Polyartikuläre juvenile idiopathische Arthritis (pJIA)
Die Sicherheit und Wirksamkeit von Adalimumab wurden in einer multizentrischen, randomisierten, doppelblinden Parallel-Gruppenstudie an 171 Kindern (im Alter zwischen 4 bis 17 Jahren) mit polyartikulärer JIA untersucht. Die Analyse erfolgte in den zwei Strata mit Methotrexat (MTX)-behandelten und nicht-MTX-behandelten Patienten. Die Patienten erhielten stabile Dosen von NSAR und/oder Prednison (≤0,2 mg/kg/Tag oder maximal 10 mg/Tag). In der offenen Einleitungsphase («open-label lead-in», OL LI) erhielten alle Patienten 16 Wochen lang jede zweite Woche 24 mg/m2 bis zu einer Maximaldosis von 40 mg Adalimumab. Die Patientenverteilung ist in Tabelle 7 dargestellt.
Tabelle 7: Patientenverteilung nach Alter und verabreichter Adalimumab-Dosis während der OL-LI-Phase
|
Altersgruppe
|
Patientenanzahl zu Studienbeginn
n (%)
|
Minimale, mittlere und maximale Dosis
| |
4 bis 7 Jahre
|
31 (18,1)
|
10, 20 und 25 mg
| |
8 bis 12 Jahre
|
71 (41,5)
|
20, 25 und 40 mg
| |
13 bis 17 Jahre
|
69 (40,4)
|
25, 40 und 40 mg
|
Die Patienten mit einem pädiatrischen ACR-30-Ansprechen in Woche 16 wurden in der doppelblinden (DB-)Studienphase randomisiert und erhielten alle 2 Wochen entweder Adalimumab (24 mg/m2 bis zu einer maximalen Einzeldosis von 40 mg) oder Placebo über maximal 32 Wochen oder bis zu einem Wiederaufflammen der Erkrankung. Die Kriterien für ein Wiederaufflammen der Erkrankung waren definiert als eine Verschlechterung von ≥30% im Vergleich zu Studienbeginn bei ≥3 von 6 pädiatrischen ACR-Core-Kriterien, ≥2 aktive Gelenke und eine Verbesserung von >30% in nicht mehr als einem der 6 Kriterien. Nach 32 Wochen oder bei Wiederaufflammen der Erkrankung waren die Patienten für die Überführung in die offene Fortsetzungsphase («Open-label extension», OLE) geeignet.
In der OL LI Phase erreichten 94,1% (80 von 85) der Patienten unter Kombinationstherapie von Adalimumab und MTX und 74,4% (64 von 86) der Patienten unter Adalimumab Monotherapie ein ACR-30-Ansprechen in Woche 16. Die Ergebnisse der doppelblinden Periode sind in Tabelle 8 dargestellt.
Tabelle 8: Pädiatrisches ACR30-Ansprechen in der JIA Studie
Ergebnisse zur Wirksamkeit
|
Doppelblind 32 Wochen
|
Adalimumab/MTX
(n=38)
|
Placebo/MTX
(n=37)
|
Adalimumab
(n=30)
|
Placebo
(n=28)
| |
Wiederaufflammen der Erkrankung nach 32 Wochena (n/N)
|
36,8% (14/38)
|
64,9% (24/37)b
|
43,3% (13/30)
|
71,4% (20/28)c
| |
Mittlere Zeit bis zum Wiederaufflammen der Erkrankung
|
>32 Wochen
|
20 Wochen
|
>32 Wochen
|
14 Wochen
|
a pädiatrisches ACR-30/50/70-Ansprechen in Woche 48 war signifikant grösser als bei mit Placebo behandelten Patienten
b p=0,015
c p=0,031
Unter den Patienten, die in Woche 16 (n = 144) ansprachen, wurde das pädiatrische ACR-30/50/70/90-Ansprechen für bis zu sechs Jahre in der OLE-Phase bei denjenigen aufrechterhalten, die Adalimumab während der ganzen Studie über erhielten. Insgesamt wurden 19 Patienten (11 zu Studienbeginn in der Altersgruppe von 4 bis 12 Jahren und 8 zu Studienbeginn in der Altersgruppe von 13 bis 17 Jahren) 6 Jahre oder länger behandelt.
Das Gesamtansprechen bei der Kombinationstherapie von Adalimumab und MTX war besser, und weniger Patienten entwickelten Antikörper im Vergleich zur Adalimumab-Monotherapie. Unter Berücksichtigung dieser Ergebnisse wird der Einsatz von Adalimumab in Kombination mit MTX empfohlen. Nur bei Patienten, bei denen der MTX-Einsatz nicht geeignet ist, wird eine Monotherapie mit Adalimumab empfohlen (siehe «Dosierung/Anwendung»).
Psoriasis-Arthritis
Die Wirksamkeit von Adalimumab wurde bei 413 Patienten untersucht. In der Hauptstudie wurden 313 erwachsene Patienten mit mässiger bis schwerer Psoriasis-Arthritis behandelt, die nur unzureichend auf nicht-steroidale anti-inflammatorische Therapie angesprochen hatten. 158 (50,5%) der behandelten Patienten nahmen zum Zeitpunkt der Randomisierung Methotrexat. Adalimumab wurde als 40 mg Dosis alle 2 Wochen über einen Zeitraum von 24 Wochen verabreicht. Nach Beenden der Studien wurden 383 Patienten in eine offene Fortsetzungssperiode eingeschlossen, in welcher Adalimumab jede zweite Woche verabreicht wurde. 382 der eingeschlossenen Patienten wurden zumindest anfänglich in dieser Fortsetzungsstudie mit Adalimumab behandelt. Bezüglich der nach 48 und 144 Wochen evaluierbaren Patienten, siehe weiter unten.
ACR und PASI Ansprechrate
In Tabelle 9 ist ersichtlich, dass Adalimumab gegenüber Placebo in allen gemessenen Parametern des Krankheitsverlaufes überlegen war (p<0,001). Bei den Patienten mit Psoriasis-Arthritis, welche Adalimumab erhielten, zeigte sich die klinische Wirkung zum Zeitpunkt der ersten Kontrolle (2 Wochen); sie war nach 12 Wochen signifikant und wurde während der 24 Behandlungswochen aufrechterhalten.
Patienten, bei denen mindestens 3% der Körperoberfläche von Psoriasis betroffen waren, wurden nach Psoriatic Area and Severity Index (PASI) beurteilt. Nach PASI gemessen, verbesserten sich bei diesen Patienten die Psoriasis-bedingten Hautläsionen im Vergleich zu Placebo.
Die Ansprechrate war mit und ohne Methotrexat vergleichbar.
Die ACR Ansprechraten blieben in der offenen Fortsetzungsperiode bis 136 Wochen aufrechterhalten.
Tabelle 9: ACR und PASI Ansprechrate in einer Placebo-kontrollierten Studie bei Patienten mit Psoriasis-Arthritis (in Prozent der Anzahl der Patienten)
|
Ansprechrate*
|
Placebo
|
Adalimumab
| |
|
N=162
|
N=151
| |
ACR20
| |
Woche 12
|
14%
|
58%
| |
Woche 24
|
15%
|
57%
| |
ACR50
| |
Woche 12
|
4%
|
36%
| |
Woche 24
|
6%
|
39%
| |
ACR70
| |
Woche 12
|
1%
|
20%
| |
Woche 24
|
1%
|
23%
| |
|
N=69
|
N=69
| |
PASI50
| |
Woche 12
|
15%
|
72%
| |
Woche 24
|
12%
|
75%
| |
PASI75
| |
Woche 12
|
4%
|
49%
| |
Woche 24
|
1%
|
59%
|
* p<0,001 für alle Vergleiche von Adalimumab und Placebo
In den Studien zu Psoriasis-Arthritis wurden die radiologischen Veränderungen beurteilt. Röntgenaufnahmen der Hände, Handgelenke und Füsse wurden zu Studienbeginn (Baseline) und in Woche 24 der Doppelblind-Studienperiode aufgenommen, in welcher die Patienten entweder Adalimumab oder Placebo erhielten, sowie in Woche 48, in welcher alle Patienten Adalimumab erhielten. Ein modifizierter Sharp-Gesamtscore (mTSS), welcher distale Interphalangealgelenke einschloss (nicht identisch mit dem Sharp-Gesamtscore für rheumatoide Arthritis), wurde verwendet.
Verglichen mit Placebo reduzierte Adalimumab die Progressionsrate von peripheren Gelenkschäden. Im modifizierten Sharp-Gesamtscore wurde eine Veränderung vom Basiswert von 0,8 ± 2,5 (Mittelwert ± SD) in der Placebogruppe (in Woche 24) im Vergleich zu 0,0 ± 1,9 in der Adalimumab-Gruppe (in Woche 48, n = 133); p<0,001) festgestellt.
84% der Patienten, welche mit Adalimumab behandelt wurden und zwischen Baseline und Woche 48 keine radiologische Progression zeigten (n=102), zeigten auch keine radiologische Progression bis Woche 144.
Mittels HAQ Disability Index und Short Form Health Survey (SF-36) bewertet, zeigten die mit Adalimumab behandelten Patienten eine statistisch signifikante Verbesserung der körperlichen Funktionsfähigkeit in Woche 24 im Vergleich zu Patienten, die mit Placebo behandelt wurden.
Die Verbesserung der körperlichen Funktionsfähigkeit blieb in der offenen Fortsetzungsperiode der Studie bis Woche 136 aufrechterhalten.
Morbus Crohn
Sicherheit und Wirksamkeit einer Mehrfachdosis Adalimumab wurden bei mehr als 1500 Patienten mit einer mässigen bis schweren aktiven Crohnschen Erkrankung (Aktivitätsindex des Morbus Crohn [CDAI = Crohn's Disease Activity Index] ≥220 und ≤450) im Rahmen von randomisierten, doppelblinden und placebo-kontrollierten Studien untersucht. Die gleichzeitige Gabe von Aminosalicylaten, Corticosteroiden bzw. immunomodulatorischen Mitteln in gleichbleibenden Dosen war erlaubt, und 80% der Patienten bekamen mindestens eines dieser Arzneimittel verabreicht.
In zwei Studien (CLASSIC I und GAIN) hat man die Einleitung der klinischen Remission (definiert als CDAI <150) bewertet. In der CLASSIC I-Studie wurden 299 TNF-Antagonist-naive Patienten auf vier Behandlungsgruppen randomisiert; die Placebo-Gruppe erhielt Placebo in den Wochen 0 und 2, die 160/80-Gruppe bekam 160 mg Adalimumab in Woche 0 und 80 mg in Woche 2, die 80/40-Gruppe behandelte man mit 80 mg in Woche 0 und 40 mg in Woche 2 und die 40/20-Gruppe mit 40 mg in Woche 0 und mit 20 mg in Woche 2. In der GAIN-Studie wurden 325 Patienten, die nicht mehr auf Infliximab ansprachen bzw. dieses nicht vertrugen, randomisiert und erhielten entweder 160 mg Adalimumab in Woche 0 und 80 mg in Woche 2 oder Placebo in den Wochen 0 und 2.
Die Aufrechterhaltung der klinischen Remission wurde in der CHARM-Studie bewertet. In dieser Studie erhielten 854 Patienten offen 80 mg Adalimumab in Woche 0 und 40 mg Adalimumab in Woche 2. In Woche 4 randomisierte man die Patienten und sie erhielten entweder 40 mg Adalimumab jede zweite Woche, 40 mg Adalimumab jede Woche, oder Placebo. Insgesamt dauerte die Studie 56 Wochen. Patienten mit einer klinischen Reaktion (Abnahme bei CDAI ≥70) in Woche 4 wurden (getrennt von denen, die in Woche 4 keine klinische Reaktion zeigten) stratifiziert und analysiert. Nach Woche 8 war ein Corticosteroid-Taper erlaubt.
Klinische Ergebnisse
Im Vergleich mit Placebo erreichte, ungeachtet der Tatsache, ob die Patienten TNF-Antagonist-naiv waren oder bereits vorher Infliximab ausgesetzt gewesen waren, in den Studien CLASSIC I und GAIN ein statistisch signifikant höherer Prozentsatz der mit 160/80 mg Adalimumab behandelten Gruppen die Einleitung einer klinischen Remission in Woche 4 (siehe Tabelle 10).
Tabelle 10: Einleitung einer klinischen Remission und Reaktion (in Prozent der Patienten)
|
|
CLASSIC I: Infliximab-naive Patienten
|
GAIN: Infliximab-erfahrene Patienten
| |
Placebo
N=74
|
Adalimumab
160/80 mg
N=76
|
Placebo
N=166
|
Adalimumab
160/80 mg
N=159
| |
Woche 4
| |
Klinische Remission
|
12%
|
36%*
|
7%
|
21%*
| |
Klinische Reaktion
(CR-100)
|
24%
|
50%**
|
25%
|
38%**
| |
Klinische Reaktion
(CR-70)
|
34%
|
58%**
|
34%
|
52%**
|
Alle p-Werte sind paarweise Vergleiche von Anteilen für Adalimumab vs. Placebo.
* p<0,001
** p<0,01
In der CHARM-Studie zeigten 58% (499/854) der Patienten in Woche 4 eine klinische Reaktion und wurden in der Primäranalyse bewertet. 48% der Patienten mit einer klinischen Reaktion in Woche 4 sind bereits vorher einer anderen Anti-TNF-Therapie ausgesetzt gewesen. In den Wochen 26 und 56 erreichte in den Adalimumab-Erhaltungstherapiegruppen im Vergleich mit den Patienten in der Placebo-Erhaltungstherapiegruppe ein statistisch signifikant höherer Anteil der Patienten mit einer klinischen Reaktion in Woche 4 eine klinische Remission. Ausserdem zeigte in den Adalimumab-Erhaltungstherapiegruppen, verglichen mit den Patienten in der Placebo-Erhaltungstherapiegruppe, ein statistisch signifikant höherer Anteil der Patienten, die man an der Baseline gleichzeitig mit Corticosteroiden behandelt hatte, in den Wochen 26 und 56 eine klinische Remission und war in der Lage, die Anwendung von Corticosteroiden mindestens 90 Tage lang abzusetzen (siehe Tabelle 11).
In einer Posthoc-Analyse waren krankheitsbezogene Hospitalisationen und intra-abdominale Operationen in der doppelblinden Studien-Phase unter Adalimumab verglichen mit Placebo statistisch signifikant vermindert.
Tabelle 11: Erhaltung der klinischen Remission und Reaktion (in Prozent der Patienten)
|
|
Placebo
|
40 mg Adalimumab
jede zweite Woche
|
40 mg Adalimumab
jede Woche
| |
Woche 26
|
N=170
|
N=172
|
N=157
| |
Klinische Remission
|
17%
|
40%*
|
47%*
| |
Klinische Reaktion
(CR-100)
|
27%
|
52%*
|
52%*
| |
Klinische Reaktion
(CR-70)
|
28%
|
54%*
|
56%*
| |
Patienten mit steroidfreier Remission
für ≥90 Tage a
|
3% (2/66)
|
19% (11/58)**
|
15% (11/74)**
| |
Woche 56
|
N=170
|
N=172
|
N=157
| |
Klinische Remission
|
12%
|
36%*
|
41%*
| |
Klinische Reaktion
(CR-100)
|
17%
|
41%*
|
48%*
| |
Klinische Reaktion
(CR-70)
|
18%
|
43%*
|
49%*
| |
Patienten mit steroidfreier Remission
für ≥90 Tagea
|
5% (3/66)
|
29% (17/58)*
|
20% (15/74)**
|
* p<0,001 für Adalimumab vs. Placebo (paarweiser Vergleich der Anteile)
** p<0,002 für Adalimumab vs. Placebo (paarweiser Vergleich der Anteile)
a Von denen, die an der Baseline Corticosteroide erhielten
Die in Tabelle 11 dargestellten Ergebnisse für die klinische Remission blieben, ungeachtet einer vorherigen Exposition gegen TNF-Antagonisten, relativ konstant.
Von den Patienten, die in Woche 4 eine Reaktion zeigten und im Studienverlauf eine Remission erreichten, konnten die Patienten in den Adalimumab-Erhaltungstherapiegruppen diese Remission über einen signifikant längeren Zeitraum aufrechterhalten als die Patienten in der Placebo-Erhaltungstherapiegruppe (siehe Abbildung 2).
Abbildung 2: Tage mit klinischer Remission bei Patienten, die in der CHARM-Studie eine klinische Remission erreichten (Intent-to-Treat-Population)
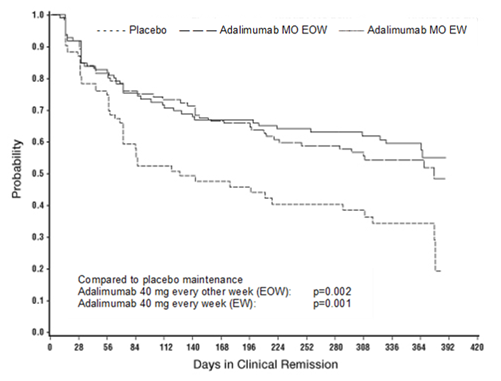
Von den Patienten, die in Woche 4 keine Reaktion zeigten, wurde eine Reaktion bei 43% der Patienten in den Adalimumab-Erhaltungstherapiegruppen bis zur Woche 12 beobachtet, verglichen mit einer Quote von 30% der Patienten in der Placebo-Erhaltungstherapiegruppe. Diese Ergebnisse lassen darauf schliessen, dass eine fortgeführte Erhaltungstherapie bis zur Woche 12 für einige Patienten, die bis zur Woche 4 keine Reaktion gezeigt hatten, von Nutzen sein kann. Eine Fortsetzung der Therapie über 12 Wochen hinaus führte nicht zu signifikant mehr Reaktionen (siehe «Dosierung/Anwendung»).
117/276 Patienten aus der Studie CLASSIC I und 272/777 Patienten aus den Studien GAIN und CHARM wurden mindestens 3 Jahre in einer offenen Verlängerungs-Studie mit Adalimumab weiterbehandelt. 88 bzw. 189 Patienten blieben nach 3 Jahren weiterhin in klinischer Remission. Die klinische Ansprechrate (CR-100) wurde bei 102 bzw. 233 Patienten erhalten.
135 Patienten wurden in der randomisierten, placebo-kontrollierten endoskopischen Studie M05-769 (EXTEND-Studie), mit Abheilung der Schleimhaut (definiert als Verschwinden von mukosalen Ulzerationen) als primärem Endpunkt, untersucht. Nach einer 4-wöchigen Adalimumab-Induktions-Phase wurden die Patienten randomisiert. In Woche 12 zeigten 27,4% der mit Adalimumab behandelten Patienten eine Abheilung der Schleimhaut verglichen mit 13,1% der mit Placebo behandelten Patienten (p=0,056), in Woche 52 zeigten 24,2% der mit Adalimumab behandelten Patienten eine Abheilung der Schleimhaut verglichen mit 0% der mit Placebo behandelten Patienten (p<0,001).
Ergebnisse aus der Patientenperspektive/Patient-Reported Outcomes
In den Studien CLASSIC I und GAIN wurde im Vergleich mit Placebo eine statistisch signifikante Verbesserung des aufgrund des krankheitsspezifischen «Fragebogens zur entzündlichen Darmerkrankung» (inflammatory bowel disease questionnaire = IBDQ) ermittelten Gesamtscores in Woche 4 bei Patienten erreicht, die für eine Behandlung mit Adalimumab 160/80 mg randomisiert wurden. Verglichen mit der Placebo-Gruppe hat man in der CHARM-Studie in den mit Adalimumab behandelten Gruppen eine statistisch signifikante Verbesserung beim IBDQ-Gesamtscore gegenüber dem Baseline-Wert in den Wochen 26 und 56 beobachtet.
Lebensqualität und körperliche Funktionsfähigkeit
Gesundheitsbezogene Lebensqualität und körperliche Funktionsfähigkeit wurden in der Studie zur Psoriasis-Arthritis anhand des Health Assessment Questionnaire (HAQ) beurteilt. Die mit Adalimumab behandelten Patienten zeigten im Vergleich zu Patienten, die mit Placebo behandelt wurden, statistisch signifikant stärkere Verbesserungen beim HAQ Disability Index zwischen den Baseline-Werten und Woche 24.
Die Resultate des Short Form Health Survey (SF-36) bekräftigen diese Ergebnisse mit statistisch signifikantem Physical Component Summary (PCS) Score sowie statistisch signifikanten Pain and Vitality Domain Scores.
Morbus Crohn bei Kindern und Jugendlichen
Sicherheit und Wirksamkeit wurden in einer randomisierten, doppelblinden Studie an 192 Kindern und Jugendlichen im Alter zwischen 6 und einschliesslich 17 Jahren mit mässigem bis schwerem Morbus Crohn (MC), definiert als pädiatrischer Morbus-Crohn-Aktivitätsindex (PCDAI)-Score >30, untersucht.
Eingeschlossen wurden Patienten, bei denen eine konventionelle MC-Therapie (einschliesslich eines Glukokortikoids und/oder eines Immunsuppressivums) versagt hatte; es wurden auch Patienten eingeschlossen, die unter Infliximabtherapie einen Verlust des klinischen Ansprechens oder eine Unverträglichkeit entwickelt hatten.
Alle Patienten erhielten eine offene Induktionstherapie mit einer Dosis auf Basis des Körpergewichts zu Studienbeginn: 160 mg zu Woche 0 und 80 mg zu Woche 2 für Patienten ≥40 kg bzw. 80 mg und 40 mg für Patienten <40 kg.
In Woche 4 wurden die Patienten 1:1 auf Basis des derzeitigen Körpergewichts entweder in ein Behandlungsschema mit Standarddosis: 20 mg jede 2. Woche für Patienten <40 kg und 40 mg für Patienten mit ≥40 kg oder mit niedriger Dosis: 10 mg jede 2. Woche für Patienten <40 kg und 20 mg für Patienten mit ≥40 kg, randomisiert.
Ergebnisse zur Wirksamkeit
Der primäre Endpunkt der Studie war die klinische Remission in Woche 26, definiert als PCDAI-Score ≤10.
In Woche 26 waren die Raten für die klinische Remission und das klinische Ansprechen (definiert als Verringerung im PCDAI-Score um mindestens 15 Punkte im Vergleich zur Baseline) 38,7% und 59,1% für die Standarddosierung (N=93) sowie 28,4% und 48,4% für die Patienten mit der niedrigen Dosierung (N=95). Der Unterschied in den Raten der klinischen Remission und des klinischen Ansprechens in Woche 26 war statistisch nicht signifikant (p=0,075 respektive p=0,073).
In Woche 52 betrugen die Raten für die klinische Remission und das klinische Ansprechen 33,3% und 41,9% für die Standarddosierung sowie 23,2% und 28,4% für die Patienten mit der niedrigen Dosierung. Der Unterschied in der Rate des klinischen Ansprechens in Woche 52 war statistisch signifikant (p=0,038).
Bei den Patienten, die die Standarddosierung erhielten, setzten 84,8% in Woche 26 und 69,7% in Woche 52 die Glukokortikoide ab (N=33). Das Absetzen von Immunsuppressiva (nach Ermessen des Prüfarztes zu oder nach Woche 26, wenn der Patient das Kriterium für ein klinisches Ansprechen erfüllte) war 30,0% in Woche 52 (N=60). Fistelremission (definiert als Verschluss aller zum Zeitpunkt des Studienbeginns drainierender Fisteln, nachgewiesen an mindestens zwei aufeinanderfolgenden Visiten im Studienverlauf) war 46,7% in Woche 26 und 40,0% in Woche 52 für Patienten mit Standarddosierung (N=15).
Bei den Patienten mit niedriger Dosierung setzten 65,8% in Woche 26 und 60,5% in Woche 52 die Glukokortikoide ab. Das Absetzen von Immunsuppressiva betrug 29,8% in Woche 52 (N=57). Fistelremission war 38,1% in Woche 26 und 23,8% in Woche 52 für Patienten mit niedriger Dosis (N=21).
Statistisch signifikante Zunahmen (Verbesserungen) im Vergleich zur Baseline wurden im Body Mass Index und der Körpergrösse zu Woche 26 und Woche 52 für beide Behandlungsgruppen beobachtet.
Statistisch und klinisch signifikante Verbesserungen im Vergleich zur Baseline wurden auch in beiden Behandlungsgruppen für die Parameter zur Lebensqualität (einschliesslich IMPACT III) beobachtet.
Colitis ulcerosa
Die Sicherheit und Wirksamkeit wurden bei erwachsenen Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa (Mayo Score 6 bis 12 mit Endoskopie-Subscore 2 bis 3) in zwei randomisierten, doppelblinden, placebokontrollierten Studien untersucht. Eine gleichzeitig verabreichte Dauermedikation mit Aminosalicylaten, Glukokortikoiden und/oder immun-modulierenden Substanzen war erlaubt.
Die Induktion einer klinischen Remission (definiert als Mayo Score ≤2 mit keinem Subscore >1) wurde in 390 TNF-Hemmer naiven Patienten untersucht, welche in Woche 0 und 2 jeweils entweder Placebo oder Adalimumab 160 mg/80 mg oder Adalimumab 80 mg/40 mg erhielten, gefolgt von Placebo oder 40 mg Adalimumab in Woche 4 und Woche 6. Während der darauffolgenden Erhaltungsphase erhielten alle Patienten 40 mg Adalimumab alle 2 Wochen.
In Woche 8 wurde mit einer Induktionsdosis von 160 mg/80 mg Adalimumab eine klinische Remission in 18% unter Adalimumab vs. 9% unter Placebo (p=0,031) erreicht. Mit der 80 mg/40 mg Induktionsdosis wurde keine statistisch signifikante Überlegenheit von Adalimumab (10%, p=0.833) beobachtet.
Die Wirksamkeit über die Induktions- und Erhaltungsphase (insgesamt 52 Wochen) wurde in 248 Patienten mit 160 mg/80 mg/40 mg alle 2 Wochen gegen 246 Patienten mit Placebo verglichen. In Woche 8 und Woche 52 waren 16,5% (p=0.019) bzw. 17,3% (p=0.004) unter Adalimumab vs. 9,3% bzw. 8,5% unter Placebo in Remission. Die Raten bezüglich anhaltendem Ansprechen, Remission und Mukosaheilung sind in Tabelle 12 zusammengefasst:
Tabelle 12: Anhaltendes Ansprechen, Remission und Mukosa-Heilung in der UC-Studie II
Prozentualer Anteil der Patienten (95%-Konfidenzintervall)
|
|
Placebo und
95% Konfidenzintervall
|
Adalimumab 40 mg
jede zweite Woche und
95% Konfidenzintervall
| |
Woche 8 und 52
| |
Anhaltendes Ansprechen
|
12% (CI 8.1-16.3)
|
24%** (CI 18.5-29.1)
| |
Anhaltende Remission
|
4% (CI 1.6-6.5)
|
8%* (CI 5.0-11.9)
| |
Anhaltende Mukosa-Heilung
|
11% (CI 6.7-14.4)
|
19%* (CI 13.7-23.4)
|
a Konfidenzintervall für Proportion basierend auf Normal-Approximation der Binomialverteilung
Klinische Remission bedeutet Mayo Score ≤2 mit keinem Subscore >1;
* p<0,05 für Adalimumab versus Placebo
** p<0,001 für Adalimumab versus Placebo
Mukosa-Heilung bedeutet Endoskopie-Subscore 0 oder 1
Ansprechen bedeutet Reduktion in Mayo Score um ≥3 Punkte und ≥30% gegenüber Baseline sowie einen Rektalblutungs-Subscore von 0 oder 1 oder dessen Reduktion um ≥1 Punkt gegenüber Baseline.
Von den 125 Patienten, die in Woche 8 angesprochen hatten, zeigten in Woche 52 noch 59 (47%) ein Ansprechen, 36 (29%) waren in Remission, 51 (41%) hatten Mukosa-Heilung und 18 (20% der 90 Patienten mit Ansprechen in Woche 8 und Steroid-Behandlung an Baseline) waren in Steroid-freier Remission für ≥90 Tage.
Eine statistisch signifikante Reduktion der durch alle Ursachen sowie durch Colitis ulcerosa bedingten Hospitalisationsrate wurde in der Gesamtanalyse beider UC-Studien beobachtet.
Bei annähernd 40% Patienten der UC-Studie II versagte zuvor die anti-TNF-Behandlung mit Infliximab. Die Wirksamkeit von Adalimumab war bei diesen Patienten im Vergleich zu Patienten, die anti-TNF naïv waren, verringert. In dieser Subgruppe wurde in Woche 52 unter Adalimumab bei 10% vs. 3% unter Placebo eine Remission (p=0.039) erreicht.
Patienten der UC Studien I und II hatten die Möglichkeit, in der offenen Langzeitstudie (UC-III) weiter behandelt zu werden. 3 Jahre nach Behandlung mit Adalimumab waren 75% (301/402) weiterhin in klinischer Remission gemäss partiellem Mayo score.
Eine Verbesserung der Lebensqualität, gemessen am krankheitsspezifischen Gesamtscore des IBDQ (Inflammatory Bowel Disease Questionnaire) wurde in Woche 52 gegenüber Placebo erreicht (p=0,007).
Ankylosierende Spondylitis (Morbus Bechterew)
Die Wirksamkeit von Adalimumab 40 mg alle 2 Wochen subkutan verabreicht wurde bei 393 Patienten mit aktiver ankylosierender Spondylitis (Krankheitsaktivität [Bath Ankylosing Spondylitits Disease Activity Index (BASDAI)]) >4 (mittlere Basiswerte 6.3 sowohl bei der Adalimumab wie auch der Placebo-Gruppe), die nur unzureichend auf herkömmliche Therapien angesprochen haben, in 2 randomisierten doppelblind, placebo-kontrollierten Studien über 24 Wochen untersucht. Als Begleittherapie erhielten 79 Patienten (20.1%) krankheitsmodifizierende Antirheumatika und 37 (9.4%) Glucocorticoide. Der verblindeten Periode folgte eine offene Fortsetzungsperiode, während der die Patienten über bis zu 28 zusätzliche Wochen jede zweite Woche 40 mg Adalimumab subkutan erhielten.
In der grösseren Studie mit 315 Patienten, zeigten die Resultate statistisch signifikante Verbesserungen der Anzeichen und Symptome der ankylosierenden Spondylitis bei denjenigen Patienten, welche Adalimumab erhielten verglichen mit denjenigen, unter Placebo. Das signifikante Ansprechen wurde zuerst nach 2 Wochen gesehen und blieb bis Woche 24 erhalten.
Die Assessment in Ankylosing Spondylitis (ASAS) 20/50/70 Ansprechraten wurden in Woche 12 bei 58%, 38% und 23% der Patienten unter Adalimumab erreicht verglichen mit 21%, 10% und 5% der Patienten unter Placebo (p<0.001 Adalimumab versus Placebo). Ein grob vergleichbares Ansprechen wurde in Woche 24 gesehen.
Wie mit BASDAI festgestellt, führte die Behandlung mit Adalimumab zu Verbesserungen der Anzeichen und Symptome. Bei 45% der mit Adalimumab behandelten Patienten wurde in Woche 12 mindestens eine 50% Reduktion der BASDAI Basiswerte erreicht verglichen mit 16% der mit Placebo behandelten Patienten (p<0.01). Vergleichbare Resultate wurden in Woche 24 gesehen.
Zusätzlich war die mittlere Abweichung der Basiswerte für C-Reaktives-Protein (CRP) in Woche 12 unter Adalimumab Behandlung (-1.3 mg/dl) grösser verglichen mit Placebo Behandlung (-0.1 mg/dl), (p<0.001).
Vergleichbare Resultate (nicht alle mit statistischer Signifikanz) wurden in der kleineren, randomisierten, doppelblinden, placebo-kontrollierten Studie bei 82 erwachsenen Patienten mit aktiver ankylosierender Spondylitis gesehen.
In den ankylosierenden Spondylitis Studien wurden die von Patienten berichteten Resultate anhand des Generic Health Status Questionnaire Short Form–36 (SF-36) und dem Disease Specific Ankylosing Spondylitis Quality of Life Questionnaire (ASQoL) bewertet. Die mit Adalimumab behandelten Patienten hatten signifikant grössere Verbesserungen des ASQoL und des «physical components» des SF-36 in Woche 12 als die Patienten in der Placebogruppe, welche bis Woche 24 aufrechterhalten blieben.
Psoriasis
Die Wirksamkeit und Sicherheit von Adalimumab wurde in randomisierten, doppelblinden, kontrollierten Studien bei über 1'600 Patienten mit mässiger bis schwerer, chronischer Plaque-Psoriasis untersucht, die ≥18 Jahre alt waren und bei denen eine systemische Therapie oder eine Phototherapie angezeigt war.
In Studie 1 wurden 1212 Patienten mit chronischer Plaque-Psoriasis mit betroffener Körperoberfläche (Body Surface Area, BSA) ≥10% und einem Psoriasis Area and Severity Index (PASI) ≥12 in drei Behandlungsperioden evaluiert. In Periode A erhielten die Patienten subkutan Placebo oder eine Initialdosis 80 mg Adalimumab in Woche 0 gefolgt von 40 mg Adalimumab alle zwei Wochen ab Woche 1. Nach 16 Therapie-Wochen wechselten diejenigen Patienten, welche in Woche 16 mindestens einen PASI75 erreicht hatten, definiert als PASI Score Verbessung von mindestens 75% relativ zum Basiswert, in die offene Fortsetzungsperiode B. Sie erhielten Adalimumab 40 mg alle zwei Wochen. Nach 17 Wochen unverblindeter Therapie wechselten diejenigen Patienten, welche mindestens PASI75 in Woche 33 beibehielten und in der Behandlungsperiode A aktive Therapie erhielten, in die Behandlungsperiode C. Sie erhielten weitere 19 Wochen lang Adalimumab 40 mg oder Placebo alle 2 Wochen. Über alle Behandlungsgruppen war der mittlere PASI-Basiswert 18,9. Der Physician's Global Assessment (PGA) Basiswert über alle Gruppen reichte von «mässig» (52,6%) über «schwer» (41,3%) bis «sehr schwer» (6.1%).
Studie 2 verglich die Wirksamkeit und Sicherheit von Adalimumab versus Methotrexat und Placebo in 271 Patienten mit chronischer Plaque-Psoriasis mit betroffener BSA 10% und PASI ≥10. Über 16 Wochen erhielten die Patienten Placebo, Methotrexat (7.5–20 mg) oder eine Initialdosis Adalimumab 80 mg subkutan in Woche 0 gefolgt von Adalimumab 40 mg alle zwei Wochen ab Woche 1. Über alle Behandlungsgruppen war der mittlere PASI-Basiswert 19.7. Der PGA Basiswert über alle Gruppen reichte von «mild» (0,4%), «mässig» (47.8%) über «schwer» (45,6%) bis «sehr schwer» (6,3%).
1469 Patienten aus Phase-II- und Phase-III-Studien wurden in einer offenen 3-phasigen Fortsetzungsstudie mit einer Weiterbehandlungsphase (104-252 Wochen), einer Behandlungsunterbruchsphase (bis Rückfall oder maximal 52 Wochen) und anschliessenden Wiederbehandlungsphase (16 Wochen) aufgenommen.
In Studie 3 wurden 148 Patienten mit chronischer Plaque-Psoriasis mit betroffener BSA ≥5% über mindestens 1 Jahr evaluiert. Die Patienten erhielten Placebo oder Initialdosis Adalimumab 80 mg in Woche 0 gefolgt von Adalimumab 40 mg alle zwei Wochen ab Woche 1 bzw. eine Initialdosis Adalimumab 80 mg in Woche 0 gefolgt von Adalimumab 40 mg jede Woche ab Woche 1.
Klinische Resultate
Primärer Endpunkt in den Studien 1, 2 und 3 war der Prozentsatz Patienten, die in Woche 16 (Studie 1 und 2) oder in Woche 12 (Studie 3) eine Reduktion im PASI Score von mindestens 75% vom Basiswert (PASI75) erreichten. Weiter wurden in den Psoriasis Studien 1–3 unter anderem PGA und andere PASI Werte untersucht.
Studie 1: Zusätzlich zum primären Endpunkt oben, hatte Studie 1 als zweiten primären Endpunkt den Verlust an adäquatem Ansprechen nach Woche 33 sowie in oder vor Woche 52. Ein Verlust an adäquater Ansprechrate war definiert als eine < PASI50 Antwort relativ zum Basiswert mit einem minimalen 6-Punkt erhöhtem PASI Wert relativ zur Woche 33.
Kontrollierte Daten über eine Therapie mit Adalimumab im Vergleich zu Placebo liegen für eine Dauer von 52 Wochen vor. In einer Placebo kontrollierten Vergleichsstudie mit Patienten, bei welchen unter einer Adalimumab-Therapie eine anhaltende Beschwerdefreiheit bis zur 33. Woche erzielt wurde, blieben unter Weiterführung mit Adalimumab 95,1% der Patienten bis zur 52. Woche rezidivfrei, unter Placebo (d.h. nach Absetzen von Adalimumab in der Woche 33) 71,6%.
Von den Patienten, welche nach der erneuten Randomisierung auf Placebo einen Verlust des adäquaten Ansprechens zeigten und anschliessend in die offene Fortsetzungsperiode eingeschlossen wurden, erzielten 38% (25/66) bzw. 55% (36/66) nach 12 bzw. 24 Wochen aktiver Therapie wieder ein PASI75-Ansprechen.
Dieses verzögerte Ansprechen nach Rezidiv dürfte im Zusammenhang stehen mit einem schwerwiegenden Verlauf der Psoriasiserkrankung bei dieser Untergruppe von Patienten.
In den Psoriasis Studien 1 und 2 erreichten in Woche 16 mehr der mit Adalimumab behandelten Patienten eine mindestens 75% Reduktion vom PASI Basiswert als die mit Placebo behandelten Patienten. Andere relevante klinische Parameter inklusive PASI 100 (z.B. völliges Verschwinden der Psoriasis Hautanzeichen) und PGA «frei von oder minimal» waren im Vergleich zu Placebo ebenfalls verbessert.
Studie 2: In Psoriasis Studie 2 erreichten die mit Adalimumab behandelten Patienten bessere Resultate für PASI75, PASI100 und PGA «frei von oder minimal» als die mit Methotrexat behandelten.
Tabelle 13: Psoriasis Studie 1
Wirksamkeit in Woche 16 (% der Patienten)
|
|
Placebo
N=398
|
Adalimumab 40 mg eow
N=814
| |
≥PASI75
|
6.5
|
70.9a
| |
PASI100
|
0.8
|
20.0a
| |
PGA: Clear/minimal
|
4.3
|
62.2a
|
a p<0.001, Adalimumab vs. Placebo
Tabelle 14: Psoriasis Studie 2
Wirksamkeit in Woche 16 (% der Patienten)
|
|
Placebo
N=53
|
MTX
N=110
|
Adalimumab 40 mg eow
N=108
| |
≥PASI 75
|
18.9
|
35.5
|
79.6 a, b
| |
PASI 100
|
1.9
|
7.3
|
16.7 a, b
| |
PGA: Clear/minimal
|
11.3
|
30.0
|
73.1 a, b
|
a p<0.001, Adalimumab vs. Placebo
b p<0.001 Adalimumab vs. Methotrexat
Fortsetzungsstudie: Insgesamt 233 Patienten, die ein PASI-75-Ansprechen in Woche 16 und Woche 33 gezeigt hatten und in der Psoriasis-Studie 1 für 52 Wochen eine Adalimumab Dauertherapie erhalten hatten, wurden mit Adalimumab in der offenen Fortsetzungsstudie weiterbehandelt. Das PASI-75-Ansprechen bzw. das PGA-Ansprechen, definiert als PGA «frei von» oder «minimal» war bei diesen Patienten nach weiteren 108 offenen Behandlungswochen (insgesamt 160 Wochen) 74,7% bzw. 59,0%. In einer Non Responder Imputation- (NRI-) Analyse, in der alle Patienten als Non-Responder betrachtet wurden, die aus der Studie aufgrund von Nebenwirkungen oder mangelnder Wirksamkeit ausschieden oder bei denen die Dosis erhöht wurde, betrug bei diesen Patienten das PASI-75-Ansprechen bzw. das PGA-Ansprechen, definiert als PGA «frei von» oder «minimal» nach weiteren 108 Wochen der offenen Fortsetzungsbehandlung (insgesamt 160 Wochen) 69,6% bzw. 55,7%.
In der Fortsetzungsstudie wurden 347 Patienten, die dauerhaft angesprochen hatten, einer Analyse einer Behandlungsunterbrechung und -wiederaufnahme zugeführt. Während der Phase der Behandlungsunterbrechung kehrten die Psoriasis-Symptome bei 54,2% (188/347) im Verlauf von durchschnittlich etwa 5 Monaten zurück (Verminderung des PGA auf «mittelschwer» oder schlechter). Keiner dieser Patienten erfuhr einen Rebound-Effekt während der Unterbrechungsphase. Insgesamt 76,5% (218/285) der Patienten in der anschliessenden Wiederbehandlungsphase hatten 16 Wochen nach Wiederaufnahme der Behandlung ein PGA-Ansprechen, definiert als PGA «frei von» oder «minimal», unabhängig davon, ob sie während des Absetzens einen Rückfall hatten (69,1% [123/178] oder nicht 88,8% [95/107]). Es wurde ein ähnliches Sicherheitsprofil in der Phase, in der die Behandlung wiederaufgenommen wurde, beobachtet, wie vor der Behandlungsunterbrechung.
Studie 3: Resultate aus Psoriasis Studie 3 unterstützen die in Studie 1 und 2 gezeigte Wirksamkeit.
Patienten in Studie 1, welche PASI75 Ansprechraten zeigten und welche in Woche 33 in die Adalimumab Gruppe re-randomisiert wurden, zeigten weniger Verlust in adäquater Ansprechrate in oder vor Woche 52 als in die Placebo Gruppe re-randomisierte Patienten (4,9% vs 28,4%, p<0.001).
In einer offenen Fortsetzungsstudie wurde in Patienten, die nach initial mindestens partiellem Ansprechen ein sekundäres Therapieversagen zeigten, d.h. gegenüber der Baseline keine PASI50-Antwort mehr aufwiesen, und die Dosis von 40 mg jede zweite Woche auf 40 mg wöchentlich gesteigert wurde, bei 28.3% (63/223) bzw. 39.5% (88/223) ein PASI-75-Ansprechen in Woche 12 bzw. 24 beobachtet.
Lebensqualität
Von Patienten berichtete Ergebnisse (Patient reported Outcomes, PRO) wurden anhand diverser Parameter evaluiert. Lebensqualität wurde anhand des krankheitsspezifischen Dermatology Life Quality Index (DLQI) in Studie 1 und 2 bestimmt. In Studie 1 zeigten die mit Adalimumab behandelten Patienten in Woche 4 und 16 Verbesserungen im DLQI Gesamtscore, Krankheitsgrad, Schmerzen und Pruritus verglichen mit den mit Placebo behandelten Patienten. Die DLQI Resultate blieben bis Woche 52 aufrechterhalten.
In Studie 2 zeigten die mit Adalimumab behandelten Patienten in Woche 16 Verbesserungen im DLQI Gesamtscore, Krankheitsgrad, und Pruritus verglichen mit den mit Placebo oder Methotrexat behandelten Patienten und klinisch aussagekräftige Verbesserungen bezüglich Schmerzen verglichen mit den mit Placebo behandelten Patienten.
Die generelle gesundheitsbezogene Lebensqualität wurde anhand des Short Form Health Survey (SF-36) in Studie 1 bestimmt. Die mit Adalimumab behandelten Patienten zeigten eine signifikant grössere Verbesserung in den SF-36 Physical Component Summary (PCS) and Mental Component Summary (MCS) Scores.
Hidradenitis suppurativa
Die Wirksamkeit und Sicherheit von Adalimumab wurde in randomisierten, doppelblinden, Plazebo-kontrollierten Studien und in einer offenen Fortsetzungsstudie bei 727 erwachsenen Patienten mit mittelschwerer bis schwerer Hidradenitis suppurativa untersucht. Die Patienten hatten entweder eine Kontraindikation, ein ungenügendes Ansprechen oder eine Intoleranz gegenüber einer systemischen Antibiotikatherapie und waren im Hurley Stadium II oder III mit mindestens 3 Abszessen oder entzündlichen Knoten.
Zwei randomisierte, doppelblinde, Plazebo-kontrollierte Phase III Studien (HS-I und II) mit insgesamt 633 erwachsenen Patienten umfassten jeweils eine initiale 12 Wochen doppelblinde Behandlungsperiode (Periode A) und eine nachfolgende 24 Wochen doppelblinde Behandlungsperiode (Periode B). In Periode A erhielten die Patienten Adalimumab (160 mg in Woche 0, 80 mg in Woche 2 und 40 mg jede Woche ab Woche 4 bis 11) oder Plazebo. Nach 12 Wochen wurden Patienten, die in Periode A Adalimumab erhalten hatten, in Periode B re-randomisiert auf Adalimumab 40 mg wöchentlich, Adalimumab 40 mg jede 2. Woche oder Plazebo bis Woche 35. Patienten, die in Periode A Plazebo erhalten hatten, wurden in Periode B auf Adalimumab 40 mg wöchentlich (HS-I) oder Plazebo (HS-II) randomisiert.
Eine gleichzeitige Behandlung mit oralen Antibiotika war in Studie HS-II erlaubt.
Die Patienten beider HS Studien konnten an einer offenen Fortsetzungsstudie teilnehmen, in welcher Adalimumab 40 mg wöchentlich verabreicht wurde. Die durchschnittliche Exposition lag in allen Adalimumab Populationen bei 762 Tagen. In allen 3 Studien verwendeten die Patienten täglich topische antiseptische Spülungen.
Klinische Wirksamkeit
Die Verringerung der entzündlichen Läsionen und die Prävention einer Verschlimmerung der Abzesse und dränierenden Fisteln wurde mit Hilfe des Hidradenitis Suppurativa Clinical Response scores (HiSCR; mindestens 50% Reduktion der Anzahl aller Abszesse und entzündlichen Knoten ohne Anstieg der Anzahl an Abszessen und ohne Anstieg der Anzahl an drainierenden Fisteln gegenüber Baseline) untersucht.
In Woche 12 erzielte in beiden Studien (HS-I und –II) ein signifikant grösserer Anteil der Adalimumab behandelten Patienten den HiSCR gegenüber Plazebo sowie in der HS-II Studie erzielte ein signifikant höherer Anteil eine relevante Verminderung des mit HS verbundenen Hautschmerzes (siehe Tabelle 15). Patienten, die mit Adalimumab behandelt wurden, hatten zudem ein signifikant reduziertes Risiko des Wiederaufflammens der Erkrankung während der initialen 12 Wochen der Behandlung.
Tabelle 15: HS Studien I und II – Wirksamkeit in Woche 12
|
|
HS Studie I
|
HS Studie II
| |
Plazebo
|
Adalimumab 40 mg wöchentlich
|
Plazebo
|
Adalimumab 40 mg wöchentlich
| |
Hidradenitis suppurativa Klinische Wirksamkeit (HiSCR)a
|
N=154
40 (26.0%)
|
N=153
64 (41.8%)*
|
N=163
45 (27.6%)
|
N=163
96 (58.9%)***
|
* P<0.05, *** P<0.001, Adalimumab vs Plazebo
a Innerhalb aller randomisierter Patienten.
Bei Patienten, die Adalimumab wöchentlich erhielten, wurde die Gesamt- HiSCR Rate bis zur Woche 96 aufrechterhalten.
Uveitis
Die Sicherheit und Wirksamkeit von Adalimumab wurde im Rahmen von zwei randomisierten, placebokontrollierten, doppelblinden Studien (UV-Studie 1 (M10-877) und UV-Studie 2 (M10-880)) über maximal 80 Wochen bei erwachsenen Patienten mit nicht-infektiöser intermediärer Uveitis, posteriorer Uveitis oder Panuveitis (auch «nicht-infektiöse Uveitis des hinteren Augenabschnitts») untersucht. Dabei waren Patienten mit isolierter anteriorer Uveitis ausgeschlossen. Die Patienten erhielten Placebo oder Adalimumab in einer Initialdosis von 80 mg, und beginnend in der darauffolgenden Woche 40 mg alle zwei Wochen.
Eine Begleitmedikation mit einem konventionellen Immunsuppressivum (Ciclosporin A, Methotrexat, Mycophenolat-Mofetil, Azathioprin, Tacrolimus) war in stabiler Dosierung erlaubt. Beide Studien hatten als primären Wirksamkeitsendpunkt die «Zeit bis zu einem Therapieversagen». Als Therapieversagen war ein kombinierter Endpunkt definiert mit folgenden Komponenten: 1) entzündliche chorioretinale und/oder entzündliche retinale Gefässveränderungen, 2) der Grad der Vorderkammerzellen, 3) der Grad einer Glaskörpertrübung (Vitreous Haze) und 4) die beste korrigierte Sehschärfe (BCVA).
In UV-Studie 1 wurden 217 Patienten untersucht, die trotz Kortikosteroid-Therapie (orales Prednison in einer Dosis von 10 bis 60 mg/Tag) an einer aktiven Uveitis litten. Alle Patienten erhielten bei Einschluss in die Studie eine standardisierte Prednison-Dosis von 60 mg/Tag mit obligatem Dosisreduktionsschema und vollständigem Absetzen der Kortikosteroide bis Woche 15.
In UV-Studie 2 wurden 226 Patienten mit inaktiver Uveitis untersucht, die bei Studienbeginn zur Kontrolle ihrer Erkrankung eine chronische Kortikosteroid-Therapie (orales Prednison 10 bis 35 mg/Tag) benötigten. Die Studienmedikation wurde unter Fortführung der etablierten Kortikosteroiddosis eingeführt, und es folgte ein obligates Dosisreduktionsschema mit vollständigem Absetzen der Kortikosteroide bis Woche 19.
Klinisches Ansprechen
Die Ergebnisse beider Studien zeigten bei den mit Adalimumab behandelten Patienten eine statistisch signifikant längere Zeit bis zum ersten Therapieversagen als bei den mit Placebo behandelten Patienten (siehe Tabelle 16). Ebenso zeigten beide Studien eine frühe und anhaltende Wirkung von Adalimumab in Bezug auf die Verzögerung des ersten Therapieversagens gegenüber Placebo (siehe Abbildung 3).
Tabelle 16: Zeit bis zum ersten Therapieversagen in den UV-Studien 1 und 2
|
Untersuchte Behandlung
|
N
|
Versagen
N (%)
|
Mediane Zeit bis Versagen
(Monate)
|
HRa
|
95%-KI
für HRa
|
p-Wertb
| |
Zeit bis zu einem Therapieversagen in oder nach Woche 6 in UV-Studie 1
| |
Primäre Analyse (ITT)
| |
Placebo
|
107
|
84 (78,5)
|
3,0
|
--
|
--
|
--
| |
Adalimumab
|
110
|
60 (54,5)
|
5,6
|
0,50
|
0,36; 0,70
|
<0,001
| |
Zeit bis zu einem Therapieversagen in oder nach Woche 2 in UV-Studie 2
| |
Primäre Analyse (ITT)
| |
Placebo
|
111
|
61 (55,0)
|
8,3
|
--
|
--
|
--
| |
Adalimumab
|
115
|
45 (39,1)
|
n.a.c
|
0,57
|
0,39; 0,84
|
0,004
|
Anmerkung: Ein Therapieversagen in oder nach Woche 6 (UV-Studie 1) bzw. in oder nach Woche 2 (UV-Studie 2) wurde als Ereignis gewertet. Abbrüche aus anderen Gründen als Therapieversagen wurden zum Zeitpunkt des Abbruchs zensuriert.
a HR von Adalimumab vs. Placebo aus der Proportional-Hazards-Regression mit Behandlung als Faktor.
b 2-seitiger p-Wert aus dem Log-Rangtest.
c n.a. = Nicht abschätzbar. Weniger als die Hälfte der infrage kommenden Patienten hatte ein Ereignis während der Studiendauer von 80 Wochen.
Abbildung 3: Kaplan-Meier-Kurven für die Zeit bis zum ersten Therapieversagen in oder nach Woche 6 (UV-Studie 1) oder in oder nach Woche 2 (UV-Studie 2)
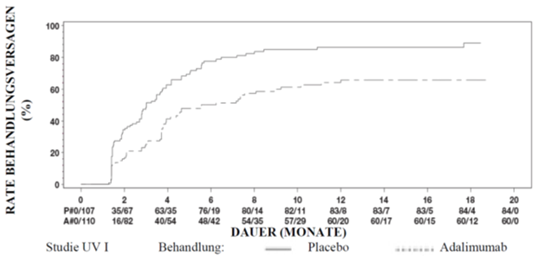
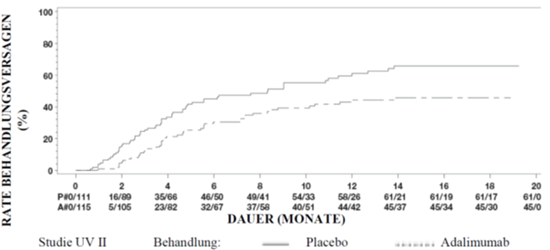
Eine Sensitivitätsanalyse des primären Endpunktes, in welcher Patienten, die vorzeitig abbrachen und solche, die unerlaubterweise Kortikosteroide als Begleitmedikation nahmen, als Behandlungsversager gezählt wurden, zeigte einen starken Behandlungseffekt zugunsten von Adalimumab (UV I: HR=0.66, 95%CI 0.48–0.88, p=0.005; UV II: HR=0.59, 95%CI 0.42-0.81, p=0.001).
In beiden Studien trugen alle Komponenten des primären Endpunkts kumulativ zur Gesamtdifferenz zwischen der Adalimumab- und Placebogruppe bei.
In UV-Studie 1 wurden statistisch signifikante Differenzen zugunsten von Adalimumab im Hinblick auf die Änderung der Anzahl der Zellen in der Vorderkammer, beim Grad einer Glaskörpertrübung und beim Visus (logMAR BCVA) beobachtet (mittlere Änderung vom besten Wert vor Woche 6, LOCF-Analyse; p-Werte: 0,011; <0,001 bzw. 0,003).
UV-Studie II tendierte in die gleiche Richtung ohne statistische Signifikanz zu erreichen.
In UV-Studie I zeigten der mittlere Verlauf im Grad der Vorderkammerzellen sowie im Grad der Glaskörpertrübung und des Visus (logMAR BCVA) eine vergleichbare Verbesserung in beiden Behandlungsgruppen während der ersten 4-6 Behandlungswochen unter Ausschleichen der Kortikosteroidbegleitmedikation; anschliessend war unter Adalimumab im Vergleich zu Plazebo ein geringerer Anstieg im Ausmass der Entzündung und ein geringerer Verlust der Sehstärke zu beobachten. Auch in der UV-Studie II wurde, verglichen mit Plazebo, ein geringerer Anstieg im Ausmass der Entzündung und ein geringerer Verlust der Sehstärke beobachtet.
46 von insgesamt 417 Teilnehmern, die in die unkontrollierte langfristige Fortsetzungsstudie der Studien UV I und UV II aufgenommen wurden, galten als ungeeignet (z.B. Entwicklung von sekundären Komplikationen einer diabetischen Retinopathie, wegen einer Kataraktoperation oder Vitrektomie) und wurden von der primären Wirksamkeitsanalyse ausgeschlossen. Von den 371 verbliebenen Patienten absolvierten 276 auswertbare Patienten die offene Adalimumab-Behandlung bis Woche 78. Auf Grundlage der beobachteten Daten erreichten 222 (80,4%) Patienten unter gleichzeitiger Steroidgabe in einer Dosis von ≤7,5 mg täglich eine Krankheitskontrolle (keine aktiven entzündlichen Läsionen, Grad der Vorderkammerzellen ≤0,5+, Grad der Glaskörpertrübung ≤0,5+), während 184 (66,7%) Patienten eine steroidfreie Krankheitskontrolle erzielten. In Woche 78 hatte sich der BCVA bei 88,4% der Augen entweder verbessert oder war gleich geblieben (Verminderung um <5 Buchstaben). Von den Patienten, die die Studienteilnahme vor Woche 78 beendeten, brachen 11% ihre Teilnahme wegen unerwünschter Ereignisse und 5% wegen eines unzureichenden Ansprechens auf die Adalimumab-Behandlung ab.
Lebensqualität
In UV-Studie 1 bewirkte die Behandlung mit Adalimumab einen Erhalt der Visus-abhängigen Funktion und der gesundheitsbezogenen Lebensqualität (beurteilt anhand des NEI VFQ-25).
|




