ZusammensetzungWirkstoffe
Komponente 1: Fibrinogen vom Menschen.
Komponente 2: Thrombin vom Menschen.
Wirkstoffe werden aus dem Plasma menschlicher Spender hergestellt.
Hilfsstoffe
Komponente 1: Natriumcitrat-Dihydrat, Natriumchlorid, Arginin, Isoleucin, Natriumhydrogenglutamat-Monohydrat und Wasser für Injektionszwecke.
Komponente 2: Calciumchlorid-Dihydrat, Albumin vom Menschen, Natriumchlorid, Glycin und Wasser für Injektionszwecke.
Indikationen/AnwendungsmöglichkeitenVeraSeal ist indiziert zur unterstützenden Behandlung bei Patienten, bei denen chirurgische Standardtechniken nicht ausreichend sind:
·zur Verbesserung der Hämostase,
·als Nahtunterstützung in der Gefässchirurgie.
VeraSeal ist bei heparinisierten Patienten wirksam.
VeraSeal wird bei allen Altersgruppen angewendet.
Dosierung/AnwendungVeraSeal darf nur von erfahrenen Chirurgen angewendet werden, die in der Anwendung dieses Arzneimittels geschult wurden.
Dosierung
Das Anwendungsvolumen und die Anwendungshäufigkeit von VeraSeal sollten sich stets nach dem klinischen Bedarf des Patienten richten.
Die zu applizierende Dosis orientiert sich unter anderem an Faktoren wie der Art des chirurgischen Eingriffs, der Grösse der zu behandelnden Fläche, der Art der beabsichtigten Anwendung sowie der Anzahl der Anwendungen.
Die Applikation des Produktes muss durch den behandelnden Arzt individuell festgelegt werden. Bei klinischen Prüfungen wurden in der Regel Einzeldosen von 0,3 bis 12 ml angewendet. Für andere Eingriffe können grössere Mengen erforderlich sein.
Das auf eine bestimmte anatomische Stelle oder Behandlungsfläche aufzutragende Anfangsvolumen des Produktes sollte ausreichend sein, um den vorgesehenen Anwendungsbereich vollständig mit einer dünnen Schicht (Dicke 1 mm) zu bedecken. Die Anwendung kann bei Bedarf wiederholt werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von VeraSeal bei Kindern und Jugendlichen im Alter von 0 bis 18 Jahren wurde in einer klinischen Studie untersucht. Zurzeit vorliegende Daten werden in Abschnitt «Eigenschaften/Wirkungen», «Pädiatrie» beschrieben. Die Anwendung des Produkts muss durch den behandelnden Chirurgen individuell festgelegt werden. In der klinischen Studie an Kindern und Jugendlichen wurden Einzeldosen von 0,6 bis 12 ml angewendet.
Art der Anwendung
Zur epiläsionalen Anwendung.
Hinweise zur Vorbereitung des Arzneimittels vor der Anwendung, siehe Abschnitt «Hinweise für die Handhabung». Das Produkt darf nur gemäss den Anweisungen und mit den dafür empfohlenen Geräten angewendet werden.
Vor dem Auftragen von VeraSeal muss die Wundoberfläche mittels Standardtechniken (z.B. intermittierende Anwendung von Kompressen, Tupfern, Anwendung von Saugern) getrocknet werden.
In Tabelle 1 sind die ungefähren Flächen ersichtlich, die durch die einzelnen VeraSeal-Packungsgrössen abgedeckt werden können.
Tabelle 1. Flächenabdeckung
|
VeraSeal-Packungsgrösse
|
Flächenabdeckung (cm2)
Anwendung durch Auftropfen oder Aufsprühen
(Schichtdicke 1 mm)
| |
2 ml
|
16–22
| |
4 ml
|
32–44
| |
6 ml
|
48–66
| |
10 ml
|
80–110
|
Für die Sprühapplikation finden sich in den Abschnitten «Warnhinweise und Vorsichtsmassnahmen» und «Hinweise für die Handhabung» spezifische Empfehlungen zum erforderlichen Gewebeabstand je nach Art des Eingriffs.
KontraindikationenVeraSeal darf nicht intravaskulär angewendet werden.
Überempfindlichkeit gegen die Wirkstoffe oder einen der genannten Hilfsstoffe.
VeraSeal darf nicht zur Behandlung von massiven und starken arteriellen Blutungen verwendet werden.
Warnhinweise und VorsichtsmassnahmenVorsichtsmassnahmen für die Anwendung
Nur zur epiläsionalen Anwendung. Nicht intravaskulär anwenden.
Eine unbeabsichtigte intravaskuläre Anwendung des Produktes kann lebensbedrohliche thromboembolische Komplikationen und disseminierte intravasale Koagulopathie (DIC) zur Folge haben (siehe Abschnitt «Unerwünschte Wirkungen»).
VeraSeal sollte nur dann als Sprühapplikation angewendet werden, wenn der Sprühabstand exakt beurteilt werden kann, insbesondere während einer Laparoskopie. Der Sprühabstand vom Gewebe muss innerhalb des von der Zulassungsinhaberin von VeraSeal empfohlenen Bereichs liegen (siehe Abschnitt «Hinweise für die Handhabung»).
Bei der Verwendung von Zubehörspitzen mit diesem Produkt sollte die Gebrauchsanweisung der Spitzen befolgt werden.
Vor der Anwendung von VeraSeal ist darauf zu achten, dass Körperteile ausserhalb des gewünschten Anwendungsbereiches ausreichend geschützt (abgedeckt) sind, um eine Anhaftung von Gewebe an unerwünschten Stellen zu vermeiden.
VeraSeal sollte als dünne Schicht (Dicke 1 mm) aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produkts und den Wundheilungsprozess negativ beeinflussen.
Es liegen keine ausreichenden Daten zur Anwendung dieses Produkts bei der Gewebeklebung, in der Neurochirurgie, für die Applikation durch ein flexibles Endoskop zur Behandlung von Blutungen oder bei gastrointestinalen Anastomosen vor.
Überempfindlichkeitsreaktionen
Wie bei jedem Proteinprodukt können Überempfindlichkeitsreaktionen vom Allergietyp auftreten. Zeichen einer Überempfindlichkeit können Nesselsucht, generalisierte Urtikaria, Engegefühl in der Brust, pfeifende Atmung, Hypotonie und Anaphylaxie sein. Bei den ersten Anzeichen dieser Symptome ist die Anwendung sofort abzubrechen. Bei einem Schock ist die übliche medizinische Schockbehandlung einzuleiten.
Übertragbare Erreger
Zu den Standardmassnahmen zur Vermeidung von Infektionen infolge der Verwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt sind, gehören die Auswahl der Spender, die Untersuchung der einzelnen Blutspenden und der Plasmapools hinsichtlich spezifischer Infektionsmarker und die Durchführung wirksamer Schritte während der Herstellung zur Inaktivierung/Entfernung von Viren. Trotz dieser Massnahmen kann die Möglichkeit der Übertragung infektiöser Erreger bei Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt sind, nicht vollständig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu auftretende Viren und andere Pathogene.
Die angewendeten Massnahmen gelten als effektiv gegenüber behüllten Viren, wie z.B. das humane Immundefizienz-Virus (HIV), das Hepatitis-B-Virus und das Hepatitis-C-Virus, sowie gegenüber dem nicht behüllten Hepatitis-A-Virus. Die getroffenen Massnahmen sind bei nicht behüllten Viren, wie dem Parvovirus B19, möglicherweise von begrenzter Wirksamkeit. Infektionen mit Parvovirus B19 können für Schwangere (fetale Infektion) und für Personen mit Immunschwäche oder gesteigerter Erythropoese (z.B. hämolytische Anämie) schwerwiegende Folgen haben.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
InteraktionenEs wurden keine formalen Studien zur Erfassung von Wechselwirkungen durchgeführt. Ähnlich wie vergleichbare Produkte bzw. Thrombinlösungen kann das Produkt durch den Kontakt mit Lösungen, die Alkohol, Jod oder Schwermetalle enthalten (z.B. antiseptische Lösungen), denaturiert werden. Solche Substanzen sollten vor der Anwendung des Produkts weitestgehend entfernt werden.
Schwangerschaft, StillzeitSchwangerschaft
Die Unbedenklichkeit von Fibrinklebern/Hämostatika während der Schwangerschaft wurde nicht in kontrollierten klinischen Studien untersucht. Tierexperimentelle Studien liefern keine ausreichenden Angaben zur Abschätzung der Sicherheit im Hinblick auf Fortpflanzung, embryonale und fötale Entwicklung, den Schwangerschaftsverlauf sowie peri- und postnatale Entwicklung. Daher sollte das Produkt bei schwangeren Frauen nur angewendet werden, wenn dies unbedingt erforderlich ist.
Stillzeit
Die Unbedenklichkeit von Fibrinklebern/Hämostatika während der Stillzeit wurde nicht in kontrollierten klinischen Studien untersucht. Daher sollte das Produkt bei stillenden Frauen nur angewendet werden, wenn dies unbedingt erforderlich ist.
Fertilität
Fertilitätsstudien wurden nicht durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In seltenen Fällen können bei Patienten, die mit Fibrinklebern/Hämostatika behandelt werden, Überempfindlichkeits- oder allergische Reaktionen auftreten (z.B. Angioödeme, Brennen und Stechen an der Applikationsstelle, Bronchospasmus, Schüttelfrost, Flush, generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, Hypotonie, Lethargie, Übelkeit, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen und pfeifende Atmung). In Einzelfällen entwickelten sich diese Reaktionen bis zu einem anaphylaktischen Schock. Derartige Reaktionen können insbesondere bei wiederholter Anwendung oder bei Patienten mit bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Produktes auftreten.
In seltenen Fällen kann es zur Bildung von Antikörpern gegen Bestandteile von Fibrinklebern/Hämostatika kommen.
Eine versehentliche intravaskuläre Injektion kann zu thromboembolischen Ereignissen und disseminierter intravasaler Gerinnung führen. Zudem besteht das Risiko einer anaphylaktischen Reaktion (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Zur Sicherheit im Hinblick auf übertragbare Erreger, siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Tabellarische Aufstellung der Nebenwirkungen
In der nachstehenden Tabelle sind die Nebenwirkungen nach Systemorganklassen und bevorzugtem Begriff gemäss MedDRA-Datenbank aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
·sehr häufig (≥1/10)
·häufig (≥1/100 bis <1/10)
·gelegentlich (≥1/1'000 bis <1/100)
·selten (≥1/10'000 bis <1/1'000)
·sehr selten (<1/10'000)
·nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Häufigkeit von unerwünschten Arzneimittelwirkungen (UAW) in klinischen Studien mit VeraSeal:
|
MedDRA-Systemorganklasse (SOC)
|
Unerwünschte Wirkungen
|
Häufigkeit
| |
Infektionen und parasitäre Erkrankungen
|
Abdominaler Abszess, Zellulitis, Leberabszess, Peritonitis, postoperative Wundinfektion, Wundinfektion, Infektion an der Inzisionsstelle, Infektion nach einem Eingriff
|
Gelegentlich
| |
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
|
Plasmazellmyelom
|
Gelegentlich
| |
Erkrankungen des Blutes und des Lymphsystems
|
Anämie, hämorrhagische Anämie, Leukozytose, Leukopenie
|
Gelegentlich
| |
Erkrankungen des Immunsystems
|
Überempfindlichkeit*
|
Nicht bekannt
| |
Stoffwechsel- und Ernährungsstörungen
|
Hyperglykämie, Hyperkaliämie, Hypokalzämie, Hypoglykämie, Hypokaliämie, Hypomagnesiämie, Hyponatriämie, Hypoproteinämie
|
Gelegentlich
| |
Psychiatrische Erkrankungen
|
Angstzustände, Insomnie
|
Gelegentlich
| |
Erkrankungen des Nervensystems
|
Kopfschmerzen, Somnolenz
|
Gelegentlich
| |
Augenerkrankungen
|
Konjunktivale Reizung
|
Gelegentlich
| |
Herzerkrankungen
|
Vorhofflimmern, ventrikuläre Tachykardie
|
Gelegentlich
| |
Gefässerkrankungen
|
Tiefe Beinvenenthrombose, Hypertonie, Hypotonie
|
Gelegentlich
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
Lungenembolie, Dyspnoe, Hypoxie, Pleuraerguss, Pleuritis, Lungenödem, Giemen, keuchendes Atmen
|
Gelegentlich
| |
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit
|
Häufig
| |
Obstipation, Flatulenz, Ileus, retroperitoneales Hämatom, Erbrechen
|
Gelegentlich
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Pruritus
|
Häufig
| |
Ekchymose, Erythem
|
Gelegentlich
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Rückenschmerzen, Schmerzen in den Extremitäten
|
Gelegentlich
| |
Erkrankungen der Nieren und Harnwege
|
Blasenspasmus, Dysurie, Harnverhaltung
|
Gelegentlich
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Schüttelfrost, Hyperthermie, peripheres Ödem, Schmerzen, Fieber, Hämatom an der Gefässpunktionsstelle
|
Gelegentlich
| |
Untersuchungen
|
Positiver Parvovirus-B19-Test, verlängerte aktivierte partielle Thromboplastinzeit, erhöhte Alanin-Aminotransferase, erhöhte Aspartat-Aminotransferase, erhöhte Bilirubinkonzentration im Blut, erhöhte Glukosekonzentration im Blut, erhöhter INR-Wert, verlängerte Prothrombin-Zeit, erhöhte Transaminasen, verminderte Harnmenge
|
Gelegentlich
| |
Arzneimittelspezifischer Antikörper nachweisbar*
|
Nicht bekannt
| |
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
|
Schmerzen während eines Eingriffs
|
Häufig
| |
Abdominale Wunddehiszenz, Galleleck nach dem Eingriff, Kontusion, Erythem an der Inzisionsstelle, Schmerzen an der Inzisionsstelle, Blutungen nach dem Eingriff, Hypotonie im Rahmen eines Eingriffs, Komplikationen beim Gefässersatz, Thrombose in Gefässersatz, Wundsekretion
|
Gelegentlich
| |
*Alle diese Reaktionen sind Klasseneffekte. Keine davon wurden in klinischen Studien berichtet; somit ist es nicht möglich, Häufigkeiten zu bestimmen.
|
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs sollte nur so viel VeraSeal aufgetragen werden, wie zum Erreichen der Hämostase erforderlich ist, um die Bildung überschüssigen Granulationsgewebes zu vermeiden und die allmähliche Absorption des verfestigten Fibrinklebers zu gewährleisten. Eine zu dicke Schicht kann den Wundheilungsprozess negativ beeinflussen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen», «Vorsichtsmassnahmen für die Anwendung»).
Eigenschaften/WirkungenATC-Code
B02BC
Wirkungsmechanismus/Pharmakodynamik
Das Fibrinadhäsionssystem leitet die letzte Phase der physiologischen Blutgerinnung ein. Die Umwandlung von Fibrinogen zu Fibrin erfolgt durch die Aufspaltung von Fibrinogen in Fibrinmonomere und Fibrinopeptide. Die Fibrinmonomere aggregieren und bilden einen Fibrinpfropf. Faktor XIIIa, der durch Aktivierung mit Thrombin aus Faktor XIII gebildet wird, bewirkt eine Vernetzung von Fibrin. Sowohl für die Umwandlung von Fibrinogen als auch die Vernetzung von Fibrin sind Calciumionen erforderlich.
Mit fortschreitender Wundheilung kommt es durch die Einwirkung von Plasmin zu einer gesteigerten fibrinolytischen Aktivität und zum Zerfall von Fibrin zu Fibrinabbauprodukten.
Klinische Wirksamkeit
Drei randomisierte, einfach verblindete klinische Studien mit VeraSeal zum Nachweis der Hämostase und Nahtunterstützung in der Gefässchirurgie wurden mit Patienten durchgeführt, die sich einer vaskulären, parenchymatösen Gewebe- oder Weichgewebsoperation unterzogen. In jede dieser drei klinischen Studien wurde eine bestimmte Operationsart einbezogen und es wurden hauptsächlich erwachsene Probanden rekrutiert.
Primärer Wirksamkeitsendpunkt war in allen drei Studien der Anteil der Patienten, bei denen innerhalb von 4 Minuten nach der Applikation des Arzneimittels (T4) die Hämostase an der Zielblutungsstelle erreicht wurde, ohne erneute Blutung bis zum Abschluss des chirurgischen Verschlusses innert eines 10-minütigen Beobachtungszeitraums. Während der ersten 4 Minuten der Hämostasebeurteilung war die wiederholte Applikation des Arzneimittels zulässig, danach wurden anhaltende sowie erneute Blutungen als Therapieversagen bewertet.
Während der Gefässchirurgie-Studie wurden 225 Patienten aufgenommen, die sich gefässchirurgischen Eingriffen unterzogen, unter Verwendung von Polytetrafluorethylen-Transplantatmaterial bei einer arteriellen End-zu-Seit-Anastomose oder einer arteriellen Anastomose mit Gefässzugang an einer oberen Extremität. Das mittlere Alter der Studienpopulation und ihre Standardabweichung betrug 63,2 (9,5) Jahre. Die häufigsten Arten der Operation waren femoropoplitealer Bypass, Gefässzugang für die Hämodialyse über die oberen Extremitäten und iliofemoraler Bypass. Dabei erwies sich VeraSeal beim Erreichen der Hämostase innerhalb von 4 Minuten als gegenüber der Kontrollgruppe (manuelle Kompression) überlegen. Der Anteil der Patienten mit innerhalb von 4 Minuten erreichter Hämostase an der Zielblutungsstelle betrug 76,1 % in der VeraSeal-Behandlungsgruppe und 22,8 % in der Kontrollgruppe.
Während der parenchymatösen Gefässchirurgie-Studie wurden 325 Patienten aufgenommen, die sich Leberresektionen unterzogen. Das mittlere Alter der Studienpopulation und ihre Standardabweichung betrug 57,9 (14,5) Jahre. Dabei erwies sich VeraSeal beim Erreichen der Hämostase innerhalb von 4 Minuten als gegenüber der Kontrollgruppe (oxidierte regenerierte Cellulose) überlegen. Der Anteil der Patienten mit innerhalb von 4 Minuten erreichter Hämostase an der Zielblutungsstelle betrug 92,8 % in der VeraSeal-Behandlungsgruppe und 80,5 % in der Kontrollgruppe.
Während der Weichgewebsoperations-Studie wurden 327 Patienten aufgenommen, die sich Operationen im Becken und Retroperitoneum sowie Abdominoplastiken und Mastopexien unterzogen. Das mittlere Alter der Studienpopulation und ihre Standardabweichung betrug 47,2 (18,4) Jahre. Die häufigsten Arten der Operation waren einfache oder radikale Hysterektomien, Abdominoplastiken und radikale Zystektomien. Dabei erwies sich VeraSeal beim Erreichen der Hämostase innerhalb von 4 Minuten als gegenüber der Kontrollgruppe (oxidierte regenerierte Cellulose) nicht unterlegen. Der Anteil der Patienten mit innerhalb von 4 Minuten erreichter Hämostase an der Zielblutungsstelle betrug 82,8 % in der VeraSeal-Behandlungsgruppe und 77,8 % in der Kontrollgruppe.
Pädiatrie
Bei Kindern und Jugendlichen wurde eine randomisierte, aktiv kontrollierte, einfach verblindete klinische Studie zur Untersuchung der Sicherheit und Wirksamkeit von VeraSeal als Unterstützung der Hämostase bei offenen parenchymatösen (Leber-)Operationen oder Weichgewebsoperationen durchgeführt. Insgesamt wurden 178 Kinder und Jugendliche (< 18 Jahre) randomisiert und mit VeraSeal (n=91) oder aktiver Kontrolle (N=87) behandelt. Von den 91 Probanden, die mit VeraSeal behandelt wurden, waren 4 ≤27 Tage alt, 19 waren ≥28 Tage bis ≤23 Monate alt, 32 waren ≥2 Jahre bis ≤11 Jahre alt und 36 waren ≥12 Jahre bis ≤17 Jahre alt. Von den mit VeraSeal behandelten Kindern und Jugendlichen wurden 46 parenchymatösen (Leber-)Operationen unterzogen und 45 hatten Weichgewebsoperationen. VeraSeal erwies sich gegenüber der Kontrollgruppe (EVICEL [Fibrinkleber]) in Bezug auf das Erreichen der Hämostase innerhalb von 4 Minuten als nicht unterlegen. Der Anteil der Patienten mit innerhalb von 4 Minuten erreichter Hämostase an der Zielblutungsstelle betrug 96,7 % (88/91 Probanden) in der VeraSeal-Behandlungsgruppe und 95,4 % (83/87) in der Kontrollgruppe.
Zusätzlich wurden in den drei zuvor beschriebenen klinischen Studien, in denen VeraSeal hauptsächlich an erwachsenen Probanden bei einer bestimmten Operationsart angewendet wurde, auch 11 pädiatrische Patienten behandelt. Von diesen 11 Patienten waren 5 jünger als 2 Jahre alt, 5 waren Kinder im Alter zwischen 2 und 11 Jahren, 1 war ein Jugendlicher im Alter von 15 Jahren. Nur der Jugendliche wurde bei der Beurteilung der Wirksamkeit berücksichtigt.
PharmakokinetikAbsorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
VeraSeal ist nur zur epiläsionalen Anwendung bestimmt. Eine intravaskuläre Anwendung ist kontraindiziert. Demzufolge wurden keine intravaskulären pharmakokinetischen Studien am Menschen durchgeführt.
Fibrinkleber/Hämostatika werden auf die gleiche Weise wie endogenes Fibrin durch Fibrinolyse und Phagozytose metabolisiert.
Präklinische DatenEs wurden keine konventionellen Studien zur Toxizität und Sicherheitspharmakologie mit VeraSeal durchgeführt. Nagerstudien zur akuten Toxizität mit intravenös verabreichtem Fibrinogen lassen keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Da keine Inkompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Nach dem Auftauen kann das ungeöffnete Produkt in der Originalverpackung bis zur Anwendung für maximal 7 Tage bei 2 – 8 °C oder für bis zu 24 Stunden bei maximal 25 °C gelagert werden.
Haltbarkeit nach Anbruch
Sobald die Blisterpackung geöffnet wurde, muss VeraSeal sofort verwendet werden.
Besondere Lagerungshinweise
Tiefgekühlt (bei ≤ -18 °C) lagern und transportieren. Die Kühlkette (≤ -18 °C) darf bis zur Anwendung nicht unterbrochen werden. Die sterilisierte Blisterpackung im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Vor der Anwendung vollständig auftauen. Nach dem Auftauen nicht wieder einfrieren. Für Aufbewahrungsbedingungen nach dem Auftauen und für die Aufbewahrung nach Anbruch, siehe Abschnitt «Haltbarkeit».
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
In der Verpackung ist ein Zweifach-Applikator mit zwei zusätzlichen luftlosen Sprühspitzen zur Sprüh- oder Tropfapplikation beigefügt. Die luftlosen Sprühspitzen sind röntgensichtbar. Siehe Abbildung 1.
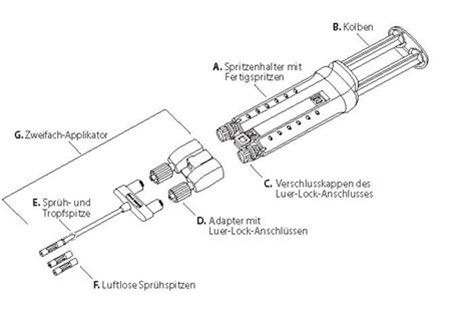
Abbildung 1
Eine Übersicht über die Auftaumethoden und die Lagerung nach dem Auftauen ist in Tabelle 2 gezeigt.
Tabelle 2. Auftauen und Lagerung nach dem Auftauen
|
Auftaumethode
|
Auftauzeit nach Packungsgrösse
|
Lagerung nach dem Auftauen
| |
Für 2 ml und 4 ml
|
Für 6 ml und 10 ml
| |
Kühlschrank
(2 – 8 °C)
|
Mindestens 7 Stunden
|
Mindestens 10 Stunden
|
7 Tage bei 2 – 8 °C (im Kühlschrank) in der Originalverpackung
ODER
24 Stunden bei maximal 25 °C in der Originalverpackung
| |
Auftauen bei 20 – 25 ºC
|
Mindestens 70 Minuten
|
Mindestens 90 Minuten
| |
Steriles Wasserbad (37 °C) im Sterilbereich
|
Mindestens 5 Minuten. Nicht länger als 10 Minuten.
|
Mindestens 5 Minuten. Nicht länger als 10 Minuten.
|
Sofort bei der Operation verwenden
|
Bevorzugte Auftaumethoden
Auftauen im Kühlschrank
1. Packung aus dem Gefrierschrank nehmen und zum Auftauen bei 2 – 8 °C in den Kühlschrank stellen,
mindestens 7 Stunden für die 2-ml- und 4-ml-Packungsgrösse,
mindestens 10 Stunden für die 6-ml- und 10-ml-Packungsgrösse.
Nach dem Auftauen ist eine Erwärmung des Produkts zur Anwendung nicht erforderlich.
Nach dem Auftauen müssen die Lösungen klar bis leicht opaleszent und farblos bis leicht gelblich sein. Lösungen, die trüb sind oder Ablagerungen enthalten, dürfen nicht verwendet werden.
Auftauen bei 20 – 25 °C
Packung aus dem Gefrierschrank nehmen, öffnen und die beiden Blisterpackungen entnehmen.
Die Blisterpackung mit dem Zweifach-Applikator bei 20 – 25 °C auf einer Oberfläche liegen lassen, bis der Fibrinkleber einsatzbereit ist.
Die Blisterpackung mit den VeraSeal-Fertigspritzen bei 20 – 25 °C auftauen lassen. Dazu sind folgende Schritte durchzuführen:
1. Die Blisterpackung mit dem Spritzenhalter und den Fertigspritzen bei 20 – 25 °C auf einer Oberfläche liegen lassen,
mindestens 70 Minuten für die 2-ml- und 4-ml-Packungsgrösse,
mindestens 90 Minuten für die 6-ml- und 10-ml-Packungsgrösse.
Nach dem Auftauen ist eine Erwärmung des Produkts zur Anwendung nicht erforderlich.
Nach dem Auftauen müssen die Lösungen klar bis leicht opaleszent und farblos bis leicht gelblich sein. Lösungen, die trüb sind oder Ablagerungen enthalten, dürfen nicht verwendet werden.
Lagerung nach dem Auftauen
Nach dem Auftauen kann das Set mit dem VeraSeal-Spritzenhalter, den Fertigspritzen und dem Zweifach-Applikator in der ungeöffneten Originalverpackung bis zur Anwendung für maximal 7 Tage im Kühlschrank bei 2 – 8 °C oder für 24 Stunden bei maximal 25 °C gelagert werden. Sobald die Blisterpackungen geöffnet wurden, muss VeraSeal sofort verwendet werden; etwaige nicht verwendete Reste sind zu entsorgen.
Nach dem Auftauen nicht mehr einfrieren!
Anweisungen für den Transfer
1. Nach dem Auftauen die Blisterpackung von der Oberfläche bei 20 – 25 °C oder aus dem Kühlschrank bei 2 – 8 °C nehmen.
2. Öffnen Sie die Blisterpackung und vergewissern Sie sich, dass die VeraSeal-Fertigspritzen vollständig aufgetaut sind. Den VeraSeal-Spritzenhalter mit den Fertigspritzen einer zweiten Person zum Transfer in den Sterilbereich übergeben. Die Aussenseite der Blisterpackung darf nicht mit dem Sterilbereich in Kontakt kommen. Siehe Abbildung 2.
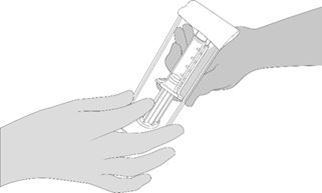
Abbildung 2
Steriles Wasserbad (schnelles Auftauen)
Packung aus dem Gefrierschrank nehmen, öffnen und die beiden Blisterpackungen entnehmen.
Die Blisterpackung mit dem Zweifach-Applikator bei 20 – 25 °C auf einer Oberfläche liegen lassen, bis der Fibrinkleber einsatzbereit ist.
Die VeraSeal Fertigspritzen innerhalb des Sterilbereichs in einem sterilen thermostatischen Wasserbad bei einer Temperatur von 37 ± 2 °C auftauen. Dazu sind folgende Schritte durchzuführen:
HINWEIS: Sobald die VeraSeal-Blisterpackungen geöffnet sind, ist das Produkt sofort zu verwenden. Es ist eine sterile Technik anzuwenden, um die Möglichkeit einer Kontamination durch unsachgemässe Handhabung zu vermeiden. Dabei sind die nachfolgend genannten Schritte genau einzuhalten. Die Luer-Kappe erst von der Spritze entfernen, wenn diese vollständig aufgetaut ist und der Zweifach-Applikator angebracht werden kann.
1. Die Blisterpackung öffnen und den VeraSeal-Spritzenhalter mit den Fertigspritzen einer zweiten Person zum Transfer in den Sterilbereich übergeben. Die Aussenseite der Blisterpackung darf nicht mit dem Sterilbereich in Kontakt kommen. Siehe Abbildung 2.
2. Legen Sie den Spritzenhalter mit den Fertigspritzen direkt in das sterile Wasserbad und stellen Sie sicher, dass sie vollständig von Wasser bedeckt sind. Siehe Abbildung 3.
3. Bei 37 °C sind für die Packungsgrössen 2 ml, 4 ml, 6 ml und 10 ml etwa 5 Minuten erforderlich und sie dürfen dieser Temperatur nicht länger als 10 Minuten ausgesetzt sein.
Die Temperatur des Wasserbades darf 39 °C nicht überschreiten.
4. Spitzenhalter mit den Fertigspritzen nach dem Auftauen mit steriler chirurgischer Gaze abtrocknen.
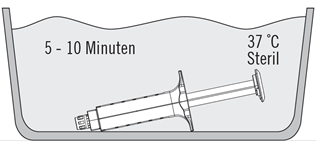
Abbildung 3
Vergewissern Sie sich, dass die VeraSeal-Fertigspritzen vollständig aufgetaut sind.
Nach dem Auftauen müssen die Lösungen klar bis leicht opaleszent und farblos bis leicht gelblich sein. Lösungen, die trüb sind oder Ablagerungen enthalten, dürfen nicht verwendet werden.
VeraSeal sofort verwenden und nicht verwendete Reste entsorgen.
Anweisungen für den Anschluss
1. Die Blisterpackung öffnen und den VeraSeal-Zweifach-Applikator sowie die zwei zusätzlichen luftlosen Sprühspitzen einer zweiten Person zum Transfer in den Sterilbereich übergeben. Die Aussenseite der Blisterpackung darf nicht mit dem Sterilbereich in Kontakt kommen.
2. VeraSeal-Spritzenhalter so halten, dass die Luer-Kappen mit der Spritze nach oben weisen. Siehe Abbildung 4.
3. Luer-Kappen der Fibrinogen- und der Thrombin-Spritze abschrauben und entsorgen. Siehe Abbildung 4.
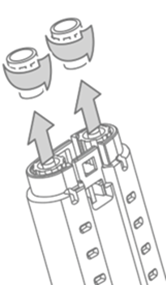
Abbildung 4
4. Spritzenhalter so halten, dass die Luer-Anschlüsse nach oben weisen. Zum Entfernen von Luftblasen aus den Spritzen den Spritzenhalter senkrecht halten und vorsichtig ein oder zwei Mal gegen den Spritzenhalter klopfen und den Kolben leicht hineindrücken, um Luft herauszudrücken. Siehe Abbildung 5.
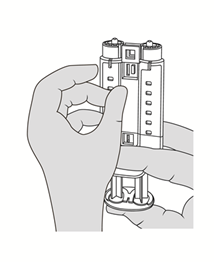
Abbildung 5
5. Zweifach-Applikator anbringen. Siehe Abbildung 6.
HINWEIS: Den Kolben beim Anbringen oder vor der vorgesehenen Anwendung nicht hineindrücken, da sich die zwei biologischen Komponenten sonst vorher in der luftlosen Sprühspitze vermischen und ein Fibringerinnsel bilden, das die Applikation verhindert. Siehe Abbildung 7.

Abbildung 6
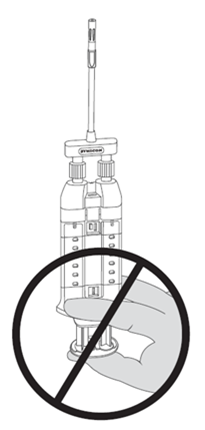
Abbildung 7
6. Luer-Anschlüsse festziehen und sicherstellen, dass der Zweifach-Applikator fest angebracht ist. Das Produkt ist nun für die Anwendung bereit.
Applikation
VeraSeal mithilfe des mitgelieferten Spritzenhalters und des Kolbens applizieren.
VeraSeal muss mithilfe des mit dem Produkt mitgelieferten Zweifach-Applikators appliziert werden. Andere Applikatorspitzen mit CE-Kennzeichnung (einschliesslich Vorrichtungen für offene und laparoskopische Verfahren), die speziell für die Anwendung mit VeraSeal vorgesehen sind, können ebenfalls verwendet werden. Bei Verwendung des mitgelieferten Zweifach-Applikators sind die oben beschriebenen Anschlussanweisungen zu befolgen. Bei der Verwendung anderer Applikatorspitzen müssen die Gebrauchsanleitungen für diese Applikatorspitzen befolgt werden.
Sprühanwendung
1. Zweifach-Applikator fassen und in die gewünschte Position biegen. Die Spitze behält ihre Form bei.
2. Die luftlose Sprühspitze in mindestens 2 cm Abstand vom Zielgewebe positionieren. Zum Aufsprühen des Fibrinklebers einen gleichmässigen, festen Druck auf den Kolben ausüben. Abstand entsprechend vergrössern, um die gewünschte Abdeckung des Zielbereichs zu erreichen.
3. Wenn die Sprühanwendung aus irgendeinem Grund abgebrochen wird, die luftlose Sprühspitze vor der weiteren Anwendung wechseln, da sich in der luftlosen Sprühspitze ein Gerinnsel bilden kann. Zum Wechseln der luftlosen Sprühspitze, das Sprühgerät vom Patienten entfernen und die gebrauchte luftlose Sprühspitze abschrauben. Siehe Abbildung 8. Die gebrauchte luftlose Sprühspitze von den Reserve-Sprühspitzen getrennt halten. Das Ende des Applikators mit trockener oder feuchter steriler chirurgischer Gaze abwischen. Dann eine neue luftlose Sprühspitze aus der Packung anbringen und vor der Anwendung prüfen, ob sie fest angebracht ist.
HINWEIS: Wenn die luftlose Sprühspitze richtig angebracht ist, ist kein roter Ring sichtbar. Siehe Abbildung 9.
HINWEIS: Drücken Sie den Kolben nicht weiter hinein, um ein Fibringerinnsel in der luftlosen Sprühspitze zu beseitigen, da der Applikator sonst unbrauchbar werden kann.
HINWEIS: Den Zweifach-Applikator nicht kürzen, damit der Innendraht nicht freigelegt wird.
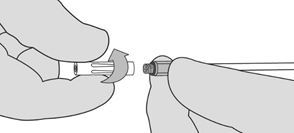
Abbildung 8
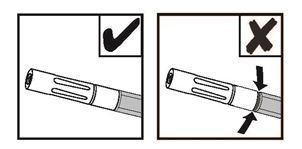
Abbildung 9
Tropfanwendung
1. Die luftlose Sprühspitze von der Sprüh- und Tropfspitze durch Abschrauben der luftlosen Sprühspitze entfernen. Siehe Abbildung 8.
2. Tropfspitze fassen und in die gewünschte Position biegen. Die Spitze behält ihre Form bei.
3. Das Ende der Tropfspitze während des Auftropfens so nahe wie möglich an die Gewebeoberfläche heranführen, ohne das Gewebe während der Applikation zu berühren.
4. Die Tropfen einzeln auf die zu behandelnde Oberfläche applizieren. Zur Prävention einer unkontrollierten Gerinnung achten Sie darauf, dass die Tropfen sich voneinander und von der Tropfspitze trennen.
HINWEIS: Schliessen Sie eine gebrauchte Tropfspitze nicht wieder an, nachdem sie vom Adapter entfernt wurde, da sich sonst ein Gerinnsel in der Tropfspitze bilden kann und der Applikator unbrauchbar werden kann.
Entsorgung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer67975 (Swissmedic).
PackungenPackung mit einem Set für den Einmalgebrauch mit zwei auf einen Spritzenhalter montierten Fertigspritzen (Glas Typ I) mit Gummistopfen, jeweils mit einer sterilen gefrorenen Lösung.
·VeraSeal 2 ml (enthält 1 ml Fibrinogen vom Menschen und 1 ml Thrombin vom Menschen) (B).
·VeraSeal 4 ml (enthält 2 ml Fibrinogen vom Menschen und 2 ml Thrombin vom Menschen) (B).
·VeraSeal 6 ml (enthält 3 ml Fibrinogen vom Menschen und 3 ml Thrombin vom Menschen) (B).
·VeraSeal 10 ml (enthält 5 ml Fibrinogen vom Menschen und 5 ml Thrombin vom Menschen) (B).
ZulassungsinhaberinJanssen-Cilag AG, Zug, ZG.
Stand der InformationAugust 2024
|









