ZusammensetzungWirkstoffe
Metamizolum natricum monohydricum.
Hilfsstoffe
1 ml Lösung zum Einnehmen enthält: Natrii dihydrogenoposphas dihydricus (E339), Dinatrii phophas anhydricus (E339), Aqua purificata.
1 ml Lösung zum Einnehmen enthält 33.9 mg Natrium.
Indikationen/Anwendungsmöglichkeiten·Starke Schmerzen, bei denen andere Nicht-Opioid-Analgetika unwirksam oder kontraindiziert sind.
·Hohes Fieber, das auf andere medikamentöse Massnahmen nicht anspricht.
Dosierung/AnwendungDie Dosierung und Anwendung hängen von der gewünschten analgetischen Wirkung und vom Zustand des Patienten ab. In vielen Fällen kann mit einer oralen Verabreichung eine genügende Analgesie erreicht werden.
Erwachsene und Kinder ab 15 Jahre oder > 53 kg Körpergewicht
Die übliche Einzeldosis für die orale Anwendung beträgt 500–1'000 mg, die Tagesdosis beträgt 1'000 bis 3'000 (max. 4'000) mg, aufgeteilt in 3 - 4 Gaben/24 Stunden: d.h. eine Einzeldosis von 1 - 2 ml Lösung und eine maximale Tagesdosis von 4 × 2 ml Lösung.
Kinder < 15 Jahre oder bis 53 kg Körpergewicht
Minalgin, Lösung zum Einnehmen mit oraler Dosierspritze, ist nicht für Kinder < 15 Jahren und nicht für Kinder bis einschliesslich 53 kg Körpergewicht bestimmt, da die orale Dosierspritze nicht zum Abmessen von pädiatrischen Dosierungen vorgesehen ist. Für Kinder < 15 Jahren oder bis 53 kg Körpergewicht steht zur oralen Einnahme das Präparat Minalgin, Tropfen zur Verfügung.
Nieren- und Leberinsuffizienz
Bei Nieren- oder Leberinsuffizienz wird empfohlen, hohe Metamizoldosen zu vermeiden, da die Elimination in diesen Fällen reduziert ist. Jedoch ist für die Kurzzeitbehandlung keine Dosisreduktion notwendig. Für die Langzeitbehandlung von Patienten mit Nieren- und Leberinsuffizienz liegen keine Erfahrungen vor.
Ältere Patienten / Schlechter Gesundheitszustand
Bei älteren Patienten und Patienten mit schlechtem Allgemeinzustand muss eine mögliche Verschlechterung der Nieren- und Leberfunktion in Betracht gezogen werden.
Art der Anwendung
Für die Dosierung ist der Packung eine orale Dosierspritze beigefügt. Sie enthält eine Graduierung in Milliliter (ml). Die gewünschte Dosis ist mit der oralen Dosierspritze aufzuziehen.
Minalgin, Lösung zum Einnehmen darf ausschliesslich mit der beigelegten oralen Dosierspritze verwendet werden. Das Abzählen von Tropfen ist nicht möglich und führt zu Dosierfehlern.
Angaben zur korrekten Handhabung von Minalgin, Lösung zum Einnehmen befinden sich unter «Sonstige Hinweise».
KontraindikationenMinalgin, Lösung zum Einnehmen darf nicht angewendet werden bei
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung;
·Allergie auf andere Pyrazolone (z.B. Phenazon, Propyphenazon) oder Pyrazolidine (z.B. Phenylbutazon) sowie z.B. schweren Hautreaktionen (SCARs) nach Einnahme solcher Wirkstoffe;
·Agranulozytose in der Anamnese, die durch Metamizol, andere Pyrazolone oder Pyrazolidine ausgelöst wurde;
·Bronchospasmus oder sonstigen anaphylaktoiden Reaktionen (z.B. Urtikaria, Rhinitis, Angioödem) nach Einnahme von Analgetika, z.B. Salicylaten, Paracetamol, Diclofenac, Ibuprofen, Indometacin und Naproxen;
·eingeschränkter Knochenmarksfunktion oder Blutbildungsstörungen;
·hepatischer Porphyrie;
·Mangel an Glukose-6-phosphat-Dehydrogenase;
·Kinder < 15 Jahren oder Kinder und Jugendliche bis einschliesslich 53 kg Körpergewicht, da sich die orale Dosierspritze nicht zum Aufziehen von pädiatrischen Dosierungen eignet;
·Schwangerschaft und Stillzeit: Siehe «Schwangerschaft, Stillzeit».
Warnhinweise und VorsichtsmassnahmenBei schwerer Leber- oder Niereninsuffizienz wird von der Anwendung abgeraten, da in diesen Situationen nicht ausreichende Erfahrungen bestehen.
Wesentliche unerwünschte Wirkungen von Minalgin, Lösung zum Einnehmen beruhen auf Überempfindlichkeitsreaktionen.
Agranulozytose
Die Behandlung mit Metamizol kann eine Agranulozytose auslösen, die tödlich verlaufen kann (siehe «Unerwünschte Wirkungen»). Sie kann auch auftreten, wenn Metamizol früher ohne Komplikationen angewendet wurde.
Eine durch Metamizol ausgelöste Agranulozytose ist eine idiosynkratische Nebenwirkung. Sie ist nicht dosisabhängig und kann jederzeit während der Behandlung oder auch noch kurz nach deren Absetzen auftreten.
Patienten müssen angewiesen werden, ihre Behandlung abzubrechen und sofort einen Arzt aufzusuchen, falls Symptome auftreten, die auf eine Agranulozytose hinweisen (z.B. Fieber, Schüttelfrost, Halsschmerzen und schmerzhafte Schleimhautveränderungen, insbesondere im Mund-, Nasen-, Rachenbereich- oder Genital- oder Analbereich).
Wenn Metamizol gegen Fieber eingenommen wird, können einige Symptome einer neu auftretenden Agranulozytose unbemerkt bleiben. Ebenso können die Symptome bei Patienten, die eine Antibiotikabehandlung erhalten, verschleiert werden.
Bei Auftreten von Anzeichen und Symptomen, die auf eine Agranulozytose hinweisen, ist sofort ein vollständiges Blutbild (einschliesslich Differentialblutbild) zu erstellen und die Behandlung muss unterbrochen werden, bis die Testergebnisse vorliegen. Wenn eine Agranulozytose bestätigt wird, darf die Behandlung nicht wieder aufgenommen werden (siehe «Kontraindikationen»).
Interaktion mit Methotrexat
Die Einnahme von Metamizol zusammen mit Methotrexat sollte vermieden werden, da eine Wechselwirkung auftreten kann. (siehe «Interaktionen»).
Panzytopenie
Beim Auftreten einer Panzytopenie muss die Behandlung sofort abgebrochen und das vollständige Blutbild so lange kontrolliert werden, bis es zu einer Normalisierung der Werte kommt.
Alle Patienten, die mit Metamizol behandelt werden, sind anzuweisen, unverzüglich einen Arzt bzw. eine Ärztin aufzusuchen, wenn sie Anzeichen und Symptome entwickeln, die auf eine Blut-Dyskrasie hinweisen, z.B. allgemeines Krankheitsgefühl, Infektionszeichen, andauerndes Fieber, Hämatome, Blutungen oder Blässe.
Anaphylaktischer Schock
Diese Reaktion tritt hauptsächlich bei empfindlichen Patienten auf. Daher ist Metamizol bei Patienten, die unter Asthma leiden oder atopische Manifestationen aufweisen, mit Vorsicht zu verordnen (siehe «Kontraindikationen»).
Bei Auftreten eines anaphylaktischen Schocks muss eine antiallergische Behandlung im Rahmen einer Notfallsintervention eingeleitet werden (Schocklage, eventuell Adrenalin s.c. oder auch i.v., Antiasthmatika, Kortikosteroide, usw.). Die Verabreichung von Minalgin, Lösung zum Einnehmen muss sofort und dauerhaft eingestellt werden. Das Gleiche gilt für die Verabreichung aller anderen Pyrazolone/Pyrazolidine.
Anaphylaktische/anaphylaktoide Reaktionen
Bei der Wahl der Art der Verabreichung muss in Betracht gezogen werden, dass die parenterale Verabreichung von Metamizol mit einem erhöhten Risiko von anaphylaktischen/anaphylaktoiden Reaktionen verbunden ist.
Folgende Patienten sind hinsichtlich eventuell schwerer anaphylaktoider Reaktionen auf Metamizol besonders gefährdet (siehe «Kontraindikationen»):
·Patienten mit Asthma bronchiale, insbesondere bei gleichzeitiger Rhinosinusitis polyposa;
·Patienten mit chronischer Urtikaria;
·Patienten mit Alkoholunverträglichkeit;
·Patienten mit Unverträglichkeit gegenüber Farb- (z.B. Tartrazine) und Konservierungsstoffen.
Schwere Hautreaktionen
Schwere kutane Nebenwirkungen (SCARs), einschliesslich Stevens-Johnson-Syndrom (SJS), toxischer-epidermaler Nekrolyse (TEN) und Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), die lebensbedrohlich oder tödlich sein können, wurden im Zusammenhang mit der Metamizolbehandlung berichtet.
Die Patienten sind über die Anzeichen und Symptome zu informieren und engmaschig auf Hautreaktionen zu überwachen.
Wenn Anzeichen und Symptome auftreten, die auf diese Reaktionen hinweisen, sollte Metamizol sofort abgesetzt werden, und die Behandlung mit Metamizol darf zu keinem Zeitpunkt erneut begonnen werden (siehe «Kontraindikationen»).
Die Patienten müssen auf diese Anzeichen und Symptome hingewiesen und engmaschig überwacht werden, v.a. in den ersten Wochen der Behandlung.
Isolierte hypotensive Reaktionen
Die Verabreichung von Metamizol kann vereinzelt hypotensive Reaktionen auslösen (siehe «Unerwünschte Wirkungen»). Diese Reaktionen sind möglicherweise dosisabhängig und treten eher nach einer parenteralen Verabreichung auf.
Um schwere hypotensive Reaktionen dieser Art zu vermeiden, sind folgende Massnahmen zu ergreifen:
·Optimierung des hämodynamischen Status bei Patienten mit vorbestehender Hypotonie mit Volumenmangel, Dehydratation, instabilem Kreislauf oder beginnendem Kreislaufversagen;
·Vorsicht bei Patienten mit hohem Fieber.
Bei diesen Patienten muss die Indikationsstellung für Metamizol mit besonderer Vorsicht erfolgen. Eine medizinische Überwachung ist erforderlich. Um das Risiko einer hypotensiven Reaktion zu vermindern, können Präventionsmassnahmen (zur Stabilisierung des Herz-Kreislauf-Zustands) notwendig sein.
Bei Patienten, bei denen ein Blutdruckabfall unbedingt vermieden werden muss (z.B. bei schwerer koronarer Herzkrankheit oder relevanten Stenosen der Blutgefässe, die das ZNS versorgen), darf Metamizol nur unter strikter hämodynamischer Überwachung verabreicht werden.
Bei Nieren- oder Leberinsuffizienz wird empfohlen, keine hohen Metamizoldosen zu verabreichen.
Arzneimittelbedingte Leberschädigungen
Bei mit Metamizol behandelten Patienten wurden Fälle einer überwiegend hepatozellulären akuten Hepatitis berichtet, wobei die Erkrankung innerhalb von Tagen bis Monaten nach Beginn der Therapie einsetzte. Zu den Anzeichen und Symptomen gehören erhöhte Leberenzyme im Serum mit oder ohne Ikterus, oft im Zusammenhang mit anderen arzneimittelbedingten Überempfindlichkeitsreaktionen (z.B. Hautausschlag, Blut-Dyskrasie, Fieber und Eosinophilie) oder mit Merkmalen einer Autoimmunhepatitis. Die meisten Patienten erholten sich nach Absetzen von Metamizol. In Einzelfällen wurde jedoch über eine Progression zu akutem Leberversagen berichtet, welches eine Lebertransplantation erforderte.
Der Mechanismus der durch Metamizol verursachten Leberschädigung ist nicht eindeutig geklärt. Die Daten weisen jedoch auf einen immunallergischen Mechanismus hin.
Die Patienten sollten darauf hingewiesen werden, ihren Arzt bzw. ihre Ärztin zu kontaktieren, falls sie Symptome bemerken, die auf eine Leberschädigung hindeuten. Bei diesen Patienten sollte Metamizol abgesetzt und die Leberfunktion überprüft werden.
Bei Patienten, bei denen während der Metamizol-Therapie eine Episode mit Leberschädigung aufgetreten ist, für die keine andere Ursache festgestellt wurde, darf die Behandlung mit Metamizol nicht wieder aufgenommen werden.
Dieses Arzneimittel enthält 33.9 mg Natrium pro ml: Tagesdosen von 1000 bis maximal 4000 mg Metamizol entsprechen 67.8-271.1 mg Natrium, i.e. 3.4-13.6 % der von der WHO bei einem Erwachsenen für die tägliche Natriumaufnahme mit der Nahrung als maximal empfohlene Menge (2 g).
InteraktionenMethotrexat
Bei gleichzeitiger Behandlung mit Metamizol und Methotrexat kann die Hämatotoxizität von Methotrexat insbesondere bei älteren Patienten ansteigen. Daher sollte diese Arzneimittelkombination vermieden werden.
Acetylsalicylsäure (Aspirin)
Die gleichzeitige Einnahme von Metamizol und Acetylsalicylsäure kann den thrombozytenaggregationshemmenden Effekt von Acetylsalicylsäure abschwächen. Daher ist diese Kombination bei Patienten, die aufgrund der herzschützenden Wirkung mit niedrigdosierter Acetylsalicylsäure behandelt werden, mit Vorsicht zu betrachten.
Pharmakokinetische Induktion metabolisierender Enzyme
Metamizol kann metabolisierende Enzyme, insbesondere CYP2B6 und CYP3A4, induzieren.
Die gleichzeitige Verabreichung von Metamizol mit Bupropion, Efavirenz, Methadon, Valproat, Cyclosporin, Tacrolimus oder Sertralin kann zu einer Reduktion der Plasmakonzentrationen dieser Arzneimittel und einer potenziellen Abnahme der klinischen Wirksamkeit führen. Daher ist bei gleichzeitiger Verabreichung von Metamizol Vorsicht angezeigt; das klinische Ansprechen und/oder die Arzneimittelspiegel müssen angemessen überwacht werden.
Bei Patienten, die Metamizol einnehmen, wurde über eine Interferenz mit Labortests berichtet, die auf der Trinder-Reaktion bzw./ auf Trinder-ähnliche Reaktionen basieren (z.B. Tests zur Messung der Serumspiegel von Kreatinin, Triglyceriden, HDL-Cholesterin und Harnsäure).
Schwangerschaft, StillzeitSchwangerschaft
Reproduktionsstudien bei Tieren haben keine Hinweise für ein fetales Risiko ergeben; man verfügt aber über keine kontrollierten Studien bei schwangeren Frauen. Minalgin, Lösung zum Einnehmen soll deshalb während des ersten Trimenons nicht angewendet werden. Im zweiten Trimemon soll Minalgin, Lösung zum Einnehmen nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich.
Obwohl Metamizol ein schwacher Inhibitor der Prostaglandinsynthese ist, ist die Anwendung von Minalgin, Lösung zum Einnehmen während des letzten Trimenons der Schwangerschaft kontraindiziert, da das Risiko eines vorzeitigen Verschlusses des Ductus arteriosus Botalli besteht und perinatale Komplikationen infolge einer Verschlechterung der maternellen und neonatalen Thrombozytenaggregation nicht ausgeschlossen werden können.
Stillzeit
Metamizol-Metaboliten gelangen in die Muttermilch. Minalgin, Lösung zum Einnehmen soll deshalb in der Stillperiode nicht angewendet werden. Bis zu 48 Stunden nach Verabreichung von Minalgin, Lösung zum Einnehmen darf nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen!
Unerwünschte WirkungenDie unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000), «nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Erkrankungen des Blutes und des Lymphsystems
Selten (≥1/10'000, <1/1000): Leukopenie.
Sehr selten (<1/10'000): Agranulozytose (siehe «Warnhinweise und Vorsichtsmassnahmen»), einschliesslich Fälle mit tödlichem Ausgang, Thrombozytopenie.
Nicht bekannt: aplastische Anämie, Panzytopenie einschliesslich Fälle mit tödlichem Ausgang.
Sehr seltene Thrombozytopenie (Reduzierung der Thrombozytenanzahl), die sich durch verstärkte Blutungsneigung und/oder durch Petechien von Haut und Schleimhäuten bemerkbar macht.
Aplastische Anämie, Agranulozytose oder Panzytopenie (auch mit tödlichem Ausgang), Leukopenie und Thrombozytopenie sind als immunologische Reaktionen zu betrachten. Sie können auch auftreten, wenn Metamizol dem Patienten bei früheren Gelegenheiten ohne Komplikationen verabreicht wurde.
Erkrankungen des Immunsystems
Selten (≥1/10'000, <1/1000): anaphylaktoide oder anaphylaktische Reaktionen*.
Sehr selten (<1/10'000): durch Analgetika ausgelöstes asthmatisches Syndrom.
Nicht bekannt: anaphylaktischer Schock*.
*: Diese Reaktionen können insbesondere nach parenteraler Metamizol-Verabreichung auftreten, und sie können schwer bis lebensbedrohlich ausgeprägt sein und in bestimmten Fällen zum Tode führen. Sie können auch dann auftreten, wenn Metamizol dem Patienten bei früheren Gelegenheiten ohne Komplikationen verabreicht wurde.
Metamizol kann einen anaphylaktischen Schock sowie anaphylaktische/anaphylaktoide Reaktionen auslösen. Diese können zum Teil schwer oder lebensbedrohlich sein oder zum Tod des Patienten führen.
Die anaphylaktischen/anaphylaktoiden Reaktionen können sofort oder Stunden nach der Verabreichung auftreten. Meist treten sie jedoch innerhalb von einer Stunde nach der Verabreichung auf. Sie können auch auftreten, nachdem Minalgin, Lösung zum Einnehmen zuvor komplikationslos vertragen wurde.
Sie umfassen Haut- und Schleimhautreaktionen (wie z.B. Juckreiz, Brennen, Hautrötung, Urtikaria und Schwellungen), Dyspnoe und seltener gastrointestinale Beschwerden, generalisierte Urtikaria, Angioödem, Bronchospasmus, Herzrhythmusstörungen, koronare Erkrankungen («Kounis-Syndrom»), Blutdruckabfall (manchmal mit vorausgegangener Blutdruckerhöhung) und Kreislaufschock. Bei Patienten mit Analgetika-Intoleranz, die unter einem asthmatischen Syndrom leiden, treten diese Reaktionen charakteristischerweise in Form von Asthmaanfällen auf.
Anaphylaktische/anaphylaktoide Reaktionen können tödlich verlaufen.
Darum muss das Arzneimittel im Fall von Hautreaktionen sofort abgesetzt werden.
Herzerkrankungen
Nicht bekannt: Kounis-Syndrom.
Siehe Rubrik «Erkrankungen des Immunsystems».
Gefässerkrankungen
Gelegentlich (≥1/1000, <1/100): isolierte hypotensive Reaktionen.
Gelegentlich können vorübergehende und isolierte hypotensive Reaktionen mit einem kritischen Blutdruckabfall nach der Verabreichung auftreten, die nicht von anderen Anzeichen einer anaphylaktischen/anaphylaktoiden Reaktion begleitet sind. Eine solche Reaktion kann zu einem schweren Blutdruckabfall führen.
Auch Hyperpyrexie kann dosisabhängig von einem kritischen Blutdruckabfall ohne weitere Anzeichen von Überempfindlichkeit begleitet werden.
Erkrankungen des Gastrointestinaltrakts
Nicht bekannt: gastrointestinale Blutungen, Ulzerationen und Perforationen.
Leber- und Gallenerkrankungen
Nicht bekannt: durch das Arzneimittel verursachte Leberschäden, einschliesslich akuter Hepatitis, Ikterus, erhöhte Leberenzyme (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Haut und des Unterhautzellgewebes
Im Zusammenhang mit der Behandlung mit Metamizol wurde über schwere kutane Nebenwirkungen, einschliesslich Stevens-Johnson-Syndrom (SJS), toxischer epidermaler Nekrolyse (TEN) und Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Gelegentlich (≥1/1000, <1/100): fixes Arzneimittelexanthem.
Selten (≥1/10'000, <1/1000): Hautausschläge (z.B. makulopapulöses Exanthem).
Sehr selten (<1/10'000): Es können schwere, zum Teil lebensbedrohliche Allergien wie blasenbildende Haut-Schleimhaut-Erkrankungen (Stevens-Johnson-Syndrom (SJS) oder toxisch-epidermale Nekrolyse (TEN) auftreten.
Beim Auftreten von Haut- oder Überempfindlichkeitsreaktionen ist Minalgin, Lösung zum Einnehmen sofort abzusetzen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nicht bekannt: Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS).
Erkrankungen der Nieren und Harnwege
Sehr selten (<1/10'000): Es kann eine akute Verschlechterung der Nierenfunktion (akutes Nierenversagen) auftreten, vor allem wenn bereits eine Nierenerkrankung vorliegt. In manchen Fällen kann gleichzeitig eine Oligurie, Anurie oder Proteinurie auftreten.
Nicht bekannt: akute interstitielle Nephritis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Eine Rotfärbung des Urins ist beobachtet worden; dies kann auf Rubazonsäure zurückzuführen sein, ein harmloses Abbauprodukt von Metamizol, das in geringen Mengen entsteht.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Mit folgenden Symptomen kann im Falle einer Überdosierung gerechnet werden: Übelkeit, Erbrechen, Abdominalschmerzen, Verschlechterung der Nierenfunktion / akutes Nierenversagen (z.B. infolge interstitieller Nephritis) und seltener ZNS-Symptome (Schwindel, Somnolenz, Koma, Konvulsionen) und Blutdruckabfall (manchmal bis zum Schock fortschreitend) sowie Herzrhythmusstörungen (Tachykardie).
Nach hohen Dosen kann die Ausscheidung von harmlosen Metaboliten (Rubazonsäure) eine Rotverfärbung des Urins bewirken.
Therapie
Es ist kein spezifisches Antidot für Metamizol bekannt. Wenn die Substanz gerade erst eingenommen wurde, sollte allenfalls die nicht resorbierte Substanz eliminiert werden (Magenspülung, Medizinalkohle). Der Hauptmetabolit (4-N-Methylaminoantipyrin) ist durch Hämoperfusion, Hämodialyse, Hämofiltration oder Plasmafiltration eliminierbar.
Eigenschaften/WirkungenATC-Code
N02BB02
Wirkungsmechanismus
Metamizol wirkt analgetisch, spasmolytisch und antipyretisch. Die analgetische Wirkung wird durch seine Hauptmetaboliten über eine zentrale und periphere Interaktion mit den nozizeptiven Rezeptoren erreicht. Die spasmolytische Wirkung beruht auf einer Herabsetzung der Erregbarkeit der peripheren glatten Muskulatur, während die antipyretische Wirkung auf die Beeinflussung des hypothalamischen Wärmezentrums und die Stimulation einer vermehrten Wärmeabgabe zurückzuführen ist.
Pharmakodynamik
Siehe Rubrik «Wirkmechanismus».
Klinische Wirksamkeit
Keine Angaben.
PharmakokinetikAbsorption
Metamizol ist in Realität ein Prodrug, das nach oraler oder parenteraler Gabe im Gastrointestinaltrakt zu 4-Methylaminoantipyrin hydrolisiert wird. Die Resorption erfolgt nach oraler Verabreichung rasch und nahezu vollständig. Die Metaboliten sind 4-Formylantipyrin und das aktive 4-Aminoantipyrin, das im Anschluss zu 4-Acetylaminoantipyrin acetyliert wird. Diese 4 der insgesamt 8 bekannten Metaboliten repräsentieren 65–70% der verabreichten Gesamtdosis und werden grösstenteils renal ausgeschieden.
Distribution
Metamizol selbst kann nach oraler Gabe im Plasma und Urin nicht nachgewiesen werden. Metamizol-Metaboliten gehen in die Muttermilch über und sind bis zu 48 Stunden nach der Einnahme nachweisbar. Sie sind auch im Speichel nachweisbar. Die Daten zur Absorption, Plasmaproteinbindung und Elimination sind in der untenstehenden Tabelle zusammengefasst.
|
|
Cmax
mg/l
|
Tmax
h
|
T½
h
|
Plasmaproteinbindung
%
|
Clearance
ml/min
|
Urin-Ausscheidung
% v. Metamizol
| |
4-Methylaminoantipyrin
|
10,5
|
1,4
|
3,3
|
58
|
4,0
|
2,8
| |
4-Formylaminoantipyrin
|
2,1
|
7,2
|
10,1
|
18
|
39,3
|
12,7
| |
4-Aminoantipyrin
| |
LA
|
2,7
|
6,7
|
5,5
|
48
|
30,7
|
6,4
| |
SA
|
1,6
|
3,2
|
3,8
|
48
|
30,7
|
6,4
| |
4-Acetylaminoantipyrin
| |
LA
|
1,6
|
16,1
|
10,6
|
14
|
36,1
|
22,2
| |
SA
|
4,4
|
10,0
|
10,6
|
14
|
36,1
|
22,2
|
LA: Langsam-Acetylierer
SA: Schnell-Acetylierer
Metabolismus
Siehe Rubriken «Absorption» und «Distribution».
Elimination
Siehe Rubrik «Distribution».
Die Ausscheidung über den Urin ist nach intravenöser Gabe grösser als nach oraler Verabreichung. Bei Niereninsuffizienz (Creatinin-Clearance unter 30 ml/min) ist die renale Ausscheidung vermindert und die Eliminationshalbwertszeit von 4-Methylaminoantipyrin verlängert.
Präklinische DatenEs liegen sowohl Hinweise auf mutagene Wirkungen von Metamizol als auch negative Ergebnisse vor. In mehreren Langzeitversuchen mit Ratten und Mäusen ergaben sich keine Hinweise auf kanzerogene Wirkungen. In zwei von drei Langzeitstudien an Mäusen wurden in hohen Dosen vermehrt Leberadenome beobachtet. Diese Befunde werden aber allgemein als von fehlender Relevanz für den Menschen betrachtet.
Studien zur Reproduktionstoxizität an Ratten und Kaninchen zeigten keine teratogene Wirkung.
Embryoletale Effekte traten ab 100 mg/kg auf. Bei Ratten führten höhere Dosen zu Beeinträchtigungen der Geburt und erhöhter Sterblichkeit von Mutter- und Jungtieren.
Fertilitätsprüfungen zeigten eine leicht verringerte Trächtigkeitsrate bei der Elterngeneration bei einer Dosis oberhalb von 250 mg pro kg und Tag. Die Fertilität der F1-Generation wurde nicht beeinträchtigt.
Sonstige HinweiseDie Ausscheidung eines unschädlichen Stoffwechselproduktes, der Rubazonsäure, kann zu einer Rotfärbung des Harns führen, welche nach Abschluss der Behandlung verschwindet.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach dem Öffnen/Anbruch 50 Tage haltbar.
Besondere Lagerungshinweise
Minalgin, Lösung zum Einnehmen soll bei Raumtemperatur (15-25 °C), vor Licht geschützt und ausser Reichweite von Kindern aufbewahrt werden.
Hinweise für die Handhabung
|
|

|
Drehen Sie den Verschluss ab und setzen Sie die Spitze der Dosierspritze in den Aufsatz der Flasche ein, so dass sie fest sitzt.
| |
|
|
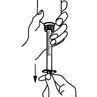
Drehen Sie die Flasche auf den Kopf, um die Spritze füllen zu können. Halten Sie die Spritze fest und ziehen Sie den Kolben nach unten, um die Lösung bis zur gewünschten Markierung aufzuziehen.
| |
|
|
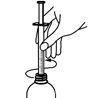
Bringen Sie die Flasche wieder in aufrechte Position. Drehen Sie die Spritze um ihre Achse, um sie leichter aus dem Aufsatz entfernen zu können.
| |
|

|
Zur Einnahme geben Sie die in der oralen Dosierspritze aufgezogene Lösung auf einen Löffel oder in einen kleinen Dosierbecher. Die Dosierspritze darf nicht direkt mit dem Mund oder Speichel in Kontakt kommen.
|
Nach jeder Anwendung soll die orale Dosierspritze sorgfältig gespült werden. Dazu wird der Stempel aus der Spritze gezogen, Stempel und Spritze mit fliessendem, kaltem Leitungswasser gespült und anschliessend mit einem sauberen Papiertuch abgewischt. Beide Teile werden an der Luft bei Raumtemperatur auf einem frischen Tuch getrocknet und dann wieder für eine erneute Anwendung zusammengebaut. Die Dosierspritze darf nur für die Anwendung von Minalgin, Lösung zum Einnehmen verwendet werden.
Zulassungsnummer68072 (Swissmedic).
Packungen100 ml Lösung zum Einnehmen, mit oraler Dosierspritze graduiert in 0.1 ml Schritten [B].
ZulassungsinhaberinStreuli Pharma AG, Uznach.
Stand der InformationMärz 2025.
|




