Eigenschaften/WirkungenATC-Code
L04AC
Risankizumab, ein Interleukin-23-Blocker, ist ein humanisierter Immunoglobulin G1 (IgG1) monoklonaler Antikörper. Risankizumab wird in einer Säugerzelllinie produziert unter Einsatz rekombinanter DNA-Technologie.
Wirkungsmechanismus
Risankizumab ist ein humanisierter Immunoglobulin G1 (IgG1) monoklonaler Antikörper, der selektiv mit hoher Affinität an die p19-Untereinheit des humanen Zytokins Interleukin 23 (IL-23) bindet und dessen Interaktion mit dem IL-23-Rezeptorkomplex hemmt. IL-23 ist ein natürlich vorkommendes Zytokin, das an Entzündungs- und Immunreaktionen beteiligt ist. IL-23 unterstützt die Proliferation, die Erhaltung und die Aktivierung von Th17-Zellen, die IL-17A, IL-17F und IL-22 sowie weitere proinflammatorische Zytokine produzieren und eine zentrale Rolle bei der Pathogenese von entzündlichen Autoimmunkrankheiten wie Psoriasis spielen. Bei Patienten mit Plaque-Psoriasis findet sich in Hautläsionen gegenüber nicht betroffenen Arealen eine Hochregulation von IL-23. Indem Risankizumab die Bindung von IL-23 an seinen Rezeptor blockiert, hemmt Risankizumab die IL-23-abhängige zelluläre Signaltransduktion und die Freisetzung proinflammatorischer Zytokine.
Risankizumab bindet nicht an humanes IL-12, welches wie das IL-23 auch eine p40-Untereinheit besitzt.
Pharmakodynamik
In einer Studie mit Psoriasis-Patienten wurde nach einer Einzeldosis Risankizumab eine reduzierte Expression von Genen, die mit der IL-23/IL-17-Axis assoziiert sind, in der Haut beobachtet. Darüber hinaus wurden in Psoriasis-Läsionen Verminderungen in der Epidermis-Dicke, Infiltration von Entzündungszellen und Expression von Psoriasis-Krankheitsmarkern festgestellt.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von SKYRIZI wurden bei 2'109 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis in vier multizentrischen, randomisierten Placebo- und/oder- aktiv- kontrollierten Doppelblindstudien beurteilt (ULTIMMA-1, ULTIMMA-2, IMMHANCE und IMMVENT). In den ULTIMMA-1 und ULTIMMA-2 Studien wurde Ustekinumab als aktiver Komparator eingesetzt. In der IMMHANCE Studie wurde zudem bei Patienten mit erfolgreichem Ansprechen das Absetzen von Risankizumab und die Wiederaufnahme der Therapie untersucht. In der IMMVENT Studie wurde Adalimumab als aktiver Komparator eingesetzt. Nach Abschluss der Studien konnten die Patienten in die offene Fortsetzungsstudie, LIMITLESS, eingeschlossen werden. Die eingeschlossenen Patienten waren mindestens 18 Jahre alt und litten an Plaque-Psoriasis mit betroffener Körperoberfläche (body surface area, BSA) von ≥10%, einem Score der statischen Beurteilung durch den Arzt (static Physician Global Assessment, sPGA) von ≥3, der Psoriasis auf einer Schweregrad-Skala von 0 bis 4, sowie einem Psoriasis Area and Severity Index (PASI) von ≥12. Patienten mit erythrodermischer Psoriasis, Psoriasis guttata oder pustulöser Psoriasis waren ausgeschlossen.
Insgesamt wiesen die Patienten einen medianen Baseline PASI-Score von 17,8 und eine mediane BSA-Beteiligung von 20,0% auf. Der Baseline sPGA-Score entsprach bei 19,3% der Patienten einer schweren Erkrankung. Bei insgesamt 9,8% der Studienpatienten lag anamnestisch eine diagnostizierte Psoriasis-Arthritis vor.
Über alle Studien hinweg hatten 30,9% der Patienten zuvor keine nicht-biologische systemische oder biologische Therapie, 38,1% eine Phototherapie, 48,3% eine nicht-biologische systemische Therapie und 42,1% eine biologische Therapie (23.7% aller Patienten in diesen Studien erhielten mindestens einen TNF-alpha-Blocker) zur Behandlung der Psoriasis erhalten. Um eine Beurteilung der Wirksamkeit von SKYRIZI in der Behandlung der Psoriasis ohne Verzerrung zu ermöglichen, war eine Begleitbehandlung mit systemischer oder topischer Therapie (mit Ausnahme milder topischer Kortikosteroide im Gesicht, Achseln und/oder Genitalien) oder Phototherapie in den Studien nicht zulässig.
ULTIMMA-1 und ULTIMMA-2
In die Studien ULTIMMA-1 und ULTIMMA-2 wurden 997 Patienten eingeschlossen (598 Patienten wurden zu SKYRIZI 150 mg, 199 Patienten zu Ustekinumab 45 mg oder 90 mg [nach Ausgangskörpergewicht] und 200 Patienten zu Placebo randomisiert). Die Behandlung wurde in Woche 0, Woche 4 und anschliessend alle 12 Wochen verabreicht. Die Ergebnisse sind in Tabelle 2 und Abbildung 1 dargestellt.
Tabelle 2: Wirksamkeitsergebnisse bei Erwachsenen mit Plaque-Psoriasis in ULTIMMA-1 und ULTIMMA-2
|
|
ULTIMMA-1
|
ULTIMMA-2
| |
|
SKYRIZI
(N=304)
n (%)
|
Ustekinumab
(N=100)
n (%)
|
Placebo
(N=102)
n (%)
|
SKYRIZI
(N=294)
n (%)
|
Ustekinumab
(N=99)
n (%)
|
Placebo
(N=98)
n (%)
| |
sPGA «frei von» oder «nahezu frei von» (0 oder 1)
| |
Woche 16
|
267 (87,8)a
|
63 (63,0)
|
8 (7,8)
|
246 (83,7)a
|
61 (61,6)
|
5 (5,1)
| |
Woche 52
|
262 (86,2)
|
54 (54,0)
|
--
|
245 (83,3)
|
54 (54,5)
|
--
| |
sPGA «frei von» (0)
| |
Woche 16
|
112 (36,8)
|
14 (14,0)
|
2 (2,0)
|
150 (51,0)
|
25 (25,3)
|
3 (3,1)
| |
Woche 52
|
175 (57,6)
|
21 (21,0)
|
--
|
175 (59,5)
|
30 (30,3)
|
--
| |
PASI 75
| |
Woche 12
|
264 (86,8)
|
70 (70,0)
|
10 (9,8)
|
261 (88,8)
|
69 (69,7)
|
8 (8,2)
| |
Woche 52
|
279 (91,8)
|
70 (70,0)
|
--
|
269 (91.5)
|
76 (76,8)
|
--
| |
PASI 90
| |
Woche 16
|
229 (75,3)a
|
42 (42,0)
|
5 (4,9)
|
220 (74,8)a
|
47 (47,5)
|
2 (2,0)
| |
Woche 52
|
249 (81,9)
|
44 (44,0)
|
--
|
237 (80,6)
|
50 (50,5)
|
--
| |
PASI 100
| |
Woche 16
|
109 (35,9)
|
12 (12,0)
|
0 (0,0)
|
149 (50,7)
|
24 (24,2)
|
2 (2,0)
| |
Woche 52
|
171 (56,3)
|
21 (21,0)
|
--
|
175 (59,5)
|
30 (30,3)
|
--
| |
Bei allen Vergleichen von SKYRIZI mit Ustekinumab und Placebo wurde ein p-Wert von < 0,001 erreicht, ausser für den PASI 75 in Woche 52 in ULTIMMA-2 (p = 0,001).
a co-primäre Endpunkte versus Placebo
|
Abbildung 1: Zeitlicher Verlauf der mittleren prozentualen Änderung von der Baseline ausgehend des PASI in ULTIMMA-1 und ULTIMMA-2
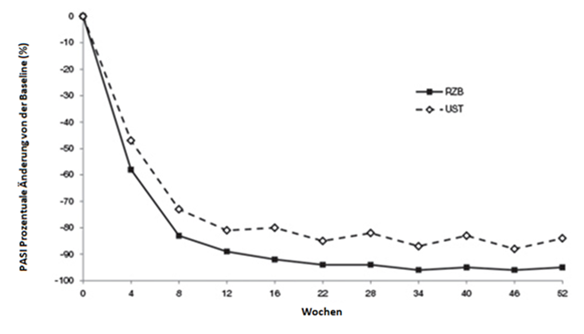
RZB = Risankizumab
UST = Ustekinumab
P < 0,001 zu jedem Zeitpunkt
Eine Analyse nach Alter, Geschlecht, ethnische Abstammung, Körpergewicht, Baseline PASI-Score, gleichzeitiger Psoriasis-Arthritis, vorheriger nicht-biologischer systemischer Behandlung, vorheriger Biologika-Therapie und vorherigem Versagen eines Biologikums erbrachte zwischen diesen Teilgruppen keine Unterschiede hinsichtlich des Ansprechens auf SKYRIZI.
Bei Patienten, die mit SKYRIZI behandelt wurden, zeigte sich in Woche 16 und Woche 52 eine Besserung der Psoriasis im Bereich der Kopfhaut, der Nägel, der Handflächen und der Fusssohlen.
IMMHANCE
In die Studie IMMHANCE wurden 507 Patienten eingeschlossen (407 Patienten wurden zu SKYRIZI 150 mg und 100 Patienten zu Placebo randomisiert). Die Behandlung wurde in Woche 0, Woche 4 und anschliessend alle 12 Wochen verabreicht.
In Woche 16 erwies sich SKYRIZI gegenüber Placebo hinsichtlich der co-primären Endpunkte sPGA «frei von» oder «nahezu frei von» (83,5% SKYRIZI vs. 7,0% Placebo) und PASI 90 (73,2% SKYRIZI vs. 2,0% Placebo) als überlegen. In Woche 16 wiesen mehr Patienten unter SKYRIZI ein erscheinungsfreies Hautbild [sPGA 0 (46,4% SKYRIZI vs. 1,0% Placebo) bzw. einen PASI 100 (47,2% SKYRIZI vs. 1,0% Placebo)] auf. Zudem erreichten Patienten unter SKYRIZI mit höherer Wahrscheinlichkeit ein PASI-75-Ansprechen als Patienten unter Placebo (88,7% SKYRIZI vs. 8,0% Placebo).
Bei keinem der 31 Patienten der IMMHANCE-Studie, die eine latente Tuberkulose (TB) aufwiesen und während der Studie keine Prophylaxe erhielten, entwickelte sich während des mittleren Nachbeobachtungszeitraums auf SKYRIZI von 55 Wochen eine aktive TB. Jedoch sollte bei Patienten mit latenter TB mit einer TB-Therapie vor Verabreichung von SKYRIZI begonnen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
IMMVENT
In die Studie IMMVENT wurden 605 Patienten eingeschlossen (301 Patienten wurden zu SKYRIZI und 304 Patienten zu Adalimumab randomisiert). Patienten, die zu SKYRIZI randomisiert wurden, erhielten in Woche 0, Woche 4 und anschliessend alle 12 Wochen eine Dosis von 150 mg. Zu Adalimumab randomisierte Patienten erhielten 80 mg in Woche 0, 40 mg in Woche 1 und 40 mg alle zwei Wochen bis einschliesslich Woche 15. Bei den mit Adalimumab behandelten Patienten erfolgte ab Woche 16, je nach Ansprechen, eine Weiterbehandlung oder eine Therapieumstellung:
·< PASI 50: Umstellung auf SKYRIZI
·PASI 50 bis < PASI 90: Re- Randomisierung für Weiterbehandlung mit 40 mg Adalimumab alle 2 Wochen oder Umstellung auf SKYRIZI
·PASI 90: Weiterbehandlung mit 40 mg Adalimumab alle 2 Wochen.
In IMMVENT zeigten sich unter SKYRIZI in Woche 16 ähnliche Ergebnisse wie in den anderen klinischen Studien (Tabelle 3 und Abbildung 2).
Tabelle 3: Wirksamkeitsergebnisse in Woche 16 bei Erwachsenen mit Plaque-Psoriasis in IMMVENT
|
|
SKYRIZI
(N=301)
n (%)
|
Adalimumab
(N=304)
n (%)
| |
sPGA «frei von» oder «nahezu frei von»a
|
252 (83,7)
|
183 (60,2)
| |
PASI 75
|
273 (90,7)
|
218 (71,7)
| |
PASI 90a
|
218 (72,4)
|
144 (47,4)
| |
PASI 100
|
120 (39,9)
|
70 (23,0)
| |
Bei allen Vergleichen wurde ein p-Wert von < 0,001 erreicht.
a co-primäre Endpunkte
|
Bei Patienten, die in Woche 16 unter Adalimumab einen PASI 50 bis < PASI 90 aufwiesen und re-randomisiert wurden, zeigten sich bereits 4 Wochen nach der Re-Randomisierung zwischen Patienten mit Therapieumstellung auf SKYRIZI und Patienten, die mit Adalimumab weiterbehandelt wurden, Unterschiede in Bezug auf die PASI-90-Ansprechraten (49,1% vs. 26,8%). Insgesamt 66,0% (35/53) der Patienten erreichten nach Behandlung mit SKYRIZI über 28 Wochen einen PASI 90, verglichen mit 21,4% (12/56) der mit Adalimumab weiterbehandelten Patienten. Andere Parameter des Ansprechens fielen nach Umstellung auf SKYRIZI ebenfalls besser aus: 39,6% PASI 100, 39,6% sPGA «frei von» und 73,6% sPGA «frei von» oder «nahezu frei von» nach Umstellung auf SKYRIZI, verglichen mit 7,1% PASI 100, 7,1% sPGA «frei von» und 33,9% sPGA «frei von» oder «nahezu frei von» unter Weiterbehandlung mit Adalimumab.
Abbildung 2: Zeitlicher Verlauf des PASI 90 nach Re-Randomisierung in IMMVENT
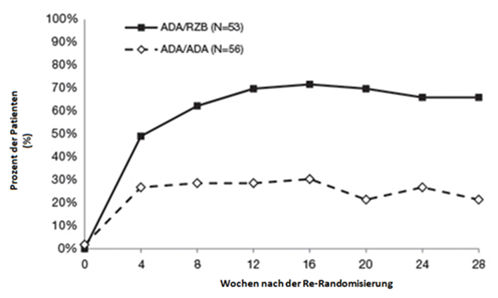
ADA/ADA: Patienten, die ursprünglich zu Adalimumab randomisiert und mit Adalimumab weiterbehandelt wurden
ADA/RZB: Patienten, die ursprünglich zu Adalimumab randomisiert und auf SKYRIZI umgestellt wurden
p < 0,05 in Woche 4 und p < 0,001 zu jedem Zeitpunkt ab Woche 8
Erhalt und Dauerhaftigkeit des Ansprechens
In einer kombinierten Analyse von Patienten, die innerhalb von ULTIMMA-1 und ULTIMMA-2 SKYRIZI erhielten und in Woche 16 ein PASI-100-Ansprechen zeigten, blieb das Ansprechen bei 79,8% (206/258) der mit SKYRIZI weiterbehandelten Patienten bis Woche 52 erhalten. 88,4% (398/450) der Patienten mit PASI-90-Ansprechen in Woche 16 zeigten bis Woche 52 ein anhaltendes Ansprechen.
Patienten, die innerhalb von IMMHANCE ursprünglich SKYRIZI erhalten hatten und in Woche 28 ein sPGA-Ansprechen «frei von» oder «nahezu frei von» aufwiesen, wurden nach Re-Randomisierung entweder mit SKYRIZI alle 12 Wochen bis einschliesslich Woche 88 (N=111) weiterbehandelt oder die Behandlung wurde abgesetzt (N=225).
In Woche 104 (16 Wochen nach der letzten SKYRIZI Verabreichung) erreichten 81,1% (90/111) der mit SKYRIZI weiterbehandelten Patienten ein sPGA-Ansprechen «frei von» oder «nahezu frei von» verglichen mit 7,1% (16/225) der Patienten, bei denen SKYRIZI abgesetzt wurde. Ein Verlust des sPGA-Ansprechens «frei von» oder «nahezu frei von» wurde bei Patienten, bei denen SKIRIZI abgesetzt wurde, bereits 12 Wochen nach einer verpassten Dosis beobachtet.
Die sPGA-Ansprechrate «frei von» in Woche 104 war 63,1% (70/111) in mit SKYRIZI weiterbehandelten Patienten verglichen mit 2,2% (5/225) in Patienten, bei welchen die SKYRIZI Behandlung abgesetzt wurde.
Es gab einen Anstieg zwischen Woche 28 und 88 im Anteil der mit SKYRIZI weiterbehandelten Patienten im PASI-100 und sPGA-Ansprechen «frei von».
Von denjenigen Patienten, welche ein sPGA-Ansprechen von «frei von» oder «nahezu frei von» in Woche 28 erreichten und ein Rezidiv (sPGA ≥3) nach Absetzen von SKYRIZI vorwiesen, erreichten 83,7% (128/153) wieder ein sPGA-Ansprechen «frei von» oder «nahezu frei von» nach 16 Wochen Wiederaufnahme der Behandlung.
Lebensqualität/Von Patienten berichtete Ergebnisse
Signifikant mehr Patienten, welche mit SKYRIZI behandelt wurden, erreichten einen Dermatology Life Quality Index (DLQI) Score von 0 oder 1 [keine Auswirkungen auf die gesundheitsbezogene Lebensqualität] in Woche 16 verglichen zu Placebo, Adalimumab oder Ustekinumab behandelten Patienten. Die Verbesserung hielt bis einschliesslich Woche 52 in den ULTIMMA-1 und ULTIMMA-2 Studien an.
In ULTIMMA-1 und ULTIMMA-2 zeigte sich in Woche 16 unter SKYRIZI eine signifikant stärkere Besserung der Psoriasis-Symptome (Juckreiz, Schmerzen, Rötung und Brennen, gemessen anhand des Psoriasis Symptom Score [PSS]) als unter Placebo. Verglichen mit Ustekinumab und Placebo erreichte ein signifikant höherer Anteil der Patienten unter SKYRIZI in Woche 16 einen PSS von 0 (Symptomfreiheit). Bis Woche 52 berichteten 55,7% (333/598) der Patienten unter SKYRIZI keinerlei Juckreiz, Schmerzen, Rötung oder Brennen.
|


