ZusammensetzungWirkstoffe
Ripretinib
Hilfsstoffe
Crospovidon, Hypromelloseacetatsuccinat, Lactose-Monohydrat (179 mg pro Tablette), Magnesiumstearat, mikrokristalline Cellulose und Siliziumdioxid.
Indikationen/AnwendungsmöglichkeitenQINLOCK ist angezeigt zur Behandlung von erwachsenen Patienten mit fortgeschrittenen gastrointestinalen Stromatumoren (GIST), die mindestens 3 vorherige Therapien mit Kinaseinhibitoren, darunter Imatinib, erhalten haben (siehe Rubrik «Klinische Wirksamkeit»).
Dosierung/AnwendungDie empfohlene Dosierung von QINLOCK beträgt 150 mg einmal täglich zur oralen Einnahme, unabhängig von der Nahrungsaufnahme, bis zur Krankheitsprogression oder inakzeptablen Toxizität.
Patienten müssen angewiesen werden, die Tabletten ganz zu schlucken.
Patienten sollten QINLOCK jeden Tag zur selben Zeit einnehmen.
Wenn Patienten eine Dosis auslassen, sollten sie diese einnehmen, sofern weniger als 8 Stunden seit der planmässigen Einnahme der ausgelassenen Dosis vergangen sind.
Wenn ein Patient sich nach der Einnahme einer Dosis übergeben muss, sollte der Patient keine Ersatzdosis einnehmen und die Einnahme planmässig mit der nächsten vorgesehenen Dosis fortsetzen.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Die empfohlene Dosisreduktion aufgrund unerwünschter Wirkungen lautet:
·QINLOCK 100 mg einmal täglich zur oralen Einnahme.
Bei Patienten, die 100 mg einmal täglich zur oralen Einnahme nicht vertragen, ist QINLOCK dauerhaft abzusetzen.
Tabelle 1 zeigt die für QINLOCK empfohlenen Dosisanpassungen beim Auftreten unerwünschter Wirkungen.
Tabelle 1: Empfohlene Dosisanpassungen beim Auftreten unerwünschter Wirkungen
|
Unerwünschte Wirkung
|
Schweregrada
|
QINLOCK Dosisanpassungen
| |
Palmar-plantares Erythrodysästhesiesyndrom (PPES)
[siehe «Warnhinweise und Vorsichtsmassnahmen»]
|
Grad 2
|
·Einnahme von QINLOCK bis zur Erholung auf Grad ≤1 oder Baseline aussetzen. Bei Erholung innerhalb von 7 Tagen Behandlung mit QINLOCK mit derselben Dosisstufe wieder aufnehmen; andernfalls mit reduzierter Dosisstufe wieder aufnehmen.
·Wenn das Ereignis mindestens 28 Tage bei Grad ≤1 oder Baseline bleibt, ist eine Re-Eskalation der QINLOCK-Dosis in Betracht zu ziehen.
·Wenn PPES erneut eintritt, die Einnahme von QINLOCK bis zur Erholung auf Grad ≤1 oder Baseline aussetzen und dann Behandlung mit QINLOCK, unabhängig von der Zeit bis zur Verbesserung, mit reduzierter Dosisstufe wieder aufnehmen.
| |
Grad 3
|
·Einnahme von QINLOCK für mindestens 7 Tage oder zur Erholung auf Grad ≤1 oder Baseline (maximal 28 Tage) aussetzen. Behandlung mit QINLOCK mit reduzierter Dosisstufe wieder aufnehmen.
·Wenn das Ereignis mindestens 28 Tage bei Grad ≤1 oder Baseline bleibt, ist eine Re-Eskalation der QINLOCK-Dosis in Betracht zu ziehen.
| |
Hypertonie
[siehe «Warnhinweise und Vorsichtsmassnahmen»]
|
Grad 3
|
·Bei symptomatischer Hypertonie QINLOCK absetzen, bis Symptome abgeklungen sind und Blutdruck unter Kontrolle ist.
·Wenn Blutdruck bis Grad ≤1 oder Baseline kontrolliert ist, Behandlung mit QINLOCK mit derselben Dosisstufe wieder aufnehmen; andernfalls mit reduzierter Dosisstufe wieder aufnehmen.
·Wenn Hypertonie von Grad 3 erneut eintritt, QINLOCK absetzen, bis Symptome abgeklungen sind und Blutdruck unter Kontrolle ist. Behandlung mit QINLOCK mit reduzierter Dosisstufe wieder aufnehmen.
| |
Grad 4
|
QINLOCK dauerhaft absetzen.
| |
Linksventrikuläre systolische Dysfunktion
[siehe «Warnhinweise und Vorsichtsmassnahmen»]
|
Grad 3 oder 4
|
QINLOCK dauerhaft absetzen.
| |
Arthralgie oder Myalgie
[siehe «Unerwünschte Wirkungen»]
|
Grad 2
|
·Einnahme von QINLOCK bis zur Erholung auf Grad ≤1 oder Baseline aussetzen. Bei Erholung innerhalb von 7 Tagen Behandlung mit QINLOCK mit derselben Dosisstufe wieder aufnehmen; andernfalls Behandlung mit QINLOCK mit reduzierter Dosisstufe wieder aufnehmen.
·Wenn das Ereignis mindestens 28 Tage bei Grad ≤1 oder Baseline bleibt, ist eine Re-Eskalation der QINLOCK-Dosis in Betracht zu ziehen.
·Wenn Arthralgie oder Myalgie erneut eintritt, die Einnahme von QINLOCK bis zur Erholung auf Grad ≤1 oder Baseline aussetzen und dann Behandlung mit QINLOCK, unabhängig von der Zeit bis zur Verbesserung, mit reduzierter Dosisstufe wieder aufnehmen.
| |
Grad 3
|
·Einnahme von QINLOCK für mindestens 7 Tage oder zur Erholung auf Grad ≤1 oder Baseline (maximal 28 Tage) aussetzen. Behandlung mit QINLOCK mit reduzierter Dosisstufe wieder aufnehmen.
·Wenn das Ereignis mindestens 28 Tage bei Grad ≤1 oder Baseline bleibt, ist eine Re-Eskalation der QINLOCK-Dosis in Betracht zu ziehen.
| |
Weitere unerwünschte Wirkungen [siehe «Unerwünschte Wirkungen»]
|
Grad 3 oder 4
|
·Einnahme von QINLOCK bis zur Erholung auf Grad ≤1 oder Baseline (maximal 28 Tage) aussetzen und dann Behandlung mit QINLOCK mit reduzierter Dosisstufe wieder aufnehmen; andernfalls dauerhaft absetzen.
·Wenn die unerwünschte Wirkung mindestens 28 Tage lang nicht erneut eintritt, ist eine Re-Eskalation der QINLOCK-Dosis in Betracht zu ziehen.
·Wenn Grad 3 oder 4 erneut eintritt, QINLOCK dauerhaft absetzen.
| |
a
Gradeinteilung nach den Toxizitätskriterien des nationalen Krebsinstituts der USA (National Cancer Institute Common Terminology Criteria) für unerwünschte Wirkungen (NCI CTCAE v4.03) Version 4.03
|
Gleichzeitig angewendete Arzneimittel
Gleichzeitig angewendete Arzneimittel, bei welchen es sich um starke oder moderate CYP3A-Induktoren handelt (siehe «Interaktionen») sollen vermieden werden. Wenn ein moderater CYP3A-Induktor gleichzeitig verabreicht werden muss, ist die Verabreichungshäufigkeit von QINLOCK während des Zeitraums der gleichzeitigen Anwendung von der empfohlenen Dosierung von 150 mg einmal täglich auf 150 mg zweimal täglich zu erhöhen. Wenn ein Patient bei zweimal täglicher QINLOCK-Gabe eine Einnahme vergisst und seit dem vorgesehenen Einnahmezeitpunkt weniger als 4 Stunden vergangen sind, so ist der Patient anzuweisen, die vergessene Dosis so schnell wie möglich nachzuholen und anschliessend die nächste Dosis zum regulär vorgesehenen Zeitpunkt einzunehmen. Wenn ein Patient bei zweimal täglicher QINLOCK-Gabe eine Einnahme vergisst und seit dem vorgesehenen Einnahmezeitpunkt mehr als 4 Stunden vergangen sind, so ist der Patient anzuweisen, die vergessene Dosis auszulassen und die Behandlung einfach nach dem regulären Einnahmeschema fortzusetzen. Der Patient ist auf klinisches Ansprechen und Verträglichkeit zu überwachen. Wird der gleichzeitig angewendete moderate CYP3A-Induktor wieder abgesetzt, dann ist 14 Tage nach Absetzen des moderaten CYP3A-Induktors zur QINLOCK-Dosierung 150 mg einmal täglich zurückzukehren.
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter Leberfunktionsstörung wird keine Dosisanpassung empfohlen. QINLOCK wurde bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung nicht untersucht (siehe «Eigenschaften/Wirkungen»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung wird keine Dosisanpassung empfohlen. QINLOCK wurde bei Patienten mit schwerer Nierenfunktionsstörung nicht untersucht Für Patienten mit schwerer Nierenfunktionsstörung wurde keine empfohlene Dosierung von QINLOCK festgelegt (siehe «Eigenschaften/Wirkungen»).
Ältere Patienten
Von den 85 Patienten in der INVICTUS-Studie, die QINLOCK 150 mg einmal täglich oral erhielten, waren 24 % zwischen 65 und 74 Jahre alt und 9 % 75 Jahre oder älter. An den klinischen Studien mit QINLOCK nahmen nicht genügend Patienten im Alter von 65 Jahren und darüber ein, um festzustellen, ob sie anders darauf ansprechen als jüngere Patienten.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von QINLOCK bei Kindern und Jugendlichen wurde bisher noch nicht erwiesen. Es liegen keine Daten vor.
Warnhinweise und VorsichtsmassnahmenPalmar-plantares Erythrodysästhesiesyndrom
Das palmar-plantare Erythrodysästhesiesyndrom (PPES) trat Patienten auf, die mit QINLOCK behandelt wurden (siehe «Unerwünschte Wirkungen»).
Je nach Schweregrad Einnahme von QINLOCK aussetzen und dann mit gleicher oder reduzierter Dosisstufe wieder aufnehmen (siehe «Dosierung/Anwendung»).
Hypertonie
Hypertonie wurde bei QINLOCK beobachtet (siehe «Unerwünschte Wirkungen»). Bei Patienten mit unkontrollierter Hypertonie darf eine Behandlung mit QINLOCK nicht eingeleitet werden. Eine Behandlung mit QINLOCK erst einleiten, wenn eine angemessene Kontrolle des Blutdrucks besteht. Der Blutdruck ist während der Behandlung mit QINLOCK entsprechend der klinischen Indikation zu überwachen und gegebenenfalls ist eine antihypertensive Therapie einzuleiten oder anzupassen.
Je nach Schweregrad Einnahme von QINLOCK aussetzen und dann mit gleicher oder reduzierter Dosisstufe wieder aufnehmen oder dauerhaft absetzen (siehe «Dosierung/Anwendung»).
Herzinsuffizienz
Herzinsuffizienz wurde bei QINLOCK beobachtet. Die Ejektionsfraktion sollte mittels Echokardiogramm oder MUGA-Untersuchung vor Beginn und während der Behandlung mit QINLOCK entsprechend der klinischen Indikation beurteilt werden. QINLOCK sollte bei linksventrikulärer systolischer Dysfunktion von Grad 3 oder 4 dauerhaft abgesetzt werden. Die Sicherheit von QINLOCK wurde bei Patienten mit einer linksventrikulären Ejektionsfraktion unter 50 % bei Studienbeginn nicht bewertet (siehe «Unerwünschte Wirkungen»).
Neue primäre kutane Tumoren
Das kutane Plattenepithelkarzinom (cuSCC) und Melanome wurde bei Patienten, die QINLOCK erhielten, berichtet. Bei der Einleitung der QINLOCK-Behandlung und regelmässig während der Behandlung sollten dermatologische Untersuchungen durchgeführt werden. Verdächtige Hautläsionen sollten mittels Exzision und dermatopathologischer Untersuchung behandelt werden (siehe «Unerwünschte Wirkungen»). QINLOCK mit der gleichen Dosisstufe fortsetzen.
Phototoxizität
Ripretinib weist ein phototoxisches Potential auf (siehe «Präklinische Daten»). Aufgrund des mit Ripretinib verbundenen Phototoxizitätsrisikos wird empfohlen, die Patienten anzuweisen, eine Exposition gegenüber direktem Sonnenlicht, Höhensonnen/Solarien und sonstigen Quellen ultravioletter Strahlung zu vermeiden oder auf ein Mindestmass zu begrenzen. Ausserdem sind die Patienten anzuweisen, Schutzmassnahmen zu treffen, wie das Tragen langärmliger, vor Sonneneinstrahlung schützender Kleidung und einer entsprechenden Kopfbedeckung sowie die Anwendung von Sonnenschutzmitteln mit hohem Lichtschutzfaktor (LSF).
Risiko einer beeinträchtigten Wundheilung
Komplikationen aufgrund beeinträchtigter Wundheilung können bei Patienten auftreten, die Arzneimittel erhalten, die den Signalweg des vaskulären endothelialen Wachstumsfaktors (VEGF) hemmen. Daher hat QINLOCK das Potenzial, die Wundheilung zu beeinträchtigen.
QINLOCK ist mindestens 1 Woche vor einer elektiven Operation abzusetzen. Es darf mindestens 2 Wochen nach einer grösseren Operation und bis zur adäquaten Wundheilung nicht verabreicht werden. Die Sicherheit einer Wiederaufnahme der QINLOCK-Behandlung nach Abklingen von Wundheilungskomplikationen ist nicht erwiesen.
Embryonale/fetale Toxizität
Basierend auf Erkenntnissen aus tierexperimentellen Studien und seinem Wirkmechanismus kann QINLOCK bei Verabreichung während der Schwangerschaft zu Schädigungen des Fötus führen (siehe «Schwangerschaft, Stillzeit» und «Präklinische Daten»).
Sonstige Inhaltsstoffe
Patienten mit seltenen angeborenen Problemen wie Galactoseintoleranz, komplettem Laktasemangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
InteraktionenAuswirkung anderer Arzneimittel auf QINLOCK
Tabelle 2: Arzneimittelinteraktionen, die sich auf QINLOCK auswirken
|
Starke CYP3A-Inhibitoren
| |
Klinische Auswirkungen
|
·Die gleichzeitige Gabe von QINLOCK mit einem starken CYP3A-Inhibitor erhöhte die Exposition von Ripretinib und seinem aktiven Metaboliten (DP-5439), was das Risiko unerwünschter Wirkungen erhöhen kann (siehe «Eigenschaften/Wirkungen»).
| |
Prävention oder Behandlung
|
· Patienten sind häufiger auf unerwünschte Wirkungen zu überwachen.
| |
Starke und moderate CYP3A-Induktoren
| |
Klinische Auswirkungen
|
·Die gleichzeitige Gabe von QINLOCK mit einem starken CYP3A-Induktor verringerte die Exposition von Ripretinib und seinem aktiven Metaboliten (DP-5439), was die Anti-Tumor-Aktivität von QINLOCK vermindern kann (siehe «Eigenschaften/Wirkungen»).
·Für die gleichzeitige Gabe von QINLOCK mit moderaten CYP3A-Induktoren wurde eine Verringerung der Exposition von Ripretinib und seinem aktiven Metaboliten (DP-5439) vorhergesagt, was die antitumorale Aktivität von QINLOCK vermindern kann (siehe «Eigenschaften/Wirkungen»).
| |
Prävention oder Behandlung
|
·Die gleichzeitige Gabe von QINLOCK mit starken oder moderaten CYP3A-Induktoren zu vermeiden.
·Wenn die Gabe eines moderaten CYP3A-Induktoren unvermeidlich ist, kann die Verabreichungshäufigkeit von QINLOCK während des Zeitraums der gleichzeitigen Anwendung von der empfohlenen Dosierung von 150 mg einmal täglich auf 150 mg zweimal täglich erhöht werden. Wenn ein Patient bei zweimal täglicher QINLOCK-Gabe eine Einnahme vergisst und seit dem vorgesehenen Einnahmezeitpunkt weniger als 4 Stunden vergangen sind, so ist der Patient anzuweisen, die vergessene Dosis so schnell wie möglich nachzuholen und anschliessend die nächste Dosis zum regulär vorgesehenen Zeitpunkt einzunehmen. Wenn ein Patient bei zweimal täglicher QINLOCK-Gabe eine Einnahme vergisst und seit dem vorgesehenen Einnahmezeitpunkt mehr als 4 Stunden vergangen sind, so ist der Patient anzuweisen, die vergessene Dosis auszulassen und die Behandlung einfach nach dem regulären Einnahmeschema fortzusetzen. Wird der gleichzeitig angewendete moderate CYP3A-Induktor wieder abgesetzt, dann ist 14 Tage nach Absetzen des moderaten CYP3A-Induktors zur QINLOCK-Dosierung 150 mg einmal täglich zurückzukehren. Der Patient ist auf klinisches Ansprechen und Verträglichkeit zu überwachen (siehe «Gleichzeitig angewendete Arzneimittel»).
|
Klinische Studien
Starke CYP3A4-Inhibitoren: Die gleichzeitige Gabe von QINLOCK mit Itraconazol (ein starker CYP3A-Inhibitor und auch ein Pgp-Inhibitor) führte zu einem Anstieg von Ripretinib Cmax um 36 % und AUC0-∞ um 99 % und auch zu einem Anstieg seines aktiven Metaboliten DP-5439 AUC0-∞ um 99 % bei unveränderter Cmax. Starke CYP3A- und Pgp-Inhibitoren sind mit Vorsicht einzusetzen und die Patienten sollten überwacht werden.
Starke CYP3A-Induktoren: Bei gleichzeitiger Gabe von QINLOCK mit Rifampicin (einem starken CYP3A-Induktor) verringerte sich die Cmax von Ripretinib um 18% und die AUC0-INF von Ripretinib um 61% sowie die AUC0-INF von DP-5439 um 57%, während sich die Cmax von DP-5439 um 37% erhöhte.
Moderate CYP3A-Induktoren: Für die gleichzeitige Gabe von QINLOCK mit Efavirenz (einem moderaten CYP3A-Induktor) wurde vorhergesagt, dass es zu einer Verringerung der Cmax von Ripretinib um 24% und der AUC0-INF von Ripretinib um 56% kommt.
Magensäure-reduzierende Arzneimittel: Es wurden keine klinisch signifikanten Unterschiede in der Plasma-Exposition mit Ripretinib und DP-5439 beobachtet, wenn QINLOCK zusammen mit Pantoprazol (einem Protonenpumpeninhibitor) gegeben wurde.
In-vitro-Studien
CYP-Enzyme: Ripretinib und DP-5439 sind Inhibitoren von CYP2C8. Ripretinib und DP-5439 sind keine Induktoren von CYP1A2, CYP2B6 oder CYP3A4.
Transporter-Systeme: Ripretinib ist ein Inhibitor von Pgp (P-Glykoprotein) und BCRP (Breast Cancer Resistance Protein). DP-5439 ist ein Substrat für Pgp und BCRP. DP-5439 ist ein Inhibitor von BCRP und MATE1 (Multidrug And Toxin Extrusion Protein 1).
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine Daten zur Anwendung von QINLOCK bei Schwangeren vor, die Angaben zu einem mit dem Präparat verbundenem Risiko zulassen. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Basierend auf Erkenntnissen aus tierexperimentellen Studien und seinem Wirkmechanismus (siehe «Eigenschaften/Wirkungen») kann QINLOCK bei Verabreichung während der Schwangerschaft zu Schädigungen des Fötus führen (siehe «Präklinische Daten»). Während der Schwangerschaft darf QINLOCK nicht verabreicht werden, es sei denn dies ist eindeutig erforderlich.
Schwangere Frauen sind über die potenziellen Risiken für den Fötus aufzuklären.
Gebärfähige Patientinnen sind darauf hinzuweisen, dass sie während der Behandlung mit QINLOCK und mindestens 1 Woche lang nach Einnahme der letzten Dosis von QINLOCK eine effektive Kontrazeption anwenden müssen. Männliche Patienten mit gebärfähigen Partnerinnen sind darauf hinzuweisen, dass sie während der Behandlung mit QINLOCK und mindestens 1 Woche lang nach Einnahme der letzten Dosis von QINLOCK eine effektive Kontrazeption anwenden müssen.
Stillzeit
Es liegen keine Daten über das Vorhandensein von Ripretinib oder dessen Metaboliten in der humanen Muttermilch oder deren Auswirkungen auf das gestillte Kind oder die Milchproduktion vor. Aufgrund der Möglichkeit für das Auftreten unerwünschter Wirkungen bei gestillten Kindern ist Frauen anzuraten, während der Behandlung und für mindestens 1 Woche nach Einnahme der letzten Dosis nicht zu stillen.
Fertilität
Basierend auf Erkenntnissen aus tierexperimentellen Studien kann QINLOCK die Fertilität von männlichen Patienten mit Reproduktionspotenzial beeinträchtigen (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien über die Auswirkungen von QINLOCK auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen durchgeführt. Es ist nicht bekannt, ob QINLOCK einen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, hat.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Häufigkeiten unerwünschter Wirkungen wurden mittels eines gepoolten Datensatzes aus zwei klinischen Studien beurteilt, in denen 392 Erwachsene mit QINLOCK bei fortgeschrittenen Tumoren behandelt wurden, darunter 299 Patienten mit GIST. Die mediane Dauer der Behandlung betrug bei 85 Patienten in der Doppelblindphase der INVICTUS Studie 23.86 Wochen (1,3 – 121.9).
Schwerwiegende unerwünschte Arzneimittelwirkungen, die mit einer Häufigkeit ≥1 % bei mit QINLOCK behandelten Patienten auftraten, waren Anämie (3,8 %), Dyspnoe (2,3 %), Erbrechen (2,0 %), Übelkeit (1,8 %), Abgeschlagenheit (1,5 %), erhöhte Bilirubin-Werte im Blut (1,3 %), Verstopfung (1,0 %) und Muskelschwäche (1,0 %).
Die am häufigsten beobachteten unerwünschten Arzneimittelwirkungen (≥10 %) bei Patienten, die mit QINLOCK behandelt wurden, waren Abgeschlagenheit (51,0 %), Alopezie (50,8 %), Übelkeit (39,8 %), Myalgie (37,8 %), Verstopfung (37,2 %), Durchfall (32,7 %), Gewichtsabnahme (26,5 %), Erbrechen (25,8 %), erhöhte Lipase-Werte (23,7 %), Muskelkrämpfe (23,7 %), Arthralgie (21,2 %), Kopfschmerz (20,7 %), Dyspnoe (20,2 %), trockene Haut (17,6 %), Rückenschmerzen (15,6 %), Husten (15,6 %), erhöhte Bilirubin-Werte im Blut (14,0 %), peripheres Ödem (13,8 %), Hypophosphatämie (12,2 %), Schmerzen in Extremitäten (12,0 %), Pruritus (11,0 %) und seborrhoische Keratose (11,0 %).
Unerwünschte Arzneimittelwirkungen von Grad 3/4, die mit einer Häufigkeit ≥2 % bei mit QINLOCK behandelten Patienten auftraten, waren erhöhte Lipase-Werte (14,8 %), Anämie (14,0 %), Bauchschmerzen (8,2 %), Hypertonie (6,9 %), Abgeschlagenheit (4,1 %), Hypophosphatämie (4,1 %), Erbrechen (2,6 %), Dyspnoe (2,0 %), Durchfall (2,0 %) und erhöhte Bilirubin-Werte im Blut (2,0 %).
Liste der unerwünschten Wirkungen
Die Häufigkeiten sind definiert als: Sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1.000 bis <1/100), selten (≥1/10.000 bis <1/1000), sehr selten (<1/10.000), nicht bekannt (kann aus den verfügbaren Daten nicht geschätzt werden).
Neoplasien, benigne, maligne und unspezifische (einschliesslich Zysten und Polypen)
Sehr häufig: Seborrhoische Keratose (11,0 %)
Häufig: Plattenepithelkarzinom der Haut, fibröses Histiozytom, Pigmentnävus, Hautpapillom
Gelegentlich: Melanom
Endokrine Erkrankungen
Häufig: Hypothyreose.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hypophosphatämie (12,2 %).
Psychiatrische Störungen
Häufig: Depression.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerz (20,7 %).
Häufig: Periphere sensorische Neuropathie.
Herzerkrankungen
Häufig: Herzinsuffizienz, Tachykardie.
Gefässerkrankungen
Sehr häufig: Hypertonie (19,4 %).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Dyspnoe (20,2 %), Husten (15,6 %).
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (39,8 %), Verstopfung (37,2 %), Durchfall (32,7 %), Erbrechen (25,8 %).
Häufig: Stomatitis, Schmerzen im Oberbauch.
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr häufig: Alopezie (50,8 %), palmar-plantares Erythrodysästhesiesyndrom (29,8 %), trockene Haut (17,6 %), Pruritus (11,0 %).
Häufig: Hyperkeratose, makulopapulöser Hautausschlag, generalisierter Pruritus, akneiforme Dermatitis.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Myalgie (37,8 %), Muskelkrämpfe (23,7 %), Arthralgie (21,2 %), Rückenschmerzen (15,6 %), Schmerzen in Extremitäten (12,0 %).
Häufig: Muskelschwäche, muskuloskelettaler Brustschmerz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Abgeschlagenheit (50,1 %), periphere Ödeme (13,8 %).
Untersuchungen
Sehr häufig: Gewichtsabnahme (26,5 %), erhöhte Lipase-Werte (23,7 %), erhöhte Bilirubin-Werte im Blut (14,0 %).
Häufig: Erhöhte Alanin-Aminotransferase-Werte.
Beschreibung ausgewählter unerwünschter Arzneimittelwirkungen gemäss obiger Definition
Palmar-plantares Erythrodysästhesiesyndrom (PPES)
In einer placebokontrollierten Studie wurde das palmar-plantare Erythrodysästhesiesyndrom (PPES) bei 19 von 85 (22,4 %) Patienten im QINLOCK-Arm und bei keinem Patienten im Placebo-Arm berichtet. PPES führte bei 2,4 % der Patienten zu einem Dosisabbruch, bei 3,5 % der Patienten zu einer Dosisunterbrechung und bei 1,2 % der Patienten zu einer Dosisreduktion. Alle Ereignisse hatten einen leichten oder mittleren Schweregrad (58 % Grad 1 und 42 % Grad 2).
In der gepoolten Sicherheitspopulation trat PPES bei 29,8 % von 392 Patienten auf, darunter 0,5 % mit unerwünschten Wirkungen von Grad 3. Die mediane Zeit bis zum Einsetzen des ersten Ereignisses betrug 8,1 Wochen (Bereich: 0,3 Wochen bis 112,1 Wochen) und seine mediane Dauer betrug 24,3 Wochen (Bereich: 0,9 bis 191,7 Wochen).
Hypertonie
In einer placebokontrollierten Studie betrug die Inzidenz von Hypertonie bei den mit QINLOCK behandelten Patienten 15,3 % gegenüber 4,7 % der Patienten, die Placebo erhielten.
In der gepoolten Sicherheitspopulation trat Hypertonie bei 19,4 % von 392 Patienten auf, darunter 6,9 % mit unerwünschten Wirkungen von Grad 3.
Herzinsuffizienz
In einer placebokontrollierten Studie trat Herzinsuffizienz bei 1,2 % der 85 Patienten auf, die QINLOCK erhielten, von denen alle die Behandlung abbrachen. In der Placebogruppe trat bei keinem Patienten eine Herzinsuffizienz auf.
In der gepoolten Sicherheitspopulation trat bei 1,5 % von 392 Patienten Herzinsuffizienz auf (u. a. Herzinsuffizienz, akute Herzinsuffizienz, akute linksventrikuläre Insuffizienz und diastolische Dysfunktion), darunter unerwünschte Wirkungen von Grad 3 bei 1,0 %.
In der gepoolten Sicherheitspopulation lagen bei 299 von 392 Patienten bei Studienbeginn ein Echokardiogramm und mindestens eines nach Studienbeginn vor. Eine verminderte Ejektionsfraktion von Grad 3 trat bei 4,0 % der 299 Patienten auf.
Kutane Tumoren
In einer placebokontrollierten Studie wurden bei 5,9 % der 85 Patienten, die QINLOCK erhielten, kutane Plattenepithelkarzinome (cuSCC; Keratoakanthom, Plattenepithelkarzinom der Haut, Plattenepithelkarzinom; Plattenepithelkarzinom des Kopfes und Halses; alle Ereignisse unabhängig von der Kausalität) berichtet. Bei den mit Placebo behandelten Patienten wurde kein CuSCC berichtet.
In der gepoolten Sicherheitspopulation trat das cuSCC bei 8,7 % von 392 Patienten auf, darunter 0,5 % mit unerwünschten Wirkungen von Grad 3. Melanom (alle Ereignisse unabhängig von der Kausalität) trat bei 0,3 % von 392 Patienten auf.
Myalgie und Arthralgie
In der Doppelblindphase der INVICTUS-Studie wurde bei 36,5 % der mit QINLOCK behandelten Patienten Myalgie beobachtet gegenüber 11,6 % bei den mit Placebo behandelten Patienten (Grad 3/4 bei 1,2 % gegenüber 0 % der Patienten). Arthralgie (alle Grad 1-2) wurde bei 17,6 % der mit QINLOCK behandelten Patienten beobachtet gegenüber 4,7 % bei den mit Placebo behandelten Patienten.
In der gepoolten Sicherheitspopulation wurde Myalgie bei 37,8 % von 392 Patienten beobachtet, darunter 0,5 % mit unerwünschten Wirkungen von Grad 3. Arthralgie wurde bei 21,2 % von 392 Patienten beobachtet.
Alopezie
In einer placebokontrollierten Studie wurde Alopezie bei 44 von 85 (51,8 %) Patienten im QINLOCK-Arm und bei 2 (4,7 %) Patienten im Placebo-Arm berichtet. Alopezie führte bei 1,2 % der Patienten zu einer Dosisunterbrechung und bei 1,2 % der Patienten zu einer Dosisreduktion. Kein Patient brach die Behandlung aufgrund von Alopezie ab.
In der gepoolten Sicherheitspopulation entwickelten 199 von 392 (50,8 %) Patienten, die Ripretinib erhielten, Alopezie. Die mediane Zeit bis zum Einsetzen des ersten Ereignisses betrug 8,3 Wochen (Bereich: 0,1 Wochen bis 89,1 Wochen); die mediane Dauer der Ereignisse betrug 25,0 Wochen (Bereich: 1,1 bis 181,1 Wochen).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs ist kein spezifisches Antidot für Überdosierungen von QINLOCK bekannt. Im Falle des Verdachts auf eine Überdosis ist die Behandlung mit QINLOCK sofort zu unterbrechen, es sind allgemeine unterstützende Massnahmen durch einen Arzt bzw. Ärztin zu ergreifen und der Patient ist bis zur klinischen Stabilisierung zu beobachten.
Eigenschaften/WirkungenATC-Code
L01EX19
Wirkungsmechanismus
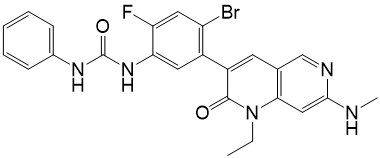
Ripretinib ist ein Kinaseinhibitor. Die chemische Bezeichnung ist 1-(4-Brom-5-[1-ethyl-7-(methylamino)-2-oxo-1,2-dihydro-1,6-naphthyridin-3-yl]-2-fluorophenyl)-3-phenylharnstoff. Die Molekularformel ist C24H21BrFN5O2 und das Molekulargewicht beträgt 510,36 g/mol. Die chemische Struktur von Ripretinib ist nachfolgend dargestellt:
Ripretinib ist ein weisser bis weissgrauer kristalliner Feststoff. Ripretinib ist eine lipophile, schwach basische Verbindung, die in wässrigen Medien praktisch unlöslich ist.
Ripretinib ist ein Tyrosinkinase-Inhibitor, der die KIT-Proto-Oncogene-Receptor-Tyrosinkinase (KIT) und die Platelet-Derived-Growth-Factor-Receptor-A-Kinase (PDGFRA-Kinase) hemmt, einschliesslich Wildtyp sowie primärer und sekundärer Mutationen. Ripretinib hemmt in vitro auch andere Kinasen, wie PDGFRB, TIE2, VEGFR2 und BRAF.
Pharmakodynamik
Expositions-Wirkungs-Beziehungen
Die Expositions-Wirkungs-Beziehungen und der zeitliche Verlauf der Pharmakodynamik von Ripretinib sind noch nicht vollständig charakterisiert worden.
Kardiale Elektrophysiologie
Nach der Behandlung mit QINLOCK bei der empfohlenen Dosis von 150 mg einmal täglich zur oralen Einnahme wurden keine klinisch bedeutsamen QTc-Verlängerungen (d. h. >20 ms) beobachtet.
Klinische Wirksamkeit
Die Bewertung der Wirksamkeit von QINLOCK erfolgte in INVICTUS, einer internationalen, multizentrischen, randomisierten (2:1), doppelblinden, placebokontrollierten Studie (NCT03353753). In die Studie aufgenommene Patienten wiesen inoperable, lokal fortgeschrittene oder metastasierte gastrointestinale Stromatumoren (GIST) auf. Eingeschlossene Patienten hatten eine Progression oder Unverträglichkeit auf Imatinib, Sunitinib und Regorafenib. Die Randomisierung wurde nach vorherigen Therapielinien (3 gegenüber ≥4) und dem Leistungsstatus der Eastern Cooperative Oncology Group (ECOG) (0 gegenüber 1 oder 2) stratifiziert. Die Patienten erhielten QINLOCK 150 mg oder Placebo einmal täglich oral bis zur Krankheitsprogression oder zu einer inakzeptablen Toxizität. Die Beurteilung des Tumoransprechens erfolgte in den ersten 4 Monaten alle 28 Tage und anschliessend alle 56 Tage. Der primäre Wirksamkeitsendpunkt war ein progressionsfreies Überleben (PFS) auf der Basis einer Krankheitsbewertung durch eine verblindete, unabhängige, zentrale Auswertung (BICR) unter Verwendung modifizierter RECIST-1.1-Kriterien, bei denen Lymphknoten und Knochenläsionen keine Zielläsionen waren und progressiv wachsende Tumorrundherde innerhalb einer bereits bestehenden Tumormasse spezifische Kriterien erfüllen mussten, um als eindeutiger Nachweis für eine Krankheitsprogression zu gelten. Zu den weiteren Wirksamkeitsendpunkten gehörten die objektive Ansprechrate (ORR) gemäss BICR und das Gesamtüberleben (OS). Patienten, die entsprechend der Randomisierung ein Placebo erhielten, konnten mit QINLOCK behandelt werden, wenn es zur Krankheitsprogression kam.
Insgesamt wurden 129 Patienten randomisiert, von denen 85 mit QINLOCK und 44 mit Placebo behandelt wurden.
Die Merkmale der Patienten in der Intent-totreat-(ITT)-Population von INVICTUS waren ein medianes Alter von 60 Jahren (Bereich: 29 bis 83 Jahre), mit 39 % 65 Jahre alt; 57 % männlich; 75 % weisse Hautfarbe; 92 % mit einem ECOG-Leistungsstatus von 0 oder 1. 63 % der Patienten hatten 3 vorherige Therapien und 37 % 4 oder mehr vorherige Therapien erhalten. 66 % der auf Placebo randomisierten Patienten wechselten nach der Krankheitsprogression zu QINLOCK.
Die Patienten im QINLOCK-Arm hatten ein medianes PFS von 6,3 Monaten (95%-KI: 4,6, 6,9) im Vergleich zu 1,0 Monat (95%-KI: 0,9, 1,7) im Placebo-Arm, was das Risiko von Krankheitsprogression oder Tod signifikant um 85 % reduzierte (Hazard Ratio von 0,15, p<0,0001).
Eine ORR wurde bei 8 Patienten im Ripretinib-Arm (9,4 %) gegenüber 0 % für Placebo beobachtet (p=0,0504). QINLOCK zeigte ein medianes OS von 15,1 Monaten (95%-KI: 12,3, 15,1) gegenüber 6,6 Monaten (95%-KI: 4,1, 11,6) im Placebo-Arm bei einer Hazard Ratio von 0,36, 95%-KI: 0,21, 0,62).
PharmakokinetikDie Pharmakokinetik von Ripretinib und seinem gleichermassen aktiven Metaboliten (DP-5439) wurde nach Einzeldosen bei gesunden Probanden und mehreren Dosen bei Patienten mit fortgeschrittenen Tumoren untersucht; die Ergebnisse sind in Tabelle 3 zusammengefasst.
Tabelle 3: Pharmakokinetische Parameter von Ripretinib und DP-5439
|
Parameter
|
Ripretinib
|
DP-5439
| |
Allgemeine Informationen
| |
Steady-State-Exposition nach QINLOCK 150 mg einmal täglich
[Mittelwert (VK%)]
|
Cmax (ng/ml)
|
761 (32)
|
804 (46)
| |
AUC0-12h (ng•h/ml)
|
5678 (32)
|
7138 (44)
| |
Dosisproportionalität nach Einzeldosen von QINLOCK bei Patienten mit fortgeschrittenen Tumoren:
|
AUC0-24h stieg proportional über einen Dosisbereich von 20-250 mg (0,13- bis 1,67-faches der empfohlenen Dosis), jedoch war Cmax geringer als dosisproportional.
|
Cmax und AUC0-24h waren innerhalb des Dosisbereichs von 50-250 mg (0,33- bis 1,67-faches der empfohlenen Dosis) geringer als dosisproportional.
| |
Zeit bis zum Steady-State [Tage]
|
14
|
14
| |
Akkumulationsverhältnis (AUC0-12h)
[Mittelwert (VK%)]a
|
1,7 (55)
|
5,29 (49)
| |
Absorption
| |
Tmax [Medianwert in Stunden]b
|
4
|
15,6
| |
Wirkung von Nahrung
|
Es wurden keine klinisch signifikanten Unterschiede bei Cmax und AUC0-24h zwischen der Verabreichung von QINLOCK mit einer Mahlzeit mit hohem Fettgehaltc und im nüchternen Zustand beobachtet.
| |
Distribution
| |
Plasmaproteinbindung (in vitro)
|
Humanes Serumalbumin
|
99,8 %
|
99,7 %
| |
α-1-Säure-Glykoprotein
|
99,4 %
|
>99,8 %
| |
Scheinbares Verteilungsvolumen im Steady-State, l
[Mittelwert (VK%)]b
|
307 (39)
|
507 (51)
| |
Elimination
| |
Scheinbare Clearance, l/h
[Mittelwert (VK%)]b
|
15,3 (45)
|
17,5 (63)
| |
Halbwertszeit, Stunden
[Mittelwert (VK%)]b
|
14,8 (30)
|
17,8 (23)
| |
Metabolismus
| |
Metabolische Wege
|
Primär
|
CYP3A4
|
CYP3A4
| |
Sekundär
|
CYP2C8 und CYP2D6
|
CYP2C8, CYP2E1 und CYP2D6
| |
Exkretionb
| |
Exkretionswege
|
Stuhl
|
34 %
|
6 %
| |
Urin
|
0,02 %
|
0,1 %
| |
a.Schätzung basiert auf Zyklus 1, Tag 15
b.Nach einer oralen Einzeldosis von 150 mg
c.Eine Mahlzeit mit hohem Fettgehalt bestand aus etwa 150 kcal aus Protein, 250 kcal aus Kohlenhydraten und 500-600 kcal aus Fett
VK = Variationskoeffizient; Cmax = maximale Plasmakonzentration; AUC0-12h = Fläche unter der Plasmakonzentration-Zeit-Kurve vom Zeitpunkt 0 bis 12 Stunden; AUC0-24h = Fläche unter der Plasmakonzentration-Zeit-Kurve vom Zeitpunkt 0 bis 24 Stunden; Tmax = Zeit bis zur maximalen Konzentration
|
Kinetik spezieller Patientengruppen
Es wurden keine klinisch bedeutsamen Unterschiede für die Pharmakokinetik von Ripretinib auf der Basis von Alter (19 bis 87 Jahre), Geschlecht, Hautfarbe (weiss, schwarz und asiatisch), Körpergewicht (39 bis 138 kg), Tumorart (GIST oder anderer solider Tumor), vorheriger Gastrektomie, leichter bis mittelschwerer Nierenfunktionsstörung (Kreatinin-Clearance [CLcr] 30 bis <90 ml/min, geschätzt nach Cockcroft-Gault) und leichter Leberfunktionsstörung (Gesamtbilirubin ≤ULN und AST >ULN oder Gesamtbilirubin 1 bis 1,5 × ULN und beliebiger AST-Wert) festgestellt. Die Auswirkungen einer schweren Nierenfunktionsstörung (CLcr 15 bis 29 ml/min) oder einer mittelschweren bis schweren Leberfunktionsstörung (Gesamtbilirubin >1,5 × ULN, beliebiger AST-Wert) auf die Pharmakokinetik von Ripretinib wurden nicht untersucht.
Präklinische DatenToxizität bei wiederholter Gabe
In 13-wöchigen Studien mit wiederholter Verabreichung an Ratten wurden bei Dosen ≥30 mg/kg/Tag (etwa die Hälfte der menschlichen Exposition bei der empfohlenen Dosis von 150 mg) dosisabhängige Befunde mit einer erhöhten Osteoblastenoberfläche und verminderten Trabekeln des Femurs festgestellt. Es gab weitere Befunde mit fehlenden oder verfärbten Zähnen, die von einer dosisabhängigen Schneidezahndegeneration bei Dosen ≥30 mg/kg/Tag begleitet wurden.
Mutagenität
Ripretinib war weder mutagen in einem bakteriellen In-vitro-Rückmutationstest (Ames-Test) noch klastogen in einem In-vitro-Mikronukleustest an humanen Lymphozytenkulturen oder einem In-vivo-Mikronukleustest mit Rattenknochenmark.
Karzinogenität
Es wurden keine Karzinogenitätsstudien mit Ripretinib durchgeführt.
Reproduktionstoxizität
In einer Untersuchung der embryonalen/fetalen Entwicklung, bei der die Verabreichung täglicher Dosen von Ripretinib an Ratten während der Organogenese untersucht wurde, führte Ripretinib bei einer Dosis von 20 mg/kg/Tag (etwa die Hälfte der menschlichen Exposition bei der empfohlenen Dosis von 150 mg) zu Fehlbildungen, die in erster Linie mit dem Herz-Kreislauf- und Skelettsystem assoziiert waren, darunter unterbrochene oder retroösophageal verlaufende Aortenbögen und retroösophageal verlaufende Arteriae subclaviae, Fusionen von Os exoccipitale und erstem Halswirbel, verzweigte und fusionierte Rippen, Anomalien der Hals-, Brust-, Schwanz- und Sakralwirbel, fehlende Phalangen in den Vorderpfoten und fehlende Metakarpalknochen. Bei 20 mg/kg/Tag wurde ebenfalls eine erhöhte Inzidenz anatomischer Abweichungen beobachtet. Abweichungen umfassten Fehlpositionierungen der Ursprünge von Arteria carotis und Arteria subclavia, Fehlpositionierung der Arteria subclavia, ein Fehlen oder eine Elongation der Arteria innominat, Deformationen und höckrige Unregelmässigkeiten der Rippen, zweiteilige unvollständig ossifizierte oder nicht ossifizierte Wirbelcentra, kleine oder deformierte Wirbelbögen und Verminderungen der Ossifikation der Phalangen der Vorder- und Hinterbeine, der Metatarsalknochen der Hinterbeine und der Schwanzwirbel.
In einer vorläufigen Studie zur embryofetalen Entwicklung, in der die Verabreichung von Ripretinib an Kaninchen während der Organogenese untersucht wurde, führte Ripretinib bei Dosen von 150 mg/kg (etwa das 3,5-Fache der menschlichen Exposition bei der empfohlenen Dosis von 150 mg) zum völligen Verlust der Trächtigkeit. Bei einer Dosis von 40 mg/kg (etwa das 2,1-Fache der menschlichen Exposition bei der empfohlenen Dosis von 150 mg) beinhalteten die Toxizitäten erhöhte Postimplantationsverluste und vermindertes fetales Körpergewicht.
Die orale Verabreichung von Ripretinib an trächtige Ratten und Kaninchen während der Organogenese führte zu Fehlbildungen, die in erster Linie mit dem Herz-Kreislauf-System und dem Skelettsystem, anatomischen Abweichungen, einem verminderten fetalen Körpergewicht und erhöhten Postimplantationsverlusten assoziiert waren, bei Expositionen, die ungefähr die Hälfte der empfohlenen Dosis von 150 mg einmal täglich auf Basis der Fläche unter der Kurve (AUC) betrugen.
Fertilität
Mit Ripretinib wurden keine speziellen Fertilitätsstudien an männlichen Tieren durchgeführt. In Toxizitätsstudien mit wiederholter Verabreichung kam es zu Befunden in männlichen Fortpflanzungsorganen, die die Degeneration der Hoden und Zelltrümmer der Nebenhoden bei männlichen Tieren, denen ≥30 mg/kg/Tag (etwa die Hälfte der menschlichen Exposition bei der empfohlenen Dosis von 150 mg) verabreicht wurden, beinhalteten.
Weitere Daten (Phototoxizität)
Aufgrund der Absorption im sichtbaren resp. UV-Bereich (über 290 nm) weist Ripretinib ein Potential für Reizwirkungen bei Lichtexposition/Phototoxizität auf. In vitro an 3T3-Mausfibroblasten durchgeführte Untersuchungen zur Phototoxizität lassen darauf schliessen, dass Ripretinib bei klinisch relevanten Konzentrationen nach Exposition gegenüber UVA- und UVB-Strahlung ein phototoxisches Potential besitzt.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25 °C) lagern. In der Originalverpackung aufbewahren. Zum Schutz vor Feuchtigkeit und Licht im Originalbehälter mit dem Trockenmittel aufbewahren. Deckel nach jedem Öffnen wieder fest verschliessen. Trockenmittel nicht entfernen.
Für Kinder unzugänglich aufbewahren.
Zulassungsnummer68199 (Swissmedic)
PackungenPackungsgrössen von 90 Tabletten. [A]
ZulassungsinhaberinDeciphera Pharmaceuticals (Schweiz) AG, Zug
Stand der InformationNovember 2022
|

