Eigenschaften/WirkungenATC-Code
A10BJ06
Wirkungsmechanismus
Semaglutide ist ein GLP-1-Analogon mit einer Sequenzhomologie von 94 % zum humanen GLP-1. Semaglutide wirkt als GLP-1-Rezeptoragonist, der selektiv an den GLP-1-Rezeptor, das Ziel für natives GLP-1, bindet und diesen aktiviert.
Verglichen mit nativem GLP-1 weist Semaglutide eine verlängerte Halbwertszeit von ungefähr 1 Woche auf, wodurch es sich für die einmal wöchentliche subkutane Anwendung eignet. Der Hauptmechanismus der Verzögerung ist die Albuminbindung, die eine verminderte renale Clearance und den Schutz vor metabolischem Abbau zur Folge hat. Darüber hinaus ist Semaglutide gegen den Abbau durch das Enzym DDP-4 stabilisiert.
GLP-1 ist ein physiologisches Hormon, das bei der Regulierung von Appetit und Kalorienaufnahme wirkt; der GLP-1-Rezeptor ist in verschiedenen Bereichen des Gehirns vorhanden, die an der Appetitregulierung beteiligt sind. Semaglutide hat direkte Wirkungen auf Gehirnregionen, die an der homöostatischen Regulierung der Nahrungsaufnahme im Hypothalamus und Hirnstamm beteiligt sind. Semaglutide beeinflusst das hedonische Belohnungssystem über direkte und indirekte Wirkungen auf Gehirnregionen wie Septum, Thalamus und Amygdala.
Klinische Studien zeigen, dass Semaglutide die Energieaufnahme verringert, die Wahrnehmung von Sättigung, Völlegefühl und Esskontrolle erhöht, das Hungergefühl dämpft und die Häufigkeit sowie Intensität von Heisshunger verringert.
Ausserdem wurde in klinischen Studien gezeigt, dass Semaglutide den Blutzuckerspiegel glucoseabhängig durch Stimulation der Insulinsekretion und Senkung der Glucagonsekretion senkt, wenn der Blutzuckerspiegel hoch ist. Der Mechanismus der Blutzuckersenkung geht auch mit einer leicht verlangsamten Entleerung des Magens in der frühen postprandialen Phase einher. Während einer Hypoglykämie verringert Semaglutide die Sekretion von Insulin, vermindert aber nicht die Glucagonsekretion.
GLP-1-Rezeptoren sind auch im Herz, im Gefässsystem, Immunsystem und in den Nieren exprimiert.
Der Wirkmechanismus von Semaglutide zur Reduktion des kardiovaskulären Risikos ist wahrscheinlich multifaktoriell und nicht vollständig geklärt, zum Teil vermittelt durch die Wirkungen auf bekannte kardiovaskuläre Risikofaktoren (einschliesslich Blutdrucksenkung, Verbesserung des Lipidprofils, und antiinflammatorischer Effekte).
Pharmakodynamik
Appetit, Energieaufnahme und Nahrungsmittelwahl
Wegovy senkt den Appetit durch Steigerung des Sättigungs- und Völlegefühls und vermindert Hunger sowie die prospektive Nahrungsaufnahme. Nach 20 Wochen Behandlung war die Energieaufnahme bei einer Ad-libitum-Mahlzeit unter Wegovy um 35 % niedriger als unter Placebo. Dies ging einher mit einer verbesserten Esskontrolle, weniger Heisshunger (auf Milchprodukte und herzhafte Nahrungsmittel), weniger Verlangen nach Süssem und einer relativ geringeren Präferenz für fettreiche Nahrungsmittel.
Kardiale Elektrophysiologie (QTc)
Die Wirkung von Semaglutide auf die kardiale Repolarisation wurde in einer ausführlichen QTc-Studie untersucht. Semaglutide verlängerte das QTc-Intervall bei Dosen bis zu 1,5 mg im Steady-State nicht.
Die Semaglutide-Exposition bei Probanden mit Übergewicht oder Adipositas, die mit Wegovy behandelt werden, ist vergleichbar mit der Exposition, die in der Semaglutid-QTc-Studie an gesunden Probanden untersucht wurde.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Wegovy für die Gewichtsregulierung in Kombination mit einer kalorienreduzierten Ernährung und verstärkter körperlicher Aktivität wurden in vier 68-wöchigen, doppelblinden, randomisierten, placebo-kontrollierten Phase-3a-Studien (STEP 1–4) untersucht. Insgesamt 4684 Patienten (2652 zur Behandlung mit Wegovy randomisiert) wurden in die Studien eingeschlossen. Darüber hinaus wurden die Wirksamkeit und Sicherheit von Semaglutide im Vergleich zu Placebo über zwei Jahre in einer doppelblinden, randomisierten, placebokontrollierten Phase-3b-Studie (STEP 5) mit 304 Patienten (152 unter Behandlung mit Semaglutide) untersucht.
Die Behandlung mit Wegovy ergab im Vergleich mit Placebo einen überlegenen, klinisch relevanten und anhaltenden Gewichtsverlust bei Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung.
Darüber hinaus erreichte in allen Studien ein höherer Anteil der Patienten mit Semaglutide einen Gewichtsverlust von ≥5 %, ≥10 %, ≥15 % und ≥20 % als mit Placebo.
Die Behandlung mit Wegovy zeigte auch statistisch signifikante Verbesserungen des Taillenumfangs und systolischen Blutdrucks gegenüber Placebo. Darüber hinaus wirkte sich Semaglutide 2.4 mg im Vergleich zu Placebo insgesamt günstig auf die Plasmalipide und CRP (Entzündungsmarker) aus (siehe Tabelle 4 und Tabelle 5).
Die Wirksamkeit in Bezug auf die Gewichtsabnahme erwies sich unabhängig von Alter, Geschlecht, ethnischer Zugehörigkeit, den Ausgangswerten von Körpergewicht und BMI, Vorliegen eines Diabetes Typ 2 und dem Grad der Nierenfunktion.
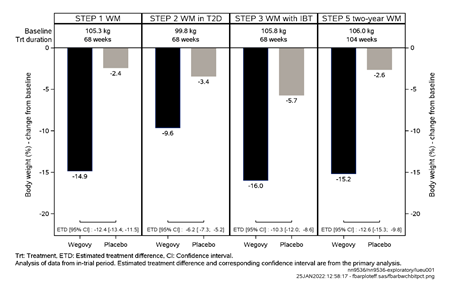
Abbildung 1 Körpergewichtveränderung (%) zwischen Studienbeginn und Woche 68 und 104
STEP 1: Gewichtsmanagement
In einer 68-wöchigen, doppelblinden Studie wurden 1 961 Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung zur Behandlung mit Wegovy oder Placebo randomisiert. Alle Patienten hielten während der gesamten Studie eine kalorienreduzierte Diät und erhöhte körperliche Aktivität ein. Die Mehrzahl der Patienten hatte mindestens eine gewichtsbedingte Begleiterkrankung. Dazu gehörten unter anderem Prä-Diabetes (43.7 %), Dyslipidämie (37.0 %), Hypertonie (36.0 %), Osteoarthrose des Knie- oder Hüftgelenks (15.9 %), obstruktive Schlafapnoe (11.7 %), Asthma/chronisch-obstruktive Lungenerkrankung (COPD) (11.6 %), Lebererkrankung (nicht-alkoholische Fettleber (NAFLD) oder nicht-alkoholische Steatohepatitis (NASH)) (8.6 %) und polyzystisches Ovarialsyndrom (PCOS) (6.6 %).
Der Gewichtsverlust trat früh ein und setzte sich während der Studie fort. Am Behandlungsende (Woche 68) war der Gewichtsverlust verglichen mit Placebo überlegen und klinisch relevant (siehe Tabelle 4 und Abbildung 2).
Im Anschluss an die 68-wöchige Studie wurde eine 52-wöchige Verlängerung ohne Behandlung durchgeführt, welche 327 Patienten einschloss, die den Hauptstudienzeitraum mit der Erhaltungsdosis von Semaglutide oder Placebo abgeschlossen hatten. In der behandlungsfreien Zeit von Woche 68 bis Woche 120 nahm das durchschnittliche Körpergewicht in beiden Behandlungsgruppen zu. Bei den Patienten, die während des Hauptstudienzeitraums mit Semaglutide behandelt worden waren, blieb das Gewicht jedoch um 5.6 % unter dem Ausgangswert, verglichen mit 0.1 % in der Placebogruppe.
Tabelle 4: Ergebnisse einer 68-wöchigen Studie zum Vergleich von Wegovy mit Placebo bei Patienten mit Adipositas oder Übergewicht und mindestens einer gewichtsbezogenen Begleiterkrankung (STEP 1)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
1'306
|
655
| |
Körpergewicht
| |
Ausgangswert (kg)
|
105.4
|
105.2
| |
Änderung (%) gegenüber Ausgangswert1,2
|
-14.9
|
-2.4
| |
Unterschied (%) gegenüber Placebo1
[95 %-KI]
|
-12.4
[-13.4; -11.5]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert
|
-15.3
|
-2.6
| |
Unterschied (kg) gegenüber Placebo1
[95 %-KI]
|
-12.7
[-13.7; -11.7]
|
-
| |
Patienten (%) mit Gewichtsverlust ≥5 %3
|
83.5*
|
31.1
| |
Patienten (%) mit Gewichtsverlust ≥10 %3
|
66.1*
|
12.0
| |
Patienten (%) mit Gewichtsverlust ≥15 %3
|
47.9*
|
4.8
| |
Patienten (%) mit Gewichtsverlust ≥20 %3
|
30.2
|
1.7
| |
Taillenumfang (cm)
| |
Ausgangswert
|
114.6
|
114.8
| |
Änderung gegenüber Ausgangswert1
|
-13.5
|
-4.1
| |
Unterschied gegenüber Placebo1
[95 %-KI]
|
-9.4
[-10.3; -8.5]*
|
-
| |
Kardiometabolische Faktoren
| |
Systolischer Blutdruck (mmHg)
| |
Ausgangswert
|
126
|
127
| |
Änderung gegenüber Ausgangswert1
|
-6.2
|
-1.1
| |
Unterschied gegenüber Placebo1
[95 %-KI]
|
-5.1
[-6.3; -3.9]*
|
-
| |
Diastolischer Blutdruck (mmHg)
| |
Ausgangswert
|
80
|
80
| |
Änderung gegenüber Ausgangswert
|
-2.8
|
-0.4
| |
Unterschied gegenüber Placebo [95 %-KI]
|
-2.4
[-3.3; -1.6]
|
-
| |
Lipide
| |
Total Cholesterol
| |
Ausgangswert (mmol/l)4
|
4.9
|
5.0
| |
Änderung (%) gegenüber Ausgangswert1
|
-3.3
|
0.1
| |
Relativer Unterschied (%) gegenüber Placebo [95 %-KI]1
|
-3.3
[-4.8; -1.8]
|
-
| |
LDL Cholesterol
| |
Ausgangswert (mmol/l)
|
2.9
|
2.9
| |
Änderung (%) gegenüber Ausgangswert1
|
-2.5
|
1.3
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-3.8
[-5.9; -1.5]
|
-
| |
HDL Cholesterol
| |
Ausgangswert (mmol/l)4
|
1.3
|
1.3
| |
Änderung (%) gegenüber Ausgangswert1
|
5.2
|
1.4
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
3.8
[2.2; 5.4]
|
-
| |
Triglycerides
| |
Ausgangswert (mmol/l)4
|
1.4
|
1.4
| |
Änderung (%) gegenüber Ausgangswert1
|
-21.9
|
-7.3
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-15.8
[-18.8; -12.7]
|
-
| |
CRP
| |
Ausgangswert (mg/l)
|
3.9
|
3.9
| |
Änderung (%) gegenüber Ausgangswer1
|
-52.6
|
-15.0
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-44.3
[-49.5; -38.5]
|
-
| |
Glykämischer Status
| |
Patienten (%) mit Prä-Diabetes bei Baseline
|
43.7
| |
Patienten (%) mit normoglykämischem Status bei Behandlungsende
|
84.1
|
47.8
|
* p < 0.0001 (unkorrigiert 2-seitig) für Überlegenheit.
1 Geschätzt mithilfe eines ANCOVA-Modells mit multipler Imputation auf Basis aller Daten unabhängig vom Abbruch der randomisierten Behandlung oder dem Beginn einer anderen medikamentösen Behandlung gegen Adipositas oder bariatrischer Chirurgie.
2 Während der Studie wurde die randomisierte Behandlung von 17.1 % und 22.4 % der Patienten abgebrochen, die zu Wegovy bzw. Placebo randomisiert waren. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Therapien gegen Adipositas erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -16.9 % für 2.4 mg Semaglutide und -2.4 % für Placebo, basierend auf einem gemischten Modell für wiederholte Messungen unter Einschluss aller Beobachtungen bis zum ersten Absetzen.
3 Geschätzt mit einem binären Regressionsmodell auf Basis desselben Imputationsverfahrens wie bei der primären Analyse.
4 Geometrisches Mittel.
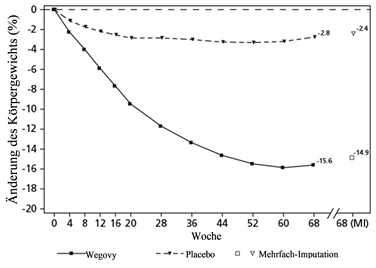
Beobachtete Werte für Patienten, die jeden geplanten Besuch absolvierten, und Schätzungen mit multiplen Imputationen (MI) für Abbrecher mit Abschlussuntersuchung («retrieved dropouts»).
Abbildung 2 STEP 1 - Mittlere Veränderung des Körpergewichts (%) von Baseline bis Woche 68
STEP 2: Gewichtsmanagement bei Patienten mit Diabetes Typ 2
In einer 68-wöchigen, doppelblinden Studie wurden 1 210 Patienten mit Übergewicht oder Adipositas (BMI ≥27 kg/m2) und Diabetes Typ 2 auf Wegovy, Semaglutide 1 mg einmal wöchentlich oder Placebo randomisiert. In die Studie wurden Patienten mit unzureichend eingestelltem Diabetes (HbA1c 7–10 %) aufgenommen, die entweder mit Diät und körperlicher Bewegung alleine oder mit 1–3 oralen Antidiabetika behandelt wurden. Alle Patienten hielten während der gesamten Studie eine kalorienreduzierte Diät und erhöhte körperliche Aktivität ein. Die Mehrzahl der Patienten hatte mindestens zwei gewichtsbedingte Begleiterkrankungen. Neben dem Diabetes Typ 2 waren dies unter anderem Hypertonie (69.8 %), Dyslipidämie (68.0 %), Osteoarthrose des Knie- oder Hüftgelenks (19.6 %), Lebererkrankung (NAFLD oder NASH) (22.6 %), obstruktive Schlafapnoe (15.1 %), Asthma/COPD (8.4 %) und PCOS (4.1 %).
Die Behandlung mit Wegovy über 68 Wochen führte zu einer überlegenen und klinisch relevanten Senkung des Körpergewichts und des HbA1c als unter Placebo (siehe Tabelle 5 und Abbildung 3).
Tabelle 5: Ergebnisse einer 68-wöchigen Studie zum Vergleich von Wegovy mit Placebo bei Patienten mit Fettleibigkeit oder Übergewicht und Diabetes Typ 2 (STEP 2)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
404
|
403
| |
Körpergewicht
| |
Ausgangswert (kg)
|
99.9
|
100.5
| |
Änderung (%) gegenüber Ausgangswert1,2
|
-9.6
|
-3.4
| |
Unterschied (%) gegenüber Placebo1
[95 %-KI]
|
-6.2
[-7.3; -5.2]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert
|
-9.7
|
-3.5
| |
Unterschied (kg) gegenüber Placebo1
[95 %-KI]
|
-6.1
[-7.2; -5.0]
|
-
| |
Patienten (%) mit Gewichtsverlust ≥5 %3
|
67.4*
|
30.2
| |
Patienten (%) mit Gewichtsverlust ≥10 %3
|
44.5*
|
10.2
| |
Patienten (%) mit Gewichtsverlust ≥15 %3
|
25.0*
|
4.3
| |
Patienten (%) mit Gewichtsverlust ≥20 %3
|
12.8
|
2.3
| |
Taillenumfang (cm)
| |
Ausgangswert
|
114.5
|
115.5
| |
Änderung gegenüber Ausgangswert1
|
-9.4
|
-4.5
| |
Unterschied gegenüber Placebo1 [95 %-KI]
|
-4.9
[-6.0; -3.8]*
|
-
| |
Kardiometabolische Faktoren
| |
Systolischer Blutdruck (mmHg)
| |
Ausgangswert
|
130
|
130
| |
Änderung gegenüber Ausgangswert1
|
-3.9
|
-0.5
| |
Unterschied gegenüber Placebo1 [95 %-KI]
|
-3.4
[-5.6; -1.3]**
|
-
| |
Diastolischer Blutdruck (mmHg)
| |
Ausgangswert
|
80
|
80
| |
Änderung gegenüber Ausgangswert
|
-1.6
|
-0.9
| |
Unterschied gegenüber Placebo [95 %-KI]
|
-0.7
[-2.0; 0.6]
|
-
| |
Lipide
| |
Total Cholesterol
| |
Ausgangswert (mmol/l)4
|
4.4
|
4.4
| |
Änderung (%) gegenüber Ausgangswert1
|
-1.4
|
-0.5
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-0.9
[-3.6; 2.0]
|
-
| |
LDL Cholesterol
| |
Ausgangswert (mmol/l)4
|
2.3
|
2.3
| |
Änderung (%) gegenüber Ausgangswert1
|
0.5
|
0.1
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
0.4
[-4.0; 4.9]
|
-
| |
HDL Cholesterol
| |
Ausgangswert (mmol/l)4
|
1.2
|
1.1
| |
Änderung (%) gegenüber Ausgangswert1
|
6.9
|
4.1
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
2.7
[0.3; 5.1]
|
-
| |
Triglycerides
| |
Ausgangswert (mmol/l)4
|
1.7
|
1.8
| |
Änderung (%) gegenüber Ausgangswert1
|
-22.0
|
-9.4
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-13.9
[-19.0; -8.4]
|
-
| |
CRP
| |
Ausgangswert (mg/l)
|
3.5
|
3.4
| |
Änderung (%) gegenüber Ausgangswer1
|
-48.9
|
-16.7
| |
Relativer Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-38.7
[-46.5; -29.8]
|
-
| |
Glykämische Faktoren
| |
HbA1c (mmol/mol (%)
| |
Ausgangswert
|
65.3 (8.1)
|
65.3 (8.1)
| |
Änderung gegenüber Ausgangswert1,2
|
-17.5 (-1.6)
|
-4.1 (-0.4)
| |
Unterschied gegenüber Placebo1 [95 %-KI]
|
-13.5
[-15.5; -11.4]
(-1.2 [-1.4; -1.1])*
|
-
-
| |
Patienten (%), die einen HbA1c-Wert < 7 %
erreichten3
|
77.4
|
26.0
| |
Patienten (%), die einen HbA1c-Wert
≤6.5 % erreichten3
|
65.9
|
15.1
|
* p < 0.001 (unkorrigiert 2-seitig) für Überlegenheit; ** p < 0.05 (unkorrigiert 2-seitig) für Überlegenheit.
1 Geschätzt mithilfe eines ANCOVA-Modells mit multipler Imputation auf Basis aller Daten unabhängig vom Abbruch der randomisierten Behandlung oder dem Beginn einer anderen medikamentösen Behandlung gegen Adipositas oder bariatrischer Chirurgie.
2 Während der Studie wurde die randomisierte Behandlung von 11.6 % und 13.9 % der Patienten abgebrochen, die zu Wegovy bzw. Placebo randomisiert waren. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Therapien gegen Adipositas erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -10.6 % für 2.4 mg Semaglutide und -3.1 % für Placebo, basierend auf einem gemischten Modell für wiederholte Messungen unter Einschluss aller Beobachtungen bis zum ersten Absetzen.
3 Geschätzt mit einem binären Regressionsmodell auf Basis desselben Imputationsverfahrens wie bei der primären Analyse.
4 Geometrisches Mittel

Beobachtete Werte für Patienten, die jeden geplanten Besuch absolvierten, und Schätzungen mit multiplen Imputationen (MI) für Abbrecher mit Abschlussuntersuchung («retrieved dropouts»).
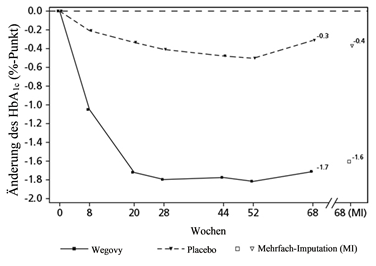
HbA1c: Hämoglobin A1c
Beobachtete Werte für Patienten, die jeden geplanten Besuch absolvierten, und Schätzungen mit multiplen Imputationen für Abbrecher mit Abschlussuntersuchung («retrieved dropouts») (RD-MI).
Abbildung 3 STEP 2 - Mittlere Veränderung des Körpergewichts (kg) und des HbA1c-Wertes (%) zwischen Studienbeginn und Woche 68
STEP 3: Gewichtsmanagement mit intensiver Verhaltenstherapie
In einer 68-wöchigen, doppelblinden Studie wurden 611 Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung zur Behandlung mit Wegovy oder Placebo randomisiert. Während der Studie erhielten alle Patienten eine intensive Verhaltenstherapie (IBT), bestehend aus einer sehr restriktiven Diät, vermehrter körperlicher Aktivität und einer Verhaltensberatung.
Die Mehrzahl der Patienten hatte mindestens eine gewichtsbedingte Begleiterkrankung. Dazu gehörten unter anderem Prä-Diabetes (49.8 %), Hypertonie (34.7 %), Dyslipidämie (34.7 %), Osteoarthrose des Knie- oder Hüftgelenks (18.7 %), Asthma/COPD (15.1 %), obstruktive Schlafapnoe (12.6 %), Lebererkrankung (NAFLD oder NASH) (6.1 %) und PCOS (5.5 %).
Die Behandlung mit Wegovy und IBT über 68 Wochen führte zu einer überlegenen und klinisch relevanten Senkung des Körpergewichts als unter Placebo (siehe Tabelle 6).
Tabelle 6: Ergebnisse einer 68-wöchigen Studie zum Vergleich von Wegovy mit Placebo bei Patienten mit Adipositas oder Übergewicht und mindestens einer gewichtsbezogenen Begleiterkrankung unter Intensiver Verhaltenstherapie (STEP 3)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
407
|
204
| |
Körpergewicht
| |
Ausgangswert (kg)
|
106.9
|
103.7
| |
Änderung (%) gegenüber Ausgangswert1,2
|
-16.0
|
-5.7
| |
Unterschied (%) gegenüber Placebo1
[95 %-KI]
|
-10.3
[-12.0; -8.6]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert
|
-16.8
|
-6.2
| |
Unterschied (kg) gegenüber Placebo1
[95 %-KI]
|
-10.6
[-12.5; -8.8]
|
-
| |
Patienten (%) mit Gewichtsverlust ≥5 %3
|
84.8*
|
47.8
| |
Patienten (%) mit Gewichtsverlust ≥10 %3
|
73.0*
|
27.1
| |
Patienten (%) mit Gewichtsverlust ≥15 %3
|
53.5*
|
13.2
| |
Patienten (%) mit Gewichtsverlust ≥20 %3
|
33.9
|
3.5
| |
Taillenumfang (cm)
| |
Ausgangswert
|
113.6
|
111.8
| |
Änderung gegenüber Ausgangswert1
|
-14.6
|
-6.3
| |
Unterschied gegenüber Placebo1 [95 %-KI]
|
-8.3
[-10.1; -6.6]*
|
-
|
* p < 0.0001 (unkorrigiert 2-seitig) für Überlegenheit.
1 Geschätzt mithilfe eines ANCOVA-Modells mit multipler Imputation auf Basis aller Daten unabhängig vom Abbruch der randomisierten Behandlung oder dem Beginn einer anderen medikamentösen Behandlung gegen Adipositas oder bariatrischer Chirurgie.
2 Während der Studie wurde die randomisierte Behandlung von 16.7 % und 18.6 % der Patienten abgebrochen, die zu Wegovy bzw. Placebo randomisiert waren. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Therapien gegen Adipositas erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -17.6 % für 2.4 mg Semaglutide und -5.0 % für Placebo, basierend auf einem gemischten Modell für wiederholte Messungen unter Einschluss aller Beobachtungen bis zum ersten Absetzen.
3 Geschätzt mit einem binären Regressionsmodell auf Basis desselben Imputationsverfahrens wie bei der primären Analyse.

Beobachtete Werte für Patienten, die jeden geplanten Besuch abschliessen, und Schätzungen mit Mehrfach-Anrechnungen (MI) der Dropouts
Abbildung 4 STEP 3 - Mittlere Veränderung des Körpergewichts (%) von Baseline bis Woche 68
STEP 4: Langfristiges Gewichtsmanagement
In einer 68-wöchigen, doppelblinden Studie wurden 902 Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung aufgenommen. Alle Patienten hielten während der gesamten Studie eine kalorienreduzierte Diät und erhöhte körperliche Aktivität ein. Von Woche 0 bis Woche 20 (Run-in Phase) erhielten alle Patienten Wegovy. In Woche 20 (Baseline) wurden 803 Patienten, die die Erhaltungsdosis von 2.4 mg erreicht hatten, zu Weiterbehandlung oder Umstellung auf Placebo für die restlichen 48 Wochen randomisiert.
Die Mehrzahl der Patienten hatte mindestens eine gewichtsbedingte Begleiterkrankung. Dazu gehörten unter anderem Prä-Diabetes (46.8 %), Hypertonie (37.1 %), Dyslipidämie (35.9 %), Osteoarthrose des Knie- oder Hüftgelenks (13.3 %), obstruktive Schlafapnoe (11.7 %), Asthma/COPD (11.5 %), Lebererkrankung (NAFLD oder NASH) (7.3 %) und PCOS (3.9 %).
Patienten, die in Woche 20 (Baseline) die Erhaltungsdosis von 2.4 mg erreicht hatten und 48 Wochen lang (Woche 20–68) mit Wegovy weiterbehandelt wurden, verloren weiter an Gewicht und erzielten eine überlegene und klinisch relevante Reduktion des Körpergewichts gegenüber denjenigen, die auf Placebo umgestellt worden waren (siehe Tabelle 7 und Abbildung 5). Bei den Patienten, die in Woche 20 (Baseline) auf Placebo umgestellt worden waren, nahm das Körpergewicht zwischen Woche 20 und Woche 68 dagegen wieder stetig zu. Dennoch blieb das beobachtete Körpergewicht in Woche 68 niedriger als zu Beginn der Run-in Phase (Woche 0) (siehe Abbildung 5). Patienten, die von Woche 0 (Einleitung) bis Woche 68 (Behandlungsende) mit Wegovy behandelt wurden, erreichten eine mittlere Veränderung des Körpergewichts von 17.4 %, wobei ein Gewichtsverlust von ≥5 %, ≥10 % ≥15 % oder ≥20 % von 87.8 %, 78.0 %, 62.2 % bzw. 38.6 % dieser Patienten erreicht wurde.
Tabelle 7: Ergebnisse des 48-wöchigen (Woche 20 bis Woche 68) randomisierten Zeitraum der Studie zum Vergleich von Wegovy mit Placebo bei Patienten mit Adipositas oder Übergewicht und mindestens einer gewichtsbezogenen Begleiterkrankung (STEP 4)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
535
|
268
| |
Körpergewicht
| |
Ausgangswert1 (kg)
|
96.5
|
95.4
| |
Änderung (%) gegenüber Ausgangswert1,2,3
|
-7.9
|
6.9
| |
Unterschied (%) gegenüber Placebo2
[95 %-KI]
|
-14.8
[-16.0; -13.5]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert1
|
-7.1
|
6.1
| |
Unterschied (kg) gegenüber Placebo2
[95 %-KI]
|
-13.2
[-14.3; -12.0]
|
-
| |
Taillenumfang (cm)
| |
Ausgangswert1
|
105.5
|
104.7
| |
Änderung gegenüber Ausgangswert1,2
|
-6.4
|
3.3
| |
Unterschied gegenüber Placebo2 [95 %-KI]
|
-9.7
[-10.9; -8.5]*
|
-
|
* p < 0.0001 (unkorrigiert 2-seitig) für Überlegenheit.
1 Ausgangswert = Woche 20.
2 Geschätzt mithilfe eines ANCOVA-Modells mit multipler Imputation auf Basis aller Daten unabhängig vom Abbruch der randomisierten Behandlung oder dem Beginn einer anderen medikamentösen Behandlung gegen Adipositas oder bariatrischer Chirurgie.
3 Während der Studie wurde die randomisierte Behandlung von 5.8 % und 11.6 % der Patienten abgebrochen, die zu Wegovy bzw. Placebo randomisiert waren. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Therapien gegen Adipositas erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -8.8 % für 2.4 mg Semaglutide und 6.5 % für Placebo, basierend auf einem gemischten Modell für wiederholte Messungen unter Einschluss aller Beobachtungen bis zum ersten Absetzen.
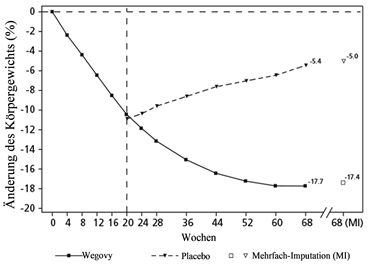
Beobachtete Werte für Patienten, die jeden geplanten Besuch absolvierten, und Schätzungen mit multiplen Imputationen (MI) für Abbrecher mit Abschlussuntersuchung («retrieved dropouts»).
Abbildung 5 STEP 4 - Mittlere Veränderung des Körpergewichts (%) zwischen Woche 0 und Woche 68
STEP 5: 2-Jahres-Daten
In einer 104-wöchigen doppelblinden Studie wurden 304 Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung auf Semaglutide oder Placebo randomisiert. Alle Patienten erhielten für die Dauer der Studie eine kalorienreduzierte Diät mit erhöhter körperlicher Aktivität.
Bei Studienbeginn hatten die Patienten einen durchschnittlichen BMI von 38.5 kg/m2 und ein durchschnittliches Körpergewicht von 106.0 kg.
Die Behandlung mit Wegovy über 104 Wochen führte zu einer überlegenen und klinisch relevanten Reduktion des Körpergewichts im Vergleich zu Placebo (siehe Tabelle 8 und Abbildung 6). Das durchschnittliche Körpergewicht nahm unter Wegovy ab Studienbeginn bis zur Woche 68 ab, danach wurde ein Plateau erreicht. Unter Placebo nahm das durchschnittliche Körpergewicht weniger stark ab, und nach etwa 20 Behandlungswochen wurde ein Plateau erreicht Die mit Semaglutide behandelten Patienten erreichten eine mittlere Änderung des Körpergewichts von -15.2 %, wobei der Gewichtsverlust bei 74.7 % der Patienten ≥5 %, bei 59.2 % ≥10 % und bei 49.7 % ≥15 % betrug.
Tabelle 8: Ergebnisse einer 104-wöchigen Studie zum Vergleich von Wegovy mit Placebo bei Patienten mit Adipositas oder Übergewicht und mindestens einer gewichtsbezogenen Begleiterkrankung (STEP 5)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
152
|
152
| |
Körpergewicht
| |
Ausgangswert1 (kg)
|
105.6
|
106.5
| |
Änderung (%) gegenüber Ausgangswert1,2
|
-15.2
|
-2.6
| |
Unterschied (%) gegenüber Placebo1 [95 %-KI]
|
-12.6 [-15.3; -9.8]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert
|
-16.1
|
-3.2
| |
Unterschied (kg) gegenüber Placebo1 [95 %-KI]
|
-12.9 [-16.1;-9.8]
|
-
| |
Patienten (%) mit Gewichtsverlust ≥5 %3
|
74.7*
|
37.3
| |
Taillenumfang (cm)
| |
Ausgangswert
|
115.8
|
115.7
| |
Änderung gegenüber Ausgangswert1
|
-14.4
|
-5.2
| |
Unterschied gegenüber Placebo1 [95 %-KI]
|
-9.2 [-12.2; -6.2]*
|
-
| |
* p < 0.0001 (unbereinigt 2-seitig) für Überlegenheit.
1 Geschätzt anhand eines ANCOVA-Modells mit multipler Imputation auf Grundlage aller Daten, unabhängig vom Abbruch der randomisierten Behandlung, Einleitung einer anderen medikamentösen Adipositastherapie oder bariatrischer Chirurgie.
2 Während der Studie wurde die randomisierte Behandlung von 13.2 % der Patienten, die auf Semaglutide und 27.0 % der Patienten, die auf Placebo randomisiert worden waren, dauerhaft abgebrochen. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Adipositastherapien erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -16.7 % für Semaglutide und -0.6 % für Placebo, auf der Grundlage eines gemischten Modells für wiederholte Messungen, das alle Beobachtungen bis zum ersten Absetzen einschliesst.
3 Geschätzt anhand eines binären Regressionsmodells auf der Grundlage desselben Imputationsverfahrens wie in der Primäranalyse.
|
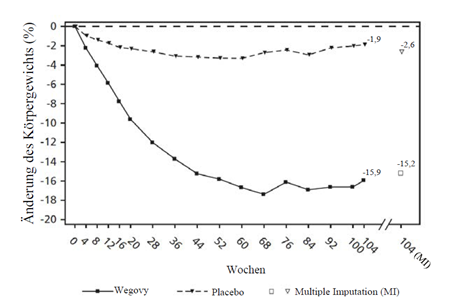
Beobachtete Werte für Patienten, die jeden geplanten Besuch absolvierten, und Schätzungen mit multiplen Imputationen (MI) für Abbrecher mit Abschlussuntersuchung («retrieved dropouts»).
Abbildung 6 STEP 5 - Mittlere Veränderung des Körpergewichts (%) zwischen Woche 0 und Woche 104
STEP 8: Semaglutide gegenüber Liraglutide
In einer 68-wöchigen, randomisierten, unverblindeten, paarweise placebokontrollierten Studie wurden 338 Patienten mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 bis < 30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung auf Wegovy einmal wöchentlich, Liraglutide 3 mg einmal täglich oder Placebo randomisiert. Wegovy einmal wöchentlich und Liraglutide 3 mg waren unverblindet, aber jede aktive Behandlungsgruppe war doppelt verblindet gegenüber Placebo, das mit der gleichen Dosierungsfrequenz verabreicht wurde. Alle Patienten erhielten für die Dauer der Studie eine kalorienreduzierte Diät mit erhöhter körperlicher Aktivität.
Bei Studienbeginn hatten die Patienten einen durchschnittlichen BMI von 37.5 kg/m2 und ein durchschnittliches Körpergewicht von 104.5 kg.
Das durchschnittliche Körpergewicht nahm unter Wegovy ab Studienbeginn bis zur Woche 68 ab. Mit Liraglutide war die Reduktion des mittleren Körpergewichts geringer (siehe Tabelle 9). 37.4 % der mit Semaglutide behandelten Patienten verloren ≥20 %, verglichen mit 7.0 % unter Liraglutide.
Tabelle 9: STEP 8: Ergebnisse einer 68-wöchigen Studie zum Vergleich von Semaglutide und
Liraglutide
|
|
Wegovy
|
Liraglutide 3 mg
| |
Full analysis set (N)
|
126
|
127
| |
Körpergewicht
| |
Ausgangswert (kg)
|
102.5
|
103.7
| |
Änderung (%) gegenüber Ausgangswert1,2,3
|
-15.8
|
-6.4
| |
Unterschied (%) zu Liraglutide1 [95 %-KI]
|
-9.4 [-12.0;-6.8]*
|
-
| |
Änderung (kg) gegenüber Ausgangswert
|
-15.3
|
-6.8
| |
Unterschied (kg) zu Liraglutide1 [95 %-KI]
|
-8.5 [-11.2;-5.7]
|
-
| |
* p < 0.005 (unbereinigt 2-seitig) für Überlegenheit.
1 Geschätzt anhand eines ANCOVA-Modells mit multipler Imputation auf Grundlage aller Daten, unabhängig vom Abbruch der randomisierten Behandlung, Einleitung einer anderen medikamentösen Adipositastherapie oder bariatrischer Chirurgie.
2 Während der Studie wurde die randomisierte Behandlung von 13.5 % der Patienten, die auf Semaglutide und 27.6 % der Patienten, die auf Liraglutide randomisiert worden waren, dauerhaft abgebrochen. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Adipositastherapien erhielten, betrugen die geschätzten Änderungen des Körpergewichts von der Randomisierung bis Woche 68 -16.7 % für Semaglutide und -6.7 % für Liraglutide, auf der Grundlage eines gemischten Modells für wiederholte Messungen, das alle Beobachtungen bis zum ersten Absetzen einschliesst.
3 Die Veränderung (%) gegenüber dem Ausgangswert in den gepoolten Placebogruppen betrug -1.9 %.
|
STEP 9: Gewichtsmanagement bei Patienten mit Knie-Osteoarthrose – Semaglutide
In einer 68-wöchigen doppelblinden Studie wurden 407 Patienten (Durschnittsalter 56 Jahre) mit Adipositas und moderater Knie-Osteoarthrose (OA) in einem oder beiden Knien randomisiert mit Wegovy (n=271) oder Placebo (n=136) behandelt. Zu Studienbeginn betrug das durchschnittliche Körpergewicht 108.6 kg bei einem durchschnittlichen BMI von 40.3 kg/m². Im Einklang mit den Ergebnissen früherer Studien zeigte sich ein klinisch bedeutsamer Unterschied in der Gewichtsabnahme zwischen der Behandlungsgruppen zugunsten von Wegovy (Unterschied gegenüber Placebo [95 % KI]: -10.5 % [-12.3, -8.6]). Gleichzeitig verbesserte sich der Western Ontario and McMaster Universities Osteoarthritis 3.1 Index (WOMAC), ein Mass für Knie-OA-bedingten Schmerzen, signifikant stärker in der Wegovy Gruppe im Vergleich zur Placebo Gruppe (Unterschied [95 % KI]: -14.1 [-20.0, -8.3]), wobei 59 % der Patienten in der Wegovy Gruppe eine klinisch bedeutsame Verbesserung erreichten im Vergleich zu 35 % in der Placebo Gruppe.
Wirkung auf den Körperfettanteil
In einer Unterstudie von STEP 1 (N = 140) wurde mithilfe der Dual-Röntgen-Absorptiometrie (DEXA) gezeigt, dass unter der Behandlung mit Wegovy die Körperfettmasse stärker abgebaut wurde als die fettfreie Körpermasse, was einer Verbesserung des Körperfettanteils nach 68 Wochen im Vergleich mit Placebo entspricht. Ausserdem ging mit dieser Reduktion der gesamten Fettmasse auch eine Reduktion des viszeralen Fettes einher.
Kardiovaskuläre Ergebnisse
SELECT: Kardiovaskuläre Ergebnisstudie bei Patienten mit Übergewicht oder Adipositas
SELECT war eine randomisierte, doppelblinde, placebokontrollierte, ereignisgesteuerte Studie, an der 17'604 Patienten mit etablierter kardiovaskulärer Erkrankung (67.6 % mit früherem Myokardinfarkt, 17.8 % mit früherem Schlaganfall und 4.4 % mit peripherer arterieller Erkrankung (PAD); 8.2 % mit 2 oder mehr früheren kardiovaskulären Ereignissen) und einem BMI ≥27 kg/m2 teilnahmen. Patienten mit einer Vorgeschichte von Typ-1- und Typ-2-Diabetes wurden ausgeschlossen. Die mittlere Verweildauer in der Studie betrug 41.8 Monate. Die Studienpopulation bestand aus 27.7 % Frauen und 72.3 % Männern mit einem Durchschnittsalter von 61.6 Jahren, darunter 38.2 % Patienten ≥65 Jahre (n = 6728) und 7.8 % Patienten ≥75 Jahre (n = 1366). Der durchschnittliche BMI betrug 33.3 kg/m2 und das durchschnittliche Körpergewicht betrug 96.7 kg.
Die Patienten wurden entweder auf Semaglutide mit einer anzustrebenden Maximaldosis von 2.4 mg pro Woche (n=8803) oder Placebo (n=8801) als Zusatz zu einer Standardtherapie für die kardiovaskuläre Vorerkrankung randomisiert. Zu Beginn der Studie erhielten 92.0 % der Patienten kardiovaskuläre Medikamente (70.2 % Betablocker, 45.0 % Angiotensin-Converting-Enzym (ACE)-Inhibitoren, 29.5 % Angiotensin-Rezeptor-Blocker und 26.9 % Calciumkanalblocker), 90.1 % Lipidsenker (hauptsächlich Statine 87.6 %) und 86.2 % Antithrombozytenmittel.
Zu Beginn hatten die meisten Patienten kardiovaskuläre Begleiterkrankungen, darunter 66.4 % mit HbA1c ≥5.7 % und <6.5% als Hinweis auf Prädiabetes, 24.3 % mit chronischer Herzinsuffizienz, 81.8 % mit Hypertonie, 46.8 % mit Entzündungen (hsCRP ≥2 mg/L) sowie Patienten mit leichter (48.7 %), mittelschwerer (10.4 %) oder schwerer (0.4 %) Niereninsuffizienz.
Der primäre Endpunkt war die Zeit von der Randomisierung bis zum ersten Auftreten von schwerwiegenden kardiovaskulären Ereignissen (MACE), definiert als zusammengesetzter Endpunkt bestehend aus kardiovaskulärem Tod, nicht-tödlichem Myokardinfarkt oder nicht-tödlichem Schlaganfall. Die Überlegenheit von Semaglutide 2.4 mg gegenüber Placebo wurde mit einem Hazard Ratio von 0.80 [0.72; 0.90] [95 % KI] bestätigt, was einer relativen Risikoreduktion von 20 % entspricht (siehe Abbildung 7 & 8). Die drei Bestandteile trugen zur Reduktion von MACE bei (Tabelle 10). Die kardiovaskuläre Risikoreduktion erschien weitgehend unabhängig vom Gewichtsverlust.
Die Behandlungswirkung bezüglich MACE Risikoreduktion war in den wesentlichen Subgruppen, die durch Alter, Geschlecht, Rasse, Ethnizität, Typ früherer kardiovaskulärer Erkrankung, BMI, Normoglykämie/Prädiabetes und Nierenfunktion definiert wurden, vergleichbar.
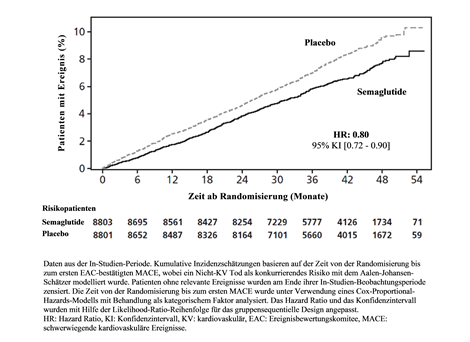
Abbildung 7 Kumulative Inzidenzfunktionsdarstellung - Zeit von der Randomisierung bis zum ersten MACE
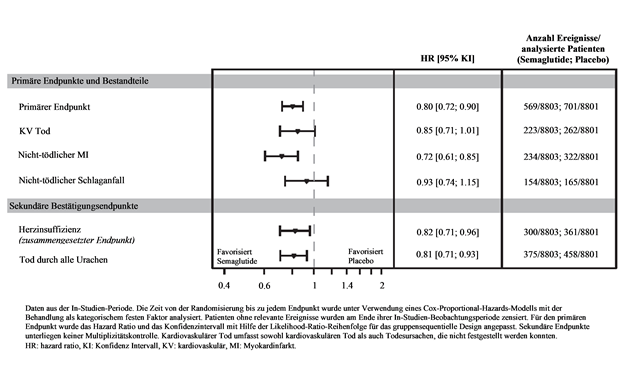
Abbildung 8 Forest Plot der Zeit von der Randomisierung bis zum ersten MACE, MACE Bestandteile und sekundäre Bestätigungsendpunkte
Tabelle 10: Zeit von der Randomisierung bis zum ersten MACE und deren Bestandteile, sekundäre Bestätigungsendpunkt KV Tod.
|
|
HR [95 % KI]
|
p-Wert
(zweiseitig)
|
Anzahl Ereignisse/ analysierte Patienten (Sema 2.4 mg)
|
Anzahl Ereignisse/ analysierte Patienten (Placebo)
| |
Primärer zusammen-gesetzter Endpunkt (MACE)
|
0.80 [0.72; 0.90]
|
<0.0001
|
569/8803
|
701/8801
| |
KV Tod
|
0.85 [0.71; 1.01]
|
0.0653
|
223/8803
|
262/8801
| |
Nicht-tödlicher MI
|
0.72 [0.61; 0.85]
|
|
234/8803
|
322/8801
| |
Nicht-tödlicher Schlaganfall
|
0.93 [0.74; 1.15]
|
|
154/8803
|
165/8801
| |
Sekundäre Bestätigungsendpunkte
| |
KV Tod1
|
0.85 [0.71; 1.01]
|
0.0653
|
223/8803
|
262/8801
| |
Herzinsuffizienz (zusammengesetzter Endpunkt)1
|
0.82 [0.71; 0.96]
|
|
300/8803
|
361/8801
| |
Tod durch alle Ursachen1
|
0.81 [0.71; 0.93]
|
|
375/8803
|
458/8801
| |
Subgruppen:
| |
KV-Erkrankung
| |
KV-Erkrankung: Nur Myokardinfarkt
|
0.78 [0.68; 0.90]
|
0.4803
|
362/5962
|
455/5944
| |
KV-Erkrankung: Nur Hirnschlag
|
0.98 [0.75; 1.27]
|
|
109/578
|
109/1556
| |
KV-Erkrankung: Nur PAD
|
0.74 [0.36; 1.48]
|
|
13/376
|
19/401
| |
KV-Erkrankung: 2 oder mehr KV-Erkrankungen
|
0.75 [0.55; 1.00]
|
|
76/718
|
100/719
| |
Geschlecht
| |
Geschlecht: Weiblich
|
0.84 [0.66; 1.07]
|
0.6324
|
126/2448
|
147/2424
| |
Geschlecht: Männlich
|
0.79 [0.70; 0.90]
|
|
443/6355
|
554/6377
|
Hinweis: Die Zeit von der Randomisierung bis zu jedem Endpunkt wurde unter Verwendung eines Cox-Proportional-Hazards-Modells mit der Behandlung als festen kategorischen Faktor analysiert. Probanden ohne Ereignis von Interesse wurden am Ende ihres In-Studien-Zeitraums zensiert. Für den primären Endpunkt wurden das HR, das Konfidenzintervall und der p-Wert unter Verwendung der Likelihood-Ratio-Reihenfolge für die gruppensequenziellen Designs angepasst. Subgruppenanalysen für den primären Endpunkt wurden in einem Cox-Proportional-Hazards-Modell mit Interaktion zwischen Behandlungsgruppe und der relevanten Subgruppe als festen Faktor analysiert. Kardiovaskulärer Tod umfasst sowohl kardiovaskulären Tod als auch Todesursachen, die nicht bestimmt werden konnten.
1Sekundärer Bestätigungsendpunkt. Nicht statistisch signifikant gemäss der vorab festgelegten Testhierarchie.
HR: hazard ratio, KI: Konfidenzinterval, p-Wert: Zweiseitiger p-Wert für den Test auf keinen Unterschied. Für die Subgruppenanalysen bezieht sich der p-Wert auf den Test auf keinen Interaktionseffekt. KV: kardiovaskulär, MACE: schwerwiegende kardiovaskuläre Ereignisse, MI: Myokardinfarkt.
Tabelle 11: SELECT – Bewertung der kardiovaskulären Risikofaktoren in Woche 104
|
|
Semaglutide
|
Placebo
| |
Full analysis set (N)
|
8803
|
8801
| |
Kardiometabolische Faktoren:
| |
Systolischer Blutdruck (mmHg)
| |
Ausgangswert
Mittelwert (SD)
|
131.0 (15.6)
|
130.9 (15.3)
| |
Änderung gegenüber Ausgangswert1
|
-3.82
|
-0.51
| |
Unterschied gegenüber Placebo [95 % KI]1
|
-3.1 [-3.75; -2.88]
|
-
| |
Diastolischer Blutdruck (mmHg)
| |
Ausgangswert
Mittelwert (SD)
|
79.4 (10.0)
|
79.2 (9.9)
| |
Änderung gegenüber Ausgangswert1
|
-1.02
|
-0.47
| |
Unterschied gegenüber Placebo [95 % KI]1
|
-0.55 [-0.83; -0.27]
|
-
| |
Herzfrequenz
| |
Ausgangswert
Mittelwert (SD)
|
68.9 (10.6)
|
68.6 (10.7)
| |
Änderung gegenüber Ausgangswert1
|
3.79
|
0.69
| |
Unterschied gegenüber Placebo [95 % KI]1
|
3.10 [2.80; 3.39]
|
-
| |
Lipide:
| |
Total Cholesterol
| |
Ausgangswert (mmol/L)
Geometrisches Mittel (CV)
|
4.03 (25.82)
|
4.04 (25.41)
| |
Änderung (%) gegenüber Ausgangswert1
|
-4.63
|
-1.92
| |
Relativer Unterschied (%) gegenüber Placebo1
|
-2.77 [-3.37; -2.16]
|
-
| |
LDL Cholesterol
| |
Ausgangswert (mmol/L)
Geometrisches Mittel (CV)
|
2.03 (43.70)
|
2.03 (43.56)
| |
Änderung (%) gegenüber Ausgangswert1
|
-5.25
|
-3.14
| |
Relativer Unterschied (%) gegenüber Placebo [95 % KI]1
|
-2.18 [-3.22; -1.12]
|
-
| |
HDL Cholesterol
| |
Ausgangswert (mmol/L)
Geometrisches Mittel (CV)
|
1.14 (25.52)
|
1.15 (25.02)
| |
Änderung (%) gegenüber Ausgangswert1
|
4.86
|
0.59
| |
Relativer Unterschied (%) gegenüber Placebo [95 % KI]1
|
4.24 [3.70; 4.79]
|
-
| |
Triglyzeride
| |
Ausgangswert (mmol/L)
Geometrisches Mittel (CV)
|
1.56 (51.75)
|
1.57 (50.84)
| |
Änderung (%) gegenüber Ausgangswert1
|
-18.34
|
-3.20
| |
Relativer Unterschied (%) gegenüber Placebo [95 % KI]1
|
-15.64 [-16.7; -14.6]
|
-
| |
Gewichtsabhängige KV-Risikofaktoren:
| |
Körpergewicht (%)
| |
Ausgangswert (kg)
Mittelwert (SD)
|
96.53 (17.52)
|
96.82 (17.80)
| |
Änderung gegenüber Ausgangswert1
|
-9.39
|
-0.88
| |
Unterschied gegenüber Placebo [95 % KI]1
|
-8.51 [-8.75; -8.27]
|
-
|
1Die Antworten wurden unter Verwendung einer ANCOVA analysiert, wobei die Behandlung als fester Faktor und der Ausgangswert als Kovariate betrachtet wurden. Vor der Analyse wurden fehlende Daten mehrfach imputiert. Das Imputationsmodell (lineare Regression) wurde für jeden Behandlungsarm separat durchgeführt und umfasste den Ausgangswert als Kovariate sowie alle Teilnehmer mit Messungen unabhängig von ihrem Behandlungsstatus in Woche 104. Das gefittete Modell wurde verwendet, um Werte für Teilnehmer ohne Messungen in Woche 104 zu imputieren. Die mittleren Schätzungen wurden entsprechend der beobachteten Ausgangsverteilung angepasst.
STEP TEENS: Gewichtsregulierung bei jugendlichen Patienten
In einer 68-wöchigen, doppelblinden Studie wurden 201 Jugendliche während der Pubertät im Alter von 12 bis < 18 Jahren mit Adipositas (n=200) oder Übergewicht und mit mindestens einer gewichtsbedingten Begleiterkrankung (n=1) 2:1 auf Semaglutide oder Placebo randomisiert. Alle Patienten erhielten für die Dauer der Studie eine kalorienreduzierte Diät mit erhöhter körperlicher Aktivität.
Am Ende der Behandlung (Woche 68) war die Verbesserung des BMI mit Semaglutide überlegen und klinisch bedeutsam im Vergleich zu Placebo (siehe Tabelle 12 und Abbildung 9). Darüber hinaus erreichte ein grösserer Anteil von Patienten einen Gewichtsverlust von ≥5 %, 10 % und ≥15 % mit Semaglutide im Vergleich zu Placebo (siehe Tabelle 12).
Tabelle 12: STEP TEENS: Ergebnisse in Woche 68
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
134
|
67
| |
BMI
| |
Ausgangswert (BMI)
|
37.7
|
35.7
| |
Änderung (%) gegenüber Ausgangswert BMI1, 3
|
-16.1
|
0.6
| |
Unterschied (%) zu Placebo1 [95 % KI]
|
-16.7 [-20.3; -13.2]*
|
-
| |
Ausgangswert (BMI SDS)
|
3.4
|
3.1
| |
Änderung des Ausgangswerts in BMI SDS1
|
-1.1
|
-0.1
| |
Unterschied zu Placebo1 [95 % KI]
|
-1.0 [-1.3; -0.8]
|
-
| |
Körpergewicht
| |
Ausgangswert (kg)
|
109.9
|
102.6
| |
Änderung (%) gegenüber Ausgangswert1
|
-14.7
|
2.8
| |
Unterschied (%) zu Placebo1 [95 % KI]
|
-17.4 [-21.1; -13.8]
|
-
| |
Änderung (kg) gegenüber Ausgangswert1
|
-15.3
|
2.4
| |
Unterschied (kg) zu Placebo1 [95 % KI]
|
-17.7 [-21.8; -13.7]
|
-
| |
Patienten (%) mit Gewichtsverlust ≥5 %4
|
72.5*
|
17.7
| |
Patienten (%) mit Gewichtsverlust ≥10 %4
|
61.8
|
8.1
| |
Patienten (%) mit Gewichtsverlust ≥15 %4
|
53.4
|
4.8
| |
Patienten (%) mit Gewichtsverlust ≥20 %4
|
37.4
|
3.2
| |
Taillenumfang (cm)
| |
Ausgangswert
|
111.9
|
107.3
| |
Änderung (%) gegenüber Ausgangswert1
|
-12.7
|
-0.6
| |
Unterschied zu Placebo1 [95 % KI]
|
-12.1 [-15.6; -8.7]
|
-
|
* p < 0.0001 (unbereinigt 2-seitig) für Überlegenheit.
1 Geschätzt anhand eines ANCOVA-Modells mit multipler Imputation auf Grundlage aller Daten, unabhängig vom Abbruch der randomisierten Behandlung, Einleitung einer anderen medikamentösen Adipositastherapie oder bariatrischer Chirurgie.
2 Die Zahlen beziehen sich auf Patienten ohne Diabetes Typ 2.
3 Während der Studie wurde die randomisierte Behandlung von 10.4 % der Patienten, die auf 2.4 mg Semaglutide und 10.4 % der Patienten, die auf Placebo randomisiert worden waren, dauerhaft abgebrochen. Unter der Annahme, dass alle randomisierten Patienten die Behandlung beibehielten und keine zusätzlichen Adipositastherapien erhielten, betrugen die geschätzten Änderungen des BMI von der Randomisierung bis Woche 68 -17.9 % für 2.4 mg Semaglutide und -0.6 % für Placebo, auf der Grundlage eines gemischten Modells für wiederholte Messungen, das alle Beobachtungen bis zum ersten Absetzen einschliesst.
4 Geschätzt anhand eines logistischen Regressionsmodells auf der Grundlage desselben Imputationsverfahrens wie in der Primäranalyse.
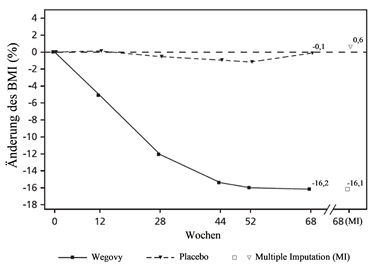
Beobachtete Werte für Patienten, die jeden Kontrolltermin wahrgenommen haben und Schätzungen mit multiplen Imputationen (MI) für erfasste Studienabbrecher
Abbildung 9 STEP TEENS - Mittlere Änderung des BMI (%) vom Ausgangswert bis Woche 68
|










