Sonstige HinweiseInkompatibilitäten
Da keine Studien zur Inkompatibilität durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln vermischt werden.
Haltbarkeit
Das Arzneimittel darf nach Ablauf des auf der Packung mit «EXP» angegebenen Verfalldatums nicht mehr angewendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2–8 °C) lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Ausser Reichweite von Kindern aufbewahren.
Temperaturabweichungen, die ausserhalb des Bereiches von 2–8 °C liegen, sollten begrenzt werden. Temperaturen von über 30 °C müssen vermieden werden. Während eines Zeitraums von 28 Tagen darf die durchschnittliche Lagerungstemperatur des Arzneimittels zwischen 2 °C und 25 °C betragen. Nach Temperaturabweichungen sollte das Arzneimittel sofort wieder in die empfohlenen Lagerungsbedingungen gebracht werden (im Kühlschrank (2–8 °C) lagern). Temperaturabweichungen haben einen kumulativen Effekt auf die Qualität des Arzneimittels, und der Zeitraum von 28 Tagen darf über die Dauer der Haltbarkeit von Fulvestrant Xiromed nicht überschritten werden. Eine Exposition gegenüber Temperaturen unter 2 °C beeinträchtigt das Arzneimittel nicht, vorausgesetzt es wird nicht unter -20 °C gelagert.
Hinweise für die Handhabung
Die Originalverpackung enthält eine, zwei oder sechs 5 ml Fertigspritzen aus Glas mit einem Stempel aus Polystyrol zusammen mit je einer Nadel mit Sicherheitssystem (SafetyGlide™). Die Fertigspritze enthält eine klare, farblose bis gelbe, visköse Lösung.
Die Fertigspritze ist nur zum einmaligen Gebrauch bestimmt.
Die Injektion soll entsprechend den lokalen Weisungen betreffend der Durchführung einer Intramuskulär-Injektion mit grossem Volumen angewendet werden.
Hinweis: Bei der Injektion von Fulvestrant Xiromed im dorsoglutealen Bereich ist Vorsicht geboten aufgrund der Nähe des darunterliegenden Ischiasnervs (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die SafetyGlide™ Nadel darf vor Gebrauch nicht autoklaviert werden.
Handhabung für jede Spritze
Nehmen Sie die Fertigspritze aus der Packung und stellen Sie sicher, dass diese nicht beschädigt ist.
Öffnen Sie die äussere Verpackung der Sicherheitsnadel (SafetyGlide™).
Parenterale Lösungen müssen vor der Verabreichung visuell auf Partikel und Farbveränderungen geprüft werden.
Abbildung 1

Halten Sie die Spritze aufrecht am gerippten Teil (C) mit der einen Hand. Mit der anderen Hand fassen Sie die Verschlusskappe (A) und vorsichtig die Verschlusskappe aus Plastik im Gegenuhrzeigersinn drehen. (siehe Abbildung 1).
Abbildung 2

Entfernen Sie die Verschlusskappe (A) mit einem leichten Zug nach oben. Zur Erhaltung der Sterilität berühren Sie nicht den Nadelanschluss (B) (siehe Abbildung 2).
Abbildung 3
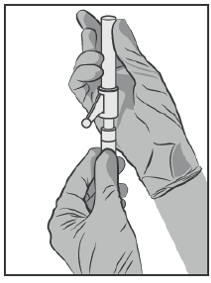
Verbinden Sie die Injektionsnadel mit dem Nadelanschluss (Luer-Lok) und drehen Sie solange, bis beide Teile fest miteinander verbunden sind.
Prüfen Sie, ob die Nadel fest mit dem Luer-Anschluss verbunden ist, bevor Sie die Spritze aus der aufrechten Position bewegen. Ziehen Sie die Schutzabdeckung von der Spritze ab, ohne die Nadel zu beschädigen.
Führen Sie die gefüllte Spritze zur Applikationsstelle.
Entfernen Sie die Nadelhülse. Entfernen Sie die überschüssige Luft aus der Spritze.
Abbildung 4
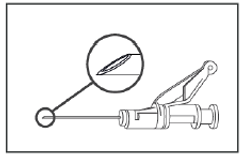
Verabreichen Sie die Lösung langsam (1–2 Min/Injektion) intramuskulär ins Gesäss (Glutealbereich).
Als Hilfe für den Anwender ist die Abschrägung der Nadelöffnung dem Hebelarm zugewandt, wie in Abbildung 4 gezeigt.
Abbildung 5
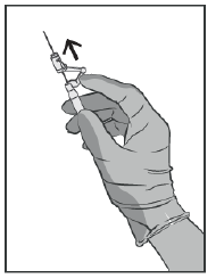
Aktivieren Sie sofort nach dem Herausziehen der Nadel das Sicherheitssystem mit einem Fingerdruck nach vorne (siehe Abb. 5).
Hinweis: Aktivieren Sie das Sicherheitssystem immer mit der Nadelspitze von sich und anderen wegweisend. Sie hören ein Klicken. Überzeugen Sie sich, dass die Nadelspitze ganz abgedeckt ist.
Entsorgen Sie die Spritze nach der einmaligen Anwendung in einen dafür vorgesehenen Behälter.
| 




