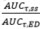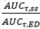PharmakokinetikAbsorption
Sowohl Casirivimab als auch Imdevimab zeigten von 300 mg Ronapreve (150 mg Casirivimab und 150 mg Imdevimab) bis 8'000 mg Ronapreve (4'000 mg Casirivimab und 4'000 mg Imdevimab) nach intravenöser Gabe einer Einzeldosis eine lineare und dosisproportionale Pharmakokinetik (PK) auf. Tabelle 8 enthält eine Zusammenfassung von PK-Parametern nach intravenöser Gabe einer Einzeldosis (600 mg Casirivimab und 600 mg Imdevimab), berechnet anhand eines Populations-PK-Modells für jeden Antikörper auf der Grundlage der Daten von 3'687 (Casirivimab) bzw. 3'716 Probanden (Imdevimab).
Tabelle 8: Zusammenfassung von PK-Parametern für Casirivimab und Imdevimab nach einer Einzeldosis von 1'200 mg Ronapreve i. v.
|
PK-Parameter1
|
Casirivimab
|
Imdevimab
| |
AUC0-28 (mg·Tag/l)2
|
1754,9 (380,50)
|
1600,8 (320,88)
| |
AUCinf (mg·Tag/l)3
|
3563,6 (1239,61)
|
2890,5 (876,31)
| |
Cmax (mg/l)4
|
182,7 (81,45)
|
181,7 (77,78)
| |
C28 (mg/l)5
|
37,9 (10,33)
|
31,0 (8,24)
| |
Halbwertszeit (Tag)
|
31,2 (10,59)
|
27,3 (7,73)
|
1 Mittelwert (SD), wobei SD die Standardabweichung des arithmetischen Mittelwerts ist; 2 AUC0-28 = Fläche unter der Konzentrations-Zeit-Kurve vom Zeitpunkt 0 bis Tag 28 nach der Dosisgabe; 3 AUCinf = Fläche unter der Konzentrations-Zeit-Kurve vom Zeitpunkt 0 bis unendlich; 4 Cmax = Maximale Konzentration im Serum und repräsentiert Konzentration am Ende der Infusion, 5 C28 = Konzentration 28 Tage nach Verabreichung, d.h. an Tag 29.
Tabelle 9 zeigt eine Zusammenfassung von PK-Parametern nach subkutaner Gabe einer Einzeldosis (600 mg Casirivimab und 600 mg Imdevimab) auf der Grundlage des Populations-PK-Modells für jeden Antikörper.
Tabelle 9: Zusammenfassung von PK-Parametern für Casirivimab und Imdevimab nach einer Einzeldosis von 1'200 mg [Ronapreve] s. c.
|
PK-Parameter1
|
Casirivimab
|
Imdevimab
| |
AUC0-28 (mg·Tag/l)2
|
1121,7 (243,12)
|
1016,9 (203,92)
| |
AUCinf (mg·Tag/l)3
|
2559,5 (890,35)
|
2073,3 (628,60)
| |
Cmax (mg/l)4
|
52,2 (12,15)
|
49,2 (11,01)
| |
Tmax (Tag)5, 6
|
6,7 [3,4, 13,6]
|
6,6 [3,4, 13,6]
| |
C28 (mg/l)7
|
30,5 (7,55)
|
25,9 (6,07)
|
1 Mittelwert (SD), wobei SD die Standardabweichung des arithmetischen Mittelwerts ist; 2 AUC0-28 = Fläche unter der Konzentrations-Zeit-Kurve vom Zeitpunkt 0 bis Tag 28 nach der Dosisgabe; 3 AUCinf = Fläche unter der Konzentrations-Zeit-Kurve vom Zeitpunkt 0 bis unendlich; 4 Cmax = Maximale Konzentration im Serum, 5 Tmax = Dauer bis zum Erreichen der Cmax; 6 Median [Minimum, Maximum]; 7 C28 = Konzentration 28 Tage nach Verabreichung, d.h. an Tag 29.
Tabelle 10 zeigt eine Zusammenfassung von PK-Parametern nach einer intravenösen einzelnen Aufsättigungsdosis von 1'200 mg Ronapreve (600 mg Casirivimab und 600 mg Imdevimab), gefolgt von mehreren intravenösen Dosen mit 600 mg Ronapreve alle 4 Wochen (300 mg Casirivimab und 300 mg Imdevimab) auf der Grundlage des Populations-PK-Modells für jeden Antikörper.
Tabelle 10: Zusammenfassung von PK-Parametern für Casirivimab und Imdevimab nach einer einzelnen Aufsättigungsdosis von 1'200 mg Ronapreve i.v. und von Erhaltungsdosen von 600 mg Ronapreve i. v. q4w
|
PK-Parameter1
|
Casirivimab
|
Imdevimab
| |
AUCtau,ss (mg∙Tag/l)2
|
1767,5 (605,79)
|
1436,8 (432,87)
| |
Cmax,ss (mg/l)3
|
133,8 (46,51)
|
122,4 (41,67)
| |
CTal,ss (mg/l)4
|
42,6 (19,72)
|
31,7 (13,56)
| |
C28 (mg/l)5
|
37,9 (10,32)
|
31,0 (8,24)
| |
AR6
|
1,0 (0,241)
|
0,893 (0,174)
|
1 Mittelwert (SD), wobei SD die Standardabweichung des arithmetischen Mittelwerts ist; 2 AUCtau,ss = Fläche unter der Konzentration-Zeit-Kurve in einem Dosierungsintervall im Fliessgleichgewicht; 3 Cmax,ss = Maximale Konzentration im Fliessgleichgewicht; 4 CTal,ss = Talkonzentration im Fliessgleichgewicht; 5 C28 = Konzentration 28 Tage nach der ersten Dosis; 6 Das Akkumulationsverhältnis (AR) berechnet sich aus
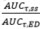
(ED = erste Dosis); q4w = alle 4 Wochen.
Tabelle 11 zeigt eine Zusammenfassung von PK-Parametern nach einer einzelnen subkutanen Aufsättigungsdosis von 1'200 mg Ronapreve (600 mg Casirivimab und 600 mg Imdevimab), gefolgt von mehreren subkutanen Dosen mit 600 mg Ronapreve alle 4 Wochen (300 mg Casirivimab und 300 mg Imdevimab) auf der Grundlage des Populations-PK-Modells für jeden Antikörper.
Tabelle 11: Zusammenfassung von PK-Parametern für Casirivimab und Imdevimab nach einer einzelnen subkutanen Aufsättigungsdosis von 1'200 mg und subkutanen Erhaltungsdosen von 600 mg Ronapreve q4w
|
PK-Parameter1
|
Casirivimab
|
Imdevimab
| |
AUCtau,ss (mg∙Tag/l)2
|
1268,9 (434,68)
|
1030,1 (310,30)
| |
Cmax,ss (mg/l)3
|
56,0 (16,81)
|
47,0 (12,43)
| |
CTal,ss (mg/l)4
|
34,0 (14,56)
|
26,1 (10,17)
| |
C28 (mg/l)5
|
30,5 (7,55)
|
25,9 (6,07)
| |
AR6
|
1,13 (0,288)
|
1,01 (0,213)
|
1 Mittelwert (SD), wobei SD die Standardabweichung des arithmetischen Mittelwerts ist; 2 AUCtau,ss = Fläche unter der Konzentration-Zeit-Kurve in einem Dosierungsintervall im Fliessgleichgewicht; 3 Cmax,ss = Maximale Konzentration im Fliessgleichgewicht; 4 CTal,ss = Talkonzentration im Fliessgleichgewicht; 5 C28 = Konzentration 28 Tage nach der ersten Dosis; 6 Das Akkumulationsverhältnis (AR) berechnet sich aus
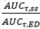
(ED = erste Dosis); q4w = alle 4 Wochen.
In Bezug auf die wiederholte intravenöse und subkutane Gabe zur Vorbeugung kann man ausgehend von populationspharmakokinetischen Simulationen vorhersagen, dass die mediane vorhergesagte CTal,ss von Casirivimab und Imdevimab im Serum ähnlich ist wie die an Tag 29 gemessenen mittleren Serumkonzentrationen nach einer subkutanen Einzeldosis von 1'200 mg Ronapreve (600 mg Casirivimab und 600 mg Imdevimab).
Tabelle 8 und Tabelle 9 enthalten die geschätzte mittlere (Standardabweichung) Cmax und C28 von Casirivimab und Imdevimab nach einer Einzeldosis von 1'200 mg (je 600 mg von jedem monoklonalen Antikörper) i. v. bzw. s. c. aufgrund eines populationspharmakokinetischen Modells. Die mediane (Bereich) Dauer bis zum Erreichen der geschätzten maximalen Serumkonzentration von Casirivimab und Imdevimab (Tmax) nach einer subkutanen Einzeldosis von 1'200 mg (jeweils 600 mg von jedem monoklonalen Antikörper) beträgt 6,7 (3,4-13,6) Tage für Casirivimab und 6,6 (3,4-13,6) Tage für Imdevimab (Tabelle 9).
Nach subkutaner Gabe von Casirivimab und Imdevimab als Einzeldosis von 1'200 mg (je 600 mg von jedem monoklonalen Antikörper) betrug die mittels Population-PK geschätzte Bioverfügbarkeit von Casirivimab 71,8 % und von Imdevimab 71,7 %.
Distribution
Das anhand einer populationspharmakokinetischen Analyse geschätzte Gesamtdistributionsvolumen beträgt 7,161 l für Casirivimab und 7,425 l für Imdevimab.
Metabolismus
Es wurden keine speziellen Studien zum Metabolismus durchgeführt, da es sich bei Casirivimab und Imdevimab um Proteine handelt. Da Casirivimab und Imdevimab humane monoklonale IgG1-Antikörper sind, kann man annehmen, dass sie gleich wie endogenes IgG über katabole Stoffwechselwege zu kleinen Peptiden und Aminosäuren abgebaut werden.
Elimination
Laut einer populationspharmakokinetischen Analyse betrugen die Eliminationshalbwertszeit und die Clearance nach einer einzigen Verabreichung von 600 mg jedes der monoklonalen Antikörper durchschnittlich (5., 95. Perzentil) 29,8 (16,4, 43,1) Tage und 0,188 (0,11, 0,3) l/Tag bei Casirivimab bzw. 26,2 (16,9, 35,6) Tage und 0,227 (0,15, 0,35) l/Tag bei Imdevimab.
Ausscheidung
Casirivimab und Imdevimab sind monoklonale Antikörper, was eine Ausscheidung über die Nieren unwahrscheinlich macht.
Kinetik spezieller Patientengruppen
Der Einfluss aller untersuchten Kovariaten und der beobachteten, statistisch signifikanten Kovariaten (Geschlecht, Körpergewicht und Ausgangswert des Albuminspiegels auf Clearance [CL] und zentrales Verteilungsvolumen [Vc] sowie Ethnie, geringe Leberfunktionsstörung und Ausgangswert der Viruslast auf die CL) auf die Pharmakokinetik von Ronapreve wurde durch eine populationspharmakokinetische Analyse bewertet. Diese Analyse wies auf keinen klinisch relevanten Einfluss auf die Exposition gegenüber Casirivimab und Imdevimab hin: Alter (Median: 42 Jahre, Spanne: 18–96 Jahre), Geschlecht (männlich, weiblich), Körpergewicht (Median: 81,5 kg, Spanne: 35,5–201 kg ), Ethnie (schwarze Hautfarbe, sonstige [weisse Hautfarbe, asiatisch, indigene Einwohner der U.S.A.] ), Albuminspiegel zur Baseline (Median: 43 g/l, Spanne: 26–56 g/l), Nierenfunktionsstörung (normale Funktion, leichte/mässig schwere/hochgradige Niereninsuffizienz) und geringe Leberfunktionsstörung (normale Funktion, geringfügige/mässig schwere Leberinsuffizienz).
Von allen untersuchten Kovariaten hatte das Körpergewicht den grössten Einfluss auf die Exposition gegenüber Casirivimab und Imdevimab. Im Vergleich zu einem Referenzprobanden mit 81 kg ist die vorhergesagte Exposition (AUCTag28, Cmax und CTag28) sowohl von Casirivimab als auch von Imdevimab bei Probanden des 5. Perzentils des Körpergewichts (55,4 kg) um 20 bis 30 % höher und bei Probanden des 95. Perzentils des Körpergewichts (123 kg) um 20 bis 25 % geringer.
Im Vergleich zu einem Referenzprobanden mit 81 kg betragen bei einem Probanden mit der Kovariatenkombination, die zur höchsten vorhergesagten Populationsclearance von Casirivimab und Imdevimab führt (hellhäutig, männlich, Albumin 29 g/l, 151,8 kg), die Quotienten von AUCTag28, Cmax und CTag28 voraussichtlich für Casirivimab 0,48, 0,56 und 0,31 bzw. für Imdevimab 0,47, 0,56 und 0,28.
Leberfunktionsstörungen
Es ist nicht zu erwarten, dass Casirivimab und Imdevimab in signifikantem Umfang über die Leber eliminiert werden. Die Auswirkung einer Leberfunktionsstörung auf die Exposition gegenüber Casirivimab und Imdevimab wurde mithilfe einer Populations-PK-Analyse bei Patienten mit leichter Leberfunktionsstörung (n = 586 für Casirivimab und n = 599 für Imdevimab) beurteilt (Gesamtbilirubin [TB] mehr als das 1,0- bis 1,5-Fache der oberen Normgrenze [ULN] und ein beliebiger Wert für die Aspartataminotransferase [AST]). Es wurden keine klinisch bedeutsamen Unterschiede zwischen Patienten mit leichter Leberfunktionsstörung und Patienten mit normaler Leberfunktion in Bezug auf die Exposition gegenüber Casirivimab und Imdevimab festgestellt. Von Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung sind nur begrenzte Daten (n = 11) verfügbar. Die Pharmakokinetik bei Patienten mit schwerer Leberfunktionsstörung wurde nicht untersucht.
Nierenfunktionsstörungen
Casirivimab und Imdevimab sind monoklonale Antikörper, bei denen aufgrund ihrer Molekülmasse (> 69 kDa) keine wesentliche renale Elimination erwartet wird. Ausgehend von der Populations-PK-Analyse waren die Serum-Talkonzentrationen von Casirivimab und Imdevimab im Fliessgleichgewicht bei Patienten mit leichter oder mittelschwerer Nierenfunktionsstörung und Patienten mit CrCl < 15 ml/min einschliesslich Dialysepatienten vergleichbar mit denen von Personen mit normaler Nierenfunktion. Von Patienten mit schwerer Nierenfunktionsstörung (n = 3) liegen begrenzte Daten vor.
Ältere Patienten
In der Populations-PK-Analyse erwies sich das Alter (18 Jahre bis 96 Jahre) nicht als signifikante Kovariate der PK von Casirivimab und Imdevimab.
Im Vergleich zu Personen im Alter von < 65 Jahren war die Exposition gegenüber Casirivimab und Imdevimab bei Personen im Alter von > 65 Jahren oder ≥75 Jahren nach intravenöser oder subkutaner Gabe ähnlich.
Kinder und Jugendliche
Bei Jugendlichen mit COVID-19-Erkrankung (ab dem Alter von 12 Jahren und mit einem Körpergewicht von mindestens 40 kg in der Studie COV-2067), die intravenös eine Einzeldosis von 1'200 mg erhielten, betrug die mittlere Konzentration ± SD am Ende der Infusion und an Tag 28 nach der Verabreichung 172 ± 96,9 mg/l und 54,3 ± 17,7 mg/l für Casirivimab bzw. 183 ± 101 mg/l und 45,3 ± 13,1 mg/l für Imdevimab.
Für nicht mit SARS-CoV-2 infizierte Jugendliche (ab dem Alter von 12 Jahren und mit einem Körpergewicht von mindestens 40 kg in der Studie COV-2069), die subkutan eine Einzeldosis von 1'200 mg erhielten, betrug die mittlere Konzentration ± SD an Tag 28 nach der Verabreichung 44,9 ± 14,7 mg/l für Casirivimab bzw. 36,5 ± 13,2 mg/l für Imdevimab. Bei Kindern < 12 Jahren wurde die Pharmakokinetik von Casirivimab und Imdevimab noch nicht untersucht.
|