Eigenschaften/WirkungenATC-Code
S01LA09
Wirkungsmechanismus
Bei Faricimab handelt es sich um einen humanisierten bispezifischen Antikörper vom Immunglobulintyp G1 (IgG1), der seine Wirkung ausübt, indem er durch Neutralisation sowohl von Ang-2 (Angiopoietin-2) als auch von VEGF-A (vaskulärer endothelialer Wachstumsfaktor A) zwei separate Signalwege hemmt. Ang-2 verursacht eine vaskuläre Instabilität, indem es die Destabilisierung des Endothels, den Verlust von Perizyten und die pathologische Angiogenese fördert und so Gefässleckagen und Entzündungen potenziert. Darüber hinaus sensibilisiert es Blutgefässe für die Aktivität von VEGF-A, was die vaskuläre Destabilisierung weiter verstärkt. Ang-2 und VEGF-A erhöhen synergistisch die Gefässpermeabilität und regen die Neovaskularisation an. Durch die Hemmung sowohl von Ang-2 als auch von VEGF-A reduziert Faricimab die vaskuläre Permeabilität und Entzündung, hemmt die pathologische Angiogenese und stellt die Gefässstabilität wieder her.
Pharmakodynamik
In den sechs nachstehend beschriebenen Phase-III-Studien wurde ab Tag 7 eine Suppression der medianen okulären Konzentrationen von freiem Ang-2 und freiem VEGF-A gegenüber dem Ausgangswert festgestellt.
nAMD
Bei Anwendung von Vabysmo wurden zwischen Studienbeginn und Woche 48 ähnliche Reduktionen der mittleren Dicke des zentralen Bereichs der Fovea (Central Subfield Thickness, CST) festgestellt wie bei Anwendung von Aflibercept. Die mittlere CST-Reduktion zwischen Studienbeginn und den Besuchen zur Untersuchung hinsichtlich des primären Endpunkts (Mittelwert aus den Wochen 40, 44 und 48) betrug in den Studien TENAYA und LUCERNE bei Anwendung von Vabysmo im Abstand von 8 (q8w), 12 (q12w) oder 16 Wochen (q16w) -137 μm bzw. -137 μm gegenüber -129 μm und -131 μm bei Anwendung von Aflibercept. Diese mittleren CST-Reduktionen blieben im 2. Jahr durchgehend erhalten. Vabysmo und Aflibercept hatten eine vergleichbare Wirkung auf die Reduktion intraretinaler Flüssigkeit (IRF), subretinaler Flüssigkeit (SRF) und der Pigmentepithelablösung (PED). Bei den Besuchen zur Untersuchung hinsichtlich des primären Endpunkts betrugen die prozentualen Anteile der Patienten ohne IRF in den Studien TENAYA und LUCERNE 76% bis 82% bzw. 78% bis 85% unter Behandlung mit Vabysmo vs. 74% bis 85% bzw. 78% bis 84% unter Behandlung mit Aflibercept. Die prozentualen Anteile der Patienten ohne SRF in den beiden Studien betrugen 70% bis 79% bzw. 66% bis 78% unter Behandlung mit Vabysmo vs. 66% bis 78% bzw. 62% bis 76% unter Behandlung mit Aflibercept. Die prozentualen Anteile der Patienten ohne PED in den beiden Studien betrugen 3% bis 8% bzw. 3% bis 6% unter Behandlung mit Vabysmo vs. 8% bis 10% bzw. 7% bis 9% unter Behandlung mit Aflibercept. Diese Reduktionen der IRF, der SRF und der PED blieben im 2. Jahr (Woche 104 – 108) erhalten.
In beiden Studien wurden bei den Patienten unter Behandlung mit Vabysmo und bei den Patienten unter Behandlung mit Aflibercept in Woche 48 vergleichbare Veränderungen der Gesamtfläche der Läsionen aufgrund einer choroidalen Neovaskularisation (CNV) und vergleichbare Verringerungen der CNV-Fläche mit Austreten von Blut und Flüssigkeit gegenüber dem Studienbeginn festgestellt.
DME
Sowohl in der Studie YOSEMITE als auch in der Studie RHINE war die Reduktion der mittleren CST gegenüber dem Anfangswert bei Patienten, die alle 8 Wochen (q8w) mit Vabysmo behandelt wurden, und denen, die Vabysmo in einer bis q16w ausdehnbaren Dosierung erhielten, im Vergleich zu Aflibercept q8w von Woche 4 bis Woche 100 numerisch höher. In beiden Studien war der Anteil der Patienten ohne IRF und ohne DME (definiert als Erreichen einer CST von unter 325 µm in der OCT) im Zeitverlauf in den jeweiligen Vabysmo-Armen höher als im Aflibercept-Arm. In beiden Studien wurden in den jeweiligen Vabysmo- und Aflibercept-Behandlungsarmen im Zeitverlauf ähnliche Reduktionen der SRF festgestellt. Die mittlere CST-Reduktion zwischen Studienbeginn und den Besuchen zur Untersuchung hinsichtlich des primären Endpunkts (Mittelwert aus den Wochen 48, 52 und 56) betrug in der Studie YOSEMITE bei den Patienten, die q8w mit Vabysmo behandelt wurden, und denen, die Vabysmo in einer bis q16w ausdehnbaren Dosierung erhielten, 207 µm bzw. 197 µm verglichen mit 170 µm bei den q8w mit Aflibercept behandelten Patienten; in der Studie RHINE lauteten die entsprechenden Zahlen 196 µm, 188 µm und 170 µm. Diese mittleren CST-Reduktionen blieben im 2. Jahr durchgehend erhalten. Der Anteil der Patienten ohne DME bei den Besuchen zur Untersuchung hinsichtlich des primären Endpunkts (Min.-Max.) betrug in der Studie YOSEMITE bei den Patienten, die q8w mit Vabysmo behandelt wurden, und denen, die Vabysmo in einer bis q16w ausdehnbaren Dosierung erhielten, 77% bis 87% bzw. 80% bis 82%, verglichen mit 64% bis 71% bei den q8w mit Aflibercept behandelten Patienten; in der Studie RHINE lauteten die entsprechenden Zahlen 85% bis 90%, 83% bis 87% und 71% bis 77%. Die Ergebnisse blieben im 2. Jahr durchgehend erhalten.
Die Anteile der Patienten ohne IRF bei den Besuchen zur Untersuchung hinsichtlich des primären Endpunkts (Mittelwert aus den Wochen 48, 52 und 56) betrugen in der Studie YOSEMITE bei den Patienten, die q8w mit Vabysmo behandelt wurden, und denen, die Vabysmo in einer bis q16w ausdehnbaren Dosierung erhielten, 42% bis 48% bzw. 34% bis 43%, verglichen mit 22% bis 25% bei den q8w mit Aflibercept behandelten Patienten; in der Studie RHINE lauteten die entsprechenden Zahlen 39% bis 43%, 33% bis 41% und 23% bis 29%. Diese Ergebnisse blieben im 2. Jahr durchgehend erhalten.
BRVO und CRVO
In Phase-III-Studien bei Patienten mit retinalem Venenastverschluss (BRVO; BALATON) und Zentralvenenverschluss/Hemizentralvenenverschluss (C/HRVO; COMINO) wurden bei Anwendung von Vabysmo alle 4 Wochen (q4w) Reduktionen der mittleren CST zwischen Studienbeginn und Woche 24 beobachtet, die mit denen unter Aflibercept q4w vergleichbar waren. Die mittlere CST-Reduktion zwischen Studienbeginn und Woche 24 betrug in der Studie BALATON 311,4 μm unter Vabysmo q4w gegenüber 304,4 μm unter Aflibercept q4w und in der Studie COMINO 461,6 μm unter Vabysmo q4w gegenüber 448,8 μm unter Aflibercept q4w. CST-Reduktionen blieben bis einschliesslich Woche 72 bestehen, wenn die Patienten auf ein bis zu q16w ausdehnbares Vabysmo-Dosierungsschema umgestellt wurden.
Die Anteile der Patienten ohne IRF, ohne SRF und ohne Makulaödem (definiert als Erreichen einer CST unter 325 µm) im Zeitverlauf bis einschliesslich Woche 24 waren in beiden Studien jeweils zwischen dem Vabysmo- und dem Aflibercept-Arm vergleichbar. Diese Ergebnisse blieben bis einschliesslich Woche 72 bestehen, wenn die Patienten auf ein bis zu q16w ausdehnbares Vabysmo-Dosierungsschema umgestellt wurden.
In der Studie BALATON betrug in Woche 24 der Anteil der Patienten ohne Makulaödem im Vabysmo-Arm q4w 95,3 % gegenüber 93,9 % im Aflibercept-Arm q4w; der Anteil der Patienten ohne IRF betrug im Vabysmo-Arm q4w 72,5 % gegenüber 66 % im Aflibercept-Arm q4w. Der Anteil der Patienten ohne SRF betrug im Vabysmo-Arm q4w 91,3 % gegenüber 90,3 % im Aflibercept-Arm q4w.
In der Studie COMINO betrug in Woche 24 der Anteil der Patienten ohne Makulaödem im Vabysmo-Arm q4w 93,7 % gegenüber 92,0 % im Aflibercept-Arm q4w. Der Anteil der Patienten ohne IRF betrug im Vabysmo-Arm q4w 76,2 % gegenüber 70,8 % im Aflibercept-Arm q4w; der Anteil der Patienten ohne SRF betrug im Vabysmo-Arm q4w 96,4 % gegenüber 93,4 % im Aflibercept-Arm q4w.
Klinische Wirksamkeit
Behandlung der neovaskulären altersbedingten Makuladegeneration (nAMD)
Die Sicherheit und Wirksamkeit von Faricimab wurde in zwei 2-armigen, randomisierten (1:1), multizentrischen, doppelt maskierten Studien (TENAYA und LUCERNE) bei Patienten mit nAMD vergleichend zu einer anti-VEGF Behandlung untersucht. Die Behandlung (Faricimab 6 mg bzw. Aflibercept 2 mg) erfolgte jeweils mittels intravitrealer Injektion, initial im Abstand von 4 Wochen. Im Aflibercept-Arm betrug das Dosierungsintervall nach 3 initialen Aflibercept-Injektionen für den Rest der Studie 8 Wochen (q8w). Im Faricimab-Arm wurde das Dosierungsintervall nach 4 initialen Dosen individuell angepasst. Das endgültige (fixe) Dosierungsintervall betrug 8 Wochen (q8w), 12 Wochen (q12w) oder maximal 16 Wochen (q16w) abhängig von der laut Prüfplan definierten Veränderung der CST bei Messung per SD-OCT und/oder der Veränderung der BCVA bei Messung anhand des ETDRS-Letter-Scores sowie der klinischen Beurteilung des Vorhandenseins/Nichtvorhandenseins einer Makulablutung durch den behandelnden Arzt/die behandelnde Ärztin in Woche 20 und 24. Ab Woche 60 wurden die Patienten im Vabysmo-Arm auf ein ausdehnbares Dosierungsschema umgestellt, bei dem das Dosierungsintervall basierend auf einer automatisierten objektiven Bewertung vorgängig definierter visusbezogener und anatomischer Kriterien für die Krankheitsaktivität durch stufenweise Erhöhung um jeweils bis zu 4 Wochen (bis q16w) ausgedehnt oder durch stufenweise Reduktion um jeweils bis zu 8 Wochen (bis q8w) verkürzt werden konnte. Die Patienten im Aflibercept-Arm behielten während des gesamten Studienzeitraums die Dosierung q8w bei. Beide Studien hatten jeweils eine Dauer von 112 Wochen.
Die Studien schlossen insgesamt 1'329 nicht vorbehandelte Patienten ein, von denen 1'135 (85%) durchgängig bis Woche 112 an den Studien teilnahmen. Insgesamt erhielten 1'326 (664 Patienten im Faricimab-Arm) mindestens eine Dosis. Das Durchschnittsalter [Altersbereich] der untersuchten Population lag bei 75,9 Jahren [50 bis 99 Jahre].Primärer Wirksamkeitsendpunkt war die mittlere Veränderung der BCVA gegenüber dem Ausgangswert innerhalb des ersten Jahres (basierend auf dem Mittelwert über die Wochen 40, 44 und 48) ermittelt anhand der Buchstabentafel aus der Early Treatment Diabetic Retinopathy Study (ETDRS) bei einem Abstand von 4 Metern. In beiden Studien wurde die primäre Hypothese (Nichtunterlegenheit) bestätigt: die mit Vabysmo im Abstand von bis zu q16w behandelten Patienten und die mit Aflibercept q8w behandelten Patienten wiesen im 1. Jahr eine vergleichbare mittlere Veränderung der BCVA gegenüber ihrem jeweiligen Ausgangswert auf. In beiden Behandlungsarmen wurden bis Woche 112 deutliche Visusverbesserungen gegenüber dem jeweiligen Ausgangswert beobachtet. Ausführliche Ergebnisse beider Studien sind in den Tabellen 2 und 3 sowie in Abbildung 1 nachstehend dargestellt.
Anteile der Patienten in den personalisierten Behandlungsintervall-Gruppen in Woche 48 in den Studien TENAYA bzw. LUCERNE:
·q16w: 46%, 45%
·q12w: 34%, 33%
·q8w: 20%, 22%
Anteile der Patienten in den personalisierten Behandlungsintervall-Gruppen in Woche 112 in den Studien TENAYA bzw. LUCERNE:
·q16w: 59%, 67%
·q12w: 15%, 14%
·q8w: 26%, 19%
Tabelle 2: Wirksamkeitsergebnisse bei den Besuchen zur Untersuchung hinsichtlich des primären Endpunktsa sowie im 2. Jahrb in der Studie TENAYA
|
Wirksamkeitsergebnisse
|
TENAYA
| |
1. Jahr
|
2. Jahr
| |
Vabysmo im Abstand von bis zu q16w
N = 334
|
Aflibercept q8w
N = 337
|
Vabysmo im Abstand von bis zu q16w
N = 334
|
Aflibercept q8w
N = 337
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (95%-KI)
|
5,8
(4,6, 7,1)
|
5,1
(3,9, 6,4)
|
3,7
(2,1, 5,4)
|
3,3
(1,7, 4,9)
| |
Anteil der Patienten mit Verbesserung um ≥15 Buchstaben gegenüber dem Anfangswert (CMH-gewichteter Anteil, 95%-KI)
|
20,0%
(15,6%, 24,4%)
|
15,7%
(11,9%, 19,6%)
|
22,5%
(17,8%, 27,2%)
|
16,9%
(12,7%, 21,1%)
| |
Anteil der Patienten mit vermiedener Verschlechterung um ≥15 Buchstaben gegenüber dem Anfangswert (CMH-gewichteter Anteil, 95%-KI)
|
95,4%
(93,0%, 97,7%)
|
94,1%
(91,5%, 96,7%)
|
92,1%
(89,1%, 95,1%)
|
88,6%
(85,1%, 92,2%)
|
a Durchschnitt der Wochen 40, 44 und 48. b Durchschnitt der Wochen 104, 108, 112.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Tabelle 3: Wirksamkeitsergebnisse bei den Besuchen zur Untersuchung hinsichtlich des primären Endpunktsa sowie im 2. Jahrb in der Studie LUCERNE
|
Wirksamkeitsergebnisse
|
LUCERNE
| |
1. Jahr
|
2. Jahr
| |
Vabysmo im Abstand von bis zu q16w
N = 331
|
Aflibercept q8w
N = 327
|
Vabysmo im Abstand von bis zu q16w
N = 331
|
Aflibercept q8w
N = 327
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (95%-KI)
|
6,6
(5,3, 7,1)
|
6,6
(5,3, 7,8)
|
5,0
(3,4, 6,6)
|
5,2
(3,6, 6,8)
| |
Anteil der Patienten mit Verbesserung um ≥15 Buchstaben gegenüber dem Anfangswert (CMH-gewichteter Anteil, 95%-KI)
|
20,2%
(15,9%, 24,6%)
|
22,2%
(17,7%, 26,8%)
|
22,4%
(17,8%, 27,1%)
|
21,3%
(16,8%, 25,9%)
| |
Anteil der Patienten mit vermiedener Verschlechterung um ≥15 Buchstaben gegenüber dem Anfangswert (CMH-gewichteter Anteil, 95%-KI)
|
95,8%
(93,6%, 98,0%)
|
97,3%
(95,5%,
99,1%)
|
92,9%
(90,1%, 95,8%)
|
93,2%
(90,2%, 96,2%)
|
a Durchschnitt der Wochen 40, 44 und 48. b Durchschnitt der Wochen 104, 108, 112.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Abbildung 1: Gepoolte Phase-III-Studien bei nAMD (TENAYA und LUCERNE): Plot der Veränderung der BCVA im Studienauge bis Woche 112 gegenüber dem Ausgangswert: MMRM-Methode (primäre Schätzung) (ITT-Population)
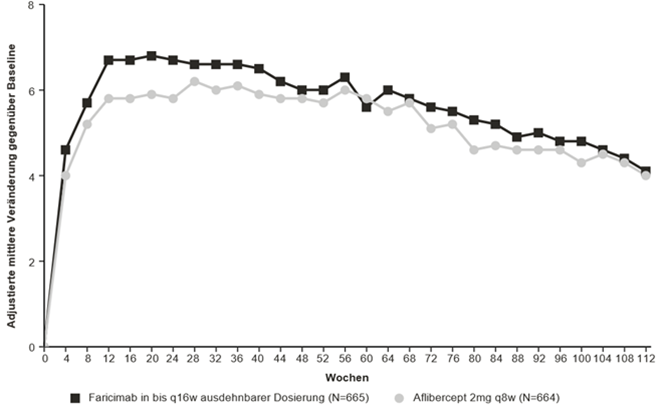
Sowohl in der Studie TENAYA als auch in der Studie LUCERNE waren die Verbesserungen der BCVA und CST in Woche 60 gegenüber dem Studienbeginn in den beiden Behandlungsarmen vergleichbar und stimmten mit denen in Woche 48 überein.
Die Wirksamkeitsergebnisse in allen auswertbaren Untergruppen (z.B. nach Alter, Geschlecht, Ethnie, Sehschärfe zum Studienbeginn, Läsionstyp, Läsionsgrösse) in jeder Studie sowie der gepoolten Analyse entsprachen den Ergebnissen in der Gesamtpopulation.
In beiden Studien wurden durch Gabe von Vabysmo im Abstand von bis zu q16w klinisch bedeutsame Verbesserungen des kombinierten Ergebnisses des Sehfunktion-Fragebogens des National Eye Institute (National Eye Institute Visual Function Questionnaire bzw. NEI VFQ-25) zwischen Studienbeginn und Woche 48 erzielt, die mit denen bei Anwendung von Aflibercept q8w vergleichbar waren. Die Patienten in den Vabysmo-Armen der Studien TENAYA und LUCERNE erzielten in Woche 48 eine Verbesserung des kombinierten Ergebnisses des NEI VFQ-25 gegenüber dem Ausgangswert um ≥4 Punkte.
Behandlung des diabetischen Makulaödems (DME)
Die Sicherheit und Wirksamkeit von Faricimab wurde in zwei 3-armigen, randomisierten (1:1:1), multizentrischen, doppelt maskierten Studien (YOSEMITE und RHINE) über eine Dauer von 2 Jahren bei Patienten mit DME vergleichend zu einer anti-VEGF Behandlung untersucht. Patienten in den drei Studienarmen erhielten intravitreale Injektionen von Faricimab 6 mg q8w (nach 6 monatlichen Injektionen zu Beginn der Behandlung), Faricimab 6 mg mit personalisiertem Injektionsintervall bis maximal q16w (nach 4 monatlichen Injektionen zu Beginn der Behandlung) bzw. Aflibercept 2 mg q8w (nach 5 monatlichen Injektionen zu Beginn der Behandlung). In dem Faricimab-Arm mit bis zu q16w ausdehnbarer Dosierung erfolgte die Dosierung nach einem standardisierten T&E-Schema. Je nach Veränderung der CST bei Messung per OCT und/oder Veränderung der BCVA bei Messung anhand des ETDRS-Letter-Scores, konnte das personalisierte Injektionsintervall in der Faricimab-Gruppe bei jedem Termin zur Gabe des Studienpräparates um 4 Wochen verlängert oder um 4 oder 8 Wochen verkürzt werden (siehe «Dosierung/Anwendung»).
Die Studien schlossen insgesamt 1'891 Patienten ein (davon ca. 94% mit Diabetes mellitus Typ 2), von denen 1'622 Patienten (85,8%) die Studien komplett (bis Woche 100) absolvierten. Insgesamt 1'887 wurden bis Ende der Woche 56 mit mindestens einer Dosis behandelt (1'262 mit Vabysmo). Das Durchschnittsalter [Altersbereich] der untersuchten Patienten lag bei 62,2 Jahren [24 bis 91 Jahre]. Die Studienpopulation umfasste sowohl anti-VEGF naive Patienten (78%) als auch Patienten mit vorheriger anti-VEGF Therapie (22%).
Der primäre Wirksamkeitsendpunkt war die mittlere Veränderung der BCVA vom Studienbeginn bis zum Ende des ersten Jahres (Mittelwert aus den Wochen 48, 52 und 56) ermittelt anhand der Buchstabentafel aus der Early Treatment Diabetic Retinopathy Study (ETDRS) bei einem Abstand von 4 Metern. In beiden Studien wurde die primäre Hypothese (Nichtunterlegenheit) in jeweils beiden Behandlungsarmen bestätigt: die mit Vabysmo q8w oder mit Vabysmo in einer bis q16w ausdehnbaren Dosierung behandelten Patienten und die mit Aflibercept q8w behandelten Patienten wiesen nach dem 1. Jahr eine vergleichbare mittlere Veränderung der BCVA gegenüber ihrem jeweiligen Ausgangswert auf. Diese Visusverbesserungen blieben im 2. Jahr durchgehend erhalten.
Nach 4 anfänglichen monatlichen Dosen konnten die Patienten in dem Vabysmo-Arm mit bis zu q16w ausdehnbarem Dosierungsintervall bis einschliesslich Woche 96 insgesamt mindestens 6 bis maximal 21 Injektionen erhalten haben. In Woche 52 hatten 74% bzw. 71% der Patienten in den jeweiligen Vabysmo-Armen mit bis zu q16w ausdehnbarer Dosierung in den Studien YOSEMITE und RHINE ein Dosierungsintervall von q16w oder q12w erreicht (q16w bei 53% bzw. 51%, q12w bei 21% und 20%). Von den Patienten in den Studien YOSEMITE bzw. RHINE behielten 75% bzw. 84% ein Dosierungsintervall ≥ q12w ohne Verkürzung des Intervalls auf unter q12w bis einschliesslich Woche 96 bei; von den Patienten unter q16w-Dosierungsintervall in Woche 52 behielten 70% bzw. 82% das q16w-Intervall ohne Verkürzung des Intervalls bis einschliesslich Woche 96 bei. In Woche 96 hatten 78% der Patienten im jeweiligen Vabysmo-Arm mit bis zu q16w ausdehnbarer Dosierung in beiden Studien ein Dosierungsintervall von q16w oder q12w erreicht (q16w bei 60% bzw. 65%, q12w bei 18% und 14%). Bei 4% bzw. bei 6% der Patienten in den Studien YOSEMITE bzw. RHINE wurde das Intervall auf q8w ausgedehnt, und die Patienten behielten ein Dosierungsintervall ≤ q8w bis einschliesslich Woche 96 bei; 3% bzw. 5% erhielten nur ein q4w-Intervall bis Ende der Woche 96.
In Tabelle 4, 5, 6, 7 und Abbildung 2 unten sind ausführliche Ergebnisse der Analysen aus den Studien YOSEMITE und RHINE aufgeführt.
Tabelle 4: Wirksamkeitsergebnisse bei den Besuchen im 1. Jahra und im 2. Jahrb zur Untersuchung hinsichtlich des primären Endpunkts in der Studie YOSEMITE
|
Wirksamkeitsergebnisse
|
YOSEMITE
| |
1. Jahr
|
2. Jahr
| |
Vabysmo q8w
N = 315
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 313
|
Aflibercept q8w
N = 312
|
Vabysmo q8w
N = 315
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 313
|
Aflibercept q8w
N = 312
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (97,5%-KI im 1. Jahr und 95% im 2. Jahr)
|
10,7
(9,4, 12,0)
|
11,6
(10,3, 12,9)
|
10,9
(9,6, 12,2)
|
10,7
(9,4, 12,1)
|
10,7
(9,4, 12,1)
|
11,4
(10,0, 12,7)
| |
Anteil der Patienten mit einer Verbesserung der BCVA um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI im 1. Jahr und 2. Jahr)
|
29,2%
(23,9%, 34,5%)
|
35,5%
(30,1%, 40,9%)
|
31,8%
(26,6%, 37,0%)
|
37,2%
(31,4%, 42,9%)
|
38,2%
(32,8%, 43,7%)
|
37,4%
(31,7%, 43,0%)
| |
Anteil der Patienten mit vermiedener Verschlechterung der BCVA um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI im 1. Jahr und 2. Jahr)
|
98,1%
(96,5%, 99,7%)
|
98,6%
(97,2%, 100,0%)
|
98,9%
(97,6%, 100,0%)
|
97,6%
(95,7%, 99,5%)
|
97,8%
(96,1%, 99,5%)
|
98,0%
(96,2%, 99,7%)
|
a Durchschnitt der Wochen 48, 52, 56. b Durchschnitt der Wochen 92, 96, 100.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Hinweis: Die gezeigten Daten zu den CMH-gewichteten Prozent für den Aflibercept-Arm beziehen sich auf den Vergleich zwischen Vabysmo q8w und Aflibercept. Die entsprechenden Daten zu den CMH-gewichteten Prozent für den Vergleich zwischen Vabysmo mit ausdehnbarer Dosierung und Aflibercept sind jedoch ähnlich wie die oben gezeigten Daten.
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale (Skala zur Beurteilung einer diabetischen Retinopathie aus der Early Treatment Diabetic Retinopathy Study).
Tabelle 5: Anteil der Patienten mit Verbesserung des ETDRS-DRSS um ≥2 Stufen gegenüber dem Ausgangswert in Woche 52 und in Woche 96 in der Studie YOSEMITE (hinsichtlich DR auswertbare Population)
|
Wirksamkeitsergebnisse
|
YOSEMITE
| |
52 Wochen
|
96 Wochen
| |
Vabysmo q8w
N = 237
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 242
|
Aflibercept q8w
N = 229
|
Vabysmo q8w
N = 220
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 234
|
Aflibercept q8w
N = 221
| |
Anteil der Patienten mit Verbesserung des ETDRS-DRSS um ≥2 Stufen gegenüber dem Ausgangswert (CMH-gewichteter Anteil)
|
46,0%
|
42,5%
|
35,8%
|
51,4%
|
42,8%
|
42,2%
|
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Hinweis: Die gezeigten Daten zu den CMH-gewichteten Prozenten für den Aflibercept-Arm beziehen sich auf den Vergleich zwischen Vabysmo q8w und Aflibercept. Die entsprechenden Daten zu den CMH-gewichteten Prozenten für den Vergleich zwischen Faricimab mit ausdehnbarer Dosierung und Aflibercept sind jedoch ähnlich wie die oben gezeigten Daten.
Tabelle 6: Wirksamkeitsergebnisse bei den Besuchen im 1. Jahra und im 2. Jahrb zur Untersuchung hinsichtlich des primären Endpunkts in der Studie RHINE
|
Wirksamkeitsergebnisse
|
RHINE
| |
1. Jahr
|
2. Jahr
| |
Vabysmo q8w
N = 317
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 319
|
Aflibercept q8w
N = 315
|
Vabysmo q8w
N = 317
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 319
|
Aflibercept q8w
N = 315
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (97,5%-KI im 1. Jahr und 95% im 2. Jahr)
|
11,8
(10,6, 13,0)
|
10,8
(9,6, 11,9)
|
10,3
(9,1, 11,4)
|
10,9
(9,5, 12,3)
|
10,1
(8,7, 11,5)
|
9,4
(7,9, 10,8)
| |
Anteil der Patienten mit einer Verbesserung der BCVA um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI im 1. Jahr und 2. Jahr)
|
33,8%
(28,4%, 39,2%)
|
28,5%
(23,6%, 33,3%)
|
30,3%
(25,0%, 35,5%)
|
39,8%
(34,0%, 45,6%)
|
31,1%
(26,1%, 36,1%)
|
39,0%
(33,2%, 44,8%)
| |
Anteil der Patienten mit vermiedener Verschlechterung der BCVA um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI im 1. Jahr und 2. Jahr)
|
98,9%
(97,6%, 100,0%)
|
98,7%
(97,4%, 100,0%)
|
98,6%
(97,2%, 99,9%)
|
96,6%
(94,4%, 98,8%)
|
96,8%
(94,8%, 98,9%)
|
97,6%
(95,7%, 99,5%)
|
a Durchschnitt der Wochen 48, 52, 56. b Durchschnitt der Wochen 92, 96, 100.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Hinweis: Die gezeigten Daten zu den CMH-gewichteten Prozenten für den Aflibercept-Arm beziehen sich auf den Vergleich zwischen Vabysmo q8w und Aflibercept. Die entsprechenden Daten zu den CMH-gewichteten Prozenten für den Vergleich zwischen Vabysmo mit ausdehnbarer Dosierung und Aflibercept sind jedoch ähnlich wie die oben gezeigten Daten.
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale (Skala zur Beurteilung einer diabetischen Retinopathie aus der Early Treatment Diabetic Retinopathy Study).
Tabelle 7: Anteil der Patienten mit Verbesserung des ETDRS-DRSS um ≥2 Stufen gegenüber dem Ausgangswert in Woche 52 und in Woche 96 in der Studie RHINE (hinsichtlich DR auswertbare Population)
|
Wirksamkeitsergebnisse
|
RHINE
| |
52 Wochen
|
96 Wochen
| |
Vabysmo q8w
N = 231
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 251
|
Aflibercept q8w
N = 238
|
Vabysmo q8w
N = 214
|
Vabysmo mit ausdehnbarer Dosierung im Abstand von bis zu q16w
N = 228
|
Aflibercept q8w
N = 203
| |
Anteil der Patienten mit Verbesserung des ETDRS-DRSS um ≥2 Stufen gegenüber dem Ausgangswert (CMH-gewichteter Anteil)
|
44,2%
|
43,7%
|
46,8%
|
53,5%
|
44,3%
|
43,8%
|
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Hinweis: Die gezeigten Daten zu den CMH-gewichteten Prozenten für den Aflibercept-Arm beziehen sich auf den Vergleich zwischen Vabysmo q8w und Aflibercept. Die entsprechenden Daten zu den CMH-gewichteten Prozenten für den Vergleich zwischen Vabysmo mit ausdehnbarer Dosierung und Aflibercept sind jedoch ähnlich wie die oben gezeigten Daten.
Abbildung 2: Gepoolte Phase-III-Studien bei DME (YOSEMITE und RHINE): Plot der Veränderung der BCVA im Studienauge bis Woche 100 gegenüber dem Ausgangswert: MMRM-Methode (primäre Schätzung) (ITT-Population)
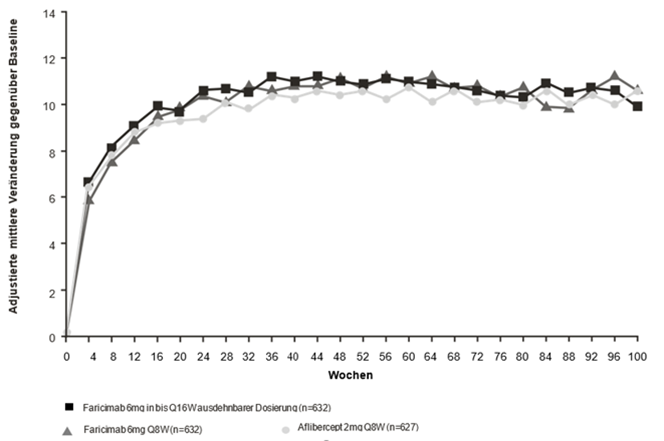
Die Wirksamkeitsergebnisse bei Patienten ohne Anti-VEGF-Vorbehandlung vor der Studienteilnahme sowie in allen anderen auswertbaren Untergruppen (z.B. nach Alter, Geschlecht, Ethnie, HbA1c zum Studienbeginn, Sehschärfe zum Studienbeginn) in jeder Studie entsprachen den Ergebnissen in der jeweiligen Gesamtpopulation.
Die Behandlungswirkung war unabhängig vom glykämischen Management. Bei Patienten, deren HbA1c sich im Zeitverlauf um > 0,5% verbesserte oder verschlechterte oder innerhalb von 0,5% des Ausgangswertes blieb, wurden unter Behandlung mit Faricimab vergleichbare Ergebnisse erzielt.
Behandlung eines Makulaödems als Folge von BRVO oder CRVO
Die Sicherheit und Wirksamkeit von Faricimab wurde in zwei multizentrischen Studien bei Patienten mit Makulaödem als Folge von BRVO (BALATON) oder C/HRVO (COMINO) untersucht. Beide Studien bestanden aus einer initialen, 24-wöchigen, randomisierten (1:1), aktiv kontrollierten (Aflibercept) Behandlungsphase. Anschliessend wurden alle Patienten (einschliesslich der ursprünglich mit Aflibercept behandelten) gemäss einem personalisierten Dosierungsschema bis Woche 68 (letzte Visite in Woche 72) mit Faricimab behandelt. Das Dosierungsintervall konnte dabei basierend auf der Krankheitsaktivität (beurteilt anhand einer vorab definierten, automatisierten und objektiven Bewertung visusbezogener und anatomischer Kriterien) um jeweils 4 Wochen bis maximal q16w ausgedehnt und bei Bedarf (Verschlechterung der CST und/oder Sehschärfe) wieder um jeweils 4, 8 oder 12 Wochen verkürzt werden. In Patienten, die eine Verkürzung des Behandlungsintervalls erforderten, wurde dieses nach Stabilisierung der Krankheitsaktivität nicht erneut ausgedehnt. Ausgenommen davon waren Patienten mit einem minimalen (4 Wochen) Abstand zwischen den Injektionen.
Es wurden insgesamt 1'282 Patienten (553 in BALATON und 729 in COMINO) in die beiden Studien aufgenommen, wobei 1'276 Patienten bis einschliesslich Woche 24 mit mindestens einer Dosis behandelt wurden (641 mit Vabysmo).
In beiden Studien wurde die Wirksamkeit in Bezug auf den primären Endpunkt festgestellt, definiert als Veränderung der BCVA zwischen Studienbeginn und Woche 24, gemessen anhand des ETDRS-Letter-Score. In beiden Studien wiesen die mit Vabysmo q4w behandelten Patienten gegenüber den Patienten unter Behandlung mit Aflibercept q4w in Woche 24 eine nicht unterlegene mittlere Veränderung der BCVA gegenüber dem Ausgangswert auf und diese Visusverbesserungen blieben bis einschliesslich Woche 72 bestehen, wenn die Patienten auf ein bis zu q16w ausdehnbares Vabysmo-Dosierungsschema umgestellt wurden.
Zwischen Woche 24 und Woche 68 erzielten 81,5% der Patienten in der Studie BALATON und 74,0% der Patienten in der Studie COMINO, die Vabysmo 6 mg in einer bis zu q16w ausdehnbaren Dosierung erhielten, ein Dosierungsintervall von q16w oder q12w. Von diesen Patienten schlossen 72,1% in der Studie BALATON und 61,6% in der Studie COMINO mindestens einen Zyklus mit Dosierung q12w ab und behielten ein Dosierungsintervall von q16w oder q12w ohne Verkürzung des Intervalls auf unter q12w bis einschliesslich Woche 68 bei; 1,2% der Patienten in der Studie BALATON und 2,5% der Patienten in der Studie COMINO erhielten bis einschliesslich Woche 68 nur eine Dosierung q4w.
In Tabellen 8 und 9, Abbildung 3 und Abbildung 4 unten sind ausführliche Ergebnisse beider Studien gezeigt.
Tabelle 8: Wirksamkeitsergebnisse in Bezug auf den primären Endpunkt in Woche 24 sowie zum Studienende in der Studie BALATON
|
Wirksamkeitsergebnisse
|
BALATON
| |
24 Wochen
|
72 Wochena
| |
Vabysmo
N = 276
|
Aflibercept
N = 277
|
Umstellung von Vabysmo q4w auf Vabysmo mit ausdehnbarer Dosierung
N = 276
|
Umstellung von Aflibercept q4w auf Vabysmo mit ausdehnbarer Dosierung
N = 277
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (95%-KI)
|
16,9
(15,7, 18,1)
|
17,5
(16,3, 18,6)
|
18,1
(16,9, 19,4)
|
18,8
(17,5, 20,0)
| |
Anteil der Patienten mit einer Verbesserung um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI)
|
56,1%
(50,4%, 61,9%)
|
60,4%
(54,7%, 66,0%)
|
61,5%
(56,0%, 67,0%)
|
65,8%
(60,3%, 71,2%)
|
a Durchschnitt der Wochen 64, 68, 72.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Tabelle 9: Wirksamkeitsergebnisse in Bezug auf den primären Endpunkt in Woche 24 sowie zum Studienende in der Studie COMINO
|
Wirksamkeitsergebnisse
|
COMINO
| |
24 Wochen
|
72 Wochena
| |
Vabysmo
N = 366
|
Aflibercept
N = 363
|
Umstellung von Vabysmo q4w auf Vabysmo mit ausdehnbarer Dosierung
N = 366
|
Umstellung von Aflibercept q4w auf Vabysmo mit ausdehnbarer Dosierung
N = 363
| |
Mittlere Veränderung der BCVA gemessen anhand des ETDRS-Letter-Scores gegenüber dem Ausgangswert (95%-KI)
|
16,9
(15,4, 18,3)
|
17,3
(15,9, 18,8)
|
16,9
(15,2, 18,6)
|
17,1
(15,4, 18,8)
| |
Anteil der Patienten mit einer Verbesserung um mindestens 15 Buchstaben gegenüber dem Ausgangswert (CMH-gewichteter Anteil, 95%-KI)
|
56,6%
(51,7%, 61,5%)
|
58,1%
(53,3%, 62,9%)
|
57,6%
(52,8%, 62,5%)
|
59,5%
(54,7%, 64,3%)
|
a Durchschnitt der Wochen 64, 68, 72.
BCVA: Best Corrected Visual Acuity (bestkorrigierte Sehschärfe).
ETDRS: Early Treatment Diabetic Retinopathy Study.
KI: Konfidenzintervall.
CMH: Cochran–Mantel–Haenszel-Methode; ein statistischer Test, der eine Schätzung einer Assoziation mit einem binären Ergebnis generiert und zur Beurteilung kategorialer Variablen verwendet wird.
Abbildung 3: Phase-III-Studie BALATON: Plot der Veränderung der BCVA bis Woche 72 gegenüber dem Ausgangswert: MMRM-Methode (primäre Schätzung) (ITT-Population)
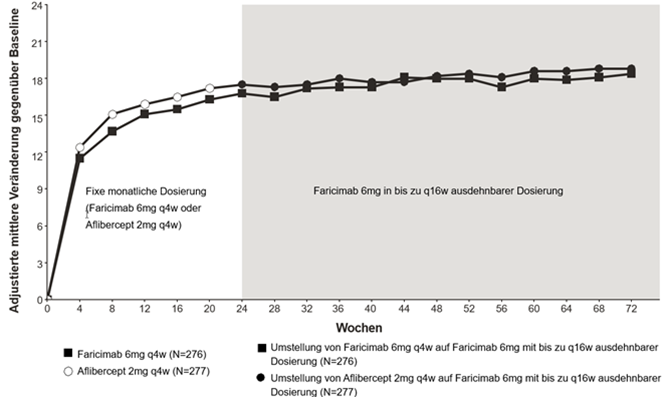
Abbildung 4: Phase-III-Studie COMINO: Plot der Veränderung der BCVA bis Woche 72 gegenüber dem Ausgangswert: MMRM-Methode (primäre Schätzung) (ITT-Population)
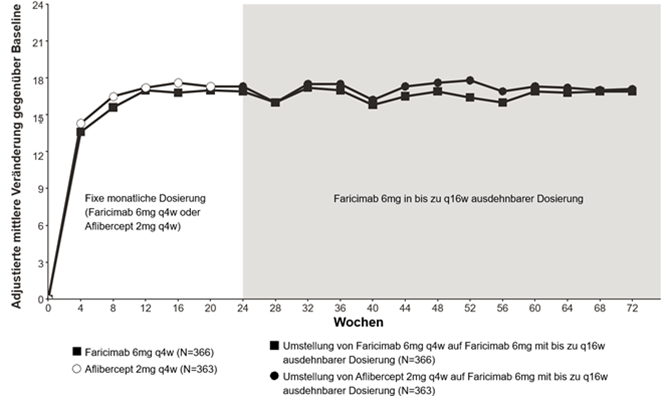
Ältere Patienten
In den sechs klinischen Phase-III-Studien waren ungefähr 58% (1'496/2'571) der Patienten, die nach der Randomisierung eine Behandlung mit Vabysmo erhielten, ≥65 Jahre alt. Die Analyse der Populationspharmakokinetik ergab eine Auswirkung des Alters auf die okuläre Pharmakokinetik von Faricimab, die nicht als klinisch bedeutsam eingestuft wurde (siehe «Dosierung/Anwendung, Ältere Patienten» und «Pharmakokinetik, Ältere Patienten»).
Pädiatrie
Die Sicherheit und Wirksamkeit von Vabysmo bei pädiatrischen Patienten wurde nicht untersucht.
Weitere Informationen
Immunogenität
Bei Patienten unter Behandlung mit Vabysmo kann es zum Auftreten einer Immunreaktion kommen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nach Anwendung von Vabysmo bis zu 112 (nAMD), 100 (DME) und 72 (BRVO/CRVO) Wochen wurden bei etwa 13,8%, 9,6% und 14,4% der Patienten mit nAMD, DME bzw. BRVO/CRVO, die nach Randomisierung Faricimab erhielten, behandlungsbedingte Anti-Faricimab-Antikörper festgestellt. Die klinische Bedeutung von Anti-Faricimab-Antikörpern im Hinblick auf die Sicherheit ist zum jetzigen Zeitpunkt nicht geklärt. Bei den Patienten mit Anti-Faricimab-Antikörpern gab es eine höhere Inzidenz unerwünschter Wirkungen mit intraokulärer Entzündung. Die Gesamtinzidenz von Anti-Faricimab-Antikörper-Positivität und intraokulären Entzündungen in der gesamten Studienpopulation liegt jedoch bei etwa 1%. Anti-Faricimab-Antikörper waren nicht mit Auswirkungen auf die klinische Wirksamkeit oder die systemische Pharmakokinetik verbunden.
|




