Eigenschaften/WirkungenATC-Code
L04AD03
Immunsuppressiva, Calcineurin-Inhibitoren
Wirkungsmechanismus
Voclosporin ist ein Immunsuppressivum mittels der Calcineurin-Inhibition. Bei der Aktivierung von Lymphozyten kommt es zu einem Anstieg der intrazellulären Calciumkonzentration. Calcineurin ist eine Calcium-/Calmodulin-abhängige Phosphatase, deren Aktivität für die Induktion der Lymphokinproduktion und Proliferation von T-Zellen erforderlich ist. Die immunsuppressive Aktivität führt zur Inhibition der Lymphozytenproliferation, T-Zell-Zytokinproduktion und Expression von T-Zell-Aktivierungs-Oberflächenantigenen.
Studien an Tiermodellen sprechen auch für eine nicht-immunologischen Einfluss der Calcineurin-Inhibition auf die Nierenfunktion im Sinne einer Stabilisierung des Aktin-Zytoskeletts und der Stressfasern von Podozyten, die zu erhöhter Integrität der Podozyten in den Glomeruli führt.
Pharmakodynamik
Calcineurin-Inhibition
Nach zweimal täglicher oraler Anwendung von Voclosporin bei gesunden Probanden wurde eine konzentrationsabhängige Calcineurin-Inhibition, gemessen als Prozentsatz der maximalen Calcineurin-Inhibition, beobachtet. Es besteht kein oder kaum ein zeitlicher Abstand zwischen der Zeit bis zur maximalen Wirkstoffkonzentration und der Zeit bis zur maximalen Calcineurin-Inhibition. Die von Voclosporin bewirkte Calcineurin-Inhibition ist dosisabhängig bis zu einer maximalen Dosis von 1,0 mg/kg. Unter einer Voclosporin-Dosis von 23,7 mg zweimal täglich wurde eine Calcineurin-Inhibition von 16% bei Ctrough und 58% bei Cmax festgestellt.
Kardiale Elektrophysiologie
In einer randomisierten, placebo- und aktiv (mit Moxifloxacin 400 mg) kontrollierten Einzeldosisstudie mit Parallelgruppen-Studiendesign wurde eine dosisabhängige Verlängerung des QT-Intervalls mit Voclosporin im Dosisbereich von 0,5 mg/kg bis 4,5 mg/kg (bis zum 9-Fachen der Exposition bei der therapeutischen Dosis) festgestellt. Die dosisabhängige Wirkung auf die QT-Verlängerung ergab bei verschiedenen Dosen eine Zeit bis zur maximalen QTc-Verlängerung von 4 bis 6 Stunden nach der Dosisgabe. Die maximalen mittleren Placebokorrigierten Veränderungen der QTcF gegenüber dem Ausgangswert nach Gabe von Voclosporin in einer Dosis von 0,5 mg/kg, 1,5 mg/kg, 3,0 mg/kg und 4,5 mg/kg betrugen 6,4 msec, 17,5 msec, 25,7 msec bzw. 34,6 msec.
Die Wirkung der wiederholten Gabe von zweimal täglich Voclosporin 0,3 mg/kg, 0,5 mg/kg und 1,5 mg/kg auf das QTc-Intervall wurde in einer randomisierten, placebo- und aktiv (mit Moxifloxacin 400 mg) kontrollierten Crossover-Studie an 31 gesunden Probanden untersucht. In den mit 0,3 mg/kg und 0,5 mg/kg Voclosporin (d. h. dem Dosisbereich der LN-Therapie) behandelten Gruppen betrug der mittlere maximale Unterschied zu Placebo beim QTcF-Intervall 0,8 msec bzw. 2,4 msec, jeweils mit einer Obergrenze des einseitigen 95-%-KI von 4,7 msec bzw. 6,2 msec. Unter der supra-therapeutischen Dosis von 1,5 mg/kg zweimal täglich betrug der mittlere Unterschied zu Placebo beim QTcI-Intervall 2,8 msec, mit der Obergrenze des einseitigen 95-%-KI bei 6,9 msec. Auf der Grundlage von Daten von Lupus-Nephritis Patienten, die Voclosporin in einer Dosierung von 23,7 mg oder 39,5 mg zweimal täglich erhielten, ergab eine Regressionsanalyse der placebokorrigierten QTcF-Veränderung gegenüber Studienbeginn eine negative Steigung (-0,065344 msec/ng/ml) ohne statistischen Unterschied zu einer Steigung von 0 (p = 0,1042).
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Voclosporin wurden in zwei placebokontrollierten klinischen Studien (AURORA 1 und AURA-LV) bei Patienten mit Lupus-Nephritis der Klasse III oder IV (allein oder in Kombination mit Klasse V) oder der reinen Klasse V untersucht. Alle Patienten erhielten eine Basistherapie mit MMF (2 g/Tag) und niedrig dosierten Kortikosteroiden (bis zu insgesamt 1 g Methylprednisolon intravenös (i.v.) an Tag 1 und 2, gefolgt von einer Anfangsdosis oraler Kortikosteroide von 25 mg/Tag (oder 20 mg/Tag bei einem Körpergewicht <45 kg), die bis Woche 16 auf 2,5 mg/Tag herabtitriert wurde).
Während der gesamten Studien durften die Patienten keine Immunsuppressiva (ausser MMF und Hydroxychloroquin/Chloroquin) einnehmen oder die Dosierung von Angiotensin-II-Rezeptorblocker (ARB) oder Angiotensin-Converting-Enzyme (ACE)-Hemmer ändern.
Die Sicherheit und Wirksamkeit wurden in einer zweijährigen Verlängerungsstudie (AURORA 2) bei Patienten, die die Studie AURORA 1 abgeschlossen hatten, weiter untersucht.
Phase-3-Studie AURORA 1
Die AURORA 1 Studie war eine prospektive, randomisierte, doppelblinde Phase 3 Studie, in der Voclosporin zweimal täglich 23,7 mg (entsprechend einer Dosis von 0,37 mg/kg; n = 179) gegenüber Placebo (n = 178) über einen Behandlungszeitraum von 52 Wochen verglichen wurde.
Im Voclosporin-Arm erreichten mehr Patienten als im Placebo-Arm den primären Endpunkt des adjudizierten renalen Ansprechens (definiert als Urin-Protein/Kreatinin-Quotient (UPCR) ≤ 0,5 mg/mg bei normaler, stabiler Nierenfunktion und unter kontinuierlicher, niedrig dosierter Steroidtherapie) nach 52 Wochen (40,8% vs. 22,5%; OR = 2,65; 95-%-KI: 1,64, 4,27; p < 0,001).
Die demografischen Merkmale der Studienpatienten waren über die beiden Behandlungsarme ausgewogen verteilt. Das Durchschnittsalter betrug 33 Jahre (Bereich 18 bis 72 Jahre) und die Mehrheit der Teilnehmer war weiblich (87,7%), darunter 81,8% im gebärfähigen Alter.
Die meisten Teilnehmer waren kaukasischer (36,1%) oder asiatischer (30,5%) Herkunft, und ca. ein Drittel der Studienpopulation war hispanischer oder lateinamerikanischer Herkunft.
Das Durchschnittsgewicht betrug 66,5 kg (Bereich 36 bis 142 kg). Die mediane Zeit seit Diagnose eines systemischen Lupus erythematodes (SLE) betrug 5,0 Jahre und die mediane Zeit seit Diagnose der Lupus-Nephritis betrug 2,0 Jahre.
Alle vorab definierten, hierarchischen sekundären Endpunkte erreichten statistische Signifikanz zugunsten von Voclosporin (siehe Tabelle 4).
Tabelle 4: AURORA 1 – Zusammenfassung der hierarchischen Endpunkte
|
|
Voclosporin
(n = 179)
n (%)
|
Placebo
(n = 178)
n (%)
|
Odds Ratio vs. Placebo
(95-%-KI)
|
p-Wert
| |
Adjudiziertes renales Ansprechen in Woche 52
|
73
(40,8)
|
40
(22,5)
|
2,65
(1,64, 4,27)
|
< 0,001
| |
Adjudiziertes renales Ansprechen in Woche 24
|
58
(32,4)
|
35
(19,7)
|
2,23
(1,34, 3,72)
|
= 0,002
| |
Partielles renales Ansprechen* in Woche 24
|
126
(70,4)
|
89
(50,0)
|
2,43
(1,56, 3,79)
|
< 0,001
| |
Partielles renales Ansprechen* in Woche 52
|
125
(69,8)
|
92
(51,7)
|
2,26
(1,45, 3,51)
|
< 0,001
| |
Zeit bis UPCR ≤0,5 mg/mg
|
Voclosporin schneller als Kontrolle
|
2,02
(1,51, 2,70)
|
< 0,001
| |
Zeit bis 50% Reduktion der UPCR
|
Voclosporin schneller als Kontrolle
|
2,05
(1,62, 2,60)
|
< 0,001
|
* Partielles renales Ansprechen war definiert als 50% Reduktion der UPCR.
Anmerkungen: KI = Konfidenzintervall; UPCR = Urin-Protein/Kreatinin-Quotient
Die Ergebnisse von Kovariaten-Analysen nach Alter, Geschlecht, ethnischer Abstammung, Region, Biopsie-Klasse, MMF beim Screening und MMF-Höchstdosis beschreiben in allen Untergruppen eine Odds Ratio zugunsten von Voclosporin vs. Placebo (Abbildung 1).
Abbildung 1: Forest-Plot des adjudizierten renalen Ansprechens in Woche 52 nach Untergruppen

Im Voclosporin-Arm erreichten mehr Patienten verglichen zum Placebo-Arm einen UPCR ≤0,5 mg/mg (64,8% vs. 43,8%), und die Zeit bis zur Erreichung eines UPCR ≤ 0,5 mg/mg war unter Voclosporin signifikant kürzer (mediane Dauer: 169 Tage vs. 372 Tage unter Placebo; Hazard Ratio (HR) 2,02; 95-%-KI: 1,51, 2,70; p < 0,001).
Wie im Kaplan-Meier-Plot (Abbildung 2) zu erkennen, wurde der Unterschied zwischen den beiden Behandlungsarmen im ersten Monat sichtbar und hatte für die gesamte Dauer der Studie Bestand.
Abbildung 2: Kaplan-Meier-Kurve der Zeit (Tage) bis UPCR ≤ 0,5 mg/mg
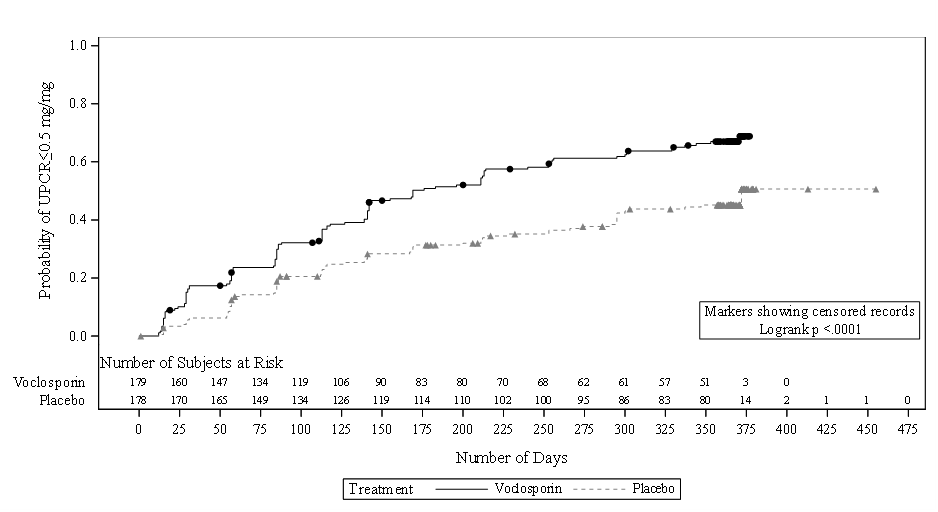
96,6% der Patienten, die mit Voclosporin behandelt wurden, erreichten eine 50%ige Reduktion der UPCR gegenüber Behandlungsbeginn; bei den Patienten, die Placebo erhielten, waren es 75,8%. Die Zeit bis zur Erreichung dieser 50%igen UPCR-Reduktion war im Voclosporin-Arm signifikant kürzer als im Placebo-Arm (HR 2,05; 95-%-KI: 1,62, 2,60; p < 0,001). Die mediane Zeit bis zur 50%igen Reduktion der UPCR betrug 29 Tage unter Voclosporin vs. 63 Tage unter Placebo (Abbildung 3).
Abbildung 3: Kaplan-Meier-Kurve der Zeit (Tage) bis 50% Reduktion der UPCR gegenüber Behandlungsbeginn

Phase-3-Studie AURORA 2
Bei der AURORA-2-Studie handelte es sich um eine Verlängerungsstudie mit Patienten, die die AURORA-1-Studie abgeschlossen hatten. Die Patienten wurden mit der gleichen Behandlung, die sie am Ende der AURORA-1-Studie erhalten hatten, 2 weitere Jahre lang weiterbehandelt.
Voclosporin wurde gut vertragen und bei den Patienten, die weiterhin Voclosporin erhielten, wurden keine neuen oder unerwarteten Sicherheitssignale beobachtet. Die Inzidenz unerwünschter Ereignisse nahm mit der Zeit in beiden Behandlungsarmen ab, und die 3-Jahres-Sicherheitsdaten zu Voclosporin bei Patienten mit Lupus-Nephritis ergaben keine Hinweise auf eine chronische Nierentoxizität, Neurotoxizität oder ein gehäuftes Auftreten maligner Erkrankungen. Darüber hinaus blieb die mittlere eGFR über den 3jährigen Behandlungszeitraum hinweg stabil.
Der Anteil der Patienten, der einen UPCR ≤ 0,5 mg/mg erreichte, wurde über den Studienverlauf in beiden Behandlungsarmen aufrechterhalten. Der Anteil der Patienten, der einen UPCR ≤ 0,5 mg/mg erreichte, war in der Voclosporin-Gruppe zu allen Zeitpunkten grösser als in der Placebo-Gruppe.
|



