Eigenschaften/WirkungenATC-Code
L01EL02
Wirkungsmechanismus
Acalabrutinib ist ein selektiver niedermolekularer Bruton-Tyrosinkinase (BTK)-Inhibitor. BTK ist ein Signalmolekül der B-Zell-Antigen-Rezeptor- (BCR) und Zytokin-Rezeptor-Signalwege. Die Signalgebung über BTK führt in B-Zellen zum Überleben und zur Proliferation der Zellen und ist für zelluläre Adhäsion, Trafficking und Chemotaxis erforderlich.
Acalabrutinib und sein aktiver Metabolit (ACP-5862) bilden eine kovalente Bindung mit einem Cysteinrest im aktiven Zentrum von BTK, was zur irreversiblen und selektiven Inaktivierung von BTK (IC50 ≤5nM) mit minimalen off-target Interaktionen führt. In einem Screening von 380 Säugetier-Wildtyp-Kinasen waren die einzigen zusätzlichen Kinasen, die durch klinisch relevante Konzentrationen von Acalabrutinib und ACP-5862 beeinflusst wurden, BMX und ERBB4, und diese Beeinflussung war von 3- bis 4-fach geringerer Potenz als bei BTK.
In nicht-klinischen Studien inhibierte Acalabrutinib die BTK-vermittelte Aktivierung der nachgeschalteten Signalproteine CD86 und CD69, hemmte die Proliferation und das Überleben maligner B-Zellen und wies eine minimale Aktivität auf andere Immunzellen (T-Zellen und NK-Zellen) auf.
Pharmakodynamik
Bei Patienten mit malignen B-Zell-Erkrankungen, die zweimal täglich 100 mg Acalabrutinib einnahmen, betrug die mediane BTK-Belegung im peripheren Blut im Steady-State ≥95% und blieb über 12 Stunden aufrechterhalten. Dies führte zur Inaktivierung von BTK über das gesamte empfohlene Verabreichungsintervall.
Kardiale Elektrophysiologie
In einer spezifischen QT-Studie wurde durch Acalabrutinib nach Gabe von 100 mg und 400 mg Einzeldosen, keine klinisch relevante Verlängerung des QT/QTc-Intervalls beobachtet (z.B. nicht länger als oder gleich 10 ms).
Klinische Wirksamkeit
Patienten mit nicht vorbehandelter CLL
Die Sicherheit und Wirksamkeit von CALQUENCE bei Patienten mit nicht vorbehandelter CLL wurde in einer multizentrischen, randomisierten, unverblindeten Phase-III-Studie (ELEVATE-TN) untersucht, an der 535 Patienten teilnahmen. Es musste sich um eine CD20+, gemäss IWCLL 2008 Kriterien diagnostizierte und aktive/behandlungsbedürftige CLL handeln. Darüber hinaus mussten absolute Neutrophilenzahl und Thrombozyten unabhängig von Wachstumsfaktor- respektive Transfusions-Unterstützung sein und über 750 respektive 50.000 Zellen/μl liegen (im Falle von Knochenmarksbeteiligung über 500 respektive 30.000 Zellen/μl). Patienten mit ZNS-Beteiligung, prolymphozytischer Leukämie oder Richter-Transformation waren von der Teilnahme ausgeschlossen. Die Patienten erhielten CALQUENCE plus Obinutuzumab, CALQUENCE als Monotherapie oder Obinutuzumab plus Chlorambucil. Die ELEVATE-TN-Studie schloss Patienten im Alter von 65 Jahren oder darüber und solche zwischen 18 und 65 Jahren mit Begleiterkrankungen (Kreatinin-Clearance 30-69 ml/min und/oder CIRS-G-Score >6) ein. Die Patienten durften begleitend antithrombotische Wirkstoffe erhalten, mit Ausnahme von Warfarin und äquivalenten Vitamin-K-Antagonisten.
Die Patienten wurden im Verhältnis 1:1:1 randomisiert und einem der folgenden 3 Behandlungsarme zugeteilt:
·CALQUENCE plus Obinutuzumab (CALQUENCE+G): CALQUENCE wurde, beginnend an Tag 1 von Zyklus 1, bis zu einem Fortschreiten der Krankheit oder bis zum Auftreten einer nicht vertretbaren Toxizität in einer Dosis von 100 mg zweimal täglich verabreicht. Obinutuzumab wurde, beginnend an Tag 1 von Zyklus 2, für maximal 6 Behandlungszyklen verabreicht. Obinutuzumab wurde in einer Dosis von 1'000 mg an den Tagen 1 und 2 (100 mg an Tag 1 und 900 mg an Tag 2), 8 und 15 von Zyklus 2 verabreicht, gefolgt von 1'000 mg an Tag 1 der Zyklen 3 bis 7. Ein Behandlungszyklus dauerte 28 Tage.
·CALQUENCE-Monotherapie: CALQUENCE wurde bis zu einem Fortschreiten der Krankheit oder bis zum Auftreten einer nicht vertretbaren Toxizität in einer Dosis von 100 mg zweimal täglich verabreicht.
·Obinutuzumab plus Chlorambucil (GClb): Obinutuzumab und Chlorambucil wurden für maximal 6 Behandlungszyklen verabreicht. Obinutuzumab wurde in einer Dosis von 1.000 mg an den Tagen 1 und 2 (100 mg an Tag 1 und 900 mg an Tag 2), 8 und 15 von Zyklus 1 verabreicht, gefolgt von 1.000 mg an Tag 1 der Zyklen 2 bis 6. Chlorambucil wurde in einer Dosis von 0,5 mg/kg an den Tagen 1 und 15 der Zyklen 1 bis 6 verabreicht. Ein Behandlungszyklus dauerte 28 Tage.
Die Patienten wurden gemäss 17p-Deletions-Mutationsstatus (Ja/Nein), ECOG-Performance-Status (Status gemäss Eastern Cooperative Oncology Group, 0 oder 1 versus 2) und geographische Region (Nordamerika und Westeuropa versus Andere) stratifiziert. Nach bestätigtem Fortschreiten der Krankheit erhielten 45 in den GClb-Arm randomisierte Patienten im Rahmen eines Crossovers die CALQUENCE-Monotherapie.
Die Ausgangsmerkmale waren in den drei Armen (Calquence plus Obinutuzumab [n=179], Calquence-Monotherapie [n=179] und Obinutuzumab plus Chlorambucil [n=177]) generell ausgewogen: medianes Alter 70, 70 bzw. 71 Jahre; 62%, 62% bzw. 59,9% waren männlich; 94,4%, 92,2% bzw. 94,4% hatten einen ECOG-PS von 0-1; die mediane Zeit seit Diagnosestellung betrug 30,5, 24,4 bzw. 30,7 Monate; die zytogenetischen Faktoren (del17p, del11q, TP53-Mutation, nicht-mutiertes IGHV, komplexer Karyotyp) sowie das Rai-Stadium waren generell ausgewogen.
Der primäre Endpunkt war das progressionsfreie Überleben (PFS) gemäss Beurteilung durch ein unabhängiges Gremium (IRC) auf Grundlage der IWCLL (International Workshop on Chronic Lymphocytic Leukemia)-Kriterien aus dem Jahr 2008 unter Berücksichtigung der Abklärung betreffend behandlungsbedingter Lymphozytose (Cheson 2012). Nach einer medianen Nachbeobachtungsdauer von 28,3 Monaten zeigte das durch das IRC ermittelte PFS bei den Patienten mit nicht vorbehandelter CLL im CALQUENCE+G-Behandlungsarm im Vergleich zum GClb-Behandlungsarm eine statistisch signifikante Reduktion des Risikos für Fortschreiten der Krankheit oder Tod von 90%. Zum Zeitpunkt der Analyse war das mediane Gesamtüberleben mit insgesamt 37 Todesfällen noch in keinem Behandlungsarm erreicht worden: 9 (5%) im CALQUENCE+G-Behandlungsarm, 11 (6,1%) im CALQUENCE-Monotherapie-Behandlungsarm und 17 (9,6%) im GClb-Arm. Die Wirksamkeitsdaten sind in Tabelle 5 aufgeführt.
Tabelle 5: Wirksamkeitsergebnisse bei Patienten mit CLL (ELEVATE-TN)
|
Merkmal
|
CALQUENCE plus Obinutuzumab
N=179
|
CALQUENCE-Monotherapie
n=179
|
Obinutuzumab plus Chlorambucil
n=177
| |
Progressionsfreies Überleben*
| |
Anzahl der Ereignisse (%)
|
14 (7,8)
|
26 (14,5)
|
93 (52,5)
| |
Median (95%-KI), Monate
|
n.e.
|
n.e. (34,2; n.e.)
|
22.6 (20,2; 27,6)
| |
HR† (95%-KI)
|
0,10 (0,06; 0,17)
|
0,20 (0,13; 0,30)
|
-
| |
Gesamtansprechrate*
| |
ORR, n (%)
(95%-KI)
|
168 (93,9)
(89,3; 96,5)
|
153 (85.5)
(79,6; 89,9)
|
139 (78.5)
(71,9; 83,9)
| |
CR, n (%)
|
23 (12,8)
|
1 (0,6)
|
8 (4,5)
|
KI=Konfidenzintervall; HR=Hazard Ratio; n.e.=nicht erreicht; CR=Vollremission (Complete Response); CRi=Vollremission mit unvollständiger Erholung der Blutzellzahlen; nPR=noduläre Teilremission; PR=Teilremission (Partial Response);
*Gemäss IRC-Beurteilung
†Basierend auf einem stratifizierten Cox-Proportional-Hazards-Modell
Die PFS-Ergebnisse für die Behandlung mit CALQUENCE mit oder ohne Obinutuzumab fielen in den verschiedenen Untergruppen, darunter solche mit Hochrisiko-Merkmalen (17p-Deletion, 11q-Deletion, TP53-Mutation und nicht-mutiertes IGHV), vergleichbar aus.
Eine Richter-Transformation trat bei 6 Patienten (3,4%) im Acalabrutinib-Monotherapie-Arm (und bei keinem Patienten im Kombinationstherapie-Arm) während der randomisierten Phase und bei einem Patienten (2,2%) im Chlorambucil/Obinutuzumab-Arm während der Crossover-Phase auf.
Patienten mit CLL, die mindestens eine Vorbehandlung erhalten haben
Die Sicherheit und Wirksamkeit von CALQUENCE bei Patienten mit rezidivierter oder refraktärer CLL wurden in einer multizentrischen, randomisierten, unverblindeten Phase-III-Studie (ASCEND) untersucht, an der 310 Patienten teilnahmen, die mindestens eine vorherige Behandlung erhalten hatten. Eine vorgängige Behandlung mit einem B-Zell Lymphom (BCL)-2-Inhibitor (z.B. Venetoclax), einem B-Zell Rezeptor (BCR) Inhibitor (z.B. BTK- oder PI3K-Inhibitoren) oder eine Radio- oder Toxin-konjugierte Antikörper-Therapie war nicht gestattet. Es musste sich um eine CD20+, gemäss IWCLL 2008 Kriterien diagnostizierte und aktive/behandlungsbedürftige CLL handeln. Darüber hinaus mussten absolute Neutrophilenzahl und Thrombozyten unabhängig von Wachstumsfaktor- respektive Transfusions-Unterstützung sein und über 750 respektive 50.000 Zellen/μl liegen (im Falle von Knochenmarksbeteiligung über 500 respektive 30.000 Zellen/μl). Patienten mit ZNS-Beteiligung, prolymphozytischer Leukämie oder Richter-Transformation waren von der Teilnahme ausgeschlossen. Die Patienten erhielten eine CALQUENCE-Monotherapie oder eine Behandlung nach Wahl des Prüfarztes, die entweder in Idelalisib plus Rituximab oder in Bendamustin plus Rituximab bestehen konnte. Die Anwendung antithrombotischer Wirkstoffe war erlaubt, mit Ausnahme von Warfarin und äquivalenten Vitamin-K-Antagonisten.
Die Patienten wurden im Verhältnis 1:1 randomisiert und einer der folgenden Behandlungsgruppen zugeteilt:
·CALQUENCE 100 mg zweimal täglich bis zu einem Fortschreiten der Krankheit oder bis zum Auftreten einer nicht vertretbaren Toxizität, oder
·nach Wahl des Prüfarztes:
·Idelalisib 150 mg zweimal täglich bis zu einem Fortschreiten der Krankheit oder bis zum Auftreten einer nicht vertretbaren Toxizität, in Kombination mit ≤8 Infusionen Rituximab (375 mg/m2/500 mg/m2) an Tag 1 jedes 28-tägigen Zyklus für bis zu 6 Zyklen
·Bendamustin 70 mg/m2 (Tag 1 und 2 jedes 28-tägigen Zyklus) in Kombination mit Rituximab (375 mg/m2/500 mg/m2) an Tag 1 jedes 28-tägigen Zyklus für bis zu 6 Zyklen
Die Patienten wurden gemäss Faktoren 17p-Deletions-Mutationsstatus (Ja/Nein), ECOG-Performance-Status (0 oder 1 versus 2) und Anzahl der Vorbehandlungen (1 bis 3 versus ≥4) stratifiziert. Nach bestätigtem Fortschreiten der Krankheit erhielten 35 Patienten, die zunächst nach Wahl des Prüfarztes entweder mit Idelalisib plus Rituximab oder mit Bendamustin plus Rituximab behandelt worden waren, im Rahmen eines Crossovers CALQUENCE.
Die Ausgangsmerkmale waren in den zwei Armen (CALQUENCE-Monotherapie [n=155] bzw. vom Prüfarzt gewählte Behandlung mit Idelalisib + Rituximab oder Bendamustin + Rituximab [n=155]) generell ausgewogen: medianes Alter 68 bzw. 67 Jahre; 69,7% bzw. 64,5% waren männlich; 87,7% bzw. 86,5% hatten einen ECOG-PS von 0-1; die mediane Zeit seit Diagnosestellung betrug 85,3 bzw. 79 Monate; die mediane Zeit zwischen der letzten vorherigen CLL-Therapie und der ersten Dosis betrug 26,4 bzw. 22,7 Monate; die zytogenetischen Faktoren (del17p, del11q, TP53-Mutation, nicht-mutiertes IGHV, komplexer Karyotyp) sowie das Rai-Stadium waren generell ausgewogen.
Primärer Endpunkt war das durch ein IRC beurteilte PFS auf Grundlage der IWCLL-Kriterien aus dem Jahr 2008 unter Berücksichtigung der Abklärung betreffend behandlungsbedingter Lymphozytose (Cheson 2012). Zum Zeitpunkt der ersten präspezifizierten Analyse mit einer medianen Nachbeobachtungsdauer von 16,1 Monaten zeigte CALQUENCE eine klinisch relevante und statistisch signifikante Verbesserung des IRC-beurteilten PFS im Vergleich zum IR/BR-Arm (Hazard Ratio 0,31 [95%-KI 0,20 bis 0,49] p<0,0001). Zum Zeitpunkt dieser Analyse war das mediane Gesamtüberleben mit insgesamt 33 Todesfällen noch in keinem Behandlungsarm erreicht worden: 15 (9,7%) im CALQUENCE-Monotherapie-Arm und 18 (11,6%) im Behandlungsarm mit der vom Prüfarzt gewählten Behandlung (Idelalisib plus Rituximab oder Bendamustin plus Rituximab).In einer weiteren nicht präspezifizierten Analyse nach einer medianen Nachbeobachtungsdauer von 22 Monaten wurde das mediane PFS, welches im Gegensatz zum primären Endpunkt vom Prüfarzt beurteilt wurde, im CALQUENCE-Arm nicht erreicht und betrug im IR/BR-Arm 16,8 Monate (Hazard Ratio 0,27 [95%-KI 0,18 bis 0,40]. Die Daten zum Gesamtüberleben waren weiterhin unreif mit 21 (13,5%) und 26 (16,8%) Ereignissen im CALQUENCE- respektive Vergleichsarm. Die Wirksamkeitsergebnisse der präspezifizierten Analyse sind in Tabelle 6 dargestellt.
Tabelle 6: Wirksamkeitsergebnisse bei Patienten mit CLL (ASCEND)
|
|
CALQUENCE
Monotherapie
n=155
|
Vom Prüfarzt gewählte Behandlung mit Idelalisib + Rituximab (n=119) oder Bendamustin + Rituximab (n=36)
n=155
| |
Progressionsfreies Überleben*
| |
Anzahl der Ereignisse (%)
|
27 (17,4)
|
68 (43,9)
| |
Median (95%-KI), Monate
|
n.e.
|
16.5 (14,0; 17,1)
| |
HR† (95%-KI)
|
0.31 (0,20; 0,49)
| |
Gesamtansprechrate*
| |
ORR, n (%)
(95%-KI)
|
126 (81,3)
(74,4; 86,6)
|
117 (75,5)
(68,1; 81,6)
| |
CR, n (%)
|
0
|
2 (1,3)
| |
Dauer des Ansprechens* (DoR)
| |
Median (95%-KI), Monate
|
n.e.
|
13,6 (11,9; n.e.)
|
KI=Konfidenzintervall; HR=Hazard Ratio; n.e.=nicht erreicht; CR=Vollremission (Complete Response); PR=Teilremission (Partial Response)
*Gemäss IRC-Beurteilung
†Basierend auf einem stratifizierten Cox-Proportional-Hazards-Modell
Die PFS-Ergebnisse für die Behandlung mit CALQUENCE fielen in den verschiedenen Untergruppen, darunter solche mit Hochrisiko-Merkmalen (17p-Deletion, 11q-Deletion, TP53-Mutation und nicht-mutiertes IGHV), vergleichbar aus.
Eine Richter-Transformation trat bei 4 Patienten (2,6%) im Acalabrutinib-Monotherapie-Arm und 3 Patienten (2,0%) im Idelalisib plus Rituximab- / Bendamustin plus Rituximab-Arm während der randomisierten Phase und bei 2 Patienten (5,7%) im Idelalisib plus Rituximab- / Bendamustin plus Rituximab-Arm während der Crossover-Phase auf.
Patienten mit bisher unbehandeltem MCL
Die Wirksamkeit von CALQUENCE bei Patienten mit bisher unbehandeltem MCL wurden in ECHO, einer randomisierten, doppelblinden, placebokontrollierten, multizentrischen Phase-III-Studie, untersucht. An ECHO nahmen 598 Patienten im Alter von 65 Jahren und älter mit bestätigtem, bisher unbehandeltem MCL teil. Patienten mit dem Behandlungsziel einer Tumorreduktion vor autologer Stammzelltransplantation waren aus der Studie ausgeschlossen. Die Randomisierung der Patienten erfolgte stratifiziert nach geographischer Region (Nordamerika versus Westeuropa versus Andere) und vereinfachtem MIPI (Mantle Cell Lymphoma International Prognostic Index)-Score (0–3 versus 4–5 versus 6–11). In die Studie wurden Patienten während der COVID-19-Pandemie aufgenommen.
Die Patienten wurden im Verhältnis 1:1 auf 2 Arme randomisiert und erhielten:
·CALQUENCE plus Bendamustin und Rituximab (CALQUENCE + BR)-Arm – CALQUENCE 100 mg wurde ab Tag 1 von Zyklus 1 zweimal täglich kontinuierlich verabreicht. Bendamustin, 90 mg/m2, wurde an den Tagen 1 und 2 jedes der sechs 28-tägigen Zyklen intravenös über 30 Minuten verabreicht und Rituximab, 375 mg/m2, wurde an Tag 1 jedes der sechs 28-tägigen Zyklen intravenös verabreicht. CALQUENCE + BR wurden für maximal 6 Behandlungszyklen verabreicht (Induktionsbehandlung).
·Placebo plus Bendamustin und Rituximab (Placebo + BR)-Arm – Placebo wurde ab Tag 1 von Zyklus 1 zweimal täglich kontinuierlich verabreicht. Bendamustin, 90 mg/m2, wurde an den Tagen 1 und 2 jedes der sechs 28-tägigen Zyklen intravenös über 30 Minuten verabreicht und Rituximab, 375 mg/m2, wurde an Tag 1 jedes der sechs 28-tägigen Zyklen intravenös verabreicht. Placebo + BR wurden für maximal 6 Behandlungszyklen verabreicht (Induktionsbehandlung).
CALQUENCE oder Placebo wurden kontinuierlich bis zu einem Fortschreiten der Krankheit oder bis zum Auftreten einer nicht akzeptablen Toxizität verabreicht. Nach der Induktionsbehandlung erhielten die Patienten im Placebo + BR-Arm, die ein Ansprechen (Teilremission oder Vollremission) erreicht hatten, eine Rituximab-Erhaltungsdosis von 375 mg/m2 an Tag 1 jedes zweiten Zyklus für maximal 12 zusätzliche Dosen bis Zyklus 30. Auf den Placebo + BR-Arm randomisierte Patienten, bei denen ein Fortschreiten der Krankheit bestätigt wurde, konnten im Rahmen eines Crossovers bis zu einem zweiten Fortschreiten der Krankheit oder dem zweiten Auftreten einer nicht vertretbaren Toxizität auf die CALQUENCE-Monotherapie mit einer Dosis von zweimal täglich 100 mg umgestellt werden.
Das mediane Alter betrug 71 Jahre (65–86); 70,7% waren männlich; 78,3% waren Weisse; 93,1% hatten einen ECOG-Performance-Status von 0–1. Der vereinfachte MIPI-Score war bei 33,1% der Patienten niedrig (0–3), bei 42,8% intermediär (4–5) und bei 24,1% hoch (6–11). Insgesamt 37,7% der Patienten hatten ein Tumorvolumen von ≥5 cm und 86% wiesen das Ann-Arbor-Stadium IV auf. Aggressive Varianten des MCL wie blastoide und pleomorphe Formen traten bei 7,7% bzw. 5,5% der Patienten auf. Insgesamt 47,8% der Patienten hatten einen Ki-67-Score von ≥30%. Die Ausgangsmerkmale waren in beiden Behandlungsarmen ähnlich.
Der primäre Endpunkt war das progressionsfreie Überleben (PFS), das von einem unabhängigen Gremium (IRC, Independent Review Committee) gemäss der Lugano-Klassifikation für NHL bei Patienten mit bisher unbehandeltem MCL beurteilt wurde. Weitere multiplizitätskontrollierte Wirksamkeitsendpunkte waren die vom IRC beurteilte Gesamtansprechrate (ORR) und das Gesamtüberleben (OS). Das Studiendesign ohne eine 2. Randomisierung für die Post-Induktionstherapie lässt keine Aussage über den Vorteil der Dauertherapie mit Calquence bis zum Fortschreiten der Erkrankung oder inakzeptabler Toxizität zu.
Bei einer medianen Nachbeobachtungsdauer von 46,1 Monaten im CALQUENCE + BR-Arm und 44,4 Monaten im Placebo + BR-Arm ergab die Beurteilung des PFS durch das IRC eine statistisch signifikante Reduktion des Risikos für ein Fortschreiten der Krankheit oder den Tod bei den mit CALQUENCE + BR behandelten Patienten um 27% im Vergleich zu Placebo + BR. Es fielen allerdings Inkonsistenzen in gewissen Subgruppen auf, diese zeigten sich sowohl für das PFS als auch für das OS. Besonders erwähnenswert ist die Inkonsistenz in Bezug auf das Geschlecht. Die HR für PFS bei den 423 untersuchten Männern betrug 0.91 (0.68, 1.21) im Vergleich zu 0.34 (0.19,0.58) bei den 175 Frauen, die entsprechende HR für OS war 1.01 (0.74, 1.38) für die Männer und 0.52 (0.28, 0.94) für die Frauen.Die vom IRC beurteilte ORR zeigte keinen statistisch signifikanten Unterschied Calquence plus BR und Placebo plus BR.
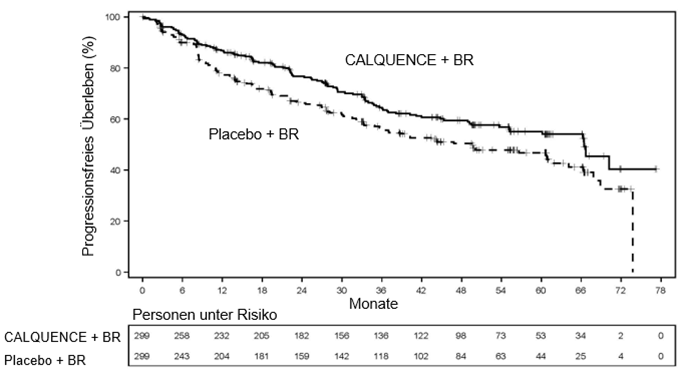
Zum Zeitpunkt der PFS-Analyse war das mediane OS bei insgesamt 203 Todesfällen in keinem der beiden Arme erreicht worden: 97 (32,4%) im CALQUENCE + BR-Arm, 106 (35,5%) im Placebo + BR-Arm, und das OS zeigte keinen statistisch signifikanten Unterschied zwischen den Behandlungsarmen: HR (95%-KI) (stratifiziert) 0.86 (0.65, 1.13). Die Wirksamkeitsergebnisse sind in Tabelle 7 aufgeführt. Die Kaplan-Meier-Kurven des PFS sind in Abbildung 1 dargestellt.
Tabelle 7: Wirksamkeitsergebnisse bei Patienten mit bisher unbehandeltem MCL in ECHO
|
|
CALQUENCE + BR
N = 299
|
Placebo + BR
N = 299
| |
Vom IRC beurteiltes PFS
| |
Median (95%-KI)
|
66,4 (55,1; n.a.)
|
49,6 (36,0; 64,1)
| |
HR (95%-KI) (stratifiziert)*
|
0,73 (0,57; 0,94)
| |
p-Wert‡
|
0,0160
| |
Vom IRC beurteiltes ORR
| |
CR + PR n (%)
|
272 (91,0)
|
263 (88,0)
| |
95%-KI
|
87,3; 93,8
|
83,9; 91,3
| |
CR n (%)
|
199 (66,6)
|
160 (53,5)
| |
PR n (%)
|
73 (24,4)
|
103 (34,4)
| |
ORR-Differenz (vs. PBR-Arm)
|
3,0%
|
-
| |
p-Wert
|
0,2196
|
-
|
HR = Hazard Ratio, CR = Vollremission (Complete Response), PR = Teilremission (Partial Response), n.a. – nicht auswertbar
* Stratifiziert nach Randomisierungsstratifizierungsfaktoren: Geographische Regionen (Nordamerika, Westeuropa, Andere) und vereinfachter MIPI-Score (niedriges Risiko [0 bis 3], intermediäres Risiko [4 bis 5], hohes Risiko [6 bis 11]), wie über IXRS erhoben. Geschätzt auf der Grundlage eines stratifizierten Cox-Proportional-Hazards-Modells für die Hazard Ratio (95%-KI).
‡ Geschätzt auf der Grundlage eines stratifizierten Log-Rank-Tests für den p-Wert
Abbildung 1. Kaplan-Meier-Kurve des PFS gemäss Beurteilung durch das IRC bei Patienten mit bisher unbehandeltem MCL (ECHO)
Patienten mit MCL, die mindestens eine Vortherapie erhalten haben
Die Sicherheit und Wirksamkeit von CALQUENCE bei MCL wurden in einer offenen, multizentrischen, einarmigen Phase-II-Studie (ACE-LY-004) untersucht, an der 124 vorbehandelte Patienten teilnahmen, bei denen mit vorheriger Therapie kein partielles Ansprechen erreicht wurde oder die nach der vorherigen Therapie eine Progression gezeigt hatten. Alle Patienten erhielten CALQUENCE 100 mg zweimal täglich oral bis zu einem Fortschreiten der Erkrankung oder bis zum Auftreten einer nicht vertretbaren Toxizität. An der Studie nahmen keine Patienten teil, die zuvor mit BTK-Inhibitoren, anderen Inhibitoren des B-Zell-Rezeptor-Signalwegs (Phosphoinositid-3 Kinase [PI3K] oder SYK) oder einem BCL-2 Inhibitor behandelt worden waren. Der primäre Endpunkt war die vom Prüfarzt beurteilte Gesamtansprechrate (ORR) gemäss der Lugano-Klassifikation für Non-Hodgkin-Lymphome (NHL). Die Dauer des Ansprechens (DoR) war ein zusätzliches Ergebnismass. Die Wirksamkeitsergebnisse der primären (12 Monate) und der finalen (54 Monate) Analyse sind in Tabelle 8 dargestellt.
Bei der primären Analyse betrug das mediane Alter 68 (Bereich 42 bis 90) Jahre, 79,8% waren männlich und 74,2% waren Weisse. Zu Studienbeginn hatten 92,8% der Patienten einen ECOG-Performance-Status von 0 oder 1. Die mediane Zeit seit Diagnosestellung betrug 46,3 Monate und die mediane Anzahl der Vorbehandlungen lag bei 2 (Bereich 1 bis 5), darunter 17,7% mit vorangegangener Stammzelltransplantation. Die häufigsten vorherigen Therapieschemata waren CHOP-basiert (51,6%) und ARA-C (33,9%). Zu Studienbeginn hatten 37,1% der Patienten mindestens einen Tumor mit einem längsten Durchmesser von ≥5 cm; 72,6% wiesen einen zusätzlichen Knotenbefall auf, davon 50,8% einen Knochenmarkbefall. Der vereinfachte MIPI-Score (der das Alter, den ECOG-Score sowie den Ausgangswert für die Laktatdehydrogenase und die Leukozytenzahl berücksichtigt) war bei 43,5% der Patienten intermediär und bei 16,9% hoch.
Tabelle 8. Gesamtansprechrate und Dauer des Ansprechens bei (ACE-LY-004) Patienten mit MCL bei der 12- und der 54-Monats-Analyse
|
|
Beurteilung des Prüfarztes nach 12 Monaten
n = 124
n (%) (95%-KI*)
|
Beurteilung des Prüfarztes nach 54 Monaten
n = 124
n (%) (95%-KI*)
| |
Gesamtansprechrate (ORR)
| |
Gesamtansprechrate
|
100 (80,6%) (72,6; 87,2)
|
101 (81,5%) (73,5; 87,9)
| |
Vollremission
|
49 (39,5%) (30,9; 48,7)
|
59 (47,6%) (38,5; 56,7)
| |
Teilremission
|
51 (41,1%) (32,4; 50,3)
|
42 (33,9%) (25,6; 42,9)
| |
Stabile Erkrankung
|
11 (8,9%) (4,5; 15,3)
|
10 (8,1%) (3,9; 14,3)
| |
Krankheitsprogression
|
10 (8,1%) (3,9; 14,3)
|
10 (8,1%) (3,9; 14,3)
| |
Nicht auswertbar†
|
3 (2,4%) (0,5; 6,9)
|
3 (2,4%) (0,5; 6,9)
| |
Dauer des Ansprechens (DoR)
| |
Median (Monate)
|
n. e. (13,5; n.e.)
|
28,6 (17,5; 39,1)
| |
KI = Konfidenzintervall; n. e. = nicht erreicht
*Exaktes binominales Konfidenzintervall von 95%.
†Umfasst Probanden ohne hinreichende Krankheitsbeurteilung nach Studienbeginn.
|
|

