Eigenschaften/WirkungenATC-Code
B03XA08; Antianämika; andere Antianämika.
Wirkungsmechanismus
Vadadustat stabilisiert den Hypoxie-induzierten Faktor (HIF) durch Inhibition von an der Degradation des Transkriptionsfaktors beteiligten Prolylhydroxylasen (PH1, PH2, PH3). Die darauffolgende intrazelluläre Akkumulation von HIF-α und seine nukleären Translokation bewirken letztlich eine Erhöhung der Transkription HIF-regulierter Gene. Unter anderem wird die endogene Erythropoetin (EPO)-Produktion angeregt und die Mobilisierung von Eisen sowie die Bildung von Erythrozyten erhöht, was zu einem allmählichen Anstieg des Hb-Werts führt (siehe Abbildungen 1 und 2).
Pharmakodynamik
Nach einmaliger Gabe einer Dosis Vadadustat (80 mg bis 1’200 mg) an gesunde männliche Probanden wurde ein dosisabhängiger EPO-Anstieg beobachtet.
Kardiale Elektrophysiologie
Vadadustat führte nach Gabe einer Dosis von 600 mg und 1’200 mg nicht zu einer klinisch relevanten Verlängerung der QTc-Zeit.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Vadadustat bei einmal täglicher Anwendung zur Behandlung von Anämie bei erwachsenen Patienten mit CKD wurde im Vergleich zu Darbepoetin alfa in globalen, multizentrischen, randomisierten, aktiv kontrollierten, unverblindeten Nichtunterlegenheitsstudien mit 3’923 dialysepflichtigen und 3’476 nicht-dialysepflichtigen Patienten nachgewiesen.
Patienten mit der Diagnose NDD-CKD und einer eGFR > 60 ml/min/1,73 m2 auf der Grundlage der Kreatinin-Gleichung der Chronic Kidney Disease Epidemiology Collaboration von 2009 beim Screening waren von den pivotalen Studien ausgeschlossen.
Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten entweder Vadadustat mit einer Anfangsdosis von 300 mg einmal täglich oder Darbepoetin alfa, das subkutan oder intravenös gemäss den Verschreibungsinformationen über 52 Wochen verabreicht wurde, um die Wirksamkeitsendpunkte zu bewerten. Um den Hb-Zielwert der Patienten zu erreichen, wurde Vadadustat in 150mg-Schritten bis zu einer Höchstdosis von 600 mg titriert. Zur Langzeituntersuchung der Sicherheit wendeten die Patienten die Studienbehandlung nach den 52 Wochen bis zum Erreichen der ereignisbasierten Endpunkte für MACE weiter an. Der primäre Wirksamkeitsendpunkt war in jeder der Studien die Differenz der mittleren Hb-Veränderungen zwischen Baseline und der primären Auswertungsphase (Woche 24 bis 36). Der wichtige sekundäre Wirksamkeitsendpunkt war die Differenz der mittleren Hb-Veränderungen zwischen Baseline und der sekundären Auswertungsphase (Woche 40 bis 52). Der primäre Sicherheitsendpunkt war die Zeit bis zum ersten MACE. MACE war definiert als Mortalität jeglicher Ursache, nicht-letaler MI oder nicht-letaler Schlaganfall.
Anämietherapie bei dialysepflichtigen Patienten
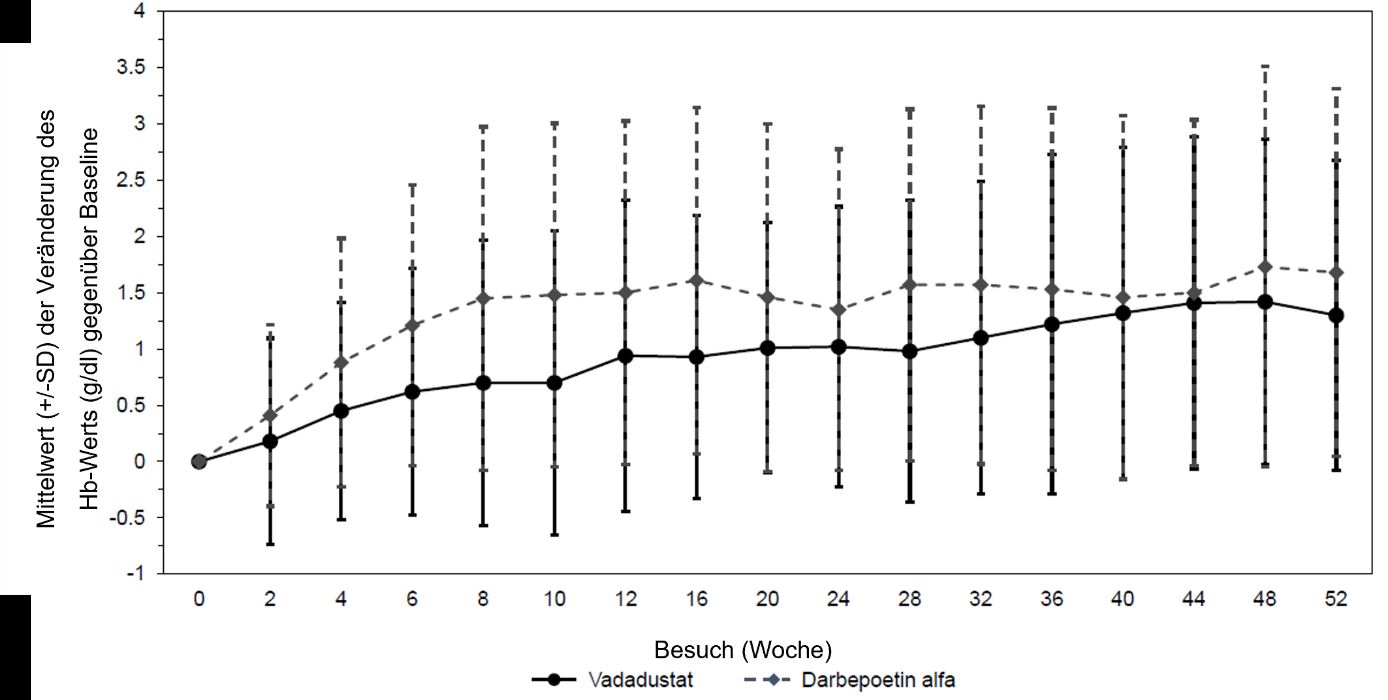
Es wurden zwei Studien (INNO2VATE 1 und INNO2VATE 2) mit erwachsenen dialysepflichtigen Patienten mit chronischer Nierenerkrankung mit Hb-Ausgangswerten von 8,0 bis 11,0 g/dl in den USA und 9,0 bis 12,0 g/dl ausserhalb der USA durchgeführt. An INNO2VATE 1 nahmen Patienten mit inzidenter dialysepflichtiger chronischer Nierenerkrankung teil, die innerhalb von 16 Wochen nach Beginn ihrer Studienteilnahme eine Dialysebehandlung aufnahmen und nicht mit ESA vorbehandelt waren, ESA zuvor nur in begrenztem Masse angewendet hatten oder ESA zur Erhaltungstherapie anwendeten. An INNO2VATE 2 nahmen Patienten teil, die seit mehr als 12 Wochen eine stabile Dialyse erhielten und von einer vorherigen ESA-Therapie auf Vadadustat umgestellt worden waren. In beiden Studien war Vadadustat Darbepoetin alfa im Hinblick auf die Korrektur und Aufrechterhaltung bzw. Aufrechterhaltung der Hb-Spiegel innerhalb regional spezifischer Hb-Zielbereiche (10,0 bis 11,0 g/dl in den USA und 10,0 bis 12,0 g/dl in Europa und dem Rest der Welt) in den Wochen 24 bis 36 und den Wochen 40 bis 52 bei erwachsenen dialysepflichtigen Patienten mit chronischer Nierenerkrankung und Anämie nicht unterlegen. Die Ergebnisse hinsichtlich der primären und sekundären Wirksamkeitsendpunkte sind in Tabelle 6 aufgeführt. Die Entwicklung des Hb-Werts während der Behandlung in einzelnen Studien ist in Abbildung 1 und Abbildung 2 gezeigt. Eine Untersuchung verschiedener Subgruppen, die nach Alter, Geschlecht, ethnischer Abstammung und Region gebildet wurden, ergab in diesen Subgruppen keine Unterschiede beim Ansprechen auf Vadadustat.
Tabelle 6 INNO2VATE-STUDIEN
|
|
INNO2VATE 1
|
INNO2VATE 2
| |
Hb (g/dl)
|
Vadadustat
N = 181
|
Darbepoetin alfa
N = 188
|
Vadadustat
N = 1’777
|
Darbepoetin alfa
N = 1’777
| |
Mittelwert bei Baseline (SD)
|
9,37 (1,07)
|
9,19 (1,14)
|
10,25 (0,85)
|
10,23 (0,83)
| |
Primärer Endpunkt: Mittelwert in Wochen 24 bis 36 (SD)
|
10,36 (1,13)
|
10,61 (0,94)
|
10,36 (1,01)
|
10,53 (0,96)
| |
Adjustierte mittlere Veränderung gegenüber Baseline (LSM) [95%-KI]
|
1,26 [1,05; 1,48]
|
1,58 [1,37; 1,79]
|
0,19 [0,12; 0,25]
|
0,36 [0,29; 0,42]
| |
Geschätzte Differenz zwischen den Therapien [95%-KI] Vadadustat – Darbepoetin alfa
|
-0,31 [-0,53; -0,10]
|
-0,17 [-0,23; -0,10]
| |
Wichtiger sekundärer Endpunkt: Mittelwert in Wochen 40 bis 52 (SD)
|
10,51 (1,19)
|
10,55 (1,14)
|
10,40 (1,04)
|
10,58 (0,98)
| |
Adjustierte mittlere Veränderung gegenüber Baseline (LSM) [95%-KI]
|
1,42 [1,17; 1,68]
|
1,50 [1,23; 1,76]
|
0,23 [0,16; 0,29]
|
0,41 [0,34; 0,48]
| |
Geschätzte Differenz zwischen den Therapien [95%-KI] Vadadustat – Darbepoetin alfa
|
-0,07 [-0,34; 0,19]
|
-0,18 [-0,25; -0,12]
| |
KI: Konfidenzintervall; LSM: Least Squares Mean, Mittelwert nach der Methode der kleinsten Quadrate; SD: Standardabweichung
|
Abbildung 1: Mittelwert (+/-SD) der Veränderung des Hb-Werts (g/dl) gegenüber Baseline in Studie INNO2VATE 1 bei gelegentlicher Dialyse

Abbildung 2: Mittelwert (+/-SD) der Veränderung des Hb-Werts (g/dl) gegenüber Baseline in Studie INNO2VATE 2 bei vorherrschender Dialyse
|


