ZusammensetzungWirkstoffe
Botulinumtoxin Typ A*.
* aus Clostridium botulinum (Stamm CBFC26).
Hilfsstoffe
Albumin vom Menschen, Natriumchlorid.
Eine Durchstechflasche enthält 0,18 mg Natrium.
Indikationen/AnwendungsmöglichkeitenLetybo wird angewendet zur vorübergehenden Verbesserung des Erscheinungsbildes mittelstarker bis starker vertikaler Falten zwischen den Augenbrauen bei Erwachsenen <75 Jahren, die bei maximalem Stirnrunzeln auftreten (Glabellafalten), wenn das Ausmass der Gesichtsfalten eine erhebliche psychologische Belastung darstellt.
Dosierung/AnwendungLetybo ist nur von Ärzten mit entsprechender Qualifikation und Erfahrung mit dieser Behandlung unter Verwendung der erforderlichen Hilfsmittel zu verabreichen.
Übliche Dosierung
Die empfohlene Dosis beträgt insgesamt 20 Einheiten, aufgeteilt auf 5 Injektionen von je 4 Einheiten (0,1 ml): 2 Injektionen in jeden M. corrugator supercilii und 1 Injektion in den M. procerus.
Botulinumtoxin-Einheiten verschiedener Arzneimittel sind untereinander nicht austauschbar.
Die empfohlenen Dosen unterscheiden sich von denen anderer Botulinumtoxin-Präparate.
Die Behandlungen sollten nicht häufiger als alle drei Monate stattfinden.
Wenn nach einer Behandlungssitzung keine Nebenwirkungen auftreten, kann die Behandlung nach frühestens drei Monaten wiederholt werden.
Falls die Behandlung einen Monat nach einer vorherigen Behandlungssitzung keinen Erfolg zeigt, d. h. keine wesentliche Verbesserung gegenüber der Anfangssituation festzustellen ist, können die folgenden Möglichkeiten in Betracht gezogen werden:
-Analyse der Ursachen für das Scheitern der Behandlung, z. B. Injektion in die falschen Muskeln, falsche Injektionstechnik, Bildung von Toxin-neutralisierenden Antikörpern, Unterdosierung.
-Neubewertung der Relevanz einer Behandlung mit Botulinumtoxin Typ A.
Die Wirksamkeit und Sicherheit von wiederholten Injektionen von Letybo über 12 Monate hinaus wurden nicht untersucht.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Ältere Patienten
Es liegen keine klinischen Daten zur Anwendung von Letybo bei Personen über 75 Jahren vor. Die Anwendung von Letybo bei Personen über 75 Jahren wird nicht empfohlen. Für die Anwendung bei älteren Personen über 65 Jahren ist keine spezielle Dosisanpassung erforderlich (siehe «Eigenschaften/Wirkungen»).
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Letybo bei Kindern und Jugendlichen. Die Sicherheit und Wirksamkeit von Letybo bei Personen unter 18 Jahren wurde daher nicht untersucht. Die Anwendung von Letybo bei Personen unter 18 Jahren wird nicht empfohlen.
Art der Anwendung
Intramuskuläre Anwendung.
Letybo darf nach Rekonstitution nur für eine Injektionssitzung pro Patient angewendet werden.
Hinweise zur Verdünnung, Anwendung, Handhabung und Entsorgung der Durchstechflaschen mit dem Arzneimittel siehe «Sonstige Hinweise».
Intramuskuläre Injektionen sind mit einer sterilen Insulin- oder Tuberkulinspritze mit einem Volumen von 1 ml und einer Graduierung von 0,01 ml sowie einer Nadel mit einem Gaugebereich von 30 bis 31 G durchzuführen.
In die sterile Spritze ist ein Volumen von 0,5 ml der ordnungsgemäss rekonstituierten Letybo-Lösung aufzuziehen. Alle Luftblasen im Spritzenzylinder sind zu entfernen. Die zur Rekonstitution des Arzneimittels verwendete Nadel ist vor der Injektion zu wechseln.
Es ist darauf zu achten, dass Letybo nicht in ein Blutgefäss injiziert wird.
Um die Komplikation einer Blepharoptose zu reduzieren, müssen Injektionen in der Nähe des M. levator palpebrae superioris vermieden werden, insbesondere bei Patienten mit grossen Brauendepressor-Komplexen. Bei der Injektion in zwei Stellen jedes M. corrugator supercilii hat die erste Injektion direkt über dem medialen Rand der Augenbrauen zu erfolgen. Die zweite Injektion erfolgt ungefähr 1 cm über dem Supraorbitalkamm (starre knöcherne Begrenzungen, die über dem oberen Teil des oberen Augenlids tastbar sind), wo sich die Mittellinien der Augenbrauen treffen. Die Injektionsstelle im M. procerus befindet sich direkt über der Mittellinie des Nasenrückens, wo zwischen den medialen Enden der Augenbrauen horizontale Falten entstehen. Bei Injektionen in das mediale Ende des M. corrugator supercilii und in die Mittellinie der Augenbrauen sollten die Injektionsstellen mindestens 1 cm vom Supraorbitalkamm (starre knöcherne Begrenzungen, die über dem oberen Teil des oberen Augenlids tastbar sind) entfernt sein.

Injektionen müssen mit Vorsicht vorgenommen werden, um eine intravaskuläre Injektion zu vermeiden. Vor der Injektion kann mit dem Daumen oder Zeigefinger fest unter den Augenhöhlenrand gedrückt werden, um ein Auslaufen des Arzneimittels in diesen Bereich zu verhindern. Die Nadel nach oben und nach medial ausrichten.
KontraindikationenLetybo darf nicht angewendet werden bei:
-Überempfindlichkeit gegen den Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
-Generalisierte Muskelaktivitätsstörungen (z. B. Myasthenia gravis, Lambert-Eaton-Syndrom, amyotrophe Lateralsklerose).
-Vorliegen einer akuten Infektion oder Entzündung an den geplanten Injektionsstellen.
Warnhinweise und VorsichtsmassnahmenAllgemeines
Vor der Gabe von Letybo müssen die Anatomie der Muskeln und der umgebenden Gefäss- und Nervenstrukturen in der Glabellaregion sowie alle Veränderungen der Anatomie aufgrund früherer operativer Eingriffe festgestellt werden. Eine Injektion in empfindliche anatomische Strukturen ist zu vermeiden.
Bei der Anwendung von Letybo ist Vorsicht geboten, wenn im Zielmuskel eine übermässige Schwäche oder Atrophie vorliegt.
Nach der Behandlung besteht das Risiko einer Augenlidptosis. Zur Minimierung dieses Risikos sind die Anwendungshinweise in der Rubrik «Dosierung/Anwendung» zu beachten.
Die Anwendung von Letybo wird nicht empfohlen bei Personen, die unter 18 Jahren bzw. über 75 Jahre alt sind.
Verfahrensbedingte Ereignisse
Nadelbedingte Schmerzen und/oder Angstzustände führten nach der Behandlung mit anderen Botulinumtoxinen zu vasovagalen Reaktionen, einschliesslich einer vorübergehenden symptomatischen Hypotonie und Synkope.
Vorbestehende neuromuskuläre Erkrankungen
Bei Patienten mit unerkannten neuromuskulären Erkrankungen besteht bei typisch therapeutischen Dosen von Botulinumtoxin Typ A möglicherweise ein erhöhtes Risiko für klinisch signifikante systemische Wirkungen einschliesslich einer schweren Dysphagie und Atemwegsbeeinträchtigung.
Überempfindlichkeitsreaktionen
Nach Injektion von Botulinumtoxin kann in sehr seltenen Fällen eine anaphylaktische Reaktion auftreten. Daher müssen Epinephrin (Adrenalin) oder andere Massnahmen zur Behandlung einer Anaphylaxie verfügbar sein.
Lokale oder entfernte Ausbreitung der Toxinwirkung
In sehr seltenen Fällen wurden bei Anwendung von Botulinumtoxin Nebenwirkungen gemeldet, die möglicherweise im Zusammenhang mit der Ausbreitung des Toxins an von der Injektionsstelle entfernten Stellen stehen (siehe «Unerwünschte Wirkungen»). Bei Patienten, die mit therapeutischen Dosen behandelt werden, kann eine verstärkte Muskelschwäche auftreten.
Schluck- und Atembeschwerden sind schwerwiegend und können zum Tod führen. Die Injektion von Letybo wird bei Patienten mit Dysphagie und Aspiration in der Vorgeschichte nicht empfohlen.
Den Patienten ist anzuraten, sich bei Schluckbeschwerden, Sprachstörung oder Atembeschwerden sofort an einen Arzt zu wenden.
Bildung von Antikörpern
Eine zu häufige oder übermässige Dosierung kann das Risiko einer Antikörperbildung erhöhen. Die Bildung von Antikörpern kann auch bei anderen Indikationen zu einem Therapieversagen von Botulinumtoxin Typ A führen.
Blutungsstörungen
Bei der Anwendung von Letybo bei Patienten mit Blutungsstörungen ist Vorsicht geboten, da die Injektion zu Blutergüssen führen kann.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. es ist nahezu „natriumfrei“.
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. In dieser Indikation wurden keine anderen Wechselwirkungen von klinischer Bedeutung berichtet.
Theoretisch kann die Wirkung von Botulinumtoxin durch Aminoglykosid-Antibiotika, Spectinomycin oder andere Arzneimittel, die die neuromuskuläre Reizleitung beeinflussen (z. B. neuromuskulär blockierende Arzneimittel), verstärkt werden.
Die Auswirkung der Verabreichung verschiedener Botulinum-Neurotoxin-Serotypen gleichzeitig oder innerhalb von mehreren Monaten ist nicht bekannt. Eine übermässige neuromuskuläre Schwäche kann durch die Gabe eines anderen Botulinumtoxins vor dem Abklingen der Wirkung eines zuvor verabreichten Botulinumtoxins verstärkt werden.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine adäquaten Erfahrungen mit der Anwendung von Botulinumtoxin Typ A bei Schwangeren vor. Tierexperimentelle Studien haben bei hohen Dosen eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Das potenzielle Risiko für den Menschen ist nicht bekannt. Die Anwendung von Letybo während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.
Stillzeit
Es ist nicht bekannt, ob Botulinumtoxin Typ A in die Muttermilch übergeht. Letybo sollte während der Stillzeit nicht angewendet werden.
Fertilität
Es liegen keine klinischen Daten zu den Auswirkungen der Anwendung von Botulinumtoxin Typ A auf die Fertilität vor. Tierexperimentelle Studien mit Botulinumtoxin Typ A haben eine Verringerung der Fertilität gezeigt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Botulinumtoxin Typ A wurde jedoch mit Asthenie, Muskelschwäche, Schwindelgefühl und Sehstörungen in Verbindung gebracht, die die Fahrtüchtigkeit und die Fähigkeit, Maschinen zu bedienen, beeinträchtigen können.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheit von Letybo wurde in drei pivotalen klinischen Phase-III-Studien untersucht, die jeweils einen placebokontrollierten Teil (Zyklus 1) und einen langfristigen Verlängerungsteil (Zyklen 2-4) über einen Zeitraum von bis zu einem Jahr umfassten und an denen 1'162 Patienten teilnahmen, die Letybo erhielten. Darüber hinaus liegen unterstützende Daten aus einer in Korea durchgeführten Phase-III-Studie mit Glabellafalten sowie Post-Marketing-Daten vor.
Nebenwirkungen können mit der Studienmedikation (Letybo), dem Injektionsverfahren oder beidem zusammenhängen. Im Allgemeinen treten Nebenwirkungen innerhalb der ersten Tage nach der Injektion auf und sind vorübergehend. Die meisten gemeldeten unerwünschten Ereignisse waren leicht bis mittelschwer. Die häufigsten (bei mindestens zwei mit Letybo in Zyklus 1 behandelten Patienten berichtet) Nebenwirkungen in den drei pivotalen Studien zu Letybo bei Glabellafalten waren Kopfschmerzen (1,7 % der Patienten), Schmerzen an der Injektionsstelle (0,3 % der Patienten) sowie Augenlidptosis, Blepharospasmus, Kopfbeschwerden und Kontusion (jeweils 0,2 % der Patienten).
Die Injektion wurde mit lokalen Schmerzen, Entzündung, Parästhesie, Hypoästhesie, Druckschmerz, Schwellung/Ödem, Erythem, lokalisierter Infektion, Blutung und/oder Blutergüsse in Verbindung gebracht. Ferner wurde nach Injektionen von Botulinumtoxin über Fieber und Grippesyndrom berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: „sehr häufig“ (≥1/10), „häufig“ (≥1/100, <1/10), „gelegentlich“ (≥1/1‘000, <1/100), „selten“ (≥1/10‘000, <1/1‘000), „sehr selten“ (<1/10‘000).
Tabelle 1: In klinischen Studien und Studien nach der Markteinführung berichtete Nebenwirkungen nach Verabreichung von Letybo
|
Systemorganklasse
|
Häufigkeit
|
Nebenwirkung
| |
Infektionen und parasitäre Erkrankungen
|
gelegentlich
|
Nasopharyngitis
| |
|
selten
|
oraler Herpes, Follikulitis*
| |
Erkrankungen des Blutes
und des Lymphsystems
|
selten
|
Kalium im Blut erhöht
| |
Erkrankungen des Nervensystems
|
häufig
|
Kopfschmerzen
| |
gelegentlich
|
Kopfbeschwerden*
| |
selten
|
Migräne, Schwindelgefühl, Parästhesie, Gesichtsfelddefekt, Dysarthrie
| |
Augenerkrankungen
|
gelegentlich
|
Augenlidptosis, Blepharospasmus, Periorbitalödem
| |
selten
|
Bindehautblutung*, trockenes Auge, verschwommenes Sehen, Augenschmerzen*, Sensibilitätsstörung des Augenlids**
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
selten
|
Hypästhesie im Pharynxbereich
| |
Erkrankungen des Gastrointestinaltrakts
|
selten
|
Obstipation, Übelkeit
| |
Erkrankungen der Haut und des Unterhautgewebes
|
selten
|
Ptose der Augenbraue, trockene Haut, Urtikaria
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
gelegentlich
|
Mephisto-Zeichen (laterale Hebung der Augenbrauen)
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
häufig
|
Reaktion an der Injektionsstelle
| |
gelegentlich
|
Schmerzen an der Injektionsstelle, Bluterguss an der Injektionsstelle, Schwellung an der Verabreichungsstelle*, Jucken an der Injektionsstelle, Raumforderung an der Injektionsstelle, Druck an der Injektionsstelle**
| |
|
selten
|
Gesichtsschmerzen*, grippeähnliche Erkrankung, Fieber
| |
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
|
gelegentlich
|
Kontusion, periorbitales Hämatom*
|
Anmerkung: Von den 1’162 mit Letybo behandelten Patienten traten nur bei 1 Patienten seltene Ereignisse auf.
Es wurde ein „Worst-Case-Ansatz“ verwendet, um Ereignissen in klinischen Studien und Post-Marketing-Studien Häufigkeiten zuzuordnen.
* Nebenwirkung durch das Injektionsverfahren. Es ist zu beachten, dass diese Information in der koreanische Post-Marketing-Studie nicht erhoben wurde.
** Nur in der Post Marketing-Studie
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Applikationsbezogene Nebenwirkungen
Applikationsbezogene Nebenwirkungen, die nach der Verabreichung von Letybo berichtet wurden, sind einzeln betrachtet gelegentlich, in der Summe jedoch häufig. Gelegentliche Reaktionen an der Injektionsstelle sind Schmerzen, Blutergüsse, Schwellung, Pruritus, Raumforderung und Druck. Selten auftretende Ereignisse an der Injektionsstelle sind Schmerzen und Beschwerden.
Risiko der Ausbreitung des Toxins entfernt vom Verabreichungsort
Nebenwirkungen, die möglicherweise im Zusammenhang mit der Ausbreitung des Toxins an vom Injektionsort entfernten Stellen stehen (z. B. Muskelschwäche, Dysphagie, Obstipation oder Aspirationspneumonie, die tödlich sein kann), wurden mit Botulinumtoxin sehr selten berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Eine Überdosierung von Letybo hängt von der Dosis, der Injektionsstelle und zugrundeliegenden Gewebeeigenschaften ab.
Es wurden keine Fälle einer systemischen Toxizität aufgrund einer versehentlichen Injektion von Botulinumtoxin Typ A beobachtet. Exzessive Dosen können lokale oder entfernte, generalisierte und ausgeprägte neuromuskuläre Lähmungen erzeugen. Es wurden keine Fälle einer oralen Aufnahme von Botulinumtoxin Typ A bekannt.
Symptome einer Überdosierung treten möglicherweise nicht sofort nach der Injektion auf.
Behandlung
Bei versehentlicher Injektion oder oraler Aufnahme ist der Patient medizinisch auf Anzeichen und Symptome einer allgemeinen Schwäche oder Muskellähmung zu überwachen. Bei Patienten mit Symptomen einer Vergiftung mit Botulinumtoxin Typ A (generalisierte Schwäche, Ptose, Doppeltsehen, Schluck- und Sprechstörungen oder Parese der Atemmuskulatur) ist eine stationäre Aufnahme in Betracht zu ziehen.
Eigenschaften/WirkungenATC-Code
M03AX01
Wirkungsmechanismus / Pharmakodynamik
Clostridium botulinum Neurotoxin Typ A blockiert die periphere Freisetzung des Neurotransmitters Acetylcholin an präsynaptischen cholinergen Nervenenden neuromuskulärer Verbindungen durch Spaltung von SNAP 25, einem Protein, das für das erfolgreiche Andocken und die Freisetzung von Acetylcholin aus Bläschen in den Nervenendigungen von Bedeutung ist, was zur Denervierung des Muskels und einer schlaffen Lähmung führt.
Nach der Injektion kommt es zunächst zu einer schnellen Bindung des Toxins mit hoher Affinität an spezifische Rezeptoren an der Zelloberfläche. Daraufhin wird das Toxin durch rezeptorvermittelte Endozytose durch die Plasmamembran geschleust. Schliesslich wird das Toxin unter fortschreitender Hemmung der Acetylcholinfreisetzung ins Zytosol freigesetzt. Klinische Symptome treten innerhalb von 2 bis 3 Tagen auf, wobei die maximale Wirkung innerhalb von 4 Wochen nach der Injektion festzustellen ist. Ein Abflauen der Wirkung tritt normalerweise innerhalb von 3 bis 4 Monaten nach der Injektion auf, wenn die Nervenenden erneut aussprossen und sich wieder mit der Endplatte verbinden.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Letybo wurden in 3 pivotalen, doppelblinden Phase-III-Studien (BLESS I, BLESS II und BLESS III) untersucht, in denen insgesamt 955 Patienten eine Behandlung mit Letybo und 317 Patienten eine Behandlung mit einem Placebo erhielten. Darüber hinaus liegen Daten von 854 Patienten vor, die im Rahmen einer nicht verblindeten Verlängerungsphase der Studien BLESS I und II weitere 1 bis 3 Behandlungen mit Letybo erhielten. Unterstützende Daten zu Glabellafalten stammen aus dem klinischen Entwicklungsprogramm in Korea, das eine Phase-III-Studie (HG-11-01) bei 137 Patienten und eine Post-Marketing-Studie (HG-13-02) bei 815 Patienten umfasste.
In den Studien BLESS I, BLESS II und BLESS III hatten alle Patienten bei maximalem Stirnrunzeln zu Studienbeginn mittelstarke (27 % der Patienten) oder starke (73 % der Patienten) Glabellafalten. Letybo reduzierte in einer Dosis von 20 Einheiten signifikant die Stärke der Glabellafalten bei maximalem Stirnrunzeln, gemessen anhand der Beurteilung der Stärke der Glabellafalten durch den Prüfarzt und den Patienten auf einer 4-Punkte-Skala zur Beurteilung von Gesichtsfalten (Facial Wrinkle Scale, FWS). Bei Anlegen eines Endpunkts, der eine Verbesserung auf der FWS um 2 Punkte erforderte, wurden statistisch signifikante Ansprechraten zugunsten von Letybo festgestellt. Hohe Ansprechraten zugunsten von Letybo wurden auch bei Anwendung der Definition eines klinisch bedeutsamen Ansprechens (Erreichen eines Scores von 0 oder 1 auf der FWS bzw. keine oder leichte Linien) nach Einstufung durch den Prüfarzt in Woche 4 beobachtet (siehe Tabelle 2).
Tabelle 2: Ansprechraten von der Baseline bis Woche 4 bei maximalem Stirnrunzeln auf der Grundlage der Skala zur Beurteilung von Gesichtsfalten (FWS) in den Studien BLESS I, BLESS II und BLESS III – Vollständige Analysegruppe
|
|
BLESS I
|
BLESS II
|
BLESS III
| |
Beurteilt von:
|
Letybo
(N = 529)
|
Placebo
(N = 175)
|
Letybo
(N = 160)
|
Placebo
(N = 53)
|
Letybo
(N = 266)
|
Placebo
(N = 89)
| |
Ansprechrate (n [%]): Reduzierung des FWS-Scores von mittelstark oder stark auf keine oder leicht (Verbesserung um ≥2 Punkte erforderlich)a
| |
Prüfarzt UND Patient
|
246 (46,5 %)*
|
0 (0 %)
|
78 (48,8 %)*
|
1 (1,9 %)
|
172 (64,7 %)*
|
0 (0,0 %)
| |
Prüfarzt
|
348 (65,8 %)*
|
1 (0,6 %)
|
120 (75,0 %)*
|
1 (1,9 %)
|
209 (78,6 %)*
|
1 (1,1 %)
| |
Patient
|
290 (54,8 %)*
|
0 (0 %)
|
83 (51,9 %)*
|
1 (1,9 %)
|
183 (68,8 %)*
|
0 (0,0 %)
| |
Ansprechrate (%): Reduzierung des FWS-Scores von mittelstark oder stark auf keine oder leichtb
| |
Prüfarzt
|
393 (74,3 %)*
|
3 (1,7 %)
|
136 (85,0%)*
|
2 (3,8 %)
|
218 (82,0 %)*
|
1 (1,1 %)
|
* p-Wert <0,001 im Cochran–Mantel–Haenszel-Test auf Vorhandensein eines Unterschieds zwischen Letybo und Placebo; N: Anzahl der randomisierten Patienten, n: Anzahl Responder
a Primärer Wirksamkeitsendpunkt
b Post-hoc-Analyse
Insgesamt 38,3 % der mit Letybo behandelten Studienteilnehmer wiesen in Woche 4 nach Einschätzung durch den Prüfarzt eine Verbesserung der Faltenstärke um 3 Punkte von anfangs starken Falten (FWS-Grad 3) zu keinen Falten (FWS-Grad 0) auf.
Die Verbesserung der Glabellafalten (basierend auf einer Verbesserung bzw. Reduzierung des FWS-Scores um ≥2 Punkte bei maximalem Stirnrunzeln, basierend auf der Beurteilung durch den Studienteilnehmer und den Prüfarzt) setzte innerhalb einer Woche nach der Injektion ein und erreichte eine maximale Wirkung in der zweiten Woche nach der Injektion. Die Wirkungsdauer beträgt zwischen 12 und 16 Wochen (siehe Abbildung 1).
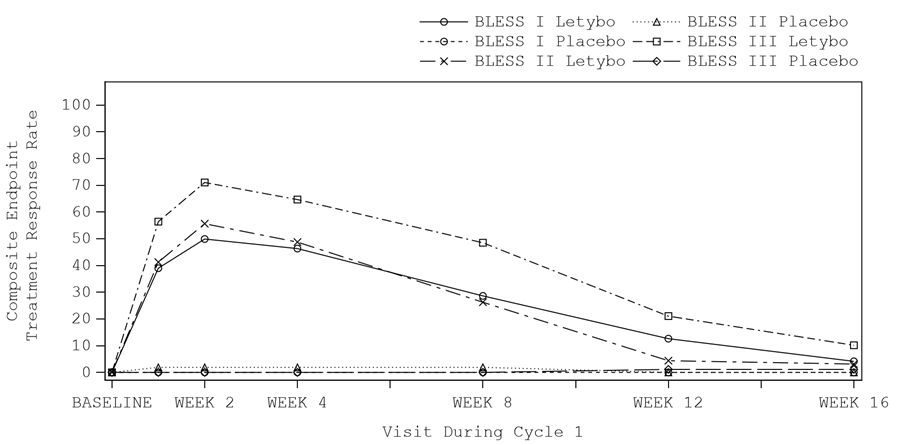
Abbildung 1: Zeitlicher Verlauf der Responderrate (Verbesserung um ≥2 Punkte auf der FWS sowohl bei Einschätzung durch den Studienteilnehmer als auch durch den Prüfarzt erforderlich) in Zyklus 1 bei Anwendung der Verum- versus der Placebo-Behandlung in den pivotalen BLESS-Studien
Es konnte gezeigt werden, dass die Responderrate mit Reduzierung des FWS-Scores in Ruhe um ≥1 Punkt(e) in der Letybo-Gruppe im Vergleich zur Placebo-Gruppe statistisch signifikant höher war: Vier Wochen nach der Injektion wiesen 63,1 %, 59,4 % und 61,3 % der mit Letybo behandelten Patienten sowie 15,4 %, 5,7 % und 9,0 % der mit Placebo behandelten Patienten in den Studien BLESS I, BLESS II bzw. BLESS III nach Einschätzung durch den Prüfarzt eine Verbesserung in Ruhe um ≥1 Punkt(e) auf der FWS auf (der p-Wert für Unterschiede zwischen den Behandlungen war in allen Studien <0,001).
Offene Langzeitdaten bei wiederholter Anwendung bestätigten, dass die Ansprechraten nach der zweiten, dritten und vierten Behandlung mit Letybo während des einjährigen Studienzeitraums hoch blieben, wenngleich in den Wiederholungszyklen bedingt durch das Studiendesign eine gewisse Tendenz in Richtung eines Nichtansprechens vorlag.
Gemäss der neu entwickelten modifizierten Skindex 16 Glabellar Line Quality of Life-Skala lagen zur Baseline bei mehr als 85 % der Patienten, die an der Studie teilnahmen, mittelstarke oder starke und bei etwa 15 % der Patienten leichte negative psychologische Auswirkungen der Glabellafalten vor.
Bei Patienten unter Behandlung mit Letybo wurde gegenüber denen in der Placebogruppe eine deutliche Verbesserung der psychologischen Auswirkungen, gemessen anhand der modifizierten Skindex 16 Glabellar Line Quality of Life-Skala, festgestellt.
Die Patienten berichteten über insgesamt positive ästhetische Ergebnisse und eine hohe Zufriedenheit mit dem Ergebnis.
Post-Marketing-Daten
Die Post-Marketing-Daten, einschliesslich der Daten aus einer Post-Marketing-Studie zu Glabellafalten (HG-13-02) bei 815 Patienten, stimmen mit den Daten aus den klinischen Studien überein.
Ältere Patienten
In den Studien BLESS I, BLESS II und BLESS III waren insgesamt 152/1’272 (11,91 %) der Patienten zum Screening-Zeitpunkt ≥65 Jahre alt. Kein Patient war älter als 75 Jahre. Die kombinierte Responderrate in Woche 4 (primärer Endpunkt) unter Behandlung mit Letybo betrug bei Kombination der Studien BLESS I, BLESS II und BLESS III bei Patienten ≥65 Jahren 46/118 (39,0 %) und war damit niedriger als bei Patienten <65 Jahren (450/839 bzw. 53,6 %). In den 3 Studien kombiniert gab es keine grossen Unterschiede in den Gesamtraten der Patienten mit TEAEs, die als mit der doppelblinden Letybo-Behandlung im Zusammenhang stehend eingestuft wurden (3,7 % bei Patienten <65 Jahren und 1,7 % bei den Patienten ≥65 Jahren, wenn medikationsbezogene TEAEs und/oder durch das Injektionsverfahren bedingte TEAEs berücksichtigt wurden).
PharmakokinetikAbsorption
Nicht zutreffend.
Distribution
Es ist nicht zu erwarten, dass Botulinumtoxin Typ A nach intramuskulärer Injektion der empfohlenen Dosis von 20 Einheiten in messbaren Mengen im peripheren Blut vorhanden ist.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenToxizität bei einmaliger und wiederholter Gabe
Toxizitätsstudien zur einmaligen und wiederholten Gabe mit wöchentlichen oder monatlichen intramuskulären Injektionen von Letybo bei Ratten zeigten eine dosisabhängige Lähmung des injizierten Muskels, die zu einer verringerten Lokomotion, verringerter Futteraufnahme, verringertem Körpergewicht und verringertem Kreatinin aufgrund von Muskelatrophie führte, die als sekundär zu der Muskellähmung und verminderten Beweglichkeit der Tiere erachtet wurden. Bei Dosen bis zu 15 E/kg wurden keine anderen schwerwiegenden unerwünschten lokalen oder systemischen Wirkungen mit toxikologischer Relevanz festgestellt.
Mutagenität und Karzinogenität
Es wurden keine Studien zum genotoxischen oder kanzerogenen Potenzial von Letybo durchgeführt.
Reproduktionstoxizität
Es wurden keine Studien zur Fertilität mit Letybo durchgeführt. Jedoch wurden bei Ratten nach hoher Dosierung anderer Botulinumtoxin Typ A enthaltender Produkte Beeinträchtigungen der männlichen und weiblichen Fertilität beobachtet.
In einer Studie zur embryo-fötalen Entwicklung mit täglichen intramuskulären Letybo-Injektionen von bis zu 8 E/kg von Gestationstag 5 bis 16 bei trächtigen Ratten wurde eine dosisabhängige Muskellähmung festgestellt, die zu Muskelatrophie, verringertem Körpergewicht und mangelnder Reinlichkeit in der Perinealregion bei den Muttertieren führte. Es wurden eine verzögerte fötale Ossifikation und ein verringertes fötales Körpergewicht (≥20 %), jedoch keine Missbildungen festgestellt, was im Einklang mit den Erfahrungen mit anderen Botulinumtoxin Typ A-haltigen Produkten als sekundäre Folgen einer maternalen Toxizität gewertet wurde. Es wurden keine Beurteilungen der Auswirkungen auf die peri-/postnatale Entwicklung durchgeführt.
Sonstige HinweiseInkompatibilitäten
Das Arzneimittel darf nur mit den unter Hinweise für die Handhabung aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die rekonstituierte Injektionszubereitung ist nicht konserviert. Chemische und physikalische inuse Stabilität wurde für einen Zeitraum von 48 Stunden bei 2 - 8°C gezeigt. Aus mikrobiologischer Sicht ist die rekonstituierte Lösung sofort zu verwenden. Wird die Lösung nicht sofort verwendet, so liegen Lagerbedingungen und Dauer der Lagerung in der Verantwortung des Anwenders und dürfen im Normalfall nicht mehr als 24 Std. bei 2 - 8°C betragen, es sei denn die Rekonstitution unter kontrollierten und validierten aseptischen Bedingungen erfolgt.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Hinweise zur Anwendung, Handhabung und Entsorgung sind strikt einzuhalten.
Die Rekonstitution hat in Übereinstimmung mit den Richtlinien der guten Praxis zu erfolgen, insbesondere im Hinblick auf Asepsis.
Als Verdünnungsmittel für die Rekonstitution von Letybo darf nur Natriumchlorid 9 mg/ml (0,9 %) Injektionslösung verwendet werden, das in einem Volumen von 1,25 ml zuzugeben ist.
Es wird empfohlen, die Spritze bei der Rekonstitution des Inhalts der Durchstechflasche über einem kunststoffbeschichteten Papiertuch vorzubereiten, um verschüttetes Material aufzufangen. Die Injektionslösung mit 9 mg/ml (0,9 %) Natriumchlorid in eine Spritze aufziehen und vorsichtig in die Durchstechflasche injizieren, um Schaum-/Blasenbildung oder heftiges Schütteln zu vermeiden, das zu Denaturierung führen kann. Die Durchstechflasche ist zu verwerfen, wenn das Lösungsmittel nicht aufgrund des Vakuums in die Durchstechflasche gezogen wird. Rekonstituiertes Letybo ist eine klare, farblose Lösung, die praktisch frei von Schwebstoffen ist. Die Durchstechflasche ist vor der Anwendung visuell zu überprüfen, um sicherzustellen, dass das Arzneimittel keine Fremdpartikel aufweist.
Letybo darf nicht verwendet werden, wenn die rekonstituierte Lösung trüb aussieht oder Partikel enthält.
Injektionslösungen, die länger als 24 Stunden gelagert wurden, sind zu verwerfen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Vorgehensweise zur sicheren Entsorgung von Durchstechflaschen, Spritzen und verwendeten Materialien
Für eine sichere Entsorgung ist nicht-rekonstituiertes Letybo in der Durchstechflasche mit etwas Wasser zu rekonstituieren und anschliessend zu autoklavieren. Es sollten alle leeren Durchstechflaschen, Durchstechflaschen mit Restlösung, Spritzen oder verschüttetes Material autoklaviert werden. Alternativ können nicht verwendete Restmengen von Letybo mit verdünnter Natronlauge (0,1 N NaOH) oder verdünnter Natriumhypochloritlösung (0,5 % oder 1 % NaOCl) inaktiviert werden.
Nach der Inaktivierung gebrauchte Durchstechflaschen, Spritzen und Materialien nicht entleeren, sondern in geeignete Behälter entsprechend den nationalen Anforderungen beseitigen.
Empfehlungen bei Zwischenfällen beim Umgang mit Botulinumtoxin
-Verschüttetes Arzneimittel aufwischen: entweder mit einem mit Natriumhypochloritlösung imprägnierten absorbierenden Material (falls das Pulver verschüttet wurde) oder mit trockenem, saugfähigem Material (falls das rekonstituierte Arzneimittel verschüttet wurde).
-Die kontaminierten Flächen sollten mit saugfähigem Material, das mit einer Natriumhypochloritlösung imprägniert ist, gereinigt und anschliessend getrocknet werden.
-Wenn eine Durchstechflasche zerbrochen ist, wie oben beschrieben vorgehen, die Glasscherben vorsichtig einsammeln und das Arzneimittel aufwischen. Dabei auf die Vermeidung von Schnittverletzungen der Haut achten.
-Wenn das Arzneimittel mit der Haut in Berührung kommt, die betroffene Stelle mit einer Natriumhypochloritlösung abwaschen und anschliessend mit reichlich Wasser spülen.
-Wenn das Arzneimittel mit den Augen in Berührung kommt, gründlich mit reichlich Wasser oder einer Augenspüllösung spülen.
-Wenn das Arzneimittel mit einer Wunde, Schnittwunde oder Hautverletzung in Berührung kommt, gründlich mit reichlich Wasser spülen und je nach Expositionsdosis geeignete medizinische Massnahmen ergreifen.
Zulassungsnummer68864 (Swissmedic).
PackungenPackungen mit 1 Durchstechflasche oder mit 2 Durchstechflaschen [A].
Bündelpackung mit 2 Durchstechflaschen (2 Packungen à 1 Durchstechflasche) [A].
Bündelpackung mit 6 Durchstechflaschen (6 Packungen à 1 Durchstechflasche) [A].
ZulassungsinhaberinMedius AG, 4132 Muttenz.
Stand der InformationJuni 2023.
|


