ZusammensetzungWirkstoffe
Calcipotriolum, Betamethasonum ut Betamethasoni dipropionas
Hilfsstoffe
Butylhydroxyanisolum 1,0 mg/g (E320), Macrogolglyceroli hydroxystearas 3,4 mg/g, Isopropylis myristas, Paraffinum liquidum, Triglycerida media, Alcohol isopropylicus, Macrogoli 4 aether laurilicus, Poloxamerum 407, Carbomera, Trolaminum, Dinatrii phosphas heptahydricus, Natrii dihydrogenophosphas monohydricus, alpha-Tocopherolum, Aqua purificata
Indikationen/AnwendungsmöglichkeitenZur topischen Behandlung einer leichten bis mittelschweren Psoriasis vulgaris (einschliesslich Psoriasis der Kopfhaut) bei Erwachsenen.
Dosierung/AnwendungDosierung
Wynzora Crème sollte einmal täglich dünn auf die betroffenen Bereiche aufgetragen und gut eingerieben werden. Die empfohlene Behandlungsdauer beträgt bis zu 8 Wochen. Die Behandlung sollte beendet werden, wenn der angestrebte Behandlungserfolg erreicht worden ist. Wynzora Crème darf nicht im Bereich von Gesicht, Leisten oder Achselhöhlen oder bei Hautatrophie angewendet werden.
Bei Anwendung von calcipotriolhaltigen Arzneimitteln sollte die Tageshöchstdosis von 15 g nicht überschritten werden. Die mit calcipotriolhaltigen Arzneimitteln behandelte Hautfläche sollte 30 % der Körperoberfläche nicht überschreiten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Verwendung auf der Kopfhaut
Alle betroffenen Bereiche der Kopfhaut mit Ausnahme des Gesichtes können mit Wynzora Crème behandelt werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Die Sicherheit und Wirksamkeit von Wynzora Crème bei Patienten mit schweren Lebererkrankungen wurde nicht untersucht.
Patienten mit Nierenfunktionsstörungen
Die Sicherheit und Wirksamkeit von Wynzora Crème bei Patienten mit schwerer Niereninsuffizienz wurde nicht untersucht.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Wynzora Crème ist bei Kindern und Jugendlichen unter 18 Jahren nicht gezeigt.
Art der Anwendung
Wynzora Crème sollte nicht direkt auf das Gesicht oder an den Augen aufgetragen werden. Für eine optimale Wirkung wird empfohlen, nicht direkt nach der Anwendung von Wynzora Crème zu duschen oder zu baden. Wynzora Crème sollte mindestens 8 Stunden auf der Haut bleiben.
Die Hände müssen nach der Anwendung gewaschen werden.
Kontraindikationen§Überempfindlichkeit gegenüber den Wirkstoffen oder einem der Hilfsstoffe (siehe «Zusammensetzung»).
§Wynzora Crème ist bei erythrodermischer, exfoliativer und pustulöser Psoriasis kontraindiziert.
§Aufgrund des Calcipotriolgehalts ist Wynzora Crème bei Patienten mit bekannten Störungen des Kalziumstoffwechsels kontraindiziert (siehe «Warnhinweise und Vorsichtsmassnahmen»).
§Aufgrund des Kortikosteroidgehalts ist Wynzora Crème bei folgenden Erkrankungen kontraindiziert: Virale Läsionen (z. B. mit Herpes- oder Varizellen) der Haut, Pilz- oder bakterielle Hautinfektionen, parasitäre Infektionen, Hautmanifestationen von Tuberkulose, periorale Dermatitis, atrophische Haut, Striae atrophicae, Fragilität der Hautvenen, Ichthyose, Acne vulgaris, Acne rosacea, Rosacea, Ulzerationen und Wunden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenAuswirkungen auf das endokrine System
Unerwünschte Wirkungen, die im Zusammenhang mit einer systemischen Kortikosteroid-Behandlung festgestellt werden, wie z. B. Nebennierenrindensuppression oder Auswirkungen auf die Stoffwechselkontrolle bei einem Diabetes mellitus, können aufgrund von systemischer Resorption auch während einer topischen Behandlung mit einem Kortikosteroid auftreten.
Die Anwendung unter Okklusivverbänden sollte vermieden werden, da dies zu einer verstärkten systemischen Resorption von Kortikosteroiden führt.
Die Anwendung auf grossen Flächen geschädigter Haut, auf Schleimhäuten oder in Hautfalten sollte vermieden werden, da dies die systemische Resorption von Kortikosteroiden erhöht (siehe «Unerwünschte Wirkungen»).
Die Suppression der HPA-Achse (Hypothalamus-Hypophysen-Nebennierenrinden-Achse) durch Wynzora wurde bei erwachsenen Patienten (N = 27) mit ausgedehnter Psoriasis (einschliesslich Kopfhaut) untersucht. Eine Nebennierensuppression wurde bei 6 von 26 Patienten (23 %) nach 4 Behandlungswochen und bei 3 von 25 Patienten (12 %) nach 8 Behandlungswochen beobachtet.
Sehstörungen
Bei der systemischen und topischen Anwendung von Kortikosteroiden können Sehstörungen auftreten. Wenn ein Patient mit Symptomen wie verschwommenem Sehen oder anderen Sehstörungen vorstellig wird, sollte eine Überweisung des Patienten an einen Augenarzt zur Bewertung möglicher Ursachen in Erwägung gezogen werden; diese umfassen unter anderem Katarakt, Glaukom oder seltene Erkrankungen, wie z. B. zentrale seröse Chorioretinopathie (CSC), die nach der Anwendung systemischer oder topischer Kortikosteroide gemeldet wurden.
Auswirkungen auf den Kalziumstoffwechsel
Aufgrund des Calcipotriolgehalts von Wynzora Crème kann eine Hyperkalzämie auftreten. Der Serumkalziumspiegel normalisiert sich nach Absetzen der Behandlung wieder. Das Risiko einer Hyperkalzämie ist gering, wenn die maximale Tagesdosis von Wynzora Crème (15 g) bzw. 100g pro Woche nicht überschritten wird (siehe «Dosierung/Anwendung»).
Lokale unerwünschte Wirkungen
In einem Vasokonstriktions-Test an gesunden Probanden entsprach das Ausmass der Hautabblassung durch Wynzora Crème im Vergleich zu anderen topischen Kortikosteroiden einem Kortikosteroid der Klasse III. Eine gleichzeitige Behandlung mit anderen Steroiden auf dem gleichen Behandlungsareal muss vermieden werden.
Die Haut im Gesicht und an den Genitalien reagiert sehr empfindlich auf Kortikosteroide. Das Arzneimittel sollte in diesen Bereichen nicht angewendet werden.
Der Patient muss über die korrekte Anwendung des Arzneimittels aufgeklärt werden, um das Auftragen und die versehentliche Übertragung auf Gesicht, Mund und Augen zu vermeiden. Die Hände müssen nach jeder Anwendung gewaschen werden, um eine versehentliche Übertragung auf diese Bereiche zu vermeiden.
Gleichzeitig auftretende Hautinfektionen
Bei Auftreten sekundärer Infektionen, sollten diese mit einer antimikrobiellen Therapie behandelt werden. Tritt dennoch eine Verschlechterung der Infektion auf, ist die Behandlung mit Kortikosteroiden abzubrechen (siehe «Kontraindikationen»).
Absetzen der Behandlung
Wird eine Psoriasisbehandlung mit Kortikosteroiden abgesetzt, besteht das Risiko einer generalisierten pustulösen Psoriasis oder von Rebound-Effekten. Die ärztliche Überwachung sollte daher in der Nachbehandlungsphase fortgesetzt werden.
Langzeitanwendung
Die Langzeitanwendung von Kortikosteroiden kann das Risiko für lokale und systemische unerwünschte Wirkungen erhöhen. Die Behandlung sollte abgesetzt werden, wenn unerwünschte Wirkungen im Zusammenhang mit der Langzeitanwendung von Kortikosteroiden auftreten (siehe «Unerwünschte Wirkungen»).
Ungeprüfte Anwendung
Es liegen keine Erfahrungen mit der Anwendung von Wynzora Crème bei Psoriasis guttata vor.
Gleichzeitige Behandlung und UV-Exposition
Es liegen keine ausreichenden Erfahrungen mit der Kombination von Wynzora Crème und anderen topischen Antipsoriatika auf denselben Körperbereichen, systemisch angewendeten Antipsoriatika oder Phototherapie vor, um diesbezügliche Empfehlungen geben zu können.
Während der Therapie mit Wynzora Crème wird empfohlen, exzessive Bestrahlung mit natürlichem oder künstlichem Sonnenlicht zu begrenzen oder zu meiden. Topisches Calcipotriol sollte nur dann zusammen mit UV-Bestrahlung angewendet werden, wenn nach sorgfältiger Abwägung durch Arzt und Patient der potentielle Nutzen das potentielle Risiko übersteigt.
Wynzora Crème enthält Butylhydroxyanisol und Macrogolglycerolhydroxystearat
Butylhydroxyanisol kann örtlich begrenzt Hautreizungen (z.B. Kontaktdermatitis) oder Reizungen der Augen und Schleimhäute hervorrufen.
Macrogolglycerolhydroxystearat kann Hautreizungen hervorrufen.
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen mit Wynzora Crème durchgeführt.
Wynzora Crème darf nicht mit Salicylsäure-haltigen Zubereitungen gemischt werden, da die Salicylsäure Calcipotriol rasch inaktiviert. Die Wirkung des in Wynzora Crème enthaltenen Betamethasons wird durch Salicylsäure jedoch nicht beeinflusst. Salicylsäure wird nicht absorbiert und bleibt einige Stunden auf der Hautoberfläche, so dass auch eine zeitlich versetzte Calcipotriol-Anwendung in der Wirkung vermindert sein kann. Über mögliche Interaktionen mit anderen antipsoriatischen Produkten liegen keine Erfahrungen vor. In speziellen Umständen wie sehr hochdosierter und ausgedehnter kutaner Behandlung können die Wirkstoffe von Wynzora Crème in klinisch relevanten Mengen systemisch absorbiert werden.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine hinreichenden Erfahrungen mit der Anwendung von Calcipotriol/Betamethason-Produkten bei Schwangeren vor. Bei oraler Anwendung an Tieren haben Studien zu Calcipotriol keine teratogenen Wirkungen gezeigt, obwohl eine Reproduktionstoxizität nachgewiesen wurde (siehe «Präklinische Daten»). Tierexperimentelle Studien mit Glukokortikoiden haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»), aber eine Reihe von epidemiologischen Studien (weniger als 300 Schwangerschaftsausgänge) haben keine angeborenen Anomalien bei Säuglingen gezeigt, die von Frauen geboren wurden, die während der Schwangerschaft mit Kortikosteroiden behandelt wurden. Das potenzielle Risiko für den Menschen ist ungewiss. Daher sollte Wynzora Crème während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko rechtfertigt.
Stillzeit
Betamethason geht in die Muttermilch über, aber in therapeutischen Dosen erscheinen unerwünschte Wirkungen auf das gestillte Kind unwahrscheinlich. Es liegen keine Daten zum Übergang von Calcipotriol in die Muttermilch vor. Wynzora Crème sollte stillenden Frauen mit Vorsicht verordnet werden. Muss Wynzora Crème an den Brüsten angewendet werden, darf nicht gestillt werden.
Fertilität
Studien an Ratten mit oralen Dosen von Calcipotriol oder Betamethasondipropionat zeigten keine Beeinträchtigung der männlichen und weiblichen Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDer Einfluss von Wynzora Crème auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, wurde nicht untersucht.
Unerwünschte WirkungenDie Abschätzung der Häufigkeit von unerwünschte Wirkungen basiert auf einer gepoolten Analyse von Daten aus klinischen Studien.
Alle berichteten unerwünschte Wirkungen wurden mit einer Häufigkeit unter 1 % beobachtet. Die am häufigsten beobachteten unerwünschte Wirkungen waren «Reaktionen an der Anwendungsstelle», wie Reizungen, Schmerzen, Pruritis, Ekzem, Exfolation, Teleangiektasie und Follikulitis.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklasse und Häufigkeit in Tabelle 1 unten dargestellt. Innerhalb jeder Häufigkeitsgruppe sind unerwünschte Wirkungen nach abnehmendem Schweregrad angegeben. Die Häufigkeit der unerwünschten Wirkungen wird in den folgenden Kategorien ausgedrückt: «sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1‘000, <1/100); «selten» (≥1/10‘000, <1/1‘000); «sehr selten» (<1/10‘000); «nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Tabelle 1: Für Wynzora berichtete unerwünschte Wirkungen
|
Systemorganklasse
|
Gelegentlich
|
Nicht bekannt
| |
Infektionen und parasitäre Erkrankungen
|
Follikulitis an der Applikationsstelle
Infektionen der oberen Luftwege
|
| |
Erkrankungen des Nervensystems
|
Schlaflosigkeit
|
| |
Augenerkrankungen
|
|
Verschwommenes Sehen*
| |
Erkankungen der Haut und des Unterhautgewebes
|
Pruritus
Ausschlag
Urtikaria
|
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Reizung der Applikationsstelle
Schmerzen an der Applikationsstelle
Pruritus an der Applikationsstelle
Ekzem an der Applikationsstelle
Exfoliation der Applikationsstelle
Teleangiektasie an der Applikationsstelle
Kopfschmerzen
|
|
* Siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»
Die folgenden unerwünschte Wirkungen werden den pharmakologischen Klassen von Calcipotriol bzw. Betamethason zugerechnet:
Calcipotriol
Zu den unerwünschte Wirkungen zählen Reaktionen an der Applikationsstelle, Juckreiz, Hautreizung, Brennen und Stechen, trockene Haut, Erythem, Hautausschlag, Dermatitis, Ekzem, verstärkte Psoriasis, Lichtempfindlichkeit und Überempfindlichkeitsreaktionen, einschliesslich sehr seltener Fälle von Angioödem und Gesichtsödem.
Systemische unerwünschte Wirkungen nach topischer Anwendung können sehr selten auftreten und Hyperkalzämie oder Hyperkalziurie verursachen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Betamethason (als Dipropionat)
Lokale Reaktionen können nach topischer Anwendung auftreten, insbesondere bei längerer Anwendung, einschliesslich Hautatrophie, Teleangiektasie, Striae, Follikulitis, Hypertrichose, periorale Dermatitis, allergische Kontaktdermatitis, Depigmentierung und Kolloidmilium.
Bei der Behandlung von Psoriasis mit topischen Kortikosteroiden kann das Risiko einer generalisierten Psoriasis pustulosa bestehen.
Systemische Reaktionen aufgrund der topischen Anwendung von Kortikosteroiden sind bei Erwachsenen selten, können jedoch schwerwiegend sein. Nebennierenrindensuppression, Katarakt, Infektionen, Auswirkungen auf die Stoffwechselkontrolle bei einem Diabetes mellitus und Anstieg des Augeninnendrucks können insbesondere nach Langzeitbehandlung auftreten. Systemische Reaktionen treten häufiger auf, wenn unter Okklusion (Kunststoff, Hautfalten) aufgetragen wird, wenn auf grossen Flächen und im Rahmen einer Langzeitbehandlung angewendet wird (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine Anwendung über die empfohlene Dosis hinaus kann zu einem erhöhten Serumkalziumspiegel führen, der sich nach Absetzen der Behandlung normalisiert. Zu den Symptomen einer Hyperkalzämie zählen Polyurie, Verstopfung, Muskelschwäche, Verwirrtheit und Koma.
Es wurde von einem Patienten mit extensiver erythrodermischer Psoriasis berichtet, bei dem sich aufgrund einer missbräuchlichen Anwendung von 240 g Calcipotriol/Betamethason Gel pro Woche (empfohlene maximale Dosis: 100 g/Woche) während 5 Monaten ein Cushing's Syndrom und nach abruptem Therapieabbruch eine pustulöse Psoriasis entwickelte.
Behandlung:
Eine übermässig lange Anwendung topischer Kortikosteroide kann zu einer Nebennierenrindensuppression führen, die in der Regel reversibel ist. Eine symptomatische Behandlung kann angezeigt sein.
Im Falle einer chronischen Toxizität muss die Kortikosteroidbehandlung schrittweise ausgeschlichen werden.
Eigenschaften/WirkungenATC-Code
D05AX52
Wirkungsmechanismus
Calcipotriol ist ein Vitamin-D3-Derivat. In-vitro-Daten zeigen, dass Calcipotriol die Differenzierung von Keratinozyten induziert und deren Proliferation hemmt. Diese beiden Wirkungen werden als Grundlage des therapeutischen Effektes bei Psoriasis angenommen.
Der Dipropionatester von Betamethason zeigt die grundlegenden Eigenschaften von Kortikosteroiden. In pharmakologischen Dosierungen werden Kortikosteroide vor allem wegen ihrer entzündungshemmenden und/oder immunsupressiven Wirkung verwendet. Der genaue Wirkungsmechanismus von Kortikosteroiden bei Psoriasis ist unklar.
Pharmakodynamik
Die Suppression der HPA-Achse wurde bei erwachsenen Probanden (N = 27) mit ausgedehnter Psoriasis untersucht, die 20–30 % der Körperoberfläche (einschliesslich Kopfhaut) unter maximalen Einsatzbedingungen umfasste. Die Behandlung bestand aus der einmal täglichen Anwendung von Wynzora Crème auf dem Körper und der Kopfhaut (75 % der Probanden hatten eine Kopfhautbeteiligung) für bis zu 8 Wochen. Eine Nebennierensuppression wurde bei 6 von 26 Patienten (23 %) nach 4 Behandlungswochen und bei 3 von 25 Patienten (12 %, ein Proband mit fortgesetzter Suppression ab Woche 4 und zwei weitere Probanden) nach 8 Behandlungswochen beobachtet.
Es zeigte sich keine Tendenz zu sinkenden Cortisolspiegeln nach der ACTH-Stimulation mit steigender systemischer Konzentration von B17P, gemessen anhand der AUC0-7 oder Cmax, oder mit steigender durchschnittlicher wöchentlicher Menge der verwendeten Wynzora Crème.
Während der Behandlung mit Wynzora Crème gab es keine Probanden, die Laborwerte zeigten, die auf eine Veränderung des Kalziumstoffwechsels hinwiesen.
Klinische Wirksamkeit
Die Wirksamkeit der einmal täglichen Anwendung von Wynzora Crème wurde in zwei randomisierten, prüfarztverblindeten, 8-wöchigen klinischen Phase III Studien an 738 Patienten mit Psoriasis am Körper und am Rumpf (auch Kopfhaut in Studie 1) mit leichter bis mittelschwerer Psoriasis gemäss der Gesamtbeurteilung der Schwere der Erkrankung durch den Arzt (PGA) untersucht. Diese wurden mit Wynzora Crème, einem Calcipotriol/Betamethason Gel oder einem entsprechenden Vehikel behandelt. Wynzora Crème wurde in beiden Phase III Studien im Vergleich zu den aktiven Kontrollgruppen in höherer Dosis angewendet. In der europäische Phase III Studie MC2-01-C7 wurden 257,9 g Wynzora Crème über 8 Wochen verwendet, während der aktive Komparator Calcipotriol/Betamethason Gel im gleichen Zeitraum 181,9 g verwendete. In der US-amerikanischen Phase III Studie MC2-01-C2 wurde Wynzora Crème mit 33,8 g Wynzora Crème pro Woche angewendet, während der aktive Komparator Calcipotriol/Betamethason Gel mit 27,1 g pro Woche verwendet wurde.
Die Verteilung der Krankheitsschweregrade der randomisierten Studienteilnehmer war in den beiden Studien ähnlich und repräsentativ für die klinische Praxis, wobei die Mehrheit der Studienteilnehmer eine leichte bis mittelschwere Krankheit, und 24 % eine schwere Krankheit gemäss KOF (mehr als 10 % der KOF betroffen) und mehr als 12 % eine schwere Krankheit gemäss mPASI (mPASI > 12) bei Baseline aufwiesen. Wynzora Crème war bei allen Schweregraden der Erkrankung wirksam. Calcipotriol/Betamethasondipropionat-Gel wurde als aktives Vergleichspräparat verwendet.
Die Ergebnisse sowohl der primären als auch der sekundären Wirksamkeitsendpunkte in Studie 1 und Studie 2 zeigten, dass Wynzora Crème im Vergleich zum Vehikel in allen bestätigenden Wirksamkeitsendpunkten bei der Behandlung von Psoriasis am Körper und am Rumpf eine überlegene Wirksamkeit aufwies (p < 0,0001; Tabelle 2). Der mittels PGA beurteilte Behandlungserfolg war definiert als «erscheinungsfrei» oder «fast erscheinungsfrei» für Patienten mit mittelschwerer Erkrankung bei Baseline und «erscheinungsfrei» für Patienten mit leichter Erkrankung bei Baseline.
Tabelle 2: Wirksamkeit in Studie 1 und Studie 2 mit Wynzora Crème
|
|
Studie 1
|
Studie 2
| |
|
Wynzora Crème
N= 213
|
Vehikel-Crème
N = 68
|
Wynzora Crème
N = 342
|
Vehikel-Crème
N = 115
| |
Anteil Patienten mit «Behandlungserfolg» nach PGA in Woche 8 (CI 95%)
|
50,7
(43,9; 57,5)
|
6,1
(-0,2; 12,4)
|
37,4
(32,1; 42,6)
|
3,7
(0,1; 7,2)
| |
Mittlere prozentuale Reduktion des mPASI in Woche 8
|
67,5
|
11,7
|
62,9
|
22,9
| |
PASI75 in Woche 8 (CI 95%)
|
47,6
(40,8; 54,4)
|
5,1
(-0,5; 10,7)
|
41,6
(36,3; 47,0)
|
8,1
(2,8; 13,5)
|
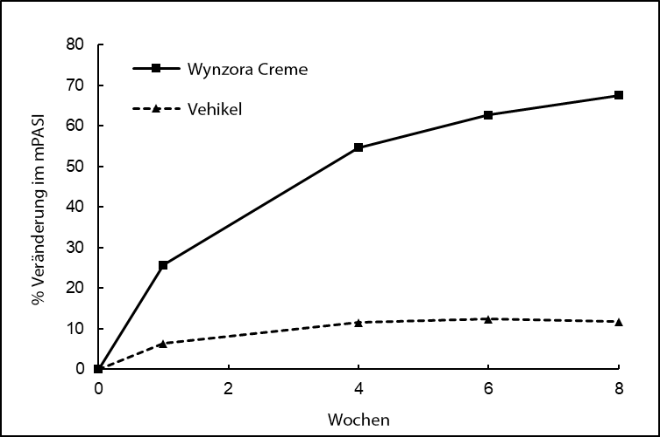
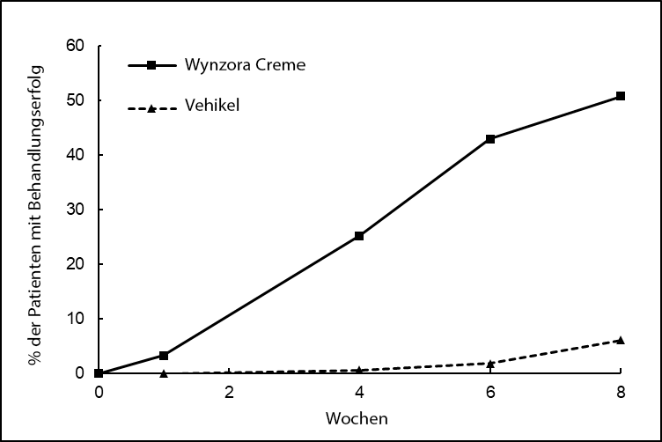
Abbildung 1: Wirksamkeitsergebnisse im Zeitverlauf in Studie 1
|
|
|
|
| |
Studie 1: Prozentuale Veränderung im mPASI gegenüber Baseline. Statistisch signifikante Behandlungsunterschiede in Bezug auf das Vehikel wurden ab Woche 1 (p < 0,0001) und danach beobachtet.
|
Studie 1: Behandlungserfolg laut PGA. Statistisch signifikante Behandlungsunterschiede gegenüber dem Vehikel wurden ab Woche 4 (p < 0,0001) und danach beobachtet.
|
Wynzora Crème hat in Woche 8 im Vergleich zum Calcipotriol/Betamethasondipropionat-Gel einen statistisch signifikant grösseren Behandlungserfolg laut PGA gezeigt.
In Studie 1 wurde die Wirksamkeit von Wynzora Crème auf Kopfhaut-Psoriasis als Anteil der Studienteilnehmer mit «Behandlungserfolg» laut PGA untersucht (Tabelle 3). Die Wirksamkeit von Wynzora Crème bei Kopfhaut-Psoriasis war in Woche 4 (p = 0,0051) und Woche 8 (p = 0,0002) statistisch signifikant grösser als beim Vehikel.
Tabelle 3: Wirksamkeit von Wynzora Crème bei Kopfhaut-Psoriasis in Studie 1
|
|
Studie 1
| |
|
Wynzora Crème
N = 112
|
Vehikel-Crème
N = 38
| |
Anteil Patienten mit «Behandlungserfolg» nach PGA in Woche 8
(CI 95%)
|
50,8
(41,4; 60,1)
|
9,3
(-0,5; 19,1)
|
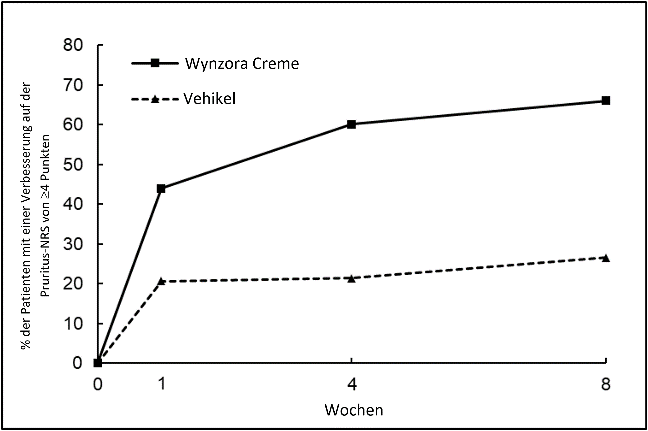
In Studie 2 zeigte die Wynzora Crème eine überlegene Reduktion des Juckreizes gegenüber dem Vehikel, definiert als Verbesserung des Pruritus um mindestens 4 Punkte auf der numerischen Bewertungsskala (NRS) von der Baseline bis Woche 4. Ein statistisch signifikanter Behandlungsunterschied (p < 0,0001) wurde ab Woche 1 und danach beobachtet.
Abbildung 2: Verbesserung des Juckreiz-NRS von Baseline bis Woche 4 in Studie 2 mit Wynzora Crème
PharmakokinetikAbsorption
Das Ausmass der perkutanen Resorption beider Wirkstoffe nach topischer Anwendung von Wynzora Crème wurde in der HPA-Achsenstudie bei Studienteilnehmern mit ausgedehnter Psoriasis vulgaris bestimmt (siehe «Eigenschaften/Wirkungen, Pharmakodynamik»).
Die mittlere ± SD für die gesamte Körperoberfläche betrug 25 ± 5 % und 74 % der Studienteilnehmer wiesen eine Kopfhautbeteiligung auf, wobei die mittlere ± SD für die Kopfhaut 52 ± 40 % betrug. Die mittlere ± SD Wochendosis während der 8-wöchigen Behandlung betrug 79 ± 30 g.
Distribution
Die Plasmakonzentrationen von Calcipotriol und Betamethasondipropionat und ihren Hauptmetaboliten wurden nach 4 und 8 Wochen einmal täglicher Anwendung von Wynzora Crème gemessen.
Der Mittelwert aller Analyten lag innerhalb des subnanomolaren Plasmakonzentrationsbereichs und in den meisten Proben unterhalb oder nahe der unteren Bestimmungsgrenze.
Einer von 27 (3,7 %) Studienteilnehmern wies in Woche 4 messbare Calcipotriol-Spiegel auf. Die Cmax und die AUC0-7 betrugen 30 pg/ml bzw. 229 pg*h/ml. 3 von 27 (11,1 %) Studienteilnehmern wiesen in Woche 4 messbare Spiegel des Hauptmetaboliten von Calcipotriol, MC1080, auf. Die mittlere ± SD Cmax und AUC0-7 betrugen 30 ± 4 pg/ml bzw. 224 ± 16 pg*h/ml. Kein Studienteilnehmer wies in Woche 8 messbare Calcipotriol - oder MC1080-Spiegel auf.
Bei Betamethasondipropionat gab es 3 Patienten (11,1 %) mit messbaren Betamethasondipropionat-Spiegeln in Woche 4. Der Mittelwert ± SD von Cmax und AUC0-7 betrug 22 ± 9 pg/ml bzw. 160 ± 36 pg*h/ml. Der Hauptmetabolit von Betamethasondipropionat, Betamethason 17-Propionat (B17P) war bei 13 von 27 Patienten (48,1 %) in Woche 4 messbar. Die mittlere ± SD Cmax und AUC0-7 betrugen 96 ± 234 pg/ml bzw. 419 ± 646 pg*h/ml. Keiner der Studienteilnehmer hatte messbare Betamethasondipropionat-Spiegel in Woche 8, aber 7 von 19 (37 %) Studienteilnehmern wiesen messbare B17P-Spiegel in Woche 8 auf. Die mittlere ± SD Cmax und AUC0-7 betrugen 31 ± 29 pg/ml bzw. 205 ± 142 pg*h/ml.
Metabolismus
Calcipotriol:
Der Metabolismus von Calcipotriol erfolgt nach der systemischen Aufnahme schnell und in der Leber. Die primären Metaboliten von Calcipotriol sind weniger wirksam als die Ausgangsverbindung.
Calcipotriol wird zu MC1046 (dem α,ß-ungesättigten Ketonanalogon von Calcipotriol) metabolisiert, das weiter zu MC1080 (einem gesättigten Ketonanalogon) metabolisiert wird. MC1080 ist der Hauptmetabolit im Plasma. MC1080 wird langsam zu Calcitronsäure metabolisiert.
Betamethasondipropionat:
Betamethasondipropionat wird durch Hydrolyse zu Betamethason-17-propionat und Betamethason, einschliesslich der 6ß-Hydroxyderivate dieser Verbindungen, metabolisiert. Betamethason-17-propionat (B17P) ist der primäre Metabolit.
Elimination
Die Elimination erfolgt auf renalem und hepatischem Wege. Der Hauptausscheidungsweg – wie aus Tierversuchen bekannt – von Calcipotriol ist über den Stuhl und bei Betamethasondipropionat über den Urin.
Präklinische DatenStudien mit Kortikosteroiden an Tieren haben eine Reproduktionstoxizität gezeigt (Gaumenspalte, Skelettfehlbildungen). In Reproduktionstoxizitätsstudien mit langfristiger oraler Verabreichung von Kortikosteroiden an Ratten wurden verlängerte Gestation und verlängerte und erschwerte Geburt festgestellt. Weiterhin waren bei den Nachkommen eine erhöhte Sterblichkeitsrate, ein verringertes Geburtsgewicht und eine verminderte Gewichtszunahme zu beobachten. Es bestand keine Beeinträchtigung der Fertilität. Die Relevanz für den Menschen ist unbekannt.
Calcipotriol hat eine maternale und fetale Toxizität bei Ratten und Kaninchen gezeigt, wenn es oral in Dosen von 54 µg/kg/Tag bzw. 12 µg/kg/Tag verabreicht wurde. Die bei gleichzeitiger maternaler Toxizität beobachteten fetalen Anomalien umfassten Anzeichen, die auf eine Skelettunreife hindeuten (unvollständige Ossifikation der Schambeine und Vorderbeinphalangen und vergrösserte Fontanellen) und eine erhöhte Inzidenz überzähliger Rippen.
Die geschätzte systemische Exposition nach topischer Anwendung von Wynzora Crème bei Psoriasis-Patienten ist im Vergleich zu den in den oralen In-vivo-Studien untersuchten Konzentrationen von Calcipotriol vernachlässigbar, und es besteht kein nennenswertes Reproduktionsrisiko für Menschen, die eine therapeutische Exposition mit Wynzora Crème erhalten.
Basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Eine Karzinogenitätsstudie mit dermaler Anwendung von Calcipotriol an Mäusen und eine Karzinogenitätsstudie mit oraler Anwendung an Ratten ergaben kein besonderes Risiko für den Menschen.
Studien zur Photo-(Co)-Karzinogenese an Mäusen legen nahe, dass Calcipotriol die Wirkung von UVR zur Induktion von Hauttumoren verstärken kann.
Eine Karzinogenitätsstudie mit dermaler Anwendung an Mäusen und eine Karzinogenitätsstudie mit oraler Anwendung an Ratten ergaben kein besonderes Risiko von Betamethasondipropionat für den Menschen.
In einer Verträglichkeitsstudie mit lokaler Anwendung an Minischweinen verursachte Wynzora Crème leichte bis mässige Hautreizungen.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
6 Monate haltbar.
Besondere Lagerungshinweise
Nicht über 25 ºC lagern. Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer68917 (Swissmedic)
PackungenEine Tube mit 60 g [B]
Eine Packung mit zwei Tuben à je 60 g [B]
ZulassungsinhaberinAlmirall AG, 8304 Wallisellen
Stand der InformationApril 2023
|



