Eigenschaften/WirkungenATC-Code
B06AX05
Wirkungsmechanismus
Casgevy ist eine Zelltherapie, bestehend aus autologen CD34+-HSPC, die mithilfe der CRISPR/Cas9-Technologie ex vivo editiert wurden. Die hochspezifische Leit-RNA ermöglicht es, mittels CRISPR/Cas9 einen präzisen DNA-Doppelstrangbruch an der kritischen Transkriptionsfaktor-Bindungsstelle (GATA1) in der Erythroid-spezifischen Enhancer-Region des BCL11A-Gens zu erzielen. Durch die Editierung wird die GATA1-Bindung irreversibel unterbrochen und die BCL11A-Expression reduziert. Die reduzierte BCL11A-Expression führt zu einem Anstieg der γ-Globin-Expression und zur Bildung des Proteins fetales Hämoglobin (HbF) in den erythroiden Zellen, wodurch das fehlende Globin bei der transfusionsabhängigen Beta-Thalassämie (TDT) und das abweichende Globin bei der Sichelzellkrankheit (SCD), die die zugrundeliegenden Krankheitsursachen sind, ersetzt werden. Bei Patienten mit TDT wird durch die Bildung von γ-Globin die Korrektur des Ungleichgewichts zwischen dem α-Globin und dem Nicht-α-Globin erwartet, wodurch die ineffektive Erythropoese und Hämolyse verringert wird, und der Gesamthämoglobinspiegel ansteigt. Bei Patienten mit schwerer SCD wird durch die Expression von HbF die Verringerung der intrazellulären HbS-Konzentration erwartet, was die Sichelbildung der roten Blutzellen verhindert.
Klinische Wirksamkeit
Die Wirksamkeit von Casgevy wurde bei Jugendlichen und Erwachsenen im Alter von 12 bis 35 Jahren mit transfusionsabhängiger Beta-Thalassämie (TDT) oder Sichelzellkrankheit (SCD) in zwei offenen, einarmigen Studien (Studie 111 und Studie 121) und einer Langzeit-Nachbeobachtungsstudie (Studie 131) untersucht.
Transfusionsabhängige Beta-Thalassämie
Studie 111 ist eine noch laufende offene, multizentrische, einarmige Studie zur Bewertung der Sicherheit und Wirksamkeit von Casgevy bei Erwachsenen und Jugendlichen mit transfusionsabhängiger Beta-Thalassämie. Nach Abschluss der 24-monatigen Nachbeobachtung in Studie 111 wurden die Patienten eingeladen, an Studie 131 teilzunehmen, einer noch laufenden Langzeitstudie zur Sicherheit und Wirksamkeit.
Die Patienten kamen für die Studie in Frage, wenn sie in den 2 Jahren vor der Aufnahme in die Studie mindestens 100 ml/kg/Jahr oder 10 Einheiten/Jahr an Erythrozytentransfusionen benötigten. Die Patienten benötigten ausserdem einen Lansky- oder Karnofsky-Performance-Score von ≥80 %.
Ausgeschlossen von der Studie waren Patienten, für die ein HLA-kompatibler, verwandter HSZ-Spender zur Verfügung stand. Patienten mit stark erhöhtem Eisengehalt im Herzen (d.h. Patienten mit einer kardialen T2* von weniger als 10 ms in der Magnetresonanztomographie [MRT]) oder einer fortgeschrittenen Lebererkrankung wurden von der Studie ausgeschlossen. Bei allen Patienten wurde eine MRT der Leber durchgeführt. Bei Patienten mit MRT-Ergebnissen, die einen Eisengehalt in der Leber von ≥15 mg/g zeigten, wurde zur weiteren Abklärung eine Leberbiopsie durchgeführt. Patienten mit einer Leberbiopsie, die eine Brückenfibrose oder Zirrhose zeigten, wurden ausgeschlossen.
Von den 59 Patienten, die in Studie 111 mit der Mobilisierung begannen, brachen 3 Patienten (5,1 %) die Behandlung vor der Casgevy-Infusion ab, alle wegen Widerrufs der Einwilligungserklärung.
Die wichtigsten demographischen Daten und Baseline-Charakteristika sind in Tabelle 5 gezeigt, und zwar (1) von allen Patienten, die in Studie 111 aufgenommen wurden, und (2) von allen Patienten, die in Studie 111 eine Infusion von Casgevy erhielten.
Tabelle 5: Demographische Daten und Baseline-Charakteristika in Study 111
|
Demographische Daten und Krankheitsmerkmale
|
Casgevy
aufgenommene Patienten
(N=59) §
|
Casgevy
Patienten mit Infusion †
(N=54)
| |
Alter, n (%)
|
|
| |
Erwachsene (≥18 und ≤35 Jahre)
Jugendliche (≥12 und < 18 Jahre)
|
39 (66,1 %)
20 (33,9 %)
|
35 (64,8 %)
19 (35,2 %)
| |
Alle Altersgruppen (≥12 und ≤35 Jahre)
|
|
| |
Median (min., max.)
|
19 (12; 35)
|
20 (12; 35)
| |
Geschlecht, n (%)
|
|
| |
Weiblich
|
28 (47,5 %)
|
25 (46,3 %)
| |
Männlich
|
31 (52,5 %)
|
29 (53,7 %)
| |
Ethnie, n (%)
|
|
| |
Asiatisch
|
25 (42,4 %)
|
23 (42,6 %)
| |
Weisshäutig
|
19 (32,2 %)
|
18 (33,3 %)
| |
Sonstige#
|
6 (10,2 %)
|
5 (9,3 %)
| |
Nicht erfasst
|
9 (15,3 %)
|
8 (14,8 %)
| |
Genotyp, n (%)
|
|
| |
β0/β0-artig ‡
|
38 (64,4 %)
|
33 (61,1 %)
| |
Nicht-β0/β0-artig
|
21 (35,6 %)
|
21 (38,9 %)
| |
Annualisiertes Erythrozytentransfusionsvolumen zu Studienbeginn (ml/kg)
|
|
| |
Median (min., max.)
|
211,2 (48,3; 330,9)
|
205,7 (48,3; 330,9)
| |
Annualisierte Erythrozytentransfusionsepisoden zu Studienbeginn
|
|
| |
Median (min., max.)
|
16,5 (5,0; 34,5)
|
16,5 (5,0; 34,5)
| |
Intakte Milz, n (%)
|
43 (72,9 %)
|
38 (70,4 %)
| |
Eisenkonzentration in der Leber zu Studienbeginn (mg/g)
|
|
| |
Median (min., max.)
|
3,5 (1,2; 14,8)
|
3,5 (1,2; 14,0)
| |
Kardiales Eisen T2* (msec) zu Studienbeginn
|
|
| |
Median (min., max.)
|
34,1 (12,4; 61,1)
|
34,4 (12,4; 61,1)
| |
Serumferritin (pmol/l) zu Studienbeginn
|
|
| |
Median (min., max.)
|
3'100,9 (584,2; 10 837,3)
|
3'115,5 (584,2; 10 837,3)
|
§ N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten.
† Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023, mit 54 Patienten durchgeführt, die Casgevy erhalten hatten, und 2 Patienten, denen eine Casgevy-Infusion bevorstand.
‡ Niedrige bis keine endogene Beta-Globinbildung (β0/β0, β0/IVS-I-110 und IVS-I-110/IVS-I-110).
# Einschliesslich «gemischtrassig».
Mobilisierung und Apherese
Zur Aufrechterhaltung eines Gesamt-Hb-Werts von ≥11 g/dl mussten die Patienten vor der Mobilisierung und Apherese Erythrozytentransfusionen erhalten und weitere Transfusionen bis zum Beginn der myeloablativen Konditionierung.
Zur Mobilisierung von Stammzellen für die Apherese wurde den Patienten in Studie 111 Granulozyten-Kolonie-stimulierender Faktor (G-CSF) verabreicht. Patienten mit Milz wurde eine geplante Dosis von 5 μg/kg G-CSF etwa alle 12 Stunden als intravenöse oder subkutane Injektion über 5 bis 6 Tage gegeben. Splenektomierte Patienten erhielten eine geplante Dosis von 5 μg/kg G-CSF einmal täglich für 5 bis 6 Tage. Die Dosis wurde bei splenektomierten Patienten auf alle 12 Stunden erhöht, wenn kein Anstieg der weissen Blutzellen oder der CD34+-Zellen im peripheren Blut zu verzeichnen war. Nach viertägiger Anwendung von G-CSF erhielten alle Patienten Plerixafor in einer geplanten Dosis von 0,24 mg/kg, die etwa 4 bis 6 Stunden vor jeder geplanten Apherese subkutan injiziert wurde. Die Apherese wurde an bis zu 3 aufeinanderfolgenden Tagen durchgeführt, um die angestrebte Zellentnahme für die Herstellung des Arzneimittels und für die unveränderten CD34+-Reservezellen zu erreichen. Die mittlere (SD) und mediane (min., max.) Anzahl der Mobilisierungs- und Apheresezyklen, die für die Herstellung von Casgevy und für die Gewinnung von CD34+-Reservezellen erforderlich waren, betrug 1,3 (0,7) bzw. 1 (1, 4).
Konditionierung zur Vorbehandlung
Alle Patienten erhielten vor der Behandlung mit Casgevy eine vollständige myeloablative Konditionierung mit Busulfan. Busulfan wurde an 4 aufeinanderfolgenden Tagen intravenös über einen zentralen Venenkatheter in einer geplanten Anfangsdosis von 3,2 mg/kg/Tag einmal täglich oder 0,8 mg/kg alle 6 Stunden verabreicht. Die Busulfan-Plasmaspiegel wurden durch serielle Blutentnahmen gemessen und die Dosis angepasst, um die Exposition im Zielbereich zu halten. Bei einmal täglicher Anwendung betrug die angestrebte kumulative Busulfan-Exposition über vier Tage 82 mg*h/l (Bereich: 74 bis 90 mg*h/l), entsprechend einer AUC0-24h von 5'000 μM*min (Bereich: 4'500 bis 5'500 μM*min). Bei einer Anwendung alle 6 Stunden betrug die angestrebte viertägige kumulative Busulfan-Exposition 74 mg*h/l (Bereich: 59 bis 89 mg*h/l), was einer AUC0-6h von 1'125 μM*min (Bereich: 900 bis 1'350 μM*min) entspricht.
Alle Patienten erhielten vor Beginn der Konditionierung mit Busulfan eine Prophylaxe gegen Krampfanfälle mit anderen Arzneimitteln als Phenytoin. Phenytoin wurde wegen seiner Induktion von Cytochrom P-450 und der daraus resultierenden erhöhten Clearance von Busulfan nicht zur Prophylaxe von Krampfanfällen eingesetzt.
Eine Prophylaxe gegen die hepatische venookklusive Erkrankung (VOD)/das hepatische sinusoidale Obstruktionssyndrom wurde gemäss den institutionellen Richtlinien durchgeführt.
Anwendung von Casgevy
Die Patienten erhielten Casgevy in einer medianen (min., max.) Dosis von 8,0 (3,0; 19,7) × 106 CD34+-Zellen/kg als intravenöse Infusion. Allen Patienten wurde vor der Infusion von Casgevy ein Antihistaminikum und ein fiebersenkendes Arzneimittel gegeben.
Nach der Anwendung von Casgevy
G-CSF wurde in den ersten 21 Tagen nach der Infusion von Casgevy nicht empfohlen. Da es sich bei Casgevy um eine autologe Therapie handelt, waren nach der ersten myeloablativen Konditionierung keine immunsuppressiven Arzneimittel erforderlich.
Ergebnisse zur Wirksamkeit – Beta-Thalassämie
Mit 42 Patienten, denen Casgevy verabreicht wurde und die für die primäre Wirksamkeitsanalyse geeignet waren, wurde eine Zwischenanalyse durchgeführt. Das primäre Wirksamkeitsset (primary efficacy set, PES) war definiert als alle Studienteilnehmer, die nach der Infusion von Casgevy mindestens 16 Monate lang nachbeobachtet worden waren. Zum Zeitpunkt der Zwischenanalyse waren 59 Patienten in die Studie aufgenommen und 54 Patienten hatten Casgevy erhalten. Die mediane (min., max.) Gesamtdauer der Nachbeobachtung betrug 22,8 Monate (2,1; 51,1) ab dem Zeitpunkt der Infusion von Casgevy.
Die Wirksamkeit von Casgevy wurde anhand der Auswertung von Patienten mit einer Nachbeobachtungsdauer von mindestens 16 Monaten bewertet. Der primäre Endpunkt war der Anteil von Patienten, die 12 Monate in Folge transfusionsunabhängig waren (TI12). Dies war definiert als Aufrechterhaltung eines gewichteten durchschnittlichen Hb-Werts von ≥9 g/dl ohne Erythrozytentransfusionen für mindestens 12 aufeinanderfolgende Monate zu einem beliebigen Zeitpunkt innerhalb der ersten 24 Monate nach der Infusion von Casgevy in Studie 111. Die Bewertung erfolgte ab 60 Tagen nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung der TDT.
Die Daten zur Wirksamkeit sind in Tabelle 6 und Tabelle 7 zusammengestellt. Tabelle 6 zeigt den primären Endpunkt für (1) alle Patienten, die in Studie 111 aufgenommen wurden, und (2) alle Patienten, die in Studie 111 eine Infusion von Casgevy erhielten. Tabelle 7 zeigt die sekundären Endpunkte von Patienten, die in Studie 111 eine Infusion von Casgevy erhielten.
Tabelle 6: Primärer Wirksamkeitsendpunkt bei Patienten mit TDT
|
Primärer Endpunkt
|
Casgevy
aufgenommene Patienten *
(N=45) †
|
Casgevy
Patienten mit Infusion *
(N=42) ‡
| |
Anteil von Patienten, die TI12 erreichten §
|
|
| |
n (%)
|
39 (86,7 %)
|
39 (92,9 %)
| |
(95 %-KI)
|
(73,2 %; 94,9 %)
|
(80,5 %; 98,5 %)
|
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten, und schliesst Patienten aus, die zum Zeitpunkt der Analyse auf eine Behandlung mit Casgevy warteten, oder Patienten, die für den primären Wirksamkeitsendpunkt noch nicht auswertbar waren.
‡ N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (full analysis set, FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Patienten, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
§ TI12 ist definiert als Aufrechterhaltung eines gewichteten durchschnittlichen Hb-Wertes ≥9 g/dl ohne Erythrozytentransfusionen für mindestens 12 aufeinanderfolgende Monate zu jedem Zeitpunkt nach der Casgevy-Infusion. Die Bewertung von TI12 erfolgt ab 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung der TDT.
Table 7: Sekundäre Wirksamkeitsendpunkte bei Patienten mit TDT
|
Sekundäre Endpunkte
|
Casgevy
Patienten mit Infusion *
(N=42) †
| |
Dauer der Transfusionsunabhängigkeit bei Patienten, die TI12 erreichten (Monate)
|
| |
n
|
39
22,3 (13,5; 48,1)
| |
Median (min., max.)
| |
Gesamt-Hb (g/dl)
|
| |
in Monat 6
|
| |
n
|
42
| |
Mittelwert (SD)
|
12,1 (2,0)
| |
in Monat 24
|
| |
n
|
23
| |
Mittelwert (SD)
|
12,9 (2,4)
| |
HbF (g/dl)
|
| |
in Monat 6
|
| |
n
|
42
| |
Mittelwert (SD)
|
10,8 (2,8)
| |
in Monat 24
|
| |
n
|
23
| |
Mittelwert (SD)
|
11,5 (2,7)
|
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Studienteilnehmer, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
SD: Standardabweichung.
Alle Patienten, die TI12 erreichten, blieben transfusionsunabhängig, mit einer medianen (min., max.) Dauer der Transfusionsunabhängigkeit von 22,3 Monaten (13,5; 48,1) und normalen gewichteten durchschnittlichen Gesamt-Hb-Werten (Mittelwert [SD] 13,2 [1,4] g/dl). Die mediane Zeit (min., max.) bis zur letzten Erythrozytentransfusion bei Patienten, die TI12 erreichten, betrug 28 Tage (11, 91) nach der Infusion von Casgevy. Drei Patienten erreichten TI12 nicht. Bei diesen Patienten kam es im Zeitverlauf zu einer Abnahme der Häufigkeit von Erythrozytentransfusionen und sie erhielten zwischen 12,2 und 21,6 Monaten nach der Casgevy-Infusion keine Transfusionen mehr. Dies entspricht einer insgesamt langsameren Erholung der Hämatopoese.
Abbildung 1 zeigt die Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf für alle Patienten, die Casgevy zur Behandlung von Beta-Thalassämie erhielten.
Abbildung 1: Mittlere Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf von Patienten mit TDT
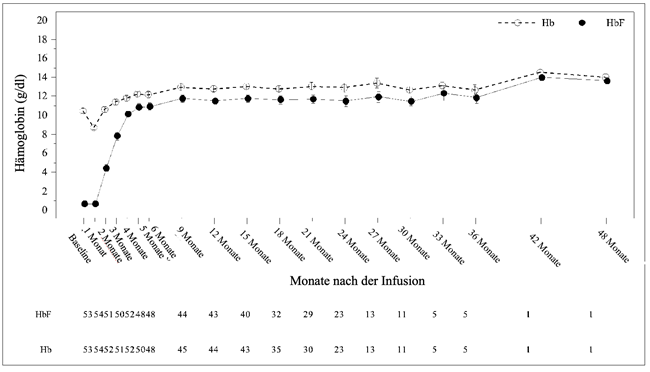
Die Mittelwerte sind in der Linie dargestellt, und die +Standardfehler (standard error, SE)-Werte und -SE-Werte der Mittelwerte sind als Balken bei jedem Besuch dargestellt. Die Anzahl der Patienten mit verfügbaren Werten bei den entsprechenden Besuchen ist unter der Abbildung angegeben.
Bereits im 3. Monat nach der Infusion von Casgevy wurde ein Anstieg der mittleren (SD) Gesamt-Hb- und HbF-Werte beobachtet, und diese Werte stiegen bis zum 6. Monat auf 12,2 (2,0) g/dl bzw. 10,9 (2,7) g/dl weiter an. Nach dem 6. Monat blieben die Gesamt-Hb- und HbF-Werte konstant, wobei HbF ≥88 % des Gesamt-Hb-Werts ausmachte.
Alle Patienten, die in Studie 111 (n = 39) TI12 erreichten, hatten normale (28/39 Patienten, 71,8 %) oder nahezu normal (11/39 Patienten, 28,2 %) gewichtete durchschnittliche Gesamt-Hb-Werte. Die Patienten mit nahezu normal gewichteten durchschnittlichen Gesamt-Hb-Werten umfassten 6 Männer mit gewichteten durchschnittlichen Gesamt-Hb-Werten zwischen < 0,1 und 0,7 g/dl der alters- und geschlechtsabhängigen WHO-Referenzschwelle und 5 Frauen mit gewichteten durchschnittlichen Gesamt-Hb-Werten zwischen < 0,4 und 1,4 g/dl der alters- und geschlechtsabhängigen WHO-Referenzschwelle.
Subgruppenanalysen, in denen die Auswirkungen auf transfusionsbezogene Endpunkte und hämatologische Parameter in den Subgruppen Alter, Geschlecht, Ethnie oder Genotyp untersucht wurden, ergaben keine Unterschiede aufgrund dieser Faktoren.
Sichelzellkrankheit
Studie 121 ist eine noch laufende, offene, multizentrische, einarmige Studie zur Bewertung der Sicherheit und Wirksamkeit von Casgevy bei Erwachsenen und Jugendlichen mit schwerer Sichelzellkrankheit. Nach Abschluss der 24-monatigen Nachbeobachtung in Studie 121 wurden die Patienten eingeladen, an Studie 131 teilzunehmen, einer noch laufenden Langzeitstudie zur Sicherheit und Wirksamkeit.
Die Patienten kamen für die Studie in Frage, wenn sie in den letzten 2 Jahren vor dem Screening mindestens 2 schwere vasookklusive Krisen (VOC) pro Jahr erlitten hatten, die definiert waren als:
·akutes Schmerzereignis, das einen Besuch in einer medizinischen Einrichtung und die Anwendung von Schmerzmitteln (Opioide oder intravenöse nichtsteroidale Entzündungshemmer [NSAR]) oder Erythrozytentransfusionen erfordert,
·akutes Thoraxsyndrom.
·Priapismus mit einer Dauer von > 2 Stunden, der einen Besuch in einer medizinischen Einrichtung erfordert,
·Sequestrierung der Milz.
Patienten mit den Genotypen HbS/S, HbS/β0 und HbS/β+ kamen für die Aufnahme in Frage. Die Patienten benötigten ausserdem einen Lansky- oder Karnofsky-Leistungsscore von ≥80 %.
Patienten wurden von der Studie ausgeschlossen, wenn für sie ein HLA-kompatibler, verwandter HSZ-Spender zur Verfügung stand. Patienten wurden ausgeschlossen, wenn sie eine fortgeschrittene Lebererkrankung, eine unbehandelte Moyamoya-Krankheit in der Vorgeschichte hatten oder eine Moyamoya-Krankheit vorlag, die nach Ansicht des Prüfarztes ein Blutungsrisiko für den Patienten darstellte. Patienten im Alter von 12 bis 16 Jahren mussten eine transkraniale Doppler-Untersuchung (TCD) mit unauffälligem Befund vorweisen, und Patienten im Alter von 12 bis 18 Jahren wurden ausgeschlossen, wenn sie in der Vergangenheit eine auffällige TCD in der mittleren Hirnarterie und der inneren Carotisarterie hatten.
Von den 58 Patienten, die in Studie 121 mit der Mobilisierung begannen, brachen 11 Patienten (19,0 %) die Behandlung nach Beginn der Mobilisierung und Apherese und vor der Verabreichung von Casgevy ab. Sechs Patienten (10,3 %) erreichten nicht die Mindestdosis. Fünf Patienten (8,6 %) brachen die Studie ab wegen mangelnder Compliance, Widerruf der Einwilligungserklärung oder weil sie die Eignungskriterien nicht mehr erfüllten.
Die wichtigsten demographischen Daten und Baseline-Charakteristika sind in Tabelle 8 unten gezeigt, und zwar für (1) alle Patienten, die in Studie 121 aufgenommen wurden, und (2) alle Patienten, die in Studie 121 eine Infusion von Casgevy erhielten.
Tabelle 8: Demographische Daten und Baseline-Charakteristika in Studie 121
|
Demographische Daten und Krankheitsmerkmale
|
Casgevy
aufgenommene Patienten
(N=63) *
|
Casgevy
Patienten mit Infusion
(N=43) †
| |
Alter (Jahre), n (%)
|
|
| |
Erwachsene (≥18 und ≤35 Jahre)
|
50 (79,4 %)
|
31 (72,1 %)
| |
Jugendliche (≥12 und < 18 Jahre)
|
13 (20,6 %)
|
12 (27,9 %)
| |
Alle Altersgruppen (≥12 und ≤35 Jahre)
|
|
| |
Median (min., max.)
|
21 (12, 35)
|
20 (12, 34)
| |
Geschlecht, n (%)
|
|
| |
Männlich
|
36 (57,1 %)
|
24 (55,8 %)
| |
Weiblich
|
27 (42,9 %)
|
19 (44,2 %)
| |
Ethnie, n (%)
|
|
| |
Dunkelhäutig oder afroamerikanisch
|
55 (87,3 %)
|
37 (86,0 %)
| |
Weisshäutig
|
4 (6,3 %)
|
3 (7,0 %)
| |
Sonstige
|
4 (6,3 %)
|
3 (7,0 %)
| |
Genotyp, n (%) ‡
|
|
| |
βS/βS
|
58 (92,1 %)
|
39 (90,7 %)
| |
βS/β0
|
3 (4,8 %)
|
3 (7,0 %)
| |
βS/β+
|
2 (3,2 %)
|
1 (2,3 %)
| |
Annualisierte Rate von schweren VOC in den 2 Jahren vor Studieneintritt (Ereignisse/Jahr)
|
|
| |
Median (min., max.)
|
3,5 (2,0; 19,0)
|
3,5 (2,0; 18,5)
| |
Annualisierte Rate der Hospitalisierungen wegen schwerer VOC in den 2 Jahren vor Studieneintritt (Ereignisse/Jahr)
|
|
| |
Median (min., max.)
|
2,5 (0,0; 11,0)
|
2,5 (0,5; 9,5)
| |
Annualisierte Dauer der Krankenhausaufenthalte wegen schwerer VOC in den 2 Jahren vor Studieneintritt (Ereignisse/Jahr)
|
|
| |
Median (min., max.)
|
15,5 (0,0; 136,5)
|
13,5 (2,0; 136,5)
| |
Annualisierte Einheiten von Erythrozytentransfusionen wegen SCD-bedingter Indikationen in den 2 Jahren vor Studieneintritt (Ereignisse/Jahr)
|
|
| |
Median (min., max.)
|
5,0 (0,0; 86,1)
|
5,0 (0,0; 86,1)
|
* N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten.
† Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 mit 43 Patienten durchgeführt, die Casgevy erhalten hatten, und 4 Patienten, denen eine Casgevy-Infusion bevorstand.
‡ Von Patienten mit anderen Genotypen liegen keine Daten vor.
Mobilisierung und Apherese
Die Patienten erhielten mindestens 8 Wochen vor dem geplanten Beginn der Mobilisierung einen Erythrozytenaustausch oder einfache Transfusionen und bis zum Beginn der myeloablativen Konditionierung weiterhin Transfusionen oder Erythrozytenaustausche. Die HbS-Werte wurden auf < 30 % des Gesamt-Hb-Werts eingestellt, während ein Gesamt-Hb-Wert von ≤11 g/dl aufrechterhalten wurde.
Zur Mobilisierung von Stammzellen für die Apherese wurde den Patienten in Studie 121 Plerixafor in einer geplanten Dosis von 0,24 mg/kg als subkutane Injektion etwa 2 bis 3 Stunden vor jeder geplanten Apherese gegeben. Die Patienten unterzogen sich an bis zu 3 aufeinanderfolgenden Tagen einer Apherese, um die angestrebte Zellentnahme für die Herstellung des Arzneimittels und für die unveränderten CD34+-Reservezellen zu erreichen. Der Median (min., max.) und der Mittelwert (SD) der Mobilisierungs- und Apheresezyklen, die für die Herstellung von Casgevy und für die Gewinnung von CD34+-Reservezellen erforderlich waren, betrugen 2 (1, 6) bzw. 2,21 (1,30).
Konditionierung zur Vorbehandlung
Alle Patienten erhielten vor der Behandlung mit Casgevy eine vollständige myeloablative Konditionierung mit Busulfan. Busulfan wurde an 4 aufeinanderfolgenden Tagen intravenös über einen zentralen Venenkatheter in einer geplanten Anfangsdosis von 3,2 mg/kg/Tag einmal täglich oder 0,8 mg/kg alle 6 Stunden verabreicht. Die Busulfan-Plasmaspiegel wurden durch serielle Blutentnahmen gemessen und die Dosis angepasst, um die Exposition im Zielbereich zu halten. Bei einmal täglicher Anwendung betrug die angestrebte kumulative Busulfan-Exposition über vier Tage 82 mg*h/l (Bereich: 74 bis 90 mg*h/l), entsprechend einer AUC0-24h von 5'000 μM*min (Bereich: 4'500 bis 5'500 μM*min). Bei einer Anwendung alle 6 Stunden betrug die angestrebte viertägige kumulative Busulfan-Exposition 74 mg*h/l (Bereich: 59 bis 89 mg*h/l), was einer AUC0-6h von 1'125 μM*min (Bereich: 900 bis 1'350 μM*min) entspricht.
Alle Patienten erhielten vor Beginn der Konditionierung mit Busulfan eine Prophylaxe gegen Krampfanfälle mit anderen Arzneimitteln als Phenytoin. Phenytoin wurde wegen seiner Induktion von Cytochrom P450 und der daraus resultierenden erhöhten Clearance von Busulfan nicht zur Prophylaxe von Krampfanfällen eingesetzt.
Eine Prophylaxe gegen die hepatische venookklusive Erkrankung (VOD)/das hepatische sinusoidale Obstruktionssyndrom wurde gemäss den regionalen und institutionellen Richtlinien durchgeführt.
Anwendung von Casgevy
Die Patienten erhielten Casgevy in einer medianen (min., max.) Dosis von 4,0 (2,9 - 14,4) × 106 CD34+-Zellen/kg als intravenöse Infusion. Allen Patienten wurde vor der Infusion von Casgevy ein Antihistaminikum und ein fiebersenkendes Arzneimittel gegeben.
Nach der Anwendung von Casgevy
G-CSF wurde in den ersten 21 Tagen nach der Infusion von Casgevy nicht empfohlen. Da es sich bei Casgevy um eine autologe Therapie handelt, waren nach der ersten myeloablativen Konditionierung keine immunsuppressiven Arzneimittel erforderlich.
Ergebnisse zur Wirksamkeit – Sichelzellkrankheit
Mit 29 Patienten, denen Casgevy verabreicht wurde und die für die primäre Wirksamkeitsanalyse geeignet waren, wurde eine Zwischenanalyse durchgeführt. Das primäre Wirksamkeitsset (PES) war definiert als alle Patienten, die nach der Infusion von Casgevy mindestens 16 Monate lang beobachtet worden waren. Zum Zeitpunkt der Zwischenanalyse waren 63 Patienten aufgenommen worden und 43 Patienten hatten Casgevy erhalten. Die mediane (min, max) Gesamtdauer der Nachbeobachtung betrug 17,5 Monate (1,2; 46,2) ab dem Zeitpunkt der Infusion von Casgevy.
Die Wirksamkeit von Casgevy wurde anhand der Auswertung von Patienten mit einer Nachbeobachtungsdauer von mindestens 16 Monaten bewertet. Der primäre Endpunkt war der Anteil von Patienten, die in den ersten 24 Monaten nach der Infusion von Casgevy in Studie 121 mindestens 12 Monate in Folge keine schweren VOC erlitten (VF12, primärer Wirksamkeitsendpunkt). Für diesen Endpunkt war eine schwere VOC definiert als entweder (a) ein akutes Schmerzereignis, das einen Besuch in einer medizinischen Einrichtung und die Verabreichung von Schmerzmitteln (Opioide oder intravenöse nichtsteroidale Entzündungshemmer [NSAR]) oder Erythrozytentransfusionen erforderte, (b) ein akutes Thoraxsyndrom, (c) Priapismus, der mehr als 2 Stunden andauerte und einen Besuch in einer medizinischen Einrichtung erforderte, oder (d) eine Milzsequestration. Der Anteil von Patienten, die in mindestens 12 aufeinanderfolgenden Monaten keinen Krankenhausaufenthalt wegen schwerer VOC benötigten (HF12, wichtiger sekundärer Endpunkt), wurde ebenfalls bewertet. Die Bewertung von VF12 und HF12 begann 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung von SCD.
Die Daten zur Wirksamkeit sind in Tabelle 9 und Tabelle 10 zusammengestellt. Tabelle 9 zeigt den primären Endpunkt für (1) alle Patienten, die in Studie 121 aufgenommen wurden, und (2) alle Patienten, die in Studie 121 eine Infusion von Casgevy erhielten. Tabelle 10 zeigt die sekundären Endpunkte von allen Patienten, die in Studie 121 eine Infusion von Casgevy erhielten.
Tabelle 9: Primärer Wirksamkeitsendpunkt bei Patienten mit SCD
|
Primärer Endpunkt
|
Casgevy
aufgenommene Patienten *
(N=46) †
|
Casgevy
Patienten mit Infusion *
(N=29) ‡
| |
Anteil von Patienten, die VF12 erreichen (%)§
|
|
| |
n (%)
|
28 (60,9 %)
|
28 (96,6 %)
| |
(95 %-KI)
|
(45,4 %; 74,9 %)
|
(82,2 %; 99,9 %)
|
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten, und schliesst Patienten aus, die zum Zeitpunkt der Analyse auf eine Behandlung mit Casgevy warteten, oder Patienten, die zwar behandelt wurden, aber für den primären Wirksamkeitsendpunkt noch nicht auswertbar waren.
‡ N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Patienten, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
§ VF12 ist definiert als keine schweren VOC während mindestens 12 aufeinanderfolgenden Monaten nach der Casgevy-Infusion. Die Bewertung von VF12 beginnt 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach einer Transplantation oder zur Behandlung von SCD.
Tabelle 10: Sekundäre Wirksamkeitsendpunkte bei Patienten mit SCD
|
Sekundäre Endpunkt
|
Casgevy
Patienten mit Infusion *
(N=29) †
| |
Anteil von Patienten ohne Krankenhausaufenthalte wegen schwerer VOC für mindestens 12 Monate (HF12) (%) ‡
|
| |
n (%)
|
29 (100 %)
| |
(95 %-KI)
|
(88,1 %; 100,0 %)
| |
Dauer des Zeitraums ohne schwere VOC bei Patienten, die VF12 erreichten (Monate)
|
| |
n
|
28
| |
Median (min., max.)
|
20,5 (13,5; 43,6)
| |
Anteil von Patienten mit einem HbF-Wert ≥20 %, der mindestens12 Monate lang erhalten blieb (%) §
|
| |
n
|
29
| |
% (95 %-KI)
|
100 % (88,1 %; 100,0 %)
| |
Gesamt-Hb (g/dl)
|
| |
in Monat 6
|
| |
n
|
27
| |
Mittelwert (SD)
|
12,7 (1,7)
| |
in Monat 24
|
| |
n
|
15
| |
Mittelwert (SD)
|
13,1 (1,9)
| |
Anteil von HbF am Gesamt-Hb (%)
|
| |
in Monat 6
|
| |
n
|
27
| |
Mittelwert (SD)
|
43,1 (6,0)
| |
in Monat 24
|
| |
n
|
15
| |
Mittelwert (SD)
|
42,2 (5,5)
|
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl von Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Studienteilnehmer, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
‡ HF12 ist definiert als keine schweren VOC-bedingten stationären Krankenhausaufenthalte während mindestens 12 Monaten nach der Casgevy-Infusion. Die Bewertung von HF12 beginnt 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach einer Transplantation oder zur Behandlung von SCD.
§ Der gleiche Anteil von Patienten erreichte einen HbF-Wert ≥ 20 %, der mindestens 3 oder 6 Monate erhalten blieb.
Abbildung 2 zeigt die Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf für alle Patienten, die Casgevy zur Behandlung der Sichelzellkrankheit erhielten.
Abbildung 2: Mittlere Gesamt-Hb- und HbF-Spiegel (g/dl) im Zeitverlauf bei Patienten mit SCD
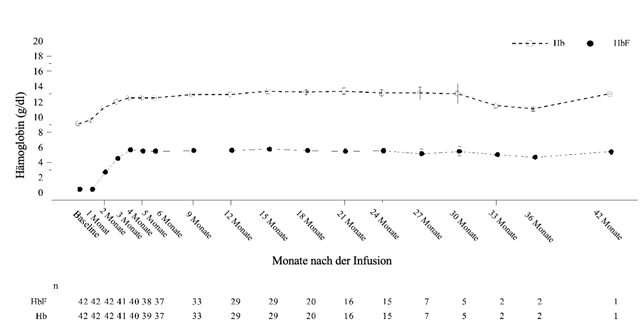
Die Mittelwerte sind in der Linie dargestellt, und die +SE-Werte und -SE-Werte der Mittelwerte sind als Balken bei jedem Besuch dargestellt. Die Anzahl von Patienten mit verfügbaren Werten bei den entsprechenden Besuchen ist unter der Abbildung angegeben.
Bereits im 3. Monat nach der Infusion von Casgevy wurde ein Anstieg des mittleren (SD) Gesamt-Hb-Spiegels beobachtet, der bis zum 6. Monat weiter auf 12,5 (1,8) g/dl anstieg und danach erhalten blieb.
Der mittlere (SD) Anteil von HbF am Hb betrug 43,2 % (7,6 %) im 6. Monat und blieb danach erhalten.
In Übereinstimmung mit dem Anstieg der HbF-Werte lag der mittlere (SD) Anteil der zirkulierenden Erythrozyten, die HbF exprimieren (F-Zellen), bei allen behandelten Patienten im 3. Monat bei 70,4 % (14,0 %) und stieg im Laufe der Zeit bis auf 93,9 % (12,6 %) im 6. Monat an, wobei die Werte danach stabil blieben, was auf eine anhaltende panzelluläre Expression von HbF hinweist.
Subgruppenanalysen, in denen die Auswirkungen auf VOC-bezogene Endpunkte und hämatologische Parameter in den Subgruppen Alter, Geschlecht, Ethnie oder Genotyp untersucht wurden, ergaben keine Unterschiede aufgrund dieser Faktoren.
|


