Eigenschaften/WirkungenATC-Code
R03DX11
Wirkungsmechanismus
Tezepelumab ist ein humaner monoklonaler Antikörper gegen Thymusstroma Lymphopoietin (Anti-TSLP-Antikörper, IgG2λ), der an humanes TSLP bindet und dessen Interaktion mit dem heterodimeren TSLP-Rezeptor verhindert. TSLP, ein aus Epithelzellen stammendes Zytokin, ist an der Entzündungskaskade bei Asthma beteiligt und spielt eine Rolle bei der Auslösung und Persistenz der Atemwegsentzündung bei Asthma. TSLP reguliert die Immunität an der Oberfläche der Atemwegsbarriere, indem es dendritische Zellen, andere angeborene und adaptive Zellen, Entzündungsprozesse sowie die bronchiale Hyperreagibilität beeinflusst. Ausserdem wurde gezeigt, dass TSLP indirekte Wirkungen auf Strukturzellen der Atemwege (z.B. Fibroblasten und glatte Atemwegsmuskulatur) entfalten kann. Bei Asthma induzieren sowohl allergische als auch nichtallergische Auslöser die TSLP-Produktion. Die Blockade von TSLP mit Tezepelumab beeinflusst ein breites Spektrum von Biomarkern und Zytokinen, die mit Entzündungen assoziiert sind (z.B. Eosinophile im Blut, IgE, FeNO, IL-5 und IL-13).
Pharmakodynamik
In NAVIGATOR reduzierte die Verabreichung von Tezepelumab 210 mg s.c. alle 4 Wochen (n = 528) die inflammatorischen Biomarker und Zytokine gegenüber den Ausgangswerten im Vergleich zu Placebo (n = 531) mit einem Einsetzen der Wirkung nach 2 Wochen und anhaltender Reduktion der Zahl der Eosinophilen im Blut, des FeNO-Wertes, der IL-5-Konzentration im Serum sowie der IL-13-Konzentration im Serum bis Woche 52. Tezepelumab führte zu einer zunehmenden Reduktion der Gesamt-IgE-Serumkonzentration, und die Werte nahmen über 52 Behandlungswochen kontinuierlich ab. In PATHWAY wurden ähnliche Ergebnisse beobachtet.
Die Langzeit-Verlängerungsstudie (DESTINATION) zeigt, dass bei Patienten, die mit Tezepelumab behandelt worden sind, die Eosinophilenzahl im Blut, die FeNO-Werte und die Gesamt-IgE-Serumkonzentration bis Woche 104 in ähnlichem Umfang verringert bleiben wie in Woche 52 der NAVIGATOR-Studie.
Eine 28-wöchige randomisierte, doppelblinde, placebokontrollierte, mechanistische Studie der Phase 2 mit Parallelgruppen beurteilte die Wirkung von Tezepelumab 210 mg s.c. alle 4 Wochen auf die Atemwegsentzündung bei Erwachsenen (n = 116) mit unzureichend kontrolliertem mittelschwerem bis schwerem Asthma. Tezepelumab reduzierte die submukosale Eosinophilenzahl um 89 % (Behandlungsende-Baseline-Verhältnis 0,11 [90%-KI 0,06–0,21]) im Vergleich zu einer Reduktion um 25 % bei Placebo (0,75 [90%-KI 0,41–1,38]). Die Reduktion war unabhängig von den Ausgangswerten für Eosinophile im Blut, FeNO, Serum-IL-5, Serum-IL-13 und Allergiestatus (bestimmt mittels perennierendem aeroallergenspezifischem IgE).
Immunogenität
In NAVIGATOR wurden bei 26 (4,9 %) von 527 Patienten, die mit Tezepelumab im empfohlenen Dosierungsschema behandelt wurden, zu jedem Zeitpunkt während der 52-wöchigen Studiendauer Anti-Drug-Antikörper (ADA) festgestellt. Von diesen 26 Patienten entwickelten 10 Patienten (1,9 % der mit Tezepelumab behandelten Patienten) unter der Behandlung auftretende Antikörper, und 1 Patient (0,2 % der mit Tezepelumab behandelten Patienten) entwickelte neutralisierende Antikörper. Die ADA-Titer waren im Allgemeinen niedrig und oft nur vorübergehend messbar. Es gab zu wenige Patienten mit behandlungsbedingten ADAs oder neutralisierenden Antikörpern, um die Auswirkungen auf Pharmakokinetik, Pharmakodynamik, Wirksamkeit und Sicherheit von TEZSPIRE zu beurteilen.
Das Immunogenitätsprofil von Tezepelumab wurde im Rahmen von DESTINATION bei den ursprünglich in die NAVIGATOR-Studie eingeschlossenen Patienten mit schwerem Asthma (n = 415) über 76 Behandlungswochen aufrechterhalten und blieb auch über 104 Wochen bei den Patienten erhalten, die anschliessend in die verlängerte Nachbeobachtungsphase von DESTINATION aufgenommen wurden (n = 289).
Klinische Wirksamkeit
Die Wirksamkeit von TEZSPIRE wurde in drei randomisierten, doppelblinden, placebokontrollierten klinischen Studien mit Parallelgruppen (PATHWAY, NAVIGATOR und SOURCE) über eine Dauer von 48 bis 52 Wochen bei insgesamt 1761 Patienten im Alter ab 12 Jahren untersucht. In allen drei Studien war für die Aufnahme der Patienten kein Mindestausgangswert für Eosinophile im Blut oder andere Biomarker der Entzündung (z.B. FeNO oder IgE) erforderlich.
PATHWAY war eine 52-wöchige Exazerbationsstudie, in die insgesamt 550 Patienten (im Alter ab 18 Jahren) mit schwerem, unkontrolliertem Asthma für die Behandlung mit TEZSPIRE 70 mg s.c. alle 4 Wochen, TEZSPIRE 210 mg s.c. alle 4 Wochen, TEZSPIRE 280 mg s.c. alle 2 Wochen oder Placebo randomisiert wurden. Die Patienten mussten 2 oder mehr Asthma-Exazerbationen, die eine orale oder systemische Behandlung mit Kortikosteroiden erforderten, oder 1 Asthma-Exazerbation, die zu einer stationären Aufnahme führte, in den letzten 12 Monaten gehabt haben.
NAVIGATOR war eine 52-wöchige Exazerbationsstudie, in die insgesamt 1061 Patienten (Erwachsene und Jugendliche ab 12 Jahren) mit schwerem, unkontrolliertem Asthma für die Behandlung mit TEZSPIRE 210 mg s.c. alle 4 Wochen oder Placebo randomisiert wurden. Die Patienten mussten 2 oder mehr Asthma-Exazerbationen, die eine orale oder systemische Behandlung mit Kortikosteroiden erforderten oder zu einer stationären Aufnahme führten, in den letzten 12 Monaten gehabt haben.
In PATHWAY und NAVIGATOR mussten die Patienten einen Score von mindestens 1,5 im Asthma Control Questionnaire 6 (ACQ-6) beim Screening sowie einen reduzierten Ausgangswert der Lungenfunktion (präbronchodilatatorische FEV1 unter 80 % des Sollwertes bei Erwachsenen und unter 90 % des Sollwertes bei Jugendlichen) aufweisen. Die Patienten mussten unter regelmässiger Behandlung mit mittleren oder hohen Dosen von inhalativen Kortikosteroiden (ICS) und mindestens einer zusätzlichen Asthma-Kontrolltherapie mit oder ohne orale Kortikosteroide (OCS) stehen. Die Patienten setzten ihre Asthma-Basistherapie während der gesamten Dauer der Studien fort.
SOURCE war eine 48-wöchige Studie zur OCS-Reduktion, in die insgesamt 150 Asthmapatienten (ab 18 Jahren) randomisiert wurden, die eine Behandlung mit täglichem OCS (7,5 mg bis 30 mg pro Tag) zusätzlich zur regelmässigen Anwendung von hochdosierten ICS und langwirksamen Beta-Agonisten (LABA) mit oder ohne zusätzliche Asthma-Kontrolltherapie benötigten. Die Patienten mussten mindestens eine Exazerbation in den letzten 12 Monaten gehabt haben. Nach einer bis zu 8-wöchigen OCS-Optimierungsphase erhielten die Patienten Tezepelumab 210 mg s.c. alle 4 Wochen oder Placebo für insgesamt 48 Wochen. Die Patienten erhielten während der Studie weiterhin ihre bisherige Asthma-Basismedikation; ihre OCS-Dosis wurde jedoch während der OCS-Reduktionsphase alle 4 Wochen (Woche 4 bis 40) reduziert, solange die Asthmakontrolle aufrechterhalten wurde. Danach folgte eine 8-wöchige Erhaltungsphase, während der die Patienten die bis Woche 40 erreichte OCS-Dosis beibehalten sollten.
Die demografischen Daten und Ausgangscharakteristika dieser 3 Studien sind in Tabelle 2 unten aufgeführt.
|
Tabelle 2: Demografische Daten und Ausgangsmerkmale in den Asthmastudien
| |
|
PATHWAY
n = 550
|
NAVIGATOR
n = 1059
|
SOURCE
n = 150
| |
Mittleres Alter (Jahre) (SD)
|
52 (12)
|
50 (16)
|
53 (12)
| |
Weiblich (%)
|
66
|
64
|
63
| |
Kaukasisch (%)
|
92
|
62
|
84
| |
Schwarz oder Afroamerikanisch (%)
|
3
|
6
|
1
| |
Asiatisch (%)
|
3
|
28
|
15
| |
Hispanisch oder Latino (%)
|
1
|
15
|
16
| |
Nie geraucht (%)
|
81
|
80
|
74
| |
Anwendung hochdosierter ICS (%)
|
49
|
75
|
99
| |
OCS-Anwendung (%)
|
9
|
9
|
100
| |
Mittlere Anzahl an Exazerbationen im vorherigen Jahr (SD)
|
2,4 (1,2)
|
2,8 (1,4)
|
2,0 (1,5)
| |
Mittlere Dauer des Asthmas (Jahre) (SD)
|
17 (12)
|
22 (16)
|
23 (15)
| |
Mittlerer Ausgangswert in % des FEV1-Sollwertes (SD)
|
60 (13)
|
63 (18)
|
54 (18)
| |
Mittlere postbronchodilatatorische FEV1-Reversibilität (%) (SD)
|
23 (20)
|
15 (15)
|
15 (15)
| |
Mittlerer Ausgangswert der EOS-Zahl im Blut (Zellen/µl) (SD)
|
371 (353)
|
340 (403)
|
242 (180)
| |
Positiver Allergiestatus (%)a
|
43
|
64
|
39
| |
Mittlerer FeNO (ppb) (SD)
|
35 (39)
|
44 (41)
|
41 (39)
| |
Mittlerer ACQ-6 (SD)
|
2,7 (0,8)
|
2,8 (0,8)
|
2,5 (1,1)
|
a Positiver Allergiestatus definiert als positives Serum-IgE-Ergebnis, das spezifisch ist für eines der perennierenden Aeroallergene im FEIA-Profil.
ACQ-6: Asthma Control Questionnaire 6; EOS: Eosinophile; FEIA: Fluoreszenz-Enzymimmunoassay; FeNO: Fractional Exhaled Nitric Oxide (exhalierte Stickstoffmonoxid-Fraktion); FEV1: forcierte exspiratorische Einsekundenkapazität; ICS: inhalatives Kortikosteroid; IgE: Immunglobulin E; OCS: orales Kortikosteroid; ppb: Parts per billion; SD: Standardabweichung.
Die im Folgenden zusammengefassten Ergebnisse beziehen sich auf das empfohlene Dosierungsschema von Tezepelumab 210 mg s.c. alle 4 Wochen.
Exazerbationen
Der primäre Endpunkt in PATHWAY und NAVIGATOR war die Rate an klinisch signifikanten Asthma-Exazerbationen über 52 Wochen. Klinisch signifikante Asthma-Exazerbationen waren definiert als Asthma-Verschlimmerung, die die Anwendung oder Dosissteigerung von oralen oder systemischen Kortikosteroiden für mindestens 3 Tage oder eine einzelne Depotinjektion von Kortikosteroiden erforderte, und/oder Aufsuchen der Notaufnahme mit notwendiger Anwendung von oralen oder systemischen Kortikosteroiden und/oder stationäre Aufnahme.
In PATHWAY und NAVIGATOR kam es bei Patienten unter der Behandlung mit TEZSPIRE zur signifikanten Reduktion der annualisierten Rate an Asthma-Exazerbationen im Vergleich zu Placebo (Tabelle 3). Ausserdem traten bei Patienten unter TEZSPIRE weniger Exazerbationen auf, die das Aufsuchen einer Notaufnahme und/oder eine stationäre Aufnahme erforderten, als unter Placebo. Ferner war der Anteil der Patienten, die während der 52-wöchigen Behandlung keine Asthma-Exazerbation erlitten, unter TEZSPIRE grösser als unter Placebo.
|
Tabelle 3: Rate klinisch signifikanter Exazerbationen über 52 Wochen in Studie 1 und Studie 2
| |
|
PATHWAY
|
NAVIGATOR
| |
TEZSPIRE
n = 137
|
Placebo
n = 138
|
TEZSPIRE
n = 528
|
Placebo
n = 531
| |
Annualisierte Asthma-Exazerbationsrate
| |
Rate
|
0,20
|
0,72
|
0,93
|
2,10
| |
Ratenverhältnis (95%-KI)
|
0,29 (0,16–0,51)
|
0,44 (0,37–0,53)
| |
p-Wert
|
< 0,001
|
< 0,001
|
Die Rate der Exazerbationen, die eine Krankenhauseinweisung/Notaufnahme erforderten, betrug bei Patienten, die TEZSPIRE erhielten, im Vergleich zu Placebo 0,03 versus 0,18 (Ratenverhältnis 0,15; 95%-KI 0,04–0,58, p=0,005) für PATHWAY und 0,06 versus 0,28 (Ratenverhältnis 0,21; 95%-KI 0,12–0,37, p<0,001) für NAVIGATOR. Ähnliche Ergebnisse zeigten sich bei der Reduktion der Rate von Exazerbationen, die einen alleinigen Krankenhausaufenthalt erforderten (0,02 versus 0,14 [Ratenverhältnis 0,14; 95%-KI 0,03–0,71, p=0,017]) für PATHWAY und 0,03 versus 0,19 (Ratenverhältnis 0,15; 95%-KI 0,07–0,33, p<0,001) für NAVIGATOR.
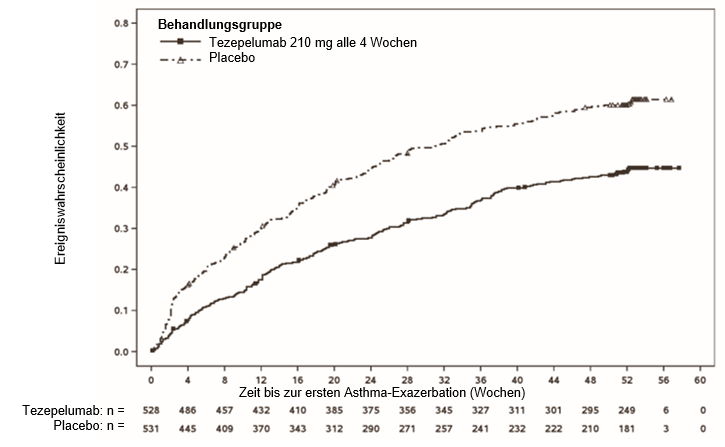
In NAVIGATOR war die Zeit bis zur ersten Exazerbation bei den Patienten unter TEZSPIRE länger als unter Placebo (Abbildung 1). In PATHWAY wurden ähnliche Ergebnisse beobachtet.
Abbildung 1: Kumulative Kaplan-Meier-Inzidenzkurven für die Zeit bis zur ersten Exazerbation über 52 Wochen, NAVIGATOR
Untergruppenanalyse
In NAVIGATOR zeigte TEZSPIRE eine Reduktion der Rate an Asthma-Exazerbationen sowohl in der Gesamtpopulation als auch in der Untergruppe von Patienten mit Ausgangswerten der Eosinophilen im Blut von < 300 Zellen/µl.
Abbildung 2: Verhältnis der annualisierten Asthma-Exazerbationsrate über 52 Wochen für verschiedene Ausgangswerte von Biomarkern in NAVIGATOR
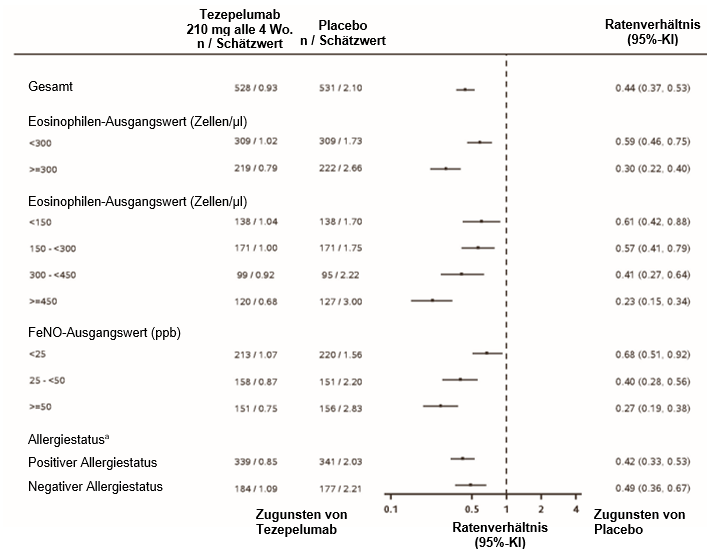
a Allergiestatus definiert als Serum-IgE-Ergebnis, das spezifisch ist für eines der perennierenden Aeroallergene im FEIA-Profil.
Lungenfunktion
Die Veränderung der FEV1 gegenüber dem Ausgangswert wurde als sekundärer Endpunkt in PATHWAY und NAVIGATOR beurteilt. Im Vergleich zu Placebo führte TEZSPIRE in beiden Studien zu einer klinisch bedeutsamen Verbesserung der mittleren Veränderung der FEV1 gegenüber dem Ausgangswert (Tabelle 4).
|
Tabelle 4: Mittlere Veränderung der präbronchodilatatorischen FEV1 vs. Ausgangswert nach 52 Wochen in PATHWAY und NAVIGATOR
| |
|
PATHWAY
|
NAVIGATOR
| |
TEZSPIRE
n = 133*
|
Placebo
n = 138*
|
TEZSPIRE
n = 527*
|
Placebo
n = 531*
| |
LS-Mittelwert-Veränderung vs. Ausgangswert (l)
|
0,08
|
-0,06
|
0,23
|
0,10
| |
LS-Mittelwert-Differenz zu Placebo (l) (95%-KI)
|
0,13 (0,03–0,23)
|
0,13 (0,08–0,18)
| |
p-Wert
|
0,009 †*
|
< 0,001
|
* Anzahl der Patienten, die zur vollständigen Analyse (VA) mit mindestens einer Veränderung gegenüber dem Ausgangswert beitragen.
†* Nomineller p-Wert
KI: Konfidenzintervall; FEV1: Forciertes Exspirationsvolumen in einer Sekunde: LS, Least Square.
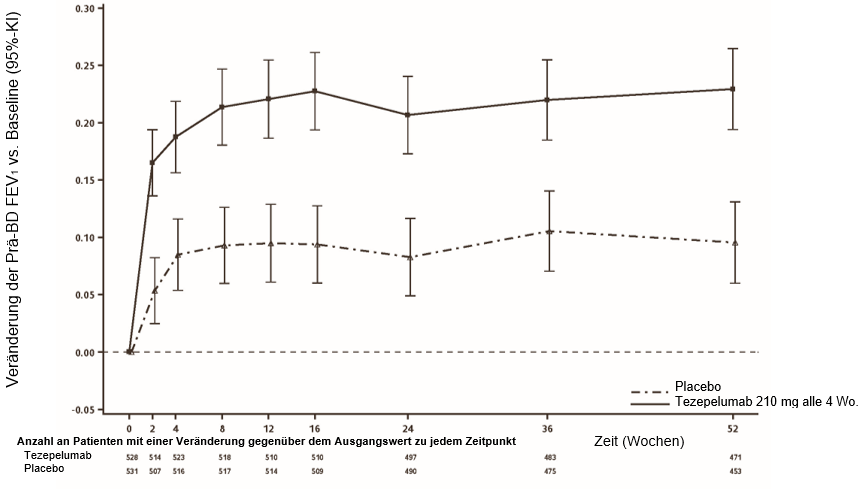
In der NAVIGATOR-Studie wurde bereits 2 Wochen nach Behandlungsbeginn eine Verbesserung des FEV1-Wertes festgestellt, die bis Woche 52 anhielt (Abbildung 3).
Abbildung 3: Mittlere Veränderung (95%-KI) der präbronchodilatatorischen FEV1 (L) vs. Ausgangswert in NAVIGATOR
Patientenselbstbeurteilungen
In PATHWAY und NAVIGATOR wurden die Veränderungen der Scores des Asthma Control Questionnaire 6 (ACQ-6) und des Standardised Asthma Quality of Life Questionnaire für ein Alter ab 12 Jahren [AQLQ(S)+12] gegenüber den Ausgangswerten als sekundäre Endpunkte untersucht. Die Ergebnisse für NAVIGATOR sind in Tabelle 5 aufgeführt. In beiden Studien wurden Verbesserungen des ACQ-6 und des AQLQ(S)+12 bereits 2 bzw. 4 Wochen nach Beginn der Verabreichung von TEZSPIRE beobachtet, die bis Woche 52 anhielten.
In beiden Studien zeigten unter TEZSPIRE mehr Patienten als unter Placebo eine klinisch bedeutsame Verbesserung des ACQ-6 und des AQLQ(S)+12. Eine klinisch bedeutsame Verbesserung (Responderrate) von ACQ-6 und AQLQ(S)+12 war definiert als Verbesserung des Scores um 0,5 am Studienende. In Studie 2 lag die ACQ-6-Responderrate für TEZSPIRE bei 86 % im Vergleich zu 77 % für Placebo (Odds Ratio = 1,99; 95%-KI 1,43–2,76) und die AQLQ(S)+12-Responderrate für TEZSPIRE bei 78 % im Vergleich zu 72 % für Placebo (Odds Ratio = 1,36; 95%-KI 1,02–1,82). In PATHWAY wurden ähnliche Ergebnisse beobachtet.
Die wöchentlichen mittleren Scores im Asthma Symptom Diary (ASD) wurden in NAVIGATOR ebenfalls als sekundärer Endpunkt beurteilt. Der Schweregrad von pfeifender Atmung, Kurzatmigkeit, Husten und Brustenge wurde zweimal täglich (morgens und abends) gemessen. Nächtliches Aufwachen und Aktivität wurden täglich beurteilt. Der ASD-Gesamtscore wurde als Mittelwert aus 10 Items berechnet. Unter der Behandlung mit TEZSPIRE erreichten mehr Patienten als unter Placebo eine klinisch bedeutsame Verbesserung des ASD-Scores. Eine klinisch bedeutsame Verbesserung (Responderrate) war definiert als Verbesserung des Scores um mindestens 0,5 am Studienende. Die ASD-Responderrate für TEZSPIRE betrug 58 % im Vergleich zu 51 % für Placebo (Odds Ratio = 1,68; 95%-KI 1,12–2,53).
|
Tabelle 5: Ergebnisse in NAVIGATOR für AQLQ(s)+12, ACQ-6 und ASD nach 52 Wochen
| |
|
n*
|
LS-Mittelwert-Veränderung vs. Ausgangswert
|
Unterschied zu Placebo (95%-KI)
|
p-Wert
| |
AQLQ(S)+12-Gesamtscore
| |
TEZSPIRE
|
524
|
1,48
|
0,33
(0,20–0,47)
|
< 0,001
| |
Placebo
|
526
|
1,14
| |
ACQ-6-Score
| |
TEZSPIRE
|
527
|
-1,53
|
-0,33 (-0,46–-0,20)
|
< 0,001
| |
Placebo
|
531
|
-1,20
| |
ASD
| |
TEZSPIRE
|
525
|
-0,70
|
-0,11 (-0,19–-0,04)
|
0,004
| |
Placebo
|
531
|
-0,59
|
* Anzahl der Patienten, die zur vollständigen Analyse (VA) mit mindestens einer Veränderung gegenüber dem Ausgangswert beitragen.
ACQ-6: Asthma Control Questionnaire 6; AQLQ(S)+12: Standardisierter Fragebogen zur Asthma-Lebensqualität für 12 Jahre und älter; ASD: Asthma Symptom Diary; KI: Konfidenzintervall; LS: Least square.
Reduktion von oralen Kortikosteroiden
Die Auswirkung von TEZSPIRE auf die Reduktion der Erhaltungstherapie mit OCS wurde in SOURCE untersucht. Der primäre Endpunkt war die kategorisierte prozentuale Reduktion der finalen OCS-Dosis nach 48 Wochen gegenüber dem Ausgangswert (≥90 % Reduktion, ≥75 % bis < 90 % Reduktion, ≥50 % bis < 75 % Reduktion, > 0 % bis < 50 % Reduktion und keine Veränderung oder eine Erhöhung) unter Aufrechterhaltung der Asthmakontrolle. Im Vergleich zu Placebo erreichten unter TEZSPIRE numerisch mehr Patienten eine Reduktion der OCS-Erhaltungsdosis gegenüber dem Ausgangswert ohne Verlust der Asthmakontrolle (kumulative Odds Ratio = 1,28; 95%-KI 0,69–2,35); der Unterschied war jedoch nicht statistisch signifikant.
Abbildung 4: Prozentuale Verringerung der endgültigen OCS-Tagesdosis in Woche 48 bei verschiedenen Baseline-Biomarkern, SOURCE
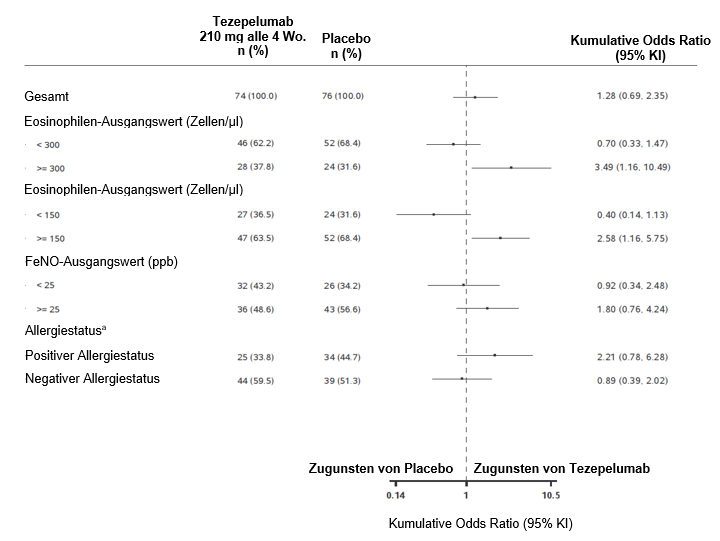
a Allergiestatus definiert als Serum-IgE-Ergebnis, das spezifisch ist für eines der perennierenden Aeroallergene im FEIA-Profil.
Die sekundären Endpunkte in SOURCE, darunter die annualisierte Rate der Asthma-Exazerbationen, die Veränderung der präbronchodilatatorischen FEV1 gegenüber dem Ausgangswert sowie ACQ-6 und AQLQ(S)+12, zeigten mit TEZSPIRE keine statistisch signifikanten Unterschiede im Vergleich zu Placebo.
|




