Eigenschaften/WirkungenATC-Code
C02KX06
Wirkungsmechanismus
Sotatercept, ein rekombinantes Fusionsprotein des Activin-Rezeptors Typ IIA-Fc (ActRIIA-Fc), ist ein Activin-Signalinhibitor, der an Activin A und andere Liganden der TGF-β-Superfamilie bindet. Dadurch verbessert Sotatercept das Gleichgewicht zwischen der proproliferativen (ActRIIA/Smad2/3-vermittelten) und der antiproliferativen (BMPRII/Smad1/5/8-vermittelten) Signalübertragung, um die Gefässproliferation zu modulieren.
Pharmakodynamik
In einer klinischen Phase-II-Studie wurde der pulmonale Gefässwiderstand (PVR) bei PAH Patienten nach einer 24-wöchigen Behandlung mit Sotatercept beurteilt. Die Abnahme des PVR gegenüber dem Ausgangswert war in den Gruppen mit 0,7 mg/kg und 0,3 mg/kg Sotatercept signifikant grösser als in der Placebogruppe. Der placebobereinigte mittlere Unterschied (least square, LS) gegenüber dem Ausgangswert betrug -269,4 dyn•s/cm5 (95%-KI: -365,8; -173,0) in der Gruppe mit 0,7 mg/kg Sotatercept und -151,1 dyn•s/cm5 (95%-KI: -249,6; -52,6) in der Gruppe mit 0,3 mg/kg Sotatercept. In STELLAR war die Abnahme des PVR gegenüber dem Ausgangswert in der Gruppe mit 0,7 mg/kg Sotatercept ebenfalls signifikant grösser als in der Placebogruppe (siehe «Klinische Wirksamkeit»).
In PAH Rattenmodellen verringerte ein Sotatercept-Analogon die Expression von proinflammatorischen Markern an der Pulmonalarterienwand, reduzierte die Rekrutierung von Leukozyten, hemmte die Proliferation von Endothel- und glatten Muskelzellen und förderte die Apoptose in den erkrankten Gefässen. Diese zellulären Veränderungen gingen mit dünneren Gefässwänden, einer Umkehrung des arteriellen und rechtsventrikulären Remodellings und einer verbesserten Hämodynamik einher.
Klinische Wirksamkeit
Die Wirksamkeit von Winrevair wurde in der Studie STELLAR bei erwachsenen Patienten mit PAH beurteilt. STELLAR war eine globale, doppelblinde, placebokontrollierte, multizentrische klinische Parallelgruppenstudie, in der 323 Patienten mit PAH (WHO-Gruppe 1, Funktionsklasse II oder III) randomisiert im Verhältnis 1:1 einer Behandlung mit Winrevair (Zieldosis 0,7 mg/kg) (n = 163) oder Placebo (n = 160) subkutan einmal alle 3 Wochen erhielten.
Die demographischen und klinischen Baseline-Charakteristika waren in der Winrevair- und der Placebogruppe generell vergleichbar. Studienteilnehmende waren Erwachsene mit einem medianen Alter von 48,0 Jahren (Bereich: 18 bis 82 Jahre); das mediane Gewicht betrug 68 kg (Bereich: 38,0 bis 141,3 kg); 89,2% waren weiss und 79,3% waren nicht hispanisch oder lateinamerikanisch; 79,3% waren weiblich. Die häufigsten PAH Ätiologien waren: idiopathische PAH (58,5%), hereditäre PAH (18,3%) und PAH assoziiert mit Bindegewebserkrankungen (14,9 %). Die mediane Zeit zwischen PAH Diagnose und Screening betrug 8,76 Jahre. Die meisten Teilnehmenden erhielten entweder eine dreifache (61,3%) oder eine zweifache (34,7%) PAH Backgroundtherapie, und mehr als ein Drittel (39,9%) erhielten Prostacyclin-Infusionen. Der Anteil von Teilnehmenden mit PAH der WHO-Funktionsklasse II (48,6%) bzw. WHO-Funktionsklasse III (51,4%) war in beiden Gruppen ähnlich. Von der Teilnahme an der STELLAR-Studie ausgeschlossen waren Patienten mit diagnostizierter PAH in Zusammenhang mit einer Infektion mit dem Humanen Immundefizienz-Virus (HIV), PAH in Zusammenhang mit portaler Hypertonie, Schistosomiasis-assoziierter PAH und pulmonaler venookklusiver Erkrankung.
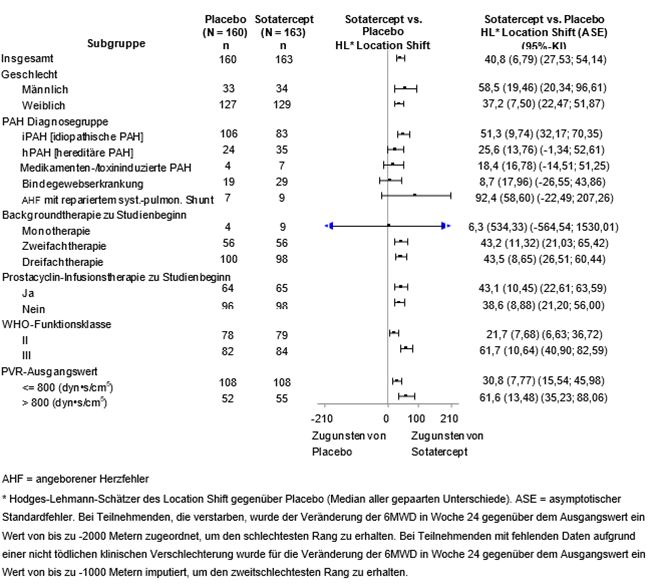
Primärer Wirksamkeitsendpunkt war die Veränderung der 6-Minuten-Gehstrecke (6MWD) in Woche 24 im Vergleich zum Ausgangswert. In der Winrevair-Behandlungsgruppe betrug die placebobereinigte Veränderung der 6MWD in Woche 24 gegenüber dem Ausgangswert im Median 40,8 Meter (95%-KI: 27,5; 54,1; p < 0,001). Der Median der placebobereinigten Veränderungen der 6MWD in Woche 24 wurde auch in Subgruppen beurteilt (siehe Abbildung 1).
Abbildung 1: Veränderung der 6-Minuten-Gehstrecke (Meter) in Woche 24 gegenüber dem Ausgangswert in Subgruppen
Die klinische Verbesserung war ein vordefinierter Endpunkt, der anhand des Anteils der Patienten gemessen wurde, die in Woche 24 im Vergleich zum Ausgangszeitpunkt alle drei der folgenden Kriterien erfüllten: Verbesserung der 6MWD (Zunahme um ≥30 m), Verbesserung des N-terminalen pro-B-Typ-natriuretischen Peptids (NT-proBNP) (Abnahme des NT-proBNP um ≥30% oder Aufrechterhaltung/Erreichen eines NT-proBNP-Spiegels < 300 ng/l) und Verbesserung der WHO-Funktionsklasse oder Erhaltung der WHO-Funktionsklasse II. Das Fortschreiten der Erkrankung wurde gemessen als Zeit bis zum Tod oder bis zum ersten Auftreten eines Ereignisses einer klinischen Verschlechterung. Zu den Ereignissen einer klinischen Verschlechterung zählten eine Listung zur Lungen- und/oder Herztransplantation infolge einer Verschlechterung, die Notwendigkeit der Einleitung einer Rescue-Therapie mit einer zugelassenen PAH Backgroundtherapie oder die Notwendigkeit einer Dosiserhöhung der Prostacyclin-Infusionen um ≥10%, die Notwendigkeit einer Vorhofseptostomie, eine Hospitalisierung wegen einer sich verschlechternden PAH (≥24 Stunden) oder eine Verschlechterung der PAH (Verschlechterung der WHO-Funktionsklasse und Abnahme der 6MWD um ≥15%, wobei beide Ereignisse gleichzeitig oder zu unterschiedlichen Zeitpunkten eintreten können). Ereignisse einer klinischen Verschlechterung sowie Todesfälle wurden erfasst, bis der letzte Patient die Visite in Woche 24 absolviert hatte (Daten bis zum data cutoff; mediane Dauer der Exposition 33,6 Wochen).
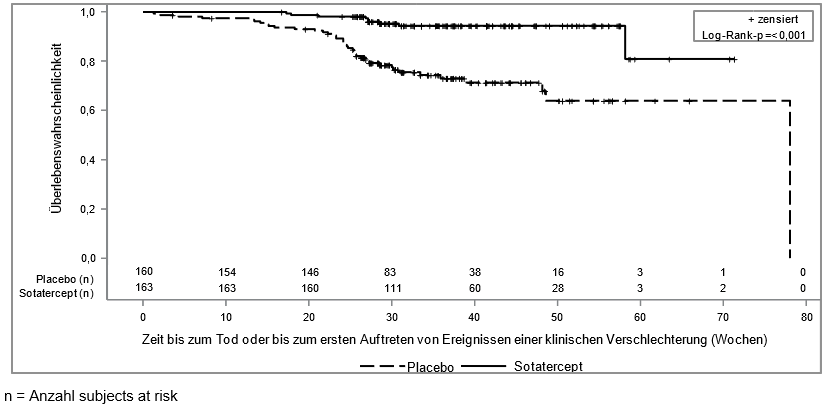
Bei den mit Winrevair behandelten Patienten kam es im Vergleich zu den Patienten der Placebogruppe zu einer statistisch signifikanten klinischen Verbesserung, einer Verbesserung der WHO-Funktionsklasse und zu einem verzögerten Fortschreiten der Erkrankung, einschliesslich eines geringeren Risikos von Tod und Hospitalisierung (siehe Tabelle 4 und Abbildung 2).
In Woche 24 zeigten 38,9% der Patienten unter Sotatercept eine Verbesserung der MCI gegenüber 10,1% in der Placebogruppe (p<0,001). Der mediane Behandlungsunterschied im PVR zwischen der Sotatercept- und der Placebogruppe betrug -234,6 dyn*s/cm5 (95% KI: -288,4, -180,8; p<0,001). Der mediane Behandlungsunterschied im NT-proBNP zwischen der Sotatercept- und der Placebogruppe betrug -441,6 pg/ml (95% KI: -573,54, -309,61; p<0,001). Eine Verbesserung der Funktionsklasse gegenüber dem Ausgangswert trat bei 29% der Patienten in der Sotatercept-Gruppe gegenüber 13,8% in der Placebogruppe auf (p<0,001).
Tabelle 4: Tod oder Ereignisse einer klinischen Verschlechterung
|
|
Placebo
(N = 160)
|
Winrevair
(N = 163)
| |
Gesamtanzahl der Patienten, die verstarben oder mindestens ein Ereignis einer klinischen Verschlechterung erlitten, n (%)
|
42 (26,3)
|
9 (5,5)
| |
Bewertung von Tod oder erstem Auftreten von Ereignissen einer klinischen Verschlechterung*, n (%)
|
|
| |
Tod
|
6 (3,8)
|
2 (1,2)
| |
Verschlechterungsbedingte Listung zur Lungen- und/oder Herztransplantation
|
1 (0,6)
|
1 (0,6)
| |
Notwendigkeit der Einleitung einer Rescue-Therapie mit einer zugelassenen PAH Therapie oder Notwendigkeit einer Dosiserhöhung der Prostacyclin-Infusionen um ≥10 %
|
17 (10,6)
|
2 (1,2)
| |
Notwendigkeit einer Vorhofseptostomie
|
0 (0,0)
|
0 (0,0)
| |
PAH spezifische Hospitalisierung (≥24 Stunden)
|
7 (4,4)
|
0 (0,0)
| |
Verschlechterung der PAH†
|
15 (9,4)
|
4 (2,5)
| |
* Bei einem Patienten können für das erste Ereignis einer klinischen Verschlechterung mehr als eine Bewertung dokumentiert sein. Bei 3 Patienten unter Placebo und 0 Patienten unter Sotatercept wurden für ihr erstes Ereignis einer klinischen Verschlechterung mehr als eine Bewertung dokumentiert.
† Verschlechterung der PAH ist definiert als Auftreten beider folgender Ereignisse zu einem beliebigen Zeitpunkt, auch wenn diese zu verschiedenen Zeiten auftraten, verglichen mit den Ausgangswerten: (a) Verschlechterung der WHO-Funktionsklasse (II zu III, III zu IV, II zu IV usw.); und (b) Abnahme der 6MWD um ≥15% (bestätigt durch zwei 6-Minuten-Gehtests im Abstand von mindestens 4 Stunden, aber höchstens einer Woche).
N = Anzahl Patienten in der FAS-Population; n = Anzahl Patienten in der Kategorie. Prozentanteile berechnet als (n/N)•100.
|
Abbildung 2: Kaplan-Meier-Kurve der Zeit bis zum Tod oder bis zum ersten Auftreten von Ereignissen einer klinischen Verschlechterung
|


