Eigenschaften/WirkungenATC-Code
C09XX01
Wirkungsmechanismus
Sparsentan ist ein dualer Endothelin-Angiotensin-Rezeptorantagonist.
Es ist ein einzelnes Molekül, das als hochaffiner, doppelt wirkender Antagonist sowohl des ETAR als auch des AT1R fungiert. Endothelin-1 über ETAR und Angiotensin II über AT1R vermitteln Prozesse, die durch hämodynamische Wirkungen und Mesangialzellproliferation, die erhöhte Expression und Aktivität proinflammatorischer und profibrotischer Mediatoren, Podozytenschädigung und oxidativen Stress zur Progression von IgAN führen. Sparsentan hemmt die Aktivierung sowohl von ETAR als auch AT1R und verringert dadurch die Proteinurie und verlangsamt das Fortschreiten der Nierenerkrankung.
Pharmakodynamik
In einer randomisierten positiv- und placebokontrollierten Studie mit gesunden Teilnehmern bewirkte Sparsentan eine leichte QTcF-Verlängerung mit einem maximalen Effekt von 8,8 ms (90-%-KI: 5,9; 11,8) bei 800 mg und 8,1 ms (90-%-KI: 5,2; 11,0) bei 1600 mg. In einer zusätzlichen Studie mit gesunden Teilnehmern mit einer Sparsentan-Exposition von mehr als dem 2-Fachen der empfohlenen Höchstdosis für den Menschen trat keine relevante QTcF-Verlängerung auf; der maximale Effekt lag bei 8,3 (6,69; 9,90) ms. Daher ist es unwahrscheinlich, dass Sparsentan eine klinisch relevante Wirkung auf die QT-Verlängerung hat.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Sparsentan wurden in PROTECT mit Patienten mit IgAN untersucht.
PROTECT ist eine randomisierte, doppelblinde (110 Wochen), aktiv kontrollierte, multizentrische, globale Phase-III-Studie mit Patienten mit IgAN. An der Studie nahmen Patienten im Alter von ≥ 18 Jahren teil, darunter 15 (8 %) mit Sparsentan behandelte Patienten im Alter von > 65 Jahren, mit einer eGFR ≥ 30 ml/min/1,73 m2 und einer Gesamtproteinausscheidung im Urin von ≥ 1,0 g/Tag. Vor der Studienteilnahme hatten die Patienten mindestens 3 Monate lang die maximal verträgliche Dosis eines ACE-Hemmers und/oder eines ARB eingenommen. Die ACE-Hemmer- und/oder ARB-Therapie wurde vor der Verabreichung von Sparsentan abgesetzt. Patienten mit einem Kalium-Ausgangswert von mehr als 5,5 mmol/l wurden ausgeschlossen.
Insgesamt wurden 404 Patienten randomisiert und erhielten Sparsentan (n = 202) oder Irbesartan (n = 202). Die Behandlung wurde mit 200 mg Sparsentan einmal täglich oder 150 mg Irbesartan einmal täglich begonnen. Nach 14 Tagen sollte die Dosis je nach Verträglichkeit auf die empfohlene Dosis von 400 mg Sparsentan einmal täglich oder 300 mg Irbesartan einmal täglich titriert werden. Die Dosisverträglichkeit wurde definiert als systolischer Blutdruck > 100 mmHg und diastolischer Blutdruck > 60 mmHg nach 2 Wochen sowie keine UE (z. B. Verschlechterung des Ödems) oder Laborbefunde (z. B. Serumkalium > 5,5 mEq/l [5,5 mmol/l]). Inhibitoren des RAAS- oder Endothelin-Systems waren während der Studie verboten. Andere Klassen von Antihypertensiva waren je nach Bedarf zugelassen, um den Zielblutdruck zu erreichen. Die Behandlung mit Immunsuppressiva war während der Studie nach dem Ermessen des Forschers zulässig.
Die Ausgangsdaten bzgl. eGFR und Proteinurie waren zwischen den Behandlungsgruppen vergleichbar. Die Gesamtpopulation hatte eine mittlere (SD) eGFR von 57 (24) ml/min/1,73 m2 und ein medianes Urinprotein/Kreatinin(UP/K)-Verhältnis von 1,24 g/g (Interquartilsabstand: 0,83; 1,77). Das Durchschnittsalter betrug 46 Jahre (Spanne 18 bis 76 Jahre); 70 % waren männlich, 67 % Weiss, 28 % Asiatisch, 1 % Schwarz oder Afroamerikanisch und 3 % gehörten einer anderen Ethnie an.
Die primäre (Interims-)Proteinurieanalyse wurde 36 Wochen nach Randomisierung von etwa 280 Teilnehmern durchgeführt, um zu bestimmen, ob der Behandlungseffekt des primären Wirksamkeitsendpunktes, die Veränderung des UP/K in Woche 36 gegenüber dem Ausgangswert, statistisch signifikant ist. Der primäre Endpunkt der Studie, die Veränderung des UP/K-Verhältnisses gegenüber dem Ausgangswert in Woche 36, wurde erreicht. Der geometrische Mittelwert des UP/K in Woche 36 betrug 0,62 g/g in der Sparsentan-Gruppe gegenüber 1,07 g/g in der Irbesartan-Gruppe. Der geometrische Mittelwert der kleinsten Quadrate (LS, von engl. least squares) für die prozentuale Veränderung von UP/K gegenüber dem Ausgangswert in Woche 36 betrug -49,8 % (95-%-Konfidenzintervall [KI]): -54,98, -43,95) in der Sparsentan-Gruppe gegenüber -15,1 % (95-%-KI: -23,72, -5,39) in der Irbesartan-Gruppe (p<0,0001; (Abbildung 1). Bei der endgültigen Analyse zeigte Sparsentan eine schnelle und nachhaltige Wirkung der antiproteinurischen Behandlung über einen Zeitraum von 2 Jahren mit einem einem geometrischen Mittelwert des UP/K in Woche 110 von 0,64 g/g in der Sparsentan-Gruppe gegenüber 1,09 g/g in der Irbesartan-Gruppe, was eine mittlere Reduzierung von 43 % gegenüber dem Ausgangswert (95 % KI: -49,75, -34,97) im Vergleich zu nur 4,4 % bei einer Behandlung mit Irbesartan (95 % KI: -15,84, 8,70) darstellt. Eine Verbesserung der Proteinurie-Reduktion wurde mit Sparsentan bereits nach 4 Wochen fortlaufend beobachtet und hielt bis Woche 110 an (Abbildung 1).
Abbildung 1: Prozentuale Veränderung gegenüber dem Ausgangswert des Verhältnisses Urinprotein/Kreatinin nach Visite (PROTECT)
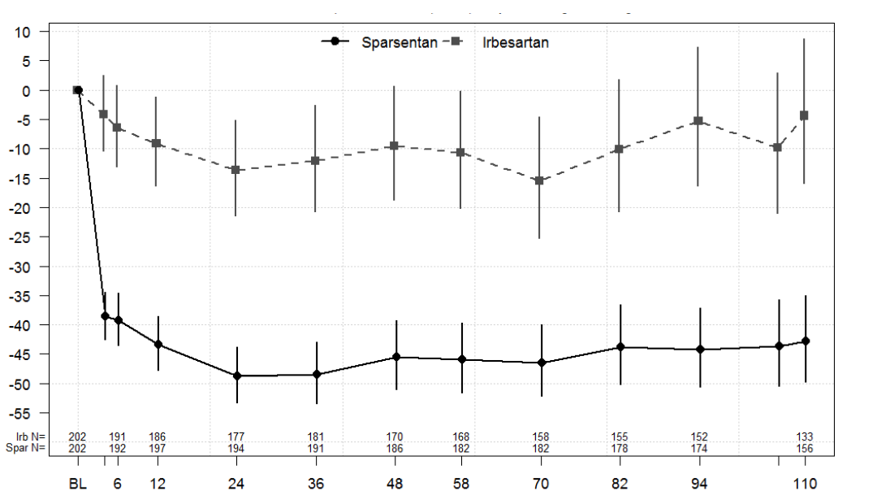
Hinweise: Der bereinigte geometrische Mittelwert der kleinsten Quadrate für das Verhältnis UP/K im Vergleich zum Ausgangswert basierte auf einem Längsschnittmodell mit wiederholten Messungen, das nach eGFR- und Proteinurie-Screening stratifiziert war, und wird als prozentuale Veränderung zusammen mit dem jeweiligen 95-%-KI angegeben. Die Analyse umfasst UP/K-Daten während der Doppelblindphase von allen Patienten, die randomisiert wurden und mindestens eine Dosis des Studienmedikaments erhielten. Der Ausgangswert wurde definiert als die letzte nicht fehlende Beobachtung vor der und einschliesslich der Verabreichung der ersten Dosis.
Abkürzungen: KI = Konfidenzintervall; eGFR = geschätzte glomeruläre Filtrationsrate; LS = kleinste Quadrate (von engl. least squares); UP/K = Verhältnis Urinprotein/Kreatinin.
Geschätzte GFR
Zum Zeitpunkt der bestätigenden Analyse betrug die Verbesserung der dauerhaften eGFR-Senkung in zwei Jahren (ab 6 Wochen) bei Sparsentan 1,1 ml/min/1,73 m2 pro Jahr im Vergleich zu Irbesartan [95-%-KI -0,07, 2,12; p = 0,037), und die entsprechende Verbesserung der gesamten eGFR-Senkung (ab Baseline) betrug 1,0 ml/min/1,73 m2 in zwei Jahren (95-%-KI: -0,03, 1,94; p = 0,058). Die absolute Veränderung der eGFR gegenüber dem Ausgangswert nach 2 Jahren betrug -5,8 ml/min/1,73 m2 (95-%-KI: -7,38, -4,24) für Sparsentan im Vergleich zu -9,5 ml/min/1,73 m2 (95-%-KI: -11,17, -7,89) für Irbesartan.
Zusätzliche Informationen
In zwei grossen randomisierten, kontrollierten Studien (ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) und VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes)) wurde die kombinierte Anwendung von ACE-Hemmern und Angiotensin-II-Rezeptorblockern untersucht. Die Studie ONTARGET wurde bei Patienten mit kardiovaskulären oder cerebrovaskulären Erkrankungen oder Diabetes mellitus Typ 2 in der Anamnese durchgeführt, bei denen Hinweise auf Endorganschäden vorlagen. VA NEPHRON-D war eine Studie für Patienten mit Diabetes mellitus Typ 2 und diabetischer Nephropathie. Diese Studien zeigten keine signifikante positive Wirkung auf renale und/oder kardiovaskuläre Ergebnisse und Mortalität, wobei im Vergleich zur Monotherapie ein erhöhtes Risiko für Hyperkaliämie, akute Nierenschädigung und/oder Hypotonie beobachtet wurde. Angesichts ihrer ähnlichen pharmakodynamischen Eigenschaften sind diese Ergebnisse auch für andere ACE-Hemmer und Angiotensin-II-Rezeptorblocker relevant. Daher sollte bei Patienten mit diabetischer Nephropathie keine Begleittherapie mit ACE-Hemmern und Angiotensin-II-Rezeptorblockern durchgeführt werden. Die Studie ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) war darauf ausgelegt, den Nutzen einer Hinzunahme von Aliskiren zu einer Standardtherapie mit einem ACE-Hemmer oder einem Angiotensin-II-Rezeptorblocker bei Patienten mit Diabetes mellitus Typ 2und chronischer Nierenerkrankung, kardiovaskulärer Erkrankung oder beidem zu prüfen. Die Studie wurde aufgrund eines erhöhten Risikos unerwünschter Ergebnisse vorzeitig beendet. In der Aliskiren-Gruppe traten zahlenmässig häufiger Fälle von kardiovaskulärem Tod und Schlaganfall auf als in der Placebogruppe, und unerwünschte Ereignisse sowie schwerwiegende unerwünschte Ereignisse von Interesse (Hyperkaliämie, Hypotonie und Nierenfunktionsstörungen) wurden in der Aliskiren-Gruppe häufiger gemeldet als in der Placebogruppe.
|

