Eigenschaften/WirkungenATC-Code
R03DX05
Wirkungsmechanismus
Omalizumab ist ein rekombinanter, humanisierter monoklonaler Antikörper, der selektiv an das menschliche Immunglobulin E (IgE) bindet. Es handelt sich um einen IgG1-kappa-Antikörper mit einem humanen Grundgerüst, dessen komplementaritäts-bestimmende Region muriner Herkunft ist und an humanes IgE bindet.
Pharmakodynamik
Patienten mit allergischem Asthma
Durch die Bindung an freies IgE verhindert Omalizumab somit die Bindung von IgE an den hochaffinen FcεRI- Rezeptor (hochaffiner IgE-Rezeptor). Die Menge an freiem IgE, das zum Auslösen der allergischen Kaskade verfügbar ist, wird reduziert. Die Behandlung atopischer Patienten mit Omalizumab reduzierte die Anzahl an FcεRI-Rezeptoren auf den Basophilen. Ausserdem wurde die in vitro Histaminausschüttung aus Basophilen, welche von mit Xolair behandelten Patienten gewonnen wurden, nach Allergenstimulation im Vergleich zu den Werten vor der Behandlung um ca. 90% gesenkt.
Durch die Behandlung mit Xolair kommt es zu einer verminderten Eosinophilenzahl im Blut und Gewebe sowie zu einem Rückgang der Entzündungsmediatoren. Zu diesen zählen auch Interleukine (IL-4, IL-5 und IL-13). In klinischen Studien wurden die freien IgE-Werte im Serum innerhalb 1 h nach der ersten Dosis dosisabhängig reduziert und zwischen den einzelnen Dosen behalten.
Die durchschnittliche Reduktion des freien IgE war bei Anwendung der empfohlenen Dosen grösser als 96%. Die Gesamt-IgE-Werte im Serum (d.h. gebunden und ungebunden) stiegen nach der ersten Dosis aufgrund der Bildung von Omalizumab-IgE-Komplexen an. Die Omalizumab-IgE-Komplexe haben im Vergleich zum freien IgE eine langsamere Eliminationsrate. 16 Wochen nach der ersten Dosis waren die Gesamt-IgE-Werte 5 mal höher als die Werte bei der Vorbehandlung, wobei Standard-Assays zur Bestimmung verwendet wurden. Nach Abbruch der Xolair-Therapie waren der Anstieg des Gesamt-IgE und die Reduktion des freien IgE reversibel, ohne dass ein Rebound-Effekt der IgE-Werte nach Auswaschen von Omalizumab beobachtet wurde. Gesamt-IgE-Werte wie sie vor der Therapie waren, wurden innerhalb eines Jahres nach Abbruch der Therapie mit Xolair nicht erreicht.
Die Auswirkungen von Omalizumab auf IgE-tragende B-Zellen und auf die langfristige Regulation der allergenspezifischen IgE-Synthese sind unklar.
Patienten mit Nasenpolypen
In klinischen Studien an Patienten mit Nasenpolypen führte die Behandlung mit Xolair zu einer Reduktion der Werte für das freie IgE im Serum und einer Zunahme der Werte für das Gesamt-IgE im Serum, ähnlich den Beobachtungen an Patienten mit allergischem Asthma.
Patienten mit chronischer spontaner Urtikaria (CSU)
Es bestehen mehrere Theorien für die Ätiologie der CSU, darunter eine Theorie, die einen autoimmunen Ursprung annimmt. Bei einigen Patienten mit CSU wurden Autoimmunantikörper gegen IgE und dessen Rezeptor, FcεRI, aus dem Serum isoliert. Diese Autoantikörper können basophile Granulozyten oder Mastzellen aktivieren und dadurch die Freisetzung von Histamin auslösen.
Eine Hypothese über den Wirkungsmechanismus von Omalizumab bei CSU besagt, dass Omalizumab die Spiegel an freiem IgE im Blut und dadurch auch in der Haut erniedrigt. Dies führt zu einer Herunterregulation von IgE-Oberflächenrezeptoren, wodurch die Downstream-Signalübertragung über den FcεRI-Signalweg vermindert wird, was eine Hemmung der Zellaktivierung und der Entzündungsreaktion bewirkt. In der Folge werden die Häufigkeit und der Schweregrad der Symptome der CSU vermindert. Eine andere Hypothese besagt, dass die Verminderung der Spiegel an freiem IgE eine rasche und unspezifische Desensibilisierung kutaner Mastzellen zur Folge hat. Die Herunterregulation von FcεRI könnte die Aufrechterhaltung dieser Reaktion unterstützen.
In klinischen Studien bei Patienten mit CSU bewirkte die Behandlung mit Omalizumab eine dosisabhängige Reduktion der Spiegel an freiem IgE und eine Zunahme der Gesamt-IgE-Werte im Serum, ähnlich den Beobachtungen bei Patienten mit allergischem Asthma. Die maximale Suppression des freien IgE wurde 3 Tage nach der ersten subkutanen Dosis beobachtet. Nach Mehrfachdosierung einmal alle 4 Wochen blieben die Spiegel an freiem IgE im Serum vor Dosisgabe zwischen den Wochen 12 und 24 der Behandlung stabil. Der Gesamt-IgE-Wert im Serum stieg nach der ersten Dosis infolge einer Bildung von Omalizumab-IgE-Komplexen, welche einer langsameren Eliminationsrate als freies IgE unterliegen. Nach Mehrfachdosierung von 75 mg bis 300 mg einmal alle 4 Wochen betrugen die mittleren Gesamt-IgE-Werte im Serum vor Dosisgabe in Woche 12 das Zwei- bis Dreifache der Werte vor Beginn der Behandlung und blieben zwischen Woche 12 und 24 der Behandlung stabil. Nach Beendigung der Behandlung mit Xolair, während einer 16-wöchigen behandlungsfreien Nachbeobachtungsphase, stiegen die Spiegel an freiem IgE während Gesamt-IgE-Werte abnahmen, beide in Richtung der Werte vor der Behandlung.
Klinische Wirksamkeit
Allergisches Asthma
Erwachsene und Jugendliche (≥12 Jahre)
Wirksamkeit und Sicherheit von Xolair wurden in einer 28-wöchigen Placebo-kontrollierten pivotalen Studie (Studie 5) bei 419 Patienten mit schwerem allergischem Asthma im Alter zwischen 12 und 79 Jahren nachgewiesen, die eine eingeschränkte Lungenfunktion (angenommener Forced Expiratory Volume/1 second: FEV1 40-80%) aufwiesen und deren Symptomatik auf Behandlung mit >1'000 µg Beclomethason-Dipropionat (oder gleichwertig) und langwirkenden Beta2-Agonisten schlecht ansprach. Die zur Studie zugelassenen Patienten hatten im Verlauf des letzten Jahres mehrere Asthma-Exazerbationen erlitten, deren Behandlung eine systemische Gabe von Kortikosteroiden erforderte, wurden stationär im Spital behandelt oder hatten wegen schwerer Asthma-Exazerbation trotz kontinuierlicher Behandlung mit hochdosierten inhalierten Kortikosteroiden und langwirkenden Beta2-Agonisten eine Notfallbehandlung beansprucht. Xolair oder Placebo wurden subkutan als Zusatztherapie zu >1'000 µg Beclomethason-Dipropionat (oder gleichwertig) und langwirkenden Beta2-Agonisten verabreicht. Weiterhin erhielten die Patienten eine Dauertherapie von oralen Kortikosteroiden (22%), Theophyllin (27%) und Leukotrienantagonisten (35%). Während der Behandlungsphase wurde die begleitende Asthmatherapie nicht geändert.
Den primären Endpunkt stellt die Rate der Asthma-Exazerbationen dar, bei denen eine Akut-Behandlung mit systemischen Kortikosteroiden nötig war. Omalizumab reduzierte die Rate der Asthma-Exazerbationen um 19% (p=0.153). Weitere Auswertungen, die statistische Signifikanz (p=0.05) zu Gunsten von Xolair zeigten, beinhalten die Reduzierung von schweren Exazerbationen (bei denen die Lungenfunktion des Patienten auf weniger als 60% des persönlichen Bestwertes reduziert war und systemische Kortikosteroide benötigt wurden) und Asthma-bedingtes Aufsuchen einer Notfallambulanz (einschliesslich Hospitalisierung, Notfallambulanz und nicht geplante Arztbesuche) sowie Verbesserung der ärztlichen Gesamtbewertung der Wirksamkeit der Behandlung, der Lebensqualität bezüglich Asthma (AQL), der Asthmasymptome und der Lungenfunktion.
In einer Subgruppen-Analyse bei Patienten mit einem IgE-Wert von ≥76 I.E./ml vor der Behandlung war ein klinisch bedeutsamer Nutzen von Xolair wahrscheinlicher. Bei diesen Patienten der Studie 1 reduzierte Xolair die Anzahl der Asthma-Exazerbationen um 40% (p=0.002). Zusätzlich zeigten im Studienprogramm zu Xolair bei schwerem Asthma in der Population mit einem IgE-Gesamtwert ≥76 I.E./ml mehr Patienten ein klinisch relevantes Ansprechen (s. Tabelle 6).
In vier weiteren grossen Placebo-kontrollierten unterstützenden Studien mit einer Dauer von 28 bis 52 Wochen mit 1'722 Erwachsenen und Jugendlichen (Studien 3, 4, 5, 6) wurden die Wirksamkeit und Verträglichkeit von Xolair bei Patienten mit schwerem persistierenden Asthma untersucht. Die meisten Patienten waren ungenügend kontrolliert, erhielten jedoch weniger Begleitmedikation für Asthma als Patienten in Studie 1 oder 2. Die Studien 3–5 hatten Exazerbationen als primären Endpunkt, wogegen Studie 6 primär das Einsparen von inhalativen Kortikosteroiden ermittelte.
In der Studie 2 wurden Sicherheit und Wirksamkeit von Omalizumab an 312 Patienten mit schwerem allergischem Asthma, welche der Population der Studie 1 entsprachen, nachgewiesen. Behandlung mit Xolair in dieser open-label-Studie führte zu 61% Reduktion der klinisch signifikanten Asthma-Exazerbations-Rate verglichen mit der aktuellen Asthma-Therapie alleine.
In den Studien 3, 4 und 5 hatten die mit Xolair behandelten Patienten jeweils Reduktionen der Asthma-Exazerbations-Rate um 37.5% (p=0.027), 40.3% (p<0.001) und 57.6% (p<0.001) im Vergleich zu Placebo.
In Studie 6 waren signifikant mehr Patienten mit schwerem allergischem Asthma in der Lage ohne Verschlechterung der Asthma-Kontrolle mit Xolair ihre Fluticason-Dosis auf ≤500 µg/Tag zu reduzieren (60.3%), im Vergleich zur Placebo-Gruppe (45.8%, p<0.05).
|
Tabelle 6: Resultate der Studie
| |
|
Gesamtpopulation der Studie
| |
|
Xolair
N=209
|
Placebo
N=210
| |
Asthma-Exazerbationen
|
|
| |
Häufigkeit pro 28 Wochen
|
0.74
|
0.92
| |
% Reduktion, p-Wert für Verhältnis der Häufigkeiten
|
19.4%, p = 0.153
| |
Schwere Asthma-Exazerbationen
|
|
| |
Häufigkeit pro 28 Wochen
|
0.24
|
0.48
| |
% Reduktion, p-Wert für Verhältnis der Häufigkeiten
|
50.1%, p = 0.002
| |
Notfallambulanzbesuche
|
|
| |
Häufigkeit pro 28 Wochen
|
0.24
|
0.43
| |
% Reduktion, p-Wert für Verhältnis der Häufigkeiten
|
43.9%, p = 0.038
| |
Ärztliche Gesamtbewertung
|
|
| |
% Responder*
|
60.5%
|
42.8%
| |
p-Wert**
|
<0.001
| |
AQL***-Verbesserungen
|
|
| |
% Patienten mit einer Verbesserung ≥0.5
|
60.8%
|
47.8%
| |
p-Wert
|
0.008
| |
* merkliche Verbesserung oder vollständige Kontrolle
** p-Wert für die allgemeine Verteilung der Bewertung
*** Asthma Quality of Life
|
Kinder im Alter von 6 bis <12 Jahren
Die grundlegenden Daten für die Sicherheit und Wirksamkeit von Xolair in der Altersgruppe von 6 bis <12 Jahren stammen aus einer randomisierten, doppelblinden, Placebo-kontrollierten multizentrischen Studie (Studie 7).
Studie 7 war eine Placebo-kontrollierte Studie mit einer spezifischen Subgruppe (N=235) von Patienten nach derzeitiger Indikation, die mit hoch dosierten inhalativen Kortikosteroiden (≥500 µg Fluticason-Äquivalent/Tag) und langwirksamen Beta-Agonisten behandelt wurden.
Eine klinisch signifikante Exazerbation wurde definiert als eine vom Prüfarzt klinisch beurteilte Verschlechterung der Asthmasymptome, die eine Verdopplung der Ausgangsdosis des inhalativen Kortikosteroids für mindestens 3 Tage und/oder einer Notfallbehandlung mit systemischem (oral oder intravenös) Kortikosteroid für mindestens 3 Tage erforderte.
Bei der spezifischen Subgruppe von Patienten, die hoch dosierte inhalative Kortikosteroide erhielten, zeigte die Omalizumab-Gruppe eine statistisch signifikant niedrigere Rate an Asthma-Exazerbationen als die Placebo-Gruppe. Nach 24 Wochen wurde bei der Betrachtung der Differenzen der Raten für die Omalizumab-Patienten eine um 34% (Verhältnis der Raten 0.662, p=0.047) geringere Rate im Verhältnis zu Placebo erzielt. Im zweiten doppelblinden, 28-wöchigen Behandlungszeitraum wurde bei der Betrachtung der Differenzen der Raten für die Omalizumab-Patienten eine um 63% (Verhältnis der Raten 0.37, p<0.001) geringere Rate im Verhältnis zu Placebo erzielt.
Während der 52-wöchigen, doppelblinden Behandlung (bestehend aus der 24-wöchigen Phase mit konstanter Steroid-Dosis und der 28-wöchigen Phase mit angepasster Steroid-Dosis) zeigten die Differenzen der Raten zwischen den Behandlungsgruppen eine 50%ige (Verhältnis der Raten 0.504, p<0.001) Abnahme der Exazerbationen für Omalizumab-Patienten.
Die Omalizumab-Gruppe zeigte am Ende der 52-wöchigen Behandlung eine grössere Abnahme des Gebrauchs von Beta-Agonisten als Notfallmedikation als die Placebo-Gruppe, auch wenn der Unterschied zwischen den Behandlungsgruppen nicht statistisch signifikant war. In der Gesamtauswertung der Wirksamkeit nach 52-wöchiger, doppelblinder Behandlung war in der Untergruppe der schwer erkrankten Patienten mit hoch dosierten inhalativen Kortikosteroiden und gleichzeitigen langwirksamen Beta-Agonisten der Anteil der Patienten mit «exzellentem» Behandlungserfolg bei der Omalizumab-Gruppe höher als bei der Placebo-Gruppe. Die Anteile der Patienten mit «moderatem» oder «schlechtem» Behandlungserfolg waren in der Omalizumab-Gruppe geringer als bei der Placebo-Gruppe. Die Unterschiede zwischen den Gruppen waren statistisch signifikant (p <0.001). Bei den subjektiven Patientenbewertungen ihrer Lebensqualität gab es keine Unterschiede zwischen der Omalizumab-Gruppe und der Placebo-Gruppe.
Nasenpolypen
Die Sicherheit und die Wirksamkeit von Xolair wurden in zwei randomisierten, multizentrischen, doppelblinden, placebokontrollierten klinischen Studien (Studie 1, N=138; Studie 2, N=127) an Patienten mit chronischer Rhinosinusitis und Nasenpolypen bewertet. Die Patienten erhielten Xolair oder Placebo subkutan alle 2 oder 4 Wochen, wobei die Dosierung und die Anwendungshäufigkeit den Angaben in den Tabellen 7 und 8 entsprachen (siehe «Dosierung/Anwendung»). Ausserdem erhielten alle Patienten während der gesamten Studie eine Hintergrundtherapie mit Mometason intranasal. Eine vorangegangene sinonasale Operation bzw. eine vorherige systemische Behandlung mit Kortikosteroiden waren für die Aufnahme in die Studien nicht erforderlich. Die Studienteilnehmer erhielten 24 Wochen lang Xolair oder Placebo und darauf folgte eine 4-wöchige behandlungsfreie Nachbeobachtungsphase. Die demografischen Angaben und die Baseline-Charakteristika einschliesslich der allergischen Komorbiditäten sind in Tabelle 7 dargestellt.
Tabelle 7 Demografische Angaben und Baseline-Charakteristika in den Nasenpolypen-Studien
|
Parameter
|
Nasenpolypenstudie 1
N=138
|
Nasenpolypenstudie 2
N=127
| |
Mittleres Alter in Jahren (SD)
|
51.0 (13.2)
|
50.1 (11.9)
| |
% männlich
|
63.8
|
65.4
| |
Patienten mit Anwendung systemischer Kortikosteroide im Vorjahr (%)
|
18.8
|
26.0
| |
Mittlerer bilateraler endoskopischer NPS-Score* (SD), Spanne: 0-8
|
6.2 (1.0)
|
6.3 (0.9)
| |
Mittlerer Score für die Nasenkongestion (NC)* (SD), Spanne: 0-3
|
2.4 (0.6)
|
2.3 (0.7)
| |
Mittlerer Score für den Geruchssinn* (SD) Spanne: 0-3
|
2.7 (0.7)
|
2.7 (0.7)
| |
Mittlerer SNOT-22-Gesamtscore* (SD) Spanne: 0-110
|
60.1 (17.7)
|
59.5 (19.3)
| |
Mittlere Eosinophilenzahl im Blut (Zellen/µl) (SD)
|
346.1 (284.1)
|
334.6 (187.6)
| |
Mittleres Gesamt-IgE in IU/ml (SD)
|
160.9 (139.6)
|
190.2 (200.5)
| |
Asthma (%)
|
53.6
|
60.6
| |
Leicht (%)
|
37.8
|
32.5
| |
Mittelschwer (%)
|
58.1
|
58.4
| |
Schwer (%)
|
4.1
|
9.1
| |
Aspirin-exazerbierte Atemwegserkrankung (%)
|
19.6
|
35.4
| |
Allergische Rhinitis
|
43.5
|
42.5
|
SD= Standardabweichung; NPS= Nasenpolypenscore; SNOT-22 = Fragebogen zum Sino-Nasal Outcome Test mit 22 Fragen; IgE = Immunoglobulin E; IU= internationale Einheiten.
Beim NPS, beim NCS und bei den Scores für den Geruchssinn, das Postnasal-Drip-Syndrom und das Naselaufen sowie beim SNOT-22-Score weisen höhere Punktwerte auf eine stärkere Ausprägung der Erkrankung hin.
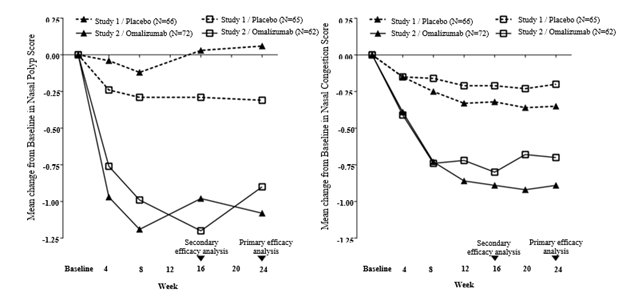
Die ko-primären Endpunkte waren der bilaterale Nasenpolypenscore (NPS) und der gemittelte tägliche Score für die Nasenkongestion (NCS), jeweils bestimmt in Woche 24. Der NPS wurde mittels Endoskopie zur Baseline und zu vorab festgelegten Zeitpunkten bestimmt (Spanne: 0-4 pro Nasenloch), und aus diesen Werten wurde der Gesamt-NPS berechnet (Spanne: 0 = bester Wert bis 8 = schlechtester Wert). Die Nasenkongestion wurde täglich anhand der NCS-Skala bewertet (Spanne: 0 = bester Wert bis 3 = schlechtester Wert). Die Patienten mussten vor der Randomisierung trotz der Verwendung von Mometason intranasal einen NPS ≥5 und einen Wochenmittelwert für den NCS > 1 aufweisen. Der mittlere NPS zur Baseline war in beiden Studien zwischen den beiden Behandlungsgruppen ausgeglichen.
Sowohl in Studie 1 als auch in Studie 2 der Nasenpolypenstudien zeigten die Patienten, die Xolair erhielten, in Woche 24 sowohl beim NPS als auch beim über die Woche gemittelten NCS eine statistisch signifikant stärkere Verbesserung gegenüber der Baseline als die Patienten, die Placebo erhielten (siehe Tabelle 8).
Die stärkeren Verbesserungen beim NPS und beim NCS in der Xolair-Gruppe im Vergleich zur Placebo-Gruppe wurden in beiden Studien bereits bei der ersten Beurteilung in Woche 4 beobachtet, wie aus Abbildung 1 ersichtlich ist. In Woche 4 betrug die Differenz der Kleinste-Quadrate- (LS-) Mittelwerte für die Veränderung gegenüber der Baseline beim NPS in der Xolair-Gruppe im Vergleich zur Placebo-Gruppe -0.92 (95% KI: -1.37, -0.48) in Studie 1 und -0.52 (95% KI: -0.94, -0.11) in Studie 2. Beim NCS betrug die Differenz der LS-Mittelwerte in der Xolair-Gruppe für die Veränderung gegenüber der Baseline in Woche 4 im Vergleich mit der Placebo-Gruppe -0.25 (95% KI: -0.46, -0.04) in Studie 1 und -0.26 (95% KI: -0.45, -0.07) in Studie 2. Die statistischen Tests waren zu diesem Zeitpunkt jedoch nicht präspezifiziert.
Tabelle 8 Veränderung gegenüber der Baseline in Woche 24 beim Nasenpolypenscore und beim über 7 Tage gemittelten Score für die Nasenkongestion in den Nasenpolypenstudien 1 und 2
|
|
Nasenpolypenstudie 1
|
Nasenpolypenstudie 2
| |
|
Placebo
|
Xolair
|
Placebo
|
Xolair
| |
N
|
66
|
72
|
65
|
62
| |
Nasenpolypenscore
|
|
|
|
| |
Baseline Mittelwert
|
6.32
|
6.19
|
6.09
|
6.44
| |
LS-Mittelwert für die Veränderung gegenüber der Baseline bis Woche 24
|
0.06
|
-1.08
|
-0.31
|
-0.90
| |
Differenz der LS-Mittelwerte
vs. Placebo
|
-1.14
|
-0.59
| |
95% KI der Differenz
|
-1.59, -0.69
|
-1.05, -0.12
| |
p-Wert
|
<0.0001
|
0.0140
| |
Über 7 Tage gemittelter Wert des täglichen Scores für die Nasenkongestion
|
|
|
|
| |
Baseline Mittelwert
|
2.46
|
2.40
|
2.29
|
2.26
| |
LS-Mittelwert für die Veränderung gegenüber der Baseline bis Woche 24
|
-0.35
|
-0.89
|
-0.20
|
-0.70
| |
Differenz der LS-Mittelwerte
vs. Placebo
|
-0.55
|
-0.50
| |
95% KI für die Differenz
|
-0.84, -0.25
|
-0.80, -0.19
| |
p-Wert
|
0.0004
|
0.0017
|
LS = kleinste Quadrate (Bestimmung des Mittelwerts nach der Methode der Least Squares = kleinste Quadrate)
Abbildung 1 Mittlere Veränderung gegenüber der Baseline beim Score für die nasale Kongestion und dem Nasenpolypenscore nach Behandlungsgruppe in den Nasenpolypenstudien 1 und 2
Ein sekundärer Hauptendpunkt war die Bewertung der Veränderung des Gesamtscores der nasalen Symptome (Total nasal symptom score, TNSS) in Woche 24 gegenüber der Baseline. Bei dem patientenberichteten TNSS handelte es sich um einen Score, der der Summe von 4 gleich gewichteten täglichen Symptom-Scores entsprach. Dies waren: der NCS, der Geruchssinn-Score, der posteriore Rhinorrhö-Score und der anteriore Rhinorrhö-Score. Die Spanne beim TNSS reichte von 0 = bester Wert bis 12 = schlechtester Wert. Unter Xolair kam es zu einer signifikanten Verbesserung des mittleren täglichen TNSS im Vergleich mit Placebo. Die Differenz der LS-Mittelwerte für die Veränderung gegenüber Baseline bis Woche 24 betrug -1.91 Punkte (95% KI: -2.85, -0.96; p = 0.0001) in Studie 1 und -2.09 Punkte (95% KI: -3.00, -1.18; p < 0.0001) in Studie 2.
Unter Xolair kam es zu einer signifikanten Verbesserung beim SNOT-22 (Sino-Nasal OutcomeTest), bei dem Fragen aus den Bereichen sinonasale Symptome, Psychologie und Schlafqualität kombiniert sind. Der SNOT-22 lag innerhalb einer Spanne von 0 bis 110 (0 = bester Wert, 110 = schlechtester Wert). Die Differenz der LS-Mittelwerte für die Veränderung gegenüber der Baseline bis Woche 24 im SNOT-22 unter Xolair im Vergleich mit Placebo lag bei -16.12 (95% KI: -21.86, -10.38; p < 0.0001) in Studie 1 und -15.04 (95% KI: -21.26, -8.82; p < 0.0001) in Studie 2.
Unter Xolair kam es ausserdem zu einer signifikanten Verbesserung des mittleren täglichen UPSIT- (University of Pennsylvania Smell Identification Test-)Scores im Vergleich mit Placebo. Der UPSIT-Score lag innerhalb einer Spanne von 0 bis 40 (0 = schlechtester Wert, 40 = bester Wert). Die Differenz der LS-Mittelwerte für die Veränderung gegenüber der Baseline bis Woche 24 betrug unter Xolair im Vergleich mit Placebo 3.81 Punkte (95% KI: 1.38, 6.24; p = 0.0024) in Studie 1 und 3.86 Punkte (95% KI: 1.57, 6.15; p= 0.0011) in Studie 2.
Die Auswirkung auf den TNSS und den SNOT-22 wurde in beiden Studien bereits bei der ersten Beurteilung in Woche 4 beobachtet. Darüber hinaus wurde in beiden Studien die Auswirkung auf den UPSIT-Score bei der ersten Beurteilung in Woche 8 beobachtet.
Zusätzliche sekundäre Endpunktanalysen umfassten Beurteilungen des NPS und des NCS in Woche 16. Unter Xolair kam es zu einer signifikanten Verbesserung des NPS in Woche 16 (0 = schlechtester Wert, 8= bester Wert) im Vergleich mit Placebo. Die Differenz der LS-Mittelwerte für die Veränderung gegenüber der Baseline bis Woche 16 betrug unter Xolair im Vergleich mit Placebo -1.01 (95% KI: -1.43, -0.60; p < 0.0001) in Studie 1 und -0.91 (95% KI: -1.39, -0.44; p= 0.0002) in Studie 2. Unter Xolair kam es zu einer signifikanten Verbesserung des NCS in Woche 16 (0 = bester Wert, 3= schlechtester Wert) im Vergleich mit Placebo. Die Differenz der LS-Mittelwerte für die Veränderung gegenüber Baseline bis Woche 16 beim mittleren täglichen NCS betrug unter Xolair im Vergleich mit Placebo -0.57 (95% KI: -0.83, -0.31; p < 0.0001) in Studie 1 und -0.59 (95% KI: -0.87, -0.30; p < 0.0001) in Studie 2.
Chronische spontane Urtikaria (CSU)
Das klinische Phase-III-Entwicklungsprogramm bei CSU umfasste drei randomisierte, doppelblinde, Placebo-kontrollierte, multizentrische Parallelgruppenstudien: Q4881g, Q4882g und Q4883g.
Untersucht wurden Erwachsene und Jugendliche (ab 12 Jahren) mit CSU während ≥6 Monaten (6 Monate bis 66 Jahre, durchschnittliche 6 Jahre) mit ständigen Schüben trotz Antihistaminika in zugelassenen Maximaldosen (UAS 7≥16/42 während ≥8 nacheinander folgenden Tagen).
Studien Q4881g und Q4882g dienten zur Beurteilung der Wirksamkeit und Sicherheit der Verabreichung von 75 mg, 150 mg oder 300 mg Xolair alle 4 Wochen während 24 bzw. 12 Wochen mit einer 16-wöchigen behandlungsfreien Nachbeobachtungsphase bei Patienten (12-75 Jahre) mit refraktärer CSU trotz Behandlung mit H1-Antihistaminen.
Studie Q4883g diente zur Beurteilung der Sicherheit und Wirksamkeit von 300 mg Xolair, verabreicht alle 4 Wochen, während 24 Wochen mit einer 16-wöchigen behandlungsfreien Nachbeobachtungsphase bei Patienten (12-75 Jahre) mit refraktärer CSU trotz Behandlung mit H1- und/oder H2-Antihistaminen und/oder Leukotrien-Rezeptorantagonisten (LTRA).
|
Tabelle 9
|
Endpunkte betreffend der Wirksamkeit
| |
Veränderung des wöchentlich erhobenen Itch Severity Scores (ISS, Bereich 0-21) in Woche 12 gegenüber Baseline
|
Primärer Endpunkt in Studien Q4881g und Q4882g
Sekundärer Endpunkt in der Sicherheitsstudie Q4883g
| |
Zeit bis zu einem MID a-Ansprechen (Verringerung um ≥5 Punkte gegenüber Baseline) des wöchentlich erhobenen ISS bis Woche 12
|
Sekundäre Endpunkte in allen drei Studien Q4881g, Q4882g und Q4883g
| |
Veränderung des über einen Zeitraum von 7 Tagen gemessenen Urtikaria-Aktivitäts-Scores (UAS7 b, Bereich 0-42) in Woche 12 gegenüber Baseline
| |
Anteil der Patienten mit einem über einen Zeitraum von 7 Tagen gemessenen Urtikaria-Aktivitäts-Score ≤6 (UAS7 b ≤6) in Woche 12
| |
Anteil der Patienten mit einem über einen Zeitraum von 7 Tagen gemessenen Urtikaria-Aktivitäts-Score = 0 (UAS7 b = 0) in Woche 12 c
| |
Veränderung des wöchentlich erhobenen Scores für die Anzahl der Quaddeln in Woche 12 gegenüber Baseline
| |
Veränderung des Gesamtscores des Dermatologischen Lebensqualitäts-Index (DLQI) in Woche 12 gegenüber Baseline
| |
Anteil der Patienten mit Angioödem-freien Tagen zwischen Woche 4 und Woche 12 d
| |
a
MID: Geringster relevanter Unterschied (Minimally Important Difference)
b UAS7: Zusammengesetzt aus dem Schweregrad des Juckreizes und der Anzahl der Quaddeln; Summe der an 7 aufeinanderfolgenden Tagen gemessenen Scores
c Post-hoc-Analyse für Studie Q4882g
d Der mittlere Anteil der Angioödem-freien Tage zwischen Woche 4 und Woche 12 wurde für die gesamte Studienpopulation einschliesslich der Patienten ohne Symptome eines Angioödems berechnet.
|
Die 75 mg-Dosis erreichte in den Studien Q4881g und Q4882g weder konsistent den primären Wirksamkeitsendpunkt (Veränderung des wöchentlich erhobenen Itch Severity Scores (ISS) in Woche 12 gegenüber Baseline) noch mehrere sekundäre Endpunkte. Daher wurde diese Dosis als nicht wirksam erachtet und wird daher nicht weiter dargestellt.
Der primäre Wirksamkeitsendpunkt, die Veränderung des wöchentlich erhobenen Itch Severity Scores in Woche 12 gegenüber Baseline, wurde in den Studien Q4881g und Q4882g sowohl mit der 150 mg-Dosis als auch mit der 300 mg-Dosis und in Studie Q4883g mit der 300 mg-Dosis erreicht (sekundärer Endpunkt; siehe Tabelle 10).
|
Tabelle 10: Veränderung des wöchentlich erhobenen Itch Severity Scores in Woche 12 gegenüber Baseline, Studien Q4881g, Q4882g und Q4883g (mITT-Population*)
| |
|
Placebo
|
Omalizumab
150 mg
|
Omalizumab
300 mg
| |
Studie Q4881g
|
|
|
| |
N
|
80
|
80
|
81
| |
Mittelwert (SD)
|
-3.63 (5.22)
|
-6.66 (6.28)
|
-9.40 (5.73)
| |
Difference in LS means vs. placebo1
|
-
|
-2.95
|
-5.80
| |
95% CI for difference
|
-
|
−4.72,−1.18
|
−7.49,−4.10
| |
P-value vs. placebo2
|
-
|
0.0012
|
<0.0001
| |
Studie Q4882g
|
|
|
| |
N
|
79
|
82
|
79
| |
Mittelwert (SD)
|
-5.14 (5.58)
|
-8.14 (6.44)
|
-9.77 (5.95)
| |
Difference in LS means vs. placebo1
|
-
|
-3.04
|
-4.81
| |
95% CI for difference
|
-
|
−4.85,−1.24
|
−6.49,−3.13
| |
P-value vs. placebo2
|
-
|
0.0011
|
<0.0001
| |
Studie Q4883g
|
|
|
| |
N
|
83
|
-
|
252
| |
Mittelwert (SD)
|
-4.01 (5.87)
|
-
|
-8.55 (6.01)
| |
Difference in LS means vs. placebo1
|
-
|
-
|
-4.52
| |
95% CI for difference
|
-
|
-
|
−5.97, −3.08
| |
P-value vs. placebo2
|
-
|
-
|
<0.0001
| |
* Modifizierte Intent-to-Treat (mITT)-Population: umfasst alle randomisierten Patienten, die mindestens eine Dosis des Prüfmedikaments erhalten hatten
Zur Kalkulation fehlender Daten wurde das BOCF (Baseline Observation Carried Forward)-Verfahren angewendet.
1 Der LS-Mittelwert wurde unter Anwendung eines ANCOVA-Modells berechnet. Stratifizierungsfaktoren waren der Ausgangswert des wöchentlich erhobenen Itch Severity Scores (< 13 vs. ≥13) und das Ausgangsgewicht (< 80 kg vs. ≥80 kg).
2 p-Werte entstammen dem ANCOVA t-Test.
|
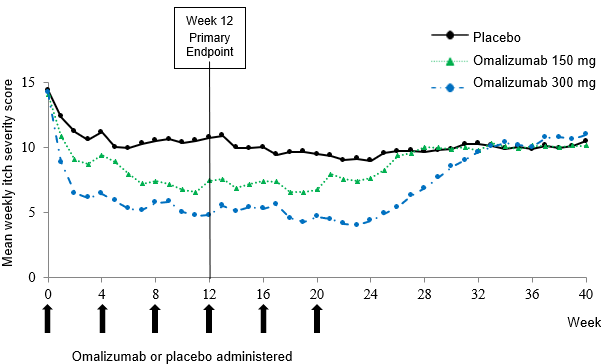
In Abbildung 2 ist der mittlere wöchentlich erhobene ISS im Zeitverlauf in Studie Q4881g dargestellt. Der mittlere wöchentlich erhobene Itch Severity Score nahm in beiden Behandlungsgruppen signifikant ab. Die maximale Wirkung wurde ungefähr in Woche 12 erreicht und blieb über die 24-wöchige Behandlungsphase bestehen. In den Studien Q4883g (300 mg über eine 24-wöchige Behandlungsphase) und Q4882g (150 mg oder 300 mg über eine 12-wöchige Behandlungsphase) waren die Resultate ähnlich wie in Studie Q4881g.
In allen drei Studien (siehe Abbildung 2 für Studie Q4881g) stieg der mittlere wöchentlich erhobene Itch Severity Score für beide Dosierungen während der 16-wöchigen behandlungsfreien Phase allmählich an, parallel zum Wiederauftreten der Symptome. Am Ende der Nachbeobachtungsphase waren die Mittelwerte mit denen der Placebo-Gruppe vergleichbar, jedoch niedriger als die entsprechenden mittleren Ausgangswerte.
Abbildung 2: Mittlerer wöchentlich erhobener Itch Severity Score im Zeitverlauf, Studie Q4881g (BOCF, mITT-Population)
BOCF = Baseline Observation Carried Forward; mITT = modifizierte Intent-to-Treat-Population
Zeit bis zu einem MID-Ansprechen des wöchentlich erhobenen ISS bis Woche 12
In den Studien Q4881g und Q4882g betrug die mediane Zeit bis zum Erreichen eines MID des wöchentlich erhobenen Itch Severity Scores von 5 Punkten bei Patienten in der Behandlungsgruppe mit 150 mg 2 Wochen (p=0.0301 in Studie Q4881g; p=0.0101 in Studie Q4882g) und bei Patienten in der Behandlungsgruppe mit 300 mg 1 Woche (p<0.0001), verglichen mit 4 Wochen bei Patienten in den Placebo-Gruppen. Vergleichbare Resultate wurden in Studie Q4883g mit einer medianen Zeit bis zum Erreichen eines MID von 2 Wochen in der Behandlungsgruppe mit 300 mg (p<0.0001) vs. 5 Wochen in der Placebo-Gruppe beobachtet.
Veränderung des UAS7 in Woche 12 gegenüber Baseline
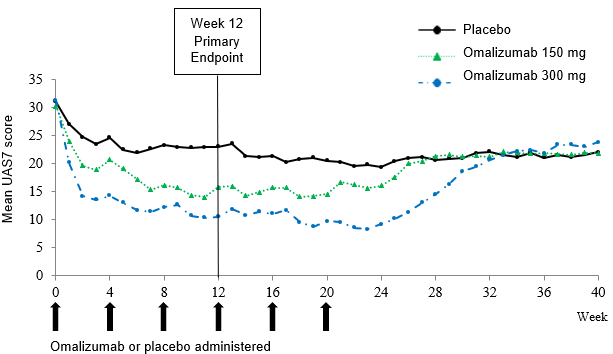
In den Phase-III-Studien wiesen die Behandlungsgruppen mit 150 mg und 300 mg Omalizumab im Vergleich zu Placebo einen statistisch signifikanten Unterschied der mittleren Veränderung des UAS7 in Woche 12 gegenüber Baseline auf (Abbildung 3 für Studie Q4881g). Statistische Signifikanz (p<0.0001) wurde in allen drei Studien in der Behandlungsgruppe mit 300 mg sowie in den Studien Q4881g (p=0.0008) und Q4882g (p=0.0001) in der Behandlungsgruppe mit 150 mg erreicht.
In Abbildung 3 ist der mittlere UAS7 im Zeitverlauf in Studie Q4881g dargestellt, der in beiden Behandlungsgruppen eine signifikante Abnahme gegenüber Baseline bei einer maximalen Wirkung um Woche 12 herum aufwies. Die Stärke dieser Wirkung blieb über die 24-wöchige Behandlungsphase bestehen. In den Studien Q4882g (150 mg und 300 mg während einer 12-wöchigen Behandlungsphase) und Q4883g (300 mg während einer 24-wöchigen Behandlungsphase) waren die Resultate mit denen von Studie Q4881g vergleichbar.
In allen drei Studien (siehe Abbildung 3 für Studie Q4881g) stieg der UAS7 in beiden Omalizumab-Behandlungsgruppen während der 16-wöchigen behandlungsfreien Nachbeobachtungsphase allmählich an, parallel zum Wiederauftreten der Symptome. Am Ende der Nachbeobachtungsphase waren die Mittelwerte mit denen der Placebo-Gruppe vergleichbar, jedoch niedriger als die entsprechenden Ausgangswerte.
Abbildung 3: Mittlerer UAS7 im Zeitverlauf, Studie Q4881g (BOCF, mITT-Population)
BOCF = Baseline Observation Carried Forward; mITT = modifizierte Intent-to-Treat-Population; UAS7 = Über einen Zeitraum von 7 Tagen gemessener Urtikaria-Aktivitäts-Score
Anteil der Patienten mit einem UAS7 ≤6 in Woche 12
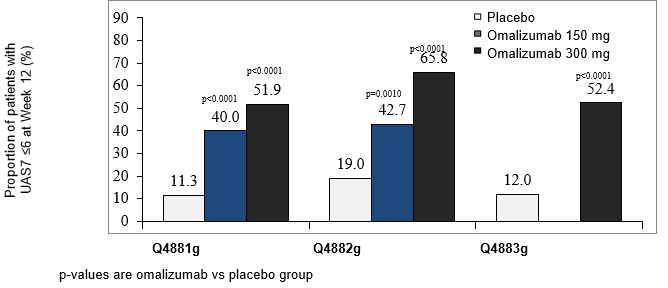
Der Anteil der Patienten mit einem UAS7 ≤6 in Woche 12 ist in Abbildung 4 dargestellt. Die Ansprechraten waren alle statistisch signifikant und lagen zwischen 52% und 66% (300 mg-Dosis; p<0.0001) bzw. zwischen 40% und 43% (150 mg-Dosis; p<0.001) im Vergleich zu 11-19% in der Placebo-Gruppe.
Abbildung 4: Anteil der Patienten mit einem UAS7 ≤6 in Woche 12, Studien Q4881g, Q4882g und Q4883g
Anteil der Patienten mit einem UAS7 = 0 in Woche 12
Der Anteil der Patienten mit einem vollständigen Ansprechen gemäss einem UAS7 = 0 in Woche 12 betrug 34-44% (300 mg-Dosis, statistisch signifikant, alle p<0.0001) bzw. 15-22% (150 mg-Dosis) im Vergleich zu 5-9% in der Placebo-Gruppe (Abbildung 5).
Abbildung 5: Anteil der Patienten mit einem UAS7 = 0 in Woche 12, Studien Q4881g, Q4882g und Q4883g

Prospektive Analyse in den Studien Q4881g und Q4883g und als Post-hoc-Analyse in Studie Q4882g
Veränderung des wöchentlich erhobenen Scores für die Anzahl der Quaddeln in Woche 12 gegenüber Baseline
Die mittlere Veränderung des wöchentlich erhobenen Scores für die Anzahl der Quaddeln in Woche 12 gegenüber Baseline war in allen drei Phase-III-Studien in der Behandlungsgruppe mit 300 mg statistisch signifikant (p<0.001) und zeigte eine Verminderung der Anzahl der Quaddeln im Vergleich zu Placebo (-11.35 in Q4881g, -11.97 in Q4882g und -10.46 in Q4883g versus -4.37, -5.22 bzw. -4.49 in den entsprechenden Placebo-Gruppen). In der Behandlungsgruppe mit 150 mg betrug die mittlere Veränderung -7.78 (p=0.0017) in Q4881g und -9.75 (p<0.0001) in Q4882g.
Anteil der Angioödem-freien Tage zwischen Woche 4 und 12
In allen drei Phase-III-Studien erreichten die Behandlungsgruppen mit 300 mg durchgängig den höchsten mittleren Anteil der Angioödem-freien Tage zwischen Woche 4 und 12 (91-96%). Die Zunahme des Anteils der Angioödem-freien Tage war im Vergleich zu Placebo statistisch signifikant (p<0.001) (Abb. 6). In der Behandlungsgruppe mit 150 mg betrug der mittlere Anteil der Angioödem-freien Tage über den gleichen Zeitraum 89.6% in Studie Q4881g und 91.6% in Studie Q4882g. Die entsprechenden Placebo-Werte der betreffenden Studien betrugen 88.2% bzw. 89.2%. In beiden Studien erreichten die Unterschiede zwischen der 150 mg-Dosis und Placebo keine statistische Signifikanz.
Abbildung 6: Anteil der Angioödem-freien Tage zwischen Woche 4 und 12, Studien Q4881g, Q4882g und Q4883g
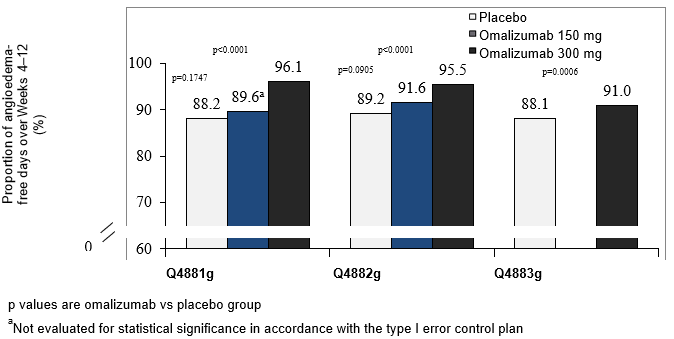
Der mittlere Anteil der Angioödem-freien Tage zwischen Woche 4 und Woche 12 wurde für die gesamte Studienpopulation einschliesslich der Patienten ohne Symptome eines Angioödems berechnet.
Veränderung des Gesamtscores des Dermatologischen Lebensqualitäts-Index (DLQI) in Woche 12 gegenüber Baseline
In allen drei Phase-III-Studien war die mittlere Veränderung des DLQI-Gesamtscores in Woche 12 gegenüber Baseline in der Behandlungsgruppe mit 300 mg statistisch signifikant (p<0.001) grösser als unter Placebo. Die Behandlungsgruppe mit 150 mg Omalizumab wies in Studie Q4882g einen statistisch signifikanten (p=0.022) Unterschied gegenüber Placebo auf (Abbildung 7).
Abbildung 7: Veränderung des Gesamtscores des Dermatologischen Lebensqualitäts-Index in Woche 12 gegenüber Baseline, Studien Q4881g, Q4882g und Q4883g
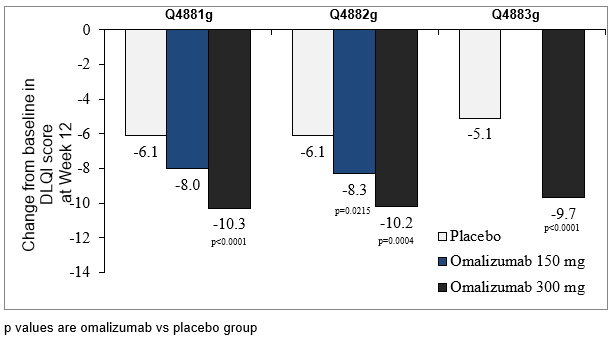
DLQI=Dermatology Life Quality Index
Wirksamkeit nach 24-wöchiger Behandlung
In Tabelle 11 sind die Resultate nach 24-wöchiger Behandlung dargestellt. Die Grössenordnungen des Ansprechens sind ähnlich denen, die nach 12 Wochen beobachtet wurden.
|
Tabelle 11: Wirksamkeitsergebnisse nach 24-wöchiger Behandlung, Studien Q4881g und Q4883g (mITT-Population*)
| |
Studienparameter
|
Woche
|
Placebo
|
Omalizumab
150 mg
|
Omalizumab
300 mg
| |
Änderung gegenüber Baseline des wöchentlichen Itch Severity Scores (BOCF), Mittelwert
| |
Studie Q4881g
|
Woche 24
|
−5.41
|
−6.47
|
−9.84**
| |
Studie Q4883g
|
Woche 24
|
−4.03
|
NA
|
−8.60**
| |
Änderung gegenüber Baseline des UAS7 (BOCF), Mittelwert
| |
Studie Q4881g
|
Woche 24
|
−11.73
|
−14.21
|
−22.11**
| |
Studie Q4883g
|
Woche 24
|
−8.85
|
NA
|
−19.15**
| |
Anteil der Patienten mit UAS7 ≤6, % Patienten
| |
Studie Q4881g
|
Woche 24
|
25.0
|
36.3
|
61.7**
| |
Studie Q4883g
|
Woche 24
|
16.9
|
NA
|
55.6**
| |
Anteil der Patienten mit UAS7 = 0, % Patienten
| |
Studie Q4881g
|
Woche 24
|
12.5
|
20.0
|
48.1**
| |
Studie Q4883g
|
Woche 24
|
3.6
|
NA
|
42.5**
| |
* Modifizierte Intent-to-Treat (mITT)-Population: umfasst alle randomisierten Patienten, die mindestens eine Dosis des Prüfmedikaments erhalten hatten.
** p-Wert ≤0.0001 im jeweiligen statistischen Test zwischen der Behandlung und Placebo
NA: Nicht zutreffend (Not Applicable).
BOCF: Baseline Observation Carried Forward.
|
Wirksamkeit nach 48 Behandlungswochen
In einer 48-wöchigen Studie nahmen 206 Patienten mit CSU, welche mit einer H1 Antihistaminika-Therapie nicht kontrolliert werden konnte, im Alter zwischen 12 und 75 Jahren an einer 24-wöchigen offenen Behandlungsphase mit Omalizumab 300 mg alle 4 Wochen als Zusatztherapie teil. Patienten, die auf die Behandlung in dieser offenen Phase ansprachen, erhielten anschliessend verblindet nach dem Zufallsprinzip Omalizumab 300 mg (81 Patienten) oder Placebo (53 Patienten) alle 4 Wochen für weitere 24 Wochen.
Von den Patienten, die insgesamt 48 Wochen lang weiter mit Omalizumab behandelt wurden, zeigten 21 % eine klinische Verschlechterung (UAS7-Wert von 12 oder mehr für mindestens 2 aufeinanderfolgende Wochen nach der Randomisierung zwischen Woche 24 und 48), während dies bei 60,4 % der mit Placebo behandelten Patienten in Woche 48 der Fall war (Der Unterschied lag bei -39,4 %, p < 0,0001, 95%-KI: -54,5 %; -22,5 %).
Die prospektive Schwangerschaftsregisterstudie (EXPECT)
Eine von 2006 bis 2018 in den USA durchgeführte prospektive Schwangerschaftsregisterstudie (EXPECT) umfasste 250 schwangere Frauen mit Asthma, die mit Xolair behandelt wurden. 246 der Frauen waren im ersten Schwangerschaftstrimester mit Xolair behandelt worden, und 78.4% (196/250) der Frauen waren in jedem der 3 Schwangerschaftstrimester mindestens einmal mit Xolair behandelt worden, wobei die gesamte Expositionsdauer im Median 8,7 Monate betrug. Die EXPECT-Ergebnisse bei den relevanten Mutter- und Säuglingsuntergruppen wurden mit den altersangepassten Häufigkeiten in einer krankheitsangepassten externen Kohorte von 1'153 schwangeren Frauen mit Asthma (ohne Behandlung mit Xolair) verglichen, die aus Gesundheitsdatenbanken von Einwohnern der kanadischen Provinz Quebec ermittelt und als Quebec External Comparator Cohort (QECC) bezeichnet wurde.
Bei den Säuglingen aus EXPECT, die mit Säuglingen aus der QECC (n=223) verglichen wurden, lag die Prävalenz von relevanten kongenitalen Fehlbildungen bei 8.1% und war damit vergleichbar mit der bei den Säuglingen aus der QECC (8.9%). Bei den Schwangerschaften aus EXPECT, die zum Vergleich mit der QECC (n=230) herangezogen wurden, führten 99.1% zu Lebendgeburten; ähnlich den 99.3% aus den QECC Schwangerschaften.
In einer Substudie von EXPECT wurden die Spiegel der Blutplättchen bei 51 Säuglingen untersucht, die von Frauen, mit Exposition gegenüber Xolair, geboren wurden; diese Spiegel lagen alle im Normbereich.
|







