Eigenschaften/WirkungenATC-Code
B01AC24
Wirkungsmechanismus
Ticagrelor NOBEL enthält als Wirkstoff Ticagrelor, einen Stoff der chemischen Klasse der Cyclopentyl-Triazolopyrimidine (CPTP). Es handelt sich um einen oralen, direkt wirkenden, selektiven und reversibel bindenden P2Y12-Rezeptor- Antagonisten, der in der Lage ist, die Adenosindiphospat (ADP)-vermittelte P2Y12-abhängige Thrombozytenaktivierung und -aggregation zu verhindern. Ticagrelor verhindert dabei nicht die Bindung des Rezeptors mit ADP, sondern verhindert mit seiner Bindung an den P2Y12–Rezeptor die ADP-induzierte Signalübertragung.
Da Thrombozyten an der Auslösung und/oder Entwicklung thrombotischer Komplikationen bei Atherosklerose beteiligt sind, kann eine Hemmung der Thrombozytenfunktion das Risiko kardiovaskulärer Ereignisse wie Herz-Tod, Myokardinfarkt oder Schlaganfall vermindern.
Ticagrelor verfügt über einen weiteren Wirkmechanismus, indem es über eine Hemmung des equilibrativen Nukleosidtransporters-1 (ENT-1) einen Anstieg der lokalen endogenen Adenosinspiegel herbeiführt. Adenosin wird bei vorhandener Hypoxie und Gewebeschädigung durch Abbau von freigesetztem Adenosintriphosphat und -diphosphat (ATP und ADP) lokal synthetisiert. Da der Abbau von Adenosin im Wesentlichen auf den Intrazellularraum beschränkt ist, führt die Hemmung von ENT-1 durch Ticagrelor zu einer Verlängerung der Halbwertszeit von Adenosin. Ticagrelor besitzt keine klinisch bedeutsame unmittelbare Wirkung auf Adenosinrezeptoren (A1, A2A, A2B, A3) und wird nicht zu Adenosin verstoffwechselt. Es wurden zahlreiche Adenosinwirkungen dokumentiert, hierzu zählen: Vasodilatation, Thrombozytenhemmung, Modulation von Entzündung und Induktion von Dyspnoe, welche zum klinischen Profil von Ticagrelor beitragen dürften.
Pharmakodynamik
Einsetzen der Wirkung
Die Hemmung der Thrombozytenaggregation (IPA = Inhibition of Platelet Aggregation) durch Ticagrelor und Clopidogrel wurde in einer 6-wöchigen Studie untersucht, in der bei Patienten mit stabiler koronarer Herzkrankheit (KHK) unter ASS sowohl akute als auch chronische thrombozytenhemmende Effekte in Reaktion auf 20 µM ADP als Agonist der Thrombozytenaggregation beurteilt wurden. Das Einsetzen der Wirkung wurde nach einer Aufsättigungsdosis von 180 mg Ticagrelor oder 600 mg Clopidogrel bewertet.
Ticagrelor zeigt ein rasches Einsetzen der pharmakologischen Wirkung, was sich 0.5 Stunden nach einer Initialdosis von 180 mg in einer mittleren Hemmung der Thrombozytenaggregation für Ticagrelor von ca. 41 % zeigte, mit einem maximalen IPA-Effekt von 89 %, der bis zu 2-4 Stunden nach Dosierung erreicht wurde und zwischen 2-8 Stunden anhielt. Bei 90 % der Patienten betrug 2 Stunden nach Dosierung das endgültige Ausmass der IPA > 70 %.
Aussetzen der Wirkung
Wenn eine CABG geplant ist, ist das Blutungsrisiko durch Ticagrelor verglichen mit Clopidogrel erhöht, wenn es weniger als 96 Stunden vor dem Eingriff abgesetzt wird.
Daten zur Therapieumstellung
Die Umstellung von Clopidogrel 75 mg einmal täglich auf Ticagrelor 90 mg zweimal täglich führt zu einem absoluten IPA-Anstieg um 26.4 %, umgekehrt geht eine Umstellung von Ticagrelor auf Clopidogrel mit einer absoluten IPA-Reduktion um 24.5 % einher. Die Therapie kann von Clopidogrel auf Ticagrelor NOBEL umgestellt werden, ohne dass die Thrombozyten hemmende Wirkung unterbrochen wird (siehe «Dosierung/Anwendung»).
Adenosin-Mechanismus (ENT-1)
Ticagrelor führte bei ACS-Patienten zu einem Anstieg der Adenosinkonzentration im Plasma und bewirkte eine Verstärkung verschiedener physiologischer Reaktionen auf Adenosin. Adenosin ist ein Vasodilatator; es wurde gezeigt, dass Ticagrelor bei gesunden Freiwilligen und ACS-Patienten die adenosininduzierte Steigerung des koronaren Blutflusses erhöht. Adenosin ist ein endogener Thrombozytenhemmer; es wurde nachgewiesen, dass Ticagrelor die adenosinvermittelte Hemmung der Thrombozytenaggregation verstärkt, und zwar zusätzlich zur Thrombozytenhemmung über seinen P2Y12-Antagonismus. Ebenso induziert Adenosin Dyspnoe; es wurde nachgewiesen, dass Ticagrelor bei gesunden Freiwilligen eine adenosininduzierte Dyspnoe verstärkt. Daher ist nicht auszuschliessen, dass die bei manchen Patienten unter Ticagrelor zu beobachtende Dyspnoe (siehe «Unerwünschte Wirkungen») teilweise adenosinvermittelt ist.
Klinische Wirksamkeit
Die klinische Evidenz für die Wirksamkeit von Ticagrelor stammt aus zwei Phase-III-Studien:
·Aus der PLATO-Studie [PLATO = PLATelet Inhibition and Patient Outcomes], ein Vergleich von Ticagrelor mit Clopidogrel, jeweils verabreicht in Kombination mit ASS und anderen Standardtherapien (Akutes Koronarsyndrom)
·Aus der Studie PEGASUS TIMI-54 [PEGASUS = PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients], ein Vergleich von Ticagrelor in Kombination mit ASS mit einer alleinigen ASS-Therapie (Langzeitbehandlung bei anamnestisch bekanntem Myokardinfarkt und Vorliegen weiterer kardiovaskulären Risikofaktoren)
PLATO-Studie (Akutes Koronarsyndrom)
Die PLATO Studie untersuchte 18'624 Patienten, bei denen innerhalb von 24 Stunden Symptome einer instabilen Angina pectoris (IA), eines Myokardinfarktes ohne ST-Strecken-Hebung (NSTEMI) oder eines Myokardinfarktes mit ST-Strecken-Hebung (STEMI) auftraten und die bereits medizinisch behandelt wurden, oder bei denen eine perkutane Koronarintervention (PCI) oder eine aortokoronare Bypass-Operation (CABG) durchgeführt wurde (siehe «Indikationen/Anwendungsmöglichkeiten»).
Vor dem Hintergrund einer täglichen ASS-Einnahme zeigte Ticagrelor 90 mg bei zweimal täglicher Einnahme eine Überlegenheit gegenüber Clopidogrel 75 mg täglich, im Hinblick auf die Prävention des kombinierten Endpunkts kardiovaskulärer (CV)-Tod, Myokardinfarkt (MI), oder Schlaganfall, wobei die Differenz hauptsächlich auf CV-Tod und MI zurückzuführen war. Die Patienten erhielten eine 300-mg-Initialdosis von Clopidogrel (600 mg möglich im Falle von PCI) oder 180 mg Ticagrelor.
Das Ergebnis zeichnete sich früh ab (absolute Risikoreduktion [ARR] 0.6 % und relative Risikoreduktion [RRR] von 12 % nach 30 Tagen), und ergab aufgrund einer konstanten Wirkung der Therapie während des gesamten Zeitraums von 12 Monaten eine ARR von 1.9 % pro Jahr mit einer RRR von 16 %. Dies deutet darauf hin, dass es angebracht ist, die Patienten bis zu 12 Monate lang mit Ticagrelor zu behandeln (siehe «Dosierung/Anwendung»). Wenn 54 Patienten mit akutem Koronarsyndrom mit Ticagrelor anstelle von Clopidogrel behandelt werden, so verhindert dies 1 atherothrombotisches Ereignis; die Behandlung von 91 Patienten verhindert 1 CV-Tod (siehe Abbildung 1 und Tabelle 3).
Die Wirkung der Behandlung mit Ticagrelor verglichen mit Clopidogrel zeigt sich durchgängig in vielen Subgruppen, wie z.B. Gewicht; Geschlecht; medizinische Vorgeschichte von Diabetes mellitus, transitorischer ischämischer Attacke oder nicht-hämorrhagischem Schlaganfall oder Revaskularisierung; Begleittherapien einschliesslich Heparin, GP-IIb/IIIa-Hemmern und Protonenpumpenhemmern (siehe «Interaktionen»); abschliessende Diagnose des Indexereignisses (STEMI, NSTEMI oder instabile Angina pectoris) und geplante Behandlungsmethode bei der Randomisierung (invasiv oder medikamentös).
Eine leicht signifikante Interaktion zwischen der Therapie und der Region wurde beobachtet. Die Hazard Ratio zum primären Endpunkt war in Nordamerika, was ungefähr 10 % der gesamten untersuchten Studienpopulation darstellt, für Clopidogrel günstiger, während weltweit in allen anderen Regionen Ticagrelor günstiger war (p-Wert für die Interaktion = 0.045). Explorative Analysen deuten auf einen möglichen Zusammenhang mit der ASS-Dosis hin, da eine reduzierte Wirksamkeit bei Ticagrelor mit erhöhten ASS-Dosen beobachtet wurde. Dauerhafte, Ticagrelor NOBEL begleitende ASS-Tagesdosen sollten 75-150 mg betragen (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Abbildung 1 zeigt das geschätzte Risiko für die Zeit bis zum ersten Auftreten eines Ereignisses des zusammengesetzten Wirksamkeitsendpunkts.
Abbildung 1: Zeit bis zum ersten Auftreten von kardiovaskulärem (CV) Tod, Myokardinfarkt und Schlaganfall (PLATO)
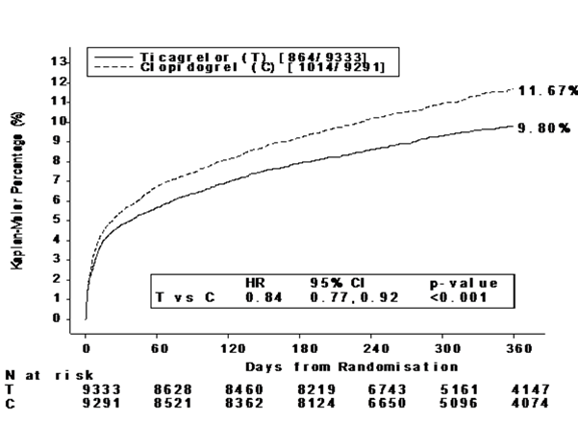
Ticagrelor verminderte sowohl in der instabilen Angina pectoris/NSTEMI als auch in der STEMI-Population das Auftreten des zusammengesetzten primären Endpunkts im Vergleich zu Clopidogrel.
Tabelle 3: Analyse der Primären und sekundären Wirksamkeits-Endpunkte in PLATO
|
Primärer Endpunkt (EP)
|
Patienten mit Ereignissen
|
|
|
| |
Ticagrelor 90 mg zweimal täglich
(%)
N=9333
|
Clopidogrel einmal täglich 75 mg (%)
N=9291
|
Reduktion des Relativen Risikosa
(%)
|
Hazard Ratio
(95 %-KI)
|
p-Wert
| |
Zusammengesetzter EP aus CV-Tod/MI (ausser stummer MI)/Schlaganfall
|
9.3
|
10.9
|
16
|
0.84(0.77,0.92)
|
p=0.0003
| |
CV-Tod
|
3.8
|
4.8
|
21
|
0.79(0.69,0.91)
|
p=0.0013
| |
MI (ausser stummer MI)
|
5.4
|
6.4
|
16
|
0.84(0.75,0.95)
|
p=0.0045
| |
Schlaganfall
|
1.3
|
1.1
|
-17
|
1.17(0.91,1.52)
|
p=0.2249
| |
Sekundäre Endpunkte
| |
Zusammengesetzter EP aus CV-Tod/MI (ausser stummer MI)/Schlaganfall – geplante invasive Behandlung
|
8.5
|
10.0
|
16
|
0.84(0.75,0.94)
|
p=0.0025
| |
Zusammengesetzter EP aus Gesamtmortalität/MI (ausser stummer MI)/Schlaganfall
|
9.7
|
11.5
|
16
|
0.84(0.77,0.92)
|
p=0.0001
| |
Zusammengesetzter EP aus CV-Tod/allen MI/ Schlaganfall/SRIb/RIc/TIAd/Andere ATEe
|
13.8
|
15.7
|
12
|
0.88(0.81,0.95)
|
p=0.0006
| |
Gesamtmortalität
|
4.3
|
5.4
|
22
|
0.78(0.69,0.89)
|
p=0.0003**
|
a RRR= (1-Hazard Ratio) x 100 %. Negative Werte für die Reduktion des relativen Risikos entsprechen einem Anstieg des relativen Risikos
** nominaler p-Wert, nicht formal statistisch signifikant durch ein vorher festgelegtes hierarchisches Testverfahren
b SRI= Severe Recurrent Cardiac Ischaemia
c RI= Recurrent Cardiac Ischaemia
d TIA= Transitional Ischaemic Attack
e ATE= Arterial Thrombotic Events
Holter-Substudie
Um das Auftreten ventrikulärer Pausen und anderer arrhythmischer Episoden während PLATO zu untersuchen, führten die Prüfärzte ein Holter-Monitoring in einer Untergruppe von annähernd 3'000 Patienten durch. Bei ca. 2'000 dieser Patienten wurde ein EKG sowohl während der akuten Phase des ACS als auch nach einem Monat durchgeführt. Die primär interessierende Variable war das Auftreten ventrikulärer Pausen ≥3 Sekunden. In der akuten Phase hatten unter Ticagrelor mehr Patienten ventrikuläre Pausen (6.0 %) als unter Clopidogrel (3.5 %); nach einem Monat traf dies für 2.2 % bzw. 1.6 % zu (siehe «Warnhinweise und Vorsichtsmassnahmen»). Der Anstieg von ventrikulären Pausen in der akuten Phase eines ACS war ausgeprägter bei Ticagrelor-Patienten mit chronischer Herzinsuffizienz in der Vorgeschichte (9.2 % versus 5.4 % bei Patienten ohne chronische Herzinsuffizienz in der Vorgeschichte; bei Clopidogrel-Patienten 4.0 % bei denen mit versus 3.6 % bei denen ohne chronische Herzinsuffizienz in der Vorgeschichte). Dieses Ungleichgewicht trat nicht nach einem Monat auf: 2.0 % versus 2.1 % für Ticagrelor-Patienten mit bzw. ohne chronische Herzinsuffizienz in der Vorgeschichte; und 3.8 % versus 1.4 % bei Clopidogrel. Bei dieser Patientengruppe waren mit diesem Ungleichgewicht keine negativen klinischen Folgen verbunden (einschliesslich Implantation eines Schrittmachers).
PLATO genetische Substudie
Die CYP 2C19und ABCB1-Genotypisierung von 10'285 Patienten in PLATO ergab Zusammenhänge zwischen Genotypgruppen und PLATO-Outcomes. Die Überlegenheit von Ticagrelor gegenüber Clopidogrel im Hinblick auf die Verringerung schwerwiegender kardiovaskulärer Ereignisse wurde durch den CYP 2C19oder ABCB1-Genotyp der Patienten nicht signifikant beeinflusst. Ähnlich wie in der PLATO-Studie insgesamt gab es im Hinblick auf PLATO gesamt schwerwiegende Blutungen, unabhängig vom CYP2C19oder ABCB1-Genotyp, keine Unterschiede zwischen Ticagrelor und Clopidogrel. Nicht-CABG-bedingte PLATO schwerwiegende Blutungen traten bei Patienten mit einem oder mehreren «Loss of function» Allelen für CYP2C19 unter Ticagrelor verglichen mit Clopidogrel häufiger auf, aber vergleichbar zu Clopidogrel-Patienten mit keinem «Loss of function» Allel.
Zusammengesetzter kombinierter Wirksamkeits-/Sicherheits-Endpunkt
Ein zusammengesetzter kombinierter Wirksamkeits-/Sicherheits-Endpunkt (CV-Tod, MI, Schlaganfall oder PLATO-definierte «Gesamt-Major»-Blutung) untermauert den klinischen Nutzen von Ticagrelor gegenüber Clopidogrel (RRR 8 %, ARR 1.4 %, HR 0.92; p=0.0257) über 12 Monate nach einem ACS-Ereignis.
PEGASUS-Studie (Langzeitbehandlung bei anamnestisch bekanntem Myokardinfarkt und Vorliegen weiterer kardiovaskulären Risikofaktoren)
Bei der Studie PEGASUS TIMI-54 handelt es sich um eine ereignisgesteuerte, randomisierte, doppelblinde, Placebo-kontrollierte, internationale, multizentrische Parallelgruppenstudie an 21'162 Patienten, in der die Prävention thrombotischer Ereignisse mit Ticagrelor in 2 Dosierungen (entweder 90 mg zweimal täglich oder 60 mg zweimal täglich) in Kombination mit niedrig dosierter ASS (75-150 mg) im Vergleich mit einer alleinigen ASS-Therapie bei Patienten mit anamnestisch bekanntem Myokardinfarkt und zusätzlichen Risikofaktoren für eine Atherothrombose untersucht wurde.
Risikofaktoren
Die Patienten waren für eine Studienteilnahme geeignet, wenn sie mindestens 50 Jahre alt waren, einen Myokardinfarkt in der Vorgeschichte hatten (1 bis 3 Jahre vor der Randomisierung) und mindestens einen der folgenden kardiovaskulären Risikofaktoren aufwiesen:
·einen zweiten vorangegangenen Myokardinfarkt
·dokumentierte Mehrgefäss-KHK
·Diabetes mellitus, der eine Medikation erfordert
·Alter ≥65 Jahre
·chronische nichtterminale Niereninsuffizienz.
Abbildung 2 - Kaplan-Meier-Plot und Analyse des primären klinischen kombinierten Endpunkts aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall in PEGASUS
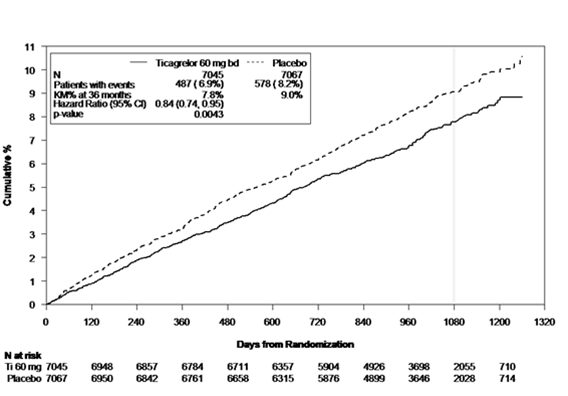
Tabelle 4 - Analyse der primären und der sekundären Wirksamkeitsendpunkte in PEGASUS
|
|
Ticagrelor 60 mg zweimal täglich + ASS
N = 7045
|
ASS allein
N = 7067
|
p-Wert
| |
Merkmal
|
Patienten mit Ereignissen
|
KM %
|
HR
(95 %-KI)
|
Patienten mit Ereignissen
|
KM %
| |
Primärer Endpunkt
| |
Kombination aus kardiovaskulärem Tod/MI/Schlaganfall
|
487 (6.9 %)
|
7.8 %
|
0.84
(0.74, 0.95)
|
578 (8.2 %)
|
9.0 %
|
0.0043 (s)
| |
Kardiovaskulärer Tod
|
174 (2.5 %)
|
2.9 %
|
0.83
(0.68, 1.01)
|
210 (3.0 %)
|
3.4 %
|
0.0676
| |
MI
|
285 (4.0 %)
|
4.5%
|
0.84
(0.72, 0.98)
|
338 (4.8 %)
|
5.2 %
|
0.0314
| |
Schlaganfall
|
91 (1.3 %)
|
1.5 %
|
0.75
(0.57, 0.98)
|
122 (1.7 %)
|
1.9 %
|
0.0337
| |
Sekundärer Endpunkt
| |
Kardiovaskulärer Tod
|
174 (2.5 %)
|
2.9 %
|
0.83
(0.68, 1.01)
|
210 (3.0 %)
|
3.4 %
|
-
| |
Gesamtmortalität
|
289 (4.1 %)
|
4.7 %
|
0.89
(0.76, 1.04)
|
326 (4.6 %)
|
5.2 %
|
-
|
Hazard Ratio und p-Werte für Ticagrelor vs. ASS allein separat berechnet anhand eines Cox-Proportional-Hazards-Modells mit Behandlungsgruppe als einzige explanatorische Variable.
Kaplan-Meier-Prozentanteil berechnet nach 36 Monaten.
Hinweis: Die Anzahl von Erstereignissen der Komponenten kardiovaskulärer Tod, MI und Schlaganfall stellen die tatsächliche Anzahl von Erstereignissen für die jeweilige Komponente dar und werden nicht zur Anzahl der Ereignisse des kombinierten Endpunkts hinzuaddiert.
(s) Zeigt statistische Signifikanz an.
KI = Konfidenzintervall; HR = Hazard Ratio; KM= Kaplan-Meier; MI = Myokardinfarkt; N = Anzahl Patienten.
Sowohl das 60-mgals auch das 90-mg-zweimal-täglich-Ticagrelor-Regime hat sich, jeweils in Kombination mit ASS, bei der Prävention thrombotischer Ereignisse (kombinierter Endpunkt: kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) gegenüber einer alleinigen ASS-Therapie als überlegen erwiesen. Dabei wurde während des gesamten Studienzeitraums ein konsistenter Behandlungseffekt beobachtet, der zu einer 16 %igen RRR und 1.27 %igen ARR im Fall von Ticagrelor 60 mg bzw. zu einer 15 %igen RRR und 1.19 %igen ARR im Fall von Ticagrelor 90 mg führte.
Obwohl das Wirksamkeitsprofil von Ticagrelor 90 mg und 60 mg ähnlich ausfiel, scheint die niedrigere Dosierung ein besseres Verträglichkeitsund Sicherheitsprofil im Hinblick auf das Risiko von Blutungen und Dyspnoe zu besitzen. Daher wird für die Prävention thrombotischer Ereignisse (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) bei Patienten mit anamnestisch bekanntem Myokardinfarkt, der mindestens 12 Monate zurück liegt, und einem hohen Risiko zur Entwicklung eines thrombotischen Ereignisses eine Dosis von 60 mg Ticagrelor zweimal täglich in Kombination mit ASS empfohlen.
Im Vergleich zu ASS allein reduzierte Ticagrelor 60 mg zweimal täglich signifikant den primären kombinierten Endpunkt aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall. Zur Reduktion des primären kombinierten Endpunkts trug jede der einzelnen Komponenten bei (kardiovaskulärer Tod 17 % RRR, Myokardinfarkt 16 % RRR, Schlaganfall 25 % RRR).
Um ein Ereignis des primären kombinierten Endpunkts zu verhindern, ist eine Behandlung von 79 Patienten über bis zu 36 Monate mit Ticagrelor 60 mg zweimal täglich in Kombination mit ASS anstelle einer alleinigen ASS-Therapie erforderlich.
Der Nutzen von Ticagrelor hinsichtlich des primären kombinierten Endpunkts zeigte sich auch bei den beiden sekundären Endpunkten, und zwar in Form eines numerischen Rückgangs sowohl von kardiovaskulären Todesfällen als auch der Gesamtmortalität unter Ticagrelor 60 mg in Kombination mit ASS gegenüber einer alleinigen ASS-Therapie, allerdings wurde hier keine statistische Signifikanz erreicht (siehe Tabelle 4).
Die RRR für den kombinierten Endpunkt von Tag 1 bis 360 (17 % RRR) und von Tag 361 und danach (16 % RRR) war ähnlich. Dieser Effekt war während der gesamten Studie konsistent, mit einer Dauer von bis zu 48 Monaten (Median 33 Monate). Die Konsistenz der RRR über die Zeit deutet darauf hin, dass eine Fortführung der Behandlung mit Ticagrelor so lange angemessen ist, wie der Patient ein hohes Risiko zur Entwicklung thrombotischer Ereignisse aufweist (siehe «Dosierung/Anwendung»).
Der Behandlungseffekt von Ticagrelor 60 mg zweimal täglich gegenüber einer alleinigen ASS-Therapie war konsistent über mehrere Patienten-Subgruppen, die auf demographischen Merkmalen einschliesslich Gewicht, Geschlecht, medizinischer Anamnese und Region beruhten.
Die mit Ticagrelor verbundenen Vorteile waren zudem unabhängig von der Anwendung anderer kardiovaskulärer Therapien, darunter Lipidsenker, Betablocker, ACE-Hemmer, Angiotensin-II-Rezeptorantagonisten, Calciumkanalblocker, Nitrate und Protonenpumpenhemmer (siehe «Interaktionen»).
Kinder und Jugendliche
In einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie wurde das primäre Ziel einer Reduktion der Rate vasookklusiver Krisen bei Kindern und Jugendlichen im Alter von 2 bis unter 18 Jahren mit Sichelzellanämie nicht erreicht.
|


