Eigenschaften/WirkungenATC-Code
L04AA47
Wirkungsmechanismus
Inebilizumab ist ein monoklonaler Antikörper, der spezifisch an CD19, ein Zelloberflächenantigen auf Prä-B- und reifen B-Zell-Lymphozyten (einschliesslich Plasmablasten und einigen Plasmazellen) bindet. Nach der Bindung an die Zelloberfläche von B-Lymphozyten unterstützt Inebilizumab die Antikörper-abhängige zelluläre Zytolyse (antibody-dependent cellular cytolysis, ADCC) und die Antikörper-abhängige zelluläre Phagozytose (antibody-dependent cellular phagocytosis, ADCP). Man geht davon aus, dass B-Zellen eine zentrale Rolle bei der Pathogenese von NMOSD spielen. Der genaue Mechanismus, durch den Inebilizumab seine therapeutische Wirkung bei NMOSD entfaltet, ist nicht bekannt, aber es wird vermutet, dass er mit einer B-Zell-Depletion einhergeht und möglicherweise die Unterdrückung der Antikörpersekretion, Antigenpräsentation, B-Zell-T-Zell-Interaktion sowie der Produktion von Entzündungsmediatoren umfasst.
Pharmakodynamik
Die Pharmakodynamik von Inebilizumab wurde mit einem Assay für CD20+-B-Zellen untersucht, da Inebilizumab mit dem Assay für CD19+-B-Zellen interferieren kann. Die Behandlung mit Inebilizumab verringert bis 8 Tage nach der Infusion die Anzahl der CD20+-B-Zellen im Blut. In einer klinischen Studie an 174 Patienten wurde die Anzahl der CD20+-B-Zellen bei 100 % der mit Inebilizumab behandelten Patienten innerhalb von 4 Wochen auf Werte unterhalb des unteren Normwerts gesenkt und blieb bei 94 % der Patienten 28 Wochen nach Behandlungsbeginn unterhalb des unteren Normwerts. Die Zeit bis zur vollständigen Erholung der B-Zellen nach der Verabreichung von Inebilizumab ist nicht bekannt.
In der Zulassungsstudie mit NMOSD-Patienten wurden bei 14,7 % der Patienten am Ende der OLP Anti-Arzneimittel-Antikörper (anti-drug antibodies, ADA) nachgewiesen; die Gesamthäufigkeit der unter der Behandlung auftretenden ADA lag bei 7,1 % (16 von 225) und das Auftreten und der Titer zu ADA-positiven Messzeitpunkten nahm im Laufe der Inebilizumab-Behandlung ab. Der positive ADA-Status hatte offenbar keine klinisch relevanten Auswirkungen auf die PK- und PD-(B-Zell)-Parameter und keinen Einfluss auf das langfristige Sicherheitsprofil. Es gab keine erkennbaren Auswirkungen des ADA-Status auf das Wirksamkeitsergebnis. Angesichts der geringen Inzidenz von ADA im Zusammenhang mit der Inebilizumab-Behandlung kann die Auswirkung jedoch nicht vollständig bewertet werden.
Klinische Wirksamkeit
Die Wirksamkeit von Inebilizumab zur Behandlung von NMOSD wurde in einer randomisierten (3:1), doppelblinden, placebokontrollierten klinischen Studie an Erwachsenen mit AQP4-IgG-seropositiver oder -seronegativer NMOSD untersucht. An der Studie nahmen Patienten teil, die im Jahr zuvor mindestens einen akuten NMOSD-Schub oder in den letzten zwei Jahren mindestens zwei Schübe erlitten hatten, der/die eine Notfallbehandlung (z.B. Steroide, Plasmaaustausch, intravenöses Immunglobulin) erforderte(n), und die einen EDSS (Expanded Disability Severity Scale)-Score von ≤7,5 aufwiesen (Patienten mit einem Score von 8,0 waren teilnahmeberechtigt, sofern die Patienten in angemessener Weise zur Teilnahme in der Lage waren). Patienten waren von der Studienteilnahme ausgeschlossen, wenn sie zuvor innerhalb eines für jede der entsprechenden Therapien festgelegten Intervalls mit Immunsuppressiva behandelt worden waren. Immunsuppressive Hintergrundtherapien zur Vorbeugung von NMOSD-Schüben waren nicht zulässig. In der Zulassungsstudie wurde bei Einleitung der Behandlung mit Inebilizumab eine 2-wöchige orale Kortikosteroidtherapie (plus eine 1-wöchige Ausschleichphase) verabreicht.
Die Patienten erhielten Inebilizumab 300 mg oder das entsprechende Placebo als intravenöse Infusion an Tag 1 und Tag 15 und wurden anschliessend über einen Zeitraum von bis zu 197 Tagen oder bis zu einem bestätigten Schub beobachtet; dies wurde als randomisiert-kontrollierte Phase (RCP) bezeichnet. Alle potenziellen Schübe wurden von einem verblindeten, unabhängigen Beurteilungsausschuss (Adjudication Committee, AC) bewertet, der feststellte, ob der Schub die im Prüfplan definierten Kriterien erfüllte. Die Schubkriterien berücksichtigten Schübe in allen von der NMOSD betroffenen Bereichen (Optikusneuritis, Myelitis, Gehirn und Hirnstamm). Sie enthielten Kriterien, die sich ausschliesslich auf wesentliche klinische Manifestationen stützen, sowie Kriterien, bei denen leichtere klinische Befunde durch den Einsatz von MRT ergänzt wurden (siehe Tabelle 3).
Tabelle 3. Überblick über die im Prüfplan definierten Kriterien für einen NMOSD-Schub
|
Bereich
|
Repräsentative Symptome
|
Rein klinische Befunde
|
Klinische PLUS radiologische Befunde
| |
Sehnerv
|
Verschwommenes Sehen
Sehverlust
Augenschmerzen
|
8 Kriterien auf Grundlage von Veränderungen der Sehschärfe oder des relativen afferenten Pupillendefekts (RAPD)
|
3 Kriterien auf Grundlage von Veränderungen der Sehschärfe oder des RAPD plus Vorliegen entsprechender MRT-Befunde des Sehnervs
| |
Rückenmark
|
Tiefer oder Wurzelschmerz
Parästhesien der Extremitäten
Schwäche
Funktionsstörung des Schliessmuskels
Lhermitte-Zeichen (nicht isoliert)
|
2 Kriterien auf Grundlage von Veränderungen in den Funktionswerten des pyramidalen Systems, von Blase/Darm oder Sensorik
|
2 Kriterien auf Grundlage von Veränderungen in den Funktionswerten des pyramidalen Systems, von Blase/Darm oder Sensorik PLUS entsprechender MRT-Befunde
| |
Hirnstamm
|
Übelkeit
Unbehandelbares Erbrechen
Hartnäckiger Schluckauf
Sonstige neurologische Anzeichen (z.B. Doppeltsehen, Dysarthrie, Dysphagie, Vertigo, okulomotorische Lähmung, Schwäche, Nystagmus, andere Hirnnervenanomalien)
|
Keine
|
2 Kriterien auf Grundlage von Symptomen oder Veränderungen der Funktionswerte von Hirnstamm/ Kleinhirn PLUS entsprechender MRT-Befunde des Hirnstamms
| |
Gehirn
|
Enzephalopathie
Hypothalamus-Funktionsstörung
|
Keine
|
1 Kriterium auf Grundlage von Veränderungen der zerebralen/sensorischen/ pyramidalen Funktionswerte PLUS entsprechender MRT-Befunde des Gehirns
|
Patienten, die während der RCP einen durch den AC bestätigten Schub erlitten oder die den Besuch an Tag 197 ohne Schub abschlossen, verliessen die RCP und hatten die Möglichkeit, in eine Open-Label-Phase (OLP) aufgenommen zu werden und die Behandlung mit Inebilizumab zu beginnen bzw. fortzusetzen.
Insgesamt wurden 230 Patienten in die Studie aufgenommen: 213 Patienten waren AQP4-IgG-seropositiv und 17 waren -seronegativ; 174 Patienten wurden in der RCP der Studie mit Inebilizumab behandelt und 56 Patienten erhielten Placebo. Von den 213 AQP4-IgG-seropositiven Patienten wurden 161 mit Inebilizumab behandelt und 52 erhielten Placebo in der RCP behandelt. Die Daten zum Ausgangszeitpunkt und Wirksamkeitsergebnisse werden für die AQP4-IgG-seropositiven Patienten dargestellt.
Die demografischen Daten zum Ausgangszeitpunkt und die Krankheitsmerkmale waren in beiden Behandlungsgruppen ausgeglichen (siehe Tabelle 4).
Tabelle 4. Demografische Daten und Ausgangsmerkmale der AQP4-IgG-seropositiven NMOSD-Patienten
|
Merkmal
|
Placebo
N = 52
|
Inebilizumab
N = 161
|
Insgesamt
N = 213
| |
Alter (Jahre): Mittelwert (Standardabweichung [standard deviation, SD])
|
42,4 (14,3)
|
43,2 (11,6)
|
43,0 (12,3)
| |
Alter ≥65 Jahre, n (%)
|
4 (7,7)
|
6 (3,7)
|
10 (4,7)
| |
Geschlecht: männlich, n (%)
|
3 (5,8)
|
10 (6,2)
|
13 (6,1)
| |
Geschlecht: weiblich, n (%)
|
49 (94,2)
|
151 (93,8)
|
200 (93,9)
| |
Erweiterte Skala zur Einstufung einer Behinderung (EDSS): Mittelwert (SD)
|
4,35 (1,63)
|
3,81 (1,77)
|
3,94 (1,75)
| |
Dauer der Erkrankung (in Jahren): Mittelwert (SD)
|
2,92 (3,54)
|
2,49 (3,39)
|
2,59 (3,42)
| |
Anzahl der vorherigen Rückfälle: ≥2, n (%)
|
39 (75,0)
|
137 (85,1)
|
176 (82,6)
| |
Annualisierte Rückfallrate: Mittelwert (SD)
|
1,456 (1,360)
|
1,682 (1,490)
|
1,627 (1,459)
|
Bei auftretenden NMOSD-Schüben wurde je nach Bedarf eine Notfalltherapie eingeleitet. Alle Patienten erhielten vor der Verabreichung des Prüfpräparats eine Prämedikation, um das Risiko infusionsbedingter Reaktionen zu verringern.
Der primäre Wirksamkeitsendpunkt war die Zeit (in Tagen) von Tag 1 bis zum Auftreten eines durch den AC bestätigten NMOSD-Schubs an oder vor Tag 197. Weitere wesentliche sekundäre Endpunkte waren die Verschlechterung des EDSS beim letzten Besuch während der RCP gegenüber dem Ausgangszeitpunkt, die Veränderung des binokularen Sehschärfe-Scores im Niedrigkontrastbereich gegenüber dem Ausgangszeitpunkt (gemessen mithilfe des kontrastarmem Landholtrings) beim letzten Besuch während der RCP, die kumulative Gesamtzahl aktiver MRT-Läsionen (neue Gadolinium-anreichernde oder neue/sich vergrössernde T2-Läsionen) während der RCP sowie die Anzahl der NMOSD-bedingten stationären Krankenhausaufenthalte. Eine Verschlechterung des EDSS-Scores lag vor, wenn eines der folgenden Kriterien erfüllt war: (1) Verschlechterung des EDSS-Scores um 2 oder mehr Punkte bei einem Ausgangswert von 0; (2) Verschlechterung des EDSS-Scores um 1 oder mehr Punkte bei Patienten mit einem Ausgangswert von 1 bis 5; (3) Verschlechterung des EDSS-Scores um 0,5 Punkte oder mehr bei Patienten mit einem Ausgangswert von 5,5 oder höher. Obwohl während der OLP keine Vergleichsgruppe zur Verfügung stand, wurde die annualisierte Schubrate sowohl für die randomisierte als auch für die unverblindete Behandlung ermittelt.
Die Ergebnisse der AQP4-IgG-seropositiven Patienten sind in Tabelle 5 und Abbildung 1 dargestellt. In dieser Studie reduzierte die Behandlung mit Inebilizumab statistisch signifikant das Risiko eines durch den AC bestätigten NMOSD-Schubs gegenüber Placebo (Hazard Ratio: 0,227, p < 0,0001; Verringerung des Risikos eines durch den AC bestätigten NMOSD-Schubs um 77,3 %) bei AQP4-IgG-seropositiven Patienten. Bei AQP4-IgG-seronegativen Patienten wurde kein Behandlungsnutzen festgestellt.
In der Inebilizumab-Gruppe war die Verschlechterung des EDDS signifikant geringer als in der Placebo-Gruppe (14,9 % gegenüber 34,6 % der Teilnehmer). Es gab keine Unterschiede in der binokularen Sehschärfe bei geringem Kontrast zwischen den Studienarmen. Die mittlere Gesamtanzahl der aktiven MRT-Läsionen (1,7 gegenüber 2,3) und die mittlere Gesamtanzahl der NMOSD-bedingten Krankenhausaufenthalte (1,0 gegenüber 1,4) waren in der Inebilizumab-Gruppe geringer.
Tabelle 5. Wirksamkeitsergebnisse der Zulassungsstudie bei NMOSD mit seropositivem AQP4-IgG
|
|
Behandlungsgruppe
| |
|
Placebo
N = 52
|
Inebilizumab
N = 161
| |
Zeit bis zu einem vom Beurteilungsausschuss (AC) festgestellten Schub (primärer Wirksamkeitsendpunkt)
| |
Anzahl (%) der Patienten mit Schub
|
22 (42,3 %)
|
18 (11,2 %)
| |
Hazard Ratio (95 %-KI)a
|
0,227 (0,1214; 0,4232)
| |
p-Werta
|
< 0,0001
|
a Cox-Regressionsmethode, mit Placebo als Referenzgruppe.
Abbildung 1. Kaplan-Meier-Diagramm der Zeit bis zum ersten durch den AC bestätigten NMOSD-Schub während der RCP bei AQP4-IgG-seropositiven Patienten
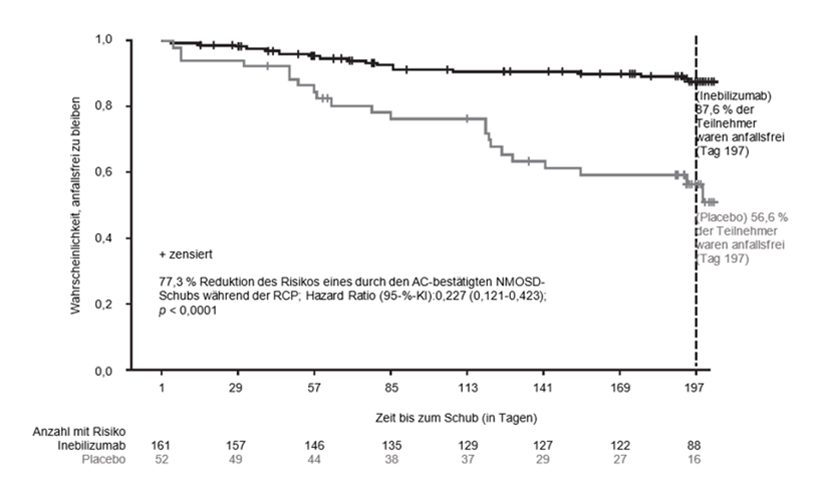
AC: Beurteilungsausschuss; AQP4-IgG: Anti-Aquaporin-4-Immunglobulin G; KI: Konfidenzintervall; NMOSD: Neuromyelitis-optica-Spektrum-Erkrankungen; RCP: Randomisiert-kontrollierte Phase.
Die annualisierte, durch den Beurteilungsausschuss (AC) bestätigte NMOSD-Schubrate wurde im Rahmen der RCP und OLP als sekundärer Endpunkt analysiert. Bei den AQP4-IgG-seropositiven Patienten, die mit Inebilizumab behandelt wurden, lag das Ergebnis bei 0,09.
|

