ZusammensetzungWirkstoffe
Dengue-Fieber tetravalenter Impfstoff (lebend, attenuiert)
Dengue-Virus-Serotyp 1 (lebend, attenuiert)
Dengue-Virus-Serotyp 2 (lebend, attenuiert)
Dengue-Virus-Serotyp 3 (lebend, attenuiert)
Dengue-Virus-Serotyp 4 (lebend, attenuiert)
Hilfsstoffe
Pulver:
α,α-Trehalose-Dihydrat, Poloxamer 407, Humanalbumin, Kaliumdihydrogenphosphat, Dinatriumhydrogenphosphat, Kaliumchlorid, Natriumchlorid.
Lösungsmittel:
Natriumchlorid, Wasser für Injektionszwecke.
Eine Dosis enthält 0,633 mg Natrium und 0.038 mg Kalium.
Indikationen/AnwendungsmöglichkeitenQdenga wird angewendet zur Prävention von Dengue-Fieber bei Personen ab 4 Jahren.
Qdenga sollte gemäss den offiziellen Empfehlungen angewendet werden.
Dosierung/AnwendungUm die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Dosierung
Kinder und Personen ab 4 Jahren
Qdenga sollte als 0,5-ml-Dosis im Rahmen eines 2-Dosen-Impfschemas (Monat 0 und 3) verabreicht werden.
Die Notwendigkeit einer Auffrischimpfung wurde nicht nachgewiesen.
Sonstige Kinder und Jugendliche (Kinder < 4 Jahren)
Die Sicherheit und Wirksamkeit von Qdenga bei Kindern unter 4 Jahren ist bisher noch nicht erwiesen.
Zurzeit vorliegende Daten werden in der Rubrik «Eigenschaften/Wirkungen» beschrieben. Eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Ältere Patienten
Qdenga wurde bei Personen über 60 Jahren nicht untersucht.
Bei älteren Personen ≥60 Jahren ist keine Dosisanpassung erforderlich. Siehe «Warnhinweise und Vorsichtsmassnahmen».
Art der Anwendung
Nach vollständiger Rekonstitution des lyophilisierten Impfstoffs mit dem Lösungsmittel sollte Qdenga als subkutane Injektion verabreicht werden, vorzugsweise in den Oberarm im Bereich des Deltamuskels.
Qdenga darf nicht intravasal, intradermal oder intramuskulär injiziert werden.
Der Impfstoff darf nicht mit anderen Impfstoffen oder anderen parenteralen Arzneimitteln in derselben Spritze gemischt werden.
Hinweise zur Rekonstitution von Qdenga vor der Anwendung, siehe Abschnitt Hinweise für die Handhabung.
Kontraindikationen·Überempfindlichkeit gegen die Wirkstoffe oder einen der in «Zusammensetzung» genannten sonstigen Bestandteile oder Überempfindlichkeit gegen eine frühere Dosis von Qdenga.
·Personen mit angeborener oder erworbener Immundefizienz, einschliesslich Personen, die in den 4 Wochen vor der Impfung immunsuppressive Therapien wie hoch dosierte systemische Kortikosteroide (z.B. 20 mg/Tag oder 2 mg/kg Körpergewicht/Tag Prednison über mindestens 2 Wochen) oder jegliche andere Arzneimittel mit bekannten immunsuppressiven Eigenschaften, einschliesslich Chemotherapie, erhalten haben.
·Personen mit symptomatischer HIV-Infektion oder einer asymptomatischen HIV-Infektion, bei der Hinweise auf eine eingeschränkte Immunfunktion vorliegen.
·Schwangere (siehe «Schwangerschaft, Stillzeit»).
·Stillende Frauen (siehe «Schwangerschaft, Stillzeit»).
Warnhinweise und VorsichtsmassnahmenAnaphylaxie
Es wurden Fälle von Anaphylaxie bei Personen berichtet, die Qdenga erhalten haben. Wie bei allen injizierbaren Impfstoffen muss für den Fall einer seltenen anaphylaktischen Reaktion nach der Verabreichung des Impfstoffs eine geeignete medizinische Behandlung und Überwachung stets unmittelbar verfügbar sein.
Überprüfung der Krankengeschichte
Vor der Impfung ist die individuelle Anamnese zu prüfen (insbesondere im Hinblick auf frühere Impfungen und mögliche Überempfindlichkeitsreaktionen, die nach einer Impfung aufgetreten sind).
Begleiterkrankungen
Die Impfung mit Qdenga sollte bei Personen mit einer akuten schweren fiebrigen Erkrankung aufgeschoben werden. Bei Vorliegen einer leichten Infektion, wie z.B. einer Erkältung, sollte die Impfung nicht verschoben werden.
Risiken für Dengue-Naive Personen
Bei Personen, die in der Vergangenheit keine Dengue-Virus-Infektion durchgemacht haben, wurde eine Wirksamkeit gegen die Dengue-Virus-Serotypen 1 und 2 nachgewiesen, jedoch liessen die Daten aus klinischen Studien nicht auf eine Wirksamkeit gegen den Dengue-Virus-Serotyp 3 schliessen, und eine Wirksamkeit gegen den Dengue-Virus-Serotyp 4 konnte aufgrund von geringerer Fallinzidenz nicht gezeigt werden (siehe «Eigenschaften/Wirkungen» Langzeitschutz). Eine Zunahme des Schweregrads der Dengue-Erkrankung oder des hämorrhagischen Dengue Fiebers infolge einer Dengue-Virusinfektion wurde bei mit Qdenga geimpften Dengue-naiven Personen bisher nicht festgestellt, kann jedoch nicht endgültig ausgeschlossen werden. Das individuelle Nutzen Risiko Verhältnis muss dementsprechend für Dengue Naive Personen besonders sorgfältig abgewogen werden.
Einschränkungen der Impfstoffwirksamkeit
Möglicherweise wird nicht bei allen Geimpften durch Qdenga eine schützende Immunantwort gegen alle Serotypen des Dengue-Virus hervorgerufen, und diese kann mit der Zeit abnehmen (siehe «Eigenschaften/Wirkungen» Langzeitschutz). Es ist derzeit nicht bekannt, ob ein fehlender Schutz zu einem schwereren Dengue-Fieber führen könnte. Es wird empfohlen, auch nach der Impfung die persönlichen Schutzmassnahmen gegen Mückenstiche weiter anzuwenden. Personen, bei denen Symptome oder Warnzeichen einer Dengue-Infektion auftreten, sollten sich in ärztliche Behandlung begeben.
Zur Anwendung von Qdenga bei Personen über 60 Jahren liegen keine Daten vor, und zur Anwendung bei Patienten mit chronischen Erkrankungen liegen nur begrenzte Daten vor.
Angstbedingte Reaktionen
Angstbedingte Reaktionen, einschliesslich vasovagaler Reaktionen (Synkope), Hyperventilation oder stressbedingter Reaktionen, können im Zusammenhang mit der Impfung als psychogene Reaktion auf die Injektion mit einer Nadel auftreten. Es ist wichtig Vorkehrungen zu treffen, um Verletzungen durch Ohnmachtsanfälle zu vermeiden.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten wie bei anderen attenuierten Lebendimpfstoffen nach der Impfung mindestens einen Monat eine Schwangerschaft vermeiden (siehe «Schwangerschaft, Stillzeit» und «Kontraindikationen»).
Andere
Qdenga darf nicht als intravasale, intradermale oder intramuskuläre Injektion verabreicht werden.
Hilfsstoffe
Qdenga enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
Qdenga enthält weniger als 1 mmol Kalium (39 mg) pro Dosis, d.h. es ist nahezu «kaliumfrei».
InteraktionenBei Patienten, die eine Behandlung mit Immunglobulinen oder Immunglobulin-haltigen Blutprodukten wie Blut oder Plasma erhalten, empfiehlt es sich, mit der Anwendung von Qdenga mindestens 6 Wochen, bevorzugt bis 3 Monate nach dem Ende der Behandlung zu warten, um eine Neutralisierung der im Impfstoff enthaltenen attenuierten Viren zu vermeiden.
Qdenga sollte nicht an Personen verabreicht werden, die in den 4 Wochen vor der Impfung immunsuppressive Therapien wie hoch dosierte systemische Kortikosteroide oder jegliche andere Arzneimittel mit bekannten immunsuppressiven Eigenschaften, einschliesslich Chemotherapie, erhalten haben (siehe «Kontraindikationen»).
Anwendung mit anderen Impfstoffen
Bei einer gleichzeitigen Anwendung von Qdenga mit einem anderen Impfstoff sollten die Impfstoffe immer an unterschiedlichen Injektionsstellen verabreicht werden.
Qdenga kann gleichzeitig mit einem Hepatitis-A-Impfstoff verabreicht werden. Die gleichzeitige Verabreichung wurde bei Erwachsenen untersucht.
Qdenga kann gleichzeitig mit einem Gelbfieber-Impfstoff verabreicht werden. In einer klinischen Studie mit ungefähr 300 erwachsenen Probanden, die Qdenga gleichzeitig mit dem Gelbfieberimpfstoff 17D erhielten, ergab sich keine Auswirkung auf die Gelbfieber-Seroprotektionsrate. Die Dengue-Antikörperantworten waren nach gleichzeitiger Verabreichung von Qdenga und Gelbfieberimpfstoff 17D verringert. Die klinische Signifikanz dieses Ergebnisses ist nicht bekannt.
Qdenga kann gleichzeitig mit einem humanen Papillomvirus (HPV)-Impfstoff verabreicht werden (siehe «Eigenschaften/Wirkungen», Gleichzeitige Verabreichung mit HPV-Impfstoff).
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten eine Schwangerschaft für mindestens einen Monat nach der Impfung vermeiden. Frauen, die beabsichtigen schwanger zu werden, sollte eine Verschiebung der Impfung angeraten werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Kontraindikationen»).
Schwangerschaft
Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf eine Reproduktionstoxizität vor (siehe «Präklinische Daten»).
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Qdenga bei Schwangeren vor. Diese Daten reichen nicht aus, um mögliche Auswirkungen von Qdenga auf die Schwangerschaft, embryofetale Entwicklung, Geburt und postnatale Entwicklung auszuschliessen.
Qdenga ist ein attenuierter Lebendimpfstoff, daher ist Qdenga während der Schwangerschaft kontraindiziert (siehe « Kontraindikationen»).
Stillzeit
Es ist nicht bekannt, ob Qdenga in die Muttermilch übergeht. Ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden.
Qdenga ist während der Stillzeit kontraindiziert (siehe «Kontraindikationen»).
Fertilität
Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf eine Reproduktionstoxizität vor (siehe «Präklinische Daten»).
Es wurden keine speziellen Studien zur Fertilität beim Menschen durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenQdenga hat einen geringen Einfluss auf die Fahrtüchtigkeit und die Fähigkeit, Maschinen zu bedienen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In klinischen Studien waren die am häufigsten berichteten Reaktionen bei Probanden zwischen 4 und 60 Jahren Schmerzen an der Injektionsstelle (50%), Kopfschmerzen (35%), Myalgie (31%), Erythem an der Injektionsstelle (27%), Unwohlsein (24%), Asthenie (20%) und Fieber (11%).
Diese Nebenwirkungen traten gewöhnlich innerhalb von 2 Tagen nach der Injektion auf, waren leicht bis mittelschwer, waren von kurzer Dauer (1 bis 3 Tage) und traten nach der zweiten Injektion von Qdenga weniger häufig als nach der ersten Injektion auf.
Impfvirämie
In der klinischen Studie DEN-205 wurde nach der Impfung mit Qdenga bei 49% der Studienteilnehmer ohne vorherige Dengue-Infektion und bei 16% der Studienteilnehmer mit vorheriger Dengue-Infektion eine vorübergehende Impfvirämie beobachtet. Die Impfvirämie begann meist in der zweiten Woche nach der ersten Injektion und dauerte durchschnittlich 4 Tage und wurde nach der zweiten Dosis nur selten beobachtet. Die Impfvirämie ging bei einigen Probanden mit vorübergehenden, leichten bis mittelschweren Symptomen einher, wie Kopfschmerzen, Arthralgie, Myalgie und Ausschlag, die auch bei Dengue-Fieber auftreten können. Weitere vorübergehende Nebenwirkungen, die nach der Zulassung beobachtet wurden, waren Augenschmerzen, Thrombozytopenie und Petechien.
Diagnostische Tests auf Dengue-Fieber fallen möglicherweise während einer Impfvirämie positiv aus und können nicht zur Unterscheidung zwischen einer Impfvirämie und einer Infektion mit dem Wildtyp-Dengue-Virus eingesetzt werden.
Liste der unerwünschten Wirkungen
Unerwünschte Wirkungen in Verbindung mit Qdenga aus klinischen Studien und Erfahrungen nach der Zulassung sind nachstehend aufgeführt (Tabelle 1).
Das nachstehend dargestellte Sicherheitsprofil beruht auf Daten aus placebokontrollierten klinischen Studien und Erfahrungen nach der Zulassung. Die gepoolte Analyse der klinischen Studien beinhaltete Daten von 14'627 Studienteilnehmern im Alter von 4 bis 60 Jahren (13'839 Kinder und 788 Erwachsene), die mit Qdenga geimpft wurden. Diese beinhaltete eine Untergruppe zur Reaktogenität mit 3'830 Teilnehmern (3'042 Kinder und 788 Erwachsene).
Die unerwünschten Wirkungen sind gemäss folgenden Häufigkeitskategorien aufgeführt:
sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000), nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
Tabelle 1: Unerwünschte Wirkungen aus klinischen Studien (Alter 4 bis 60 Jahre) und Erfahrungen nach der Zulassung (Alter 4 Jahre und älter)
|
Systemorganklasse gemäss MedDRA
|
Häufigkeit
|
Unerwünschte Wirkung
| |
Infektionen und parasitäre Erkrankungen
|
Sehr häufig
|
Infektion der oberen Atemwegea
| |
Häufig
|
Nasopharyngitis
Pharyngotonsillitisb
| |
Gelegentlich
|
Bronchitis
Rhinitis
| |
Erkrankungen des Blutes und des Lymphsystems
|
Sehr selten
|
Thrombozytopeniec
| |
Erkrankungen des Immunsystems
|
Nicht bekannt
|
Anaphylaktische Reaktion, einschliesslich anaphylaktischer Schockc
| |
Stoffwechsel- und Ernährungsstörungen
|
Sehr häufig
|
Verminderter Appetitd
| |
Psychiatrische Erkrankungen
|
Sehr häufig
|
Reizbarkeitd
| |
Erkrankungen des Nervensystems
|
Sehr häufig
|
Kopfschmerzen
Somnolenzd
| |
Gelegentlich
|
Schwindelgefühl
| |
Augenerkrankungen
|
Gelegentlich
|
Augenschmerzenc
| |
Erkrankungen des Gastrointestinaltrakts
|
Gelegentlich
|
Diarrhoe
Übelkeit
Abdominalschmerz
Erbrechen
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Gelegentlich
|
Ausschlage
Pruritusf
Urtikaria
| |
Selten
|
Petechienc
| |
Sehr selten
|
Angioödem
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Sehr häufig
|
Myalgie
| |
Häufig
|
Arthralgie
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Sehr häufig
|
Schmerzen an der Injektionsstelle
Erythem an der Injektionsstelle
Unwohlsein
Asthenie
Fieber
| |
Häufig
|
Schwellung an der Injektionsstelle
Blaue Flecken an der Injektionsstellef
Jucken an der Injektionsstellef
Grippeähnliche Erkrankung
| |
Gelegentlich
|
Blutung an der Injektionsstellef
Ermüdungf
Verfärbung an der Injektionsstellef
|
a Umfasst Infektion der oberen Atemwege und virale Infektion der oberen Atemwege
b Umfasst Pharyngotonsillitis und Tonsillitis
c Nach der Zulassung beobachtete Nebenwirkung
d Bei Kindern unter 6 Jahren in klinischen Studien erhoben
e Umfasst Ausschlag, viralen Ausschlag, makulo-papulösen Ausschlag, juckenden Ausschlag
f Gemeldet bei Erwachsenen in klinischen Studien
Kinder und Jugendliche
Daten von Kindern und Jugendlichen im Alter von 4 bis 17 Jahren
Gepoolte Sicherheitsdaten aus klinischen Studien liegen für 13'839 Kinder vor (9'210 im Alter von 4 bis 11 Jahren und 4'629 im Alter von 12 bis 17 Jahren). Diese beinhalten bei 3'042 Kindern (1'865 im Alter von 4 bis 11 Jahren und 1'177 im Alter von 12 bis 17 Jahren) erfasste Reaktogenitätsdaten.
Die Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern entsprachen weitgehend jener bei Erwachsenen. Nebenwirkungen, die bei Kindern häufiger berichtet wurden als bei Erwachsenen, waren Fieber (11% gegenüber 3%), Infektion der oberen Atemwege (11% gegenüber 3%), Nasopharyngitis (6% gegenüber 0,6%), Pharyngotonsillitis (2% gegenüber 0,3%) und grippeähnliche Erkrankung (1% gegenüber 0,1%). Nebenwirkungen, die bei Kindern weniger häufig berichtet wurden als bei Erwachsenen, waren Erythem an der Injektionsstelle (2% gegenüber 27%), Übelkeit (0,03% gegenüber 0,8%) und Arthralgie (0,03% gegenüber 1%).
Die folgenden Reaktionen wurden bei 357 mit Qdenga geimpften Kindern unter 6 Jahren erfasst:
verminderter Appetit (17%), Somnolenz (13%) und Reizbarkeit (12%).
Daten von Kindern im Alter von unter 4 Jahren, d.h. ausserhalb der für die Anwendung vorgesehenen Altersgruppe
Die Reaktogenität wurde bei 78 Probanden unter 4 Jahren beurteilt, die mindestens eine Dosis Qdenga erhielten, wobei 13 Probanden die vorgesehenen 2 Dosen erhielten. Sehr häufig berichtete Reaktionen waren Reizbarkeit (25%), Fieber (17%), Schmerzen an der Injektionsstelle (17%) und Appetitverlust (15%). Somnolenz (8%) und Erythem an der Injektionsstelle (3%) wurden häufig berichtet. Schwellungen an der Injektionsstelle wurden bei Probanden unter 4 Jahren nicht beobachtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs wurden keine Fälle einer Überdosierung berichtet.
Eigenschaften/WirkungenATC-Code
J07BX04
Wirkungsmechanismus
Qdenga enthält lebende, attenuierte Dengue-Viren. Der primäre Wirkmechanismus von Qdenga ist die lokale Replikation und Auslösung von humoralen und zellulären Immunantworten gegen die vier Dengue-Virus-Serotypen.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Die klinische Wirksamkeit von Qdenga wurde in Studie DEN-301, einer doppelblinden, randomisierten, placebo-kontrollierten pivotalen Phase-III-Studie, die in 5 lateinamerikanischen Ländern (Brasilien, Kolumbien, Dominikanische Republik, Nicaragua, Panama) und 3 asiatischen Ländern (Sri Lanka, Thailand, Philippinen) durchgeführt wurde, beurteilt. Insgesamt erhielten 20'099 Kindern zwischen 4 und 16 Jahren randomisiert (im Verhältnis 2:1) entweder Qdenga oder Placebo, unabhängig von einer vorherigen Dengue-Infektion.
Die Wirksamkeit wurde mittels aktiver Überwachung über die gesamte Studiendauer beurteilt. Jeder Proband mit fiebriger Erkrankung (definiert als Fieber ≥38°C an 2 von 3 aufeinanderfolgenden Tagen) musste das Prüfzentrum zur Dengue-Fieber-Beurteilung durch den Prüfarzt aufsuchen. Probanden/Erziehungsberechtigte wurden mindestens wöchentlich an diese Anforderung erinnert, um die Erkennung aller symptomatischen, virologisch bestätigten Fälle von Dengue-Fieber (VCD-Fällen) zu maximieren. Fiebrige Episoden wurden mittels einer validierten, quantitativen Dengue-RT-PCR zur Ermittlung des spezifischen Dengue-Serotyps bestätigt.
Klinische Wirksamkeitsdaten für Probanden im Alter von 4 bis 16 Jahren
Die Ergebnisse zur Impfstoffwirksamkeit (Vaccine Efficacy, VE) sind gemäss dem primären Endpunkt (VCD-Fieber, das von 30 Tagen bis zu 12 Monaten nach der zweiten Impfung auftritt) in Tabelle 2 dargestellt. Das Durchschnittsalter der Per-Protokoll-Studienpopulation betrug 9,6 Jahre (Standardabweichung 3,5 Jahre) mit 12,7% Probanden zwischen 4 und 5 Jahren, 55,2% zwischen 6 und 11 Jahren und 32,1% zwischen 12 und 16 Jahren. Davon waren 46,5% in Asien und 53,5% in Lateinamerika, 49,5% waren weiblich und 50,5% männlich. Der Dengue-Serostatus zum Ausgangszeitpunkt (vor der ersten Injektion) wurde bei allen Probanden durch Mikroneutralisationstests (MNT50) bestimmt, um die Beurteilung der Impfstoffwirksamkeit (Vaccine Efficacy, VE) nach Serostatus zum Ausgangszeitpunkt zu ermöglichen. Die Dengue-Seronegativitätsrate für die Per-Protokoll-Gesamtpopulation betrug zum Ausgangszeitpunkt 27,7%.
Tabelle 2: Impfstoffwirksamkeit bei der Prävention von VCD-Fieber, unabhängig vom Serotyp, von 30 Tagen bis zu 12 Monaten nach der zweiten Impfung in der Studie DEN-301 (Per-Protokoll-Set)a
|
|
Qdenga
N = 12'700b
|
Placebo
N = 6'316b
| |
VCD-Fieber, n (%)
|
61 (0,5)
|
149 (2,4)
| |
Impfstoffwirksamkeit (95%-KI) (%)
|
80,2 (73,3; 85,3)
| |
p-Wert
|
< 0,001
|
KI: Konfidenzintervall; n: Anzahl der Probanden mit Fieber; VCD: virologisch bestätigtes Dengue-Fieber
a Die primäre Analyse der Wirksamkeitsdaten basierte auf dem Per-Protokoll-Set, bestehend aus allen randomisierten Probanden, bei denen keine schweren Prüfplanverstösse vorlagen, auch nicht der Nichterhalt beider Dosen von Qdenga oder Placebo, wie jeweils zugewiesen
b Anzahl ausgewerteter Probanden
Die VE-Ergebnisse gemäss den sekundären Endpunkten, Vermeidung von Hospitalisierung aufgrund von VCD-Fieber und Prävention von VCD-Fieber nach Serostatus, sind nach Serotyp und Prävention von schwerwiegendem VCD-Fieber in Tabelle 3 dargestellt. Hinsichtlich schwerwiegendem VCD-Fieber wurden zwei Arten von Endpunkten berücksichtigt: klinisch schwerwiegende VCD-Fälle und VCD-Fälle, welche die WHO-Kriterien von 1997 für hämorrhagisches Dengue-Fieber (DHF) erfüllen. Die in Studie DEN-301 verwendeten Kriterien für die Bewertung des VCD-Schweregrads durch ein unabhängiges «Dengue Case Severity Adjudication Committee» (DCAC) basierten auf den WHO-Leitlinien von 2009. Das DCAC bewertete alle Fälle von Hospitalisierung aufgrund von VCD mithilfe vordefinierter Kriterien, die eine Beurteilung von abnormen Blutungen, Plasmaaustritt, Leberfunktion, Nierenfunktion, Herzfunktion, Zentralnervensystem und Schock beinhalteten. In der Studie DEN-301 wurden VCD-Fälle, die den WHO-Kriterien für DHF von 1997 entsprachen, anhand eines programmierten Algorithmus identifiziert, d.h. ohne medizinische Beurteilung. Im Wesentlichen umfassten die Kriterien Vorhandensein von Fieber über 2 bis 7 Tage, hämorrhagische Tendenzen, Thrombozytopenie und Nachweis von Plasmaaustritt.
Tabelle 3: Impfstoffwirksamkeit bei der Vermeidung von Hospitalisierung aufgrund von VCD-Fieber, VCD-Fieber nach Dengue-Serotyp, VCD-Fieber nach Dengue-Serostatus zum Ausgangszeitpunkt und von schweren Formen von Dengue-Fieber von 30 Tagen bis zu 18 Monaten nach der zweiten Impfung in der Studie DEN-301 (Per-Protokoll-Set)
|
|
Qdenga
N = 12'700a
|
Placebo
N = 6'316a
|
VE (95%-KI)
| |
VE bei der Vermeidung von Hospitalisierungen aufgrund von VCD-Fieberb, n (%)
| |
Hospitalisierungen aufgrund von VCD-Fieberc
|
13 (0,1)
|
66 (1,0)
|
90,4 (82,6; 94,7)d
| |
VE bei der Prävention von VCD-Fieber nach Dengue-Serotyp, n (%)
| |
VCD-Fieber, verursacht durch DENV-1
|
38 (0,3)
|
62 (1,0)
|
69,8 (54,8; 79,9)
| |
VCD-Fieber, verursacht durch DENV-2
|
8 (<0,1)
|
80 (1,3)
|
95,1 (89,9; 97,6)
| |
VCD-Fieber, verursacht durch DENV-3
|
63 (0,5)
|
60 (0,9)
|
48,9 (27,2; 64,1)
| |
VCD-Fieber, verursacht durch DENV-4
|
5 (<0,1)
|
5 (<0,1)
|
51,0 (-69,4; 85,8)
| |
VE bei der Prävention von VCD-Fieber nach Dengue-Fieber-Serostatus zum Ausgangszeitpunkt, n (%)
| |
VCD-Fieber bei allen Probanden
|
114 (0,9)
|
206 (3,3)
|
73,3 (66,5; 78,8)
| |
VCD-Fieber bei Probanden, die zum Ausgangszeitpunkt seropositiv waren
|
75 (0,8)
|
150 (3,3)
|
76,1 (68,5; 81,9)
| |
VCD-Fieber bei Probanden, die zum Ausgangszeitpunkt seronegativ waren
|
39 (1,1)
|
56 (3,2)
|
66,2 (49,1; 77,5)
| |
VE bei der Prävention von DHF, welches durch einen beliebigen Dengue-Serotyp hervorgerufen wurde, n (%)
| |
Insgesamt
|
2 (<0,1)
|
7 (0,1)
|
85,9 (31,9; 97,1)
| |
VE bei der Prävention von schwerwiegendem Dengue-Fieber, das durch einen beliebigen Dengue-Serotyp hervorgerufen wurde, n (%)
| |
Insgesamt
|
2 (<0,1)
|
1 (<0,1)
|
2,3 (-977,5; 91,1)
|
VE: Impfstoffwirksamkeit; KI: Konfidenzintervall; n: Anzahl der Probanden; VCD: virologisch bestätigtes Dengue-Fieber; DENV: Dengue-Virus-Serotyp
a Anzahl ausgewerteter Probanden
b Wichtigster sekundärer Endpunkt
c Die meisten der beobachteten Fälle waren auf DENV-2 zurückzuführen (0 Fälle im Qdenga-Arm und 46 Fälle im Placebo-Arm).
d p-Wert <0,001
Es wurde ein frühes Einsetzen der Schutzwirkung, mit einer explorativen VE von 81,1% (95%-KI: 64,1%; 90,0%) gegen VCD-Fieber, verursacht durch alle Serotypen zusammengenommen, von der ersten Impfung bis zur zweiten Impfung, beobachtet.
Langzeitschutz
In Studie DEN-301 wurden mehrere explorative Analysen durchgeführt, um den Langzeitschutz von der ersten Dosis bis zu 4,5 Jahre nach der zweiten Dosis zu schätzen (Tabelle 4).
Tabelle 4: Impfstoffwirksamkeit bei der Prävention von VCD-Fieber und Hospitalisierungen insgesamt, nach Dengue-Serostatus zum Ausgangszeitpunkt und gegen einzelne Serotypen nach Serostatus zum Ausgangszeitpunkt von der ersten Dosis bis 54 Monate nach der zweiten Dosis in der Studie DEN-301 (Sicherheits-Set)
|
|
Qdenga
n/N
|
Placebo n/N
|
VE (95% KI) bei der Prävention von VCD-Fiebera
|
Qdenga n/N
|
Placebo n/N
|
VE (95% KI) bei der Vermeidung von Hospitalisierung aufgrund von VCD-Fiebera
| |
Insgesamt
|
442/13'380
|
547/6'687
|
61,2 (56,0; 65,8)
|
46/13'380
|
142/6'687
|
84,1 (77,8; 88,6)
| |
Zum Ausgangszeitpunkt seronegativ, N = 5'546
| |
Beliebiger Serotyp
|
147/3'714
|
153/1'832
|
53,5 (41,6; 62,9)
|
17/3'714
|
41/1'832
|
79,3 (63,5; 88,2)
| |
DENV-1
|
89/3'714
|
79/1'832
|
45,4 (26,1; 59,7)
|
6/3'714
|
14/1'832
|
78,4 (43,9; 91,7)
| |
DENV-2
|
14/3'714
|
58/1'832
|
88,1 (78,6; 93,3)
|
0/3'714
|
23/1'832
|
100 (88,5; 100)b
| |
DENV-3
|
36/3714
|
16/1'832
|
-15,5 (-108,2; 35,9)
|
11/3'714
|
3/1'832
|
-87,9 (-573,4; 47,6)
| |
DENV-4
|
12/3'714
|
3/1'832
|
-105,6 (-628,7; 42,0)
|
0/3'714
|
1/1'832
|
NPc
| |
Zum Ausgangszeitpunkt seropositiv, N = 14'517
|
| |
Beliebiger Serotyp
|
295/9'663
|
394/4'854
|
64,2 (58,4; 69,2)
|
29/9'663
|
101/4'854
|
85,9 (78,7; 90,7)
| |
DENV-1
|
133/9'663
|
151/4'854
|
56,1 (44,6; 65,2)
|
16/9'663
|
24/4'854
|
66,8 (37,4; 82,3)
| |
DENV-2
|
54/9'663
|
135/4'854
|
80,4 (73,1; 85,7)
|
5/9'663
|
59/4'854
|
95,8 (89,6; 98,3)
| |
DENV-3
|
96/9'663
|
97/4'854
|
52,3 (36,7; 64,0)
|
8/9'663
|
15/4'854
|
74,0 (38,6; 89,0)
| |
DENV-4
|
12/9'663
|
20/4'854
|
70,6 (39,9; 85,6)
|
0/9'663
|
3/4'854
|
NPc
|
VE: Impfstoffwirksamkeit, KI: Konfidenzintervalll, VCD: virologisch bestätigtes Dengue-Fieber, n: Anzahl der Probanden, N: Anzahl der ausgewerteten Probanden, NP: not provided (nicht angegeben)
a Explorative Analysen; die Studie hatte weder die Teststärke noch das Design, um einen Unterschied zwischen dem Impfstoff- und dem Placebo-Arm zu zeigen
b Geschätzt mit einem einseitigen 95% KIc VE-Schätzung nicht angegeben, da für Qdenga und Placebo weniger als 6 Fälle beobachtet wurden.
Ferner betrug die VE bei der Prävention von DHF, welches durch einen beliebigen Serotyp verursacht wurde, 70,0% (95%-KI: 31,5%; 86,9%) und bei der Prävention von klinisch schwerwiegenden VCD-Fällen, welche durch einen beliebigen Serotyp verursacht wurden, 70,2% (95%-KI: -24,7%; 92,9%).
Bei Probanden, die zum Ausgangszeitpunkt Dengue-seropositiv waren, wurde für alle vier Serotypen eine VE bei der Prävention von VCD-Fieber gezeigt. Bei Probanden, die zum Ausgangszeitpunkt seronegativ waren, wurde eine VE für DENV-1 und DENV-2 nachgewiesen, nicht jedoch für DENV-3. Für DENV-4 konnte diese aufgrund von geringerer Fallinzidenz nicht gezeigt werden (Tabelle 4).
Bis viereinhalb Jahre nach der zweiten Dosis wurde eine Analyse auf Jahresbasis durchgeführt (Tabelle 5).
Tabelle 5: Impfstoffwirksamkeit bei der Prävention von VCD-Fieber und Hospitalisierungen insgesamt und nach Dengue-Serostatus zum Ausgangszeitpunkt in Jahresabständen 30 Tage nach der zweiten Dosis in der Studie DEN-301 (Per-Protokoll-Set)
|
|
|
VE (95%-KI) bei der Prävention von VCD-Fieber
Na = 19'021
|
VE (95%-KI) bei der Vermeidung von Hospitalisierung aufgrund von VCD-Fieber
Na = 19'021
| |
Jahr 1b
|
Insgesamt
|
80,2 (73,3; 85,3)
|
95,4 (88,4; 98,2)
| |
|
Nach Dengue-Serostatus zum Ausgangszeitpunkt
|
|
| |
|
Seropositiv
|
82,2 (74,5; 87,6)
|
94,4 (84,4; 98,0)
| |
|
Seronegativ
|
74,9 (57,0; 85,4)
|
97,2 (79,1; 99,6)
| |
Jahr 2c
|
Insgesamt
|
56,2 (42,3; 66,8)
|
76,2 (50,8; 88,4)
| |
|
Nach Dengue-Serostatus zum Ausgangszeitpunkt
|
|
| |
|
Seropositiv
|
60,3 (44,7; 71,5)
|
85,2 (59,6; 94,6)
| |
|
Seronegativ
|
45,3 (9,9; 66,8)
|
51,4 (-50,7; 84,3)
| |
Jahr 3d
|
Insgesamt
|
45,0 (32,9; 55,0)
|
70,8 (49,6; 83,0)
| |
|
Nach Dengue-Serostatus zum Ausgangszeitpunkt
|
|
| |
|
Seropositiv
|
48,7 (34,8; 59,6)
|
78,4 (57,1; 89,1)
| |
|
Seronegativ
|
35,5 (7,4, 55,1)
|
45,0 (-42,6; 78,8)
| |
Jahr 4e
|
Insgesamt
|
62,8 (41,4; 76,4)
|
96,4 (72,2; 99,5)
| |
|
Nach Dengue-Serostatus zum Ausgangszeitpunkt
|
|
| |
|
Seropositiv
|
64,1 (37,4; 79,4)
|
94,0 (52,2; 99,3)
| |
|
Seronegativ
|
60,2 (11,1; 82,1)
|
NPf
|
VE: Impfstoffwirksamkeit, KI: Konfidenzintervall, VCD: virologisch bestätigtes Dengue-Fieber, NP: not provided (nicht angegeben), N: Gesamtzahl der Probanden im Per-Protokoll-Analyseset, a Anzahl der ausgewerteten Probanden ist in jedem Jahr anders.
b Jahr 1 bezieht sich auf die 11 Monate ab 30 Tage nach der zweiten Dosis.
c Jahr 2 bezieht sich auf Monat 13 bis 24 nach der zweiten Dosis.
d Jahr 3 bezieht sich auf Monat 25 bis 36 nach der zweiten Dosis.
e Jahr 4 bezieht sich auf Monat 37 bis 48 nach der zweiten Dosis.
f VE-Schätzung nicht angegeben, da für Qdenga und Placebo weniger als 6 Fälle beobachtet wurden.
Klinische Wirksamkeit für Personen ab 17 Jahren
Es wurde keine klinische Wirksamkeitsstudie mit Probanden ab 17 Jahren durchgeführt. Die Wirksamkeit von Qdenga bei Personen ab 17 Jahren wird von der klinischen Wirksamkeit bei den 4- bis 16-Jährigen mittels Übertragung von Immunogenitätsdaten abgeleitet (siehe unten).
Immunogenität
Da es keine Korrelate für den Schutz vor Dengue-Fieber gibt, ist die klinische Relevanz der Immunogenitätsdaten noch nicht vollständig geklärt.
Immunogenitätsdaten für Probanden von 4 bis 16 Jahren in Endemiegebieten
Die geometrischen Mittelwerte der Titer (GMT) nach Dengue-Serostatus zum Ausgangszeitpunkt bei Probanden zwischen 4 und 16 Jahren in der Studie DEN-301 sind in Tabelle 6 dargestellt.
Tabelle 6: Immunogenität nach Dengue-Serostatus zum Ausgangszeitpunkt in Studie DEN-301 (Per-Protokoll-Set hinsichtlich Immunogenität)a
|
|
Beim Ausgangszeitpunkt seropositiv
|
Beim Ausgangszeitpunkt seronegativ
| |
Vor der Impfung
N = 1'816*
|
1 Monat
nach der 2. Dosis
N = 1'621
|
Vor der Impfung
N = 702
|
1 Monat
nach der 2. Dosis
N = 641
| |
DENV-1
GMT
95%-KI
|
411,3
(366,0; 462,2)
|
2'115,2
(1'957,0; 2'286,3)
|
5,0
NE**
|
184,2
(168,6; 201,3)
| |
DENV-2
GMT
95%-KI
|
753,1
(681,0; 832,8)
|
4'897,4
(4'645,8; 5'162,5)
|
5,0
NE**
|
1'729,9
(1'613,7; 1'854,6)
| |
DENV-3
GMT
95%-KI
|
357,7
(321,3; 398,3)
|
1'761,0
(1'645,9; 1'884,1)
|
5,0
NE**
|
228,0
(211,6; 245,7)
| |
DENV-4
GMT
95%-KI
|
218,4
(198,1; 240,8)
|
1'129,4
(1'066,3; 1'196,2)
|
5,0
NE**
|
143,9
(133,6; 155,1)
|
N: Anzahl ausgewerteter Probanden; DENV: Dengue-Virus; GMT: geometrische Mittelwerte der Titer; KI: Konfidenzintervall; NE: not estimated (nicht geschätzt)
a Die Immunogenitätsuntergruppe war eine zufällig ausgewählte Teilmenge von Probanden und das Per-Protokoll-Set für Immunogenität waren jene Probanden aus der Untergruppe, die auch dem Per-Protokoll-Set angehörten
* Für DENV-2 und DENV-3: N = 1815
** Alle Probanden wiesen GMT-Werte unterhalb der LLOD (10) auf. Daher wurden für diese ein Wert von 5 und keine KI-Werte berichtet
Immunogenitätsdaten für Probanden von 18 bis 60 Jahren in nicht endemischen Gebieten
Die Immunogenität von Qdenga bei Erwachsenen zwischen 18 und 60 Jahren wurde in DEN-304, einer doppelblinden, randomisierten, Placebo-kontrollierten Phase-III-Studie, in einem nicht endemischen Land (USA) beurteilt. Die GMT nach der 2. Dosis sind in Tabelle 7 dargestellt.
Tabelle 7: GMT von Dengue-neutralisierenden Antikörpern in Studie DEN-304 (Per-Protokoll-Set)
|
|
Beim Ausgangszeitpunkt seropositiv*
|
Beim Ausgangszeitpunkt seronegativ*
| |
Vor der Impfung
N = 68
|
1 Monat
nach der 2. Dosis
N = 67
|
Vor der Impfung
N = 379
|
1 Monat
nach der 2. Dosis
N = 367
| |
DENV-1
GMT
95%-KI
|
13,9
(9,5; 20,4)
|
365,1
(233,0; 572,1)
|
5,0
NE**
|
268,1
(226,3; 317,8)
| |
DENV-2
GMT
95%-KI
|
31,8
(22,5; 44,8)
|
3'098,0
(2'233,4; 4'297,2)
|
5,0
NE**
|
2'956,9
(2'635,9; 3'316,9)
| |
DENV-3
GMT
95%-KI
|
7,4
(5,7; 9,6)
|
185,7
(129,0; 267,1)
|
5,0
NE**
|
128,9
(112,4; 147,8)
| |
DENV-4
GMT
95%-KI
|
7,4
(5,5; 9,9)
|
229,6
(150,0; 351,3)
|
5,0
NE**
|
137,4
(121,9; 155,0)
|
N: Anzahl ausgewerteter Probanden; DENV: Dengue-Virus; GMT: geometrische Mittelwerte der Titer; KI: Konfidenzintervall; NE: not estimated (nicht geschätzt)
* Gepoolte Daten aus tetravalenten Dengue-Impfstoff-Chargen 1, 2 und 3
** Alle Probanden wiesen GMT-Werte unterhalb der LLOD (10) auf. Daher wurden für diese ein Wert von 5 und keine KI-Werte berichtet
Die Übertragung der Wirksamkeit beruht auf Immunogenitätsdaten und -ergebnissen aus einer Nicht-Unterlegenheitsanalyse, die die GMT nach der Impfung der DEN-301- und DEN-304-Populationen, die beim Ausgangszeitpunkt Dengue-seronegativ waren, verglich (Tabelle 8). Bei Erwachsenen ist ein Schutz gegen Dengue-Fieber zu erwarten, obwohl der tatsächliche Grad der Wirksamkeit im Verhältnis zu der beobachteten Wirksamkeit bei Kindern und Jugendlichen unbekannt ist.
Tabelle 8: GMT-Verhältnisse zwischen Probanden in den Studien DEN-301 (4 – 16 Jahre) und DEN-304 (18 – 60 Jahre), die beim Ausgangszeitpunkt Dengue-seronegativ waren (Per-Protokoll-Set für Immunogenität)
|
GMT-Verhältnis*
(95%-KI)
|
DENV-1
|
DENV-2
|
DENV-3
|
DENV-4
| |
1 Monat nach der 2. Dosis
|
0,69 (0,58; 0,82)
|
0,59 (0,52; 0,66)
|
1,77 (1,53; 2,04)
|
1,05 (0,92; 1,20)
| |
6 Monate nach der 2. Dosis
|
0,62 (0,51; 0,76)
|
0,66 (0,57; 0,76)
|
0,98 (0,84; 1,14)
|
1,01 (0,86; 1,18)
|
DENV: Dengue-Virus; GMT: geometrische Mittelwerte der Titer; KI: Konfidenzintervall; M: Monat(e)
*Nicht-Unterlegenheit: obere Grenze des 95%-KI weniger als 2,0.
Langzeitpersistenz von Antikörpern
Die Langzeitpersistenz von neutralisierenden Antikörpern wurde in der Studie DEN-301 gezeigt, mit Titern, die für alle vier Serotypen bis zu 51 Monate nach der ersten Dosis noch deutlich über den Werten vor der Impfung lagen.
Gleichzeitige Verabreichung mit HPV-Impfstoff
In der Studie DEN-308 mit ungefähr 300 Probanden im Alter von 9 bis 14 Jahren, die Qdenga gleichzeitig mit einem 9valenten HPV-Impfstoff erhielten, ergab sich keine Auswirkung auf die Immunantwort auf den HPV-Impfstoff. In der Studie wurde nur die gleichzeitige Verabreichung der ersten Dosen von Qdenga und des 9valenten HPV-Impfstoffs untersucht. Die Nicht-Unterlegenheit der Immunantwort auf Qdenga bei gleichzeitiger Verabreichung von Qdenga mit dem 9valenten HPV-Impfstoff wurde in der Studie nicht direkt beurteilt. In der Dengue-seronegativen Studienpopulation lagen die Dengue-Antikörperreaktionen nach der gleichzeitigen Verabreichung im gleichen Bereich wie in der Phase-III-Studie (DEN-301), in der eine Wirksamkeit gegen VCD und hospitalisierte VCD nachgewiesen wurde.
PharmakokinetikEs wurden keine pharmakokinetischen Studien mit Qdenga durchgeführt.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenBasierend auf den konventionellen Studien zu Einzeldosen, lokaler Toleranz, Toxizität bei wiederholter Gabe sowie Reproduktions- und Entwicklungstoxizität lassen die präklinischen Sicherheitsdaten keine besonderen Gefahren für den Menschen erkennen. In einer Studie zur Verbreitung und Ausscheidung erfolgte keine Ausscheidung von Qdenga-RNA in den Stuhl und Urin, was ein geringes Risiko einer Impfstoff-Freisetzung in die Umwelt oder Weitergabe durch Geimpfte bestätigt. Eine Studie zur Neurovirulenz ergab, dass Qdenga nicht neurotoxisch wirkt.
Wenngleich kein relevantes Risiko festgestellt wurde, ist die Relevanz der Studien zur Reproduktionstoxizität eingeschränkt, da das Dengue-Virus Kaninchen nicht infizieren kann.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel mit Ausnahme des mitgelieferten Lösungsmittels nicht mit anderen Impfstoffen oder Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach der Rekonstitution mit dem mitgelieferten Lösungsmittel sollte Qdenga sofort verwendet werden.
Wenn es nicht sofort verwendet wird, muss Qdenga innerhalb von 2 Stunden verwendet werden.
Die chemische und physikalische Stabilität nach Anbruch wurde für 2 Stunden bei Raumtemperatur (bis zu 32,5°C) ab dem Zeitpunkt der Rekonstitution der Impfstoff-Durchstechflasche belegt. Nach Ablauf dieses Zeitraums muss der Impfstoff verworfen werden. Legen Sie ihn nicht zurück in den Kühlschrank.
Aus mikrobiologischer Sicht sollte Qdenga sofort verwendet werden. Wird der Impfstoff nicht sofort verwendet, liegen die Lagerzeiten und -bedingungen nach dem Anbruch in der Verantwortung des Anwenders.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Qdenga ist ein Impfstoff mit 2 Komponenten, bestehend aus einer Durchstechflasche mit dem lyophilisierten Impfstoff und einem Lösungsmittel in der Fertigspritze. Der lyophilisierte Impfstoff muss vor der Verabreichung mit dem Lösungsmittel rekonstituiert werden.
Qdenga darf nicht mit anderen Impfstoffen in derselben Spritze gemischt werden.
Verwenden Sie zur Rekonstitution von Qdenga ausschliesslich das Lösungsmittel (0,22% Natriumchlorid-Lösung) in der Fertigspritze, das mit dem Impfstoff geliefert wird, da es frei von Konservierungsmitteln bzw. anderen antiviralen Substanzen ist. Der Kontakt mit Konservierungsmitteln, Antiseptika, Reinigungsmitteln und anderen antiviralen Substanzen muss vermieden werden, da sie den Impfstoff inaktivieren könnten.
Nehmen Sie die Durchstechflasche mit dem Impfstoff und die Fertigspritze mit dem Lösungsmittel aus dem Kühlschrank.
|
|
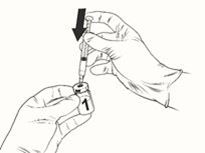
Durchstechflasche mit lyophilisiertem Impfstoff
|
·Entfernen Sie die Schutzkappe von der Durchstechflasche mit dem Impfstoff und reinigen Sie die Oberfläche des Gummistopfens an der Oberseite der Durchstechflasche mit einem Alkoholtupfer.
·Befestigen Sie eine sterile Nadel an der Fertigspritze und stechen Sie die Nadel in die Impfstoff-Durchstechflasche. Die empfohlene Nadel ist 23G.
·Richten Sie den Fluss des Lösungsmittels auf die Wand der Durchstechflasche, während Sie den Kolben langsam herunterdrücken, um die Wahrscheinlichkeit von Blasenbildung zu reduzieren.
| |
|
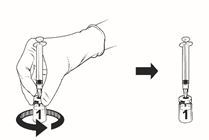
Rekonstituierter Impfstoff
|
·Nehmen Sie Ihren Finger vom Kolben, stellen Sie die Durchstechflasche auf eine ebene Fläche und schwenken Sie die Durchstechflasche mit aufgesetzter Spritze vorsichtig in beide Richtungen.
·NICHT SCHÜTTELN. Im rekonstituierten Produkt kann es zu Schaum- und Blasenbildung kommen.
·Lassen Sie die Durchstechflasche mit aufgesetzter Spritze eine Weile stehen, bis die Lösung klar wird. Dies dauert ca. 30 – 60 Sekunden.
|
Nach der Rekonstitution sollte die resultierende Lösung klar, farblos bis blassgelb und im Wesentlichen frei von Fremdpartikeln sein. Entsorgen Sie den Impfstoff, wenn Partikel vorhanden sind und/oder wenn er verfärbt erscheint.
|
|
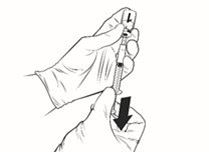
Rekonstituierter Impfstoff
|
·Entnehmen Sie die gesamte Menge der rekonstituierten Qdenga-Lösung mit derselben Spritze, bis eine Luftblase in der Spritze erscheint.
·Nehmen Sie die Spritze und Nadel aus der Durchstechflasche. Halten Sie die Spritze mit der Nadel nach oben, tippen Sie seitlich die Spritze an, um die Luftblasen an die Oberfläche steigen zu lassen, verwerfen Sie die aufgesetzte Nadel und ersetzen Sie sie durch eine neue sterile Nadel, drücken Sie die Luftblase heraus, bis sich ein kleiner Tropfen Flüssigkeit an der Spitze der Nadel bildet. Die empfohlene Nadel ist 25G 16 mm.
·Qdenga ist nun zur Verabreichung als subkutane Injektion bereit.
|
Qdenga sollte unmittelbar nach der Rekonstitution verabreicht werden. Die chemische und physikalische Stabilität nach Anbruch wurde für 2 Stunden bei Raumtemperatur (bis zu 32,5°C) ab dem Zeitpunkt der Rekonstitution der Impfstoff-Durchstechflasche belegt. Nach Ablauf dieses Zeitraums muss der Impfstoff verworfen werden. Legen Sie ihn nicht zurück in den Kühlschrank. Aus mikrobiologischer Sicht sollte Qdenga sofort verwendet werden. Wird der Impfstoff nicht sofort verwendet, liegen die Lagerzeiten und -bedingungen nach dem Anbruch in der Verantwortung des Anwenders.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer69403 (Swissmedic)
PackungenPulver in einer Durchstechflasche und Lösungsmittel in einer Fertigspritze mit 2 separaten Nadeln: Packung mit 1 Stück (B)
ZulassungsinhaberinTakeda Pharma AG, Opfikon
Stand der InformationSeptember 2025
|



