Rebif® RebiDoseWas ist Rebif RebiDose und wann wird es angewendet?Multiple Sklerose ist eine Krankheit, die das Zentralnervensystem befällt. Ihr Ursprung ist noch nicht klar festgestellt, man nimmt jedoch an, dass diese Krankheit mit einer anormalen Reaktion des Immunsystems in Zusammenhang steht.
Interferone werden vom Körper hergestellt und spielen eine wesentliche Rolle im Immunsystem. Durch Mechanismen, die noch nicht vollständig verstanden werden, helfen sie, die Wirkungen der Multiplen Sklerose auf das Zentralnervensystem zu begrenzen.
Rebif gehört zur Klasse der Interferone. Sein Wirkstoff ist in tierischen Zellen gentechnologisch hergestelltes Interferon-beta-1a.
Rebif wird zur Behandlung der schubweise fortschreitenden Multiplen Sklerose angewendet. Es verringert nachweislich die Anzahl und Schwere von Schüben und verlangsamt das Fortschreiten der Behinderung. Darüber hinaus kann Rebif auch bei Patienten angewendet werden, bei denen zum ersten Mal Symptome auftreten, die auf ein hohes Risiko hinweisen, eine Multiple Sklerose zu entwickeln.
Bevor Sie behandelt werden, wird Ihr Arzt bzw. Ihre Ärztin alle anderen möglichen Ursachen für Ihre Beschwerden ausschliessen.
Dieses Arzneimittel wurde Ihnen persönlich verschrieben; Sie dürfen es nicht an andere Personen weitergeben.
Dieses Arzneimittel darf nur auf Verschreibung des Arztes oder der Ärztin angewendet werden.
Was sollte dazu beachtet werden?Der Arzt bzw. die Ärztin entscheidet von Fall zu Fall über die geeignete Behandlung. Befolgen Sie seine Anweisungen genauestens.
Wann darf Rebif RebiDose nicht angewendet werden?Rebif darf im Falle einer Allergie oder einer Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe des Arzneimittels nicht angewendet werden.
Rebif darf bei Patienten mit schweren depressiven Störungen und/oder Selbstmordgedanken nicht angewendet werden.
Wann ist bei der Anwendung von Rebif RebiDose Vorsicht geboten?Rebif darf nur unter Aufsicht Ihres Arztes bzw. Ihrer Ärztin angewendet werden. Bei Kindern und Jugendlichen zwischen 2 und 17 Jahren liegen begrenzte Erfahrungen zur Anwendung von Rebif vor. Patienten, die jünger als 2 Jahre sind, sollten Rebif nicht anwenden, da das Arzneimittel bei diesem Patientenkreis unzureichend untersucht wurde.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin darüber, wenn Sie an einer Erkrankung des Knochenmarks, der Schilddrüse oder an Nieren- oder Leberproblemen leiden oder wenn Sie in der Vergangenheit epileptische Anfälle hatten. Ist dies der Fall, muss der Arzt bzw. die Ärztin Ihre Behandlung sorgfältiger überwachen und in regelmässigen Abständen Ihr Blut überprüfen.
Wenden Sie sich sofort an Ihren Arzt bzw. Ihre Ärztin, wenn Sie depressive oder Selbstmordgedanken haben.
Setzen Sie Ihren Arzt bzw. Ihre Ärztin im Falle einer Herzkrankheit in Kenntnis. Ihr Arzt bzw. Ihre Ärztin muss dann Ihre Behandlung besonders überwachen.
Um unerwünschte Reaktionen an der Injektionsstelle zu vermeiden, befolgen Sie die Anweisungen genauestens (siehe Wie verwenden Sie Rebif RebiDose?).
Wenden Sie sich im Falle von Problemen an Ihren Apotheker oder Ihren Arzt bzw. Ihre Apothekerin oder Ärztin.
Ändern Sie nicht von sich aus die verschriebene Dosierung oder das Therapieschema.
Beenden Sie bitte die Behandlung nicht ohne Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin. Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie eine Allergie oder Überempfindlichkeit gegen andere Arzneimittel haben.
Während der Behandlung können im Innern der kleinen Blutgefässe Blutgerinnsel entstehen. Diese Blutgerinnsel können Ihre Nierenfunktion beeinträchtigen. Dies kann einige Wochen bis einige Jahre nach Beginn der Therapie mit Rebif auftreten. Ihr Arzt, Ihre Ärztin kann daher eine Überprüfung Ihres Blutdruckes, Ihres Blutes (Anzahl Blutplättchen) und der Funktion Ihrer Nieren als notwendig erachten.
Rebif enthält Benzylalkohol
Rebif enthält 1.0 mg Benzylalkohol pro Dosis von 0.2 ml und 2.5 mg Benzylalkohol pro Dosis von 0.5 ml. Benzylalkohol kann allergische Reaktionen hervorrufen. Benzylalkohol wurde mit dem Risiko schwerwiegender Nebenwirkungen, einschliesslich Atemproblemen (so genanntes «Gasping- Syndrom») bei Kleinkindern in Verbindung gebracht. Es darf nicht bei Frühgeborenen oder Neugeborenen angewendet werden. Es kann bei Säuglingen und Kindern bis zu 3 Jahren toxische und allergische Reaktionen hervorrufen.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit (d.h. pro 0.2 ml bzw. 0.5 ml), d.h. es ist nahezu «natriumfrei».
Ihre Fahrtüchtigkeit und Ihre Fähigkeit zum Bedienen von Werkzeugen oder Maschinen kann durch die Auswirkungen der Krankheit selbst oder durch deren Behandlung beeinträchtigt sein. Falls Sie davon betroffen sind, besprechen Sie dies bitte mit Ihrem Arzt bzw. Ihrer Ärztin.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
·an anderen Krankheiten leiden,
·Allergien haben,
·andere Arzneimittel (auch selbstgekaufte!) einnehmen.
Bitte informieren Sie insbesondere Ihren Arzt, wenn Sie Antiepileptika (Mittel gegen Epilepsie) oder Antidepressiva (Mittel gegen Depression) einnehmen.
Darf Rebif RebiDose während einer Schwangerschaft oder in der Stillzeit angewendet werden?Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie Ihren Arzt bzw. Ihre Ärztin um Rat, bevor Sie Rebif anwenden.
Wie verwenden Sie Rebif RebiDose?Rebif ist als Injektionslösung in Fertigspritzen, vormontiert in einer Applikationshilfe (Fertigpen namens «RebiDose») zur einmaligen Selbstanwendung verfügbar. Der Fertigpen namens «RebiDose» ist gebrauchsfertig. Drei Dosierungen sind verfügbar: 8.8 Mikrogramm (Fertigpen mit gelbem Knopf), 22 Mikrogramm (Fertigpen mit grünem Knopf) und 44 Mikrogramm (Fertigpen mit petrolgrünem Knopf).
Dosierung
Patienten mit ersten Symptomen («klinisch-isoliertes Ereignis»)
Die empfohlene Dosierung bei erwachsenen Patienten ist 44 Mikrogramm dreimal pro Woche.
Patienten mit schubweise fortschreitender Multipler Sklerose
Bei Erwachsenen ab 18 Jahren ist die empfohlene Dosierung 44 Mikrogramm dreimal pro Woche. Rebif 22 Mikrogramm, ebenfalls dreimal pro Woche zu verabreichen, wird für diejenigen Patienten empfohlen, die die höhere Dosierung nicht vertragen können.
Für weitere Informationen zur Arzneimittelverträglichkeit bei Kindern ab 2 Jahren und Jugendlichen siehe auch «Welche Nebenwirkungen kann Rebif haben?»
Rebif wird nicht für die Anwendung bei Kindern unter 2 Jahren empfohlen.
Die Injektionen sollten möglichst immer zur gleichen Tageszeit (vorzugsweise abends) und an den gleichen 3 Tagen (in mindestens 48 Stunden Abstand) jede Woche erfolgen.
Es kann sein, dass die Wirkung von Rebif nicht sofort bemerkbar ist. Brechen Sie die Behandlung in diesem Falle nicht ab, sondern führen Sie sie nach Vorschrift weiter, um das gewünschte Resultat zu erzielen. Bezüglich der Dauer der Behandlung befolgen Sie bitte den Rat Ihres Arztes bzw. Ihrer Ärztin.
Sollten Sie über den Nutzen der Behandlung unsicher sein, wenden Sie sich bitte an Ihren Arzt bzw. Ihre Ärztin.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin.
Behandlungsbeginn
Am Anfang der Rebif-Behandlung wird zur Minderung einiger der Nebenwirkungen folgendes Dosierungsschema empfohlen:
Bei einer Zieldosierung von Rebif 44 µg dreimal pro Woche:
·während der ersten und zweiten Woche werden an jedem Behandlungstag 20 % der Gesamtdosis injiziert (d.h. 8.8 µg pro Injektion) = das Gesamtvolumen des 8.8 µg Fertigpens (gelber Knopf), dreimal pro Woche
·während der dritten und der vierten Woche werden an jedem Behandlungstag 50 % der Gesamtdosis injiziert (d.h. 22 µg pro Injektion) = das Gesamtvolumen des 22 µg Fertigpens (grüner Knopf), dreimal pro Woche
·ab der fünften Woche und für die weitere Behandlungsdauer wird die volle Dosis injiziert (d.h. 44 µg pro Injektion) = das Gesamtvolumen des 44 µg Fertigpens (petrolgrüner Knopf), dreimal pro Woche
Bei einer Zieldosierung von Rebif 22 µg dreimal pro Woche:
Für die ersten vier Wochen muss zur Auftitrierung die Startpackung der Rebif Injektionslösung in Fertigspritzen eingesetzt werden, da beim RebiDose Fertigpen im Gegensatz zu den Fertigspritzen nur der volle Inhalt des RebiDose Fertigpens (und nicht ein Teil davon) injiziert werden kann:
·während der ersten und zweiten Woche werden an jedem Behandlungstag 20 % der Gesamtdosis injiziert (d.h. 4.4 µg pro Injektion) = 0.1 ml der 8.8 µg Fertigspritze, dreimal pro Woche
·während der dritten und der vierten Woche werden an jedem Behandlungstag 50 % der Gesamtdosis injiziert (d.h. 11 µg pro Injektion) = 0.25 ml der 22 µg Fertigspritze, dreimal pro Woche.
Ab der fünften Woche können die 22 µg Fertigpens angewendet werden:
·ab der fünften Woche und für die weitere Behandlungsdauer wird die volle Dosis injiziert (d.h. 22 µg pro Injektion) = das Gesamtvolumen des 22 µg Fertigpens (grüner Knopf), dreimal pro Woche.
Anweisungen für die Selbstinjektion
Rebif muss subkutan (unter die Haut) verabreicht werden.
Die erste Injektion muss in Gegenwart einer für diese Anwendungen qualifizierten Person durchgeführt werden.
Ihr behandelnder Arzt bzw. Ihre Ärztin oder Ihre Pflegefachperson werden Sie instruieren und Ihnen helfen, die Technik der Selbstinjektion zu erlernen. Nehmen Sie diese Hilfe in Anspruch, solange Sie ihrer bedürfen, um die Technik und die Ausführung der Selbstinjektion vollständig zu beherrschen. Da Rebif im RebiDose Fertigpen zur subkutanen Anwendung verfügbar ist, können Sie selbst oder ein Mitglied Ihrer Familie oder ein Freund zu Hause die Injektion vornehmen.
Bitte lesen Sie die folgenden Anweisungen zur Verabreichung von Rebif mittels des RebiDose Fertigpen aufmerksam und befolgen Sie diese Punkt für Punkt.
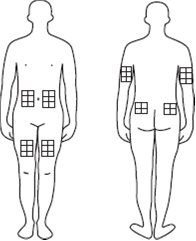
Wahl einer Injektionsstelle
|
|
|
·Wählen Sie eine Injektionsstelle. Ihr Arzt oder eine geschulte Pflegefachperson wird Sie über geeignete Injektionsstellen informieren (günstige Stellen sind z.B. die Oberschenkel, der Unterbauch oder das Gesäss).
·BITTE BEACHTEN SIE: Wählen Sie für die Injektion keine Stellen, an denen Sie Schwellungen, feste Knoten oder Schmerzen spüren. Sprechen Sie mit Ihrem Arzt oder Ihrer Pflegefachperson über alle Auffälligkeiten, die Sie entdecken.
|
Wechsel der Injektionsstelle
Durch das regelmässige Wechseln der Injektionsstelle können Sie Reaktionen an der Injektionsstelle vermeiden. Sie lassen auf diese Weise der benutzten Stelle die Zeit, sich zu erholen. Die aktuelle Injektion darf nicht an derselben Stelle erfolgen, an der die vorangehende erfolgt ist.
Notieren Sie, wo und wann Sie die letzten Injektionen vorgenommen haben. Man kann diese Daten zum Beispiel in einen Monatskalender eintragen.
Eine Injektionsstelle kann nach ca. einer Woche erneut benutzt werden. Wenn alle Injektionsstellen schmerzhaft werden, wenden Sie sich bezüglich anderer Injektionsstellen bitte an Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie Schwierigkeiten haben, die eine oder die andere der Injektionsstellen zu erreichen, bitten Sie Ihre Pflegefachperson oder eine in der Injektionstechnik erfahrene Person um Hilfe.
Vorbereitung der subkutanen Selbstinjektion
Dieses Arzneimittel ist zur Einmalanwendung vorgesehen. Verwenden Sie jeden RebiDose Fertigpen nur einmal.
·Nehmen Sie den Fertigpen mindestens 30 Minuten vor der Injektion aus dem Kühlschrank.
·Waschen Sie Ihre Hände gründlich mit Wasser und Seife.
Sobald Sie eine Injektionsstelle ausgewählt haben:
·Stellen Sie alles zusammen, was Sie brauchen und legen Sie alles auf eine saubere Fläche:ein neuer Fertigpen «RebiDose», einen Alkoholtupfer, einen trockenen Tupfer oder eine Baumwollgaze.
·Nehmen Sie den Fertigpen aus der Blisterpackung, indem Sie die Plastikfolie abziehen.
·Überprüfen Sie das Aussehen von Rebif durch das durchsichtige Fenster. Es muss klar bis opaleszent sein, und es dürfen keine Schwebstoffe und keine sichtbaren Anzeichen von Zersetzung erkennbar sein. Wenn Schwebstoffe oder andere sichtbare Anzeichen von Zersetzung erkennbar sind, verwenden Sie den Fertigpen «RebiDose» nicht und verständigen Sie Ihren Arzt/Ihre Ärztin, Ihre Pflegefachperson oder Ihren Apotheker/Ihre Apothekerin.
·Kontrollieren Sie das Verfalldatum auf dem Etikett des RebiDose Fertigpen oder auf dem Umkarton. Wenn das Verfalldatum überschritten ist, darf der RebiDose Fertigpen nicht mehr verwendet werden.
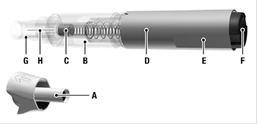
Folgendes Bild zeigt Ihnen, wie der RebiDose Fertigpen im Detail aussieht:
|
Vor der Injektion:
|
A.Schutzkappe
B.Durchsichtiger Kontrollbereich
C.Kolben
D.Dosis-Etikett
E.Hauptgehäuse
F.Farbiger Knopf (je nach Dosierung unterschiedliche Farbe)
G.Schutzvorrichtung
H.Injektionsnadel
| |
|

| |
Nach der Injektion:
| |
|
|
Wie wird Rebif RebiDose injiziert?
·Verwenden Sie vor der Injektion einen Alkoholtupfer, um die Haut an der Injektionsstelle zu reinigen. Lassen Sie die Haut vollständig trocknen. Wenn etwas Alkohol auf der Haut verbleibt, können Sie ein brennendes Gefühl verspüren.
·Entfernen Sie die Schutzkappe der Injektionsnadel erst, wenn Sie bereit für die Injektion sind.
|
|

|
·Halten Sie den RebiDose Fertigpen am Hauptgehäuse fest und entfernen Sie mit der anderen Hand die Schutzkappe.
| |
|

|
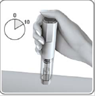
·Halten Sie den RebiDose Fertigpen im rechten Winkel (90°) zur Injektionsstelle. Drücken Sie den RebiDose Fertigpen gegen Ihre Haut, bis Sie Widerstand spüren. Dadurch wird der Knopf entsperrt.
| |
|
|
·Pressen Sie den RebiDose Fertigpen mit ausreichendem Druck auf die Haut und drücken Sie mit dem Daumen auf den Knopf. Sie hören ein Klickgeräusch, das den Beginn der Injektion anzeigt und der Kolben setzt sich in Bewegung. Drücken Sie RebiDose Fertigpen für mindestens 10 Sekunden auf die Haut, damit das gesamte Arzneimittel injiziert wird.
·Wenn die Injektion begonnen hat, brauchen Sie den Knopf nicht länger mit dem Daumen nach unten zu drücken.
Anmerkung: falls die Injektion nicht beginnt, lassen Sie den Knopf los und überprüfen, dass der RebiDose Fertigpen fest gegen die Haut gedrückt wird. Danach drücken Sie den Knopf erneut und achten auf das Klickgeräusch, welches den Beginn der Injektion anzeigt.
| |
|

|
·Entfernen Sie RebiDose Fertigpen von der Injektionsstelle.
·Die Nadel wird automatisch von einer Schutzvorrichtung umschlossen, die einrastet und Sie vor der Nadel schützt.
| |
Nach der Injektion:
| |
|

|
·Schauen Sie durch das durchsichtige Fenster und vergewissern Sie sich, dass der Kolben, wie in der Abbildung gezeigt, nach unten gewandert ist.
·Vergewissern Sie sich, dass keine Flüssigkeit mehr zu sehen ist. Sollte noch Flüssigkeit sichtbar sein, wurde das Arzneimittel nicht vollständig injiziert. Wenden Sie sich in diesem Fall an Ihren Arzt oder Ihre Ärztin oder Ihre Pflegefachperson.
|
·Massieren Sie die Injektionsstelle sanft mit einem trockenen Tupfer oder einer Baumwollgaze.
·Setzen Sie den Schnappdeckel der Nadel nicht wieder auf den schon benutzten RebiDose Fertigpen auf, da die Nadel jetzt durch die Schutzvorrichtung bedeckt ist. Stecken Sie Ihre Finger nicht in die Öffnung der Schutzvorrichtung.
·Der RebiDose Fertigpen ist nur zur einmaligen Anwendung vorgesehen und darf niemals wieder verwendet werden.
·Sobald Sie die Injektion beendet haben, entsorgen Sie sofort den RebiDose Fertigpen in einen geeigneten Entsorgungsbehälter. Fragen Sie ihren Apotheker bzw. Ihre Apothekerin, wie man den RebiDose Fertigpen sicher entsorgt.
Wenn Sie eine grössere Menge von Rebif angewendet haben, als Sie sollten
Wenden Sie sich im Falle einer Überdosis bitte sofort an Ihren Arzt.
Wenn Sie die Anwendung von Rebif vergessen haben
Falls Sie eine Dosis versäumt haben, fahren Sie bitte am Tag der nächsten geplanten Dosis mit den Injektionen fort. Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben.
Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Ihre Ärztin, Ihre Pflegefachperson oder Ihren Apotheker oder Ihre Apothekerin.
Welche Nebenwirkungen kann Rebif RebiDose haben?Folgende Nebenwirkungen können bei der Anwendung von Interferon-beta auftreten:
grippeähnliche Symptome wie Kopfschmerzen, Fieber, Schüttelfrost, Müdigkeit, Übelkeit, Muskel- und Gelenkschmerzen. Diese Wirkungen treten zu Beginn der Behandlung bei bis zu 7 von 10 Patienten auf. Sie verringern sich bei fortdauernder Anwendung. Ihr Arzt oder Ihre Ärztin kann Ihnen zur Linderung dieser Symptome ein Schmerzmittel verordnen, vorübergehend die Dosierung ändern oder die Behandlung unterbrechen. Sie dürfen die Behandlung ohne Verordnung Ihres Arztes bzw. Ihrer Ärztin nicht unterbrechen oder ändern.
Es kann bei etwa 3 von 10 Patienten zu Reaktionen an der Injektionsstelle, wie Rötungen, Schwellungen, Verfärbungen, Entzündungen, Schmerzen, Hautläsionen und Zerstörungen des Hautgewebes (Nekrosen), sowie anderen unspezifischen Reaktionen kommen. Das Auftreten von Reaktionen an der Injektionsstelle verringert sich gewöhnlich mit der Zeit. Wenn Sie anomale lokale Reaktionen haben, fragen Sie bitte Ihren Arzt bzw. Ihre Ärztin.
Weitere, weniger häufig auftretende unerwünschte Wirkungen in Verbindung mit Interferon-beta wurden berichtet: Durchfall, Erbrechen, Appetitlosigkeit, Leberentzündung, Schlafstörungen, Schwindel, Nervosität, Hautausschlag, Nesselausschlag, Haarausfall, Sehstörungen, Juckreiz, Beklemmungsgefühle und Herzklopfen.
Bei einer Therapie mit Interferon-beta können ebenfalls folgende Nebenwirkungen auftreten: Veränderungen der Netzhaut, welche zu Sehstörungen führen; Selbstmordgedanken; Krampfanfälle; schwere Hautreaktionen (einige mit Schleimhautschädigungen), Atembeschwerden, vermehrtes Schwitzen, Infektion an der Injektionsstelle, Erkrankung des Immunsystems mit Beteiligung der Haut, (arzneimittelinduzierter Lupus erythematodes, reversibel nach Absetzen des Arzneimittels), verminderte Anzahl roter und weisser Blutkörperchen wie auch von Blutplättchen (Panzytopenie) oder Entstehung von Blutgerinnseln (Thromben) im Innern der kleinen Blutgefässe des gesamten Körpers, die Auswirkungen auf Ihre Nieren haben können (thrombotisch-thrombozytopenische Purpura oder hämolytisch-urämisches Syndrom). Dies führt zu Blutarmut wegen einer erhöhten Zerstörung der roten Blutkörperchen (hämolytische Anämie) und zu einer zu geringen Anzahl zirkulierender Blutplättchen. Die Symptome können eine erhöhte Blutungsneigung (Unterhautblutungen sowie violett gefärbte kleine Blutungen in der Haut (Purpura), innerliche Blutungen), vermehrte Blutergüsse, Fieber, extremes Schwächegefühl, Kopfschmerzen, Schwindel und Benommenheit umfassen. Ihr Arzt wird möglicherweise Veränderungen in Ihrem Blut und Ihrer Nierenfunktion feststellen. Nierenprobleme einschliesslich Narbenbildung können zu einer Verringerung der Nierenfunktion führen. Wenn Sie einige oder alle der folgenden Symptome an sich bemerken – schaumiger Urin, Müdigkeit, Schwellungen, vor allem im Bereich der Knöchel und Augenlieder, sowie Gewichtszunahme – informieren Sie bitte Ihren Arzt, da es sich hierbei um Anzeichen eines möglichen Nierenproblems handeln könnte.
Sehr selten können schwerwiegende allergische Reaktionen (Hypersensitivität) auftreten. Sollte bei Ihnen unmittelbar nach der Verabreichung von Rebif plötzlich Atemnot oder eine Anschwellung des Gesichtes, möglicherweise auch in Verbindung mit einem Nesselausschlag, und Schwächegefühl auftreten, begeben Sie sich bitte sofort in ärztliche Obhut.
Im Falle schwerer oder anhaltender Nebenwirkungen fragen Sie bitte Ihren Arzt bzw. Ihre Ärztin.
Die Anzahl der weissen und roten Blutkörperchen oder der Blutplättchen kann verringert sein, und es kann zu veränderten Leberfunktionswerten kommen. Aus diesem Grund sollte Ihr Blut vor der Behandlung und dann in regelmässigen Abständen untersucht werden.
Diese Veränderungen werden im allgemeinen vom Patienten nicht wahrgenommen (keine Symptome). Sie sind meist reversibel und leichter Natur. Wenn Sie jedoch Symptome bemerken, die auf eine Leberfunktionsstörung hinweisen, wie Appetitverlust in Kombination mit anderen Symptomen, wie Übelkeit, Erbrechen oder Gelbsucht, kontaktieren Sie bitte sofort Ihren Arzt bzw. Ihre Ärztin.
Interferone können bei Ihrer Schilddrüse eine Über- oder Unterfunktion bewirken. Diese Änderungen der Schilddrüsenaktivität werden vom Patienten selten wahrgenommen. Dennoch könnte Ihr Arzt bzw. Ihre Ärztin eine Untersuchung als notwendig empfehlen.
Depressionen oder sogar Selbstmordgedanken können bei Multiple-Sklerose-Patienten häufiger auftreten. Falls Sie solche Gefühle feststellen, wenden Sie sich bitte sofort an Ihren Arzt bzw. Ihre Ärztin.
Zu Beginn der Therapie mit Rebif können Symptome auftreten, die denjenigen ähnlich sind, welche bei einem Multiple-Sklerose-Pseudo-Schub auftreten. Zum Beispiel können sich die Muskeln sehr schwer oder schwach anfühlen, was Sie im täglichen Tun beeinträchtigt. In manchen Fällen treten solche Symptome in Zusammenhang mit dem oben beschriebenen Fieber oder den fieberähnlichen Symptomen auf.
Sonstige Nebenwirkungen (Häufigkeit nicht bekannt – Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Pulmonale arterielle Hypertonie: Eine schwerwiegende Verengung der Blutgefässe in den Lungen, die zu hohem Blutdruck in den Blutgefässen führt, die das Blut vom Herz zu den Lungen transportieren. Pulmonale arterielle Hypertonie wurde zu verschiedenen Zeitpunkten während der Behandlung beobachtet, unter anderem bis zu einige Jahre nach Beginn der Behandlung mit Rebif.
Kinder und Jugendliche
Es wurden keine formellen klinischen Prüfungen mit Kindern oder Jugendlichen durchgeführt. Einige vorliegende klinische Daten deuten jedoch darauf hin, dass das Sicherheitsprofil bei Kindern (2 bis 11 Jahre alt) und Jugendlichen (12 bis 17 Jahre alt), die Rebif 22 µg oder Rebif 44 µg dreimal wöchentlich erhalten, dem Sicherheitsprofil von Erwachsenen ähnelt.
Rebif sollte bei Kindern (2 bis 11 Jahre alt) mit Vorsicht angewendet werden.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Das Arzneimittel muss im Kühlschrank zwischen 2 bis 8°C aufbewahrt werden (nicht einfrieren).
Rebif soll zum Schutz vor Licht in der Originalverpackung aufbewahrt werden.
Um ein versehentliches Einfrieren zu verhindern, lagern Sie die Packung immer in der Vorderseite des Kühlschrankes.
Falls zeitweilig keine Möglichkeit besteht, Rebif im Kühlschrank (bei 2 - 8°C) aufzubewahren, kann das Arzneimittel während höchstens 14 Tagen bei Raumtemperatur bis maximal 25°C gelagert werden. Nach Ablauf dieser 14 Tage Lagerung bei Raumtemperatur, müssen Sie das Arzneimittel wieder im Kühlschrank (bei 2 - 8°C) aufbewahren und können es bis zu dem auf der Packung bezeichnetem Datum («EXP») verwenden.
Nicht verbrauchte Arzneimittel müssen aus Vorsichtsgründen an die Apotheke zurückgegeben werden.
Bewahren Sie Rebif wie alle Medikamente für Kinder unerreichbar auf.
Das Produkt nicht anwenden, wenn Sie sichtbare Beschädigungen feststellen, wie zum Beispiel Beschädigungen der Kunststoffverpackung des Fertigpens oder des Fertigpens selbst.
Weitere Hinweise
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Rebif RebiDose enthalten?Wirkstoffe
1 Fertigpen Rebif RebiDose à 0.2 ml enthält: 8.8 Mikrogramm Interferon-beta 1a ADNr. (entspricht 2.4 Mio. I.E.)
1 Fertigpen Rebif RebiDose à 0.5 ml enthält: 22 oder 44 Mikrogramm Interferon-beta 1a ADNr (entsprechen 6 Mio. I.E. oder 12 Mio. I.E.)
Hilfsstoffe
1 Fertigpen Rebif RebiDose à 0.2 ml enthält: Mannitol, Poloxamer 188, Natriumacetat-Trihydrat, Natriumhydroxid, Essigsäure, Methionin, Benzylalkohol und Wasser für Injektionszwecke
1 Fertigpen Rebif RebiDose à 0.5 ml enthält: Mannitol, Poloxamer 188, Natriumacetat-Trihydrat, Natriumhydroxid, Essigsäure, Methionin, Benzylalkohol und Wasser für Injektionszwecke
Wo erhalten Sie Rebif RebiDose? Welche Packungen sind erhältlich?In Apotheken nur gegen ärztliche Verschreibung.
Packungen mit:
·Startpackung: 6 Fertigpens Rebif RebiDose 8.8 Mikrogramm und 6 Fertigpens Rebif RebiDose 22 Mikrogramm
·12 Fertigpens Rebif 22 Mikrogramm
·12 Fertigpens Rebif 44 Mikrogramm
Zulassungsnummer62067 (Swissmedic)
ZulassungsinhaberinMerck (Schweiz) AG, Zug
Diese Packungsbeilage wurde im März 2024 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft. |








