Zusammensetzung
Wirkstoffe
Mit Glutaraldehyd modifizierte und an L-Tyrosin adsorbierte allergene Substanzen (Allergoide) zu gleichen Teilen von Pollen der frühblühenden Bäume Birke (Betula spp.), Erle (Alnus spp.) und Hasel (Corylus spp.).
Hilfsstoffe
L-Tyrosin, Natriumchlorid, Glycerol, Natriumdihydrogenphosphat-Dihydrat, Natriummonohydrogenphosphat-Dodecahydrat, Phenol, Wasser für Injektionszwecke.Diese Arzneimittel enthalten 0,0807 mmol (1,86 mg) Natrium pro Dosis.
Indikationen/Anwendungsmöglichkeiten
Behandlung (spezifische Immuntherapie) von saisonalen, IgE-vermittelten allergischen Erkrankungen wie allergische Rhinitis (Pollinosis), allergische Konjunktivitis und allergisches Asthma bronchiale, die durch die Pollen der frühblühenden Bäume Birke, Erle und Hasel ausgelöst werden.
Zur Diagnosestellung sind eine allergologisch ausgerichtete Anamnese und eine spezifische Allergietestung, vorzugsweise ein Hauttest (Pricktest), erforderlich.
Dosierung/Anwendung
Übliche Dosierung (für Erwachsene und Kinder ab 6 Jahren)
POLVAC Bäume wird präsaisonal verabreicht, das heisst bis kurz vor dem entsprechenden Pollenflug. Da bei der Allergie auf frühblühende Bäume die Symptome von etwa Mitte Januar bis Mitte Mai auftreten, sollte die Behandlung Ende Dezember/Anfang Januar bzw. 2-3 Wochen vor dem erwarteten Einsetzen des Pollenflugs (Beschwerdebeginns) abgeschlossen sein. Bei Auftreten des Pollenflugs während der Behandlung ist die Behandlung abzubrechen (siehe neuester Pollenflugbericht bzw. Pollenflugkalender).
Ein vollständiger präsaisonaler Therapiezyklus besteht aus 1 Packung POLVAC Bäume Basisbehandlung (Spritzen/Durchstechflaschen Nr. 1, 2, 3) und 1 Packung POLVAC Bäume Fortsetzungsbehandlung (3 Spritzen Nr. 3 oder 1 Durchstechflasche Nr. 3).
Die von jeder Konzentration zu verabreichende Höchstdosis beträgt 0,5 ml.
Basisbehandlung: Die 3 Injektionen der Basisbehandlung sind in Abständen von mindestens 7, höchstens jedoch 14 Tagen in steigender Dosierung (erst Spritze/Durchstechflasche Nr. 1, dann Spritze/Durchstechflasche Nr. 2, dann Spritze/Durchstechflasche Nr. 3) zu verabreichen.
Beginn der Basisbehandlung: etwa Ende September, spätestens Anfang Dezember, um einen ganzen Zyklus (Basis- und Fortsetzungsbehandlung) mit 6 Injektionen verabreichen zu können.
Dosissteigerungen sind nur zulässig bei guter Verträglichkeit der vorangegangenen Injektion und Einhaltung des Injektionsintervalls. Bei Überschreiten des Injektionsintervalls sollte die Therapie aus Sicherheitsgründen wieder von vorne, mit Spritze/Durchstechflasche Nr. 1, begonnen werden.
Fortsetzungsbehandlung: Zur Konsolidierung des Therapieerfolgs sollte direkt im Anschluss an die Basisbehandlung eine präsaisonale Fortsetzungsbehandlung mit 3 Spritzen Nr. 3 oder 1 Durchstechflasche Nr. 3 (Höchstdosis) durchgeführt werden. Die 1. Injektion der Fortsetzungsbehandlung erfolgt etwa 14 Tage nach der letzten Injektion der Basisbehandlung. Die weiteren 2 Injektionen erfolgen dann in je 2-4wöchigem Abstand.
Dosierungshinweise
Alle Injektionen können in Abständen von 1 Woche gegeben werden, so dass ein voller Behandlungszyklus (Basis- und Fortsetzungsbehandlung mit insgesamt 6 Spritzen) in 5 Wochen möglich ist.
Kinder unter 6 Jahren
Siehe Abschnitt „Kontraindikationen“.
Verabreichungsart
Die Injektionen sind streng subkutan (an der Oberarmstreckseite, im Bereich von ca. 4 cm oberhalb des Olecranons bis zur Oberarmmitte) zu verabreichen und nur durch den Arzt. Mit konstantem Druck injizieren. Die Einstichstelle sollte jedes Mal gewechselt werden. Nicht intramuskulär und nicht intravasal injizieren (Aspirationskontrolle!). Nicht an der Injektionsstelle reiben. Zur Handhabung der Fertigspritzen und Durchstechflaschen siehe unter „Sonstige Hinweise“.
Massnahmen vor jeder Injektion
-Den aktuellen allergischen Status des Patienten überprüfen, eventuelle zwischenzeitlich aufgetretene Kontraindikationen beachten. Im Bedarfsfall Kontrolle der Lungenfunktion (Peak-Flow-Messung) bei Asthmatikern.
-Befragen des Patienten nach der Verträglichkeit der letzten Injektion.
-Sich vergewissern, dass die korrekte Spritze/Durchstechflasche gewählt wurde (Konzentration).
-Eine Notfallausrüstung zur Behandlung eines anaphylaktischen Schocks (insbesondere eine gebrauchsfertige Adrenalin (Epinephrin)-Spritze) ist griffbereit zu halten.
Massnahmen nach jeder Injektion
-Patienten mindestens 30 Minuten lang unter ärztlicher Aufsicht behalten. Sollten während dieser Zeit unerwünschte Wirkungen auftreten, muss die Beobachtung des Patienten bis zur Normalisierung des Gesundheitszustandes verlängert werden. Schwere Nebenwirkungen können selten eine Intensivüberwachung / Behandlung in einem Spital notwendig machen.
-Den Patienten informieren, dass er sich bei später auftretenden Nebenwirkungen sofort mit dem behandelnden Arzt oder gegebenenfalls dessen Vertretung in Verbindung setzt.
Mögliche Injektions-/Therapieschemata
Beispiele für Therapieschemata, je nach Verfügbarkeit und Reaktionslage des Patienten, der Pollenflugsituation usw.:
Therapiedauer
Bereits nach Verabreichung eines vollständigen präsaisonalen Behandlungszyklus sollte in der darauf folgenden Pollensaison eine deutliche Besserung der allergischen Symptomatik auftreten.
Zur Sicherung einer dauerhaften Besserung der allergischen Reaktion sollte die spezifische Immuntherapie (Basis- und Fortsetzungsbehandlung) mit POLVAC Bäume mindestens 3 aufeinander folgende Jahre jeweils präsaisonal durchgeführt werden.
Gabe von 2 verschiedenen Lösungen
Bei Behandlung mit 2 verschiedenen Hyposensibilisierungspräparaten sind diese alternierend mit einem Injektionsabstand von 2-3 Tagen zu verabreichen.
Kontraindikationen
Wie jede spezifische Immuntherapie ist POLVAC kontraindiziert bei
-Überempfindlichkeit gegen einen der Hilfsstoffe (siehe Rubrik „Zusammensetzung“)
−akuten fieberhaften Infekten sowie schweren chronischen und entzündlichen Erkrankungen
−Sekundärveränderungen am Reaktionsorgan (z.B. Emphysem, Bronchiektasen)
−unkontrolliertem Asthma bronchiale
−Autoimmunerkrankungen
−Immundefekten (auch durch Immunsuppression)
−aktiver Lungen- und Augentuberkulose
−aktiven malignen Erkrankungen
−schweren psychischen Störungen
−Krankheiten oder gleichzeitig verabreichten Medikamenten, welche den effizienten Einsatz von Adrenalin (Epinephrin) verunmöglichen
−Therapie mit Betablockern (verminderte Reaktion auf Adrenalin (Epinephrin)) oder ACE-Hemmern
−Schwangerschaft; während der Schwangerschaft sollte eine Immuntherapie weder begonnen noch fortgesetzt werden, da sich während der Schwangerschaft der Sensibilisierungsgrad der Patientin in nicht vorhersehbarem Ausmass verändern kann (siehe Rubrik Schwangerschaft/Stillzeit).
POLVAC ist im Besonderen kontraindiziert bei
−Kindern unter 6 Jahren (mangels ausreichender klinischer Erfahrung)
−Störungen des Tyrosinmetabolismus (Tyrosinämie, Alkaptonurie) aufgrund seines Gehalts an Tyrosin.
Warnhinweise und Vorsichtsmassnahmen
Bei einer akuten Infektion, fieberhaften Zuständen oder schweren asthmatischen Beschwerden darf die Injektion erst 24 bis 48 Stunden nach Normalisierung des Gesundheitszustandes verabreicht werden. Bei längerer Therapiepause ist die Behandlung unter Umständen mit Spritze/Durchstechflasche Nr. 1 neu zu beginnen.
Risikopatienten (z.B. Patienten mit extrem hohem Sensibilisierungsgrad oder nach einem Asthmaanfall) sollten in einer Allergiepoliklinik behandelt werden. Vorsicht ist bei Patienten mit Herz-Kreislauf-Insuffizienz essentiell. Ängstlichen oder zu vasovagaler Instabilität neigenden Patienten sollte die Injektion bevorzugt im Liegen verabreicht werden.
Da Adrenalin (Epinephrin)-Gabe notwendig sein kann, sind die Adrenalin (Epinephrin)-Kontraindikationen zu beachten.
Am Injektionstag sollte der Patient stärkere körperliche Anstrengung (auch sportliche Aktivität), Sauna, üppiges Essen und Alkohol meiden.
Die in der Rubrik Dosierung/Anwendung aufgeführten Massnahmen vor und nach jeder Injektion sind zu beachten.
Testung und spezifische Immuntherapie sollten nur von einem allergologisch erfahrenen Arzt durchgeführt werden.
Schutzimpfungen sollten nicht während einer Hyposensibilisierung vorgenommen werden. Ist eine Schutzimpfung nicht zu umgehen, sollte sie frühestens 8 Tage nach der letzten POLVAC Injektion erfolgen. Sollten bei dieser POLVAC Injektion lokale oder systemische Reaktionen auftreten, darf die Impfung erst 1 Woche nach deren Abklingen verabreicht werden.
Nach einer Schutzimpfung darf die nächste POLVAC Injektion erst nach völligem Abklingen der Impfreaktion erfolgen, frühestens jedoch 2 Wochen nach der Impfung. Daraus resultiert ein Mindestabstand der POLVAC Injektionen von 3 Wochen. Im Falle einer Intervallüberschreitung sollte die POLVAC Therapie mit Spritze/Durchstechflasche Nr. 1 neu begonnen werden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Injektion, d.h. es ist nahezu „natriumfrei“.
Interaktionen
Eine Hyposensibilisierungsbehandlung sollte nicht gleichzeitig mit einer immunsuppressiven Behandlung durchgeführt werden. Bezüglich Gabe von ACE-Hemmern und Betablockern siehe Rubrik Kontraindikationen.
Eine begleitende Therapie mit symptomatischen Antiallergika (z.B. Antihistaminika, Corticosteroide, Mastzelldegranulationshemmer) kann die aktuelle Reaktionslage maskieren.
Zusätzliche Allergenexposition (exogen und iatrogen) kann die Toleranzgrenze herabsetzen. Deshalb sollte der Patient darauf hingewiesen werden, dass die betreffenden kausalen und kreuzreaktiven Allergene während der spezifischen Immuntherapie so weit möglich zu meiden sind.
Gabe von 2 verschiedenen Präparaten zur spezifischen Immuntherapie, siehe Rubrik Dosierung/Anwendung.
Vorgehen bei parallel erforderlicher Schutzimpfung, siehe Rubrik Warnhinweise und Vorsichtsmassnahmen.
Schwangerschaft, Stillzeit
Es gibt keine Hinweise zu einer teratogenen Wirkung von Hyposensibilisierungslösungen in Studien.
Auch wenn die Möglichkeit einer Schädigung des Fötus durch die spezifische Immuntherapie per se unwahrscheinlich ist, ist POLVAC bei Schwangerschaft kontraindiziert, weil Änderungen im Sensibilisierungsgrad und in der Reaktivität des Immunsystems während einer Schwangerschaft nicht vorhersehbar sind und eine überschiessende allergische Reaktion, die eine Behandlung erfordert, während einer Immuntherapie jederzeit möglich ist.
Es liegen keine Erkenntnisse darüber vor, ob POLVAC in die Muttermilch übertritt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Gelegentlich kann nach der Injektion von POLVAC leichte Müdigkeit auftreten. Ist dies der Fall, sollte der Patient kein Fahrzeug führen und keine Maschine bedienen.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die für Polvac Bäume zu erwartenden Nebenwirkungen sind vorwiegend leichte bis mittelschwere Reaktionen an der Injektionsstelle (z. B. Urtikaria, Schwellung, Erythem), Reaktionen der Haut (z. B. Pruritus, Erythem, Ausschlag) und der Atemwege (z. B. Dyspnoe, Husten, Bronchospasmus) oder typische Symptome durch ein Wiederauftreten/eine Exazerbation der patientenspezifischen Allergie oder sonstige allergische Symptome.
Übersicht über die Nebenwirkungen
Die folgende Übersicht enthält die in Spontanberichten für Polvac Bäume eingegangenen Nebenwirkungen.
Aus klinischen Studien liegen keine Angaben zu den Häufigkeiten der Nebenwirkungen vor und deshalb wird die Nebenwirkungshäufigkeit als nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) angegeben.
Erkrankungen des Immunsystems:
Anaphylaktischer Schock, anaphylaktische Reaktion
Erkrankungen des Nervensystems:
Parästhesie, Geschmacksstörung, Kopfschmerz, Unruhe, Tremor.
Augenerkrankungen:
Okuläre Hyperämie
Herzerkrankungen:
Tachykardie, Zyanose
Gefässerkrankungen:
Kreislaufkollaps, Verlust des Bewusstseins, Hypotonie, Schwindelgefühl, kardiovaskuläre Insuffizienz, Hitzegefühl/Hitzewallung, Blässe
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Asthma, Dyspnoe, Bronchospasmus, Rachenreizung, Nasenverstopfung, Husten
Erkrankungen des Gastrointestinaltrakts:
Dysphagie, Erbrechen, Übelkeit
Erkrankungen der Haut und des Unterhautzellgewebes:
Urtikaria (generalisiert), Pruritus, Erythem, Angioödem, schwellendes Gesicht, geschwollene Lippe, makulopapulärer Ausschlag
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Arthralgie, Gelenkschwellung, Gefühl der Schwere
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Brustkorbbeschwerden , Ödem (peripher), Unwohlsein, Ermüdung, Hyperhidrose, Reaktionen an der Injektionsstelle (z. B. Schwellung, Urtikaria, Erythem, Pruritus, Schmerz, Verhärtung, Wärme).
Beschreibung einzelner Nebenwirkungen
Anaphylaktische Reaktionen/anaphylaktischer Schock
In Einzelfällen wurde unter Polvac Bäume über schwere anaphylaktische Reaktionen bis hin zum anaphylaktischen Schock berichtet. Ein anaphylaktischer Schock kann sich innerhalb weniger Minuten nach Verabreichung einer Allergie-Immuntherapie entwickeln und das häufig schon vor Auftreten einer Lokalreaktion.
Typische Warnzeichen eines anaphylaktischen Schocks sind in der Rubrik „Behandlung von überschiessenden Immunreaktionen: Schwere Allgemeinreaktion, anaphylaktischer Schock“ beschrieben.
Systemische Nebenwirkungen,von denen bekannt ist, dass sie mit jeder Immuntherapie auftreten:
Leicht: Wiederauftreten oder Exazerbation der patientenspezifischen, allergischen Anzeichen und Symptomen wie etwa Rhinokonjunktivitis, Augenjucken, Niesen, Nasenverstopfung, Husten, generalisierte Urtikaria, Pruritus (generalisiert), atopisches Ekzem und Atemnot. Es kann auch Ermüdung, Hitzegefühl/Hitzewallung, Erkrankungen des Gastrointestinaltrakts, Rachenreizung oder Engegefühl des Halses kommen.
Mittelschwer bis schwer: Giemen, Dyspnoe oder Quincke-Ödem.
Schwere, verzögert auftretende Reaktionen:
Reaktionen ähnlich der Serumkrankheit mit Symptomen wie z.B. Fieber, Gelenkschmerzen, Urtikaria und Anschwellen der Lymphknoten können nach einigen Tagen auftreten. Diese Reaktionen sind jedoch äusserst selten.
Behandlung von überschiessenden Immunreaktionen
Hierbei ist zu beachten, dass die Ansprechbarkeit auf Adrenalin (Epinephrin) bei Patienten unter Betablocker-Therapie verändert sein kann.
Bei Kindern sind die Dosierungen von Adrenalin (Epinephrin), Theophyllin, Antihistaminika und Glucocorticoiden grundsätzlich entsprechend dem Alter bzw. Körpergewicht zu reduzieren.
Schwere Lokalreaktion:
Auftragen eines topischen Corticosteroids (Creme oder Gel). Gabe eines oralen Antihistaminikums bei Bedarf.
Moderate bis gesteigerte Allgemeinreaktion:
Zügig venösen Katheter legen. Intravenöse Verabreichung eines Antihistaminikums und eines Glucocorticoids (100 mg Prednisolon oder Äquivalent). Puls- und Blutdruckkontrolle.
Im Falle eines Bronchospasmus Gabe eines Bronchodilatators als Dosieraerosol.
Schwere Allgemeinreaktion, anaphylaktische Reaktionen/anaphylaktischer Schock:
Anaphylaktischer Schock
Wie bei jeder spezifischen Immuntherapie besteht das Risiko eines anaphylaktischen Schocks.
Warnsymptome
1. Akuter Krankheitsausbruch (innerhalb von Minuten bis Stunden) mit Beteiligung der Haut, der Schleimhäute oder beiden UND MINDESTENS EINEM DER FOLGENDEN SYMPTOME: Beeinträchtigung der Atmung, Blutdruckabfall oder damit assoziierte Symptome einer Endorganinsuffizienz.
2. Zwei oder mehr der folgenden Symptome, die rasch (innerhalb von Minuten bis Stunden) nach der Exposition gegenüber einem für diesen Patienten wahrscheinlichen Allergen auftreten: Beteiligung der Haut und der Schleimhäute, Beeinträchtigung der Atmung, Blutdruckabfall oder damit assoziierte Symptome, hartnäckige Magen-Darm-Symptome.
3. Blutdruckabfall nach Exposition gegenüber einem für diesen Patienten bekannten Allergen (innerhalb von Minuten bis Stunden).
Zeigt der Patient Anzeichen einer ausgeprägten systemischen Reaktion oder eines anaphylaktischen Schocks, müssen sofort medizinische Behandlungsmaßnahmen ergriffen werden und zwar in dieser Reihenfolge (Empfehlung gemäß EAACI, 2014).
·Adrenalin (Epinephrin) ist als intramuskuläre Injektion in den mittleren/außenseitigen Bereich des Oberschenkels zu geben (0,01 ml/kg Körpergewicht bis maximal 0,5 ml). Eine weitere Dosis kann im Abstand von mindestens 5 Minuten gegeben werden.
·Der Auslöser der anaphylaktischen Reaktion muss beseitigt werden.
·Ärztliche Hilfe sollte sofort herbeigeholt werden, noch während der Patient beurteilt wird.
·Bei Kreislaufinstabilität soll der betroffene Patient flach liegen und die Beine sollen erhöht gelagert werden; hat der Patient Atmungsbeschwerden, soll er eine sitzende Position einnehmen und wenn er bewusstlos ist, soll er in die stabile Seitenlage gebracht werden.
·Über eine Gesichtsmaske ist High-Flow-Sauerstoff zu geben.
·Bei Patienten mit Herz-Kreislauf-Instabilität sind intravenöse Flüssigkeiten (Elektrolytlösungen) zu geben (Bolus-Dosen von 20 ml/kg).
·Zur Linderung der Symptome einer Bronchialverengung sollen zusätzlich kurzzeitig wirksame Beta-2-Agonisten gegeben werden.
·Orale H1-(und H2)-Antihistaminika können die Hautsymptome einer Anaphylaxie lindern.
Außerdem können systemische Glucocorticosteroide angewendet werden, da diese das Risiko für spät auftretende Atemwegssymptome senken können. Bei Obstruktion der oberen Atemwege können hochdosierte Glucocorticoide in Aerosolform nützlich sein
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Nichteinhaltung des Injektionsintervalls, willkürlicher Dosissteigerung oder versehentlicher intramuskulärer oder intravasaler Injektion muss mit systemischen Nebenwirkungen gerechnet werden.
Siehe Unterkapitel Behandlung von überschiessenden Immunreaktionen in der Rubrik Unerwünschte Wirkungen.
Eigenschaften/Wirkungen
ATC-Code
V01A A05
Wirkungsmechanismus
POLVAC enthält sogenannte Allergoide, das sind durch chemische Behandlung (bei POLVAC mit Glutaraldehyd) modifizierte Allergene. Durch diese chemische Modifikation werden die allergenen Eigenschaften (die IgE-Reaktivität) reduziert, die erwünschten immunogenen Eigenschaften bleiben jedoch erhalten. Für die klinische Praxis bedeutet dies eine Senkung des Nebenwirkungsrisikos bei Beibehaltung der immunisierenden Wirksamkeit.
Da das Allergoid and die natürlich vorkommende Aminosäure L-Tyrosin gebunden ist, die als Adsorbans und Adjuvans dient, wird eine gewünschte Depotwirkung gewährleistet.
Modifikation, wie Adsorption, erlaubt ein Erreichen der Höchstdosis nach nur 3 Injektionen, was eine wesentliche Reduktion der Gesamtzahl der Injektionen im Vergleich zu herkömmlichen Methoden der Hyposensibilisierung darstellt.
Als Wirkungsmechanismus der spezifischen Immuntherapie wird eine Umorientierung der T-Helfer Lymphozyten vermutet, d.h. ein Wechsel („Switch“) von TH2-Lymphozyten, die die IgE-Synthese und die Aktivierung von Entzündungszellen fördern, zu den protektiven TH1-Zellen und ihren Zytokinen, die durch Interferon-γ-Produktion der IgE-Synthese entgegenwirken.
Pharmakodynamik
Keine Angaben
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Absorption
Die Allergoide sind an L-Tyrosin gebunden und werden nach der subkutanen Injektion von diesem Adjuvans/Adsorbens nur langsam freigesetzt.
Distribution
Keine Daten vorhanden.
Metabolismus
Als natürliche Aminosäure wird L-Tyrosin vollständig metabolisiert. Weitere Angaben zu den Allergenextrakten sind nicht möglich.
Elimination
Keine Daten vorhanden.
Kinetik spezieller Patientengruppen
Keine Daten vorhanden.
Präklinische Daten
Keine relevanten Daten vorhanden.
Sonstige Hinweise
Inkompatibilitäten
Keine Daten vorhanden.
Beeinflussung diagnostischer Methoden
Keine Daten vorhanden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern. Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Vor der Verabreichung muss die Injektionssuspension auf Raumtemperatur gebracht werden, sie sollte deshalb beizeiten aus dem Kühlschrank genommen werden.
POLVAC ist eine weisse, undurchsichtige Suspension, welche während der Lagerung ein Sediment bilden kann. Deshalb ist es wesentlich, die Fertigspritze/Durchstechflasche vor der Injektion gründlich zu schütteln, damit das gesamte Sediment gleichmässig resuspendiert wird.
Handhabung der Fertigspritzen
-Packung mit Patientennamen beschriften.
-Die Injektionssuspension vor der Verabreichung auf Raumtemperatur bringen (Spritze 2-3 Stunden vor Gebrauch aus dem Kühlschrank nehmen und bei Raumtemperatur stehen lassen).
-Die Spritze unmittelbar vor Gebrauch 10 Sekunden lang gut schütteln (Suspension!).
-Luer-Lock Schutzkappe vorsichtig abziehen (Abb. 1).
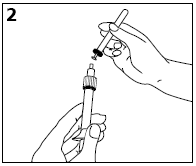
-Beiliegende Nadel durch Drehen im Uhrzeigersinn auf den Luer-Lock Ansatz schrauben. Dann Schutzkappe der Nadel entfernen (Abb. 2).
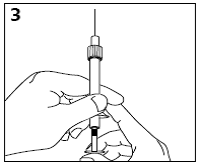
-Vorsichtig die Luft aus der Spritze und Nadel ausstossen (Abb. 3).
-Suspension mit konstantem Druck injizieren. Nicht intravasal (Aspirationskontrolle!) und nicht intramuskulär injizieren. Nicht an der Injektionsstelle reiben (Abb. 4).
Handhabung der Durchstechflaschen
-Packung mit Patientennamen beschriften.
-Die Injektionssuspension vor der Verabreichung auf Raumtemperatur bringen (Durchstechflasche 2-3 Stunden vor Gebrauch aus dem Kühlschrank nehmen und bei Raumtemperatur stehen lassen).
-Durchstechflasche unmittelbar vor Gebrauch 10 Sekunden lang gut schütteln (Suspension!).
-Kopfteil der Durchstechflasche mit einem Alkoholtupfer reinigen und Oberfläche trocknen lassen.
-Spritzenkolben bis zu der Markierung herausziehen, die der Medikationsmenge entspricht, die Sie aufziehen wollen.
-Spitze der Nadel in die Durchstechflasche einführen.
-Spritzenkolben hineinschieben und die Luft aus der Spritze in die Durchstechflasche drücken.
-Durchstechflasche auf den Kopf drehen und den Hals der Durchstechflasche mit Zeige- und Mittelfinger einer Hand festhalten.
-Mit der anderen Hand den Kolben bis zu der Markierung zurückziehen, die der verordneten Medikationsmenge entspricht.
-Vorsichtig die Luft aus der Spritze und Nadel ausstossen (Abb. 3).
-Suspension mit konstantem Druck injizieren. Nicht intravasal (Aspirationskontrolle!) und nicht intramuskulär injizieren. Nicht an der Injek-tionsstelle reiben (Abb. 4).
Zulassungsnummer
54785, 65474 (Swissmedic)
Packungen
POLVAC Bäume Basisbehandlung mit 3 Fertigspritzen oder 3 Durchstechflaschen (Nr. 1, 2 und 3). [A]
POLVAC Bäume Fortsetzungsbehandlung mit 3 Fertigspritzen (Nr. 3) oder 1 Durchstechflasche (Nr. 3). [A]
Zulassungsinhaberin
Bencard AG, 8606 Greifensee ZH
Stand der Information
März 2021