Zusammensetzung
Wirkstoffe
Aprepitant.
Hilfsstoffe
Kapselinhalt:
Saccharose, mikrokristalline Cellulose, Hydroxypropylcellulose und Natriumlaurylsulfat.
Kapselhülle:
Die Kapselhülle enthält Gelatine und Titandioxid (E 171) und kann Natriumlaurylsulfat und Silikondioxid enthalten. Die Hülle der 125-mg-Kapsel enthält rotes und gelbes Eisenoxid (E 172).
Die 125-mg-Kapseln sind opak mit weissem Unterteil und rosa Oberteil mit der Aufschrift «462» und «125 mg», in schwarzer Tinte radial aufgedruckt auf dem Unterteil. Die 80-mg-Kapseln sind opak mit weissem Unter- und Oberteil mit der Aufschrift «461» und «80 mg», in schwarzer Tinte radial aufgedruckt auf dem Unterteil.
Indikationen/Anwendungsmöglichkeiten
Emend, in Kombination mit einem 5-HT3-Antagonisten und Dexamethason, ist angezeigt zur Prävention von akuter und verzögerter Nausea und Erbrechen bei Erwachsenen, das durch hoch-emetogene Chemotherapie, einschliesslich Cisplatin in hohen Dosen und durch mässig-emetogene Chemotherapie induziert wird.
Dosierung/Anwendung
Emend (Aprepitant) ist als Kapsel zur oralen Anwendung erhältlich.
Emend wird über 3 Tage als Teil eines Therapieregimes mit einem Kortikosteroid und einem 5-HT3-Antagonisten gegeben. Vor Beginn der Behandlung mit Emend muss die Fachinformation von Ondansetron konsultiert werden.
Die empfohlene Dosis von Emend ist 125 mg oral 1 Stunde vor der Chemotherapie (Tag 1) und 80 mg oral einmal täglich morgens an Tag 2 und 3.
Empfohlene Dosierung bei emetogener Chemotherapie zur Prävention von Nausea und Erbrechen:
Hoch-emetogenes Chemotherapieschema:
|
|
Tag 1 |
Tag 2 |
Tag 3 |
Tag 4 |
|
Emend |
125 mg p.o. |
80 mg p.o. |
80 mg p.o. |
-- |
|
Dexamethason** |
12 mg p.o. |
8 mg p.o. |
8 mg p.o. |
8 mg p.o. |
|
Ondansetron |
Siehe Fachinformation von Ondansetron über die angemessene Dosierung |
-- |
-- |
-- |
**Dexamethason sollte 30 Minuten vor Beginn der Chemotherapie an Tag 1 sowie morgens an Tag 2-4 gegeben werden. Die Dosis von Dexamethason richtet sich nach Arzneimittelwechselwirkungen.
Mässig-emetogenes Chemotherapieschema:
|
|
Tag 1 |
Tag 2 |
Tag 3 |
|
Emend |
125 mg p.o. |
80 mg p.o. |
80 mg p.o. |
|
Dexamethason** |
12 mg p.o. |
-- |
-- |
|
Ondansetron*** |
2× 8 mg p.o. |
-- |
-- |
** Dexamethason sollte 30 Minuten vor Beginn der Chemotherapie an Tag 1 gegeben werden. Die Dosis von Dexamethason richtet sich nach Arzneimittelwechselwirkungen.
***Die erste Ondansetron 8 mg Kapsel sollte 30-60 Minuten vor Beginn der Chemotherapie und eine weitere 8 mg Kapsel 8 Stunden nach der ersten Dosis an Tag 1 gegeben werden.
Zusätzlich steht Ivemend (Fosaprepitant) 150 mg, ein lyophilisiertes Prodrug von Aprepitant zur intravenösen Anwendung zur Verfügung. Ivemend 150 mg steht als Einmaldosis zur Verfügung und kann als Alternative zum oralen 3-Tages-Behandlungsschema von Emend verwendet werden (siehe Fachinformation Ivemend 150 mg).
Allgemeine Information
Weitere Informationen zur Kombination mit Kortikosteroiden siehe unter «Interaktionen».
Wenn Emend mit anderen Antiemetika kombiniert wird, ist die Fachinformation des entsprechenden Antiemetikums zu beachten.
Emend kann unabhängig von der Nahrungsaufnahme eingenommen werden.
Für Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min) oder für Dialysepatienten mit einer Nierenerkrankung im Endstadium ist keine Dosisanpassung erforderlich.
Für Patienten mit leichter bis mässiger Leberinsuffizienz (Child-Pugh-Score 5-9) ist keine Dosisanpassung erforderlich. Für Patienten mit schwerer Leberinsuffizienz (Child-Pugh-Score >9) sind keine klinischen Daten vorhanden.
Die Dosis muss nicht nach Alter, Geschlecht, ethnischer Zugehörigkeit oder Body Mass Index (BMI) angepasst werden.
Kinder: Emend ist zur Anwendung bei pädiatrischen Patienten nicht zugelassen.
Kontraindikationen
Überempfindlichkeit gegenüber Aprepitant oder einem der Hilfsstoffe.
Emend darf nicht gleichzeitig mit Pimozid, Terfenadin, Astemizol oder Cisaprid angewendet werden. Die dosisabhängige Hemmung des Isoenzyms 3A4 des Cytochrom P450-Systems (CYP3A4) durch Aprepitant könnte die Plasmakonzentrationen dieser Arzneimittel erhöhen und so möglicherweise zu schwerwiegenden oder lebensbedrohlichen Reaktionen führen (siehe unter «Interaktionen»).
Warnhinweise und Vorsichtsmassnahmen
Emend, ein dosisabhängiger Hemmer von CYP3A4, sollte mit Vorsicht bei Patienten angewendet werden, die gleichzeitig mit Arzneimitteln behandelt werden, die hauptsächlich über CYP3A4 metabolisiert werden; einige Chemotherapeutika werden über CYP3A4 metabolisiert (siehe «Interaktionen»); Chemotherapeutika mit bekannter Metabolisierung über CYP3A4 sind Docetaxel, Paclitaxel, Etoposid, Irinotecan, Ifosfamide, Imatinib, Vinorelbin, Vinblastin und Vincristin. Die mässige Hemmung von CYP3A4 durch Aprepitant könnte zu erhöhten Plasmakonzentrationen der gleichzeitig angewendeten Arzneimittel führen (siehe «Interaktionen»). Deshalb sollten Chemotherapeutika mit Metabolisierung über CYP3A4 mit Vorsicht angewendet werden. Es wird angenommen, dass die schwache Hemmung von CYP3A4 durch eine einzelne Dosis von 40 mg Aprepitant die Plasmakonzentrationen von gleichzeitig eingenommenen Arzneimitteln nicht signifikant verändert. Die Wirkung von Emend auf die Pharmakokinetik von oral eingenommen CYP3A4 Substraten ist ausgeprägter als diejenige auf intravenös verabreichte CYP3A4 Substrate (siehe «Interaktionen»).
Die Kombination von Emend mit Warfarin kann zu einer klinisch signifikanten Verminderung der Prothrombinzeit (INR) führen. Bei Patienten unter Langzeittherapie mit Warfarin sollte die Prothrombinzeit (INR) in den ersten zwei Wochen und besonders an Tag 7 bis 10 nach Beginn der 3-tägigen Behandlung mit Emend in Verbindung mit jedem Chemotherapiezyklus engmaschig überwacht werden (siehe «Interaktionen»). Es wurden keine Interaktionsstudien mit Acenocoumarol und Phenprocoumon durchgeführt. Bei Patienten unter Langzeittherapie mit Acenocoumarol oder Phenprocoumon sollte die Prothrombinzeit während 2 Wochen nach Beginn der 3-tägigen Behandlung mit Emend engmaschig überwacht werden (siehe «Interaktionen»).
Die Wirkung oraler hormonaler Kontrazeptiva kann während und 28 Tage nach der Anwendung von Emend vermindert sein. Deshalb sollten während der Behandlung mit Emend und 1 Monat nach der letzten Dosis von Emend alternative oder zusätzliche Massnahmen zur Verhütung ergriffen werden (siehe «Interaktionen»).
Die gleichzeitige Einnahme von Ergotaminderivaten, die CYP3A4 Substrate sind, kann erhöhte Plasmaspiegel dieser Substanzen zur Folge haben. Aufgrund des potentiellen Risikos für ergotaminbedingte Toxizität ist Vorsicht geboten.
Interaktionen
Aprepitant ist ein Substrat, ein schwacher bis mässiger Inhibitor (dosisabhängig) und ein Induktor von CYP3A4. Zudem induziert Aprepitant CYP2C9.
Die Wirkung von Aprepitant auf die Pharmakokinetik anderer Arzneimittel
Durch eine schwache (40 mg) bis mässige (125 mg/80 mg) CYP3A4-Hemmung kann Aprepitant die Plasmakonzentrationen anderer gleichzeitig angewendeter Arzneimittel erhöhen, wenn diese über CYP3A4 metabolisiert werden. Wird das CYP3A4 Substrat intravenös verabreicht, fällt die Interaktion (Erhöhung von AUC und Plasmakonzentration) geringer aus als bei oraler Verabreichung.
Emend darf nicht gleichzeitig mit Pimozid, Terfenadin, Astemizol oder Cisaprid angewendet werden. Die dosisabhängige CYP3A4-Hemmung durch Aprepitant könnte die Plasmakonzentrationen dieser Arzneimittel erhöhen und so möglicherweise zu schwerwiegenden oder lebensbedrohlichen Reaktionen führen (siehe «Kontraindikationen»).
Es wurde gezeigt, dass Aprepitant den Metabolismus von Warfarin (S-) und Tolbutamid induziert, die über CYP2C9 metabolisiert werden. Die gleichzeitige Anwendung von Emend mit diesen oder anderen Arzneimitteln, deren Metabolismus über CYP2C9 bekannt ist, z.B. Phenytoin, kann die Plasmakonzentrationen dieser Arzneimittel verringern.
Eine Wechselwirkung zwischen Emend und Arzneimitteln, die Substrate für den Glykoprotein-P vermittelten Transport sind, ist unwahrscheinlich, wie auch eine klinische Studie zu Arzneimittelwechselwirkungen ergab, die zwischen Emend und Digoxin keine Wechselwirkung feststellen konnte.
5-HT3 Antagonisten: In klinischen Studien zu Arzneimittelwechselwirkungen hatte Emend, wenn dieses im Rahmen des Regime mit 125 mg an Tag 1 und 80 mg an den Tagen 2 und 3 gegeben wurde keine klinisch relevanten Wirkungen auf die Pharmakokinetik von Ondansetron, Granisetron oder Hydrodolasetron (den aktiven Metaboliten von Dolasetron). Mit Tropisetron liegen keine Studien vor.
Kortikosteroide:
Dexamethason: Emend als Teil eines Therapieschemas (eine Dosis 125 mg mit 20 mg Dexamethason oral an Tag 1, und in einer Dosis von 80 mg/Tag in Kombination mit 8 mg Dexamethason oral an den Tagen 2-5) vergrösserte die AUC von Dexamethason, einem CYP3A4-Substrat, um das 2,2-Fache an den Tagen 1 und 5. Die üblicherweise oral verabreichten Dosen von Dexamethason sollten bei einer Kombination mit Emend (125 mg/80 mg Therapieschema) ca. um 50% verringert werden, um Dexamethason-Expositionen zu erreichen, die denen ohne die Zusatztherapie mit Emend entsprechen. Die in den klinischen Studien (Chemotherapie induzierte Nausea und Erbrechen) mit Emend verwendeten Tagesdosen Dexamethason entsprechen einer ca. 50%igen Reduktion der Dexamethasondosis (siehe «Dosierung/Anwendung»). Eine einzelne Dosis von Emend (40 mg), zusammen mit einer einzelnen oralen Dosis von Dexamethason 20 mg verabreicht, erhöhte die AUC von Dexamethason um 1,45.
Methylprednisolon: Emend als Teil eines Therapieschemas (eine Dosis von 125 mg an Tag 1 und 80 mg/Tag an Tag 2 und 3) vergrösserte die AUC von Methylprednisolon, einem CYP3A4-Substrat um das 1,3-Fache an Tag 1 und das 2,5-Fache an Tag 3 (Dosierung Methylprednisolon 125 mg i.v. an Tag 1 und 40 mg oral an Tag 2 und 3). Die übliche intravenöse Dosis von Methylprednisolon sollte bei einer Kombination mit Emend (125 mg/80 mg Therapieschema) um ca. 25% und die übliche orale Dosis von Methylprednisolon um ca. 50% verringert werden, um Expositionen von Methylprednisolon zu erreichen, die denjenigen ohne Zusatztherapie mit Emend entsprechen.
Zytostatika: In klinischen Studien wurde Emend (125 mg/80 mg Therapieschema) mit folgenden Zytostatika kombiniert, die überwiegend oder teilweise über CYP3A4 metabolisiert werden: Etoposid, Vinorelbin, Docetaxel, Ifosfamid, Cyclophosphamid, Irinotecan und Paclitaxel. Die Dosierungen dieser Zytostatika wurden nicht hinsichtlich möglicher Wechselwirkungen angepasst. Dennoch wird bei Patienten, die diese Substanzen oder andere Zytostatika, welche primär über CYP3A4 metabolisiert werden, erhalten, zu Vorsicht und sorgfältiger, zusätzlicher Kontrolle geraten. Nach Markteinführung wurde bei Koadministration von Aprepitant und Ifosfamid über Ereignisse betreffend Neurotoxizität, eine mögliche unerwünschte Wirkung von Ifosfamid, berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Aufgrund der kleinen Anzahl von Patienten in den klinischen Studien, die CYP3A4-Substrate wie Docetaxel, Vinblastin, Vincristin oder Ifosamid erhielten, ist besondere Vorsicht und Überwachung bei Patienten geboten, die diese oder andere Chemotherapeutika erhalten, die primär über CYP3A4 metabolisiert werden und nicht untersucht wurden.
Docetaxel: Die Pharmakokinetik von Docetaxel wurde in einer separaten pharmakokinetischen Studie durch Emend (125 mg/80 mg Therapieschema) nicht beeinflusst.
Vinorelbin: Die Pharmakokinetik von Vinorelbin wurde in einer separaten pharmakokinetischen Studie durch Emend (125 mg/80 mg Therapieschema) nicht beeinflusst.
Warfarin: Gesunde Probanden, die unter Langzeittherapie mit Warfarin stabil eingestellt waren, erhielten eine Einzeldosis Emend von 125 mg an Tag 1 und von 80 mg/Tag an Tag 2 und 3. Obwohl an Tag 3 keine Wirkung von Emend auf die AUC von Warfarin (R+) oder (S-) festgestellt wurde, nahm die Minimalkonzentration von Warfarin (S-) (einem CYP2C9 Substrat) 5 Tage nach Beendigung der Anwendung von Emend um 34% ab, begleitet von einer Verringerung der Prothrombinzeit (INR) um 14%. Das weist auf eine potentielle klinisch relevante Induktion von CYP2C9 hin. Bei Patienten unter Langzeittherapie mit Warfarin sollte die Prothrombinzeit (INR) in den ersten zwei Wochen und besonders an Tag 7 bis 10 nach Beginn der 3-tägigen Behandlung mit Emend in Verbindung mit jedem Chemotherapiezyklus engmaschig überwacht werden. Es wurden keine Interaktionsstudien mit Acenocoumarol und Phenprocoumon durchgeführt. Bei Patienten unter Langzeittherapie mit Acenocoumarol oder Phenprocoumon sollte die INR während 2 Wochen, besonders an Tag 7 bis 10 nach Beginn der 3-tägigen Behandlung mit Emend engmaschig überwacht werden.
Orale Kontrazeptiva: Aprepitant, als Kapseln in einer Dosierung von 100 mg/Tag über 14 Tage angewendet, verkleinerte bei gleichzeitiger Einnahme eines oralen Kontrazeptivums (35 µg Ethinylestradiol und 1 mg Norethisteron) die AUC von Ethinylestradiol um 43% sowie die AUC von Norethisteron um 8%. Diese pharmakokinetischen Veränderungen wurden mit abnormalen Entzugsblutungen assoziiert.
In einer anderen Studie wurde ein orales Kontrazeptivum (Ethinylestradiol und Norethindron) während 21 Tage täglich eingenommen, zusätzlich wurde das Emend Therapieschema wie folgt gegeben: 125 mg an Tag 8 und 80 mg täglich an Tag 9 und 10; Ondansetron 32 mg i.v. an Tag 8 und Dexamethason 12 mg oral an Tag 8 und 8 mg täglich an Tag 9, 10 und 11. In der Studie war die AUC von Ethinylestradiol an Tag 10 um 19% erniedrigt und die Trough-Konzentrationen von Ethinylestradiol an den Tagen 9 bis 21 um bis zu 64% erniedrigt. Obwohl Emend an Tag 10 keine Veränderung der AUC von Norethindron bewirkte, gab es eine Verringerung um bis zu 60% der Trough-Konzentrationen von Norethindron an Tag 9 bis 21. Deshalb kann die Wirksamkeit oraler Kontrazeptiva während und für 28 Tage nach einer Therapie mit Emend reduziert sein. Während und 1 Monat nach der letzten Dosis von Emend sollten alternative oder zusätzliche Massnahmen zur Verhütung ergriffen werden.
Tolbutamid: Werden vor der Verabreichung von Emend (125 mg am Tag 1 und 80 mg/Tag an den Tagen 2 und 3) sowie an den Tagen 4, 8 und 15 je 500 mg orales Tolbutamid (ein CYP2C9-Substrat) verabreicht, sinkt die AUC von Tolbutamid um 23% an Tag 4, 28% an Tag 8 und 15% an Tag 15.
Midazolam: In einer Studie erhöhte Emend (125 mg an Tag 1 und 80 mg/Tag an Tag 2 bis 5) die AUC von Midazolam (2 mg oral an Tag 1 und 5), einem empfindlichen CYP3A4-Substrat, um das 2,3-Fache an Tag 1 und das 3,3-Fache an Tag 5.
Aprepitant als einzelne Dosis von 200 mg nach einem leichten Frühstück zusammen mit Midazolam 2 mg oral verabreicht, erhöhte die AUC von Midazolam um das 3,2-Fache an Tag 1. Keine klinisch bedeutsame Auswirkung resultierte an Tag 4 (Erhöhung der AUC von Midazolam um das 1,2-Fache) und eine geringe Änderung der AUC von Midazolam wurde an Tag 8 beobachtet (Reduktion um 35%).
In einer anderen Studie wurde Midazolam 2 mg i.v. vor Beginn des dreitägigen Therapieregimes mit Emend (125 mg an Tag 1 und 80 mg/Tag an Tag 2 und 3) und an den Tagen 4, 8 und 15 verabreicht. Emend erhöhte die AUC von Midazolam um 25% an Tag 4 und senkte die AUC von Midazolam um 19% an Tag 8. Diese Wirkung wurde nicht als klinisch bedeutend angesehen. Die AUC von Midazolam an Tag 15 entsprach derjenigen vor Beginn der Behandlung.
Die möglichen Auswirkungen erhöhter Plasmakonzentrationen von Midazolam oder anderen über CYP3A4 metabolisierten Benzodiazepinen (Alprazolam, Triazolam) sind bei gleichzeitiger Anwendung von Emend (125 mg/80 mg) mit diesen Substanzen zu berücksichtigen. Bei gleichzeitiger Gabe einer Einzeldosis von Emend (40 mg) und Midazolam (2 mg oral) war die AUC von Midazolam um das 1,2-Fache am ersten Tag erhöht.
In einer zusätzlichen Studie wurde eine Einzeldosis Midazolam 2 mg intravenös eine Stunde nach oraler Gabe einer Einzeldosis von 125 mg Emend verabreicht. Die Plasma-AUC von Midazolam war um das 1,5-Fache erhöht; dieser Effekt wird als nicht klinisch signifikant betrachtet.
Die Wirkungen anderer Substanzen auf die Pharmakokinetik von Aprepitant
Aprepitant ist ein Substrat für CYP3A4; deshalb kann die Kombination von Emend mit Arzneimitteln, die Inhibitoren der CYP3A4-Aktivität sind, zu erhöhten Plasmakonzentrationen von Aprepitant führen. Daher sollte die gleichzeitige Anwendung von Emend und starken CYP3A4-Inhibitoren (z.B. Ketoconazol) vorsichtig begonnen werden. Weil mässige CYP3A4-Inhibitoren (z.B. Diltiazem) zu 2-Facher Erhöhung der Plasmakonzentrationen von Aprepitant führen, ist auch hier entsprechende Vorsicht geboten.
Aprepitant ist ein Substrat für CYP3A4; daher kann die Kombination von Emend mit Arzneimitteln, die starke Induktoren der CYP3A4-Aktivität sind (z.B. Rifampicin, Carbamazepin, Phenytoin), zu erniedrigten Plasmakonzentrationen von Aprepitant und damit zu einer verminderten Wirksamkeit von Emend führen.
Ketoconazol: Die Verabreichung einer 125 mg Einzeldosis von Emend an Tag 5 eines 10tägigen Therapieregimes mit 400 mg Ketoconazol pro Tag (ein starker CYP3A4-Inhibitor) erhöhte die AUC von Aprepitant um das ca. 5-Fache und verlängerte die terminale Halbwertszeit von Aprepitant um das ca. 3-Fache. Die gleichzeitige Anwendung von Emend mit starken CYP3A4-Inhibitoren sollte vorsichtig begonnen werden.
Rifampicin: Die Verabreichung einer 375 mg Einzeldosis von Emend an Tag 9 eines 14tägigen Therapieregimes von 600 mg Rifampicin pro Tag (ein starker CYP3A4-Induktor) verkleinerte die AUC von Aprepitant ca. um den Faktor 11 und verkürzte die terminale Halbwertzeit ca. um den Faktor 3. Die gleichzeitige Anwendung von Emend und Arzneimitteln, die Induktoren der CYP3A4-Aktivität sind, kann zu erniedrigten Plasmakonzentrationen von Aprepitant und damit zu einer verminderten Wirksamkeit von Emend führen.
Weitere Wechselwirkungen
Diltiazem: Bei Patienten mit leichter bis mässiger Hypertonie führte die Anwendung einer Tagesdosis Aprepitant in einer Tablettenformulierung (entsprechend ca. 230 mg der Kapselformulierung) kombiniert mit 120 mg Diltiazem dreimal täglich über 5 Tage zu einer Erhöhung der AUC von Aprepitant um das 2-Fache sowie gleichzeitig zu einer Erhöhung der AUC von Diltiazem um das 1,7-Fache. Diese pharmakokinetischen Wirkungen führten nicht zu klinisch relevanten Veränderungen in EKG, Herzfrequenz oder Blutdruck über die von Diltiazem ausgelösten Wirkungen hinaus.
Paroxetin: Die Kombination einer Tablettenformulierung von Aprepitant (entsprechend 85 mg oder 170 mg der Kapselformulierung) 1x pro Tag mit 20 mg Paroxetin einmal täglich führte sowohl bei Aprepitant als auch bei Paroxetin zu einer Verkleinerung der AUC um ca. 25% und einer Verringerung der Cmax um ca. 20%.
Schwangerschaft, Stillzeit
Schwangerschaft
Es wurden keine geeigneten klinischen Studien mit schwangeren Frauen durchgeführt. Emend sollte während der Schwangerschaft nur angewendet werden, wenn dies absolut erforderlich ist.
Stillzeit
Aprepitant geht in die Milch säugender Ratten über. Es ist nicht bekannt, ob die Substanz beim Menschen in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen und Nebenwirkungen von Emend beim gestillten Säugling auftreten könnten, ist unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter eine Entscheidung zu treffen, ob abgestillt oder das Arzneimittel abgesetzt werden sollte.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Aufgrund der möglichen Nebenwirkungen ist beim Lenken von Fahrzeugen und Bedienen von Maschinen Vorsicht geboten.
Unerwünschte Wirkungen
Das Sicherheitsprofil von Aprepitant wurde an ca. 6'500 Personen untersucht.
Hoch-emetogene Chemotherapie (HEC)
In 2 kontrollierten klinischen Studien mit Krebspatienten, die eine hoch emetogene Chemotherapie (HEC) erhielten, wurden 544 Patienten während des 1. Zyklus der Chemotherapie und 413 dieser Patienten während der Verlängerung bis zu 6 Chemotherapiezyklen mit Aprepitant behandelt. Das orale 3-Tages-Regime von Emend wurde zusammen mit Ondansetron und Dexamethason angewendet. Die meisten in diesen Studien berichteten unerwünschten Ereignisse wurden als leicht bis mässig in ihrer Intensität beschrieben.
Zu den häufigsten Nebenwirkungen, die bei Patienten unter dem oralen 3-Tages-Regime von Aprepitant mit einer höheren Inzidenz als mit der Standardtherapie berichtet wurden, zählen: Schluckauf (4,6%), erhöhte Werte von ALT (2,8%), Dyspepsie (2,6%), Obstipation (2,4%), Kopfschmerzen (2,0%) und verminderter Appetit (2,0%).
In einer weiteren aktiv kontrollierten klinischen Studie bei 1169 Patienten, die das orale 3-Tages-Regime von Aprepitant bei HEC erhielten, war das Nebenwirkungsprofil im Allgemeinen vergleichbar mit demjenigen anderer Studien mit HEC und dem oralen 3-Tages-Regime von Aprepitant.
Mässig-emetogene Chemotherapie (MEC)
In zwei kontrollierten klinischen Studien bei Patienten mit mässig emetogener Chemotherapie (MEC) wurden 868 Patienten während des ersten Chemotherapiezyklus und 686 dieser Patienten in bis zu 4 Chemotherapiezyklen mit dem oralen 3-Tages-Regime von Aprepitant behandelt. Das orale 3-Tages-Regime von Emend wurde in beiden Studien in Kombination mit Ondansetron und Dexamethason gegeben. Die Intensität der meisten in diesen Studien berichteten unerwünschten Wirkungen wurde als leicht bis mässig beschrieben.
In der kombinierten Analyse der Daten des ersten Zyklus beider Studien wurde bei 14% der Patienten mit dem oralen 3-Tages-Regime von Aprepitant verglichen mit 15% der Patienten mit Standardtherapie über unerwünschte Ereignisse berichtet, bei denen die Untersucher einen kausalen Zusammenhang mit der antiemetischen Behandlung annahmen. Die Behandlung wurde bei 0,7% der Patienten unter dem oralen 3-Tages-Regime von Aprepitant wegen solchen Nebenwirkungen abgesetzt, verglichen mit 0,2% der Patienten unter Standardtherapie.
Das häufigste durch die antiemetische Therapie verursachte unerwünschte Ereignis, welches mit höherer Inzidenz bei Patienten mit dem oralen 3-Tages-Regime von Aprepitant als unter Standardtherapie beobachtet wurde, war Müdigkeit (1,4%).
Hoch- und mässig-emetogene Chemotherapie
In einer gepoolten Analyse von Studien mit HEC und MEC, wurden folgende Nebenwirkungen bei Patienten unter dem oralen 3-Tages-Regime von Aprepitant häufiger beobachtet als bei Patienten unter Standardtherapie:
[Häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000)]
Infektionen und parasitäre Erkrankungen
Selten: Candidiasis, Staphylokokkeninfektion.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Anämie, febrile Neutropenie.
Stoffwechsel- und Ernährungsstörungen
Häufig: Verminderter Appetit.
Selten: Polydipsie.
Psychiatrische Erkrankungen
Gelegentlich: Angst.
Selten: Desorientierung, euphorische Stimmung.
Erkrankungen des Nervensystems
Gelegentlich: Schwindel, Somnolenz.
Selten: Kognitive Störungen, Lethargie, Dysgeusie.
Augenerkrankungen
Selten: Konjunktivitis.
Erkrankungen des Ohrs und des Labyrinths
Selten: Tinnitus.
Herzerkrankungen
Gelegentlich: Palpitationen.
Selten: Bradykardie, kardiovaskuläre Erkrankung.
Gefässerkrankungen
Gelegentlich: Hitzewallung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Singultus.
Selten: Oropharyngeale Schmerzen, Niesen, Husten, nasotracheales Sekret («postnasal drip»), Halsirritation.
Erkrankungen des Gastrointestinaltrakts
Häufig: Dyspepsie.
Gelegentlich: Aufstossen, Übelkeit, gastroösophageale Refluxkrankheit, Erbrechen, Bauchschmerzen, Mundtrockenheit, Flatulenz.
Selten: Harter Stuhl, Perforation eines Duodenalulkus, neutropenische Kolitis, Stomatitis, abdominale Blähungen.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Ausschlag, Akne.
Selten: Photosensibilität, Hyperhidrose, Seborrhö, Hautläsion, juckender Ausschlag.
Über 1 Fall von einem Stevens-Johnson-Syndrom wurde bei einem Patienten unter Aprepitant in einer anderen Studie bei CINE berichtet.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Muskelspasmen, Muskelschwäche.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Dysurie.
Selten: Pollakisurie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit.
Gelegentlich: Asthenie, Malaise.
Selten: Ödem, Unwohlsein im Brustbereich, Gangstörungen.
Untersuchungen
Häufig: ALT erhöht.
Gelegentlich: AST erhöht, alkalische Phosphatase im Blut erhöht.
Selten: Erhöhte Urinausscheidung, Mikrohämaturie, vermindertes Natrium im Blut, Gewichtsabnahme, Glukosurie, Abnahme der Neutrophilen.
Die Nebenwirkungsprofile waren in den Folgezyklen (bis zu 6 Chemotherapiezyklen) der Studien mit hoch-emetogener und mässig-emetogener Chemotherapie vergleichbar mit denjenigen des 1. Therapiezyklus.
Andere Studien
Zusätzliche unerwünschte Wirkungen wurden bei Patienten beobachtet, welche mit Aprepitant (40 mg) zur Prävention von postoperativer Nausea und Erbrechen (PONE) behandelt wurden: abnormale Darmgeräusche, Sprachstörungen, Dyspnö, Störung der Sinneswahrnehmung, Miosis, verminderte Sensibilität, Magenbeschwerden, verminderte Sehschärfe, pfeifendes Atemgeräusch.
Zusätzlich wurde in klinischen Studien (PONE) über zwei schwerwiegende unerwünschte Ereignisse bei Patienten berichtet, die höhere Dosierungen von Aprepitant erhielten: Ein Fall von Obstipation und ein Fall eines Subileus.
Angioödem und Urtikaria wurden als schwerwiegende unerwünschte Ereignisse bei einem Patienten beobachtet, der Aprepitant ausserhalb der CINE- und PONE- Studien erhielt.
Meldungen nach Markteinführung
Die folgenden unerwünschten Wirkungen wurden nach Markteinführung von Emend gemeldet. Da diese Meldungen auf freiwilliger Basis und von einer Population nicht genau bekannter Grösse stammen, ist es im Allgemeinen nicht möglich, deren Häufigkeit zuverlässig einzuschätzen oder eine Kausalbeziehung mit dem Medikament herzustellen.
Störungen des Immunsystems
Überempfindlichkeitsreaktionen inkl. anaphylaktische Reaktionen.
Funktionsstörungen der Haut und des Unterhautzellgewebes
Pruritus, Hautausschlag, Urtikaria, selten Stevens-Johnson Syndrom, toxische epidermale Nekrolyse.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es liegen keine speziellen Informationen zur Therapie einer Überdosierung mit Emend vor. Einzeldosen bis zu 600 mg Aprepitant wurden von gesunden Probanden im Allgemeinen gut vertragen. In Studien zu anderen Indikationen als zu zytostatikainduzierter Übelkeit und Erbrechen wurde Aprepitant in Dosierungen von 375 mg pro Tag bis zu 42 Tagen gut vertragen. Bei 33 Krebspatienten wurden Dosierungen von 375 mg Aprepitant an Tag 1 und 250 mg einmal täglich an Tag 2-5 normalerweise gut vertragen.
Ein Patient, der 1440 mg Aprepitant eingenommen hatte, litt an Benommenheit und Kopfschmerzen.
Im Fall einer Überdosierung soll Emend abgesetzt werden. Es sollte für übliche unterstützende Massnahmen und eine Überwachung des Patienten gesorgt werden. Aufgrund der antiemetischen Wirkung von Aprepitant, können Emetika evt. nicht wirken.
Aprepitant ist nicht hämodialysierbar.
Eigenschaften/Wirkungen
ATC-Code
A04AD12
Wirkungsmechanismus
Aprepitant ist ein selektiver Substanz-P-Neurokinin 1 (NK1)-Rezeptor-Antagonist mit hoher Affinität. Aprepitant hat eine sehr kleine oder keine Affinität zu anderen Enzym-, Transport-, Ionenkanal- und Rezeptorstellen, einschliesslich der Dopamin- und Serotonin-Rezeptoren, auf die bisher angewendete Therapien für zytostatikainduzierte Übelkeit und Erbrechen (CINE) abzielen.
Pharmakodynamik
Fosaprepitant, ein Prodrug von Aprepitant, wird nach intravenöser Anwendung rasch zu Aprepitant umgewandelt.
Kardiale Elektrophysiologie
Eine Einzeldosis Fosaprepitant von 200 mg hatte keine Auswirkung auf das QTc-Intervall.
Untersuchung der NK1-Rezeptorbesetzung im Gehirn mittels Positronemissions-Tomographie
Präklinische Untersuchungen zeigten, dass NK1-Rezeptor-Antagonisten ein durch zytotoxische Wirkungen einer Chemotherapie induziertes (z.B. durch Cisplatin induziertes) Erbrechen über zentrale Mechanismen hemmen. Untersuchungen an Tieren und Menschen mittels Positronemissions-Tomographie (PET) zeigten, dass Aprepitant die Blut-Hirn-Schranke passiert und die NK1-Rezeptoren im Gehirn besetzt. Weiterhin wurde in präklinischen Studien festgestellt, dass Aprepitant eine langdauernde zentrale Wirkung besitzt und sowohl akute als auch verzögerte Phasen Cisplatin-induzierter Emesis hemmt sowie die anti-emetische Aktivität des 5-HT3-Rezeptor-Antagonisten Ondansetron und des Kortikosteroids Dexamethason gegen Cisplatin-induzierte Emesis verstärkt.
Klinische Wirksamkeit
Hoch-emetogene Chemotherapie (HEC)
Emend ist, in Kombination mit Ondansetron und Dexamethason (Aprepitant Therapieschema), wirksam bei akuter und verzögerter Nausea und Erbrechen induziert durch hoch-emetogene Chemotherapie (HEC), einschliesslich Cisplatin.
In 2 randomisierten, doppelblinden Multizentervergleichsstudien wurde ein Therapieschema mit Aprepitant (siehe Tabelle unten) mit einer Standardtherapie bei Patienten verglichen, deren Chemotherapie Cisplatin >50 mg/m2 (mittlere Cisplatin-Dosis 80,2 mg/m2) enthielt. Von 550 Patienten, die das Therapieschema mit Aprepitant erhielten, waren 42% Frauen, 58% Männer, 59% Weisse, 3% Asiaten, 5% Schwarze, 12% Südamerikaner und 21% Mehrrassig. Die mit Aprepitant behandelten Patienten hatten ein Durchschnittsalter von 56 Jahren (Bereich 14-84 Jahre). 170 Patienten waren 65 Jahre und älter, darunter waren 29 Patienten im Alter über 75.
Die Patienten (N = 1105) waren entweder zum Aprepitant Arm (N = 550) oder zur Standardtherapie (N = 555) randomisiert. Die Therapieschemata sind in der untenstehenden Tabelle definiert.
Tabelle 1
Therapieschemata
|
Behandlung |
Tag 1 |
Tage 2 bis 4 |
|
Aprepitant |
Aprepitant 125 mg po |
Aprepitant 80 mg po täglich (Tag 2 und 3) |
|
Dexamethason 20 mg po | ||
|
Standardtherapie |
Dexamethason 8 mg po täglich (morgens) |
* In den klinischen Studien mit Emend wurde Ondansetron 32 mg i.v. verwendet. Obwohl diese Dosis in klinischen Studien verwendet wurde, ist diese aufgrund von neueren sicherheitsrelevanten Erkenntnissen nicht mehr die aktuell empfohlene Dosis. Siehe Fachinformation von Ondansetron für die aktuelle Dosierung.
In diesen Studien erhielten 95% der Patienten in der Aprepitant-Gruppe zusätzlich zu Cisplatin ein weiteres Chemotherapeutikum. Die am häufigsten verwendeten Chemotherapeutika und die Anzahl von Patienten unter Aprepitant waren: Etoposid (106), Fluorouracil (100), Gemcitabin (89), Vinorelbin (82), Paclitaxel (52), Cyclophosphamid (50), Doxorubicin (38), Docetaxel (11). Die antiemetische Wirkung von Aprepitant wurde während der akuten Phase (0 bis 24 Stunden nach Cisplatin-Behandlung), der verzögerten Phase (25 bis 120 Stunden nach Cisplatin-Behandlung) und gesamthaft (0-120 Stunden nach Cisplatin-Behandlung) im ersten Zyklus evaluiert. Die Wirksamkeitsendpunkte waren:
Primärer Endpunkt:
·Vollständiges Ansprechen, definiert als keine emetische Episode und keine Anwendung von Bedarfsmedikation
Andere vordefinierte Endpunkte (sekundäre und exploratorische):
·Vollständiger Schutz, definiert als keine emetische Episode, keine Anwendung von Bedarfsmedikation und ein maximaler VAS Score (Visual Analog Scale) <25 mm auf einer Skala von 0 bis 100 mm.
·Keine Emesis, definiert als keine emetische Episode, unabhängig von Bedarfsmedikation
·Keine Nausea (max. VAS <5 mm auf einer Skala von 0 bis 100 mm)
·Keine signifikante Nausea (max. VAS <25 mm auf einer Skala von 0 bis 100 mm)
Tabelle 2 und 3 zeigen eine Zusammenfassung der Resultate der einzelnen Studien.
Tabelle 2
Ansprechrate von Patienten mit hoch-emetogener Chemotherapie pro Behandlungsgruppe und Phase in Studie 1 - Zyklus 1
|
Endpunkte |
Aprepitant-Schema |
Standardtherapie |
p-Wert |
|
Primärer Endpunkt | |||
|
Vollständiges Ansprechen | |||
|
Gesamt‡ |
73 |
52 |
<0,001 |
|
Andere vordefinierte (sekundäre und exploratorische) Endpunkte | |||
|
Vollständiges Ansprechen | |||
|
Akute Phase§ |
89 |
78 |
<0,001 |
|
Verzögerte Phase|| |
75 |
56 |
<0,001 |
|
Vollständiger Schutz | |||
|
Gesamt |
63 |
49 |
0,001 |
|
Akute Phase |
85 |
75 |
0,005 |
|
Verzögerte Phase |
66 |
52 |
<0,001 |
|
Keine Emesis | |||
|
Gesamt |
78 |
55 |
<0,001 |
|
Akute Phase |
90 |
79 |
0,001 |
|
Verzögerte Phase |
81 |
59 |
<0,001 |
|
Keine Nausea | |||
|
Gesamt |
48 |
44 |
>0,050 |
|
Verzögerte Phase |
51 |
48 |
>0,050 |
|
Keine signifikante Nausea | |||
|
Gesamt |
73 |
66 |
>0,050 |
|
Verzögerte Phase |
75 |
69 |
>0,050 |
† N: Anzahl Patienten (älter als 18 Jahre) mit Cisplatin, Studienmedikation, mit mindestens einer Wirksamkeitsevaluation nach Behandlung.
‡ Gesamt: 0 to 120 h nach Cisplatin Behandlung.
§ Akute Phase: 0 to 24 h nach Cisplatin Behandlung.
|| Verzögerte Phase: 25 to 120 h nach Cisplatin Behandlung.
Visual analogue scale (VAS) Skalenbereich: 0 mm = keine Nausea; 100 mm = schlimmste Form von Nausea.
Tabelle 2 enthält nominale p-Werte, nicht adjustiert für Mehrfachnennung.
Tabelle 3
Ansprechrate von Patienten mit hoch-emetogener Chemotherapie pro Behandlungsgruppe und Phase in Studie 2 - Zyklus 1
|
Endpunkte |
Aprepitant-Schema |
Standardtherapie |
p-Wert |
|
Primärer Endpunkt | |||
|
Vollständiges Ansprechen | |||
|
Gesamt‡ |
63 |
43 |
<0,001 |
|
Andere vordefinierte (sekundäre und exploratorische) Endpunkte | |||
|
Vollständiges Ansprechen | |||
|
Akute Phase§ |
83 |
68 |
<0,001 |
|
Verzögerte Phase|| |
68 |
47 |
<0,001 |
|
Vollständiger Schutz | |||
|
Gesamt |
56 |
41 |
<0,001 |
|
Akute Phase |
80 |
65 |
<0,001 |
|
Verzögerte Phase |
61 |
44 |
<0,001 |
|
Keine Emesis | |||
|
Gesamt |
66 |
44 |
<0,001 |
|
Akute Phase |
84 |
69 |
<0,001 |
|
Verzögerte Phase |
72 |
48 |
<0,001 |
|
Keine Nausea | |||
|
Gesamt |
49 |
39 |
0,021 |
|
Verzögerte Phase |
53 |
40 |
0,004 |
|
Keine signifikante Nausea | |||
|
Gesamt |
71 |
64 |
>0,050 |
|
Verzögerte Phase |
73 |
65 |
>0,050 |
† N: Anzahl Patienten (älter als 18 Jahre) mit Cisplatin, Studienmedikation, mit mindestens einer Wirksamkeitsevaluation nach Behandlung.
‡ Gesamt: 0 to 120 h nach Cisplatin Behandlung.
§ Akute Phase: 0 to 24 h nach Cisplatin Behandlung.
|| Verzögerte Phase: 25 to 120 h nach Cisplatin Behandlung.
Visual analogue scale (VAS) Skalenbereich: 0 mm = keine Nausea; 100 mm = schlimmste Form von Nausea.
Tabelle 3 enthält nominale p-Werte, nicht adjustiert für Mehrfachnennung.
In beiden Studien hatte ein signifikant höherer Anteil Patienten unter Aprepitant-Behandlung in Zyklus 1 ein vollständiges Ansprechen (primärer Endpunkt) verglichen mit Patienten unter Standardtherapie. Ein statistisch signifikanter Unterschied in Bezug auf das vollständige Ansprechen zu Gunsten des Aprepitant-Therapieschemas wurde auch bei separater Analyse der akuten und verzögerten Phase festgestellt.
In beiden Studien war die geschätzte Zeit bis zum ersten Erbrechen nach Behandlungsbeginn mit der Cisplatintherapie unter Aprepitant länger und das Auftreten des ersten Erbrechens war in der Aprepitantgruppe verglichen mit der Standardtherapiegruppe reduziert, siehe Kaplan-Meier Kurven in Abb.1.
Abb. 1: Prozent Patienten mit hoch-emetogener Chemotherapie ohne Emesis - Zyklus 1
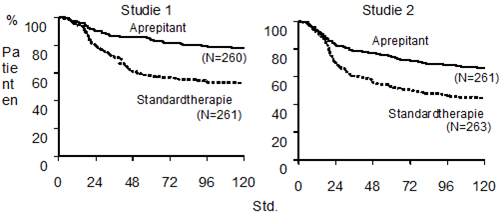
p-Wert <0.001 basiert auf einem Log Rank Test für Studie 1 und Studie 2; nominale p-Werte nicht adjustiert für Multiplizität.
Patientenberichte zur Wirkung: Der Einfluss von Übelkeit und Erbrechen auf den Alltag der Patienten wurde in Zyklus 1 beider Studien mit einem speziellen Index (Functional Living Index-Emesis FLIE) gemessen, einer validierten Methode zur Auswertung der von Patienten berichteten Ergebnisse betreffend Nausea und Erbrechen. Minimale oder keine Nausea und Erbrechen im täglichen Leben des Patienten ist definiert als FLIE Wert von >108. In beiden Studien zeigte ein höherer Anteil der Patienten unter Aprepitant im Vergleich zur Standardtherapie (p <0,001) keine oder nur eine minimale Beeinträchtigung des Alltags durch Übelkeit und Erbrechen (Studie 1: 74% vs. 64%; Studie 2: 75% vs. 64%) gemessen am FLIE Gesamtwert.
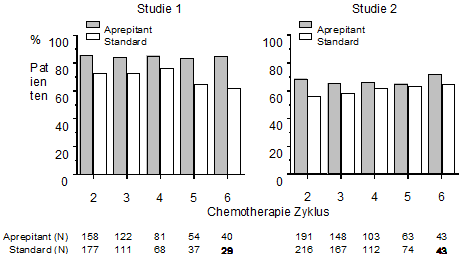
Mehrfachzyklen: In denselben 2 klinischen Studien setzten Patienten die Therapie über bis zu 5 weitere Chemotherapiezyklen fort. Der Anteil Patienten ohne Emesis und ohne signifikante Nausea ist pro Behandlungsgruppe in Abb. 2 dargestellt. Die antiemetische Wirksamkeit wurde bei Patienten, die Aprepitant erhielten, über mehrere Zyklen aufrechterhalten.
Abb. 2: Anteil Patienten mit hoch-emetogener Chemotherapie ohne Emesis und ohne signifikante Nausea pro Behandlungsgruppe und Zyklus
Mässig-emetogene Chemotherapie (MEC)
In einer randomisierten Doppelblindstudie mit insgesamt 866 Patienten mit Chemotherapie [einschliesslich Cyclophosphamid 750-1500 mg/m2; oder Cyclophosphamid 500-1500 mg/m2 und Doxorubicin (≤60 mg/m2) oder Epirubicin (≤100 mg/m2)], die Aprepitant in Kombination mit einem Ondansetron/Dexamethason Schema (siehe «Dosierung/Anwendung») erhielten, wurde diese Kombination mit einer Standardtherapie verglichen (Placebo mit Ondansetron 8 mg oral [2 mal täglich an Tag 1 und alle 12 Stunden an Tag 2 und 3] sowie 20 mg Dexamethason oral an Tag 1).
Die antiemetische Wirksamkeit von Emend wurde während der akuten Phase (0 bis 24 Stunden nach Chemotherapie), der verzögerten Phase (25 bis 100 Stunden nach Chemotherapie) und gesamthaft (0 bis 120 Stunden nach Chemotherapie) in Zyklus 1 ausgewertet. Die Evaluation der Wirksamkeit basierte auf den folgenden zusammengesetzten Messpunkten: vollständiges Ansprechen (definiert als keine emetische Episode und keine Verwendung von zusätzlichen Antiemetika nach Bedarf) und Einfluss von Nausea und Erbrechen auf das tägliche Leben.
Eine Zusammenfassung der wichtigsten Studienresultate zeigt Tabelle 4.
Tabelle 4
Prozentanteil Patienten mit mässig-emetogener Chemotherapie Therapieantwort nach Behandlungsgruppe und Phase – Zyklus 1
|
Zusammengesetzte Messpunkte |
Aprepitant-Schema* |
Standardtherapie** |
p-Value | |
|
Vollständiges Ansprechen (keine Emesis und keine Notfallmedikation) | ||||
|
Gesamt‡ |
51 |
42 |
0,015 | |
|
Akute Phase§ |
76 |
69 |
0,034 | |
|
Verzögerte Phase|| |
55 |
49 |
0,064 | |
|
Keinen Einfluss auf das tägliche Leben (Functional Living Index-Emesis [FLIE] total score >108) | ||||
|
Gesamt |
64 |
56 |
0,019 | |
* Aprepitant Schema: Emend 125 mg oral an Tag 1 und 80 mg oral an Tag 2 und 3 plus Ondansetron 8 mg oral zweimal an Tag 1 plus Dexamethason 12 mg oral an Tag 1.
** Standard Therapie: Placebo plus Ondansetron 8 mg oral (zweimal an Tag 1 und alle 12 Stunden an Tag 2 und 3) plus Dexamethason 20 mg oral an Tag 1.
† N: Anzahl Patienten der Analyse des primären Endpunktes vollständiges Ansprechen.
‡ Gesamt: 0 bis 120 Stunden nach Chemotherapie.
§ Akute Phase: 0 bis 24 Stunden nach Chemotherapie.
|| Verzögerte Phase: 25 bis 120 Stunden nach Chemotherapie.
In dieser Studie zeigte ein statistisch signifikant grösserer Anteil der Patienten, die das Aprepitantbehandlungsschema (51%) erhielten, komplettes Ansprechen (primärer Endpunkt) während der gesamten Behandlungsphase im Vergleich zu Patienten mit Standardtherapie (42%). Zusätzlich hatte ein grösserer Anteil von Patienten mit dem Aprepitantschema komplettes Ansprechen während der akuten und verzögerten Phasen in Zyklus 1 verglichen mit Patienten unter Standardtherapie.
In dieser Studie zeigte ein statistisch signifikanter Anteil Patienten mit dem Aprepitantbehandlungsschema im Zyklus 1 keine Beeinträchtigung des täglichen Lebens durch Nausea und Erbrechen, bezogen auf den FLIE Gesamtscore >108, verglichen mit Patienten unter Standardtherapie.
Folgezyklen: Insgesamt nahmen 744 Patienten an der Extension der Studie mit Mehrfachzyklen teil und erhielten bis zu 4 Zyklen Chemotherapie. Die Wirksamkeit des Aprepitantbehandlungsschemas blieb während aller Zyklen bestehen.
In einer zweiten, klinischen, multizentrischen, randomisierten, doppelblinden Parallelgruppen-Studie wurde das Aprepitantbehandlungsschema mit der Standardtherapie verglichen, wobei 848 Patienten ein Chemotherapieschema erhielten, welches Oxaliplatin, Carboplatin, Epirubicin, Idarubicin, Ifosfamid, Irinotecan, Daunorubicin, Doxorubicin, Cyclophosphamid i.v. (<1500 mg/m2) oder Cytarabin i.v. (>1 g/m2) beinhaltete. 76% der Patienten, welche zum Aprepitantbehandlungschema randomisiert wurden, waren Frauen und 24% waren Männer. Die Patienten unter dem Aprepitantschema erhielten eine Chemotherapie wegen unterschiedlichen Tumorarten, wobei 52% der Patienten ein Mammakarzinom, 21% gastrointestinale Karzinomata (inkl. kolorektales Karzinom), 13% Lungenkarzinom und 6% gynäkologische Karzinomata aufwiesen. Das Aprepitantbehandlungsschema bestand aus Emend 125 mg an Tag 1 und 80 mg pro Tag an Tag 2 und 3 in Kombination mit Ondansetron 8 mg oral zweimal täglich an Tag 1 plus Dexamethason 12 mg oral an Tag 1. Die Standardtherapie beinhaltete Plazebo in Kombination mit Ondansetron 8 mg oral (zweimal täglich an Tag 1 und alle 12 Stunden an Tag 2 und 3) plus Dexamethason 20 mg oral an Tag 1.
Die antiemetische Wirksamkeit von Emend wurde während der akuten Phase (0 bis 24 Stunden nach Beginn der Chemotherapieinfusion), während der verzögerten Phase (25 bis 120 Stunden nach Beginn der Chemotherapieinfusion) und gesamthaft (0 bis 120 Stunden nach Chemotherapiebehandlung) in Zyklus 1 evaluiert. Die Wirksamkeit wurde aufgrund der folgenden primären und sekundären Endpunkte beurteilt: kein Erbrechen über die gesamte Periode (0 bis 120 Stunden nach Chemotherapie), Sicherheit und Verträglichkeit des Aprepitantbehandlungsschemas für CINE sowie vollständiges Ansprechen (definiert als kein Erbrechen und keine Anwendung von zusätzlicher antiemetischer Behandlung) über die gesamte Periode (0 bis 120 Stunden nach Chemotherapie).
Eine Zusammenfassung der wichtigsten Studienresultate zeigt Tabelle 5.
Tabelle 5
Prozentanteil Patienten mit mässig-emetogener Chemotherapie
Ansprechrate nach Behandlungsgruppe und Phase der Studie 2 – Zyklus 1
|
Endpunkte |
Aprepitant-Regimen* |
Standardtherapie** |
p-Wert‡ |
|
Primärer Endpunkt | |||
|
Kein Erbrechen | |||
|
Gesamt§ |
76 |
62 |
<0,0001 |
|
Wichtigste sekundäre Endpunkte | |||
|
Vollständiges Ansprechen¶ | |||
|
Gesamt |
69 |
56 |
0,0003 |
* Aprepitant Regimen: Emend 125 mg oral an Tag 1 und 80 mg oral an Tag 2 und 3 plus Ondansetron 8 mg oral zweimal täglich an Tag 1 plus Dexamethason 12 mg oral an Tag 1.
** Standardtherapie: Plazebo plus Ondansetron 8 mg oral (zweimal täglich an Tag 1 und alle 12 Stunden an Tag 2 und 3) plus Dexamethason 20 mg oral an Tag 1.
† N = Anzahl Patienten unter Chemotherapie, Studienmedikation und mit mindestens einer Wirksamkeitsevaluation nach Behandlung.
‡ Vorgehen nach Hochberg wurde verwendet zur Adjustierung der Multiplizität bei der Testung von sekundären Endpunkten betreffend Signifikanz.
§ Gesamt: 0 bis 120 Stunden nach Chemotherapie.
¶ Vollständiges Ansprechen = Kein Erbrechen und keine Bedarfsmedikation.
In dieser Studie hatte ein statistisch signifikant (p<0,0001) höherer Anteil an Patienten unter dem Aprepitantbehandlungsschema (76%) in Zyklus 1 kein Erbrechen (primärer Endpunkt) während der gesamten Phase verglichen mit den Patienten unter Standardtherapie (62%). Zusätzlich zeigte ein höherer Anteil an Patienten unter dem Aprepitantbehandlungsschema in Zyklus 1 ein vollständiges Ansprechen während der gesamten Phase (0 bis 120 Stunden) verglichen mit den Patienten unter Standardtherapie.
Pharmakokinetik
Absorption
Die mittlere absolute Bioverfügbarkeit von oral eingenommenem Aprepitant beträgt ca. 60-65% und die mittlere Spitzenplasmakonzentration (Cmax) von Aprepitant trat nach etwa 4 Stunden (Tmax) ein. Die orale Gabe einer Kapsel in Verbindung mit einem standardisierten Frühstück hatte keinen klinisch relevanten Einfluss auf die Bioverfügbarkeit von Aprepitant.
Die Pharmakokinetik von Aprepitant verläuft im klinischen Dosisbereich nicht linear. Bei jungen gesunden Erwachsenen wurde die AUC0-∞ zwischen der 80-mg- und der 125-mg-Einzeldosis um 26% mehr als dosisproportional vergrössert, wobei die Dosen nach einer Mahlzeit eingenommen wurden.
Nach oraler Anwendung einer 125-mg-Einzeldosis Emend an Tag 1 und 80 mg einmal täglich an Tag 2 und 3 betrug die AUC0-24h ca. 19,5 µg•hr/ml und 20,1 µg•hr/ml an Tag 1 bzw. Tag 3. Die Cmax von 1,5 µg/ml an Tag 1 und 1,4 µg/ml an Tag 3 wurde jeweils nach ca. 4 Stunden (Tmax) erreicht.
Distribution
Aprepitant ist zu mehr als 95% an Plasmaproteine gebunden. Das geometrische Mittel des scheinbaren Verteilungsvolumens (Vdss) im Steady-State beträgt beim Menschen ca. 66 l.
Aprepitant ist bei Ratten plazentagängig und überschreitet bei Ratten und Frettchen die Blut-Hirn-Schranke. Positronemissions-Tomographie-Untersuchungen am Menschen zeigen, dass Aprepitant die Blut-Hirn-Schranke passiert (siehe «Eigenschaften/Wirkungen, Wirkungsmechanismus»).
Metabolismus
Aprepitant wird weitgehend metabolisiert. Bei gesunden, jungen Erwachsenen ist Aprepitant für ca. 24% der Radioaktivität im Plasma verantwortlich, die 72 Stunden nach einer oralen Einzeldosis von 300 mg [14C]-markiertem Aprepitant gefunden wird, was auf eine starke Präsenz von Metaboliten im Plasma hinweist. Sieben nur schwach wirksame Metaboliten von Aprepitant wurden im menschlichen Plasma identifiziert. Der Metabolismus von Aprepitant verläuft zum grossen Teil über Oxidation am Morpholinring und seinen Seitenketten. In-vitro-Studien mit menschlichen Lebermikrosomen ergaben, dass Aprepitant hauptsächlich über CYP3A4, geringfügig über CYP1A2 und CYP2C19, nicht aber über CYP2D6, CYP2C9 oder CYP2E1 metabolisiert wird.
Elimination
Aprepitant wird über den Stoffwechsel ausgeschieden; es wird nicht renal elimiert. Nach Gabe einer 300-mg-Einzeldosis von [14C]-markiertem Aprepitant an gesunde Probanden wurden ca. 5% der Radioaktivität im Urin in Form von Metaboliten und 86% in den Fäzes wiedergefunden.
Die scheinbare Plasma-Clearance von Aprepitant reichte von ca. 60-84 ml/min. Die scheinbare terminale Halbwertzeit betrug ca. 9-13 Stunden.
Kinetik spezieller Patientengruppen
Ältere Patienten
Nach oraler Anwendung einer 125-mg-Einzeldosis von Emend an Tag 1 und Dosen von 80 mg einmal täglich an Tag 2-5 war die AUC0-24h von Aprepitant an Tag 1 ca. 21% und an Tag 5 ca. 36% grösser bei älteren Patienten (ab 65 Jahre) als bei jungen Erwachsenen. Die Cmax war bei älteren Patienten an Tag 1 um 10% und an Tag 5 um 24% höher als bei jungen Erwachsenen. Diesen Unterschieden wird keine klinische Bedeutung beigemessen. Daher ist für ältere Patienten keine Dosisanpassung von Emend erforderlich.
Geschlecht
Nach oraler Anwendung einer Einzeldosis von Emend sind die AUC0-24h und Cmax von Aprepitant bei Frauen um 9% bzw. 17% höher als bei Männern. Die Halbwertzeit von Aprepitant ist bei Frauen ca. 25% geringer als bei Männern und Tmax tritt ungefähr gleichzeitig ein. Diesen Unterschieden wird keine klinische Bedeutung beigemessen. Daher ist für Emend keine geschlechtsbedingte Dosisanpassung erforderlich.
Body Mass Index (BMI)
Die systemische Exposition (AUC) nimmt mit zunehmendem BMI statistisch signifikant ab. Trotz statistischer Signifikanz ist die Abnahme nur geringfügig. Klinisch relevante Auswirkungen sind wenig wahrscheinlich, so dass die Dosierung von Aprepitant nicht an den BMI angepasst werden muss.
Leberinsuffizienz
Emend wurde von Patienten mit leichter bis mässiger Leberinsuffizienz gut vertragen. Nach Einnahme einer 125-mg-Einzeldosis Emend an Tag 1 und 80 mg einmal täglich an Tag 2 und 3 war bei Patienten mit leichter Leberinsuffizienz (Child-Pugh-Score 5-6) die AUC0-24h von Aprepitant an Tag 1 um 11% und an Tag 3 um 36% geringer als bei gesunden Probanden unter derselben Dosierung. Bei Patienten mit mässiger Leberinsuffizienz (Child-Pugh-Score 7-9) war die AUC0-24h von Aprepitant an Tag 1 um 10% und an Tag 3 um 18% grösser als bei gesunden Probanden unter derselben Dosierung. Diesen Unterschieden in der AUC0-24h wird keine klinische Bedeutung beigemessen, daher ist keine Dosisanpassung von Emend für Patienten mit leichter bis mässiger Leberinsuffizienz erforderlich.
Zu Patienten mit schwerer Leberinsuffizienz (Child-Pugh-Score >9) liegen weder klinische noch pharmakokinetische Daten vor.
Niereninsuffizienz
An Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min) und Dialysepatienten mit einer Nierenerkrankung im Endstadium (ESRD) wurde eine Einzeldosis von 240 mg Emend verabreicht.
Bei Patienten mit schwerer Niereninsuffizienz sank die AUC0-∞ von Gesamt-Aprepitant (ungebunden und proteingebunden) um 21% und die Cmax um 32% im Vergleich zu gesunden Probanden. Bei Dialysepatienten mit ESRD sank die AUC0-∞ von Gesamt-Aprepitant um 42% und die Cmax um 32%. Aufgrund mässiger Verringerung der Proteinbindung von Aprepitant bei Patienten mit Nierenerkrankungen wurde die AUC der pharmakologisch aktiven ungebundenen Substanz von Patienten mit Niereninsuffizienz gegenüber gesunden Probanden nicht signifikant verändert. Eine Hämodialyse, die 4 bzw. 48 Stunden nach der Einnahme durchgeführt wurde, hatte keine signifikanten Auswirkungen auf die Pharmakokinetik von Aprepitant; weniger als 0,2% der Dosis wurden im Dialysat wiedergefunden.
Daher ist für Patienten mit schwerer Niereninsuffizienz oder Dialysepatienten mit ESRD keine Dosisanpassung erforderlich.
Präklinische Daten
Basierend auf den konventionellen Studien zur Toxizität unter Einzeldosen und zur chronischen Toxizität, Genotoxizität, zum kanzerogenen Potential und Reproduktionstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Die Kapseln sind in der Originalpackung bei Raumtemperatur (15-25 °C) aufzubewahren.
Zulassungsnummer
56359 (Swissmedic).
Packungen
Kombinationspackungen mit 1 Kapsel zu 125 mg und 2 Kapseln zu 80 mg. [B]
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern.
Stand der Information
Februar 2020.
WPC-MK0869-MF-042016-Deletion165mg/0869-CHE-2019-021412