Zusammensetzung
Wirkstoffe
Fosamprenavir (als Fosamprenavir-Calcium)
Hilfsstoffe
Tablettenkern: Mikrokristalline Cellulose, Croscarmellose-Natrium (entspricht 0.08 mg Natrium pro Tablette), Povidon (K30), Magnesiumstearat, Hochdisperses Siliciumdioxid
Filmüberzug: Hypromellose, Titandioxid (E171), Triacetin, Eisen(III)-oxid (E172)
Indikationen/Anwendungsmöglichkeiten
Telzir in Kombination mit niedrig dosiertem Ritonavir ist zur Behandlung von mit dem humanen Immundefizienz-Virus Typ 1 (HIV-1) infizierten Erwachsenen, Jugendlichen und Kindern mit einem Körpergewicht von mindestens 39 kg in Kombination mit anderen antiretroviralen Arzneimitteln angezeigt.
Bei antiretroviral mässig vorbehandelten Erwachsenen konnte nicht belegt werden, dass Telzir in Kombination mit niedrigdosiertem Ritonavir gleich wirksam ist wie die Kombination aus Lopinavir/Ritonavir. Bei Kindern und Jugendlichen wurden keine Vergleichsstudien durchgeführt.
Bei stark vorbehandelten Patienten ist die Anwendung von Telzir in Kombination mit niedrig dosiertem Ritonavir nicht ausreichend untersucht.
Bei mit Proteasehemmern (PI) vorbehandelten Patienten sollte die Wahl von Telzir unter Berücksichtigung des individuellen viralen Resistenzmusters und der Vorbehandlung des Patienten erfolgen (vgl. «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
|
Telzir darf nur zusammen mit niedrig dosiertem Ritonavir zur pharmakokinetischen Boosterung von Amprenavir und in Kombination mit anderen antiretroviralen Arzneimitteln gegeben werden. Daher muss die Fachinformation zu Ritonavir vor Beginn der Behandlung mit Telzir herangezogen werden. |
Die Therapie sollte von einem Arzt eingeleitet werden, der Erfahrung in der Behandlung der HIV-Infektion besitzt.
Telzir (Fosamprenavir) ist eine Vorstufe von Amprenavir und darf nicht gleichzeitig mit anderen Amprenavir enthaltenden Arzneimitteln gegeben werden.
Allen Patienten sollte verdeutlicht werden, wie wichtig die vollständige Befolgung des empfohlenen Dosierungsplans ist.
Überschreitungen der unten beschriebenen Dosierungen von Fosamprenavir mit Ritonavir werden nicht empfohlen (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Telzir wird oral verabreicht. Telzir Filmtabletten mit Ritonavir können mit oder unabhängig von den Mahlzeiten eingenommen werden.
Übliche Dosierung
Erwachsene (ab 18 Jahre)
Für antiretroviral vorbehandelte und nicht vorbehandelte Patienten beträgt die empfohlene Dosierung in Kombination mit anderen antiretroviralen Substanzen:
700 mg (1 Tablette) Telzir 2x täglich zusammen mit 100 mg Ritonavir (Norvir) 2x täglich.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit mittel- und schwergradiger Leberinsuffizienz dürfen Telzir Tabletten nicht eingesetzt werden, da die notwendige Dosisreduktion mit der Tablettenform nicht erreicht werden kann.
Leichtgradige Leberfunktionsstörung (Child Pugh-Score 5-6):
2mal täglich 700mg Telzir
1mal täglich 100mg Ritonavir
Auch mit dieser Dosisanpassung für Erwachsene mit eingeschränkter Leberfunktion können bei einzelnen Patienten, bedingt durch die bei diesen Patienten erhöhte Inter-Patienten Variabilität der Pharmakokinetik von Amprenavir und Ritonavir, niedrigere oder höhere Amprenavir- und Ritonavir-Plasmakonzentrationen als erwartet auftreten. Es sollten daher vor Therapiebeginn und in periodischen Abständen während der Therapie geeignete Leberfunktionstests durchgeführt werden.
Patienten mit Nierenfunktionsstörungen
Eine initiale Dosisanpassung wird bei Patienten mit eingeschränkter Nierenfunktion nicht für notwendig erachtet (vgl. «Pharmakokinetik»).
Ältere Patienten (über 65 Jahre)
Die Pharmakokinetik von Fosamprenavir wurde in dieser Patientengruppe nicht untersucht (vgl. «Pharmakokinetik»).
Kinder und Jugendliche (mit einem Körpergewicht ≥39 kg)
Kindern und Jugendlichen kann die Erwachsenendosierung verabreicht werden, wenn ihr Körpergewicht mindestens 39 kg beträgt und sie eine Tablette im Ganzen schlucken können (vgl. «Pharmakokinetik»). 100 mg Ritonavir Kapseln können Kindern und Jugendlichen verabreicht werden, wenn ihr Körpergewicht mindestens 33 kg beträgt und sie eine Kapsel im Ganzen schlucken können.
Kontraindikationen
Überempfindlichkeit gegen Fosamprenavir, Amprenavir oder einen der sonstigen Bestandteile von Telzir, oder gegen Ritonavir.
Telzir darf nicht gleichzeitig mit Arzneimitteln gegeben werden, die eine geringe therapeutische Breite besitzen und ausserdem Substrate des Cytochrom P450-Isoenzyms 3A4 (CYP3A4) sind. Bei gleichzeitiger Verabreichung kann es zu einer kompetitiven Hemmung des Metabolismus dieser Arzneimittel mit der Gefahr schwerwiegender und/oder lebensbedrohlicher unerwünschter Ereignisse kommen. Dabei handelt es sich um Herzrhythmusstörungen (z.B. mit Terfenadin, Astemizol, Amiodaron, Bepridil, Chinidin, Cisaprid, Pimozid), Hypotension (z.B. mit dem α-Blocker Alfuzosin), anhaltende Sedierung oder Atemdepression (z.B. mit Triazolam, Midazolam, Quetiapin) oder periphere Gefässkrämpfe oder Ischämie (z.B. mit Ergotaminderivaten) (vgl. „Interaktionen“).
Telzir darf nicht gleichzeitig mit Sildenafil, wenn Sildenafil zur Behandlung einer pulmonalen arteriellen Hypertonie eingesetzt wird, verabreicht werden (zur gleichzeitigen Anwendung von Fosamprenavir und Sildenafil bei Patienten mit erektiler Dysfunktion, siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»). Es besteht ein erhöhtes Risiko für Sildenafil-assoziierte schwere unerwünschte Wirkungen.
Telzir mit Ritonavir darf nicht gleichzeitig mit Arzneimitteln gegeben werden, die eine geringe therapeutische Breite besitzen und ausserdem über CYP2D6 metabolisiert werden, wie z.B. Flecainid und Propafenon (vgl. «Interaktionen»).
Telzir mit Ritonavir darf nicht gleichzeitig mit dem antipsychotischen Arzneimittel Lurasidon verabreicht werden (vgl. «Interaktionen»).
Rifampicin darf nicht zusammen mit Telzir gegeben werden (vgl. «Interaktionen»).
Pflanzliche Zubereitungen, die Johanniskraut (Hypericum perforatum) enthalten, dürfen aufgrund des Risikos reduzierter Plasmakonzentrationen und einer verminderten therapeutischen Wirkung von Amprenavir während der Einnahme von Telzir nicht angewendet werden (vgl. «Interaktionen»).
Telzir mit Ritonavir darf nicht mit den HMG-CoA-Reduktaseinhibitoren Simvastatin und Lovastatin kombiniert werden, da diese bezüglich Metabolismus vom Cytochrom 3A4 stark abhängig sind. Die gleichzeitige Verabreichung von Telzir mit Ritonavir kann zu erhöhten Konzentrationen der HMG-CoA-Reduktaseinhibitoren führen und dadurch eine Rhabdomyolyse verursachen. Atorvastatin darf nicht in höheren Dosen als 20 mg gegeben werden (vgl. «Interaktionen»).
Warnhinweise und Vorsichtsmassnahmen
Die Ergebnisse von Beobachtungsstudien haben gezeigt, dass kein Risiko der sexuellen Übertragung von HIV besteht, wenn eine virale Suppression erreicht und aufrechterhalten wird. Allerdings kann das Risiko einer sexuellen Übertragung von HIV nicht ausgeschlossen werden, wenn die verordnete ART nicht regelmässig eingenommen wird und/oder die virale Suppression nicht erreicht und aufrechterhalten wird.
Fosamprenavir enthält eine Sulfonamid-Gruppe. Das Potenzial für eine Kreuzallergie zwischen Arzneimitteln der Sulfonamidklasse und Fosamprenavir ist nicht bekannt. In den Zulassungsstudien mit Telzir wurden nach Gabe von Fosamprenavir mit Ritonavir keine Hinweise auf ein erhöhtes Risiko von Hautausschlägen bei Patienten mit einer Sulfonamidallergie in der Vorgeschichte gefunden im Vergleich zu den Patienten ohne Sulfonamidallergie. Dennoch sollte Telzir bei Patienten mit bekannter Sulfonamidallergie mit Vorsicht angewendet werden.
Die gemeinsame Anwendung von Telzir mit Ritonavir in höheren Dosierungen als zugelassen führte bei einigen Personen zu erhöhten Transaminasewerten und wird nicht empfohlen.
Lebererkrankungen:
Telzir Tabletten in Kombination mit Ritonavir sollte bei Erwachsenen mit leichter Leberfunktionsstörung mit Vorsicht und in geringerer Dosierung angewendet werden. Bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung dürfen Telzir Tabletten nicht angewendet werden (s. «Dosierung / Anwendung»). Patienten, die an chronischer Hepatitis B oder C leiden und mit einer antiretroviralen Kombinationstherapie behandelt werden, haben ein erhöhtes Risiko für schwere hepatische Nebenwirkungen mit potenziell tödlichem Verlauf. Für den Fall einer gleichzeitigen antiviralen Behandlung der Hepatitis B oder C lesen Sie bitte die betreffenden Fachinformationen dieser Arzneimittel.
Patienten mit vorbestehender eingeschränkter Leberfunktion einschliesslich einer chronisch-aktiven Hepatitis haben eine erhöhte Häufigkeit von Leberfunktionsstörungen unter einer antiretroviralen Kombinationstherapie und sollten entsprechend der klinischen Praxis überwacht werden. Bei Anzeichen einer Verschlechterung der Lebererkrankung bei solchen Patienten muss eine Unterbrechung oder ein Abbruch der Behandlung in Betracht gezogen werden
Interaktionen mit anderen Substanzen:
Die gleichzeitige Verabreichung von Fosamprenavir mit/ohne Ritonavir mit anderen durch CYP3A metabolisierten Antineoplastika (z.B. Dasatinib, Nilotinib, Ibrutinib, Vinblastin und Everolimus) kann die Konzentrationen dieser Arzneimittel erhöhen und das Risiko von unerwünschten Ereignissen, die normalerweise mit diesen Wirkstoffen verbunden sind, erhöhen.
Bitte beachten Sie die entsprechenden Fachinformationen zu diesen Arzneimitteln (vgl. «Interaktionen»).
Die gleichzeitige Anwendung von Telzir mit Halofantrin oder (systemisch gegebenem) Lidocain wird nicht empfohlen (vgl. «Interaktionen»).
Direkt wirkende antivirale Mittel gegen das Hepatitis-C-Virus (HCV): Wenn direkt wirkende antivirale Mittel (direct acting antiviral drugs, DAA) gegen das Hepatitis-C-Virus, die durch CYP3A4 metabolisiert werden oder CYP3A4-induzierende oder -inhibierende Eigenschaften besitzen, gleichzeitig mit Fosamprenavir mit/ohne Ritonavir verabreicht werden, ist aufgrund der Hemmung bzw. Induktion der CYP3A4-Aktivität mit einer Veränderung der Plasmakonzentration zu rechnen. Mögliche Folgen solcher Wechselwirkungen sind:
·Klinisch relevante unerwünschte Wirkungen aufgrund der höheren Exposition gegenüber Fosamprenavir/Ritonavir oder der Begleitmedikation.
·Verlust der therapeutischen Wirkung von Fosamprenavir/Ritonavir oder der Begleitmedikation und mögliche Resistenzentwicklung.
Aufgrund der möglichen Interaktionen wird daher die gleichzeitige Verabreichung von Fosamprenavir mit/ohne Ritonavir mit über CYP3A4 metabolisierten oder CYP3A4-induzierenden/-inhibierenden HCV-DAA (z.B. Telaprevir, Boceprevir, Simeprevir, Paritaprevir) nicht empfohlen. Bei gleichzeitiger Behandlung mit einem HCV-DAA bei Hepatitis C konsultieren Sie bitte die Fachinformation des entsprechenden Arzneimittels.
Die gleichzeitige Anwendung von Telzir mit PDE5-Inhibitoren (z.B. Sildenafil und Vardenafil) bei Patienten mit erektiler Dysfunktion wird nicht empfohlen (vgl. «Interaktionen»).
Amprenavir wird vor allem über das Cytochrom 3A4 (CYP3A4) metabolisiert. Die gleichzeitige Verabreichung von Fosamprenavir mit Ritonavir und anderen Arzneimitteln, die als Induktoren des CYP3A4 bekannt sind, wird nicht empfohlen, weil ein Therapieversagen und eine beschleunigte Resistenzentwicklung möglich sind. Dazu zählen insbesondere Carbamazepin, Phenobarbital, Primidon und Topiramat (vgl. auch «Kontraindikationen»). Es wurden weder pharmakokinetische noch klinische Studien mit diesen CYP3A4-Induktioren durchgeführt. Phenytoin sollte mit Vorsicht angewendet werden (vgl. «Interaktionen»). Die gleichzeitige Anwendung von Telzir und Ritonavir mit Fluticason oder anderen Glukokortikoiden, die über CYP3A4 verstoffwechselt werden, wird nicht empfohlen, es sei denn, der mögliche Nutzen einer Behandlung überwiegt das Risiko systemischer kortikosteroider Wirkungen einschliesslich Morbus Cushing und Suppression der Nebennierenfunktion (vgl. «Interaktionen»).
Eine Verringerung der Dosierung von Rifabutin um mindestens 75 % wird bei gleichzeitiger Anwendung von Telzir mit Ritonavir empfohlen. Weitere Dosisreduktionen können erforderlich sein (vgl. «Interaktionen»).
In einer Studie wurden bei der gleichzeitigen Verabreichung von Fosamprenavir/Ritonavir und einem oral verabreichten Verhütungsmittel bei 22% (7/32) der gesunden Probandinnen klinisch signifikant erhöhte Transaminasespiegel beobachtet. Weiter waren die Hormonspiegel vermindert, und daher wird Frauen im gebärfähigen Alter der Einsatz von alternativen, nicht-hormonellen Verhütungsmethoden (Kondome) empfohlen (vgl. «Interaktionen»).
Für die gleichzeitige Verabreichung von Fosamprenavir und Ritonavir mit Östrogenen und/oder Progestogenen zur Hormonersatztherapie liegen keine Angaben vor. Die Wirksamkeit und Sicherheit dieser Therapien bei gleichzeitiger Gabe von Fosamprenavir und Ritonavir ist nicht belegt.
Eine Überwachung der therapeutischen Konzentrationen immunsuppressiv wirkender Arzneimittel (Cyclosporin, Tacrolimus, Rapamycin) wird bei gleichzeitiger Gabe von Telzir empfohlen (vgl. «Interaktionen»).
Eine Überwachung der therapeutischen Konzentrationen trizyklischer Antidepressiva (z.B. Desipramin und Nortryptilin) wird bei gleichzeitiger Gabe von Telzir empfohlen (vgl. «Interaktionen»).
Wenn Methadon zusammen mit Telzir gegeben wird, sollten die Patienten engmaschig auf Opiatentzugssymptome überwacht werden (vgl. «Interaktionen»).
Wenn orale Antikoagulantien zusammen mit Telzir gegeben werden, wird eine verstärkte Kontrolle der INR (International Normalised Ratio) empfohlen (vgl. «Interaktionen»).
Magensäurereduzierende Arzneimittel (Antazida, H2-Blocker und PPI) führen zu unterschiedlich starker Verminderung der Resorption von Fosamprenavir. Die Datenlage favorisiert die Anwendung von Esomeprazol (siehe «Interaktionen»).
Hautausschläge/ Hautreaktionen:
Die meisten Patienten mit leichtem oder mittelschwerem Hautausschlag können die Einnahme von Telzir fortsetzen. Geeignete Antihistaminika (z.B. Cetirizin dihydrochlorid) können den Juckreiz lindern und das Abklingen des Hautausschlages beschleunigen. Über schwere und lebensbedrohliche Hautreaktionen einschliesslich des Stevens-Johnson-Syndroms wurde bei weniger als 1 % der Patienten im klinischen Entwicklungsprogramm berichtet. Im Falle von schweren Hautausschlägen oder von Hautausschlägen mittlerer Intensität mit systemischen oder die Schleimhaut betreffenden Symptomen muss Telzir dauerhaft abgesetzt werden (vgl. «Unerwünschte Wirkungen»).
Hämophilie-Patienten:
Bei hämophilen Patienten (Typ A und B), die mit Proteasehemmern (PI) behandelt wurden, liegen Berichte über eine Zunahme von Blutungen einschliesslich spontaner kutaner Hämatome und Hämarthrosen vor. Bei einigen Patienten war die Gabe von Faktor VIII erforderlich. In über der Hälfte dieser Fälle wurde die Behandlung mit Proteasehemmern fortgesetzt bzw. nach Abbruch wieder aufgenommen. Ein kausaler Zusammenhang wird vermutet, der Wirkmechanismus ist allerdings nicht geklärt. Hämophile Patienten sollten daher auf die Möglichkeit einer Zunahme von Blutungen aufmerksam gemacht werden.
Hyperglykämie:
Bei Patienten, die eine antiretrovirale Therapie einschliesslich Proteasehemmer erhielten, wurde über das Auftreten von Diabetes mellitus, Hyperglykämie oder eine Exazerbation eines bestehenden Diabetes mellitus berichtet. Bei einigen dieser Patienten war die Hyperglykämie schwerwiegend und in einigen Fällen zusätzlich mit einer Ketoazidose verbunden. Viele der Patienten hatten andere Erkrankungen, zu deren Therapie Arzneimittel erforderlich waren, die mit der Entwicklung eines Diabetes mellitus oder einer Hyperglykämie in Verbindung gebracht werden.
Lipohypertrophie
Die antiretrovirale Kombinationstherapie, einschliesslich Regimes mit einem Proteasehemmer, kann mit einer Erhöhung des Körperfetts bei einigen HIV-Patienten assoziiert sein. Ein kausaler Zusammenhang ist nicht etabliert worden.
Lipiderhöhungen:
Die Behandlung mit Fosamprenavir mit Ritonavir führte zu erhöhten Triglycerid- und Cholesterinspiegeln. Vor Beginn sowie in regelmässigen Abständen während der Therapie mit Telzir sollten daher die Triglycerid- und Cholesterinspiegel bestimmt werden. Lipidstörungen sollten symptomatisch behandelt werden.
Immun-Reaktivierungs-Syndrom:
Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer antiretroviralen Kombinationstherapie (ART) eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen entwickeln, die zu schweren klinischen Zuständen oder Verschlechterung von Symptomen führt. Typischerweise wurden solche Reaktionen innerhalb der ersten Wochen oder Monate nach Beginn der ART beobachtet. Entsprechende Beispiele sind CMV-Retinitis, disseminierte und/oder lokalisierte mykobakterielle Infektionen und Pneumocystis jiroveci (P. carinii) Pneumonie. Jedes Entzündungssymptom ist zu bewerten; falls notwendig ist eine Behandlung einzuleiten.
Über das Auftreten von Autoimmunerkrankungen (wie z.B. Morbus Basedow, Polymyositis und Guillain-Barré Syndrom) ist im Rahmen einer Immun-Reaktivierung berichtet worden, jedoch ist die Zeit bis zum Einsetzen der Symptome variabler. Diese können viele Monate nach Behandlungsbeginn auftreten und sich manchmal atypisch manifestieren.
Osteonekrose:
Obwohl eine multifaktorielle Ätiologie angenommen wird (darunter Anwendung von Kortikosteroiden, Alkoholkonsum, schwere Immunsuppression, höherer Body-Mass-Index), wurden Fälle von Osteonekrose insbesondere bei Patienten mit fortgeschrittener HIV-Erkrankung und/oder Langzeitanwendung einer antiretroviralen Kombinationstherapie (ART) berichtet. Die Patienten sind darauf hinzuweisen, bei Auftreten von Gelenkbeschwerden und -schmerzen, Gelenksteife oder Schwierigkeiten bei Bewegungen den Arzt aufzusuchen.
Natrium:
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
Interaktionen
|
Wenn Fosamprenavir und Ritonavir zusammen gegeben werden, kann das Wechselwirkungsprofil von Ritonavir überwiegen, da Ritonavir der stärkere CYP3A4-Inhibitor ist. Vor Beginn einer Behandlung mit Telzir mit Ritonavir muss daher die gesamte Fachinformation zu Ritonavir zu Rate gezogen werden. Ritonavir hemmt ferner CYP2D6, allerdings in einem geringeren Umfang als CYP3A4. Ritonavir induziert CYP3A4, CYP1A2, CYP2C9 und die Glucuronyl-Transferase. |
Nachfolgend sind Beispiele für Substrate, Inhibitoren oder Induktoren von CYP3A4 aufgeführt, bei deren gleichzeitiger Verabreichung mit Fosamprenavir es zu Wechselwirkungen kommen könnte. Diese Liste erhebt keinen Anspruch auf Vollständigkeit. In manchen Fällen ist die klinische Relevanz der möglichen Interaktionen nicht bekannt bzw. nicht untersucht. Die Patienten sind daher bei der Kombination mit Fosamprenavir auf die mit diesen Arzneimitteln assoziierten Toxizitätserscheinungen hin zu überwachen.
Kontraindizierte Kombinationen (vgl. «Kontraindikationen»):
- CYP3A4-Substrate mit geringer therapeutischer Breite:
Telzir darf nicht gleichzeitig mit Arzneimitteln gegeben werden, die eine geringe therapeutische Breite besitzen und ausserdem Substrate des Cytochrom P450-Isoenzyms 3A4 (CYP3A4) darstellen. Die gleichzeitige Gabe kann zu einer kompetitiven Hemmung der Metabolisierung dieser Substanzen führen, dadurch deren Plasmaspiegel erhöhen und möglicherweise schwerwiegende und/oder lebensbedrohliche Nebenwirkungen hervorrufen wie Herzrhythmusstörungen (z.B. Amiodaron, Astemizol, Bepridil, Cisaprid, Pimozid, Chinidin, Terfenadin), Hypotension (z.B. mit dem α-Blocker Alfuzosin), anhaltende Sedierung oder Atemdepression (z.B. Midazolam, Triazolam, Quetiapin) sowie periphere Vasospasmen oder Ischämie (z.B. Ergotamin, Dihydroergotamin).
Telzir darf nicht gleichzeitig mit Sildenafil, wenn Sildenafil zur Behandlung einer pulmonalen arteriellen Hypertonie eingesetzt wird, verabreicht werden (zur gleichzeitigen Anwendung von Fosamprenavir und Sildenafil bei Patienten mit erektiler Dysfunktion, siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»). Es besteht ein erhöhtes Risiko für Sildenafil-assoziierte schwere unerwünschte Wirkungen (s. «Kontraindikationen»).
- CYP2D6-Substrate mit geringer therapeutischer Breite
Telzir mit Ritonavir darf nicht zusammen mit Arzneimitteln gegeben werden, deren wirksame Bestandteile vorwiegend über CYP2D6 metabolisiert werden und für die erhöhte Plasmaspiegel mit schwerwiegenden und/oder lebensbedrohlichen Nebenwirkungen verbunden sind. Zu diesen wirksamen Bestandteilen gehören Flecainid und Propafenon.
- Rifampicin
Rifampicin ist ein starker CYP3A4-Induktor. Es wurde gezeigt, dass Rifampicin eine 82%-ige Verringerung der AUC von Amprenavir verursacht, die zu einem virologischen Versagen und zu einer Resistenzentwicklung führen kann. Bei dem Versuch, die erniedrigten Plasmaspiegel durch eine Dosiserhöhung anderer Protease-Inhibitoren in Kombination mit Ritonavir auszugleichen, wurden sehr häufig unerwünschte Wirkungen an der Leber beobachtet. Die kombinierte Anwendung von Rifampicin zusammen mit Telzir und niedrig dosiertem Ritonavir ist kontraindiziert (vgl. «Kontraindikationen»).
- Johanniskraut (Hypericum perforatum)
Die Serumspiegel von Amprenavir und Ritonavir können durch die gleichzeitige Anwendung von pflanzlichen Zubereitungen mit Johanniskraut (Hypericum perforatum) erniedrigt werden. Der Grund hierfür liegt in der Induktion metabolisierender Enzyme durch Johanniskraut. Pflanzliche Zubereitungen, die Johanniskraut enthalten, dürfen daher nicht mit Telzir mit Ritonavir kombiniert werden. Wenn ein Patient bereits Johanniskraut einnimmt, sind die Amprenavir- und Ritonavirspiegel und, wenn möglich, die Viruslast zu überprüfen und das Johanniskraut abzusetzen. Die Amprenavir- und Ritonavirspiegel könnten durch das Absetzen von Johanniskraut ansteigen. Die induzierende Wirkung von Johanniskraut kann bis zu mindestens 2 Wochen nach Absetzen anhalten.
- HMG-CoA-Reduktaseinhibitoren
Telzir mit Ritonavir darf nicht mit den HMG-CoA-Reduktaseinhibitoren Simvastatin und Lovastatin kombiniert werden, da diese bezüglich Metabolismus vom Cytochrom 3A4 stark abhängig sind. Die gleichzeitige Verabreichung von Telzir mit Ritonavir kann zu erhöhten Konzentrationen der HMG-CoA-Reduktaseinhibitoren führen und dadurch eine Rhabdomyolyse verursachen. Atorvastatin darf nicht in höheren Dosen als 20 mg gegeben werden.
Wirkung von Telzir auf andere Arzneimittel
Antiretrovirale Arzneimittel:
- Nicht-nukleosidanaloge Reverse-Transkriptase-Hemmer
Efavirenz: Es gibt keine klinisch relevante Interaktion, wenn 700 mg Fosamprenavir zusammen mit 100 mg Ritonavir 2x täglich gleichzeitig mit Efavirenz (600 mg 1x täglich) angewendet werden.
Nevirapin: Wurde Fosamprenavir 700 mg mit Ritonavir 100 mg 2x täglich zusammen mit 200 mg Nevirapin verabreicht, verringerten sich die AUC und Cmin Werte von Amprenavir um 11 % resp. 19 %, während Cmax unverändert blieb. AUC, Cmax und Cmin von Nevirapin waren um 14 %, 13 % resp. 22 % erhöht. Eine Dosisanpassung ist bei der kombinierten Gabe von Fosamprenavir 700 mg / Ritonavir 100 mg 2x täglich zusammen mit Nevirapin nicht notwendig.
- Nukleosid-/Nukleotidanaloge Reverse-Transkriptase-Hemmer
Interaktionsstudien mit Abacavir, Lamivudin und Zidovudin wurden mit Amprenavir ohne Zusatz von Ritonavir durchgeführt. Auf der Basis von Daten aus diesen Studien und da kein signifikanter Einfluss von Ritonavir auf die Pharmakokinetik von NRTI zu erwarten ist, wird durch die gleichzeitige Gabe von Fosamprenavir mit Ritonavir mit diesen Arzneimitteln keine signifikante Veränderung der Exposition der gleichzeitig angewendeten wirksamen Bestandteile erwartet.
Didanosin: Es wurden keine Interaktionsstudien mit Videx® EC Kapseln durchgeführt. Die Kapseln enthalten keinen Puffer; eine signifikante Interaktion bei der gleichzeitigen Anwendung mit Telzir wird daher nicht erwartet.
Tenofovir: Zu diesem Zeitpunkt können keine Empfehlungen zur gleichzeitigen Anwendung von Fosamprenavir mit Ritonavir und Tenofovir gegeben werden.
- Proteasehemmer:
Lopinavir / Ritonavir: Eine Dosierungsempfehlung für die gleichzeitige Anwendung von Telzir mit Ritonavir und Lopinavir/Ritonavir kann nicht gegeben werden, es wird jedoch eine engmaschige Überwachung empfohlen, da die Sicherheit und Wirksamkeit dieser Kombination nicht bekannt ist. Cmax, AUC und Cmin von Lopinavir waren um 30 %, 37 % bzw. 52 % erhöht, wenn 400 mg Lopinavir mit 100 mg Ritonavir 2x täglich in Kombination mit 700 mg Fosamprenavir und 100 mg Ritonavir 2x täglich über zwei Wochen gegeben wurde. Cmax, AUC und Cmin von Amprenavir waren um 58 %, 63 % bzw. 65 % verringert.
Wenn 533 mg Lopinavir mit 133 mg Ritonavir in Kombination mit 1400 mg Fosamprenavir 2x täglich über zwei Wochen gegeben wurde, blieben Cmax, AUC und Cmin von Lopinavir im Vergleich zu den Werten nach Gabe von 400 mg Lopinavir mit 100 mg Ritonavir 2x täglich unverändert. AUC und Cmin von Amprenavir waren jedoch um 26 % bzw. 42 % verringert; die Cmax war hingegen im Vergleich zu den Werten nach Gabe von 700 mg Fosamprenavir zusammen mit 100 mg Ritonavir 2x täglich nicht signifikant verändert.
Tipranavir / Ritonavir: Interaktionsstudien zu Fosamprenavir und Tipranavir wurden bislang nicht durchgeführt. Allerdings waren Cmax, AUC und Cmin Plasmaspiegel von Amprenavir um 39%, 44% resp. 55% vermindert, wenn Tipranavir/Ritonavir (600 mg/100 mg zweimal täglich) während zwei Wochen zusammen mit Amprenavir/Ritonavir (500 mg/100 mg zweimal täglich) verabreicht wurde. Cmax, AUC und Cmin von Tipranavir blieben unverändert. Zur gemeinsamen Gabe von Fosamprenavir/Ritonavir und Tipranavir/Ritonavir kann keine Dosierungsempfehlung gegeben werden. Deshalb wird die Kombination von Fosamprenavir mit Tipranavir/Ritonavir nicht empfohlen.
Es wurden keine Interaktionsstudien zwischen Fosamprenavir in Kombination mit Ritonavir und den folgenden Proteasehemmern durchgeführt: Indinavir, Saquinavir, Nelfinavir und Atazanavir.
- Integrase-Inhibitoren:
Raltegravir: Nach Koadministration von Fosamprenavir/Ritonavir 700/100 mg 2x täglich und Raltegravir 400 mg 2x täglich wurde eine Reduktion der Amprenavir Cmin um 19 – 33% und der Raltegravir Cmin um 36 – 54% beobachtet. Die klinische Signifikanz dieser Reduktionen ist unbekannt.
Dolutegravir: Nach Koadministration von Fosamprenavir/Ritonavir 700/100 mg 2x täglich und Dolutegravir 50 mg 1x täglich war die Amprenavir Pharmakokinetik unverändert. Die Dolutegravir AUC(0-t), Cmax und Cτ waren um 35%, 24% resp. 49% reduziert bei Kombination mit Fosamprenavir/Ritonavir. Es wird keine Dosisanpassung von Fosamprenavir oder Dolutegravir empfohlen basierend auf den Daten zur Beziehungen zwischen Exposition und klinischem Ansprechen. Vorsicht ist geboten und klinisches Monitoring ist empfohlen, wenn diese Kombination bei Integrase-Inhibitor-resistenten Patienten gegeben wird.
- HCV Medikamente:
Telaprevir: Koadministration von Fosamprenavir mit Ritonavir und Telaprevir führt zu einer reduzierten steady State-Exposition gegenüber Amprenavir und Telaprevir. Der Mechanismus dieser Interaktion ist unbekannt. Die gleichzeitige Verwendung von Fosamprenavir mit Ritonavir und Telaprevir wird nicht empfohlen.
- CCR5-Rezeptor-Antagonisten:
Maraviroc: Mangels zuverlässiger Erfahrung wird die gleichzeitige Verwendung von Fosamprenavir mit Ritonavir und Maraviroc nicht empfohlen.
Antibiotika / Antimykotika:
Clarithromycin: Eine Erhöhung der Clarithromycin-Spiegel ist bei gleichzeitiger Anwendung von Telzir / Ritonavir und Clarithromycin zu erwarten. Diese Interaktion wurde jedoch nicht untersucht. Es können keine Dosisanpassungen empfohlen werden, die sicherstellen, dass die gleichzeitige Anwendung sowohl ausreichend wirksam als auch sicher ist.
Erythromycin: Es wurde keine pharmakokinetische Studie mit Fosamprenavir mit Ritonavir in Kombination mit Erythromycin durchgeführt, jedoch könnten die Plasmaspiegel beider Arzneimittel im Fall der gleichzeitigen Gabe erhöht sein.
Ketoconazol / Itraconazol: Die gleichzeitige Anwendung von Fosamprenavir 700 mg mit Ritonavir 100 mg zweimal täglich zusammen mit Ketoconazol 200 mg einmal täglich erhöhte die Plasmakonzentrationen Cmax von Ketoconazol um 25 % und erhöhte die AUC (0-τ) auf das 2,69-fache der Werte, die unter der einmal täglichen Gabe von 200 mg Ketoconazol alleine beobachtet werden. Cmax, AUC und Cmin von Amprenavir blieben unverändert. In Kombination mit Telzir und Ritonavir werden hohe Dosen (>200mg/Tag) von Ketoconazol oder Itraconazol nicht empfohlen.
Rifabutin: Die gleichzeitige Gabe von Amprenavir und Rifabutin (300 mg 1x täglich) führte zu einem Anstieg der Plasmakonzentration (AUC) von Rifabutin um 200 %. Die AUC0-48 von Rifabutin war nach gleichzeitiger Gabe von reduzierten Rifabutin-Dosen (150 mg alle zwei Tage) und Fosamprenavir (700 mg zweimal täglich) mit Ritonavir (100 mg zweimal täglich) unverändert, Cmax war um 14 % verringert. Allerdings waren AUC0-48 und Cmax von 25-O-Desacetylrifabutin um das 11- beziehungsweise 6fache erhöht, was möglicherweise zu einem Anstieg der mit Rifabutin verbundenen Nebenwirkungen, insbesondere Uveitis, führen kann. Basierend auf einem historischen Vergleich scheint Rifabutin die Aufnahme von Amprenavir nicht zu reduzieren (AUC-Anstieg 1.35-fach, Cmax-Anstieg 1.36-fach, Cmin-Anstieg 1.17-fach). Auf Basis dieser Daten wird eine Verringerung der Standarddosierung von Rifabutin um 75 % (d.h. 150 mg alle zwei Tage) empfohlen, wenn Telzir mit Ritonavir eingenommen wird. Weitere Dosisreduktionen können erforderlich sein.
Wirkung anderer Arzneimittel auf Telzir
- Arzneimittel, die bei gemeinsamer Anwendung mit Telzir die Plasmaspiegel von Amprenavir verringern können:
Magensäurereduzierende Arzneimittel (Antazida, H2-Blocker, PPI): Die Resorption des Prodrugs Fosamprenavir war in präklinischen und klinischen Versuchen säureabhängig. Durch die gleichzeitige Gabe einer Einzeldosis von 1400 mg Fosamprenavir zusammen mit einer Einzeldosis von 30 ml Suspension eines Antazidums (entspr. 2,75 g Aluminiumhydroxid und 1,8 g Magnesiumhydroxid) wurden die AUC und die Cmax von Amprenavir um 18% bzw. 35% verringert, während die Cmin (C 12 h) vergleichbar war. «Multiple Dose»-Studien mit Antazida liegen nicht vor.
Die Anwendung von Telzir mit magensäurereduzierenden Arzneimitteln kann infolge eines erhöhten gastrischen pH-Wertes zu reduzierten Plasmakonzentrationen von Fosamprenavir führen. Telzir sollte nicht gleichzeitig mit diesen Arzneimitteln, sondern 2 Std. vor oder 1 Std. nach diesen Arzneimitteln eingenommen werden.
Eine Einzeldosis von 300 mg Ranitidin, 1 h vor einer Einzeldosis von 1400 mg Fosamprenavir verabreicht, verringerte die AUC von Amprenavir im Plasma um 30% und die Cmax um 51%.
Die steady State-Pharmakokinetik von Esomeprazol wurde nach einer multiple Dose-Gabe von 20 mg Esomeprazol 1x/Tag, gleichzeitig verabreicht mit der morgendlichen Dosis von Fosamprenavir 700 mg / Ritonavir 100 mg 2x/Tag, nicht beeinflusst. Die Gabe von Esomeprazol 20 mg 1x/Tag, koadministriert mit Fosamprenavir 700 mg/Ritonavir 100 mg 2x/Tag, führte im Plasma zu einem signifikanten Abfall der AUC von Amprenavir auf 90.7% (84.3-97.7%). Die Cmax von Amprenavir sank nicht signifikant auf 95.3% (86.4 - 105%) und die Cmin nicht signifikant auf 92.7% (84.5 - 102%) (Referenz-Behandlung: alleinige Gabe von Fosamprenavir 700 mg/Ritonavir 100 mg 2x/Tag).
Aufgrund dieser Datenlage dürfen magensäurehemmende Arzneimittel nur vorsichtig und bei begründeter Indikation zusammen mit Fosamprenavir verabreicht werden. Die Daten favorisieren die Verwendung von Esomeprazol in der Standarddosierung anstelle von H2-Blockern oder Antazida. Bei Patienten mit länger dauernder magensäurehemmender Behandlung mit Esomeprazol muss der Erfolg der anti-HIV-Therapie mit Fosamprenavir mit geeigneten Methoden (z.B. PCR der HIV-RNA) engmaschig überprüft werden.
Antikonvulsiva:
Phenytoin: Bei gleichzeitiger Anwendung von Fosamprenavir (700 mg 2x täglich) und Ritonavir (100 mg 2x täglich) mit Phenytoin (300 mg 1x täglich) waren die AUC resp. Cmin von Amprenavir um 20% resp. 19% erhöht bei unveränderter Cmax. Durch Phenytoin wurde die AUC von Ritonavir um 29% vermindert. Die Cmax von Ritonavir sank um 27% und die Cmin wurde um 36% reduziert. Die AUC, Cmax und Cmin von Phenytoin waren um 22%, 20% bzw. 29% verringert. Wenn Fosamprenavir/Ritonavir in Kombination mit Phenytoin gegeben wird, ist daher keine Anpassung der Fosamprenavir/Ritonavir Dosierung notwendig. Es wird jedoch empfohlen, die Phenytoin Plasmakonzentrationen zu überwachen und die Phenytoin-Dosis soweit erforderlich zu erhöhen.
Die gleichzeitige Anwendung von anderen Antikonvulsiva, die Enzyminduktoren sind (Phenobarbital, Primidon, Carbamazepin und Topiramat), mit Fosamprenavir wurde nicht untersucht, kann aber zu einer Erniedrigung der Plasmaspiegel von Amprenavir führen. Bei der Anwendung derartiger Kombinationen ist Vorsicht geboten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Dexamethason: kann CYP3A4 induzieren und die Plasmakonzentrationen von Amprenavir senken.
- Arzneimittel, deren Plasmaspiegel bei gemeinsamer Anwendung mit Telzir erhöht sein können
Andere Arzneimittel mit einer geringen therapeutischen Breite: Einige Substanzen (z.B. (systemisch gegebenes) Lidocain und Halofantrin) können bei gleichzeitiger Anwendung von Telzir schwere Nebenwirkungen verursachen. Eine gleichzeitige Anwendung wird daher nicht empfohlen.
Benzodiazepine: die gleichzeitige Anwendung von Telzir mit Midazolam oder Triazolam könnte zu verlängerter Sedation oder Atemwegsdepression führen und ist daher kontraindiziert.
Calciumkanalblocker: Amlodipin, Diltiazem, Felodipin, Isradipin, Nicardipin, Nifedipin, Nimodipin, Nisoldipin und Verapamil: Die Serumkonzentrationen dieser Arzneimittel können erhöht werden, wodurch möglicherweise die Wirkung und Toxizität dieser Arzneimittel verstärkt werden (z.B. Hypotension, Synkopen u.a.).
PDE5-Inhibitoren: Basierend auf den Daten zu Ritonavir und anderen Proteasehemmern ist bei gleichzeitiger Anwendung mit Telzir mit Ritonavir ein beträchtlicher Anstieg der Plasmakonzentrationen von PDE5-Inhibitoren (z.B. Sildenafil und Vardenafil) und eine damit verbundene Erhöhung der durch PDE5-Inhibitoren verursachten Nebenwirkungen einschliesslich Hypotension, Sehstörungen und Priapismus zu erwarten. Eine gleichzeitige Anwendung von PDE5-Inhibitoren für die Behandlung einer erektilen Dysfunktion oder pulmonaler arterieller Hypertonie bei Patienten unter Therapie mit Fosamprenavir wird nicht empfohlen. Die gleichzeitige Anwendung von Fosamprenavir ist kontraindiziert bei Patienten, welche aufgrund einer pulmonaren arteriellen Hypertonie mit Sildenafil behandelt werden (s. «Kontraindikationen»).
Fluticasonpropionat (Interaktion mit Ritonavir): In einer klinischen Studie, in der Ritonavir 100 mg Kapseln zweimal täglich zusammen mit 200 µg Fluticasonpropionat intranasal (1x täglich) über 7 Tage an Probanden gegeben wurden, stiegen die Fluticasonpropionat-Plasmaspiegel signifikant an, während das endogene Kortisol um ungefähr 86% (90% Konfidenzintervall 82 - 89%) absank. Stärkere Effekte sind nach Inhalation von Fluticasonpropionat zu erwarten.
Systemische kortikosteroide Wirkungen einschliesslich Morbus Cushing und Suppression der Nebennierenfunktion wurden bei Patienten berichtet, die Ritonavir zusammen mit inhalativ oder intranasal verabreichtem Fluticasonpropionat erhalten hatten; diese könnten auch bei anderen Kortikosteroiden, die über P450 3A verstoffwechselt werden z.B. Budenosid), auftreten (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Aus diesem Grund sollte die gleichzeitige Gabe von Telzir mit Ritonavir zusammen mit diesen Glukokortikoiden vermieden werden, es sei denn, der mögliche Nutzen einer Behandlung überwiegt das Risiko systemischer kortikosteroider Wirkungen.
Eine Reduktion der Glukokortikoid-Dosis sollte zusammen mit einer
engmaschigen Überwachung auf lokale und systemische Wirkungen oder einem Wechsel auf ein Glukokortikoid, das kein Substrat von CYP3A4 darstellt (z.B. Beclometason), in Erwägung gezogen werden. Darüber hinaus muss im Falle eines Absetzens der Glukokortikoide die schrittweise Dosisreduktion über einen längeren Zeitraum durchgeführt werden. Die Wirkung einer hohen systemischen Fluticason-Exposition auf die Plasmaspiegel von Ritonavir ist bisher nicht bekannt.
HMG-CoA-Reduktase-Inhibitoren: Sollte eine Behandlung mit einem HMG-CoA-Reduktase-Hemmstoff angezeigt sein, werden Pravastatin oder Fluvastatin empfohlen, da deren Metabolismus nicht von CYP3A4 abhängig ist und daher Wechselwirkungen mit Proteasehemmern nicht wahrscheinlich sind. Bei HMG-CoA-Reduktase-Hemmstoffen wie Lovastatin und Simvastatin, deren Verstoffwechselung stark von CYP3A4 abhängig ist, sind ausgeprägte Erhöhungen der Plasmaspiegel bei gleichzeitiger Anwendung von Telzir mit Ritonavir zu erwarten. Da Plasmaspiegelerhöhungen dieser HMG-CoA-Reduktase-Hemmstoffe zu Myopathie einschliesslich einer Rhabdomyolyse führen können, darf Lovastatin oder Simvastatin nicht zusammen mit Telzir / Ritonavir eingenommen werden (vgl. «Kontraindikationen»). Eine Anpassung der Dosis von Telzir oder Ritonavir ist bei gleichzeitiger Anwendung mit Atorvastatin nicht erforderlich. Atorvastatin darf jedoch nicht in höheren Dosen als 20 mg/Tag verwendet werden.
Cmax, AUC und Cmin von Atorvastatin waren nach Gabe von Atorvastatin (10 mg 1x täglich über 4 Tage) mit 700 mg Fosamprenavir 2x täglich und 100 mg Ritonavir 2x täglich über zwei Wochen auf 284 %, 253 % und 173 % erhöht. Cmax, AUC und Cmin von Amprenavir waren unverändert. Bei gleichzeitiger Anwendung mit Telzir mit Ritonavir sollten keine höheren Atorvastatin-Dosen als 20 mg/Tag gegeben werden, eine sorgfältige Überwachung auf durch Atorvastatin bedingte Toxizität ist erforderlich.
Immunsuppressiva: Es wird eine häufigere Überwachung der therapeutischen Konzentrationen bis zur Stabilisierung der Spiegel empfohlen, da die Plasmakonzentrationen von Cyclosporin, Rapamycin und Tacrolimus bei gleichzeitiger Gabe von Fosamprenavir mit Ritonavir erhöht sein können.
Trizyklische Antidepressiva: Eine sorgfältige Überwachung der therapeutischen Wirkungen und Nebenwirkungen von trizyklischen Antidepressiva (zum Beispiel Desipramin und Nortryptilin) wird bei gleichzeitiger Gabe von Telzir empfohlen.
Antineoplastische Arzneimittel:
Wenn antineoplastische Arzneimittel (z.B. Dasatinib, Nilotinib, Ibrutinib, Vinblastin und Everolimus), die durch CYP3A metabolisiert werden, gemeinsam mit Fosamprenavir mit/ohne Ritonavir verabreicht werden, können die Plasmakonzentrationen dieser antineoplastischen Arzneimittel erhöht werden und das Risiko von unerwünschten Ereignissen, die normalerweise mit diesen antineoplastischen Arzneimitteln verbunden sind, vergrössern. Bei gleichzeitiger Verabreichung mit antineoplastischen Arzneimitteln, die durch CYP3A metabolisiert werden, beachten Sie bitte die entsprechenden Fachinformationen zu diesen Arzneimitteln.
Antipsychotika:
Quetiapin: Aufgrund der CYP3A4 Inhibition durch Fosamprenavir wird erwartet, dass die Quetiapin Konzentrationen ansteigen. Die gleichzeitige Anwendung von Fosamprenavir und Quetiapin ist kontraindiziert, da dies die Quetiapin-bedingte Toxizität erhöht. Erhöhte Quetiapin Plasmaspiegel können zu Koma führen.
Lurasidon:
Wenn eine gleichzeitige Verabreichung mit Fosamprenavir notwendig ist, sollte die Lurasidon-Dosis reduziert werden. Beachten Sie die Fachinformation für Lurasidon hinsichtlich der gleichzeitigen Anwendung mit moderaten CYP3A4-Hemmern.
Die gleichzeitige Verabreichung von Fosamprenavir mit Ritonavir und Lurasidon ist wegen des Risikos für schwere und/oder lebensbedrohliche Reaktionen kontraindiziert (vgl. «Kontraindikationen»).
- Arzneimittel, deren Plasmaspiegel bei gemeinsamer Anwendung mit Telzir verringert sein können:
Methadon: Die gleichzeitige Anwendung von Fosamprenavir 700 mg und Ritonavir 100 mg 2x täglich mit Methadon 1x täglich (≤200 mg) für 14 Tage erniedrigte die AUC (0-τ) und Cmax des aktiven (R-) Methadon Enantiomers um 18% resp. 21%. Die Cmin von R-Methadon wurde um 11% vermindert und die tmax um 1.75h verzögert. Die AUC(0-τ) und die Cmax des inaktiven S-Methadon-Enantiomers wurden um jeweils 43% reduziert. Die Cmin von S-Methadon wurde um 41% vermindert und die tmax um 0.85h verzögert. Basierend auf historischen Vergleichen scheint Methadon die Pharmakokinetik von Amprenavir im Plasma nicht zu verändern. Auf der Grundlage dieser Daten ist keine Dosisanpassung notwendig, wenn Fosamprenavir mit Ritonavir gleichzeitig mit Methadon angewendet wird. Sicherheitshalber sollten die Patienten jedoch auf Entzugssymptome hin überwacht werden.
Paroxetin: Bei Gabe von 20 mg Paroxetin einmal täglich zusammen mit 700 mg Fosamprenavir und 100 mg Ritonavir zweimal täglich über 10 Tage an gesunde Probanden, verringerten sich Cmax und AUC von Paroxetin um 51% bzw. 55%. Der Mechanismus dieser Wechselwirkung ist noch nicht geklärt. Basierend auf einem historischen Vergleich wurde die Pharmakokinetik von Amprenavir durch Paroxetin nicht verändert. Deshalb wird bei gleichzeitiger Verabreichung von Paroxetin mit Telzir und Ritonavir empfohlen, die Dosis von Paroxetin schrittweise auf Basis einer klinischen Bewertung des antidepressiven Ansprechens zu steigern. Zusätzlich sollten Patienten, die stabil auf Paroxetin eingestellt sind und die eine Behandlung mit Telzir und Ritonavir beginnen, auf das antidepressive Ansprechen hin überwacht werden.
Orale Antikoagulantien: Bei gleichzeitiger Gabe von Antikoagulanzien vom Coumarintyp oder anderen oralen Antikoagulantien zusammen mit Telzir mit Ritonavir wird eine verstärkte Kontrolle der INR (International Normalised Ratio) wegen der Möglichkeit einer Abschwächung oder Verstärkung der antithrombotischen Wirkung empfohlen.
Steroide: Die gleichzeitige Verabreichung von Fosamprenavir 700 mg zweimal täglich + Ritonavir 100 mg zweimal täglich mit Brevinor® (Ethinylestradiol (EE) 0,035 mg / Norethisteron (NE) 0,5 mg) einmal täglich senkte die Plasma-AUC(0-τ) von EE um 37% und den Cmax-Wert um 28% und die Werte von AUC(0-τ), Cmax, und Cτ für NE um 34%, 38% bzw. 26%. Die pharmakokinetischen Parameter von Amprenavir im Fliessgleichgewicht waren durch die gleichzeitige Verabreichung mit Brevinor® nicht in signifikantem Masse beeinflusst; allerdings fielen die AUC(0-τ) und der Cmax-Wert von Ritonavir im Vergleich zu historischen Daten bei Frauen, die Fosamprenavir/Ritonavir allein erhalten hatten, um 45% bzw. 63% höher aus. Neben der Verminderung der Exposition gegenüber hormonellen Kontrazeptiva führte die gleichzeitige Verabreichung von Fosamprenavir mit Ritonavir und Brevinor® bei 22% (7/32) der gesunden Probandinnen zu klinisch signifikanten Steigerungen der Transaminasespiegel, was als Anzeichen einer Leberzellschädigung gelten muss. Daher wird Frauen im gebärfähigen Alter die Verwendung von alternativen, nicht-hormonellen Verhütungsmethoden (Kondome) empfohlen, da die Kontrazeption vermindert sein kann (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Gleichzeitig wurden vermehrt über Übelkeit, Diarrhoe, Hautausschläge und Studienabbrüche wegen unerwünschten Wirkungen (34% bei der Kombination Fosamprenavir/Ritonavir und Kontrazeptivum vs. 5% beim Kontrazeptivum alleine) berichtet.
Potentielle Wirkung auf Substrate des P-Glykoproteins:
Fosamprenavir ist ein Prodrug von Amprenavir, welches in oder in der Nähe der Darmschleimhaut rasch in Amprenavir konvertiert wird. Amprenavir ist ein starker Aktivator des Kernrezeptors PXR (pregnane X receptor), welcher unter anderem die Induktion des Cytochroms 3A4 (gesteigerte Metabolisierung) und die Induktion des P-Glykoproteins (gesteigerte Exkretion z.B. in den Darm, Effluxpumpe) vermittelt. Dabei ist Amprenavir selbst ein Substrat und Hemmstoff für das P-Glykoprotein. Der Cytochrom 3A4 Hemmstoff Ritonavir kann die P-Glykoprotein Induktion nur unvollständig hemmen, so dass eine beschleunigte Elimination von P-Glykoprotein Substraten wie Digoxin ggf. trotz Ritonavir möglich sein kann. Klinische Untersuchungen zu diesen Interaktionen fehlen. Bei Comedikation mit Medikamenten, die bekannte Substrate des P-Glykoproteins sind (z.B. Digoxin, Azithromycin), muss ggf. ein Drug Monitoring durchgeführt werden (z.B. Digoxin) oder auf klinische Zeichen des Therapieversagens (z.B. Azithromycin) geachtet werden.
Schwangerschaft, Stillzeit
Schwangerschaft
Bei trächtigen Ratten und Kaninchen wurden keine schwerwiegenden Wirkungen auf die embryo-fötale Entwicklung beobachtet (vgl. «Präklinische Daten»). Die systemische Plasmaexposition (AUC) gegenüber Amprenavir war in diesen Studien vergleichbar (Ratten) oder niedriger (Kaninchen) als die Exposition bei Patienten in klinischen Studien mit Telzir. Angesichts der niedrigen Exposition bei Kaninchen wurde die mögliche Entwicklungstoxizität von Telzir nicht vollständig ermittelt.
Nach Anwendung von FPV/RTV 700/100 mg zweimal täglich bei schwangeren Frauen wurde eine geringe bis mittelgradige Plazentagängigkeit von Amprenavir beobachtet (siehe Pharmakokinetik). Zur Anwendung von Fosamprenavir in Kombination mit anderen Antiretroviralia während der Schwangerschaft beim Menschen liegen nur begrenzte klinische Daten vor. Die begrenzten Daten zur Anwendung von Fosamprenavir während der Schwangerschaft aus dem Antiretroviral Pregnancy Registry (APR) und Fallberichten reichen nicht aus, um Rückschlüsse auf ein arzneimittelassoziiertes Risiko von Geburtsfehlern und Fehlgeburten zu ziehen (siehe Klinische Studien).
Telzir ist nicht indiziert während einer Schwangerschaft. Es darf während der Schwangerschaft nur angewendet werden, wenn der mögliche Nutzen das mögliche Risiko für den Fötus rechtfertigt.
Stillzeit
Wegen der möglichen Übertragung des HI-Virus in die Muttermilch dürfen die Säuglinge nicht gestillt werden.
In der Milch laktierender Ratten wurden Amprenavir-verwandte Stoffe nachgewiesen. Junge Ratten, die prä- und postnatal Amprenavir und Fosamprenavir ausgesetzt waren, zeigten Entwicklungsstörungen (vgl. «Präklinische Daten»).
Angesichts der Daten aus tierexperimentellen Studien wird davon ausgegangen, dass Amprenavir beim Menschen in die Muttermilch übergehen kann. Zum Übergang und den Auswirkungen von Amprenavir auf das gestillte Kind sowie zu den Wirkungen des Arzneimittels auf die Milchbildung liegen keine Informationen vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen von Telzir in Kombination mit Ritonavir auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Das Nebenwirkungsprofil von Telzir sollte bei der Beurteilung der Fähigkeit des Patienten, ein Fahrzeug zu führen oder Maschinen zu bedienen, in Betracht gezogen werden (vgl. «Unerwünschte Wirkungen»).
Unerwünschte Wirkungen
Die Sicherheit von Fosamprenavir wurde an 755 Patienten über 18 Jahren in kontrollierten klinischen Studien der Phasen II und III untersucht. Die Sicherheit einer gemeinsamen Gabe von Fosamprenavir mit niedrig dosiertem Ritonavir wurde in zwei Zulassungsstudien in der Phase III belegt: APV30002 (n=322) bei antiretroviral nicht vorbehandelten Patienten, in der Fosamprenavir (1400 mg) 1x täglich in Kombination mit Ritonavir (200 mg) als Teil eines Dreifachschemas zusammen mit Abacavir und Lamivudin gegeben wurde; APV30003 bei mit Proteasehemmern vorbehandelten Patienten, in der Fosamprenavir in Kombination mit Ritonavir entweder 1x täglich (1400 mg/200 mg) (n=106) oder 2x täglich (700 mg/100 mg) (n=106) in Kombination mit zwei wirksamen Reverse-Transkriptase-Hemmern (RTI) gegeben wurde.
Das Nebenwirkungsprofil war in allen diesen Studien vergleichbar, sowohl bei antiretroviral nicht vorbehandelten (APV30002) als auch bei mit Proteasehemmern vorbehandelten Erwachsenen (Dosierung 2x täglich, APV30003).
Nachfolgend sind Nebenwirkungen nach MedDRA, Organklassen und absoluter Häufigkeit aufgelistet. Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, < 1/10), gelegentlich (≥1/1000, < 1/100), selten (≥1/10000, < 1/1000), sehr selten (< 1/10000) einschliesslich Einzelfälle.
Die Häufigkeitsangaben der Nebenwirkungen beruhen auf Daten aus klinischen Studien und auf Postmarketing Daten.
Die meisten unten aufgeführten unerwünschten Wirkungen stammen aus zwei grossen Studien an Erwachsenen. Die häufigsten Nebenwirkungen von mindestens mittelschwerer Ausprägung (≥ Grad 2), deren Zusammenhang mit Telzir mindestens als kausal möglich eingestuft wurde, und welche bei mindestens 2% der mit Fosamprenavir/Ritonavir behandelten Patienten aufgetreten waren, sind nachfolgend zusammengefasst.
Störungen des Blut- und Lymphsystems:
Hämophilie-Patienten: Bei hämophilen Patienten liegen Berichte über vermehrte spontane Blutungen unter antiretroviraler Therapie einschliesslich Proteasehemmern vor (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Störungen des Immunsystems:
Immun-Reaktivierungs-Syndrom: Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer antiretroviralen Kombinationstherapie (ART) eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen entwickeln (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechsel und Ernährungsstörungen:
Sehr häufig: Hypercholesterinämie (11%) (s. «Warnhinweise und Vorsichtsmassnahmen»).
Häufig: Hypertriglyceridämie (s. «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechselstörungen: Die antiretrovirale Kombinationstherapie wurde mit Stoffwechselanomalien assoziiert, wie Hypertriglyceridämie, Hypercholesterinämie, Insulinresistenz, Hyperglykämie und Hyperlaktatämie (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Hyperglykämie: Bei Patienten, die antiretrovirale Proteasehemmer erhielten, wurde über das Auftreten von Diabetes mellitus, Hyperglykämie oder eine Exazerbation eines bestehenden Diabetes mellitus berichtet (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Störungen des Nervensystems:
Häufig: Kopfschmerzen, Schwindel, orale Parästhesie.
Funktionsstörungen des Herzens:
Gelegentlich: Myokardinfarkt.
Gastrointestinale Störungen:
Sehr häufig: Diarrhoe (13%).
Häufig: Weiche Stühle, Übelkeit, Erbrechen, Unterleibsschmerzen.
Funktionsstörungen der Haut und des Unterhautzellgewebes:
Häufig: Hautausschlag (siehe nachfolgender Text «Hautausschläge / Hautreaktionen»).
Gelegentlich: Angioödem (Quincke Ödem).
Selten: Stevens-Johnson-Syndrom.
Hautausschläge / Hautreaktionen: Erythematöse oder makulopapuläre Hauteruptionen mit oder ohne Pruritus können unter der Therapie auftreten. Die Hautausschläge bilden sich in der Regel spontan zurück, ohne dass eine Unterbrechung der Behandlung mit Fosamprenavir mit Ritonavir erforderlich ist. Schwere oder lebensbedrohliche Hautreaktionen einschliesslich eines Stevens-Johnson-Syndroms sind selten und wurden bei weniger als 1% der Patienten im klinischen Entwicklungsprogramm berichtet. Im Falle von schweren Hautausschlägen oder von Hautausschlägen mittlerer Intensität mit systemischen oder die Schleimhaut betreffenden Symptomen muss die Therapie mit Fosamprenavir mit Ritonavir unbedingt abgesetzt werden (vgl. Warnhinweise und Vorsichtsmassnahmen“).
Die antiretrovirale Kombinationstherapie, die einen Proteasehemmer beinhaltet, wurde mit einer Erhöhung des Körperfetts (Lipohypertrophie) bei einigen HIV-Patienten assoziiert (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Muskelskelettsystem:
Rhabdomyolyse: Unter Proteasehemmern wurde eine CPK-Erhöhung, Myalgie, Myositis und in seltenen Fällen über eine Rhabdomyolyse berichtet, insbesondere im Zusammenhang mit Nukleosidanaloga.
Osteonekrose: Fälle von Osteonekrose wurden insbesondere bei Patienten mit allgemein bekannten Risikofaktoren, fortgeschrittener HIV-Erkrankung oder Langzeitanwendung einer antiretroviralen Kombinationstherapie (ART) berichtet. Die Häufigkeit des Auftretens ist unbekannt (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Funktionsstörungen der Niere und ableitenden Harnwege:
Gelegentlich: Nierensteine.
Allgemeine Störungen und Reaktionen an der Applikationsstelle:
Häufig: Müdigkeit.
Untersuchungen (Grad 3 oder 4 Veränderungen):
Sehr häufig: Triglycerid-Erhöhungen (11%).
Häufig: ALT-, AST-, Serumlipase-Erhöhungen.
Kinder und Jugendliche: Das Nebenwirkungsprofil von Kindern und Jugendlichen basiert auf den Daten zur Sicherheit aus der Studie APV29005, in der 54 HIV-1 infizierte Personen im Alter von 6 bis 18 Jahren Telzir mit Ritonavir (in 2x täglicher Dosierung) zusammen mit einer NRTI-Basistherapie erhalten hatten.
Insgesamt war das Sicherheitsprofil bei diesen 54 Kindern und Jugendlichen dem bei Erwachsenen beobachtetem ähnlich.
In der Studie APV20003 wurde eine 1x tägliche Dosierung von Fosamprenavir und Ritonavir an Kindern untersucht (nicht zugelassene Dosierung). Arzneimittelinduzierte Nebenwirkungen waren in der Studie APV20003 (52%) mit einmal täglicher Einnahme von Fosamprenavir / Ritonavir häufiger als in APV29005 (39%) mit zweimal täglicher Einnahme von Fosamprenavir / Ritonavir.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es ist kein Antidot für Telzir bekannt. Es ist nicht bekannt, ob Amprenavir mittels Peritonealdialyse oder Hämodialyse eliminiert werden kann. Im Falle einer Überdosierung ist der Patient auf Anzeichen einer Intoxikation (vgl. «Unerwünschte Wirkungen») zu beobachten, wenn erforderlich, sind notwendige unterstützende Massnahmen einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
J05AE07
Pharmakotherapeutische Gruppe: Proteasehemmer (PI)
Wirkungsmechanismus
Fosamprenavir wird in vivo durch Phosphatasen in der Zelle oder im Serum rasch zu Amprenavir umgewandelt. Amprenavir ist ein kompetitiver Hemmer der HIV-1-Protease. Amprenavir bindet an das aktive Zentrum der HIV-1-Protease und verhindert dadurch die Prozessierung viraler gag- und gag-pol-Polyproteinvorstufen mit der Folge einer Bildung unreifer, nicht infektiöser Viruspartikel.
Pharmakodynamik
Fosamprenavir zeigt nur geringe oder gar keine antivirale Aktivität in vitro. Die in vitro beobachtete antivirale Aktivität von Fosamprenavir beruht auf der Anwesenheit von Spuren an Amprenavir. Die antivirale Aktivität von Amprenavir in vitro gegen HIV-1 IIIB wurde sowohl an akut und chronisch infizierten lymphoblastischen Zelllinien (MT-4, CEM-CCRF, H9) und an peripheren Blutlymphozyten untersucht. Die 50 %ige Hemmkonzentration (IC50) von Amprenavir liegt im Bereich von 0,012 bis 0,08 µM bei akut infizierten Zellen und beträgt 0,41 µM bei chronisch infizierten Zellen (1 µM = 0,50 µg/ml). In vitro zeigte Amprenavir in Kombination mit den nukleosidalen Reverse-Transkriptase-Hemmern (NRTI) Abacavir, Didanosin und Zidovudin und dem Proteasehemmer Saquinavir synergistische Aktivität gegen HIV-1, und eine additive Wirkung gegen HIV-1 in Kombination mit Indinavir, Nelfinavir und Ritonavir. Der Zusammenhang zwischen der Aktivität von Amprenavir gegen HIV-1 in vitro und der Hemmung der HIV-1-Replikation beim Menschen ist noch nicht definiert.
Die gemeinsame Gabe von Ritonavir mit Fosamprenavir führt zu einer Erhöhung der AUC von Amprenavir im Plasma um etwa das Zweifache und von Cτ,ss um das 4- bis 6-fache im Vergleich zu den Werten nach alleiniger Gabe von Fosamprenavir. Die Gabe von 700 mg Fosamprenavir 2x täglich zusammen mit 100 mg Ritonavir 2x täglich führt zu minimalen Amprenavir-Plasmaspiegeln (Cmin von 1,74 µg/ml im geometrischen Mittel in der Studie APV30003 bei antiretroviral vorbehandelten Patienten berichtet) oberhalb der in dieser Studie berichteten medianen IC50-Werte (0,008 µg/ml [0,001 – 0,144]).
Resistenz
HIV-1-Isolate mit einer verringerten Empfindlichkeit auf Amprenavir wurden in seriellen Passagen in vitro selektiert. Die verringerte Empfindlichkeit auf Amprenavir war mit einem Virus, das I50V-, I84V-, V32I+I47V- oder I54M-Mutationen entwickelte, assoziiert.
Es wurde keine genotypische oder phänotypische Resistenzentwicklung gegen Amprenavir bei 32 antiretroviral nicht vorbehandelten Patienten, die 1400 mg Fosamprenavir zusammen mit 200 mg Ritonavir 1x täglich (Studie APV30002) erhalten hatten und virologisches Versagen oder eine persistierende Virusreplikation zeigten, gefunden. Ein signifikant höherer Anteil von mit Nelfinavir behandelten Patienten erwarb primäre und/oder sekundäre Proteasemutationen (Nelfinavir 27/54 (50 %)) (p< 0,001).
Eine Resistenzentwicklung gegen Amprenavir wurde in Virus-Isolaten von mit Proteasehemmern vorbehandelten Patienten, die 1400 mg Fosamprenavir zusammen mit 200 mg Ritonavir 1x täglich oder 700 mg Fosamprenavir zusammen mit 100 mg Ritonavir 2x täglich (Studie APV30003) erhielten und virologisches Versagen oder eine persistierende Virusreplikation zeigten, gefunden. 58 % (19/33) in der Fosamprenavir-Gruppe im Vergleich zu 25 % (7/28) der Patienten im Lopinavir/Ritonavir-Arm erwarben primäre und/oder sekundäre Proteasemutationen. Die folgenden mit Amprenavir assoziierten Resistenzmutationen entwickelten sich isoliert oder in Kombination: V32I, M46I/L, I47V, I50V, I54L/M und I84V.
Kreuzresistenz
Die Daten sind derzeit zu begrenzt, um einen klinisch relevanten phänotypischen Schwellenwert für Fosamprenavir mit Ritonavir zu bestimmen.
Die Entwicklung einer Kreuzresistenz zwischen Amprenavir und Reverse-Transkriptase-Hemmern ist unwahrscheinlich, da die enzymatischen Angriffspunkte unterschiedlich sind.
Telzir wird wegen des schnellen Auftretens resistenter Viren nicht zur Anwendung als Monotherapie empfohlen.
Klinische Wirksamkeit
Die klinische Erfahrung basiert hauptsächlich auf zwei offenen Studien, die im Vergleich zu Nelfinavir an antiretroviral nicht vorbehandelten erwachsenen Patienten (Studie APV30002) und im Vergleich zu Lopinavir/Ritonavir an antiretroviral vorbehandelten erwachsenen Patienten (Studie APV30003) durchgeführt wurden. In beiden Studien wurde Fosamprenavir mit Ritonavir zur Boosterung angewendet.
Antiretroviral nicht vorbehandelte erwachsene Patienten
In der Studie APV30002 an antiretroviral nicht vorbehandelten Patienten zeigte die Kombination von Fosamprenavir (1400 mg) 1x täglich mit niedrig dosiertem Ritonavir (200 mg) als Teil einer Dreifachtherapie mit Abacavir (300 mg 2x täglich) und Lamivudin (150 mg 2x täglich) eine ähnliche Wirksamkeit über 48 Wochen im Vergleich zu Nelfinavir (1250 mg) 2x täglich in Kombination mit Abacavir und Lamivudin (300 mg und 150 mg 2x täglich).
Auf Basis des Anteils an Patienten mit HIV-1-RNA-Plasmaspiegeln < 400 Kopien/ml nach 48 Wochen (primärer Endpunkt) erwies sich Fosamprenavir mit Ritonavir gegenüber Nelfinavir als nicht unterlegen. In der ITT-Analyse (Wiederanstieg oder Abbruch als Versagen gewertet) erreichten 69 % (221/322) der Patienten unter Fosamprenavir zusammen mit Ritonavir <400 Kopien/ml im Vergleich zu 68 % (221/327) der Patienten unter Nelfinavir.
Die medianen HIV-1-RNA-Werte im Plasma waren im Telzir-mit-Ritonavir-Arm und im Nelfinavir-Arm in der 48. Woche um 3,1 log10 Kopien/ml bzw. 3,0 log10 Kopien/ml abgefallen.
Die mediane CD4-Zellzahl zu Behandlungsbeginn war in beiden Gruppen niedrig (insgesamt 170 Zellen/mm³). Die CD4-Zellzahlen stiegen sowohl in der Fosamprenavir-mit-Ritonavir-Gruppe als auch in der Gruppe mit Nelfinavir an, wobei die medianen Anstiege über den Ausgangswert hinaus in der 48. Woche vergleichbar waren (+ 203 und + 207 Zellen/mm³).
Die oben dargestellten Daten zeigen, dass die 1x tägliche Anwendung von Fosamprenavir mit Ritonavir (1400/200 mg 1x täglich) bei antiretroviral nicht vorbehandelten Patienten eine mit Nelfinavir 2x täglich vergleichbare Wirksamkeit zeigt. Der Beleg der Wirksamkeit in dieser Patientengruppe beruht jedoch nur auf einer offenen Studie gegen Nelfinavir. Es ist eine weitere klinische Studie zur Bestätigung des Belegs der Wirksamkeit geplant. Deshalb wird auf Basis der erhöhten minimalen Amprenavir-Spiegel als konservativer Ansatz die 2x tägliche Gabe von Fosamprenavir mit Ritonavir für die optimale therapeutische Versorgung dieser Patientengruppe empfohlen (vgl. «Dosierung/Anwendung»).
Antiretroviral vorbehandelte erwachsene Patienten
In einer randomisierten offenen Studie (APV30003) bei mit Proteasehemmern vorbehandelten Patienten nach virologischem Versagen (bis zu zwei PI) konnte eine Nicht-Unterlegenheit der Kombination von Fosamprenavir mit Ritonavir (700/100 mg 2x täglich oder 1400/200 mg 1x täglich) gegenüber Lopinavir/Ritonavir hinsichtlich viraler Suppression, gemessen anhand der durchschnittlichen Fläche unter der Kurve abzüglich des Ausgangswerts (AAUCMB) für die HIV-1-RNA-Konzentration im Plasma, über 48 Wochen (der primäre Endpunkt) nicht gezeigt werden. Wie untenstehend beschrieben, begünstigten die Ergebnisse den Lopinavir/Ritonavir-Arm.
Alle Patienten in dieser Studie hatten zuvor ein Therapieversagen unter vorheriger Proteasehemmer-haltiger Kombinationsbehandlung gezeigt (wie folgt definiert: kein Abfall der HIV-1-RNA-Konzentration im Plasma unter 1000 Kopien/ml über mindestens 12 aufeinanderfolgende Behandlungswochen, oder anfängliche Suppression der HIV-1-RNA und nachfolgendem Anstieg auf ≥1000 Kopien/ml). Nur 65 % der Patienten erhielten jedoch eine PI-basierende Behandlung zu Studienbeginn.
Die rekrutierte Patientengruppe bestand hauptsächlich aus antiretroviral mässig vorbehandelten Patienten. Die mediane Dauer der vorhergehenden Exposition gegenüber NRTI betrug 257 Wochen für Patienten, die Fosamprenavir mit Ritonavir 2x täglich erhielten (79 % erhielten vorher ≥3 NRTI), und 210 Wochen für Patienten, die Lopinavir/Ritonavir erhielten (64 % erhielten vorher ≥3 NRTI). Die mediane Dauer der früheren Exposition gegenüber Proteasehemmern betrug 149 Wochen bei Patienten, die Fosamprenavir mit Ritonavir 2x täglich erhielten (49 % erhielten vorher ≥2 PI), und 130 Wochen bei Patienten, die Lopinavir/Ritonavir erhielten (40 % erhielten vorher ≥2 PI).
Die mittleren AAUCMB-Werte (log10 c/ml) in der ITT (E)-Population (Beobachtungsanalyse) nach 48 Wochen sind in der folgenden Tabelle beschrieben:
APV30003: Durchschnittliche Flächen unter der Kurve abzüglich des Ausgangswerts (AAUCMB) für die HIV-1-RNA-Konzentration (log10 Kopien/ml) im Plasma in der 48. Woche nach Randomisierungsstrata in der ITT (E)-Population
|
Plasma HIV-1 RNA stratum |
Beobachtungsanalyse |
Beobachtungsanalyse |
Beobachtungsanalyse |
|
1000 – 10'000 Kopien/ml |
-1.53 (41) |
-1.43 (43) |
-0.104 |
|
> 10'000 – 100'000 Kopien/ml |
-1.59 (45) |
-1.81 (46) |
0.216 |
|
> 100'000 Kopien/ml |
-1.38 (19) |
-2.61 (14) |
1.232 |
|
Gesamtpopulation |
-1.53 (105) |
-1.76 (103) |
0.244 |
Legende: FPV/RTV BID: Fosamprenavir mit Ritonavir 2x täglich, LPV/RTV BID: Lopinavir/Ritonavir 2x täglich
Unter Berücksichtigung der Anteile an Patienten mit nicht nachweisbarer Viruslast im Arm mit 2x täglich Fosamprenavir mit Ritonavir bzw. Lopinavir/Ritonavir zeigten die Ergebnisse einen Trend zugunsten von Lopinavir/Ritonavir: 58 % im Vergleich zu 61 % (Plasma-HIV-1-RNA < 400 Kopien/ml) oder 46 % im Vergleich zu 50 % (Plasma-HIV-1-RNA < 50 Kopien/ml) in der 48. Woche (sekundärer Wirksamkeitsendpunkt) in der Intent-to-Treat (RD=F)-Analyse.
Bei Patienten mit einer hohen Viruslast zu Beginn der Studie (> 100.000 Kopien/ml) hatten 7/14 (50 %) der Patienten in der Lopinavir/Ritonavir-Gruppe und 6/19 (32 %) der Patienten in der Fosamprenavir-mit-Ritonavir-Gruppe Plasma-HIV-1-RNA-Werte < 400 Kopien/ml.
Unter Fosamprenavir mit Ritonavir 2x täglich und Lopinavir/Ritonavir 2x täglich zeigten sich ähnliche immunologische Verbesserungen über die 48 Behandlungswochen, gemessen anhand der medianen Änderung der CD4-Zellzahl gegenüber dem Ausgangswert (Fosamprenavir mit Ritonavir 2x täglich: 81 Zellen/mm³; Lopinavir/Ritonavir 2x täglich: 91 Zellen/mm³).
Es liegen keine ausreichenden Daten für eine Empfehlung zur Anwendung von Fosamprenavir mit Ritonavir bei stark vorbehandelten Patienten vor.
Schwangerschaft
Fosamprenavir wurde im Rahmen des Antiretroviral Pregnancy Registry bei 162 Frauen während der Schwangerschaft und in der postpartalen Phase beurteilt. Es gab 146 Lebendgeburten; 125 Expositionen während des ersten Trimenons und 36 Expositionen während des zweiten/dritten Trimenons; bei den lebend geborenen Kindern wurde in 4 Fällen über Geburtsfehler berichtet. Es liegen allerdings keine adäquaten und gut kontrollierten Studien an Schwangeren vor, und die Sicherheit der Anwendung von Fosamprenavir während der Schwangerschaft beim Menschen ist nicht erwiesen.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Kinder über 6 Jahre und Jugendliche (mit einem Körpergewicht ≥25 kg)
Die Fosamprenavir Tabletten und die Suspension zum Einnehmen zusammen mit Ritonavir wurden in Kombination mit NRTIs bei mit Proteasehemmern nicht vorbehandelten und vorbehandelten Kindern und jugendlichen Patienten geprüft. Der Nutzen für diese Altersgruppe wurde hauptsächlich abgeleitet aus der Studie APV29005, einer offenen 48-Wochen-Studie zur Untersuchung der pharmakokinetischen Eigenschaften, der Sicherheit und der antiviralen Aktivität von Fosamprenavir mit Ritonavir zweimal täglich bei mit HIV-1-Proteasehemmern nicht vorbehandelten und vorbehandelten Patienten im Alter von 2 bis 18 Jahren. Die Ergebnisse nach 24 Wochen sind nachfolgend dargestellt.
In die Studie APV29005 wurden 25 Patienten im Alter von 6 bis 11 Jahren (die Mehrheit davon wurde mit Fosamprenavir/Ritonavir 18/3 mg/kg zweimal täglich (Telzir Suspension ist nicht mehr zugelassen) oder dem Dosierungsschema für die Tabletten bei Erwachsenen behandelt) und 29 Patienten im Alter von 12 bis 18 Jahren (die Mehrheit davon wurde mit dem Dosierungsschema für die Tabletten bei Erwachsenen behandelt) eingeschlossen. Insgesamt waren 27 Patienten (50 %) nicht mit Proteasehemmern, davon 9 überhaupt nicht antiretroviral vorbehandelt, und 27 (50%) mit Proteasehemmern vorbehandelt. Die NRTI-Exposition in der Vorgeschichte war mit einer medianen Dauer von 421 Wochen bei nicht mit Proteasehemmern vorbehandelten bzw. 389 Wochen bei mit Proteasehemmern vorbehandelten Patienten erheblich. Die mediane Zeitdauer der vorangegangenen Proteasehemmer-Exposition betrug 239 Wochen. Insgesamt wurden Patienten mit medianen Plasma-HIV-1-RNA-Werten von 4,6 log10 Kopien/ml (33 % davon hatten zu Beginn > 100.000 Kopien/ml) und einem medianen CD4+-Zellanteil von 18 % (37 % davon hatten zu Beginn einen medianen CD4+-Zellanteil von < 15%) in die Studie eingeschlossen.
Bis zur 24. Therapiewoche wurden bei 70 % (19/27) der nicht mit Proteasehemmern vorbehandelten und bei 56 % (15/27) der mit Proteasehemmern vorbehandelten Patienten Plasma-HIV-1-RNA-Werte von <400 Kopien/ml (ITT(E), TLOVR) erreicht und aufrechterhalten.
In Woche 24 waren in der ITT(E)-Population (Beobachtungsanalyse) die medianen CD4+-Zellzahlen der nicht mit Proteasehemmern vorbehandelten um 8 % und der mit Proteasehemmern vorbehandelten Patienten um 4 % angestiegen.
Bis zur Therapiewoche 48 wurden bei 70% (19/27) der nicht mit Proteasehemmern vorbehandelten und bei 59 % (16/27) der mit Proteasehemmern vorbehandelten Patienten Plasma-HIV-1-RNA-Werte von <400 Kopien/ml (ITT(E), TLOVR) erreicht (s. Tabelle unten).
Diese Daten wurden durch die unterstützende Studie APV20003 bestätigt, in der jedoch ein 1x tägliches, nicht zugelassenes Dosisschema angewendet wurde.
APV29005: Übersicht über Responders mit Plasma HIV-1 RNA < 400 Kopien/ml und < 50 Kopien/ml in der ITT (E)-Population (TLVR)
|
Altersgruppe |
Studien-Zeitpunkt |
Verlauf Responders |
Verlauf Responders |
|
6 - 11 Jahre (N=25) |
Baseline |
0 / 25 |
0 / 25 |
|
|
Woche 2 |
3 / 25 (12%) |
0 / 25 |
|
|
Woche 4 |
7 / 25 (28%) |
0 / 25 |
|
|
Woche 8 |
10 / 25 (40%) |
2 / 25 (8%) |
|
|
Woche 12 |
12 / 25 (48%) |
6 / 25 (24%) |
|
|
Woche 16 |
12 / 25 (48%) |
9 / 25 (36%) |
|
|
Woche 24 |
14 / 25 (56%) |
11 / 25 (44%) |
|
|
Woche 36 |
14 / 25 (56%) |
11 / 25 (44%) |
|
|
Woche 48 |
14 / 25 (56%) |
11 / 25 (44%) |
|
12 - 18 Jahre (N=29) |
Baseline |
0 / 29 |
0 / 29 |
|
|
Woche 2 |
4 / 29 (14%) |
0 / 29 |
|
|
Woche 4 |
13 / 29 (45%) |
4 / 29 (14%) |
|
|
Woche 8 |
20 / 29 (69%) |
6 / 29 (21%) |
|
|
Woche 12 |
24 / 29 (83%) |
9 / 29 (31%) |
|
|
Woche 16 |
24 / 29 (83%) |
11 / 29 (38%) |
|
|
Woche 24 |
24 / 29 (83%) |
13 / 29 (45%) |
|
|
Woche 36 |
23 / 29 (79%) |
18 / 29 (62%) |
|
|
Woche 48 |
21 / 29 (72%) |
20 / 29 (69%) |
Pharmakokinetik
Nach oraler Gabe wird Fosamprenavir vor Erreichen der systemischen Zirkulation rasch und nahezu vollständig zu Amprenavir und anorganischem Phosphat hydrolysiert. Die Umwandlung von Fosamprenavir zu Amprenavir scheint hauptsächlich in Darmepithel zu erfolgen.
Die pharmakokinetischen Eigenschaften von Amprenavir nach gemeinsamer Anwendung von Telzir mit Ritonavir wurden bei gesunden Freiwilligen und mit HIV infizierten Patienten untersucht, wesentliche Unterschiede zwischen diesen Gruppen wurden nicht gefunden.
Absorption
Nach Einmalgabe von Fosamprenavir werden maximale Plasmakonzentrationen ungefähr 2 Stunden nach der Einnahme beobachtet. Die AUC-Werte von Fosamprenavir liegen im Allgemeinen bei weniger als 1 % der für Amprenavir beobachteten Werte. Die absolute Bioverfügbarkeit von Fosamprenavir beim Menschen ist nicht bekannt.
Nach mehrfacher oraler Gabe äquivalenter Fosamprenavir- und Amprenavir-Dosen wurden ähnliche AUC-Werte beobachtet; nach Gabe von Fosamprenavir lagen jedoch die Cmax-Werte um ungefähr 30 % niedriger und die Cmin-Werte um ungefähr 28 % höher.
Nach mehrfacher oraler Gabe von 700 mg Fosamprenavir mit 100 mg Ritonavir 2x täglich wurde Amprenavir rasch resorbiert, die maximale Plasmakonzentration (Cmax) von Amprenavir im Steady-State betrug 6,08 (5,38 bis 6,86) µg/ml im geometrischen Mittel (95 % KI) und wurde ungefähr 1,5 (0,75 bis 5,0) Stunden (tmax) nach Gabe erreicht. Im Steady-State betrug die Trough-Konzentration (Cmin) von Amprenavir im Plasma im geometrischen Mittel 2,12 (1,77 bis 2,54) µg/ml, die AUC0-τ betrug 39,6 (34,5 bis 45,3) h•µg/ml.
In einer vergleichenden Studie an Probanden wurden über 14 Tage 2 x 700 mg Fosamprenavir (FPV) jeweils mit und ohne Ritonavir (RTV) mit 2 x 600 mg Amprenavir (APV) jeweils mit und ohne 2 x 100 mg Ritonavir verglichen. Dabei konnten folgende Plasmaspiegelkurven für Amprenavir ermittelt werden, die sowohl das Verhältnis zwischen Amprenavir und Fosamprenavir als auch den Effekt der zusätzlichen Gabe von Ritonavir darstellen:
APV10022: Mittlere Konzentrationen von Amprenavir im Plasma
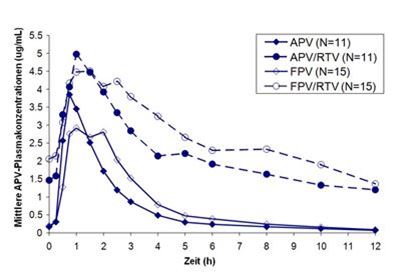
Die Gabe von Fosamprenavir in der Tablettenformulierung mit einer fettreichen Mahlzeit (standardisierte fettreiche Mahlzeit: 967 kcal, 67 Gramm Fett, 33 Gramm Protein, 58 Gramm Kohlenhydrate) war mit keinen Veränderungen in der Pharmakokinetik (Cmax oder AUC) von Amprenavir im Vergleich zur Gabe dieser Formulierung im Nüchternzustand verbunden. Durch Einnahme der Tabletten mit einer fettreichen Mahlzeit nahm die t½ (+29,6%) und die tmax (32,6%) signifikant zu. Die Telzir Filmtabletten können unabhängig von den Mahlzeiten eingenommen werden.
Die Einnahme von Amprenavir zusammen mit Grapefruitsaft war nicht mit signifikanten Veränderungen in der Pharmakokinetik von Amprenavir verbunden.
Distribution
Das scheinbare Verteilungsvolumen von Amprenavir nach Gabe von Telzir beträgt ungefähr 430 l (6 l/kg bei einem Körpergewicht von 70 kg) und lässt auf ein grosses Verteilungsvolumen sowie eine ungehinderte Penetration von Amprenavir aus dem Blutkreislauf in das Gewebe schliessen. Dieser Wert wird, wahrscheinlich auf Grund einer Erhöhung der Bioverfügbarkeit von Amprenavir, um ungefähr 40 % verringert, wenn Telzir mit Ritonavir gegeben wird.
In Invitro-Studien beträgt die Proteinbindung von Amprenavir ca. 90 %. Amprenavir wird an das alpha-1-Säure-Glykoprotein (AAG) sowie an Albumin gebunden, zeigt aber eine höhere Affinität zu AAG. Es wurde gezeigt, dass die AAG-Konzentrationen im Verlauf der antiretroviralen Therapie abnehmen. Diese Änderung führt zu einer Abnahme der Gesamtkonzentration des Wirkstoffs im Plasma, wobei die Menge von ungebundenem Amprenavir, das den aktiven Anteil darstellt, wahrscheinlich unverändert bleibt.
Die Penetration von Amprenavir in die zerebrospinale Flüssigkeit ist beim Menschen vernachlässigbar. Amprenavir scheint in die Samenflüssigkeit zu penetrieren, allerdings sind die Konzentrationen in der Samenflüssigkeit geringer als im Plasma.
Metabolismus
Nach oraler Gabe wird Fosamprenavir während der Resorption durch das Darmepithel rasch und beinahe vollständig zu Amprenavir und anorganischem Phosphat hydrolysiert. Amprenavir wird hauptsächlich über die Leber metabolisiert, nur ca. 1% der eingenommenen Dosis wird in unveränderter Form mit dem Urin ausgeschieden. Der Abbau über das Enzym Cytochrom-P450 CYP3A4 stellt den Hauptstoffwechselweg dar. Die Verstoffwechselung von Amprenavir wird durch Ritonavir über die Inhibierung von CYP3A4 gehemmt mit der Folge erhöhter Plasmakonzentrationen von Amprenavir. Zusätzlich ist Amprenavir auch ein Hemmstoff des CYP3A4-Enzyms, allerdings in geringerem Ausmass als Ritonavir. Daher müssen Arzneimittel, die CYP3A4 induzieren, inhibieren oder ein Substrat für CYP3A4 darstellen, bei gleichzeitiger Gabe von Telzir mit Ritonavir mit Vorsicht angewendet werden (vgl. «Kontraindikationen» und «Interaktionen»).
Elimination
Nach Einnahme von Telzir beträgt die Eliminationshalbwertszeit von Amprenavir 7,7 Stunden. Wenn Telzir zusammen mit Ritonavir gegeben wird, wird die Eliminationshalbwertszeit von Amprenavir auf 15 bis 23 Stunden verlängert.
Die Elimination von Amprenavir erfolgt hauptsächlich über den Leberstoffwechsel, weniger als 1% werden unverändert im Urin ausgeschieden, in den Faeces ist Amprenavir nicht nachweisbar. Ca. 14% der gegebenen Amprenavir-Dosis werden in Form von Metaboliten mit dem Urin und ca. 75% mit den Faeces ausgeschieden.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Fosamprenavir ist ein Prodrug, das beim Menschen zum aktiven Amprenavir umgewandelt wird. Der Hauptweg der Elimination von Amprenavir und Ritonavir führt über den Leberstoffwechsel.
Die Pharmakokinetik von Amprenavir im Plasma wurde in einer Studie an HIV-infizierten erwachsenen Patienten mit Leberfunktionsstörung (Child Pugh A, B und C) untersucht und mit jener bei HIV-Patienten mit normaler Leberfunktion als Kontrolle verglichen. Die Patienten erhielten über 2 Wochen eine Kombinationstherapie aus Fosamprenavir und Ritonavir, wobei die Ritonavir-Dosis bei Patienten mit Leberfunktionsstörung auf einmal täglich 100mg reduziert war.
Dabei wiesen Patienten mit leichter Leberfunktionsstörung gegenüber Lebergesunden eine um 17% höhere Cmax, eine um 22% höhere AUC0-t sowie vergleichbare trough-Konzentrationen auf.
Patienten mit mittelschwerer Leberfunktionsstörung wiesen gegenüber Patienten mit normaler Leberfunktion eine um ca. 70% höhere AUC bei ebenfalls vergleichbaren trough-Konzentrationen auf.
Patienten mit schwerer Leberfunktionsstörung (Child Pugh Score 10-13) wiesen mit 2x täglich 300 mg Fosamprenavir und 1x täglich 100 mg Ritonavir gegenüber Patienten mit normaler Leberfunktion unter 2x täglich 700 mg Fosamprenavir und 2x täglich 100 mg Ritonavir eine um 19% tiefere Plasma Amprenavir Cmax, eine um 23% tiefere AUC (0-τ) und um 38% tiefere Cτ-Werte bei vergleichbaren ungebundenen Plasma Amprenavir Cτ-Werten auf. Trotz Reduktion der Dosierungsfrequenz von Ritonavir wiesen die Patienten mit schwerer Leberfunktionsstörung eine um 64% höhere Ritonavir Cmax, eine um 40% höhere mittlere Ritonavir Plasmakonzentration (Cavg) und eine um 38% höhere Ritonavir Cτ auf als Patienten mit normaler Leberfunktion unter Fosamprenavir 700 mg / Ritonavir 100 mg 2x täglich.
Nierenfunktionsstörungen
Patienten mit Nierenfunktionsstörungen wurden nicht speziell untersucht. Weniger als 1% der therapeutischen Dosis von Amprenavir wird unverändert im Urin ausgeschieden. Auch ist die renale Clearance von Ritonavir vernachlässigbar, daher dürfte die Auswirkung einer Nierenfunktionsstörung auf die Elimination von Amprenavir und Ritonavir gering sein.
Ältere Patienten
Die Pharmakokinetik von Fosamprenavir in Kombination mit Ritonavir wurde bei Patienten über 65 Jahren nicht untersucht.
Kinder und Jugendliche
In einer klinischen Studie zur Pharmakokinetik von Fosamprenavir bei pädiatrischen Patienten erhielten 8 Testpersonen im Alter von 12 bis 18 Jahren die bei Erwachsenen übliche Fosamprenavir-Tablettendosis von 700 mg zweimal täglich (mit 100 mg Ritonavir zweimal täglich). Im historischen Vergleich zu erwachsenen Patienten, die Fosamprenavir / Ritonavir 700 mg / 100 mg zweimal täglich erhielten, lagen bei den Testpersonen im Alter von 12 bis 18 Jahren die AUC(0-24)-Werte von APV im Plasma um 20 %, die Cmax- um 23 % und die Cmin-Werte um 20 % niedriger. Bei Kindern im Alter von 6 bis 11 Jahren (n=9), die Fosamprenavir / Ritonavir 18 / 3 mg/kg zweimal täglich erhielten, lagen die AUC(0-24)-Werte um 26 % höher bei ähnlichen Werten für Cmax- und Cmin im historischen Vergleich zu erwachsenen Patienten, die Fosamprenavir / Ritonavir 700 mg / 100 mg zweimal täglich erhielten.
APV20002 ist eine offene Phase-II-Studie über 48 Wochen zur Untersuchung der Pharmakokinetik, Sicherheit, Verträglichkeit und antiviralen Aktivität von Fosamprenavir mit und ohne Ritonavir bei
pädiatrischen Testpersonen im Alter von 4 Wochen bis zu < 2 Jahren. Im historischen Vergleich zu erwachsenen Patienten, die Fosamprenavir / Ritonavir 700 mg / 100 mg zweimal täglich erhielten, wurde bei einer Untergruppe von 5 Testpersonen im Alter von 6 bis < 24 Monaten, die Fosamprenavir / Ritonavir 45 / 7 mg/kg zweimal täglich erhielten, gezeigt, dass trotz eines ungefähr fünffachen Anstiegs der Dosen von Fosamprenavir / Ritonavir, bezogen auf mg/kg-Basis, die AUC(0-τ) von
Fosamprenavir im Plasma um ungefähr 48 %, Cmax um 26 % und Cτ um 29 % bei den pädiatrischen Testpersonen niedriger lagen. Daher können für sehr kleine Kinder (Kinder < 2 Jahre) keine Dosisempfehlungen gegeben werden, auch wird Telzir mit Ritonavir nicht für diese Patientengruppe empfohlen (siehe «Dosierung / Anwendung»).
Schwangerschaft
Die Pharmakokinetik von Amprenavir (APV) wurde an schwangeren Frauen untersucht, die während des zweiten Trimenons (n=6) oder dritten Trimenons (n=9) und während der postpartalen Phase mit FPV/RTV 700/100 mg zweimal täglich behandelt wurden. Die Exposition gegenüber APV fiel während der Schwangerschaft um 25-35% niedriger aus. Die geometrischen Mittelwerte von APV (95%-KI) und Ctau-Werte lagen für das zweite Trimenon bei 1,31 (0,97; 1,77), für das dritte Trimenon bei 1,34 (0,95; 1,89) und für die postpartale Phase bei 2,03 (1,46; 2,83) μg/ml und befanden sich innerhalb des Wertebereichs bei nicht-schwangeren Patienten unter verschiedenen FPV/RTV-haltigen Therapieregimen. Eine geringe bis mittelgradige Plazentagängigkeit wurde beobachtet. Diese Schlussfolgerung basierte auf einem Verhältnis der Kleinstquadratmittelwerte von APV (95%-KI) hinsichtlich der Konzentration im fetalen Nabelschnurblut zur Konzentration im maternalen peripheren Plasma von 0,27 (0,24; 0,30).
Präklinische Daten
Die Toxizität von Fosamprenavir war der von Amprenavir ähnlich und trat bei Amprenavir-Plasmaspiegeln auf, die unterhalb der Humanexposition lagen, die nach Behandlung mit Fosamprenavir in Kombination mit Ritonavir in den empfohlenen Dosierungen erreicht wird.
In Studien mit wiederholter Anwendung an ausgewachsenen Ratten und Hunden induzierte Fosamprenavir Anzeichen gastrointestinaler Störungen (Speichelfluss, Erbrechen und weiche bis wässrige Stühle) und hepatische Veränderungen (erhöhte Lebergewichte, erhöhte Aktivität von Leberenzymen im Serum und mikroskopische Veränderungen einschliesslich hepatischer Nekrose).
Im Übrigen wurde eine starke pH Abhängigkeit der Resorption von Fosamprenavir bei Hunden beobachtet. Eine Senkung des gastralen pHs führte zu einer deutlich höheren Bioverfügbarkeit nach oraler Gabe.
Mutagenität
Fosamprenavir erwies sich als weder mutagen noch genotoxisch in einer Reihe von In-vitro- und In-vivo-Assays. Bei diesen Assays handelte es sich u.a. um Rückmutationsassays bei Bakterien (Ames), Mauslymphomtests, Ratten-Mikronukleustests und chromosomale Aberrationstests mit Humanlymphozyten.
Karzinogenität
Im Rahmen von Langzeit-Karzinogenitätsstudien wurde Fosamprenavir bis zu 104 Wochen in einer Dosierung von 250, 400 oder 600 mg/kg KG/Tag an Mäuse und in einer Dosierung von 300, 825 oder 2250 mg/kg KG/Tag an Ratten oral verabreicht. Die bei diesen Dosierungen erreichten Expositionen entsprachen dem 0,1- bis 0,3-fachen (bei Mäusen) bzw. dem 0,3- bis 0,7-fachen (bei Ratten) der Humanexposition bei einer Tagesdosis von Fosamprenavir 1400 mg plus Ritonavir 200 mg. Daraus resultierte eine Steigerung der Häufigkeit von hepatozellulären Adenomen und hepatozellulären Karzinomen bei allen Dosierungen bei den männlichen Mäusen, eine Steigerung der Häufigkeit von hepatozellulären Adenomen und Schilddrüsen-Follikelzellkarzinomen bei allen Dosierungen bei männlichen Ratten und bei den Dosierungen 825 und 2250 mg/kg KG/Tag bei weiblichen Ratten. Die Relevanz der Leberzellbefunde bei den Nagetieren für den Menschen ist ungewiss, doch liegen aus den klinischen Studien oder den Erfahrungsberichten keine Hinweise vor, die für eine klinische Signifikanz dieser Befunde sprechen. Bei Studien mit wiederholter Verabreichung von Fosamprenavir bei Ratten glichen die Effekte denen einer Enzyminduktion, die bei Ratten, aber nicht beim Menschen, zur Prädisposition für Schilddrüsenneoplasmen führt. Darüber hinaus war ebenfalls nur bei Ratten eine vermehrte interstitielle Zellhyperplasie bei den Dosierungen 825 und 2250 mg/kg KG/Tag festzustellen sowie vermehrte Adenokarzinome im Uterusendometrium bei einer Dosierung von 2250 mg/kg KG/Tag. Die Inzidenz von Positivbefunden im Endometrium war geringfügig höher als bei mitgeführten Kontrollen, lag aber im Bereich des normalen Bereichs für Rattenweibchen. Die Relevanz der Adenokarzinombefunde im Uterusendometrium bei Ratten für den Menschen ist ungewiss, doch liegen aus den klinischen Studien oder den Erfahrungsberichten keine Hinweise vor, die für eine klinische Signifikanz dieser Befunde sprechen.
Reproduktionstoxizität
In Studien zur Reproduktionstoxizität mit Fosamprenavir bei Ratten wurde kein Einfluss auf die männliche Fertilität beobachtet, jedoch waren bei trächtigen weiblichen Tieren die Uterusgewichte, die Zahl der ovariellen Gelbkörperchen und der Implantationsstellen verringert. Bei trächtigen Ratten und Kaninchen wurden keine schwerwiegenden Wirkungen auf die embryo-fetale Entwicklung beobachtet. Jedoch war die Zahl der Aborte erhöht. Bei Kaninchen lag die systemische Exposition in der Hochdosisgruppe bei nur dem 0,3-Fachen der menschlichen Exposition nach Gabe der maximalen klinischen Dosis, daher konnten toxische Effekte von Fosamprenavir auf die Entwicklung nicht vollständig bestimmt werden. Bei prä- und postnatal gegenüber Fosamprenavir exponierten Ratten zeigten die Jungtiere eine eingeschränkte physische und funktionelle Entwicklung und ein verringertes Wachstum. Die Überlebensrate der Jungtiere war verringert. Ferner wurden eine verringerte Zahl von Implantationsstellen pro Wurf und eine Verlängerung der Gestation nach der Paarung der Jungtiere nach Erreichen der Geschlechtsreife beobachtet.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Gut verschlossen, unter 30°C und ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
56'707 (Swissmedic).
Packungen
Filmtabletten zu 700 mg: Flasche zu 60 Tabletten (A)
Zulassungsinhaberin
ViiV Healthcare GmbH, 3053 Münchenbuchsee
Stand der Information
Juli 2023