Zusammensetzung
Wirkstoffe
Pregabalinum.
Hilfsstoffe
Hartkapsel zu 25 mg: lactosum monohydricum (35 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, natrii laurilsulfas (E487, corresp. 0,006 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 50 mg: lactosum monohydricum (70 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, natrii laurilsulfas (E487, corresp. 0,008 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 75 mg: lactosum monohydricum (8,25 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, ferrum oxydatum rubrum, natrii laurilsulfas (E487, corresp. 0,006 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 100 mg: lactosum monohydricum (11 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, ferrum oxydatum rubrum, natrii laurilsulfas (E487, corresp. 0,008 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 150 mg: lactosum monohydricum (16,50 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, natrii laurilsulfas (E487, corresp. 0,010 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 200 mg: lactosum monohydricum (22 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, ferrum oxydatum rubrum, natrii laurilsulfas (E487, corresp. 0,012 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Hartkapsel zu 300 mg: lactosum monohydricum (33 mg), maydis amylum, talcum, gelatina, aqua, titanii dioxidum, ferrum oxydatum rubrum, natrii laurilsulfas (E487, corresp. 0,015 mg natrium), silica colloidalis anhydrica, lacca, ferrum oxydatum nigrum, propylenglycolum (E1520), hydroxidum kalii.
Indikationen/Anwendungsmöglichkeiten
Neuropathische Schmerzen
Lyrica wird angewendet zur Behandlung peripherer und zentraler neuropathischer Schmerzen im Erwachsenenalter.
Belegt wurde in klinischen Studien die Wirksamkeit von Pregabalin gegen neuropathische Schmerzen bei diabetischer Neuropathie, postherpetischer Neuralgie und Rückenmarksverletzung (als Modell für zentralen neuropathischen Schmerz) (siehe «Eigenschaften/Wirkungen», Klinische Wirksamkeit).
Epilepsie
Lyrica wird zur Zusatztherapie von partiellen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten im Erwachsenenalter angewendet, die auf andere Antiepileptika ungenügend ansprechen.
Generalisierte Angststörungen
Lyrica wird angewendet zur Behandlung von generalisierten Angststörungen im Erwachsenenalter.
Dosierung/Anwendung
Die Dosis liegt zwischen 150 und 600 mg täglich, verabreicht in zwei bis drei Einzeldosen.
Pregabalin kann während oder zwischen den Mahlzeiten eingenommen werden.
Neuropathische Schmerzen
|
Therapiebeginn |
150 mg pro Tag (2x täglich 75 mg oder 3x täglich 50 mg) |
Abhängig von der individuellen Verträglichkeit und Wirksamkeit kann die Dosis nach 3 bis 7 Tagen auf 300 mg täglich, verabreicht in zwei oder drei Einzeldosen, erhöht werden. Bei Bedarf kann die Dosis nach weiteren 7 Tagen auf eine Höchstdosis von 600 mg täglich gesteigert werden.
In klinischen Studien bei diabetischer Polyneuropathie waren Dosen von 300 mg und 600 mg dem Placebo signifikant überlegen.
In klinischen Studien bei postherpetischer Neuralgie waren Dosen von 150 mg, 300 mg und 600 mg dem Placebo signifikant überlegen.
Epilepsie
|
Therapiebeginn |
150 mg pro Tag (2x täglich 75 mg oder 3x täglich 50 mg) |
Abhängig von der individuellen Verträglichkeit und Wirksamkeit, kann die Dosis nach einer Woche auf 300 mg täglich, verabreicht in zwei oder drei Einzeldosen, erhöht werden. Die weitere Aufdosierung auf die Höchstdosis von 600 mg täglich, verteilt auf zwei oder drei Einzeldosen, kann ebenfalls nach einer weiteren Woche erfolgen.
Bei Patienten mit partiellen Anfällen waren Dosen von 300 mg und 600 mg dem Placebo signifikant überlegen.
Bei Patienten mit sekundärer Generalisierung der Anfälle war nur die Höchstdosis von 600 mg dem Placebo signifikant überlegen.
Eine Bestimmung der Pregabalin-Konzentrationen im Plasma ist nicht notwendig, um die Pregabalin-Therapie zu optimieren.
Generalisierte Angststörungen
|
Therapiebeginn |
150 mg pro Tag (2x täglich 75 mg oder 3x täglich 50 mg) |
Abhängig vom klinischen Ansprechen und der individuellen Verträglichkeit kann die Dosis nach einer Woche auf 300 mg täglich erhöht werden. Nach einer weiteren Woche kann die Dosis auf 450 mg täglich gesteigert werden. Die Höchstdosis von 600 mg täglich kann nach einer weiteren Woche erreicht werden.
Absetzen von Pregabalin
In Übereinstimmung mit der gängigen klinischen Praxis wird empfohlen, beim Absetzen von Pregabalin unabhängig von der Indikation die Dosis ausschleichend über einen Zeitraum von mindestens einer Woche zu verringern.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung nötig (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Pregabalin wird aus dem Blutkreislauf hauptsächlich unverändert über die Niere ausgeschieden. Da die Pregabalin-Clearance direkt proportional zur Kreatinin-Clearance ist (siehe «Pharmakokinetik»), muss die Dosisreduktion bei Patienten mit eingeschränkter Nierenfunktion individuell an die Kreatinin-Clearance (CLcr) angepasst werden. Die in Tabelle 1 angegebenen Werte errechnen sich nach der folgenden Formel:
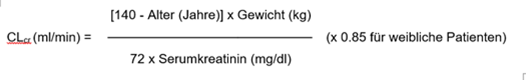
Bei Patienten mit stark eingeschränkter Nierenfunktion (CLcr <30 ml/min) sollte Pregabalin nicht angewendet werden.
Tabelle 1: Anpassung der Pregabalin-Dosis in Abhängigkeit von der Nierenfunktion
|
Kreatinin-Clearance (CLcr) (ml/min) |
Gesamttagesdosis von Pregabalin* |
Dosisaufteilung | |
|
|
Anfangsdosis (mg/Tag) |
Höchstdosis (mg/Tag) |
|
|
≥60 |
150 |
600 |
in 2 oder 3 Einzeldosen |
|
30-60 |
75 |
300 |
in 2 oder 3 Einzeldosen |
* Die Gesamttagesdosis (mg/Tag) sollte je nach der angegebenen Dosisaufteilung geteilt werden, um mg/Dosis zu erhalten.
Ältere Patienten
Bei älteren Patienten (über 65 Jahren) ist eine Dosisanpassung nur notwendig, wenn eine eingeschränkte Nierenfunktion vorliegt (siehe Tabelle 1).
Kinder und Jugendliche
Die Unbedenklichkeit und Wirksamkeit von Pregabalin bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht. Die Anwendung von Lyrica in diesen Altersgruppen kann deshalb nicht empfohlen werden.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe (siehe «Zusammensetzung»).
Warnhinweise und Vorsichtsmassnahmen
Die Sicherheit von Pregabalin bei schwerer Niereninsuffizienz ist nicht untersucht worden.
Die Sicherheit von Pregabalin bei Patienten mit Leberfunktionsstörungen ist nicht geprüft worden (siehe «Pharmakokinetik»).
Nierenversagen
Es wurden Fälle von Nierenversagen berichtet. Obwohl die Auswirkungen eines Therapieabbruchs auf die Reversibilität einer Niereninsuffizienz nicht systematisch untersucht wurden, gab es Berichte über eine Verbesserung der Nierenfunktion nach Absetzen oder nach einer Dosisreduktion von Pregabalin.
Herzinsuffizienz
Bei Patienten mit Herzinsuffizienz wurde Pregabalin nicht untersucht, deshalb könnte sich die ödemfördernde Wirkung von Pregabalin bei diesen Patienten ungünstig auswirken.
Es gibt Post-Marketing Berichte über Herzinsuffizienz bei einigen Patienten, die Pregabalin erhalten haben. Diese Reaktionen sind hauptsächlich bei älteren, kardiovaskulär beeinträchtigten Patienten während der Behandlung mit Pregabalin bei einer neuropathischen Indikation zu beobachten. Pregabalin sollte bei diesen Patienten mit Vorsicht angewendet werden (siehe «Unerwünschte Wirkungen»). Bei Kurzzeit-Therapien von Patienten ohne klinisch signifikante Herz- oder periphere Gefässkrankheiten war ein Zusammenhang zwischen peripheren Ödemen und kardiovaskulären Komplikationen wie Hypertonie oder Herzinsuffizienz nicht erkennbar.
Diabetes-Patienten
Bei einigen Diabetes-Patienten, bei denen es unter einer Pregabalin-Therapie zu einer Gewichtszunahme kommt, kann es notwendig werden, die antidiabetische Medikation entsprechend anzupassen.
Überempfindlichkeitsreaktionen
Im Rahmen der Post-Marketing-Erfahrung wurde über Überempfindlichkeitsreaktionen, einschliesslich Fälle von Angioödemen, berichtet. Pregabalin muss sofort abgesetzt werden, falls Symptome eines Angioödems auftreten, wie Schwellungen im Gesicht, im Mundbereich oder der oberen Atemwege.
Schwere arzneimittelinduzierte Hautreaktionen (SCARs, severe cutaneous adverse reactions)
Es wurde über seltene Fälle von schweren arzneimittelinduzierten Hautreaktionen (SCARs), einschliesslich Stevens-Johnson-Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN), die lebensbedrohlich oder tödlich verlaufen können, im Zusammenhang mit Pregabalin-Behandlungen berichtet. Die Patienten sollten zum Zeitpunkt der Verschreibung von Pregabalin auf Anzeichen und Symptome hingewiesen und engmaschig auf Hautreaktionen hin überwacht werden. Wenn Anzeichen und Symptome auftreten, die auf arzneimittelinduzierten Hautreaktionen hinweisen, soll die Behandlung mit Pregabalin unverzüglich beendet und eine alternative Behandlung erwogen werden.
Sehbeeinträchtigungen
In kontrollierten Studien haben mehr Patienten unter Pregabalin über verschwommenes Sehen berichtet als Patienten, die Placebo erhielten. In der Mehrzahl der Fälle verschwand diese Nebenwirkung wieder bei fortgesetzter Behandlung. In kontrollierten klinischen Studien wurden bei mehr als 3600 Patienten augenärztliche Untersuchungen durchgeführt (einschliesslich Untersuchungen der Sehschärfe und des Gesichtsfelds, sowie ausführliche Fundoskopie). Unter diesen Patienten war die Sehschärfe bei 6,5% der mit Pregabalin behandelten Patienten verringert, im Vergleich zu 4,8% bei den mit Placebo behandelten Patienten. Eine Veränderung des Gesichtsfelds wurde bei 12,4% der mit Pregabalin behandelten Patienten und bei 11,7% der mit Placebo behandelten Patienten festgestellt. Zu fundoskopischen Veränderungen kam es bei 1,7% der mit Pregabalin behandelten Patienten und bei 2,1% der mit Placebo behandelten Patienten.
Auch in den Erfahrungen nach Markteinführung wurde über Nebenwirkungen am Auge berichtet. Zumeist betraf dies ein vorübergehend verschwommenes Sehen oder andere Veränderungen der Sehschärfe. Absetzen von Pregabalin kann hier zu einem Verschwinden oder einer Verbesserung dieser visuellen Symptome führen.
Enzephalopathie
Fälle einer Enzephalopathie wurden berichtet, meistens bei Patienten mit zugrunde liegenden Bedingungen, die eine Enzephalopathie herbeiführen können.
Benommenheit, Schläfrigkeit, Bewusstseinsverlust, Verwirrtheit und geistige Beeinträchtigung
Eine Behandlung mit Pregabalin wurde mit Benommenheit und Schläfrigkeit in Verbindung gebracht. Dies kann bei älteren Patienten zu einem vermehrten Auftreten von Unfallverletzungen (Stürze) führen. Es gab auch Post-Marketing-Berichte über Bewusstseinsverlust, Verwirrtheit und Beeinträchtigung des geistigen Zustandes. Deshalb sollte den Patienten geraten werden vorsichtig zu sein, bis sie mit den potenziellen Effekten des Arzneimittels vertraut sind.
Absetzen antiepileptischer Begleitbehandlung
Es liegen keine hinreichenden Daten über das Absetzen der antiepileptischen Begleitbehandlung zur Erreichung einer Monotherapie mit Pregabalin vor, wenn unter Pregabalin als Zusatztherapie eine Anfallskontrolle erreicht wurde.
Entzugssymptome
Nach Absetzen einer Kurzzeit- oder Langzeit-Therapie von Pregabalin wurden bei einigen Patienten Entzugssymptome beobachtet. Die folgenden Ereignisse wurden berichtet: Schlafstörungen, Kopfschmerzen, Übelkeit, Durchfall, Grippesymptome, Nervosität, Depressionen, Angstgefühl, Schmerzen, Konvulsionen, Schwitzen und Schwindel (siehe «Unerwünschte Wirkungen»). Das Auftreten von Entzugssymptomen nach Absetzen von Pregabalin kann auf eine Arzneimittelabhängigkeit hinweisen (siehe «Nicht bestimmungsgemässer Gebrauch, schädlicher Gebrauch und Abhängigkeit»). Der Patient sollte zu Beginn der Behandlung hierüber informiert werden.
Im Falle des Absetzens von Pregabalin wird empfohlen, dies schrittweise über einen Zeitraum von mindestens 1 Woche zu tun, unabhängig von der Indikation.
In Bezug auf das Absetzen einer Langzeitbehandlung mit Pregabalin deuten die Daten darauf hin, dass das Auftreten und der Schweregrad der Entzugssymptome dosisabhängig sein können.
Genaue Angaben zu Häufigkeit und Schwere der beobachteten Entzugssymptome in Abhängigkeit von Behandlungsdauer und Dosierung nach Absetzen einer Langzeitbehandlung von Pregabalin sind auf Basis der aktuellen Studienlage nicht möglich.
Nicht bestimmungsgemässer Gebrauch, schädlicher Gebrauch und Abhängigkeit
Fälle von nicht bestimmungsgemässem Gebrauch, schädlichem Gebrauch und Abhängigkeit wurden berichtet, die auch unter therapeutischen Dosierungen auftreten können. Besonders bei Patienten mit schädlichem Gebrauch von Substanzen einschliesslich Arzneimitteln (aktuell und/oder in der Vorgeschichte) ist Vorsicht geboten, da bei diesen ein höheres Risiko für einen schädlichen Gebrauch von Pregabalin besteht (siehe «Eigenschaften/Wirkungen»).
Dies gilt auch für Patienten mit psychischen Erkrankungen in der Vorgeschichte.
Vor der Verordnung von Pregabalin soll das individuelle Risiko des Patienten hinsichtlich des nicht bestimmungsgemässen Gebrauchs, schädlichen Gebrauchs, und/oder der Abhängigkeit sorgfältig evaluiert werden.
Mit Pregabalin behandelte Patienten sollten hinsichtlich Anzeichen und Symptome eines schädlichen Gebrauchs, nicht bestimmungsgemässen Gebrauchs oder einer Abhängigkeit von Pregabalin (z.B. Toleranzentwicklung, Dosis-Eskalation, «drug-seeking behaviour») überwacht werden (siehe «Unerwünschte Wirkungen»).
Suizidale Gedanken und suizidales Verhalten
Über suizidale Gedanken und suizidales Verhalten wurde bei Patienten, die mit Antiepileptika in verschiedenen Indikationen behandelt wurden, berichtet. Eine Metaanalyse randomisierter, Placebo-kontrollierter Studien mit Antiepileptika zeigte auch ein leicht erhöhtes Risiko für das Auftreten von Suizidgedanken und suizidalem Verhalten. Eine epidemiologische Studie ergab im intraindividuellen Vergleich ein erhöhtes Risiko für Suizidgedanken und Tod durch Suizid während der Einnahme von Pregabalin gegenüber Zeiten ohne Pregabalin v.a. in der Altersgruppe unter 55 Jahren.
Der Mechanismus für die Auslösung dieser Nebenwirkung ist nicht bekannt und die verfügbaren Daten schliessen die Möglichkeit eines erhöhten Risikos bei der Einnahme von Pregabalin nicht aus.
Deshalb sollten Patienten hinsichtlich Anzeichen von Suizidgedanken und suizidalen Verhaltensweisen überwacht und eine geeignete Behandlung in Erwägung gezogen werden. Das Beenden der Therapie mit Pregabalin sollte beim Auftreten von Suizidgedanken und suizidalem Verhalten in Betracht gezogen werden. Patienten (und deren Betreuer) sollte geraten werden medizinische Hilfe einzuholen, wenn Anzeichen für Suizidgedanken oder suizidales Verhalten auftreten.
Behandlung von zentralen neuropathischen Schmerzen aufgrund einer Rückenmarkverletzung
Bei der Behandlung von zentralen neuropathischen Schmerzen bei Rückenmarksverletzung war die Häufigkeit von Nebenwirkungen im Allgemeinen, von zentralnervösen Nebenwirkungen und hier insbesondere der Schläfrigkeit, erhöht. Dies beruht möglicherweise auf einem additiven Effekt aufgrund der benötigten Komedikation (z.B. Spasmolytika). Dies sollte beachtet werden, wenn Pregabalin zur Therapie dieser Erkrankung verschrieben wird.
Atemdepression
Über schwere Atemdepression wurde in Verbindung mit der Anwendung von Pregabalin berichtet. Patienten mit beeinträchtigter Atemfunktion, Atemwegs- oder neurologischen Erkrankungen, Niereninsuffizienz sowie Patienten, die gleichzeitig ZNS-dämpfende Arzneimittel anwenden, und ältere Patienten könnten ein höheres Risiko für diese schwere Nebenwirkung haben. Für diese Patienten muss die Dosis gegebenenfalls angepasst werden (siehe «Dosierung/Anwendung»).
Gleichzeitige Anwendung mit Opiaten
Vorsicht ist angezeigt, falls Pregabalin zusammen mit Opiaten verschrieben wird, da das Risiko einer ZNS-Dämpfung besteht. In einer Fall-Kontroll-Studie mit Opioidanwendern bestand bei Patienten, die Pregabalin gleichzeitig mit einem Opioid einnahmen, ein erhöhtes Risiko für opioidbedingte Todesfälle im Vergleich zur alleinigen Anwendung von Opioiden (angepasstes Quotenverhältnis [adjusted odds ratio, aOR], 1,68 [95%-KI, 1,19 bis 2,36]). Dieses erhöhte Risiko wurde bereits bei niedrigen Dosen von Pregabalin beobachtet (≤300 mg, aOR 1,52 [95%-KI, 1,04 bis 2,22]), es ergab sich aber ein noch höheres Risiko bei hohen Dosen von Pregabalin (>300 mg, aOR 2,51 [95%-KI, 1,24 bis 5,06]).
Verringerte Funktionalität des unteren Gastrointestinaltrakts
Nach Markteinführung wurden Fälle von verringerter Funktionalität des unteren Gastrointestinaltrakts berichtet (z.B. Darmobstruktion, paralytischer Ileus, Obstipation), wenn Pregabalin zusammen mit Medikamenten gegeben wurde, die wie Opioidanalgetika Obstipationen verursachen können (siehe «Interaktionen»). Wenn Pregabalin und Opioide in Kombination angewendet werden, sollten Massnahmen zur Vermeidung der Verstopfung erwogen werden (insbesondere bei weiblichen und älteren Patienten).
Frauen in gebärfähigem Alter/Kontrazeption
Die Anwendung von Pregabalin während des ersten Trimenons kann schwere Missbildungen (definiert gemäss European Surveillance of Congenital Anomalies (EUROCAT) Version 2014) beim ungeborenen Kind verursachen und die postnatale neurologische Entwicklung sowie das Geburtsgewicht negativ beeinflussen. Pregabalin soll während der Schwangerschaft nicht angewendet werden, es sei denn, der Nutzen für die Mutter überwiegt eindeutig das potenzielle Risiko für den Fötus. Frauen im gebärfähigen Alter müssen während der Behandlung wirksame Kontrazeptionsmethoden anwenden (siehe «Schwangerschaft, Stillzeit»).
Hilfsstoffe von besonderem Interesse
Lyrica enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Lyrica nicht einnehmen.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Hartkapsel, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pregabalin wird hauptsächlich unverändert über die Niere ausgeschieden und beim Menschen praktisch nicht metabolisiert (<2% einer Dosis finden sich als Metaboliten im Urin wieder). Pregabalin behindert in vitro den Metabolismus von Arzneimitteln nicht und wird nicht an Plasmaproteine gebunden. Daher ist es unwahrscheinlich, dass Pregabalin pharmakokinetische Wechselwirkungen hervorruft oder diesen unterliegt.
Demzufolge wurden in in-vivo-Studien keine klinisch relevanten pharmakokinetischen Wechselwirkungen zwischen Pregabalin und Phenytoin, Carbamazepin, Valproinsäure, Lamotrigin, Gabapentin, Lorazepam, Oxycodon oder Ethanol beobachtet. Zudem haben Analysen gezeigt, dass die drei häufig verwendeten Arzneimittelklassen orale Antidiabetika, Diuretika und Insulin sowie die häufig eingesetzten Antiepileptika Phenytoin, Carbamazepin, Valproinsäure, Lamotrigin, Phenobarbital, Tiagabin und Topiramat keinen klinisch relevanten Einfluss auf die Clearance von Pregabalin haben. Ebenso haben diese Analysen gezeigt, dass Pregabalin keinen klinisch relevanten Einfluss auf die Clearance von Phenytoin, Carbamazepin, Valproinsäure, Lamotrigin, Topiramat und Phenobarbital hat.
Die gleichzeitige Verabreichung von Pregabalin und oralen Norethisteron- und/oder Ethinylestradiol-haltigen Kontrazeptiva hat keinen Einfluss auf den Steady-state dieser Substanzen.
Pregabalin kann die Wirkung von Ethanol und Lorazepam verstärken. In kontrollierten klinischen Studien hatten orale Mehrfachdosen von Pregabalin, die gleichzeitig mit Oxycodon, Lorazepam und Ethanol verabreicht wurden, keinen klinisch relevanten Einfluss auf die Atmung.
Bei Patienten, welche Pregabalin und andere ZNS-dämpfende Arzneimittel (insbesondere Opioide) einnahmen, einschliesslich drogenabhängigen Patienten, wurde im Rahmen der Post-Marketing-Erfahrung über respiratorische Insuffizienz, Koma und Todesfälle berichtet.
Eine durch Oxycodon hervorgerufene Beeinträchtigung der kognitiven und grobmotorischen Funktionen scheint durch Pregabalin noch verstärkt zu werden.
Bei gleichzeitiger Verabreichung von Pregabalin und Arzneimitteln, welche eine Obstipation verursachen können (z.B. Opioide), wurde im Rahmen der Post-Marketing-Erfahrung über eingeschränkte Funktion des unteren Gastrointestinaltrakts berichtet (z.B. Ileus, paralytischer Ileus, Obstipation).
Es wurden keine spezifischen Studien zur Pharmakodynamik bei älteren Probanden durchgeführt.
Schwangerschaft, Stillzeit
Schwangerschaft
Es gibt eine begrenzte Menge an Daten zur Anwendung von Pregabalin bei schwangeren Frauen.
Daten aus einer Beobachtungsstudie mit über 2700 Expositionen gegenüber Pregabalin während der Schwangerschaft aus routinemässig erhobenen Daten aus Verwaltungs- und Gesundheitsregistern in Dänemark, Finnland, Norwegen und Schweden lassen nicht auf ein wesentlich erhöhtes Risiko für schwere kongenitale Missbildungen (definiert gemäss European Surveillance of Congenital Anomalies (EUROCAT) Version 2014), unerwünschte Geburtsergebnisse (z.B. Totgeburten), oder eine abnorme postnatale neurologische Entwicklung nach einer Pregabalin-Exposition während der Schwangerschaft schliessen (siehe unten).
Schwere kongenitale Missbildungen (definiert gemäss European Surveillance of Congenital Anomalies (EUROCAT) Version 2014)
Die adjustierten Prävalenzraten (aPR) und 95%-Konfidenzintervalle (KI) in den Standard-Metaanalysen betrugen bei Schwangerschaften mit Pregabalin-Exposition in Monotherapie für das erste Trimenon gegenüber Schwangerschaften ohne Exposition gegenüber Antiepileptika 1,14 (0,96-1,35).
Geburtsergebnisse und postnatale neurologische Entwicklungsstörungen
Es wurden keine statistisch signifikanten Ergebnisse bezüglich Totgeburt, niedrigem Geburtsgewicht, Frühgeburt, Klein für das Gestationsalter (d.h. Neugeborene mit im unteren Bereich der Normalverteilung für das entsprechende Reifealter liegenden Geburtsgewicht oder Körperlänge), niedrigem Apgar-Score und Mikrozephalie festgestellt.
In der pädiatrischen Population mit bekannter intrauteriner Exposition wurde in der Studie kein erhöhtes Risiko für Aufmerksamkeitsdefizit-Hyperaktivitätsstörung (ADHD), Autismus-Spektrum-Störung (ASD) und intellektuelle Beeinträchtigung nachgewiesen.
Tierversuche ergaben Hinweise auf eine Reproduktionstoxizität (siehe «Präklinische Daten»). Pregabalin soll aus diesen Gründen während der Schwangerschaft nicht angewendet werden, es sei denn, der Nutzen für die Mutter überwiegt eindeutig das potenzielle Risiko für den Fötus. Frauen im gebärfähigen Alter müssen während der Behandlung wirksame Kontrazeptionsmethoden anwenden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stillzeit
Pregabalin tritt in die Muttermilch über (Daten dazu siehe «Pharmakokinetik»). Die Sicherheit von Pregabalin bei Säuglingen ist nicht bekannt, daher wird empfohlen, während der Behandlung nicht zu stillen. Unter Abwägung des Nutzens des Stillens für das Kind einerseits und der Notwendigkeit resp. des Nutzens der Behandlung für die Mutter andererseits sollte entschieden werden, ob entweder abgestillt oder die Behandlung während der Stillzeit unterbrochen wird.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Pregabalin kann Benommenheit und Schläfrigkeit hervorrufen. Deshalb wird Patienten nicht empfohlen, Auto zu fahren, komplexe Maschinen zu bedienen oder andere potenziell gefährliche Tätigkeiten auszuführen, solange nicht bekannt ist, ob die Fähigkeit zur Ausübung solcher Tätigkeiten beeinträchtigt wird.
Unerwünschte Wirkungen
Die nachfolgend aufgeführten Nebenwirkungen stammen aus klinischen Studien zu neuropathischen Schmerzen, Epilepsie, generalisierter Angststörung und Fibromyalgie mit über 12'000 Patienten, sowie aus Daten aus der Post-Marketing-Erfahrung.
Die am häufigsten berichteten unerwünschten Ereignisse in den klinischen Studien waren Benommenheit (30,7%), Schläfrigkeit (16,4%), verschwommenes Sehen (6,7%), Mundtrockenheit (8,6%), Verstopfung (5,3%), Fatigue (6,7%), periphere Ödeme (5,7%) und Gewichtszunahme (7,2%). Der Schweregrad der unerwünschten Ereignisse war in der Regel leicht bis mässig.
Bei allen kontrollierten Studien lag die Abbruchrate aufgrund von Nebenwirkungen bei 14% bei Patienten unter Pregabalin und bei 5% bei Patienten unter Placebo. Die häufigsten unerwünschten Ereignisse, die unter Pregabalin zu einem Abbruch der Therapie führten, waren Benommenheit und Schläfrigkeit.
Nachfolgend sind im klinischen Studienprogramm und der Post-Marketing-Erfahrung aufgetretene unerwünschte Wirkungen aufgelistet. Daten aus der Post-Marketing-Erfahrung beschreiben die weltweit spontan gemeldeten, in der Literatur beschriebenen und von den Behörden gemeldeten unerwünschten Wirkungen.
Die Zuordnung zu einer bestimmten Häufigkeitskategorie erfolgt auf Basis kontrollierter Studien.
Die unerwünschten Wirkungen sind geordnet nach Organsystem und Häufigkeit [sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000), nicht bekannt (Häufigkeit kann aus den verfügbaren Daten nicht abgeschätzt werden)] aufgeführt.
Infektionen und parasitäre Erkrankungen
Häufig: Nasopharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Neutropenie, erniedrigte Thrombozytenzahl.
Selten: Erniedrigte Leukozytenzahl.
Erkrankungen des Immunsystems
Nicht bekannt: Hypersensitivität*, Angioödem*, allergische Reaktion*.
Stoffwechsel- und Ernährungsstörungen
Häufig: Gesteigerter Appetit, Gewichtszunahme.
Gelegentlich: Anorexie, Hypoglykämie, Hyperglykämie, Gewichtsverlust, Verschlechterung einer diabetischen Stoffwechsellage.
Psychiatrische Erkrankungen
Häufig: Euphorie, Verwirrung, Reizbarkeit, Depression, Desorientierung, Schlaflosigkeit, verringerte Libido.
Gelegentlich: Halluzinationen, Ruhelosigkeit, Agitiertheit, Niedergeschlagenheit, gehobene Stimmung, Stimmungsschwankungen, Depersonalisation, abnorme Träume, Wortfindungsstörungen, gesteigerte Libido, Anorgasmie.
Selten: Panikattacken, Enthemmung, Apathie.
Nicht bekannt: Schädlicher Gebrauch und Abhängigkeit*, Suizidgedanken*, suizidales Verhalten*, Suizid*.
Erkrankungen des Nervensystems
Sehr häufig: Benommenheit (28%), Schläfrigkeit (15,7%).
Häufig: Ataxie, Koordinationsstörungen, Tremor, Dysarthrie, Amnesie, Gedächtnisstörungen, Aufmerksamkeitsstörungen, Parästhesie, Hypästhesie, Sedierung, Gleichgewichtstörungen, Lethargie.
Gelegentlich: Synkopen, Myoklonus, psychomotorische Hyperaktivität, Dyskinesie, orthostatischer Schwindel, Intentionstremor, Nystagmus, kognitive Störungen, Sprachstörungen, verringerte Reflexe, Hyperästhesie, brennendes Gefühl.
Selten: Stupor, Parosmie, Hypokinesie, Ageusie, Dysgraphie.
Nicht bekannt: Kopfschmerzen*, Bewusstseinsverlust*, Beeinträchtigung des psychischen Zustandes*, Enzephalopathie*.
Augenerkrankungen
Häufig: Verschwommenes Sehen, Diplopie.
Gelegentlich: Verlust des peripheren Sehvermögens («Tunnelblick»), Sehstörungen, geschwollene Augen, Gesichtsfeldausfälle, verminderte Sehschärfe, Augenschmerzen, Schwachsichtigkeit, Photopsie, Augentrockenheit, verstärkter Tränenfluss, Augenreizungen.
Selten: Oszillopsie, verändertes räumliches Sehen, Mydriasis, Strabismus, Lichtempfindlichkeit.
Nicht bekannt: Keratitis*.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Schwindel.
Selten: Hyperakusis.
Herzerkrankungen
Gelegentlich: Tachykardie, AV-Block ersten Grades, Sinusbradykardie.
Selten: Sinustachykardie, Sinusarrhythmie.
Nicht bekannt: Herzinsuffizienz*.
Gefässerkrankungen
Gelegentlich: Hypotonie, Hypertonie, Erröten, Hitzewallungen, kalte Extremitäten.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe, Epistaxis, Husten, verstopfte Nase, Rhinitis, Schnarchen.
Selten: Engegefühl im Hals, trockene Nase.
Nicht bekannt: Lungenödem*, Atemdepression*.
Erkrankungen der Leber und der Gallenwege
Gelegentlich: Erhöhung der Alanin-Aminotransferase und Aspartat-Aminotransferase.
Nicht bekannt: Gelbsucht, Leberversagen, Hepatitis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Vomitus, Obstipation, Flatulenz, Meteorismus, Mundtrockenheit.
Gelegentlich: Gastroösophagealer Reflux, vermehrter Speichelfluss, orale Hypästhesie.
Selten: Aszites, Pankreatitis, Dysphagie.
Nicht bekannt: Nausea*, Diarrhoe*, geschwollene Zunge*, verringerte Funktionalität des unteren Gastrointestinaltraktes*.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Papulöser Ausschlag, Urtikaria, Schwitzen.
Selten: Kalter Schweiss.
Nicht bekannt: Schwellungen im Gesicht*, Pruritus*, schwere arzneimittelinduzierte Hautreaktionen (SCARs, severe cutaneous adverse reactions) einschl. Stevens-Johnson-Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN)*.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelkrämpfe, Arthralgie, Rückenschmerzen, Schmerzen in den Extremitäten, zervikale Spasmen.
Gelegentlich: Gelenkschwellung, Myalgie, Muskelzuckungen, Nackenschmerzen, Muskelsteife, Erhöhung der Kreatininphosphokinase.
Selten: Rhabdomyolyse.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Harninkontinenz, Dysurie.
Selten: Nierenversagen, Oligurie, erhöhte Kreatininwerte.
Nicht bekannt: Harnverhalt*.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Erektile Dysfunktion, Störungen der Sexualfunktion, verzögerte Ejakulation, Dysmenorrhoe.
Selten: Schmerzen in den Brüsten, Amenorrhoe, Absonderungen aus der Brust, Brustvergrösserung.
Nicht bekannt: Gynäkomastie*.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Periphere Ödeme, Ödeme, Stürze, Gangstörungen, Trunkenheitsgefühl, Gefühlsstörung, Erschöpfung.
Gelegentlich: Generalisierte Ödeme, Engegefühl in der Brust, Schmerzen, Fieber, Durst, Frösteln, Asthenie.
Nicht bekannt: Malaise*.
Untersuchungen
Gelegentlich: Hypokaliämie.
* Unerwünschte Wirkungen aus der Post-Marketing-Erfahrung.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Spezialpopulationen
Ältere Patienten (über 65 Jahre)
Die Behandlung mit Pregabalin wurde mit Benommenheit und Schläfrigkeit in Verbindung gebracht, was bei älteren Patienten zum häufigeren Auftreten von sturzbedingten Verletzungen führen könnte.
Patienten mit Diabetes mellitus
In sechs kontrollierten Studien zur Behandlung der diabetischen Neuropathie mit Pregabalin über 5-12 Wochen wurde unter Pregabalin-Behandlung bei 5,2% der diabetischen Patienten eine Gewichtszunahme um mindestens 7% des Körpergewichts beobachtet. Dieser Effekt war dosisabhängig (3,4% unter 150 mg gegenüber 7,5% unter 600 mg Tagesdosis). Die Inzidenz steigt zudem mit der Therapiedauer an und betraf in kontrollierten und unkontrollierten Langzeitstudien bis zu 31,3% der Patienten.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Überdosen (1,7 g bis zu 15 g) wurden keine unerwarteten unerwünschten Ereignisse berichtet.
Anzeichen und Symptome
In der Post-Marketing-Erfahrung waren affektive Störungen, Schläfrigkeit, Verwirrtheitszustände, Depression, Bewegungsdrang und Unruhe die am häufigsten berichteten unerwünschten Wirkungen, wenn Pregabalin in zu hohen Dosen eingenommen wurde. Selten wurden Fälle von Koma berichtet. Krampfanfälle wurden ebenfalls gemeldet.
Behandlung
Die Behandlung von Pregabalin-Überdosierungen sollte generelle unterstützende Massnahmen und bei Bedarf Hämodialyse beinhalten.
Eigenschaften/Wirkungen
ATC-Code
N02BF02
Wirkungsmechanismus
Der Wirkstoff Pregabalin ist ein Analogon der Gamma-Aminobuttersäure (GABA) mit der chemischen Bezeichnung (S)-3-(aminomethyl)-5-methylhexansäure.
Pharmakodynamik
In vitro Studien haben gezeigt, dass Pregabalin an eine Untereinheit (α2-δ-Protein) von spannungsabhängigen Kalziumkanälen im ZNS bindet und dabei [3H]-Gabapentin wirksam verdrängt. Obwohl der genaue Wirkungsmechanismus noch unklar ist, konnte gezeigt werden, dass Pregabalin die Freisetzung verschiedener Neurotransmitter einschliesslich Glutamat, Noradrenalin und Substanz P reduziert, und dadurch die neuronale Erregbarkeit im zentralen Nervensystem vermindert wird.
Anhaltspunkte aus Tiermodellen mit Neuropathien weisen darauf hin, dass Pregabalin die Kalzium-abhängige Freisetzung von pronozizeptiven Neurotransmittern im Rückenmark reduzieren, möglicherweise mittels einer Unterbrechung des Kalziumtransportes und/oder der Kalziumströme. Andere Tiermodelle wiederum deuten darauf hin, dass die anti-nozizeptive Wirkung von Pregabalin durch eine Interaktion mit absteigenden noradrenergen und serotonergen Bahnen vermittelt wird.
Klinische Wirksamkeit
Neuropathische Schmerzen
Die Wirksamkeit von Pregabalin bei der Behandlung von neuropathischen Schmerzen wurde in 12 doppelblinden, Placebo-kontrollierten Multicenterstudien während bis zu 13 Wochen mit zweimal täglicher Dosierung oder während bis zu 8 Wochen mit dreimal täglicher Dosierung untersucht. Insgesamt waren 2912 Patienten in den 12 Studien eingeschlossen. In die Studien wurden Patienten mit mässigen bis starken Schmerzen einbezogen.
In klinischen Studien mit diabetischer Polyneuropathie über bis zu 13 Wochen verbesserten sich die mittleren Endpunkte auf der Schmerzskala im Vergleich zu Placebo signifikant um -1,3 bis -1,5 bei 300 mg/d und -1,0 bis -1,5 bei 600 mg/d. Eine signifikante Verringerung der Schmerzen wurde innerhalb der ersten Woche festgestellt und blieb im Vergleich zu Placebo während der gesamten Behandlung erhalten. Die Responderrate (50%ige Verringerung auf der Schmerzskala) betrug 33-46% bei einer Dosis von 300 mg/d und 39-48% bei einer Dosis von 600 mg/d verglichen mit 15-30% für Placebo.
In klinischen Studien mit postherpetischer Neuralgie über 13 Wochen verbesserten sich die mittleren Endpunkte auf der Schmerzskala im Vergleich zu Placebo signifikant um -0,9 bis -1,2 bei 150 mg/d, -1,1 bis -1,6 bei 300 mg/d und -1,7 bis -1,8 bei 600 mg/d. Eine signifikante Verringerung der Schmerzen wurde innerhalb der ersten Woche festgestellt und blieb im Vergleich zu Placebo während der gesamten Behandlung erhalten. Die Responderrate (50%ige Verringerung auf der Schmerzskala) betrug 22-26% bei einer Dosis von 150 mg/d, 26-28% bei einer Dosis von 300 mg/d und 38-50% bei einer Dosis von 600 mg/d verglichen mit 9-20% für Placebo.
In einer klinischen Studie mit Rückenmarksverletzungen über 12 Wochen verbesserten sich die mittleren Endpunkte auf der Schmerzskala im Vergleich zu Placebo signifikant um -1,53 Punkte auf der numerischen 11-Punkte-Skala zur Schmerzbewertung. Die Responderrate (50%ige Verringerung auf der Schmerzskala) betrug 22% bei den mit Pregabalin behandelten Patienten verglichen mit 7% für Placebo.
Epilepsie
Die Wirksamkeit von Pregabalin als Zusatztherapie wurde in drei 12-wöchigen, randomisierten, doppelblinden, Placebo-kontrollierten Multicenterstudien mit 1052 Patienten bei zweimal täglicher und/oder dreimal täglicher Dosierung untersucht. Die Patienten hatten refraktäre, partielle Anfälle mit oder ohne sekundäre Generalisierung und anfangs eine durchschnittliche Anfallshäufigkeit von 19 bis 27 Anfällen und eine mediane Anfallshäufigkeit von 9 bis 12 Anfällen in 28 Tagen.
Die Wirksamkeit von Pregabalin bei Epilepsie wurde in allen Studien durch die Anfallsreduktion im Vergleich zu Placebo nachgewiesen. Responder waren die Patienten, bei denen während der Behandlung die Häufigkeit der partiellen Anfälle um ≥50% im Vergleich zum Ausgangswert reduziert wurde. Die Responder-Raten waren 14 bis 31% bei 150 mg/Tag, 40% bei 300 mg/Tag und 43 bis 51% bei 600 mg/Tag im Vergleich zu 6 bis 14% unter Placebo, was auf eine dosisabhängige Wirkung hinweist.
Bei Patienten mit sekundär generalisierten Anfällen war nur die Höchstdosis von 600 mg/Tag dem Placebo signifikant überlegen.
Generalisierte Angststörungen
Pregabalin wurde in sechs kontrollierten Studien über einen Zeitraum von 4-6 Wochen sowie in einer 8-wöchigen Studie mit älteren Patienten und in einer Langzeitstudie zur Rückfallprävention mit einer doppelblinden Rückfallpräventionsphase von 6 Monaten untersucht.
Eine Besserung der Symptome von generalisierten Angststörungen gemäss der Hamilton-Anxiety-Rating-Scale (HAM-A) wurde innerhalb der ersten Woche beobachtet.
In kontrollierten klinischen Studien über 4-8 Wochen zeigten 52% der mit Pregabalin behandelten Patienten und 38% der Patienten unter Placebo eine im Vergleich zu den Ausgangswerten mindestens 50%ige Verbesserung des HAM-A-Gesamt-Scores.
Pharmakokinetik
Die Pharmakokinetik von Pregabalin im steady-state ist bei gesunden Probanden, bei Epilepsiepatienten unter Antiepileptika und bei Patienten mit chronischen Schmerzen vergleichbar.
Absorption
Pregabalin wird rasch resorbiert, wenn es nüchtern verabreicht wird. Sowohl nach Einmal- wie auch nach Mehrfachgabe werden maximale Plasmakonzentrationen innerhalb von 1 h erreicht. Die orale Bioverfügbarkeit von Pregabalin beträgt geschätzt ≥90% und ist dosisunabhängig. Nach wiederholter Verabreichung wird der steady-state innerhalb 24 bis 48 Stunden erreicht. Bei Einnahme während den Mahlzeiten wird die Resorptionsrate von Pregabalin vermindert, was zu einer Verringerung der Cmax um ca. 25-30% und einer Verzögerung der tmax auf ca. 2,5 Stunden führt. Die Verabreichung von Pregabalin mit den Mahlzeiten hat jedoch keine klinisch signifikante Auswirkung auf das Ausmass der Resorption von Pregabalin.
Distribution
Präklinische Studien haben gezeigt, dass Pregabalin bei Mäusen, Ratten und Affen rasch die Blut-Hirn-Schranke überwindet. Pregabalin geht bei Ratten in die Plazenta über und ist in der Milch von säugenden Ratten nachweisbar. Beim Menschen beträgt das Verteilungsvolumen nach oraler Verabreichung ca. 0,56 l/kg. Pregabalin wird nicht an Plasmaproteine gebunden.
Metabolismus
Pregabalin wird beim Menschen nicht nennenswert metabolisiert. Nach einer Gabe von radioaktiv markiertem Pregabalin wurden ca. 98% unverändertes Pregabalin im Urin wiedergefunden. Das N-Methylderivat, der Hauptmetabolit von Pregabalin, macht 0,9% der Dosis im Urin aus. Präklinische Studien ergaben keinen Hinweis auf eine Racemisierung des S-Enantiomers von Pregabalin zum R-Enantiomer.
Elimination
Pregabalin wird aus dem Körperkreislauf hauptsächlich renal als unveränderte Substanz ausgeschieden.
Die mittlere Eliminationshalbwertszeit von Pregabalin beträgt 6,3 Stunden. Die Plasma-Clearance und renale Clearance von Pregabalin sind direkt proportional zur Kreatinin-Clearance (siehe «Kinetik spezieller Patientengruppen, Nierenfunktionsstörungen»).
Bei Patienten mit eingeschränkter Nierenfunktion ist eine Anpassung der Pregabalin-Dosis notwendig (siehe «Dosierung/Anwendung», Tabelle 1).
Linearität/Nicht Linearität
Die Pharmakokinetik von Pregabalin ist im empfohlenen täglichen Dosisbereich linear. Die interindividuelle pharmakokinetische Variabilität von Pregabalin ist gering (<20%). Die Pharmakokinetik nach Mehrfachdosierungen kann von Einzeldosis-Daten abgeleitet werden.
Kinetik spezieller Patientengruppen
Geschlecht
Klinische Studien haben gezeigt, dass die Geschlechtszugehörigkeit keinen klinisch signifikanten Einfluss auf die Plasmakonzentration von Pregabalin hat.
Leberfunktionsstörungen
Bei Patienten mit eingeschränkter Leberfunktion wurden keine speziellen Pharmakokinetikstudien durchgeführt. Da Pregabalin jedoch kaum metabolisiert und hauptsächlich unverändert über die Niere ausgeschieden wird, ist bei eingeschränkter Leberfunktion keine nennenswerte Veränderung der Pregabalin-Plasmakonzentration zu erwarten. Es ist jedoch zu beachten, dass die Sicherheit von Pregabalin bei Patienten mit Leberfunktionsstörungen nicht geprüft worden ist.
Nierenfunktionsstörungen
Die Clearance von Pregabalin ist direkt proportional zur Kreatinin-Clearance. Bei Patienten mit mittelschwerer Niereninsuffizienz ist eine Halbierung der Dosis angezeigt (siehe «Dosierung/Anwendung», Tabelle 1).
Ältere Patienten
Die Pregabalin-Clearance nimmt mit zunehmendem Alter tendenziell ab. Diese Abnahme der oralen Pregabalin-Clearance steht im Einklang mit der Abnahme der Kreatinin-Clearance im zunehmenden Alter. Eine Reduzierung der Pregabalin-Dosis kann bei Patienten mit altersbedingter Einschränkung der Nierenfunktion notwendig sein (siehe «Dosierung/Anwendung», Tabelle 1).
Stillzeit
Die Pharmakokinetik von 300 mg Pregabalin täglich (150 mg Pregabalin alle 12 Stunden) wurde bei 10 stillenden Frauen (≥12 Wochen postpartum) untersucht. Die Laktation hatte geringen bis keinen Einfluss auf die Pharmakokinetik von Pregabalin. Die durchschnittliche Steady-State Konzentration in der Milch lag bei ca. 76% der mütterlichen Plasmakonzentration. Die geschätzte durchschnittliche tägliche Dosis Pregabalin bei den Säuglingen (unter Annahme einer durchschnittlichen Milchaufnahme von 150 ml/kg/d) betrug 0,31 mg/kg/d, was basierend auf mg/kg etwa 7% der mütterlichen Dosis entspricht.
Präklinische Daten
In Toxizitätsstudien an Ratten und Affen wurden bei wiederholter Gabe Auswirkungen auf das ZNS einschliesslich Hypoaktivität, Hyperaktivität und Ataxie beobachtet.
Bei einer Exposition von mehr als dem 5-Fachen der Exposition des Menschen nach der empfohlenen Maximaldosis kam es in Langzeitversuchen an Albino-Ratten zu einer erhöhten Inzidenz der bei älteren Tieren häufig beobachteten Retinaatrophien.
Pregabalin war nicht teratogen bei Mäusen, Ratten oder Kaninchen. Nur bei Dosen, die deutlich über der Humandosis lagen, kam es bei Ratten und Kaninchen zu Foetotoxizität. In prä- und postnatalen Toxizitätsstudien an Ratten verursachte Pregabalin ab der fünffachen der maximal empfohlenen Humandosis bei den Jungen entwicklungstoxische Störungen.
Auf Grund von Ergebnissen aus in vitro und in vivo Testreihen ist Pregabalin nicht genotoxisch.
Aus den Ergebnissen einer Studie an Ratten wurde abgeleitet, dass Pregabalin für den Menschen kein kanzerogenes Risiko aufweist. Die Relevanz der beobachteten Hämangiosarkome bei Mäusen kann zurzeit für den Menschen noch nicht abschliessend beurteilt werden.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25 °C) und ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
57057 (Swissmedic).
Packungen
Lyrica 25 mg: 14, 56 Hartkapseln. [B]
Lyrica 50 mg: 14, 84 Hartkapseln. [B]
Lyrica 75 mg: 14, 56 Hartkapseln. [B]
Lyrica 100 mg: 84 Hartkapseln. [B]
Lyrica 150 mg: 56, 168 Hartkapseln. [B]
Lyrica 200 mg: 84 Hartkapseln. [B]
Lyrica 300 mg: 56, 168 Hartkapseln. [B]
Zulassungsinhaberin
Viatris Pharma GmbH, 6312 Steinhausen.
Stand der Information
März 2025.
[Version 109 D]