Zusammensetzung
Wirkstoffe
Leuprorelinum ut leuprorelini acetas.
Hilfsstoffe
Copoly(dl-lactidum-glycolidum) pro praeparatione.
Indikationen/Anwendungsmöglichkeiten
Symptomatische Behandlung des fortgeschrittenen hormonabhängigen Prostatakarzinoms. Als alternative Behandlung, wenn Orchiektomie oder Östrogengaben entweder für den Patienten nicht indiziert oder nicht zumutbar sind.
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosierung beträgt 3,6 mg Leuprorelin als Einzeldosis alle 4 Wochen.
Art der Anwendung
Das Implantat wird subkutan in die Bauchhaut eingeschoben. Die Injektionsstelle an der Bauchhaut ist jeden Monat zu wechseln.
Die Anwendung von Leuprorelin Sandoz ist nur bei erwachsenen Männern zulässig und sollte nur unter Überwachung eines in der Tumortherapie erfahrenen Arztes bzw. einer Ärztin erfolgen. Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die vorübergehende Verschlechterung der klinischen Symptomatik abzuschwächen.
Die Antwort auf Leuprorelinacetat soll mittels Messung des Serum-Testosteronspiegels und des prostataspezifischen Antigens verfolgt werden.
Spezielle Dosierungsempfehlungen
Kinder/ Jugendliche: Die Wirksamkeit und Sicherheit von Leuprorelin Sandoz 1 Monat wurde bei Kindern und Jugendlichen nicht untersucht. Eine Behandlung in dieser Altersgruppe wird daher nicht empfohlen.
Ältere Patienten: Eine Dosisanpassung in Abhängigkeit vom Alter ist nicht erforderlich.
Leber- und Niereninsuffizienz: Eine Dosisanpassung ist nicht erforderlich (vgl. «Pharmakokinetik»).
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff, ähnlichen Nona- oder Dekapeptiden, oder einem der Hilfsstoffe gemäss Zusammensetzung.
Bei nachgewiesener Hormonunabhängigkeit des Karzinoms ist Leuprorelin Sandoz nicht indiziert.
Warnhinweise und Vorsichtsmassnahmen
Hypersensibilitätsreaktionen
Über vereinzelte Fälle von Anaphylaxie wurde berichtet. Allergische Reaktionen in Form von Überempfindlichkeitsreaktionen an der Injektionsstelle sowie systemische Reaktionen wurden beobachtet.
Bei ausgeprägten lokalen Reaktionen kann die Resorption von Leuprorelin aus dem Depot beeinträchtigt sein. In einem solchen Fall sollte der Testosteronspiegel bestimmt werden.
Hypophysenapoplexie
Während der Marktüberwachung wurde nach der Verabreichung von Gonadotropin-Releasing-Hormon (GnRH)-Agonisten selten über Hypophysenapoplexie berichtet (sekundäres klinisches Syndrom eines Hypophysen-Infarktes). In den meisten dieser Fälle wurde ein Hypophysenadenom diagnostiziert. Die Mehrheit dieser Hypophysenapoplexie-Fälle traten innerhalb von 2 Wochen, einige Fälle innerhalb der ersten Stunde, nach Verabreichung der ersten Dosis auf. In diesen Fällen zeigte sich die Hypophysenapoplexie durch plötzliche Kopfschmerzen, Erbrechen, visuelle Veränderungen, Ophthalmoplegie, einen veränderten mentalen Status und manchmal einen kardiovaskulären Kollaps. Sofortige medizinische Betreuung war erforderlich.
Bei bekanntem Hypophysenadenom sollte aus diesem Grund ein GnRH-Agonist nicht gegeben werden.
Suizidrisiko: Bei Patienten, welche mit GnRH-Agonisten behandelt werden, besteht ein erhöhtes Risiko für das Auftreten von Depressionen (welche schwerwiegend verlaufen können). Patienten mit vorbestehenden Depressionen können suizidgefährdet sein.
Knochendichte/Frakturrisiko: Während eines hypo-östrogenen Zustands können Veränderungen der Knochendichte auftreten. Die Abnahme der Knochendichte kann nach Absetzen von Leuprorelin Sandoz 1 Monat reversibel sein. Durch den Mangel an Androgenen, welcher aus der Behandlung des Prostatakarzinoms resultiert, kann das Frakturrisiko erhöht sein.
Krampfanfälle: Im Rahmen der Marktüberwachung wurde über das Auftreten von Krampfanfällen berichtet. Teilweise handelte es sich dabei um Patienten, welche andere Risikofaktoren für Krampfanfälle aufwiesen (wie z.B. Epilepsie-Anamnese, intrakranielle Tumoren, Komedikation mit Arzneimitteln, für welche ein Risiko für Krampfanfälle bekannt ist). Es liegen jedoch auch Meldungen von Patienten ohne derartige Risikofaktoren vor.
Kardiovaskuläre Risikofaktoren/Erkrankungen
Unter der Behandlung mit GnRH-Agonisten wurde über ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Ereignisse berichtet. Insbesondere wurde in mehreren grossen epidemiologischen Studien bei Prostatakarzinom-Patienten ein um etwa 20% erhöhtes Risiko für Myokardinfarkt und Schlaganfall beobachtet. Bei Patienten mit Vorliegen weiterer Risikofaktoren für kardiovaskuläre Ereignisse (z.B. Hypertonie, Hyperlipidämie) bzw. mit bereits bestehenden kardiovaskulären Erkrankungen sollte daher eine besonders sorgfältige Nutzen-Risiko-Abwägung erfolgen.
Vor Einleitung einer Behandlung mit Leuprorelin sollten Blutdruck, Blutglucose und Lipidprofil bestimmt werden. Während der Behandlung sollten die Patienten bezüglich dieser Risikofaktoren sowie bezüglich möglicher Symptome, welche die Entwicklung einer kardiovaskulären Erkrankung vermuten lassen, überwacht werden. Bereits bestehende Risikofaktoren (Diabetes, Hypercholesterinämie, Hypertonie) sollten adäquat, d.h. entsprechend der jeweiligen Guidelines, behandelt werden.
Effekte auf das QT-Intervall
Eine Androgendeprivation kann das QT-Intervall verlängern. Bei Patienten mit einer Vorgeschichte oder einem Risiko für eine QT-Verlängerung und bei Patienten, welche gleichzeitig Arzneimittel erhalten, die eine QT-Verlängerung bewirken können (siehe unter «Interaktionen»), sollte das Nutzen-Risiko-Verhältnis, inklusive der Möglichkeit eines Auftreten von Torsade de pointes abgewogen werden, bevor eine Behandlung mit Leuprorelinacetat begonnen wird.
Im Zusammenhang mit der Anwendung von GnRH-Agonisten wurde darüber hinaus bei Männern über ein erhöhtes Risiko für einen plötzlichen Herztod berichtet.
Prostatakarzinom
Eine Therapie mit Leuprorelinacetat führt anfangs zu einem kurzfristigen Anstieg der Serumtestosteronspiegel, was mit einer vorübergehenden Verstärkung bestimmter Krankheitssymptome einhergehen kann (z.B. Muskelschwäche, Zunahme oder Neuauftreten von Knochenschmerzen, Harnwegsobstruktion, Rückenmarkskompression, Ödeme). Patienten mit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen oder Harnwegsobstruktion sollten daher während der ersten Behandlungswochen unter ständiger, möglichst stationärer Überwachung stehen.
Die zusätzliche Gabe eines geeigneten Antiandrogens kann in der Initalphase der Behandlung in Betracht gezogen werden, um mögliche Folgeerscheinungen des initialen Testosteronspiegelanstiegs und eine Verschlechterung der klinischen Symptomatik abzuschwächen.
Die anfängliche Zunahme der Beschwerden bildet sich üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 1 Monat abgesetzt werden muss. Nachfolgend kommt es zu Symptomen des Testosteronentzugs (vgl. «Unerwünschte Wirkungen»).
Die Antwort auf Leuprorelinacetat soll mittels Messungen der Serum-Testosteronspiegel und des prostataspezifischen Antigens verfolgt werden.
Nach chirurgischer Kastration bewirkt Leuprorelin Sandoz keine weitere Absenkung des Testosteronspiegels.
Metabolische Veränderungen
Hyperglykämie und ein erhöhtes Risiko, an Diabetes zu erkranken, wurden bei Männern berichtet, die LHRH-Agonisten erhielten. Hyperglykämie kann die Entwicklung von Diabetes mellitus oder eine Verschlechterung der Blutzuckerkontrolle bei Patienten mit Diabetes darstellen. Blutzucker und/oder glykosyliertes Hämoglobin (HbA1c) sollten bei Patienten, die einen LHRH-Agonisten erhalten, regelmässig überwacht werden, und die Patienten sollten mit der aktuellen Praxis zur Behandlung von Hyperglykämie oder Diabetes behandelt werden. Metabolische Veränderungen, die mit LHRH-Agonisten verbunden sind, können auch eine Fettlebererkrankung umfassen.
Idiopathische intrakranielle Hypertonie
Bei Patienten, die Leuprorelin erhalten, wurde über idiopathische intrakranielle Hypertonie (Pseudotumor cerebri) berichtet. Die Patienten sollten auf Anzeichen und Symptome einer idiopathischen intrakraniellen Hypertonie, einschliesslich starker oder wiederkehrender Kopfschmerzen, Sehstörungen und Tinnitus, hingewiesen werden. Wenn eine idiopathische intrakranielle Hypertonie auftritt, sollte ein Absetzen von Leuprorelin in Betracht gezogen werden.
Schwere kutane Nebenwirkungen
Schwere kutane Nebenwirkungen (SCARs), einschliesslich des Stevens-Johnson-Syndroms (SJS) und der toxischen epidermalen Nekrolyse (TEN), die lebensbedrohlich oder tödlich sein können, wurden im Zusammenhang mit der Behandlung mit Leuprorelin berichtet. Zum Zeitpunkt der Verschreibung sollten die Patienten über die Anzeichen und Symptome informiert und engmaschig auf schwere Hautreaktionen überwacht werden. Wenn Anzeichen und Symptome auftreten, die auf diese Reaktionen hindeuten, sollte Leuprorelin sofort abgesetzt und gegebenenfalls eine alternative Behandlung in Betracht gezogen werden.
Interaktionen
Bis jetzt keine bekannt.
Es wurden keine Interaktionsstudien mit Leuprorelin Sandoz durchgeführt. Der Metabolismus von Leuprorelinacetat lässt Interaktionen jedoch selten erwarten, da Leuprorelin überwiegend durch Peptidasen und nicht über das Cytochrom P450 abgebaut wird und nur eine geringe Plasmaproteinbindung von ca. 46% aufweist.
Prostatakrebs
Da eine Androgen-Deprivation eine QT-Verlängerung verursachen kann, sollte die gleichzeitige Verabreichung von Leuprorelinacetat mit Arzneimitteln, welche eine QT-Intervallverlängerung oder Torsade de pointes hervorrufen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Antipsychotika, etc., sorgfältig abgewogen werden. Siehe «Warnhinweise und Vorsichtsmassnahmen», Effekte auf das QT-Intervall.
Schwangerschaft, Stillzeit
Es gibt keine Indikation von Leuprorelin Sandoz bei Frauen.
Leuprorelin ist kontraindiziert während der Schwangerschaft.
Es ist nicht bekannt, ob Leuprorelin in die Muttermilch ausgeschieden wird.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Leuprorelin Sandoz 1 Monat kann das Reaktionsvermögen herabsetzen, so dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden könnte. Dies gilt in verstärktem Mass im Zusammenhang mit Alkohol.
Unerwünschte Wirkungen
Eine Therapie mit Leuprorelinacetat führt anfangs zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompressionen, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 1 Monat abgesetzt werden muss.
Die häufigsten unerwünschten Wirkungen unter der Behandlung mit Leuprorelinacetat sind Vasodilatation (57%) und Hitzewallungen (52%), vermehrtes Schwitzen (42%), verringerte Libido (47%) sowie Potenzstörungen (45%) und Gewichtszunahme (22%).
Nachfolgend werden die unerwünschten Wirkungen nach Organsystem angegeben, welche in den klinischen Studien und während der Marktüberwachung unter Behandlung mit Leuprorelinacetat-Depotpräperaten beobachtet wurden. Die Häufigkeit sind dabei wie folgt definiert: «sehr häufig» (≥1/10); «häufig» (≥1/100, <1/10); «gelegentlich» (≥1/1000, <1/100); «selten» (≥1/10'000, <1/1000); «sehr selten» (<1/10'000), «nicht bekannt»: ausschliesslich aus Meldungen während der Marktüberwachung, genaue Häufigkeit kann nicht angegeben werden.
Infektionen und parasitäre Erkrankungen:
Häufig: Infektionen der Atemwege, Pharyngitis, Harnwegsinfektionen, Bronchitis
Gelegentlich: Candidose, Pilzinfektion auf der Haut, Rhinitis
Nicht bekannt: Pneumonie
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen):
Nicht bekannt: Karzinome der Haut / Ohren
Erkrankungen des Blutes und des Lymphsystems:
Häufig: Anämie
Gelegentlich: erhöhte Retikulozyten
Nicht bekannt: Erhöhung oder Erniedrigung der Leukozytenwerte, erniedrigte Thrombozytenzahl, verlängerte Prothrombin- und partielle Thromboplastinzeit
Erkrankungen des Immunsystems:
Gelegentlich: Überempfindlichkeitsreaktionen (z.B. mit Fieber, Pruritus, Eosinophilie, Hautauschlag)
Nicht bekannt: anaphylaktische Reaktionen
Endokrine Erkrankungen:
Nicht bekannt: Hypophyseninfarkt (vgl. «Warnhinweise und Vorsichtsmassnahmen»), Schilddrüsenvergrösserung
Stoffwechsel- und Ernährungsstörungen:
Sehr häufig: Gewichtszunahme (22%)
Häufig: Anorexie, gesteigerter Appetit, verminderter Appetit, Gewichtsabnahme, Hyperglykämie, vermehrtes Durstgefühl, Hypercalciämie
Gelegentlich: Hypoglykämie, Dehydration
Nicht bekannt: Diabetes mellitus, Harnstofferhöhung, Hyperurikämie, Hyperlipidämie (Gesamtcholesterol, LDL-Cholesterol, Triglyceride), Hyperphosphatämie, Hypoproteinämie, erhöhtes Kreatinin, Hypokaliämie, erhöhtes BUN
Psychiatrische Erkrankungen:
Sehr häufig: verringerte Libido (47%)
Häufig: Schlafstörungen, Angst, Schläfrigkeit, Stimmungsschwankungen, Depression, Nervosität, emotionale Labilität
Gelegentlich: Wahnvorstellungen
Nicht bekannt: gesteigerte Libido, Suizidalität
Erkrankungen des Nervensystems:
Häufig: Parästhesien, Hypästhesie, Tremor, Kopfschmerzen, Schwindel
Gelegentlich: Geschmacksstörungen, Gedächtnisstörungen, Amnesie, Gangstörung
Nicht bekannt: Lethargie, periphere Neuropathie, neuromuskuläre Störungen, Benommenheit, Neuromyopathie, Bewusstseinverlust, transitorische ischämische Attacke, Apoplexie, idiopathische intrakranielle Hypertonie (Pseudotumor cerebri).
Sehr selten wurde das Auftreten von Krampfanfällen berichtet.
Augenerkrankungen:
Häufig: Sehstörungen (z.B verschwommenes Sehen), Amblyopie
Nicht bekannt: trockene Augen, sonstige ophtalmologische Störungen
Erkrankungen des Ohrs und des Labyrinths:
Häufig: Tinnitus, Ohrenschmerzen
Nicht bekannt: Hörstörungen, beeinträchtigtes Hörvermögen
Herzerkrankungen:
Häufig: Angina pectoris, Tachykardie, Arrhythmien, ventrikuläre Extrasystolen
Gelegentlich: Herzinsuffizienz, Bradykardie
Nicht bekannt: QT-Verlängerungen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»), EKG-Veränderungen (z.B. Zeichen einer myokardialen Ischämie), Herzgeräusche, Palpitationen, Myokardinfarkt, AV-Block, plötzlicher Herztod (vgl. «Warnhinweise und Vorsichtsmassnahmen»)
Gefässerkrankungen:
Sehr häufig: Hitzewallungen (52%), Vasodilatation (57%)
Häufig: Thrombophlebitis, Lymphödem, Hypertonie, Synkope
Gelegentlich: periphere Zirkulationsstörung
Nicht bekannt: Thrombose, Lungenembolie, Hypotonie, Varikosenschmerz, Schlaganfall
Ausserdem existiert ein Einzelfallbericht über einen Patienten mit einer Thrombose der zentralen Netzhautarterie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Häufig: Husten, Dyspnoe, Epistaxis, Hämoptysenis, Asthma bronchiale, akutes Lungenödem, Lungenemphysem
Gelegentlich: chronisch-obstruktive Lungenerkrankung
Nicht bekannt: Pleurareiben, Lungeninfiltration, Lungenfibrose, Nasennebenhöhlenverstopfung, pleurale Effusion, interstitielle Lungenerkrankung
Erkrankungen des Gastrointestinaltrakts:
Häufig: Mundtrockenheit, Flatulenz, Obstipation, Diarrhö, Übelkeit, Erbrechen, Abdominalschmerzen, Gastritis
Nicht bekannt: gastroduodenale Ulcera, Dysphagie, gastrointestinale Blutungen, rektale Polypen, peptische Ulcera, harte Knötchen im Rachen
Leber- und Gallenerkrankungen:
Sehr häufig: Erhöhung der AST (20%), Erhöhung der LDH im Serum (29%)
Häufig: Leberfunktionsstörungen (z.B. Erhöhung der ALT, Erhöhung der Gamma GT)
Gelegentlich: hepatozelluläre Schädigung, cholestatische Hepatitis
Nicht bekannt: schwere Leberschädigung, Hyperbilirubinämie, Ikterus
Erkrankungen der Haut und des Unterhautgewebes:
Häufig: trockene Haut, Hautauschlag (einschliesslich makulopapulösem Exanthem), Pruritus, Urtikaria, Haarveränderungen (insbesondere Zu- oder Abnahme der Körperbehaarung), Alopezie, Ekchymose, Pigmentierstörungen
Gelegentlich: Photosensitivitätsreaktionen, trockene Schleimhäute
Nicht bekannt: Dermatitis, Hautläsionen, Knötchen, Stevens-Johnson Syndrom/Toxische epidermale Nekrolyse (SJS/TEN) (siehe «Warnhinweise und Vorsichtsmassnahmen»), toxischer Hautausschlag, Erythema multiforme
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Sehr häufig: Knochenschmerzen (14%)
Häufig: Gelenkschmerzen (Arthralgien), Rückenschmerzen, Muskelschwäche, Schmerzen in den Extremitäten, Myalgie, Muskelkrämpfe
Nicht bekannt: Reduktion der Knochendichte, Beckenfibrose, Gelenkstörungen (Arthropathie), Paralyse, Spinalfraktur, ankylosierende Spondylitis, Tenosynovitis, Knochenschwellung, Gliederschmerzen
Bei einer Langzeittherapie (6−12 Monate) wurde darüber hinaus über eine Osteoporose berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Nieren und Harnwege:
Sehr häufig: Nykturie (17%)
Häufig: Dysurie, Pollakisurie, Hämaturie
Gelegentlich: Harninkontinenz, Polyurie, Miktionsstörungen, Harnretention, Proteinurie
Nicht bekannt: vermehrter Harndrang, Spasmen der Harnblase, Harnwegsobstruktion
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Sehr häufig: Potenzstörungen (45%)
Häufig: Gynäkomastie, Hodenatrophie, PSA-Erhöhung
Sehr selten: Brustschmerzen/ -spannung /-überempfindlichkeit, Penisschwellung
Nicht bekannt: Prostataschmerzen, Hodenschmerz
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: vermehrtes Schwitzen (42%), Reaktionen an der Injektionsstelle (13%), z.B. Rötungen, Schmerzen, Ödeme, Juckreiz, Infektionen, die sich in der Regel auch bei fortgesetzter Behandlung zurückbilden, Müdigkeit/Asthenie (13%), periphere Ödeme (12%)
Häufig: Entzündungen an der Injektionsstelle (inkl. Abszesse), Frösteln, generelle Schmerzen, Schwellung (Schläfenknochen), Hypersensitivitätsreaktionen, Fieber, Unwohlsein, Schweissausbrüche, Nachtschweiss, Schüttelfrost und generelle grippeartige Symptome.
In einer Phase I Studie mit 15 Probanden, welche Leuprorelin Sandoz erhielten, wurden folgende Nebenwirkungen (Häufigkeit >1) festgestellt (siehe Tabelle 1):
Tabelle 1: Häufigste Nebenwirkungen der Phase I Studie
|
Symptome |
Anzahl Fälle (N = 15) |
|
Abnahme der Libido |
13 |
|
Hitzewallungen |
9 |
|
Kopfschmerzen |
6 |
|
Schwitzen |
6 |
In den Phase II und III Studien mit 52 Patienten, welche Leuprorelin Sandoz erhielten, wurden folgende Nebenwirkungen festgestellt (siehe Tabelle 2):
Tabelle 2: Häufigste Nebenwirkungen der Phase II und III Studien
|
Nach Organklassen |
Anzahl Patienten (N = 52) |
|
Allgemeine Erkrankungen (Hitzewallungen) |
16 |
|
Herzerkrankungen |
3 |
|
Erkrankungen der Nieren und Harnwege |
2 |
|
Beschwerden am Verabreichungsort |
1 |
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
In klinischen Studien mit Leuprorelinacetat-Depotpräparaten wurden bei Erwachsenen Dosen bis zu 20 mg/Tag über zwei Jahre verabreicht. Die unerwünschten Wirkungen unter dieser hohen Dosierung unterschieden sich nicht von jenen unter Applikation von 1 mg/Tag.
Eigenschaften/Wirkungen
ATC-Code
L02AE02
Wirkungsmechanismus/Pharmakodynamik
Der Wirkstoff Leuprorelinacetat ist ein synthetisches Analogon des natürlich vorkommenden Gonadotropin-Releasing-Hormons (GnRH), das die Freisetzung der gonadotropen Hormone LH und FSH aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die testikuläre Steroidsynthese.
Im Gegensatz zum physiologischen GnRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert Leuprorelinacetat bei therapeutischer Daueranwendung die GnRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen kurzfristigen Stimulation deren Down-Regulation. Bei Erwachsenen kommt es als Folge nach drei bis vier Wochen zu einer reversiblen hypophysären Suppression der Freisetzung der gonadotropen Hormone LH und FSH mit gleichzeitigem Abfall des Testosterons auf Kastrationsniveau.
Dieser Zustand mit tiefen Testosteron- bzw. Östrogenspiegeln bleibt während der gesamten Therapiedauer erhalten. Dies führt zu einer Wachstumshemmung von hormonabhängigen Tumoren wie des Prostatakarzinoms. Im Verlauf der Behandlung tritt dadurch eine Besserung der Symptomatik ein.
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Mit Leuprorelin Sandoz wurden 2 Studien durchgeführt. Bei der ersten Studie handelt es sich um eine randomisierte Phase III Studie, in der die Wirksamkeit und Sicherheit von Leuprorelin Sandoz bei Patienten mit fortgeschrittenem Prostatakrebs mit Lucrin Depot verglichen wurde. Die zweite Studie ist eine offene Phase II Studie, in der die Wirksamkeit und Sicherheit von Leuprorelin Sandoz an Patienten mit fortgeschrittenem Prostatakrebs untersucht wurde. Insgesamt wurden 52 Patienten mit Leuprorelin Sandoz behandelt.
Pharmakokinetik
Absorption
Leuprorelinacetat wird nach Injektionen des Implantats kontinuierlich aus dem Copolymer, bestehend aus Glykolsäure und Milchsäure im Verhältnis 1:1, über den Zeitraum von einem Monat freigesetzt. Das Copolymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Innerhalb von 1 Stunde wurden Serumspiegel von 707 pg/ml gemessen. Nachweisbare Serumspiegel liegen für mehr als 4 Wochen vor.
In der Phase l Studie bei 15 gesunden Probanden waren nach zwei Injektionen von Leuprorelin Sandoz im Abstand von 28 Tagen Leuprorelinspiegel bis zu 39 Tage nach der zweiten Applikation nachweisbar. Zwischen Tag 42 und 49 nach der Zweitapplikation wurde ein Anstieg des Testosteronspiegels ausserhalb des Kastrationsbereichs beobachtet.
Distribution/Metabolismus/Elimination
Distribution, Metabolismus und Elimination von Leuprorelinacetat wurden im Menschen nicht vollständig abgeklärt.
Das Verteilungsvolumen beträgt 36 Liter, die totale Clearance liegt bei 139,6 ml/min. Die Halbwertszeit für die nicht retardierte Substanz beträgt 2,9 Stunden.
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Kinetik spezieller Patientengruppen
Kinder/Jugendliche: Es liegen keine Daten zur Pharmakokinetik von Leuprorelin Sandoz bei Kindern und Jugendlichen vor.
Ältere Patienten: Die Pharmakokokinetik bei älteren Patienten unterscheidet sich nicht in relevanter Weise von jener bei jüngeren Erwachsenen.
Leber- und Niereninsuffizienz: Bei Patienten mit eingeschränkter Nierenfunktion wurden teilweise höhere Serumspiegel an Leuprorelinacetat gemessen, bei Patienten mit eingeschränkter Leberfunktion dagegen verminderte Werte.
Die klinische Signifikanz dieser Beobachtung ist unbekannt.
Präklinische Daten
Mutagenität
Untersuchungen zur Mutagenität (in vitro und in vivo) haben keine Zeichen eines mutagenen Potentials von Leuprorelin erkennen lassen.
Karzinogenität
In Karzinogenitätsstudien wurden Mäuse und Ratten während 2 Jahren mit Leuprorelin behandelt. Nach 24 Monaten konnte bei Ratten nach subkutaner Verabreichung von 0,6 bis 4 mg/kg eine dosisabhängige Zunahme von gutartigen hypophysären Hyperplasien und Adenomen beobachtet werden. Weiterhin wurde eine dosisunabhängige Zunahme von Adenomen der Pankreas-Inselzellen bei weiblichen Ratten und der Hodenzwischenzellen bei männlichen Tieren festgestellt. Bei Mäusen verursachten Dosierungen bis zu 60 mg/kg, welche ebenfalls während 2 Jahren verabreicht wurden, keine durch Leuprorelin induzierte Tumore oder Anomalien der Hypophyse.
Reproduktionstoxizität
Untersuchungen mit subkutaner Verabreichung von Leuprorelin an Ratten bei Dosen bis 10 µg/kg und an Kaninchen bei Dosen bis 1 µg/kg haben keine Hinweise auf ein teratogenes Potential ergeben. Embryotoxische/embryoletale Wirkungen wurden bei der Ratte bei einer Dosis von 10 µg/kg und beim Kaninchen bei Dosen über 0,1 µg/kg beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Bis jetzt keine bekannt.
Beeinflussung diagnostischer Methoden
Bis jetzt keine bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, im verschlossenen Sterilbeutel, nicht über 30°C und ausser Reichweite von Kindern lagern.
Hinweise für die Handhabung
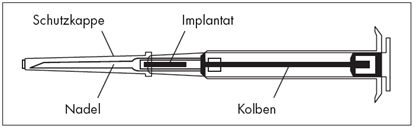
|
|
| |
|
1.Desinfizieren Sie die Injektionsstelle unterhalb der Nabellinie (Bauch). | ||
|
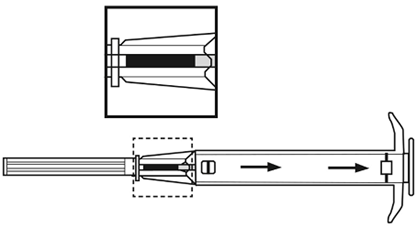
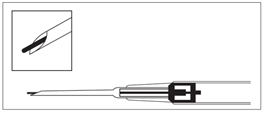
2.Entnehmen Sie den Applikator aus dem Sterilbeutel und prüfen Sie, ob das Implantat im Depot sichtbar ist (siehe eingerahmter Bereich). Zum Prüfen halten Sie den Applikator gegebenenfalls gegen das Licht oder schütteln Sie ihn leicht. | ||
|
|
| |
|
3.Ziehen Sie den Kolben des Applikators vollständig zurück, bis Sie eine durchgehende Linie im zweiten Fenster sehen. | ||
|
|
| |
|
4.Entfernen Sie dann die Schutzkappe von der Nadel. | ||
|
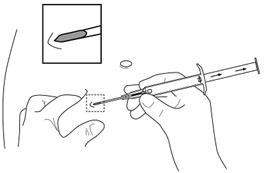
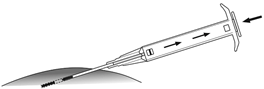
5.Halten Sie den Applikatorkörper mit einer Hand fest. Drücken Sie mit der anderen Hand die Haut unterhalb der Nabellinie zusammen (siehe Bild). Mit der Nadelöffnung nach oben führen Sie die gesamte Nadel ein. Dies erfolgt leicht schräg, fast parallel zur Haut in das subkutane Gewebe. |
|
|
|
6.Ziehen Sie den Applikator ca. 1 cm vorsichtig zurück. Dies erzeugt den Stichkanal für das Implantat. |
| |
|
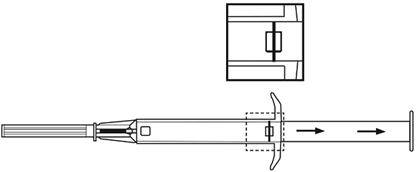
7.Schieben Sie nun den Kolben vollständig nach vorne, bis dieser einrastet und Sie ein «Klick» hören, um das Implantat in den Stichkanal zu injizieren. |
|
|
|
8.Ziehen Sie die Nadel heraus. Um sicherzustellen, dass das Implantat injiziert wurde, prüfen Sie, ob die weisse Kolbenspitze an der Nadelspitze sichtbar ist. |
|
|
Zulassungsnummer
57449 (Swissmedic)
Packungen
1x 1 Fertigspritze mit Implantat. [A]
3x 1 Fertigspritze mit Implantat. [A]
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Stand der Information
Februar 2025