Zusammensetzung
Wirkstoffe
Triptorelin als Triptorelin-Embonat.
Hilfsstoffe
Poly(lactid-co-glycolid), Mannitol, Carmellose-Natrium*, Polysorbat 80.
Lösungsmittel: Wasser für Injektionszwecke.
*Die Menge an Natrium, die durch Carmellose-Natrium zugeführt wird, entspricht 2,3 mg pro Dosis.
Indikationen/Anwendungsmöglichkeiten
Salvacyl wird angewendet zur Herbeiführung einer reversiblen und anhaltenden (länger als drei Monate) Senkung des Testosteronspiegels bis auf Kastrationsniveau bei erwachsenen Männern mit Störungen der Sexualpräferenz.
Eine Behandlung mit Salvacyl sollte nur nach vorgängiger forensischer Beurteilung durch einen speziell ausgebildeten und qualifizierten Psychiater eingeleitet werden.
Die Behandlung sollte in Kombination mit einer Psychotherapie erfolgen mit dem Ziel, das abweichende Sexualverhalten zu verringern.
Es liegen keine Daten vor, die eine günstige Wirkung von Salvacyl auf abweichendes Sexualverhalten belegen. Ein Therapieerfolg kann weder allgemein noch im Einzelfall garantiert werden.
Eine Behandlung mit Salvacyl entbindet nicht von gerichtlichen Massnahmen wie der Internierung, die darauf abzielen, einem abweichenden Verhalten vorzubeugen.
Dosierung/Anwendung
Salvacyl darf nur von Ärzten oder medizinischem Fachpersonal angewendet werden.
Art der Anwendung
Da es sich bei Salvacyl um eine Suspension von Mikrogranula handelt, ist eine intravasale Injektion unbedingt zu vermeiden. Die Injektionsstelle sollte in regelmässigen Abständen gewechselt werden.
Für die Herstellung der gebrauchsfertigen Injektionssuspension siehe «Sonstige Hinweise», Rubrik «Art der Herstellung».
Übliche Dosierung
Salvacyl wird als intramuskuläre Injektion alle zwölf Wochen angewendet.
Salvacyl ist unter ärztlicher Aufsicht anzuwenden.
Die Beurteilung der Wirksamkeit der Behandlung erfolgt in erster Linie klinisch. Eine klinische Beurteilung der Wirksamkeit ist regelmässig durchzuführen, z.B. vor jeder vierteljährlichen Injektion von Triptorelin. Im Zweifelsfall können die Testosteronwerte im Serum gemessen werden.
Spezielle Dosierungsanweisungen
Ältere Patienten
Eine altersabhängige Anpassung der Dosis ist nicht erforderlich.
Patienten mit beeinträchtigter Nierenfunktion
Bei Patienten mit beeinträchtigter Nierenfunktion ist keine Anpassung der Dosierung erforderlich.
Patienten mit beeinträchtigter Leberfunktion
Bei Patienten mit beeinträchtigter Leberfunktion ist keine Anpassung der Dosierung erforderlich.
Kontraindikationen
Überempfindlichkeit gegen Triptorelin, andere GnRH-Analoga oder einen der Hilfsstoffe in der Zusammensetzung.
Chirurgische Kastration.
Warnhinweise und Vorsichtsmassnahmen
Serumtestosteron:
Zu Beginn der Behandlung kann Triptorelin einen vorübergehenden Anstieg des Serumtestosterons verursachen. Daher ist der Patient in der Anfangsphase der Behandlung vom behandelnden Arzt sorgfältig zu überwachen, und nötigenfalls ist die zusätzliche Gabe eines geeigneten Antiandrogens in Betracht zu ziehen, um dem anfänglichen Anstieg des Serumtestosterons und der möglichen Verstärkung des Sexualtriebs entgegenzuwirken.
Sobald der Testosteron-Kastrationsspiegel am Ende des ersten Monats erreicht ist, wird dieser Spiegel so lange aufrechterhalten, wie die Patienten alle zwölf Wochen ihre Injektion erhalten.
Nach Absetzen der Behandlung besteht das Risiko einer erhöhten Testosteronsensibilität, was zu einem gesteigerten Sexualtrieb führen kann. Daher ist vor dem Absetzen von Salvacyl die zusätzliche Gabe eines geeigneten Antiandrogens in Betracht zu ziehen.
Hypophysenapoplexie:
Eine Behandlung männlicher Patienten mit GnRH-Agonisten kann zur Manifestation eines latenten Hypophysenadenoms führen, das in einigen Fällen mit einer Hypophysenapoplexie einhergehen kann. Mögliche Symptome sind plötzliche Kopfschmerzen, Sehstörungen, Lähmung der Augenmuskeln, Erbrechen und möglicherweise Veränderungen des Geisteszustands und kardiovaskulärer Kollaps. Bei Verdacht auf Hypophysenapoplexie ist das Arzneimittel sofort abzusetzen und eine geeignete Behandlung einzuleiten.
Stimmungsschwankungen/Depression:
Unter Behandlung mit Triptorelin wurde über Stimmungsschwankungen bis hin zu Depression (mitunter schwer) berichtet. Seltene Fälle von Suizidgedanken oder Suizidversuchen wurden auch unter der Behandlung mit anderen GnRH-Analoga berichtet. Patienten mit Depression (auch in der Anamnese) sind daher während der Anwendung von Salvacyl engmaschig zu überwachen Die Patienten sind auf das Risiko des Auftretens solcher Symptome (und auf die Möglichkeit der Verschlimmerung einer vorbestehenden Depression) hinzuweisen.
Osteoporose/Knochendichte:
Die Gabe von synthetischen GnRH-Analoga kann mit einer Verringerung der Knochenmineralisierung einhergehen, die zu Osteoporose führen und dadurch das Risiko von Frakturen erhöhen kann. Da keine Erfahrungen mit der Anwendung von Triptorelin bei Patienten mit vorbestehender Osteoporose vorliegen, sollten Patienten mit schwerer Osteoporose nicht mit Salvacyl behandelt werden.
Patienten mit zusätzlichen anderen Risikofaktoren für Osteoporose wie chronischer Alkoholabusus, Rauchen, Unterernährung, positive Familienanamnese für Osteoporose oder Langzeitbehandlung mit Arzneimitteln, die ebenfalls die Knochendichte reduzieren (wie Kortikosteroide oder Antiepileptika), sind engmaschig zu überwachen.
Die Knochenmineraldichte sollte vor Beginn der Behandlung gemessen und während der Behandlung gegebenenfalls in regelmässigen Abständen kontrolliert werden. Zur Vermeidung einer behandlungsbedingten Verringerung der Knochendichte wird eine ausreichende Zufuhr von Kalzium und Vitamin D (über die Nahrung) empfohlen. Gegebenenfalls ist den Patientinnen zu raten, ihren Lebensstil zu ändern, z.B. durch regelmässige körperliche Übungen, die zu einer Belastung des Skeletts führen, das Rauchen aufzugeben und Alkohol nur mässig zu konsumieren.
Krampfanfälle
Unter der Behandlung mit GnRH-Analoga wurde über das Auftreten von Krampfanfällen berichtet, insbesondere bei Frauen und Kindern. Einige dieser Patienten wiesen Risikofaktoren für Krampfanfälle auf (wie Epilepsie in der Vorgeschichte, intrakranielle Tumore oder gleichzeitige Behandlung mit Arzneimitteln, von denen bekannt ist, dass sie mit einem Risiko für Reaktionen in Form von Krampfanfällen einhergehen). Es wurden aber auch Fälle von Krampfanfällen bei Patienten gemeldet, die keine derartigen Risikofaktoren aufwiesen.
Überempfindlichkeitsreaktionen:
Kurz nach der Injektion von Salvacyl wurden sporadisch allergische Reaktionen beobachtet. Es wurden seltene Fälle von anaphylaktischem Schock und angioneurotischem Ödem nach der Gabe von Triptorelin beschrieben. Im Falle solcher Reaktionen ist die Gabe von Salvacyl sofort zu beenden und es ist eine geeignete Behandlung einzuleiten.
Diabetesrisiko/kardiovaskuläres Risiko:
Epidemiologische Studien haben metabolische Veränderungen (z.B. gestörte Glukosetoleranz, Fettleber) aufgezeigt, oder es wurde über ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Erkrankungen bei Männern berichtet, die mit GnRH-Agonisten behandelt wurden. Daher sollten Patienten mit Hypertonie, Hyperlipidämie oder kardiovaskulären Erkrankungen während der Behandlung mit Triptorelin auf dieses Risiko hin überwacht werden.
Auswirkung auf das QT/QTc-Intervall:
Langfristiger Androgenentzug kann das QT-Intervall verlängern. Patienten mit QT-Verlängerung, Elektrolytstörungen oder Herzinsuffizienz sind daher zu überwachen. Die gleichzeitige Anwendung von Triptorelin mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern oder Torsade de Pointes auslösen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol), ist mit Vorsicht zu erwägen.
Patienten unter Antikoagulation:
Bei Personen unter Antikoagulation ist besondere Vorsicht geboten, da das Risiko eines Hämatoms an der Injektionsstelle besteht.
Anämie Risiko:
Aufgrund des Androgenentzugs kann die Behandlung mit GnRH-Analoga das Risiko einer Anämie erhöhen. Dieses Risiko sollte bei behandelten Patienten beurteilt und entsprechend überwacht werden.
Weitere Vorsichtsmassnahmen:
Parästhesien und schwere Migräne sind selten. In schweren oder rezidivierenden Fällen ist die Behandlung zu unterbrechen.
Bei Patienten, die mit GnRH-Analoga behandelt wurden, wurde ein Anstieg der Lymphozytenzahl beschrieben.
Pharmazeutische Hilfsstoffe von besonderem Interesse
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Dosis, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pharmakodynamische Interaktionen
Wenn Triptorelin zusammen mit Arzneimitteln angewendet wird, welche die hypophysäre Sezernierung von Gonadotropinen beeinflussen, ist besondere Vorsicht geboten, und es wird empfohlen, den Hormonstatus der Patienten zu überwachen.
Pharmakokinetische Interaktionen
Die Wahrscheinlichkeit einer Beteiligung von Cytochrom-P450(CYP)-Enzymen am Stoffwechsel und an der Elimination von Triptorelin ist gering. Darüber hinaus haben In-vitro-Daten gezeigt, dass Triptorelin weder ein CYP-Inhibitor oder -Induktor noch ein Substrat oder Inhibitor von P-Glykoprotein (P-gp) ist. Daher sind pharmakokinetische Interaktionen mit Triptorelin unwahrscheinlich.
Schwangerschaft, Stillzeit
Schwangerschaft
Salvacyl ist für die Anwendung bei Frauen nicht zugelassen.
Stillzeit
Salvacyl ist für die Anwendung bei Frauen nicht zugelassen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Verschiedene Nebenwirkungen wie Apathie, Krampfanfälle und Sehstörungen können jedoch die Reflexe abschwächen und die Fähigkeit zum Führen eines Kraftfahrzeugs und zum Bedienen von Werkzeugen oder Maschinen beeinträchtigen.
Unerwünschte Wirkungen
Die häufigsten unerwünschten Wirkungen bei der Behandlung mit Triptorelin waren auf seine erwarteten physiologischen Effekte zurückzuführen: anfänglicher Anstieg des Testosteronspiegels, gefolgt von einer fast vollständigen Suppression des Testosterons. Die am häufigsten beobachteten Wirkungen waren Hitzewallungen (46 %) und eine Atrophie der Genitalorgane (12 %).
Die folgenden unerwünschten Wirkungen wurden in klinischen Studien oder im Rahmen der Pharmakovigilanz berichtet.
Die Häufigkeit dieser unerwünschten Wirkungen kann wie folgt klassifiziert werden: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, < 1/1000); sehr selten (< 1/10'000), nicht bekannt (beruht hauptsächlich auf spontanen Meldungen aus der Marktüberwachung, die genaue Häufigkeit kann nicht angegeben werden).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Nasopharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytose.
Selten: Lymphadenopathie.
Nicht bekannt: Anämie.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen, einschliesslich anaphylaktischer Reaktion (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Endokrine Erkrankungen
Während der Post-Marketing-Phase wurden seltene Fälle von Hypophysenapoplexie beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Anorexie, verstärkter Appetit, Gewichtsverlust, Gewichtszunahme, Hyperurikämie, Hyperglykämie, erhöhtes Serumkreatinin, erhöhter Serumharnstoff, Diabetes mellitus.
Psychiatrische Erkrankungen
Häufig: Stimmungsschwankungen, verminderte Libido, Depression.
Gelegentlich: verminderte Aktivität, Nervosität, euphorische Stimmung, Reizbarkeit, emotionale Labilität, Amnesie, Verwirrtheit.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindelgefühl.
Gelegentlich: Schläfrigkeit, Schlaflosigkeit, Parästhesien.
Selten: Hypästhesie, Migräne.
Nicht bekannt: Krampfanfälle.
Augenerkrankungen
Häufig: Augenschmerzen, Bindehautentzündung.
Gelegentlich: Sehstörung, anomales Gefühl im Auge.
Selten: Gesichtsfeldstörung, Stauungspapille.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Tinnitus.
Herzerkrankungen
Sehr selten: myokardiale Ischämie.
Nicht bekannt: verlängertes QT-Intervall.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (46 %).
Gelegentlich: Hypertonie, Hypotonie, tiefe Venenthrombose, Lungenembolie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Epistaxis, Dyspnoe, Orthopnoe.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit.
Gelegentlich: Blähungen, Bauchschmerzen, Obstipation, Durchfall, Mundtrockenheit, Dysgeusie, Flatulenz, Erbrechen, Tenesmen.
Leber und Gallenerkrankungen
Gelegentlich: Anstieg der Transaminasen und/oder der alkalischen Phosphatase, cholestatische Hepatitis.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Exanthem.
Gelegentlich: Juckreiz, verstärktes Schwitzen, Akne, Alopezie, Ekzem, Purpura, Blasenbildung auf der Haut, bullöser Hautausschlag.
Selten: Urtikaria, Photosensibilisierungsreaktionen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Rückenschmerzen, schmerzende Extremitäten, Muskelkrämpfe.
Gelegentlich: Muskelschwäche, Myalgien, Nackenschmerzen, Arthralgien, Gelenksteifigkeit, Muskelkontrakturen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Volumenabnahme der Genitalien (12 %).
Häufig: Erektionsstörungen.
Gelegentlich: Überempfindlichkeit der Brust, schmerzhafte Brustdrüsen, schmerzhafte Brustwarzen, Gynäkomastie, Entzündung der Brustdrüse, Hodenschmerzen, Anejakulation.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen an der Injektionsstelle, Asthenie, periphere Ödeme.
Gelegentlich: Rötung, Bluterguss, Brennen und Entzündung an der Injektionsstelle, Müdigkeit, Brustschmerzen, Fieber, Schüttelfrost, Schmerzen, grippales Syndrom, Dysstasie (Störung des Vermögens zu stehen).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Die pharmakologischen Eigenschaften von Salvacyl machen das Risiko einer versehentlichen oder absichtlichen Überdosierung unwahrscheinlich. Tierversuche legen nahe, dass auch bei höheren Dosen von Salvacyl keine anderen als die erwarteten therapeutischen Auswirkungen auf die Konzentration der Sexualhormone und das Fortpflanzungssystem auftreten.
Behandlung
Eine mögliche Überdosierung ist symptomatisch zu behandeln.
Eigenschaften/Wirkungen
ATC-Code
L02AE04
Wirkungsmechanismus
Durch den Ersatz der Aminosäure Glycin durch D-Tryptophan an Position 6 von Gonadorelin entsteht ein Agonist, dessen biologische Aktivität stärker ist als die des natürlichen Hormons Gonadotropin-Releasing-Hormon (GnRH). Diese erhöhte Wirkung kann auf eine verstärkte Affinität für die Hypophysenrezeptoren und eine langsamere Inaktivierung zurückgeführt werden.
Pharmakodynamik
Bei der einmaligen und intermittierenden Gabe von GnRH wird die Freisetzung von LH und FSH aus der Hypophyse stimuliert. Bei einer kontinuierlichen Dosierung hingegen, wie sie durch die verlängerte Freisetzung nach der Injektion von Salvacyl erfolgt, kommt es zu einem «paradoxen» Effekt: Die Plasmaspiegel von LH, FSH, Testosteron und Östrogen/Progesteron sinken nach einem vorübergehenden Anstieg zu Beginn der Behandlung innerhalb von etwa 2 Wochen bis auf Kastrationsniveau ab. Dies führt zu einer Atrophie der akzessorischen Geschlechtsdrüsen. Diese Auswirkungen sind nach Beendigung der medikamentösen Behandlung in der Regel reversibel.
Klinische Wirksamkeit
Die Wirksamkeit von Triptorelin zur Senkung des Testosteronspiegels wurde in einer randomisierten kontrollierten Studie bei 346 Männern mit fortgeschrittenem Prostatakarzinom in Südafrika untersucht. Die Population dieser Studie bestand zu 48 % aus Weissen, zu 38 % aus Schwarzen und zu 15 % aus Personen nicht näher bezeichneter Ethnie. Das Alter dieser Männer lag zwischen 45 und 96 Jahren (Durchschnitt 71 Jahre).
Die Patienten erhielten entweder 11,25 mg Triptorelin (n = 174) alle 84 Tage für insgesamt 3 Dosen (maximale Behandlungsdauer 252 Tage) oder 3,75 mg Triptorelin (n = 172) alle 28 Tage für insgesamt 9 Dosen. Primäre Wirksamkeitskriterien waren das Erreichen der Kastration an Tag 29 und die Beibehaltung dieser Kastration von Tag 57 bis Tag 253.
Ein dem Niveau einer Kastration entsprechender Serumtestosteron-Spiegel (≤1,735 nmol/l) wurde an Tag 29 bei 167 von 171 (97,7 %) der mit Triptorelin 11,25 mg behandelten Patienten erreicht.
Ein dem Niveau einer Kastration entsprechender Serumtestosteron-Spiegel wurde von Tag 57 bis Tag 253 bei 94,4 % der mit Triptorelin 11,25 mg behandelten Patienten aufrechterhalten.
Pharmakokinetik
Absorption
Nach einer einmaligen intramuskulären Injektion von Salvacyl bei Patienten mit Prostatakarzinom betrug die Tmax 2 (2–6) Stunden und die Cmax 37,1 (22,4–57,4) ng/ml. Bei wiederholter Gabe alle 12 Wochen wurde keine Akkumulation beobachtet.
Distribution
Nach intravenöser Bolusgabe entspricht die Distribution von Triptorelin einem 3-Kompartiment-Modell mit Halbwertszeiten von 6 Minuten, 45 Minuten und 3 Stunden. Das Distributionsvolumen entspricht ungefähr 30 Litern im Steady-State. In klinisch relevanten Konzentrationen wird Triptorelin nicht an Plasmaproteine gebunden.
Metabolismus
Beim Menschen wurden keine Metaboliten von Triptorelin gefunden. Die pharmakokinetischen Daten beim Menschen zeigen aber, dass die durch Gewebezerstörung entstehenden C-terminalen Fragmente entweder vollständig im Gewebe zerstört oder schnell und endgültig im Plasma zerstört oder über die Nieren ausgeschieden werden. Eine Beteiligung der CYP450-Enzyme am Metabolismus ist unwahrscheinlich.
Elimination
Triptorelin wird über die Leber und Nieren ausgeschieden. Nach i. v. Injektion von 0,5 mg Triptorelin wurden 42 % dieser Dosis als nicht metabolisiertes Triptorelin im Urin ausgeschieden.
Die Gesamt-Clearance von Triptorelin liegt bei etwa 200 ml/min und die terminale Halbwertszeit bei 2,8 Stunden.
Kinetik spezieller Patientengruppen
Ältere Patienten
Der Einfluss des Alters auf die Pharmakokinetik von Triptorelin wurde nicht systematisch untersucht. Pharmakokinetische Daten, die an jungen männlichen Freiwilligen im Alter von 20 bis 22 Jahren mit einer supraphysiologischen Kreatinin-Clearance (ca. 150 ml/min) erhoben wurden, deuten jedoch darauf hin, dass Triptorelin bei jungen Menschen doppelt so schnell eliminiert wird. Dies ist darauf zurückzuführen, dass die Kreatinin-Clearance mit zunehmendem Alter abnimmt.
Beeinträchtigte Nierenfunktion
Bei einer beeinträchtigten Nierenfunktion nimmt die Clearance von Triptorelin proportional zur Kreatinin-Clearance ab. Die Halbwertszeit betrug 6,7 Stunden bei Patienten mit mässig beeinträchtigter Nierenfunktion (durchschnittliche Kreatinin-Clearance 40 ml/min) und 7,8 Stunden bei Patienten mit stark beeinträchtigter Nierenfunktion.
Beeinträchtigte Leberfunktion
Bei erwachsenen Patienten mit eingeschränkter Leberfunktion war der AUC-Wert von Triptorelin etwa 3,7-mal höher als bei gesunden Probanden und die Halbwertszeit von Triptorelin betrug 7,65 Stunden. Der Anteil an nicht-metabolisiertem Triptorelin, der im Urin ausgeschieden wurde, war bei diesen Patienten auf 62 % erhöht.
Präklinische Daten
Die Toxizität von Triptorelin ist gering. Die beobachteten Effekte sind im Wesentlichen auf eine Verstärkung der pharmakologischen Wirkung von Triptorelin zurückzuführen.
Nach subkutaner Injektion von 10 µg/kg bei Ratten an Tag 6 bis 15 der Trächtigkeit (im Vergleich zur klinischen Dosis von 3,75 mg alle 4 Wochen beim Menschen) hatte Triptorelin keine embryotoxischen, teratogenen oder fetotoxischen Auswirkungen. Bei 100 µg/kg wurde hingegen eine geringere Gewichtszunahme der Muttertiere sowie eine Zunahme der Resorptionen beobachtet.
Toxizität bei wiederholter Gabe
Es wurden keine Fertilitätsstudien bei männlichen Ratten durchgeführt. In Studien zur chronischen Toxizität mit klinischen Dosierungen verursachte Triptorelin makro- und mikroskopische Veränderungen in Fortpflanzungsorganen von Ratten und Hunden, die auf die Suppression der Gonadenfunktion aufgrund der pharmakologischen Aktivität dieses Wirkstoffs zurückgeführt wurden. Diese Veränderungen bildeten sich in der Erholungsphase teilweise zurück.
Mutagenität
Triptorelin ist nicht mutagen, weder in vitro noch in vivo.
Kanzerogenität
Eine 23-monatige Kanzerogenesestudie bei Ratten zeigte eine fast 100%ige Inzidenz benigner Hypophysentumore bei jeder Dosis, die zum vorzeitigen Tod führten. Die erhöhte Inzidenz von Hypophysentumoren bei Ratten ist eine Wirkung, die gemeinhin mit der Behandlung mit GnRH-Agonisten in Verbindung gebracht wird. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Bei Mäusen wurde bei Triptorelin-Dosen bis zu 6000 μg/kg nach 18 Monaten Behandlung kein onkogener Effekt beobachtet.
Reproduktionstoxizität
Bei einer 8-mal höheren Dosis als für Menschen empfohlen (bezogen auf die Körperoberfläche) wurde in Tierversuchen bei Ratten eine Toxizität für die Organogenese nachgewiesen (maternale und embryonale Toxizität). Bei jungen Ratten, die in utero hohen Dosen von Triptorelin ausgesetzt waren, gab es vereinzelte Fälle von Hydroureter.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Triptorelin in therapeutischen Dosen führt zur Suppression der Hypophysen-Gonaden-Achse. Die normale Funktion wird in der Regel nach Absetzen der Behandlung wiederhergestellt. Die Ergebnisse diagnostischer Hypophysen-Gonaden-Funktionstests während der Behandlung oder 4 bis 12 Wochen nach Absetzen eines GnRH-Agonisten können daher irreführend sein.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Aus mikrobiologischer Sicht sollte das Arzneimittel sofort verwendet werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Behälter fest verschlossen halten.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Herstellung der Suspension zur Injektion sollte unmittelbar vor der Injektion erfolgen.
Es ist die bebilderte Anleitung am Ende des Dokuments zu beachten.
Zulassungsnummer
58543 (Swissmedic).
Packungen
Salvacyl ist in zwei Darreichungsformen erhältlich:
·1 Durchstechflasche mit 11,25 mg Triptorelin als Pulver
·1 Fertigspritze mit 2 ml Lösungsmittel.
·1 Durchstechflaschenadapter und 1 Nadel (B)
oder
·1 Durchstechflasche mit 11,25 mg Triptorelin als Pulver
·1 Ampulle mit 2 ml Lösungsmittel
·1 Spritze und 2 Nadeln. (B)
Zulassungsinhaberin
Debiopharm Research & Manufacturing SA, 1920 Martigny
Stand der Information
April 2025
02-010624/11
Anleitung zur Herstellung einer Suspension
Allgemeine Anweisungen und Empfehlungen
Das Produkt ist eine Suspension von Mikropartikeln:
·Das Produkt ist eine Suspension von Mikropartikeln, die in der Verdünnung sedimentieren können. Das Produkt sollte homogen, dickflüssig und milchig aussehen. Wenn das Produkt in der Flasche sedimentiert, schütteln Sie sie erneut.
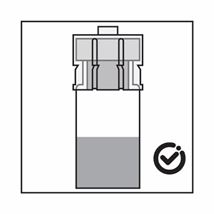
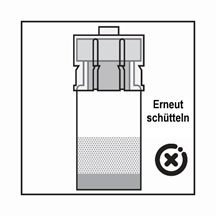
·Wenn sich die Partikel in der Spritze absetzen, führt dies zu einer Blockierung der Nadel bei der Verabreichung. Es ist sehr wichtig, das Produkt innerhalb von 2 Minuten nach der Rekonstitution in der Durchstechflasche zu injizieren.
·Wenn das Produkt in der Spritze sedimentiert, ziehen Sie etwas Luft in die Spritze auf, schütteln Sie die Flasche erneut und drücken Sie die Luft heraus (ohne die Nadel mit der Flüssigkeit zu aspirieren), bevor Sie das Produkt verabreichen.
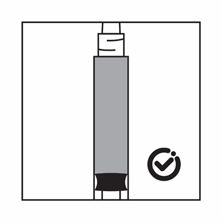
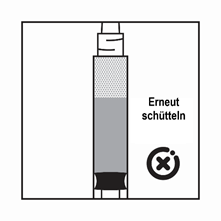
Anweisungen zur Herstellung der Suspension von Salvacyl in der Darreichungsform mit vorgefüllter Lösungsmittelspritze
|
1 |
Die Durchstechflasche mit dem Pulver entnehmen. |
|
| ||
|
2 |
Die Schutzfolie vom Adaptersystem entfernen. Entfernen Sie den Flaschenadapter nicht aus dem Blister. Die Durchstechflasche auf eine flache, harte Oberfläche stellen. Den Adapter auf dem Verschluss der Durchstechflasche zentrieren und hineindrücken, bis ein Klicken zu hören ist. Den Blister entfernen und entsorgen. |
|
|
| |
|
3 |
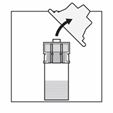
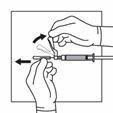
Nehmen Sie die Spritze auf, halten Sie sie am (drehbaren) Kunststoff-Konnektor zwischen Zeigefinger und Daumen einer Hand fest und schrauben Sie mit der anderen Hand die Kappe ab. |
|
|
| |
|
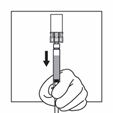
4 |
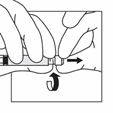
Halten Sie die Durchstechflasche am Adapter mit einer Hand fest, drücken Sie mit der anderen Hand den Kolben der Spritze und injizieren Sie langsam den gesamten Inhalt der Spritze in die Durchstechflasche. |
|
| ||
|
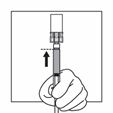
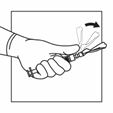
5 |
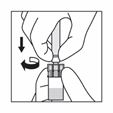
Halten Sie das gesamte System (Spritze, Adapter und Flasche) fest in der Hand und schütteln Sie es dann 30 Sekunden lang kräftig auf und ab. |
|
| ||
|
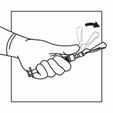
6 |
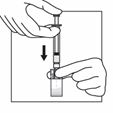
Drehen Sie das System, so dass die Flasche oben und die Spritze unten ist. Ziehen Sie vorsichtig an der Kolbenstange, um den gesamten Inhalt der Flasche in die Spritze aufzuziehen. |
|
|
| |
|
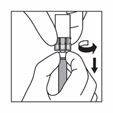
7 |
Wenn der gesamte Inhalt in die Spritze aufgezogen ist, entfernen Sie Luftblasen aus der Spritze in die Durchstechflasche. Stoppen Sie, bevor die Suspension die Basis des Spritzenkopfes erreicht. |
|
|
|
|
|
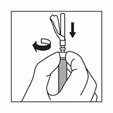
8 |
Schieben Sie die Sicherheitshülle hinter die Nadel und in Richtung des Spritzenkörpers. Die Sicherheitshülle verbleibt in der Position. |
|
|
| |
|
9 |
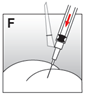
Injizieren Sie die Suspension relativ schnell und ohne Unterbrechung intramuskulär. Achten Sie darauf, dass die gesamte Menge innerhalb von 10 Sekunden ohne Unterbrechung injiziert wird. |
|
|
|
Die Nadeln in einem dafür vorgesehenen Behälter entsorgen.
Nur zur einmaligen Verwendung. Jede nicht verwendete Suspension muss entsorgt werden.
Anleitungen zur Herstellung der Suspension von Salvacyl in der Darreichungsform mit Lösungsmittelampulle
|
1. Vorbereitung der Injektion | ||||
|
·Den Nadelschutz der Rekonstitutionsnadel entfernen und das gesamte Lösungsmittel in die Spritze aufziehen (Abb. A). |
|
| ||
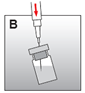
|
·Die Spritze mit dem Lösungsmittel wieder aufnehmen, die Nadel in den Gummistopfen des Fläschchens einstechen und das Lösungsmittel langsam injizieren, sodass es weitgehend an der Flaschenwand herunterläuft (Abb. B). |
|
| ||
|
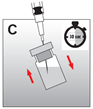
·Die Nadel oberhalb des Flüssigkeitsspiegels zurückziehen und die Durchstechflasche 30 Sekunden lang kräftig schütteln. Die Suspension sollte milchig und homogen aussehen (Abb. C). Überprüfen, dass kein Pulver in der Flasche verbleibt, und wenn nötig, die Suspension fortsetzen, bis das Pulver vollständig verschwunden ist. |
|
| ||
|
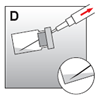
·Die gesamte Injektionssuspension in die Spritze aufziehen (Abb. D). |
|
| ||
|
·Die Rekonstitutionsnadel entfernen. Die Injektionsnadel mit Sicherheitssystem fest auf die Spritze drehen (bis zum Anschlag). Nur die farbige Hülle fassen. |
|
|
| |
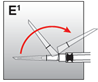
|
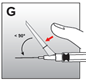
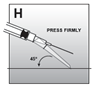
2. Injektion |
|
| ||
|
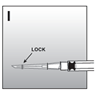
3. Nach der Verabreichung |
|
|
|
|