Zusammensetzung
Wirkstoffe
Mifamurtid (vollsynthetisches Analogon eines Zellwandbestandteils von Mycobacterium sp.) als Mifamurtid Natrium.
Hilfsstoffe
1-Palmitoyl-2-oleoyl-sn-glycero-3-phosphocholin (POPC),1,2-Dioleoyl-sn-glycero-3-phospho-L-serin, Mononatriumsalz (OOPS) pro vitro (entspricht Natrium 8,13 – 9,9 mg).
Indikationen/Anwendungsmöglichkeiten
MEPACT wird zusammen mit einer postoperativen Kombinations-Chemotherapie zur Behandlung nicht metastasierter, resezierbarer hochmaligner Osteosarkome im Anschluss an eine makroskopisch vollständige Tumorresektion eingesetzt. Unbedenklichkeit und Wirksamkeit wurden in Studien an Patienten im Alter von 2 bis 30 Jahren bei Diagnosestellung geprüft (siehe «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
Die Behandlung mit MEPACT sollte von spezialisierten Ärzten eingeleitet und überwacht werden, die über Erfahrung in der Diagnose und Therapie des Osteosarkoms verfügen.
Die empfohlene Mifamurtid-Dosis beträgt für Kinder ab 2 Jahren, Jugendliche und junge Erwachsene 2 mg/m2 Körperoberfläche. Es wird als i.v. Infusion über 1 Stunde 12 Wochen lang zweimal wöchentlich im Abstand von jeweils mindestens 3 Tagen sowie weitere 24 Wochen lang einmal wöchentlich verabreicht (insgesamt 48 Infusionen innerhalb eines Zeitraums von 36 Wochen).
MEPACT darf nicht als Bolusinjektion verabreicht werden.
Hinweise zur Rekonstitution, Filtration über den beiliegenden Filter und Verdünnung vor der Anwendung siehe «Hinweise für die Handhabung».
Da an der randomisierten Phase-III-Studie nur Patienten im Alter von bis zu 30 Jahren teilnahmen, liegen keine ausreichenden Daten vor, um die Anwendung von MEPACT bei Patienten >30 Jahren empfehlen zu können.
Wenn MEPACT über die Dauer der Chemotherapie hinaus angewendet wird, empfiehlt sich die kontinuierliche Kontrolle der Leber- und Nierenfunktion bis zum Abschluss aller Therapiemassnahmen.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Leichte bis mittelschwere Leberfunktionsstörungen (Child-Pugh Klasse A oder B) hatten keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Mifamurtid. Eine Dosisanpassung ist daher nicht erforderlich. Bei Patienten mit mittelschwerer Leberfunktionsstörung wird aber aufgrund der dort höheren Variabilität der pharmakokinetischen Parameter zur Vorsicht geraten.
Bei Patienten mit schwerer Leberinsuffizienz (Child Pugh Klasse C) wurde Mifamurtid nicht untersucht. Eine Anwendung von MEPACT sollte daher bei solchen Patienten nur unter besonderer Vorsicht erfolgen.
Patienten mit Nierenfunktionsstörungen
Leichte bis mittelschwere Nierenfunktionsstörungen [Kreatinin-Clearance (ClKr) ≥30 ml/min] hatten keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Mifamurtid. Eine Dosisanpassung ist daher nicht erforderlich.
Bei Patienten mit schwerer Niereninsuffizienz wurde Mifamurtid nicht untersucht. Eine Anwendung von MEPACT sollte daher bei solchen Patienten nur unter besonderer Vorsicht erfolgen.
Ältere Patienten
Zur Sicherheit und Wirksamkeit von Mifamurtid bei Patienten ≥65 Jahre mit Osteosarkom liegen keine Daten vor.
Kinder und Jugendliche
Unbedenklichkeit und Wirksamkeit von MEPACT wurden für Kinder ab einem Alter von 2 Jahren nachgewiesen. Bei Kindern unter zwei Jahren wird die Anwendung aufgrund des Fehlens von Daten zur Sicherheit und Wirksamkeit nicht empfohlen.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Gleichzeitige Anwendung von Ciclosporin oder anderen Calcineurin-Inhibitoren (siehe «Interaktionen»).
Gleichzeitige Anwendung von hoch dosierten, nicht-steroidalen Antiphlogistika (NSAID, Cyclooxygenase-Inhibitoren) (siehe «Interaktionen»).
Warnhinweise und Vorsichtsmassnahmen
Entzündliche Reaktionen
Gelegentlich traten im Zusammenhang mit der Anwendung von MEPACT ausgeprägte Entzündungsreaktionen mit z.B. Perikarditis oder Pleuritis auf. MEPACT sollte daher bei Patienten mit anamnestisch bekannten Autoimmunerkrankungen, entzündlichen Erkrankungen oder Kollagenosen mit Vorsicht angewendet werden. Während der Gabe von MEPACT sollten die Patienten im Hinblick auf auffällige Symptome (wie z.B. Arthritis oder Synovitis), die auf unkontrollierte Entzündungsreaktionen hindeuten könnten, überwacht werden.
Kardiovaskuläre Störungen
Patienten mit bekannten venösen Thrombosen, Vaskulitiden oder instabilen kardiovaskulären Erkrankungen sollten während der Behandlung mit MEPACT engmaschig überwacht werden. Wenn Symptome anhaltend und verstärkt auftreten, sollte die Gabe aufgeschoben bzw. abgebrochen werden.
Atemwegsobstruktion
Es wurde über leichte bis mittelgradige Atembeschwerden im Zusammenhang mit Mifamurtid berichtet. Bei Patienten mit bekanntem Asthma bronchiale oder sonstigen chronisch-obstruktiven Lungenerkrankungen sollte die prophylaktische Anwendung eines Bronchodilatators erwogen werden. Sollten schwere respiratorische Nebenwirkungen auftreten, muss die Anwendung von MEPACT beendet und eine angemessene Behandlung eingeleitet werden.
Neutropenie
Eine reversible Neutropenie entwickelte sich unter Behandlung mit MEPACT häufig, in der Regel in Verbindung mit einer Chemotherapie. Episoden einer febrilen Neutropenie sollten angemessen überwacht und behandelt werden. Die Anwendung von MEPACT kann während neutropenischer Phasen zwar fortgesetzt werden; jedoch sind die Patienten in diesem Fall engmaschig auf das Auftreten von therapiebedingtem Fieber hin zu überwachen. Tritt nach Gabe von MEPACT Fieber oder Schüttelfrost von über 8 Stunden Dauer auf, sollte eine Sepsisabklärung erfolgen.
Allergische Reaktionen
Gelegentlich traten unter Behandlung mit MEPACT allergische Reaktionen (z.B. Hautausschlag, Kurzatmigkeit, Hypertonie 4. Grades) auf. Diese allergischen Reaktionen sind nicht sicher von übersteigerten entzündlichen Reaktionen abzugrenzen, doch sollten die Patienten auf Zeichen einer allergischen Reaktion hin beobachtet werden.
Gastrointestinale Toxizität
Übelkeit, Erbrechen und Appetitlosigkeit treten sehr häufig als unerwünschte Wirkungen von MEPACT auf. Die gastrointestinale Toxizität ist bei Anwendung von MEPACT zusammen mit einer hoch dosierten Kombinations-Chemotherapie gegebenenfalls verstärkt und machte den vermehrten Einsatz parenteraler Ernährungsmassnahmen erforderlich.
Sonstiges
In Tierversuchen wurden bei sehr hoch dosierter Anwendung Blutungen beobachtet. Diese sind unter der empfohlenen Dosierung zwar nicht zu erwarten, dennoch empfiehlt es sich, die Gerinnungsparameter nach der ersten Gabe sowie erneut nach mehreren Gaben zu kontrollieren.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pharmakokinetische Interaktionen
In in-vitro-Interaktionsstudien wurde die Stoffwechselaktivität des Zytochrom-P450-Systems in gepoolten menschlichen Lebermikrosomen weder durch liposomale noch durch nicht-liposomale Zubereitungen von Mifamurtid gehemmt. In Primärkulturen frisch isolierter menschlicher Hepatozyten wurde die metabolische Aktivität oder Transkription von Zytochrom-P450-Enzymen durch liposomale und nicht-liposomale Zubereitungen von Mifamurtid nicht induziert.
Daher sind keine Interaktionen von Mifamurtid mit Substanzen zu erwarten, welche über die Zytochrom-P450-Enzyme metabolisiert werden.
Pharmakodynamische Interaktionen
Zu einem möglichen Einfluss von MEPACT auf eine Chemotherapie wurden nur wenige Studien durchgeführt, aus denen sich keine abschliessende Beurteilung ableiten lässt.
Sofern ein Chemotherapie-Regime die Anwendung von MEPACT und Doxorubicin oder anderen lipophilen Substanzen vorsieht, wird empfohlen, diese Arzneimittel zeitlich getrennt zu verabreichen.
Die gemeinsame Anwendung von MEPACT und Ciclosporin sowie anderen Calcineurin-Inhibitoren ist kontraindiziert, da theoretisch Auswirkungen auf die Funktion der Milzmakrophagen und mononukleären Phagozyten auftreten können (siehe «Kontraindikationen»).
Darüber hinaus wurde in vitro gezeigt, dass NSAID (Cyclooxygenase-Inhibitoren) in hoher Dosierung die Makrophagen-aktivierende Wirkung von liposomalem Mifamurtid hemmen können. Daher ist die gleichzeitige Anwendung von hochdosierten NSAID kontraindiziert (siehe «Kontraindikationen»).
Da die Wirkung von Mifamurtid auf der Anregung des Immunsystems beruht, sollte eine längerfristige oder Daueranwendung von Kortikoiden während der Behandlung mit MEPACT vermieden werden.
In einer grossen kontrollierten, randomisierten Studie wurde MEPACT gemeinsam mit anderen Arzneimitteln mit bekannter renaler (Cisplatin, Ifosfamid) oder hepatischer (Methotrexat hoch dosiert, Ifosfamid) Toxizität eingesetzt. Die Toxizität dieser Substanzen wurde durch MEPACT in der empfohlenen Dosierung nicht verstärkt und es ergab sich auch keine Notwendigkeit zur Anpassung der Mifamurtid-Dosis.
Schwangerschaft, Stillzeit
Schwangerschaft
Es liegen keine Daten zur Anwendung von Mifamurtid bei Schwangeren vor. Tierstudien zur Reproduktionstoxizität sind unzureichend (siehe «Präklinische Daten»). MEPACT sollte daher nicht bei schwangeren Frauen und bei Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, eingesetzt werden.
Stillzeit
Ein möglicher Übergang von Mifamurtid in die Muttermilch wurde nicht untersucht. Die Entscheidung über Fortsetzung oder Abbruch des Stillens bzw. der Therapie sollte unter Abwägung der Vorteile des Stillens für das Kind und der Vorteile der Behandlung der Mutter mit MEPACT getroffen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
MEPACT hat einen mässigen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Es wurden keine entsprechenden Studien durchgeführt.
Einige sehr häufige oder häufige unerwünschte Wirkungen von MEPACT (z.B. Benommenheit, Schwindel, Müdigkeit und Verschwommensehen) können die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Unerwünschte Wirkungen
Alle 248 Patienten, die während den einarmigen Phase-I und -II-Studien mit MEPACT behandelt wurden, zeigten mindestens eine unerwünschte Wirkung. Die häufigsten unerwünschten Wirkungen, die bei > 50% der Patienten auftraten, waren Schüttelfrost, Fieber, Müdigkeit, Übelkeit, Tachykardie und Kopfschmerzen. Es wird davon ausgegangen, dass viele der häufigsten unerwünschten Wirkungen im Zusammenhang mit dem Wirkungsmechanismus von Mifamurtid stehen.
Das Profil der unerwünschten Wirkungen ist konsistent, unabhängig davon ob, alle früheren Studien (n=248) oder nur die Studien zum Osteosarkom (n=51) zusammengefasst werden.
Unerwünschte Wirkungen werden nachfolgend nach Organsystem und Häufigkeit klassifiziert. Bei den Häufigkeitsangaben werden folgende Kategorien zugrunde gelegt: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000), «nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Häufig: Sepsis, Zellulitis, Nasopharyngitis, Katheterinfektion, Infektion des oberen Respirationstrakts, Harnwegsinfektion, Pharyngitis, Herpes-simplex-Infektion.
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Anämie (10%).
Häufig: Leukopenie, Thrombopenie, Granulozytopenie, febrile Neutropenie.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Anorexie (21%).
Häufig: Dehydration, Hypokaliämie, Appetitlosigkeit, Gewichtsabnahme.
Psychiatrische Erkrankungen
Häufig: Verwirrtheit, Depression, Schlafstörungen, Angstzustände.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (50%), Schwindel (17%).
Häufig: Parästhesien, Hypästhesien, Tremor, Schläfrigkeit, Lethargie.
Augenerkrankungen
Häufig: Verschwommensehen.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo, Tinnitus, Hörstörungen.
Herzerkrankungen
Sehr häufig: Tachykardie (50%).
Häufig: Zyanose, Palpitationen.
Nicht bekannt: perikardialer Erguss.
Gefässerkrankungen
Sehr häufig: Hypotonie (29%), Hypertonie (26%).
Häufig: Phlebitis, Hitzewallungen, Blässe.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Dyspnoe (21%), Husten (18%), Tachypnoe (13%).
Häufig: Pleuraerguss, produktiver Husten, Hämoptysen, Wheezing, Nasenbluten, Belastungsdyspnoe, Nasennebenhöhlenaffektionen, verstopfte Nase, pharyngolaryngeale Schmerzen.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (57%), Erbrechen (44%), Obstipation (17%), Diarrhö (13%), Bauchschmerzen (11%).
Häufig: Oberbauchschmerzen, Dyspepsie, aufgetriebenes Abdomen, Unterbauchschmerzen.
Leber- und Gallenerkrankungen
Häufig: Schmerzen im Bereich der Leber.
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: vermehrtes Schwitzen (11%).
Häufig: Hautausschlag, Pruritus, Erythem, Alopezie, trockene Haut.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Myalgien (31%), Rückenschmerzen (15%), Gliederschmerzen (12%), Arthralgien (10%).
Häufig: Muskelkrämpfe, Muskel- und Gelenksteifigkeit, Schmerzen in: Nackenregion, Leistenregion, Knochen, Schulter oder Thoraxwand.
Erkrankungen der Nieren und Harnwege
Häufig: Hämaturie, Dysurie, Pollakisurie, Kreatininerhöhung.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Dysmenorrhoe.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schüttelfrost (89%), Fieber (85%), Müdigkeit (53%), Hypothermie (23%), Schmerzen (15%), Asthenie (13%), Krankheitsgefühl (13%), thorakale Schmerzen (11%).
Häufig: periphere Ödeme, Ödeme, Mukositis, Rötung, Schmerzen und andere Reaktionen an der Injektions-/Infusionsstelle, Schmerzen an der Kathetereinstichstelle, Tumorschmerzen, thorakale Missempfindungen, Kältegefühl.
Beschreibung ausgewählter Nebenwirkungen
Erkrankungen des Immunsystems
In einer Phase-I-Studie wurde über eine schwere allergische Reaktion berichtet, die nach der ersten Mifamurtid-Infusion in einer Dosierung von 6 mg/m2 auftrat. Der Patient litt unter Zittern, Schüttelfrost, Fieber, Übelkeit, Erbrechen, unkontrollierbarem Husten, Atemnot, zyanotischen Lippen, Schwindel, Schwäche, Hypotonie, Tachykardie, Hypertonie und Hypothermie, die zum Studienabbruch führten. In einer Phase III Studie wurde auch über eine allergische Reaktion (Hypertonie) Grad 4 berichtet, die eine stationäre Behandlung erforderlich machte (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Die maximal tolerierte Dosis lag in den Phase-I-Studien bei 4-6 mg/m2 und ging mit sehr unterschiedlich ausgeprägten unerwünschten Wirkungen einher. Die unter hohen Dosen auftretenden bzw. dosislimitierenden Symptome wie Fieber, Schüttelfrost, Müdigkeit, Übelkeit, Erbrechen, Kopfschmerzen und Hyper- oder Hypotonie verliefen nicht lebensbedrohlich.
Behandlung
Bei einer Überdosierung ist eine geeignete supportive Therapie einzuleiten, die sich nach den vorliegenden Symptomen und nach den Leitlinien der jeweiligen Institution richten sollte.
Eigenschaften/Wirkungen
ATC-Code
L03AX15
Wirkungsmechanismus
Mifamurtid (Muramyltripeptid-Phosphatidylethanolamin, MTP-PE) ist ein vollsynthetisches Analogon von Muramyldipeptid (MDP), dem immunstimulierenden Bestandteil der Zellwand von Mycobacterium sp. Mifamurtid hat ähnliche immunstimulierende Eigenschaften wie das natürliche MDP. MEPACT ist eine liposomale Zubereitung, die in vivo nach intravenöser Infusion gezielt von Makrophagen aufgenommen wird.
Die Anwendung von MEPACT in vivo bewirkte in Maus- und Rattenmodellen von Lungenmetastasen, Haut- und Lebertumoren sowie Fibrosarkomen eine Hemmung des Tumorwachstums.
Eine signifikante Verlängerung des krankheitsfreien Überlebens wurde auch bei Hunden bei der adjuvanten Behandlung von Osteosarkomen und Hämangiosarkomen gezeigt. Der genaue Wirkungsmechanismus, über den die Aktivierung von Monozyten und Makrophagen zur tumorhemmenden Wirkung von MEPACT bei Menschen und Versuchstieren führt, ist noch nicht bekannt.
Pharmakodynamik
Mifamurtid bindet spezifisch an NOD2, einen hauptsächlich auf Monozyten, dendritischen Zellen und Makrophagen vorhandenen Rezeptor, und ist ein Makrophagenaktivator. Bei Aktivierung menschlicher Makrophagen durch MEPACT werden Zytokine wie Tumornekrosefaktor (TNF-α), Interleukin-1 (IL-1ß), IL-6, IL-8 und IL-12 sowie Adhäsionsmoleküle wie das Lymphozytenfunktions-assoziierte Antigen-1 (LFA-1) und das interzelluläre Adhäsionsmolekül-1 (ICAM-1) gebildet. In in vitro mit Mifamurtid behandelte menschliche Monozyten töteten allogene und autologe Tumorzellen (u.a. von Melanomen, Ovarial-, Colon- und Nierenzellkarzinomen) ab, ohne toxisch auf die normalen Zellen zu wirken.
Klinische Wirksamkeit
In einer randomisierten Phase-III-Studie an 678 Patienten im Alter von 1,4-30,6 Jahren mit frisch diagnostizierten resezierbaren hochmalignen Osteosarkomen führte die Zugabe von MEPACT zu einer Kombinations-Chemotherapie (Doxorubicin/Cisplatin/Methotrexat mit oder ohne Ifosfamid) gegenüber der alleinigen Chemotherapie zu einer signifikanten Erhöhung der Gesamtüberlebensrate. Der Zusatz von MEPACT reduzierte gegenüber der alleinigen Chemotherapie das Sterberisiko um 28% (Hazard Ratio = 0,72 [95%-Konfidenzintervall = 0,53; 0,97], p=0,031).
Pharmakokinetik
Absorption
Nicht zutreffend.
Distribution
Sechs Stunden nach Injektion von radioaktiv markierten Liposomen mit 1 mg Mifamurtid wurde Radioaktivität in Leber, Milz, Nasopharynx und Schilddrüse sowie in geringerem Ausmass auch in der Lunge nachgewiesen. Die Liposomen wurden von Zellen des retikuloendothelialen Systems phagozytiert. Bei zwei der vier Patienten mit Lungenmetastasen fand sich die Radioaktivität im Bereich der Lungenmetastasen.
Metabolismus
Der Metabolismus von Mifamurtid wurde beim Menschen nicht untersucht.
Elimination
Nach intravenöser Gabe einer Dosis von 4 mg bei gesunden erwachsenen Probanden wurde Mifamurtid mit einer Halbwertszeit von 2,05±0,40 Stunden aus dem Serum entfernt und die Gesamtkonzentrationen im Serum (d.h. Summe der liposomalen und freien Fraktion) waren sehr gering. Die AUC betrug im Mittel 17,0±4,86 h x nM, die Cmax 15,7±3,72 nM.
Nach Injektion radioaktiv markierter Liposomen, die Mifamurtid enthielten, war die mittlere Halbwertszeit des radioaktiven Materials biphasisch mit einer α-Phase mit einer Halbwertszeit von etwa 15 Minuten sowie einer terminalen Halbwertszeit von etwa 18 Stunden. In einer Studie mit Mehrfachdosierung (2mal wöchentlich) fanden sich weder für die Gesamtkonzentration noch für die freie Fraktion Hinweise auf eine Kumulation von Mifamurtid.
Kinetik spezieller Patientengruppen
Die Pharmakokinetik von Mifamurtid bei Patienten unterschied sich nicht in relevanter Weise von jener bei gesunden Probanden.
Leberfunktionsstörungen
Die Pharmakokinetik einer Einzeldosis von 4 mg Mifamurtid-Natrium wurde bei erwachsenen Probanden mit leichter (Child-Pugh Klasse A; n=9) oder mittelschwerer (Child-Pugh Klasse B; n=8) Leberfunktionsstörung im Vergleich zu Erwachsenen mit normaler Leberfunktion (n=19) untersucht. Eine leichte Leberfunktionsstörung zeigte keinen relevanten Einfluss auf die systemische Exposition (AUCinf) des Gesamt-Mifamurtid. Auch die Halbwertszeit des gesamten und des freien MTP-PE war ähnlich jener bei Gesunden. Bei mittelschwerer Leberfunktionsstörung war die AUCinf des Gesamt- Mifamurtid, bei insgesamt erhöhter Variabilität der pharmakokinetischen Parameter, gegenüber Lebergesunden um 19% erhöht (90% KI: 94,1%-151%). Die Halbwertszeit des gesamten und des freien MTP-PE war bei diesen Patienten gegenüber Gesunden um etwa eine Stunde verlängert.
Darüber hinaus war die mittlere Plasma AUCinf des freien (nicht-Liposom-gebundenen) Mifamurtid bei leichter und mittelschwerer Leberfunktionsstörung um 47% höher als die korrespondierenden Werte der entsprechenden Gruppen mit normaler Leberfunktion. Diese Unterschiede werden als klinisch nicht relevant erachtet.
Bei schwerer Leberinsuffizienz (Child-Pugh C) wurde Mifamurtid nicht untersucht.
Nierenfunktionsstörungen
Die Pharmakokinetik einer Einzeldosis von 4 mg Mifamurtid-Natrium wurde bei erwachsenen Probanden mit leichter (n=9) oder mittelschwerer (n=8) Nierenfunktionsstörung im Vergleich zu Erwachsenen mit normaler Nierenfunktion (ClKr > 80 mL/min, n=16) untersucht. Eine leichte (50 mL/min ≤ ClKr ≤80 mL/min) oder mittelschwere (30 mL/min ≤ ClKr < 50 mL/min) Niereninsuffizienz zeigte keinen relevanten Einfluss auf die Clearance des Gesamt-Mifamurtid oder die systemische Exposition (AUCinf) des freien (nicht-Liposom-gebundenen) Mifamurtid.
Bei schwerer Niereninsuffizienz (ClKr < 30 mL/min) wurde Mifamurtid nicht untersucht.
Kinder und Jugendliche
Die Pharmakokinetik von Mifamurtid wurde bei Osteosarkom-Patienten ab einem Alter von 6 Jahren untersucht. Clearance und Halbwertszeit unterschieden sich nicht in relevanter Weise von jener in Erwachsenen, sodass die empfohlene Dosierung von 2mg/m2 für alle Altersgruppen als adäquat erachtet werden kann.
Präklinische Daten
In empfindlichen Spezies (Kaninchen und Hunde) betrug die höchste Tagesdosis, die keine Nebenwirkungen hervorrief, 0,1 mg/kg (entsprechend 1,2 bzw. 2 mg/m2) liposomales Mifamurtid. Dieser No-Adverse-Effect-Level (NOAEL) bei Tieren entspricht in etwa der für MEPACT empfohlenen Dosis von 2 mg/m2 beim Menschen.
Daten aus einer 6-monatigen Studie an Hunden, die täglich eine intravenöse Injektion von bis zu 0,5 mg/kg (10 mg/m2) MEPACT erhielten, zeigen gegenüber der empfohlenen klinischen Dosis beim Menschen für die kumulative Exposition einen 8- bis 19-fachen Sicherheitsabstand in Bezug auf die ersichtliche Toxizität. Die wesentlichen toxischen Wirkungen, die unter diesen hohen Tages- und kumulativen Dosen auftraten, stellten in der Hauptsache übersteigerte pharmakologische Wirkungen von MEPACT dar und umfassten Pyrexie, Zeichen einer starken Entzündungsreaktion wie Synovitis, Bronchopneumonie und Perikarditis sowie entzündliche Nekrosen in Leber und Knochenmark. Daneben wurden folgende Ereignisse beobachtet:
Blutungen und verlängerte Gerinnungszeiten, Infarkte, morphologische Wandveränderungen in kleinen Arterien, Ödeme und Stauungen im Zentralnervensystem, geringfügige kardiale Wirkungen sowie leichte Hyponatriämie. MEPACT war nicht mutagen und verursachte bei Ratten und Kaninchen keine teratogenen Wirkungen. Embryotoxische Wirkungen traten nur in maternal toxischen Dosierungen auf.
Die Ergebnisse der Studien zur allgemeinen Toxizität lassen nicht auf schädliche Wirkungen auf die männlichen oder weiblichen Reproduktionsorgane schliessen. Gezielte Studien zur Fertilität, perinatalen Toxizität oder Karzinogenität wurden jedoch nicht durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Das Arzneimittel darf nur mit den unter Hinweise für die Handhabung aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Pulver in der ungeöffneten Durchstechflasche:
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Rekonstituierte Dispersion:
Die chemische und physikalische Stabilität wurde bei bis zu 25°C für 6 Stunden nachgewiesen.
Aus mikrobiologischer Sicht wird eine sofortige Verwendung empfohlen. Falls die Dispersion nach Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und Bedingungen der Aufbewahrung der rekonstituierten, gefilterten und verdünnten Dispersion verantwortlich. Diese darf 6h bei max. 25°C nicht überschreiten. Die Dispersion nicht im Kühlschrank lagern und nicht einfrieren.
Besondere Lagerungshinweise
Im Kühlschrank lagern (2–8°C).
Nicht einfrieren.
Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Lagerungsbedingungen des rekonstituierten Arzneimittels siehe «Haltbarkeit».
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Zubereitung der infusionsfertigen Dispersion muss unter aseptischen Bedingungen vorgenommen werden.
Vor der Anwendung muss MEPACT rekonstituiert, über den beigefügten Filter filtriert und anschliessend weiterverdünnt werden. Die rekonstituierte, filtrierte und verdünnte Infusionsdispersion ist eine homogene, weisse bis rohweisse, undurchsichtige liposomale Dispersion, die frei von sichtbaren Partikeln, Schaum oder Fettklümpchen sein muss.
Nach Rekonstitution, Filtration über den beiliegenden Filter und Verdünnung wird MEPACT als intravenöse Infusion über einen Zeitraum von 1 Stunde verabreicht.
Der Inhalt einer Durchstechflasche wird mit 50 ml isotonischer Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion rekonstituiert. Nach Rekonstitution enthält jeder ml der Dispersion in der Durchstechflasche 0,08 mg Mifamurtid-Natrium. Die der berechneten Dosis entsprechende Menge der rekonstituierten Dispersion wird entsprechend den nachfolgend beschriebenen Einzelschritten über den beigefügten Filter aufgezogen und mit weiteren 50 ml isotonischer Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion verdünnt.
Hinweise zur Zubereitung von MEPACT zur intravenösen Infusion
Beiliegende Materialien je Packung
·MEPACT Pulver für ein Konzentrat zur Herstellung einer Infusionsdispersion (Durchstechflasche)
·Filter für MEPACT Es sollte nur der mitgelieferte Filter verwendet werden.
Weitere erforderliche Materialien, die nicht beiliegen
·Isotonische Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion, 100 ml Beutel
·Sterile Einmalspritze 60 ml oder 100 ml mit Luer-Anschluss
·Zwei mittelstarke (18G) sterile Injektionsnadeln
Es wird empfohlen, die Rekonstitution der liposomalen Dispersion in einer Laminar-Flow-Kabine mit sterilen Handschuhen und unter aseptischen Kautelen vorzunehmen.
Das gefriergetrocknete Pulver sollte vor der Rekonstitution, Filtration mit dem beigefügten Filter und Verdünnung eine Temperatur von etwa 20-25°C annehmen. Dies ist nach etwa 30 Minuten der Fall.
1.Den Schnappdeckel der Durchstechflasche entfernen und Stopfen mit Alkoholtupfer reinigen.
2.Den Filter aus der Blisterpackung entnehmen, und den Dorn des Filters nach Abziehen der Kappe fest durch das Septum der Durchstechflasche stechen, bis der Filter aufsitzt. Die Kappe auf dem Luer-Anschluss des Filters sollte noch nicht abgezogen werden.
3.Einen Beutel mit 100 ml isotonischer Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion, Nadel und Spritze bereitlegen (nicht in der Packung enthalten).
4.Vorgesehene Einstichstelle des Beutels mit der isotonischen Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion mit einem Alkoholtupfer abwischen.
5.50 ml isotonischer Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion mit Nadel und Spritze aus dem Beutel aufziehen.
6.Nadel von der Spritze abziehen, Kappe am Luer-Anschluss des Filters öffnen und Spritze auf den Luer-Anschluss des Filters aufsetzen (Abb. 1).
|
|
|
Es sollte nur der mitgelieferte Filter verwendet werden. |
7.Isotonische Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion durch festen Druck auf den Spritzenkolben langsam in die Durchstechflasche geben. Filter und Spritze nicht aus der Durchstechflasche ziehen.
8.Durchstechflasche etwa eine Minute lang ruhig stehen lassen, damit die Trockensubstanz vollständig durchfeuchtet wird.
9.Anschliessend Durchstechflasche mit aufgesetztem Filter und Spritze eine Minute lang kräftig schütteln. Dadurch kommt es zur spontanen Ausbildung der Liposomen (Abb. 2).
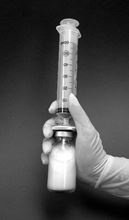
Abbildung 2
10.Durchstechflasche auf den Kopf stellen und die gewünschte Dosis durch langsames Zurückziehen des Spritzenkolbens aufziehen (Abb. 3). Jeder ml der rekonstituierten Lösung enthält 0,08 mg Mifamurtid-Natrium. Das aufzuziehende Volumen je Dosis wird folgendermassen berechnet:
Aufzuziehendes Volumen = [12,5 x berechnete Dosis (mg)] ml
Nachfolgend sind für einige häufige Beispiel-Dosierungen die entsprechenden Volumina angegeben:
|
Dosis |
Volumen |
|
1,0 mg |
12,5 ml |
|
2,0 mg |
25 ml |
|
3,0 mg |
37,5 ml |
|
4,0 mg |
50 ml |
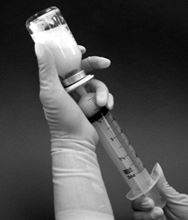
Abbildung 3
11.Gefüllte Spritze vom Filter abziehen und eine frische Nadel aufsetzen. Vorgesehene Injektionsstelle am Infusionsbeutel mit einem Alkoholtupfer abwischen und die Dispersion aus der Spritze in den Originalbeutel mit der restlichen isotonischen Natriumchloridlösung 0,9% (9 mg/ml) zur Injektion injizieren (Abb. 4).
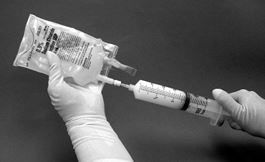
Abbildung 4
12.Lösung durch vorsichtiges Schwenken des Beutels durchmischen.
13.Patientenangaben, Datum und Uhrzeit auf dem Etikett des Beutels mit der konstituierten, filtrierten und verdünnten liposomalen Dispersion vermerken.
14.Die chemische und physikalische Stabilität wurde bei Raumtemperatur (etwa 20°C-25°C) für 6 Stunden nachgewiesen.
15.Aus mikrobiologischer Sicht sollte die Dispersion sofort verwendet werden. Falls diese nicht sofort verwendet wird, ist der Anwender für die Dauer und Bedingungen der Aufbewahrung bis zur Anwendung verantwortlich, die normalerweise 6 Stunden Raumtemperatur nicht überschreiten sollte.
16.Basierend auf der liposomalen Natur des Produkts wird eine Verwendung eines Infusionsset mit einem Inline-Filter während der Verabreichung nicht empfohlen.
17.Die liposomale Dispersion wird über einen Zeitraum von etwa einer Stunde infundiert.
Entsorgung
Keine besonderen Anforderungen.
Zulassungsnummer
60721(Swissmedic)
Packungen
1 Durchstechflasche mit 4 mg Mifamurtid-Natrium inkl. sterilem Einmalfilter. [A]
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
Januar 2021
