Zusammensetzung
Wirkstoffe
Losartan-Kalium und Hydrochlorothiazid.
Hilfsstoffe
Losartan HCT axapharm 50/12.5 mg:
Mikrokristalline Cellulose, Lactose-Monohydrat 111 mg, vorverkleisterte Stärke, hochdisperses Siliciumdioxid, Magnesiumstearat, Hydroxypropylcellulose (E463), Hypromellose (E464), Titandioxid (E171), Chinolingelb (E104).
1 Filmtablette enthält 4.24 mg Kalium.
Losartan HCT axapharm 100/12.5 mg:
Mikrokristalline Cellulose, Lactose-Monohydrat 222 mg, vorverkleisterte Maisstärke, hochdisperses Siliciumdioxid, Magnesiumstearat, Hydroxypropylcellulose (E463), Hypromellose (E464), Titandioxid (E171).
1 Filmtablette enthält 8.48 mg Kalium.
Losartan HCT axapharm 100/25 mg:
Mikrokristalline Cellulose, Lactose-Monohydrat 222 mg, vorverkleisterte Maisstärke, hochdisperses Siliciumdioxid, Magnesiumstearat, Hydroxypropylcellulose (E463), Hypromellose (E464), Titandioxid (E171), Chinolingelb (E104).
1 Filmtablette enthält 8.48 mg Kalium.
Indikationen/Anwendungsmöglichkeiten
Hypertonie
Losartan HCT axapharm ist indiziert zur Behandlung von Patienten mit Hypertonie, bei denen eine Kombinationsbehandlung angemessen ist.
Hypertonie mit linksventrikulärer Hypertrophie
Reduktion des Schlaganfallrisikos bei Hypertonikern mit linksventrikulärer Hypertrophie (siehe «Eigenschaften/Wirkungen, LIFE Studie, Patienten mit schwarzer Hautfarbe»).
Dosierung/Anwendung
Hypertonie
Die übliche Anfangs- und Erhaltungsdosis beträgt 1 Filmtablette Losartan HCT axapharm 50/12.5 mg pro Tag. Für Patienten, welche ungenügend auf Losartan HCT axapharm 50/12.5 mg ansprechen, kann die Dosis auf 1 Filmtablette Losartan HCT axapharm 100/25 mg einmal täglich oder auf 2 Filmtabletten Losartan HCT axapharm 50/12.5 mg einmal täglich erhöht werden. Die maximale Dosierung beträgt 1 Filmtablette Losartan HCT axapharm 100/25 mg einmal täglich oder 2 Filmtabletten Losartan HCT axapharm 50/12.5 mg einmal täglich. Die antihypertensive Wirkung wird im Allgemeinen innerhalb von 3 Wochen nach Therapiebeginn erreicht. Losartan HCT axapharm 100/12.5 mg ist für Patienten vorgesehen, die bereits auf Losartan 100 mg eingestellt sind und eine zusätzliche Kontrolle des Blutdruckes benötigen.
Hypertonie mit linksventrikulärer Hypertrophie
Die normale Anfangsdosierung ist 50 mg Losartan einmal täglich. Falls die Ziel-Blutdruckwerte mit Losartan 50 mg nicht erreicht werden, dann sollte die Behandlung durch das Kombinieren von Losartan mit einer tiefen Dosierung von Hydrochlorothiazid (12.5 mg) angepasst werden. Falls nötig, kann die Dosierung dann auf 100 mg Losartan/12.5 mg Hydrochlorothiazid einmal täglich oder auf 100 mg Losartan/25 mg Hydrochlorothiazid einmal täglich erhöht werden. Losartan HCT axapharm ist eine angemessene alternative Formulierung für Patienten, die ansonsten mit Losartan und gleichzeitigem Hydrochlorothiazid behandelt würden.
Spezielle Dosierungsanweisungen
Volumenmangel
Losartan HCT axapharm sollte bei Patienten mit intravaskulärer Volumendepletion nicht angewendet werden (z.B. Patienten unter Behandlung mit hohen Dosen von Diuretika).
Ältere Patienten/Nieren- und Leberfunktionsstörungen
Bei Patienten mit schwerer Einschränkung der Leberfunktion und der Nierenfunktion (Kreatininclearance ≤30 ml/min) wird die Anwendung von Losartan HCT axapharm nicht empfohlen.
Für ältere Patienten ist keine initiale Dosisanpassung von Losartan HCT axapharm 50/12.5 mg erforderlich. Losartan HCT axapharm 100/12.5 mg und Losartan HCT axapharm 100/25 mg sollten nicht als Initialtherapie bei älteren Patienten verwendet werden.
Kinder und Jugendliche
Losartan HCT axapharm sollte bei Kindern und Jugendlichen nicht angewendet werden, da die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen nicht untersucht wurden.
Losartan HCT axapharm kann auch mit anderen Antihypertonika kombiniert werden.
Losartan HCT axapharm kann vor, während oder nach einer Mahlzeit eingenommen werden.
Kontraindikationen
Losartan HCT axapharm ist kontraindiziert:
bei Patienten, welche eine Überempfindlichkeit auf die Wirksubstanzen oder einen anderen Inhaltsstoff des Produkts aufweisen;
bei Patienten mit Anurie;
bei Patienten, welche eine Überempfindlichkeit gegenüber anderen Sulfonamidderivaten aufweisen;
in der Schwangerschaft (siehe «Schwangerschaft, Stillzeit»);
bei Patienten mit schwerer Einschränkung der Leber- oder Nierenfunktion (Kreatininclearance ≤30 ml/min);
-Losartan HCT axapharm ist ferner kontraindiziert bei Patienten mit hereditärem Angioödem oder bei denen sich unter einer früheren Behandlung mit einem ACE-Hemmer oder Angiotensin-II-Rezeptor-Antagonisten ein angioneurotisches Ödem entwickelt hatte.
Die gleichzeitige Anwendung von Losartan HCT axapharm mit Aliskiren-haltigen Arzneimitteln ist bei Patienten mit Diabetes mellitus oder eingeschränkter Nierenfunktion (GFR <60 ml/min/1.73 m²) kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Losartan/Hydrochlorothiazid
Fetale Toxizität
Die Anwendung von Arzneimitteln, wie zum Beispiel Losartan HCT axapharm, das auf das Renin-Angiotensin-System wirkt, im zweiten und dritten Trimester einer Schwangerschaft reduziert die fetale Nierenfunktion und erhöht die fetale und neonatale Morbidität und Mortalität. Ein daraus resultierendes Oligohydramnion kann mit einer fetalen Lungenhypoplasie und einer Deformation des Skeletts assoziiert sein. Potenzielle neonatale unerwünschte Wirkungen beinhalten Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Sobald eine Schwangerschaft festgestellt wird, muss Losartan HCT axapharm so bald wie möglich abgesetzt werden (siehe «Schwangerschaft, Stillzeit»).
Überempfindlichkeit
Angioödem – siehe «Unerwünschte Wirkungen».
Potenzielle Interaktionen von Losartan HCT axapharm mit oralen Antikoagulantien sind nicht untersucht worden.
Losartan
Einschränkung der Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Systems wurde bei einzelnen Personen über Veränderungen der Nierenfunktion einschliesslich Nierenversagen berichtet; diese Veränderungen der Nierenfunktion können nach Absetzen der Therapie reversibel sein.
Bei Nierenarterien-Stenosen kann das Arzneimittel möglicherweise zu einer massiven Hypotonie führen.
Andere das Renin-Angiotensin-System beeinflussende Arzneimittel können bei Patienten mit bilateraler Nierenarterienstenose oder einer Stenose der Arterie einer Einzelniere die Blutharnstoff- und Serumkreatininwerte erhöhen. Ähnliche Effekte wurden mit Losartan gemeldet; diese Veränderungen der Nierenfunktion können nach Absetzen der Therapie reversibel sein.
Bei Patienten mit Hypovolämie (z.B. nach hochdosierter Diuretikabehandlung) muss mit symptomatischem Blutdruckabfall gerechnet werden. Losartan HCT axapharm sollte bei Patienten mit intravaskulärer Volumendepletion nicht angewendet werden.
Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von anderen Arzneimitteln, die das Serumkalium erhöhen können, kann zu einer Hyperkaliämie führen (siehe «Interaktionen»).
Einschränkung der Leberfunktion
Aufgrund pharmakokinetischer Daten konnte bei zirrhotischen Patienten eine signifikante Erhöhung der Plasmakonzentrationen von Losartan gezeigt werden. Daher sollte bei Patienten mit Leberfunktionsstörungen in der Anamnese eine niedrigere Anfangsdosis in Betracht gezogen werden (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
«Duale Blockade» des Renin-Angiotensin-Aldosteron-Systems
Siehe «Interaktionen».
Hydrochlorothiazid
Hypotonie und Störungen des Elektrolyt- und Flüssigkeitsgleichgewichts
Wie mit jeder anderen antihypertensiven Therapie kann bei einigen Patienten eine symptomatische Hypotonie auftreten. Während diese Nebenwirkung bei Patienten mit unkomplizierter Hypertonie nur selten beobachtet wurde, ist sie bei gestörter Flüssigkeits- und Elektrolytbalance wahrscheinlicher. Die Patienten sollten auf klinische Anzeichen von Flüssigkeits- oder Elektrolytgleichgewichtsstörungen überwacht werden, z.B. Volumenmangel, Hyponatriämie, hypochlorämische Alkalose, Hypomagnesiämie oder Hypokaliämie, welche während hinzutretendem Durchfall oder Erbrechen auftreten können. Bei Patienten unter diuretischer Behandlung sollten deshalb periodisch Bestimmungen der Serumelektrolyte durchgeführt werden.
Metabolische und endokrine Effekte
Thiazide können die Glucosetoleranz verschlechtern. Eine Anpassung der antidiabetischen Behandlung, inkl. Insulin, kann deshalb notwendig sein (siehe «Interaktionen»).
Thiazide können die renale Ausscheidung von Kalzium vermindern und zu vorübergehender und leichter Erhöhung von Serumkalzium führen. Eine ausgeprägte Hypercalcämie kann auf einen verborgenen Hyperparathyreoidismus hinweisen. Thiazide sollten deshalb vor Funktionsprüfungen der Nebenschilddrüsen abgesetzt werden.
Die diuretische Behandlung mit Thiaziden kann zu erhöhten Werten für Cholesterin und Triglyceride führen.
Thiazide können bei prädisponierten Patienten zu Hyperurikämie und/oder Gicht führen. Weil Losartan die Harnsäure senkt, vermindert die Kombination von Hydrochlorothiazid mit Losartan das Risiko einer Diuretika-induzierten Hyperurikämie.
Aderhauterguss (chorioidale Effusion), akute Myopie und sekundäres Winkelverschlussglaukom
Sulfonamide sowie Sulfonamid-Derivate können eine idiosynkratische Reaktion auslösen, die zu chorioidaler Effusion mit Gesichtsfeldausfall, vorübergehender Myopie und akutem Winkelverschlussglaukom führen kann. Die Symptome schliessen akut auftretenden Visusverlust oder Augenschmerzen ein und treten typischerweise innerhalb von Stunden bis Wochen nach Therapiebeginn auf. Das unbehandelte Winkelverschlussglaukom kann zu permanentem Visusverlust führen. Die primäre Therapie besteht im unverzüglichen Absetzen des Arzneimittels. Falls der intraokuläre Druck erhöht bleibt, muss eine sofortige medizinische Behandlung oder ein operativer Eingriff erwogen werden. Risikofaktoren für die Entwicklung eines Winkelblockglaukoms können die Anamnese einer Sulfonamid- oder Penicillinallergie sein.
Akute Atemwegstoxizität
Es wurden sehr seltene schwere Fälle von akuter Atemwegstoxizität, einschliesslich des akuten Atemnotsyndroms (ARDS), nach der Einnahme von Hydrochlorothiazid berichtet. Ein Lungenödem entwickelt sich typischerweise innerhalb von Minuten bis Stunden nach der Einnahme von Hydrochlorothiazid. Zu den Symptomen gehören zu Beginn Dyspnoe, Fieber, Verschlechterung der Lungenfunktion und Hypotonie. Bei Verdacht auf ARDS sollte Losartan HCT axapharm abgesetzt und eine angemessene Behandlung eingeleitet werden. Hydrochlorothiazid darf nicht bei Patienten angewendet werden, bei denen nach der Einnahme von Hydrochlorothiazid bereits einmal ein ARDS aufgetreten ist.
Andere
Unter Behandlung mit Thiaziden können bei Patienten mit oder ohne Anamnese einer Allergie oder eines Asthma bronchiale Überempfindlichkeitsreaktionen auftreten. Eine Exacerbation oder das Auftreten eines systemischen Lupus erythematodes wurde unter Behandlung mit Thiaziden beobachtet.
Nicht-melanozytäre Malignome der Haut
In zwei epidemiologischen Studien auf Basis des dänischen nationalen Krebsregisters wurde ein erhöhtes Risiko für nicht-melanozytäre Malignome der Haut in Form von Basalzellkarzinom (BCC) und Plattenepithelkarzinomen (SCC) unter zunehmender kumulativer Hydrochlorothiazid-Exposition beobachtet. Die photosensibilisierende Wirkung von Hydrochlorothiazid könnte als potenzieller Mechanismus an der Entwicklung von nicht-melanozytären Malignomen der Haut beteiligt sein.
Patienten, die Hydrochlorothiazid anwenden, sind über das Risiko für nicht-melanozytäre Malignome der Haut aufzuklären und anzuweisen, ihre Haut regelmässig auf neue Läsionen zu kontrollieren und jegliche verdächtige Hautveränderungen umgehend zu melden. Den Patienten sind Präventivmassnahmen wie eine begrenzte Sonnenlicht-/UV-Exposition und ein angemessener Sonnenschutz bei Exposition zu empfehlen, um das Hautkrebsrisiko zu minimieren. Verdächtige Hautveränderungen sind umgehend zu untersuchen, gegebenenfalls mittels histologischer Analyse von Biopsien. Bei Patienten mit nicht-melanozytären Malignomen der Haut in der Vorgeschichte ist die Anwendung von Hydrochlorothiazid möglicherweise zu überdenken (siehe auch Abschnitt «Unerwünschte Wirkungen»).
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit der Behandlung bei Kindern und Jugendlichen wurden nicht überprüft.
Neugeborene mit einer Anamnese einer In-utero-Exposition durch Losartan HCT axapharm
Wenn eine Oligurie oder eine Hypotonie auftritt, soll die Aufmerksamkeit der Unterstützung des Blutdrucks und der Nierendurchblutung zugewandt werden. Eine Austauschtransfusion oder eine Dialyse kann notwendig sein, um eine Hypotonie rückgängig zu machen und/oder eine Nierenfunktionsstörung zu substituieren.
Anwendung bei älteren Patienten
In klinischen Versuchen ergaben sich keine altersabhängigen Unterschiede bezüglich der Wirksamkeit oder Sicherheit einer Behandlung mit Losartan/Hydrochlorothiazid.
Lactose
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Kalium
Dieses Arzneimittel enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Filmtablette, d.h. es ist nahezu «kaliumfrei».
Interaktionen
Losartan
In klinischen pharmakokinetischen Studien wurden keine klinisch bedeutsamen Interaktionen mit folgenden Substanzen beobachtet: Hydrochlorothiazid, Digoxin, Warfarin, (siehe unten: Hydrochlorothiazid, Alkohol, Barbiturate oder Narkotika), Ketoconazol und Erythromycin. Phenobarbital als Enzyminduktor führte zu einer ca. 20%igen Abnahme der AUC von Losartan und seines aktiven Metaboliten. Cimetidin als Enzymhemmer führte zu einer 18%igen Zunahme der AUC von Losartan, nicht aber seines aktiven Metaboliten. Diese Effekte werden nicht als klinisch signifikant erachtet. Bei Rifampicin und Fluconazol wurde über reduzierte Spiegel des aktiven Metaboliten berichtet. Die klinischen Folgen dieser Interaktionen wurden nicht evaluiert.
Wie bei anderen Arzneimitteln, welche Angiotensin II oder seine Wirkungen blockieren, kann die gleichzeitige Anwendung von kaliumsparenden Diuretika (z.B. Spironolakton, Triamteren, Amilorid), Kaliumzusätzen, kaliumhaltigen Diätsalzen oder anderen Arzneimitteln, die das Serumkalium erhöhen können (z.B. Trimethoprim-haltige Arzneimittel), zu Erhöhung der Serumkaliumspiegel führen.
Wie bei anderen Arzneimitteln, die die Ausscheidung von Natrium beeinflussen, kann die Ausscheidung von Lithium vermindert sein. Deshalb sollten die Serum-Lithiumwerte sorgfältig überwacht werden, falls Lithiumsalze zusammen mit Angiotensin-II-Rezeptor-Antagonisten verabreicht werden.
Potenzielle Interaktionen von Losartan HCT axapharm mit oralen Antikoagulantien wurden nicht untersucht.
Studien mit Losartan HCT axapharm und Acenocoumarol und Phenprocoumon wurden nicht durchgeführt.
Nicht-steroidale entzündungshemmende Arzneimittel (NSAIDs) inklusive selektive Cyclooxygenase-2-Inhibitoren (COX-2-Inhibitoren) können den Effekt von Diuretika und anderen blutdrucksenkenden Arzneimitteln abschwächen. Aus diesem Grund kann die blutdrucksenkende Wirkung von Angiotensin-II-Rezeptor-Antagonisten oder ACE-Hemmern durch NSAIDs inklusive selektive COX-2-Inhibitoren vermindert werden.
Bei Patienten mit eingeschränkter Nierenfunktion (z.B. älteren Patienten oder Patienten mit Volumenmangel, inkl. solchen unter Diuretikatherapie), die mit nicht-steroidalen entzündungshemmenden Arzneimitteln inklusive selektiven Cyclooxygenase-2-Inhibitoren behandelt werden, kann die gleichzeitige Verabreichung von Angiotensin-II- Rezeptor-Antagonisten oder ACE-Hemmern zu einer weiteren Verschlechterung der Nierenfunktion führen, inkl. möglichem akutem Nierenversagen. Diese Effekte sind normalerweise reversibel. Deshalb sollte die Kombination bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden.
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
Es gibt Belege dafür, dass die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Antagonisten oder Aliskiren das Risiko für Hypotonie, Hyperkaliämie und eine Abnahme der Nierenfunktion (einschliesslich eines akuten Nierenversagens) erhöht. Eine duale Blockade des RAAS durch die gleichzeitige Anwendung von ACE-Hemmern, Angiotensin-II-Rezeptor-Antagonisten oder Aliskiren wird deshalb nicht empfohlen.
Wenn die Therapie mit einer dualen Blockade als absolut notwendig erachtet wird, sollte dies nur unter Aufsicht eines Spezialisten und unter Durchführung engmaschiger Kontrollen von Nierenfunktion, Elektrolytwerten und Blutdruck erfolgen.
ACE-Hemmer und Angiotensin-II-Rezeptor-Antagonisten sollten bei Patienten mit diabetischer Nephropathie nicht gleichzeitig angewendet werden.
Grapefruitsaft enthält Bestandteile, die CYP450-Enzyme hemmen und die Konzentration des aktiven Metaboliten von Losartan HCT axapharm senken können, was die therapeutische Wirkung verringern kann. Der Verzehr von Grapefruitsaft sollte während der Einnahme von Losartan HCT axapharm vermieden werden.
Hydrochlorothiazid
Die folgenden Substanzen können bei gleichzeitiger Verabreichung zu Interaktionen führen:
Alkohol, Barbiturate, Narkotika: Verstärkung der orthostatischen Hypotension.
Antidiabetika: (orale Substanzen und Insulin): Dosisanpassung der antidiabetischen Medikation kann notwendig sein.
Andere Antihypertonika: additiver Effekt.
Cholestyramin und Colestipol Ionenaustauscherharze: Die Absorption von Hydrochlorothiazid wird durch Anionenaustauschharze verschlechtert. Einzeldosen von Cholestyramin bzw. Colestipol binden Hydrochlorothiazid und reduzieren die gastrointestinale Absorption um bis zu 85 bzw. 43%.
Corticosteroide, ACTH, oder Glycyrrhizin (in Lakritze vorhanden), Amphotericin, Carbenoxolon: Verstärkung eines Elektrolytmangels, insbesondere Hypokaliämie.
Katecholamine (z.B. Adrenalin): Eine Reduktion der Wirkung von Vasopressoren ist möglich, was deren Anwendung aber nicht verbietet.
Nicht-depolarisierende Muskelrelaxantien (z.B. Tubocurarin): Verstärkte Wirkung der Muskelrelaxantien ist möglich.
Lithium: Diuretika reduzieren die renale Ausscheidung von Lithium und erhöhen das Risiko einer Lithium-Intoxikation. Eine gleichzeitige Behandlung wird deshalb nicht empfohlen. Packungsbeilagen von Lithiumpräparaten sind vor deren Gebrauch zu konsultieren.
Nichtsteroidale Antirheumatika inklusive Cyclooxygenase-2-Inhibitoren: Die Verabreichung von nichtsteroidalen Antirheumatika inklusive selektiven Cyclooxygenase-2-Inhibitoren kann die diuretische, natriuretische und antihypertensive Wirkung der Diuretika vermindern.
Bei Patienten mit eingeschränkter Nierenfunktion (z.B. ältere Patienten oder Patienten mit Volumenmangel, inkl. solchen unter Diuretikatherapie), die mit nicht-steroidalen entzündungshemmenden Arzneimitteln, inklusive selektiven Cyclooxygenase-2-Inhibitoren behandelt werden, kann die gleichzeitige Verabreichung von Angiotensin-II-Rezeptor-Antagonisten oder ACE-Hemmern zu einer weiteren Verschlechterung der Nierenfunktion führen, inkl. möglichem akutem Nierenversagen. Diese Effekte sind normalerweise reversibel. Deshalb sollte die Kombination bei Patienten mit eingeschränkter Nierenfunktion mit Vorsicht angewendet werden.
Allopurinol: Erhöhung der Häufigkeit von Überempfindlichkeitsreaktionen auf Allopurinol.
Antineoplastika (z.B. Methotrexat, Cyclophosphamid): Verminderung der renalen Ausscheidung von Antineoplastika.
Amantadin: Erhöhung des Risikos unerwünschter Wirkungen von Amantadin.
Anticholinergika (z.B. Atropin, Biperiden): Erhöhung der Bioverfügbarkeit thiazidartiger Diuretika.
Vitamin D: Verstärkung des Anstiegs von Serumkalzium.
Cyclosporin: Erhöhung des Risikos einer Hyperurikämie und gichtartiger Komplikationen.
Kalziumsalze: Thiazidartige Diuretika können durch Erhöhung der tubulären Rückresorption von Kalzium zu einer Hyperkalzämie führen.
Diazoxid: Verstärkung des hyperglykämischen Effekts von Diazoxid.
Interaktionen mit Arzneimittel/Laboruntersuchungen
Aufgrund ihrer Wirkungen auf den Kalziumstoffwechsel können Thiazide die Untersuchungsmethoden für die Nebenschilddrüsen beeinflussen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, Stillzeit
Schwangerschaft
Losartan HCT axapharm ist während der Schwangerschaft kontraindiziert (siehe «Kontraindikationen»). Sobald eine Schwangerschaft festgestellt wird, muss Losartan HCT axapharm so bald wie möglich abgesetzt werden.
Es liegen keine endgültigen epidemiologischen Daten hinsichtlich eines teratogenen Risikos nach Anwendung von ACE-Hemmern während des ersten Schwangerschaftstrimesters vor; ein geringfügig erhöhtes Risiko kann jedoch nicht ausgeschlossen werden. Auch wenn keine kontrollierten epidemiologischen Daten zum Risiko von Angiotensin-II-Rezeptor-Antagonisten (AIIRAs) vorliegen, so bestehen möglicherweise für diese Arzneimittelklasse vergleichbare Risiken. Sofern ein Fortsetzen der AIIRA-Therapie nicht als notwendig erachtet wird, sollten Patientinnen, die planen, schwanger zu werden, auf eine alternative antihypertensive Therapie mit geeignetem Sicherheitsprofil für Schwangere umgestellt werden. Wird eine Schwangerschaft festgestellt, ist eine Behandlung mit AIIRAs unverzüglich zu beenden und, wenn erforderlich, eine alternative Therapie zu beginnen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Kinder mit einer Anamnese einer In-utero-Exposition durch Losartan HCT axapharm, sollten engmaschig auf Hypotonie, Oligurie und Hyperkaliämie untersucht werden.
Es ist bekannt, dass eine Therapie mit AIIRAs während des zweiten und dritten Schwangerschaftstrimesters fetotoxische Effekte (verminderte Nierenfunktion, Oligohydramnion, verzögerte Schädelossifikation) und neonatal-toxische Effekte (Nierenversagen, Hypotonie, Hyperkaliämie) hat (siehe «Präklinische Daten»).
Im Falle einer Exposition mit Losartan HCT axapharm ab dem zweiten Schwangerschaftstrimester werden Ultraschalluntersuchungen der Nierenfunktion und des Schädels dringend empfohlen.
Normalerweise sind diese unerwünschten Wirkungen mit der Anwendung dieser Arzneimittel während des zweiten und dritten Trimesters assoziiert. Die meisten epidemiologischen Studien, in denen fetale Abnormalitäten nach antihypertensiver Therapie im ersten Trimester untersucht wurden, zeigten keine Unterschiede zwischen Antihypertensiva, die das Renin-Angiotensin-System beeinflussen, und anderen Antihypertensiva. Das angemessene Management einer Hypertonie bei der Mutter ist während der Schwangerschaft wichtig, um die Folgen sowohl für Mutter als auch Foetus zu optimieren.
Hydrochlorothiazid ist plazentagängig. Aufgrund des pharmakologischen Wirkmechanismus von Hydrochlorothiazid kann es zu einer Störung der fetoplazentaren Perfusion und zu fetalen und neonatalen Auswirkungen wie Ikterus, Störung des Elektrolythaushalts und Thrombozytopenien kommen.
Aufgrund des Risikos eines verringerten Plasmavolumens und einer plazentaren Hypoperfusion, ohne den Krankheitsverlauf günstig zu beeinflussen, sollte Hydrochlorothiazid bei Schwangerschaftsödemen, Schwangerschaftshypertonie oder einer Präeklampsie nicht zur Anwendung kommen.
Stillzeit
Da keine Erkenntnisse zur Anwendung von Losartan HCT axapharm in der Stillzeit vorliegen und Hydrochlorothiazid in die menschliche Muttermilch übergeht, wird Losartan HCT axapharm nicht empfohlen. Eine alternative antihypertensive Therapie mit einem besser geeigneten Sicherheitsprofil bei Anwendung in der Stillzeit ist vorzuziehen, insbesondere, wenn Neugeborene oder Frühgeborene gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Bei Teilnahme am Strassenverkehr und beim Bedienen von Maschinen ist Vorsicht geboten.
Unerwünschte Wirkungen
In klinischen Studien wurden unter der Kombinationsbehandlung mit Losartan Kalium und Hydrochlorothiazid keine neuen unerwünschten Wirkungen beobachtet. Die unerwünschten Wirkungen waren beschränkt auf Effekte, welche schon aus früheren Studien mit Losartan und/oder Hydrochlorothiazid festgestellt wurden. Die Häufigkeit von unerwünschten Wirkungen unter Kombinationsbehandlung war vergleichbar mit der Placebobehandlung. Ebenso war der Prozentsatz des Behandlungsabbruchs vergleichbar mit Placebo. Unerwünschte Wirkungen waren meistens leicht und vorübergehend; ein Abbruch der Therapie war nicht notwendig.
Unerwünschte Wirkungen sind nach Organklassen aufgeteilt und mit abnehmender Häufigkeit erwähnt:
«Sehr häufig» (≥1/10),
«Häufig» (≥1/100, <1/10),
«Gelegentlich» (≥1/1000, <1/100),
«Selten» (≥1/10'000, <1/1000),
«Sehr selten» (<1/10'000, einschliesslich gemeldeter Einzelfälle).
In klinischen Studien mit Losartan Kalium/Hydrochlorothiazid bei Patienten mit essenzieller Hypertonie und Hypertonie mit linksventrikulärer Hypertrophie wurden die folgenden unerwünschten Ereignisse beobachtet:
Erkrankungen des Nervensystems
Häufig: Schwindel.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo.
Erkrankungen der Haut und des Unterhautgewebes
Selten: Hautausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schwächegefühl, Müdigkeit.
Die weiteren folgenden unerwünschten Wirkungen wurden für Losartan/Hydrochlorothiazid nach Markteinführung und/oder in Klinischen Studien oder nach Markteinführung für beide Komponenten unabhängig beobachtet (es kann keine Häufigkeit für Berichte nach Markteinführung angegeben werden):
Infektionen und parasitäre Erkrankungen
Häufig: obere Atemwegsinfektionen.
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Nicht-melanozytäre Malignome der Haut (NMSC) (Basalzellkarzinom (BCC) und Plattenepithelkarzinom (SCC)).
Erkrankungen des Blutes und des Lymphsystems
Selten: Purpura.
Sehr selten einschliesslich Einzelfälle: Agranulozytose, Knochenmarkdepression und hämolytische Anämie, Leukopenie.
Anämie, Thrombozytopenie.
Erkrankungen des Immunsystems
Sehr selten einschliesslich Einzelfälle: Überempfindlichkeitsreaktionen.
Anaphylaktische Reaktionen, Angioödem einschliesslich Schwellung von Larynx und Glottis (Ursache für Atemwegsobstruktion) und/oder Schwellung des Gesichts, der Lippen, des Rachens und/oder Zunge wurde selten bei Patienten unter Behandlung mit Losartan berichtet; einige dieser Patienten hatten früher mit anderen Arzneimitteln einschliesslich ACE-Hemmern ein Angioödem durchgemacht.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperkaliämie, Hypokaliämie.
Gelegentlich: Appetitverlust, Hyperurikämie, Hyponatriämie, Hypomagnesiämie.
Selten: Hyperkalzämie, Hyperglykämie, Verschlechterung einer diabetischen Stoffwechsellage.
Sehr selten einschliesslich Einzelfälle: Hypochlorämische Alkalose.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit, Ruhelosigkeit.
Selten: Depressionen.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen.
Selten: Schwindel oder Benommenheit, Parästhesien.
Dysgeusie, Migräne.
In doppel-blinden, kontrollierten Studien bei Patienten mit essenzieller Hypertension wurden Kopfschmerzen bei 14.1% der mit Losartan behandelten Patienten beobachtet im Vergleich zu 17.2% in der Placebo-Gruppe.
Augenerkrankungen
Sehstörungen, besonders in den ersten Behandlungswochen.
Aderhauterguss (chorioidale Effusion) (Häufigkeit unbekannt).
Herzerkrankungen
Häufig: Hypotension, Palpitationen, Tachykardie.
Gelegentlich: dosisabhängige orthostatische Probleme, orthostatische Hypotonie, die durch Alkohol, Anästhetika oder Sedativa verstärkt werden kann.
Selten: Herzrhythmusstörungen.
Gefässerkrankungen
Selten: Vaskulitis, einschliesslich Henoch-Schoenlein.
Sehr selten einschliesslich Einzelfälle: Nekrotisierende Vaskulitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Nasenverstopfung, Husten, Pharyngitis, Sinus-Störungen.
Sehr selten einschliesslich Einzelfälle: respiratorische Beschwerden einschliesslich Pneumonitis und Lungenödem, akutes Atemnotsyndrom (ARDS) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen Gastrointestinaltrakts
Häufig: Bauchschmerzen, Dyspepsie, Nausea, Erbrechen.
Selten: Abdominalbeschwerden, Verstopfung, gastrointestinale Beschwerden.
Sehr selten einschliesslich Einzelfälle: Pankreatitis.
Diarrhoe.
Leber- und Gallenerkrankungen
Selten: Hepatitis, intrahepatische Cholestase oder Ikterus.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Urtikaria, andere Hautausschläge.
Sehr selten einschliesslich Einzelfälle: Epidermolysis acuta toxica, Lupus-erythematodes-ähnliche Reaktionen und Reaktivierung eines Lupus erythematodes.
Erythrodermie, Photosensibilität, Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Rückenschmerzen, Muskelkrämpfe.
Arthralgie, Myalgie.
Erkrankungen der Nieren und Harnwege
Selten: Glykosurie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Impotenz.
Erektile Dysfunktion.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Brustschmerzen, Ödeme/Schwellung.
Malaise.
Untersuchungen
Häufig: Anstieg der ALT, Proteinurie.
Leberfunktionsstörungen.
Beschreibung ausgewählter unerwünschter Wirkungen
Nicht-melanozytäre Malignome der Haut (BCC und SCC): Basierend auf den verfügbaren Daten aus epidemiologischen Studien wurde ein von der kumulativen Dosis abhängiger Zusammenhang zwischen Hydrochlorothiazid-Exposition und nicht-melanozytären Malignomen der Haut beobachtet (siehe auch Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es gibt keine spezifischen Informationen zur Behandlung einer Überdosierung mit Losartan HCT axapharm. Die Therapie mit Losartan HCT axapharm sollte abgebrochen werden und der Patient genau beobachtet werden. Falls die Einnahme kürzlich stattgefunden hat, soll eine Emesis erwirkt werden und Flüssigkeitsverlust, Elektrolytstörungen, Leberkoma und Hypotonie durch geeignete Massnahmen korrigiert werden.
Losartan
Beim Menschen sind nur beschränkte Angaben zur Überdosierung bekannt. Das wahrscheinlichste Anzeichen von Überdosierung müssten Blutdruckabfall und Tachykardie sein. Bradykardie könnte infolge parasympathischer (vagaler) Stimulation auftreten. Bei symptomatischem Blutdruckabfall müsste eine entsprechende, kreislaufstützende Behandlung erfolgen.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse eliminiert werden.
Hydrochlorothiazid
Die wichtigsten Symptome und Befunde, welche auf eine Überdosierung hinweisen, sind Elektrolytstörungen (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydration als Folge einer exzessiven Diurese. Wenn gleichzeitig Digitalis eingenommen wird, kann die Hypokaliämie kardiale Rhythmusstörungen verstärken.
Es ist nicht bekannt, in welchem Ausmass Hydrochlorothiazid durch Hämodialyse entfernt wird.
Eigenschaften/Wirkungen
ATC-Code
C09DA01
Wirkungsmechanismus
Losartan
Losartan ist ein oraler Angiotensin-II-Rezeptor-Antagonist (Typ AT1). Angiotensin II bindet sich an den AT1-Rezeptor, welcher in vielen Körpergeweben zu finden ist (z.B. glatte Gefässmuskulatur, Nebennieren, Nieren und Herz), wo es verschiedene wichtige biologische Wirkungen einschliesslich Gefässverengung und Freigabe von Aldosteron auslöst. Angiotensin II stimuliert auch die Proliferation glatter Muskelzellen. Gemäss pharmakologischen und biologischen Versuchen bindet es sich selektiv an den AT1-Rezeptor. Sowohl in vitro wie in vivo blockieren Losartan und sein pharmakologisch aktiver Carboxylsäure-Metabolit (E-3174) alle physiologisch bedeutsamen Wirkungen von Angiotensin II, unabhängig von dessen Herkunft oder Syntheseweg.
Hydrochlorothiazid
Der Mechanismus der antihypertensiven Wirkung der Thiazide ist nicht bekannt. Bei normalen Blutdruckwerten führen Thiazide nicht zu einer Blutdrucksenkung.
Hydrochlorothiazid ist ein Diuretikum und Antihypertonikum. Es wirkt auf die Reabsorption der Elektrolyte im distalen Nierentubulus. Hydrochlorothiazid erhöht die Ausscheidung von Natrium und Chlorid in etwa gleichem Ausmass. Die Natriurese kann von einem leichten Kalium- und Bikarbonatverlust begleitet sein.
Die Diurese beginnt innerhalb von 2 Stunden nach oraler Einnahme, zeigt ein Maximum nach etwa 4 Stunden und dauert ca. 6-12 Stunden an.
Losartan-Hydrochlorothiazid
Die beiden Komponenten von Losartan HCT axapharm haben einen additiven Effekt auf die Blutdrucksenkung, welche grösser ist als jene einer einzelnen Komponente. Es wird vermutet, dass dieser Effekt das Resultat einer komplementären Wirkung der beiden Substanzen ist. Als Folge des diuretischen Effektes erhöht Hydrochlorothiazid die Aktivität von Plasma-Renin, die Sekretion von Aldosteron sowie die Plasmaspiegel von Angiotensin II und senkt das Serumkalium. Durch Verabreichung von Losartan werden alle physiologisch relevanten Wirkungen von Angiotensin II blockiert. Zusätzlich könnte der Diuretika-induzierte Kaliumverlust durch Hemmung von Aldosteron vermindert werden.
Pharmakodynamik
Während der Verabreichung von Losartan führt die Unterdrückung der negativen Rückkopplung von Angiotensin II auf die Reninsekretion zu einer erhöhten Renin-Aktivität im Plasma. Die Zunahme der Plasmareninaktivität führt zu einem Anstieg des Angiotensin II im Plasma. Trotz dieser Zunahme bleibt die blutdrucksenkende Wirkung und Verminderung der Aldosteron-Konzentration im Plasma erhalten, was auf eine wirkungsvolle Blockade der Angiotensin-II-Rezeptoren hinweist.
Losartan bindet sich selektiv an die AT1-Rezeptoren, es bindet oder blockiert jedoch keine anderen Hormonrezeptoren oder Ionenkanäle, welche für die Herz-Kreislauf-Steuerung von Bedeutung sind. Das Enzym ACE (Kininase II), welches Bradykinin abbaut, wird durch Losartan nicht gehemmt. Demzufolge sind Wirkungen, welche nicht direkt auf der AT1-Rezeptoren-Blockade beruhen, wie die Erhöhung der Bradykininwirkungen oder Ödembildung (Losartan 1.7%, Placebo 1.9%) nicht auf Losartan zurückzuführen. Es wurde gezeigt, dass Losartan einen leichten und vorübergehenden urikosurischen Effekt hat. Unter Hydrochlorothiazid wurde ein mässiger Anstieg der Harnsäure beobachtet. Die Kombination von Losartan und Hydrochlorothiazid vermindert tendenziell die Diuretika-induzierte Hyperurikämie.
Klinische Wirksamkeit
In klinischen Studien bewirkte eine einmal tägliche Verabreichung von Losartan bei Patienten mit leichter bis mässiger essenzieller Hypertonie eine statistisch signifikante Senkung des systolischen und diastolischen Blutdrucks. Diese blutdrucksenkende Wirkung blieb in klinischen Versuchen bis zu einem Jahr erhalten. Messungen des Blutdrucks am Ende des Dosierungsintervalls (24 Stunden nach Einnahme) zeigten, verglichen mit der maximalen Wirkung (nach 5-6 Stunden), gleichmässige Blutdruckkontrolle über 24 Stunden. Die antihypertensive Wirkung entsprach dem natürlichen Tagesrhythmus. Die Blutdrucksenkung nach Ende des Dosierungsintervalls entsprach noch 70-80% der Wirkung nach 5-6 Stunden. Ein Absetzen der Behandlung mit Losartan hatte keinen abrupten Wiederanstieg des Blutdrucks zur Folge. Trotz der erheblichen Blutdrucksenkung hatte Losartan keine klinisch bedeutsame Auswirkung auf die Herzfrequenz.
Bei nicht-diabetischen Patienten mit Bluthochdruck und Proteinurie, vermindert Losartan statistisch signifikant die Proteinurie, die fraktionale Ausscheidung von Albumin und IgG. Losartan erhält die glomeruläre Filtration aufrecht und reduziert die Filtrationsfraktion. Losartan bewirkte eine leichte Senkung der Harnsäurespiegel, auch während der Langzeittherapie.
Bei Patienten mit Links-Herzinsuffizienz bewirkten Dosen von 25 bis 50 mg Losartan positive haemodynamische und neurohormonale Reaktionen, wie die Erhöhung des Herzindex und die Verminderung des pulmonalen Kapillardrucks, des systemischen Gefässwiderstandes, des durchschnittlichen arteriellen Drucks, der Herzfrequenz und der Blutspiegel von Aldosteron bzw. Noradrenalin. Bei diesen herzinsuffizienten Patienten war das Auftreten einer Hypotonie dosisabhängig.
Losartan ist bei Männern und Frauen und bei jüngeren (bis 65-jährigen) und älteren (über 65-jährigen) Hypertonikern gleich wirksam. Bei Schwarzen jedoch war Losartan weniger wirksam als bei Kaukasiern.
Die Erfahrung mit Losartan/Hydrochlorothiazid bei Patienten mit anderen kardiovaskulären Erkrankungen (z.B. Herzinsuffizienz und koronare Herzkrankheit) ist begrenzt.
Wird Losartan/Hydrochlorothiazid zusammen mit Diuretika vom Thiazidtyp verabreicht, so kann eine additive Wirkung auf die Blutdrucksenkung erwartet werden.
Nicht-melanozytäre Malignome der Haut (NMSC): Basierend auf den verfügbaren Daten aus epidemiologischen Studien wurde ein von der kumulativen Dosis abhängiger Zusammenhang zwischen Hydrochlorothiazid (HCTZ)-Exposition und NMSC-Entwicklung beobachtet. Eine Studie schloss eine Population aus 71'553 BCC-Fällen und 8629 SCC-Fällen sowie 1'430'883 bzw. 172'462 entsprechenden Kontrollen ein. Eine starke HCTZ-Exposition (kumulative Dosis ≥50'000 mg) war mit einer bereinigten Odds Ratio (OR) von 1.29 (95%-KI: 1.23-1.35) für BCC bzw. 3.98 (95%-KI: 3.68-4.31) für SCC assoziiert. Eine eindeutige kumulative Dosis-Wirkungs-Beziehung wurde sowohl für BCC als auch für SCC beobachtet. Eine weitere Studie ergab einen möglichen Zusammenhang zwischen HCTZ-Exposition und Lippenkarzinom (SCC): 633 Fälle von Lippenkarzinomen wurden mit 63'067 entsprechenden Kontrollen mittels der «Risk Set Sampling»-Strategie verglichen. Eine kumulative Dosis-Wirkungs-Beziehung wurde mit einem Anstieg der bereinigten OR von 2.1 (95%-KI: 1.7-2.6) auf 3.9 (95%-KI: 3.0-4.9) bei hoher kumulativer Dosis (≥25'000 mg) und auf 7.7 (95%-KI: 5.7.10.5) bei der höchsten kumulativen Dosis gezeigt (≥100'000 mg). Siehe auch Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Die antihypertensive Wirkung von Losartan/Hydrochlorothiazid bleibt während 24 Stunden erhalten. In klinischen Studien über mindestens ein Jahr blieb die antihypertensive Wirkung erhalten. Trotz einer signifikanten Senkung des Blutdrucks führte die Behandlung mit Losartan/Hydrochlorothiazid nicht zu klinisch fassbaren Effekten auf die Herzfrequenz. In klinischen Studien wurde nach zwölfwöchiger Therapie mit Losartan 50 mg/Hydrochlorothiazid 12.5 mg, am Ende des Dosierungsintervalls, eine Senkung des im Sitzen gemessenen diastolischen Blutdrucks um durchschnittlich bis zu 13.2 mmHg nachgewiesen.
In einer Studie, in welcher die Kombination von Losartan 50 mg/Hydrochlorothiazid 12.5 mg mit der Kombination von Captopril 50 mg/Hydrochlorothiazid 25 mg bei jüngeren (<65 Jahre) und älteren (≥65 Jahre) Patienten mit Hypertonie untersucht wurde, konnte kein Unterschied zwischen den beiden Behandlungs- und Altersgruppen nachgewiesen werden.
LIFE Studie
Die Losartan Interventionsstudie zur Endpunktreduktion bei Hypertonie (Losartan Intervention for Endpoint Reduction in Hypertension, LIFE) war eine grosse, multinationale, randomisierte, dreifach-blinde und aktiv-kontrollierte Studie mit 9193 Hypertonikern zwischen 55 und 80 Jahren (Mittelwert 67 Jahre) mit EKG-dokumentierter linksventrikulärer Hypertrophie. Von den zu Studienbeginn aufgenommenen Patienten hatten 1195 (13%) einen Diabetes mellitus, 1326 (14%) eine isolierte systolische Hypertonie, 1468 (17%) eine koronare Herzkrankheit und 728 (8%) eine zerebrovaskuläre Erkrankung.
Ziel dieser Studie war es, einen über die Blutdrucksenkung hinausgehenden kardiovaskulär protektiven Effekt von Losartan im Vergleich zu Atenolol nachzuweisen. Der Blutdruck wurde 24 h nach Verabreichung der letzten Dosis gemessen. Dazu sollte gemäss Studiendesign eine vergleichbare Blutdrucksenkung in beiden Behandlungsgruppen erreicht werden. Die Patienten erhielten randomisiert entweder Losartan 50 mg oder Atenolol 50 mg einmal täglich. Wenn der Zielblutdruck (<140/90 mmHg) nicht erreicht wurde, wurde zusätzlich Hydrochlorothiazid (12.5 mg) zugegeben und dann gegebenenfalls die Losartan oder Atenolol Dosis auf 100 mg einmal täglich erhöht. Falls notwendig, wurden andere Antihypertensiva (z.B. Dosiserhöhung von Hydrochlorothiazid auf 25 mg oder Zugabe anderer Diuretika, Kalziumantagonisten, alpha-Blocker, zentral wirksame Antihypertensiva, jedoch nicht ACE-Hemmer, Angiotensin-II-Antagonisten oder beta-Blocker) zusätzlich gegeben, um den Zielblutdruck zu erreichen. Mit dem Ziel, den Blutdruck zu kontrollieren, erhielten die Patienten in beiden Armen der LIFE-Studie zusätzlich Hydrochlorothiazid während der meisten Zeit, in der sie auch mit Studienmedikation behandelt wurden (73.9% bzw. 72.4% der Tage in der Losartan bzw. Atenolol-Gruppe).
In beiden Behandlungsgruppen wurde der Blutdruck signifikant auf vergleichbare Werte gesenkt und ein vergleichbar grosser Anteil der Patienten erreichte den Zielblutdruck. Die mittlere Beobachtungsdauer betrug 4.8 Jahre.
Der primäre Endpunkt war die Kombination von kardiovaskulärer Morbidität und Mortalität gemessen als Reduktion der kombinierten Ereignisse kardiovaskulärer Tod, Schlaganfall und Myokardinfarkt. Die Ergebnisse zeigten, dass die Behandlung mit Losartan im Vergleich zu Atenolol zu einer Risikoreduktion von 13% (p=0.021) in Bezug auf den primären zusammengesetzten Endpunkt führte (siehe Graphik 1).
Die statistische Signifikanz wurde in der Reduktion des Schlaganfalls gezeigt, während die kardiovaskuläre Mortalität und Myokard-Infarkt-Endpunkte keine statistische Signifikanz hatten.
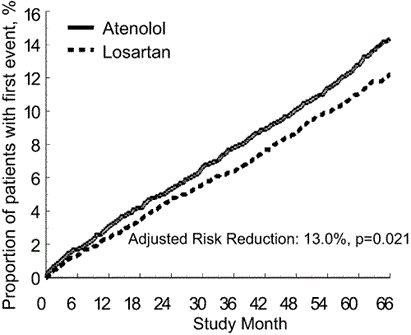
Graphik 1) Kaplan-Meier-Kurven des primären kombinierten Endpunkts kardiovaskulärer Tod, Schlaganfall oder Myokardinfarkt in den mit Losartan und mit Atenolol behandelten Gruppen, adjustiert auf den «Framingham Baseline Risk Score» und den Grad der EKG-dokumentierten Linksherzhypertrophie.
Die Behandlung mit Losartan reduzierte das Risiko eines Schlaganfalls im Vergleich zu Atenolol um 25% (p=0.001). Die Rate der Ereignisse kardiovaskulärer Mortalität und Myokardinfarkt war nicht signifikant unterschiedlich zwischen den Behandlungsgruppen. Die Wirkung von Losartan auf den primären kombinierten Endpunkt schien über den Vorteil der alleinigen Blutdrucksenkung hinauszugehen (siehe Tabelle unten).
Life Studien Endpunkte
|
Ergebnis |
Losartan |
Rate* |
Atenolol |
Rate* |
Risikoreduktion** |
p-Wert |
|
Primärer kombinierter Endpunkt |
508 (11%) |
23.8 |
588 (13%) |
27.9 |
13% |
0.021 |
|
Komponenten des primären kombinierten Endpunkts | ||||||
|
Kardiovaskuläre Mortalität |
204 (4%) |
9.2 |
234 (5%) |
10.6 |
11% |
0.206 |
|
Schlaganfall |
232 (5%) |
10.8 |
309 (7%) |
14.5 |
25% |
0.001 |
|
Myokardinfarkt |
198 (4%) |
9.2 |
188 (4%) |
8.7 |
-7% |
0.491 |
|
* Pro 1000 Patientenjahre Weiterbeobachtung. | ||||||
Andere klinische Endpunkte der LIFE Studie waren: Gesamtmortalität, Hospitalisierung wegen Herzinsuffizienz oder Angina pectoris, koronare oder periphere Revaskularisierungsmassnahmen, sowie Reanimation nach Herzstillstand. Es traten keine signifikanten Unterschiede in der Häufigkeit dieser Endpunkte zwischen den Behandlungsgruppen auf. Mit Losartan behandelte Patienten zeigten im Vergleich zu mit Atenolol behandelten Patienten eine signifikant grössere Reduktion der LVH-Werte im EKG.
Die Wirkung von Losartan im Vergleich zu Atenolol auf kardiovaskuläre Morbidität und Mortalität wurde in Subgruppen bei Patienten mit Diabetes mellitus (n=1195) und mit isolierter systolischer Hypertonie (ISH) (n=1326) in der Vorgeschichte untersucht. Im Hinblick auf den primären kombinierten Endpunkt entsprachen die Ergebnisse dieser Subgruppen dem vorteilhaften Ergebnis der Losartan-Behandlung der Studien-Gesamtpopulation: bei Diabetikern wurde eine 24% Risikoreduktion (p=0.03) und bei Patienten mit isolierter systolischer Hypertonie (ISH) wurde eine 25% Risikoreduktion (p=0.06) beobachtet. Bei Bluthochdruck-Patienten mit linksventrikulärer Hypertrophie ist Losartan HCT axapharm eine angemessene alternative Formulierung für Patienten, die ansonsten gleichzeitig mit Losartan und Hydrochlorothiazid einmal täglich behandelt würden zur Reduktion der kardiovaskulären Morbidität und Mortalität.
Unterschiede betreffend Hautfarbe
Die in der LIFE Studie beobachteten vorteilhaften Ergebnisse von Losartan im Vergleich zu Atenolol auf die kardiovaskuläre Morbidität und Mortalität gelten nicht für Patienten mit schwarzer Hautfarbe, die an Bluthochdruck und linksventrikulärer Hypertrophie leiden, obwohl beide Therapeutika den Blutdruck bei Patienten mit schwarzer Hautfarbe effektiv senkten.
Dagegen senkte Losartan in der LIFE Studie im Vergleich zu Atenolol das Risiko kardiovaskulärer Morbidität und Mortalität bei nicht-schwarzen Hypertonikern mit linksventrikulärer Hypertrophie (n=8660) signifikant (p=0.003) in Bezug auf den primären kombinierten Endpunkt kardiovaskulärer Tod, Schlaganfall und Myokardinfarkt.
Es zeigte sich, dass mit Atenolol behandelte Patienten schwarzer Hautfarbe ein geringeres Risiko den kombinierten primären Endpunkt zu erreichen hatten als mit Losartan behandelte Patienten (p=0.03) schwarzer Hautfarbe. In der Subgruppe der Patienten mit schwarzer Hautfarbe (n=533; 6% der Patienten der LIFE Studie) gab es 29 primäre Endpunkte unter den 263 mit Atenolol behandelten Patienten (11%, 25.9 pro 1000 Patientenjahre) und 46 primäre Endpunkte unter den 270 mit Losartan behandelten Patienten (17%, 41.8 pro 1000 Patientenjahre).
In der LIFE Studie war eine signifikant geringere Häufigkeit der Therapieabbrüche auf Grund von unerwünschten Nebenwirkungen unter Losartan im Vergleich zu Atenolol nachweisbar.
Pharmakokinetik
Absorption
Losartan
Nach oraler Einnahme wird Losartan gut absorbiert und unterliegt einem firstpass Effekt, wobei ein aktiver Carboxylsäure-Metabolit und weitere inaktive Metaboliten gebildet werden. Die Bioverfügbarkeit von Losartan-Tabletten beträgt ungefähr 33%. Durchschnittliche Spitzenkonzentrationen von Losartan werden nach 1 Stunde, die des aktiven Metaboliten nach 3 bis 4 Stunden erreicht. Bei gleichzeitiger Einnahme mit einer normalen Mahlzeit wurden im Plasmakonzentrationsprofil von Losartan keine klinisch signifikanten Veränderungen beobachtet.
Hydrochlorothiazid
Die Bioverfügbarkeit von Hydrochlorothiazid-Tabletten beträgt ungefähr 70%. Nach oraler Einnahme einer Einzeldosis von 12.5, 25, 50 und 75 mg werden mittlere Maximalkonzentrationen im Plasma von 70, 142, 260 und 376 ng/ml durchschnittlich nach 2 Stunden erreicht. Innerhalb des therapeutischen Dosierungsbereichs ist die systemische Verfügbarkeit von Hydrochlorothiazid proportional zur Dosis.
Distribution
Losartan
Sowohl Losartan und sein aktiver Metabolit sind zu mindestens 99% an Plasmaproteine, vor allem Albumin gebunden. Das Verteilungsvolumen von Losartan beträgt 34 Liter. Versuche an Ratten zeigten, dass Losartan die Blut-Liquorschranke kaum durchdringt.
Hydrochlorothiazid
Hydrochlorothiazid passiert die Plazenta, aber nicht die Blut/Hirn-Schranke und wird in der Muttermilch ausgeschieden.
Hydrochlorothiazid ist zu etwa 40-70% an Plasmaproteine gebunden. Das apparente Verteilungsvolumen wird auf 5-6 l/kg geschätzt.
Metabolismus
Losartan
Ungefähr 14% einer peroral verabreichten Losartan-Dosis werden zum aktiven Metaboliten umgewandelt. In-vitro-Studien zeigen, dass Cytochrom P450 2C9 und 3A4 an der Umwandlung von Losartan in seine Metaboliten beteiligt sind. Bei 1% der Patienten wurde aufgrund einer genetisch bestimmten Enzympolymorphie eine geringere Umwandlung beobachtet (weniger als 1% der Dosis im Vergleich zu 14% der Dosis bei normalen Patienten). Nach oraler Gabe von 14C-markiertem Losartan ist die im Plasma zirkulierende Radioaktivität hauptsächlich auf Losartan und seinen aktiven Metaboliten zurückzuführen.
Neben dem aktiven Metaboliten werden inaktive Metaboliten gebildet, so zwei Hauptmetaboliten durch Hydroxylierung der Butylseitenkette und ein weiterer Metabolit, ein N-2 Tetrazole Glucuronid.
Elimination
Losartan
Die Plasma-Clearance von Losartan beträgt 600 ml/min, beim aktiven Metaboliten 50 ml/min. Die renale Clearance von Losartan ist 74 ml/min, resp. beim aktiven Metaboliten 26 ml/min. Bei oraler Verabreichung werden ungefähr 4% der Dosis unverändert, ungefähr 6% der Dosis als aktiver Metabolit im Urin ausgeschieden. Die Pharmakokinetik von Losartan und seinem aktiven Metaboliten verlaufen bis zu Dosen von 200 mg Losartan linear.
Nach oraler Einnahme nehmen die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten polyexponentiell ab mit einer Halbwertszeit von ca. 2 bzw. 6-9 Stunden. Bei einmaliger Tagesdosierung mit 100 mg kommt es weder bei Losartan noch beim aktiven Metaboliten zu einer signifikanten Kumulation im Plasma.
Sowohl biliäre wie renale Ausscheidung tragen zur Elimination von Losartan und dessen Metaboliten bei. Nach oraler Einnahme von 14C-markiertem Losartan werden beim Menschen 35% der Radioaktivität im Urin und 58% im Stuhl wiedergefunden.
Hydrochlorothiazid
In Studien mit Bestimmung der Plasmaspiegel über mindestens 24 Stunden wurden Plasma-Halbwertszeiten zwischen 5.6 und 14.8 Stunden gemessen. Mindestens 61% einer oralen Dosis wird innerhalb von 24 Stunden über die Nieren ausgeschieden, 95% davon in unveränderter Form und etwa 4% als Hydrolysat des 2-Amino-4-chlor-m-benzoldisulfonamids. Bis zu 24% einer oralen Dosis können in den Fäzes gefunden und eine unbedeutende Menge über die Galle ausgeschieden werden.
Kinetik spezieller Patientengruppen
Losartan-Hydrochlorothiazid
Die AUC für Losartan (aber nicht für den aktiven Metaboliten von Losartan) und Hydrochlorothiazid ist bei älteren Patienten im Vergleich zu jüngeren Patienten erhöht.
Losartan
Bei Patienten mit leichter bis mässiger alkoholischer Leberzirrhose waren nach peroraler Einnahme die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten im Vergleich zu jungen, gesunden Männern 5-, bzw. 1.7-fach erhöht.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse eliminiert werden.
Hydrochlorothiazid
Im Vergleich zu jungen ist bei älteren Patienten die Hydrochlorothiazid-Plasmakonzentration im Steadystate höher und die systemische Clearance beträchtlich langsamer.
Bei Nierenfunktionsstörungen sind die mittleren Maximalkonzentrationen im Plasma und die AUC-Werte von Hydrochlorothiazid erhöht. Bei Patienten mit Niereninsuffizienz (Kreatininclearance zwischen 30 und 70 ml/min) ist die mittlere Halbwertszeit der Elimination fast verdoppelt.
Präklinische Daten
Die präklinischen Studien einschliesslich konventioneller Studien zur allgemeinen Pharmakologie, zur Genotoxizität und zum kanzerogenen Potenzial lassen keine besonderen Gefahren für den Menschen erkennen. Das toxische Potenzial einer Kombination von Losartan/Hydrochlorothiazid nach oraler Gabe wurde in Studien zur chronischen Toxizität mit bis zu sechsmonatiger Dauer mit Ratten und Hunden bewertet. Die in diesen Studien mit der Kombination beobachteten Veränderungen wurden hauptsächlich durch den Bestandteil Losartan bewirkt. Die Verabreichung der Losartan/Hydrochlorothiazid-Kombination führte zu einer Abnahme der roten Blutzellparameter (Erythrozyten, Hämoglobin, Hämatokrit), einem Anstieg des Harnstoff-Stickstoffs im Serum, einer Abnahme im Herzgewicht (ohne histologisches Korrelat) und gastrointestinalen Veränderungen (Schleimhautläsionen, Ulzera, Erosionen, Hämorrhagien).
Kein Hinweis auf Teratogenität ergab sich bei Ratten oder Kaninchen bei Gabe von Losartan/Hydrochlorothiazid. Bei Ratten wurde fetale Toxizität, erkennbar an einem leichten Anstieg überzähliger Rippen in der F1-Generation, beobachtet, wenn weibliche Tiere vor und während der Gestation therapiert wurden. Wie auch in Studien mit Losartan allein festgestellt, kam es zu unerwünschten Wirkungen an Feten und Neonaten, wie renaler Toxizität oder Tod der Feten, wenn trächtigen Ratten während der späten Gestation und/oder Laktation Losartan-Hydrochlorothiazid verabreicht wurde.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP.» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) in der Originalverpackung vor Licht geschützt und ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
62109 (Swissmedic).
Packungen
Losartan HCT axapharm 50/12.5 mg: 28 und 98 Filmtabletten. [B]
Losartan HCT axapharm 100/12.5 mg: 28 und 98 Filmtabletten. [B]
Losartan HCT axapharm 100/25 mg: 28 und 98 Filmtabletten. [B]
Zulassungsinhaberin
axapharm ag, 6340 Baar.
Stand der Information
Mai 2022.