Zusammensetzung
Wirkstoff: Nonacogum gamma (Factor IX coagulationis humanus(ADNr))
Hilfsstoffe: Natrii chloridum, Saccharum, Calcii chloridum, Mannitolum, Histidinum, Polysorbatum 80
Lösungsmittel: Aqua ad iniectabilia
Galenische Form und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel zur intravenösen Injektion.
Einzeldosis Durchstechflasche mit 250 I.E., 500 I.E., 1000 I.E., 2000 I.E. oder 3000 I.E.
Nach der Rekonstitution mit den mitgelieferten 5 ml Aqua ad iniectabilia ist die Konzentration des Produkts für jede Stärke unterschiedlich. Die folgende Tabelle gibt die ungefähre Konzentration für jede Stärke an.
|
Stärke |
Ungefähre Produkt Konzentration |
|
250 I.E./Durchstechflasche |
50 I.E./ml |
|
500 I.E./Durchstechflasche |
100 I.E./ml |
|
1000 I.E./Durchstechflasche |
200 I.E./ml |
|
2000 I.E./Durchstechflasche |
400 I.E./ml |
|
3000 I.E./Durchstechflasche |
600 I.E./ml |
Die spezifische Aktivität von RIXUBIS beträgt mindestens 200 I.E. Faktor IX pro mg. Die Aktivität (I.E.) wird mit dem Einstufen-Gerinnungstest gemäss Europäischer Pharmakopöe bestimmt.
Indikationen/Anwendungsmöglichkeiten
RIXUBIS ist indiziert für die Behandlung und Prophylaxe von Blutungen bei Patienten mit Hämophilie B (angeborener Mangel an Faktor IX).
Dosierung/Anwendung
Die Therapie muss unter Aufsicht eines in der Behandlung von Hämophilie erfahrenen Arztes eingeleitet werden.
Dosierung
·Dosierung und Dauer der Therapie mit RIXUBIS sind abhängig vom Schweregrad des Faktor IX-Mangels, Ort und Ausmass der Blutung, vom klinischen Zustand und Alter des Patienten sowie von den pharmakokinetischen Parametern des Faktor IX, wie Recovery und Halbwertszeit.
·Um sicherzustellen, dass der gewünschte Faktor IX-Spiegel erreicht wird, wird eine genaue Überwachung der Patienten mittels Faktor IX-Aktivitätsbestimmung empfohlen. Falls erforderlich, kann die Dosis und Häufigkeit der Injektionen entsprechend angepasst werden. Der Patient soll regelmässig auf die Bildung von Inhibitoren gegen Faktor IX überwacht werden, falls die erwarteten Faktor IX-Plasmaaktivitäten nicht erreicht werden oder wenn die Blutung mit einer angemessenen Dosis nicht beherrscht wird. [siehe Warnhinweise und Vorsichtsmassnahmen]
·Auf jeder Durchstechflasche von RIXUBIS ist die Aktivität des rekombinanten Faktors IX (rFIX) in Internationalen Einheiten angegeben.
·Die Sicherheit und Wirksamkeit bei der Anwendung von RIXUBIS als kontinuierliche Injektion wurde nicht nachgewiesen.
Die folgende Formel dient zur Berechnung der erforderlichen Dosis zur Behandlung von Blutungen:
|
Erforderliche Faktor IX-Einheiten (I.E.) |
= |
Körpergewicht (kg) |
x |
Erwünschter Faktor IX-Anstieg |
x |
Reziproke, beobachtete Recovery |
Patienten ≥ 12 Jahre
Die Berechnung der erforderlichen Dosis von RIXUBIS basiert auf dem empirischen Befund, dass bei Patienten ≥ 12 Jahre eine Internationale Einheit rFIX pro kg Körpergewicht den Faktor IX-Spiegel im Plasma durchschnittlich um 0.9 I.E./dl erhöht (SD von 0.5 bis 1.4 I.E./dl). Die in der obenstehenden Formel angeforderte Reziproke der beobachteten Recovery ist daher im Mittelwert 1.1 dl/kg (SD 0.7 bis 1.9 dl/kg).
Patienten < 12 Jahre
Die Berechnung der erforderlichen Faktor IX-Dosis von RIXUBIS basiert auf dem empirischen Befund, dass bei Patienten < 12 Jahre eine Internationale Einheit rFIX pro kg Körpergewicht den Faktor IX-Spiegel im Plasma durchschnittlich um 0.7 I.E./dl erhöht (SD von 0.31 bis 1.0 I.E./dl). Die in der obenstehenden Formel angeforderte Reziproke der beobachteten Recovery ist daher im Mittelwert 1.4 dl/kg.
Aufgrund der Vielzahl an individuellen Unterschieden der Recovery wird empfohlen, die erforderliche Dosis anhand der individuellen Recovery des Patienten zu berechnen, die durch aufeinanderfolgende Faktor IX-Aktivitäts-Bestimmungen ermittelt wird.
Die Dosis unter Beachtung der klinischen Situation des Patienten und individuellen Pharmakokinetik, insbesondere der Recovery und Halbwertszeit, anpassen.
Bei lebensbedrohlichen Blutungen und grösseren Operationen ist es besonders wichtig die Therapie möglichst sorgfältig zu überwachen.
Bei den folgenden hämorrhagischen Ereignissen darf die Faktor IX-Aktivität im entsprechenden Zeitraum nicht unter den angegebenen Faktor IX- Plasmaaktivitätsspiegel (in % der Norm oder in I.E./dl) fallen. Die folgende Tabelle enthält Richtwerte für die Dosierung bei Blutungen und chirurgischen Eingriffen:
|
Grad der Blutung / Art des chirurgischen Eingriffs |
Erforderlicher Faktor-IX-Plasmaspiegel |
Häufigkeit der Dosierung (Stunden) / Behandlungsdauer (Tage) |
|
Blutung | ||
|
Frühe Hämarthrose, Muskelblutung oder orale Blutung |
20 – 40 |
Injektion alle 24 Stunden wiederholen, mindestens 1 Tag, bis die durch Schmerzen angezeigte Blutung gestillt oder Heilung erreicht ist. |
|
Mittelschwere Hämarthrose, Muskelblutung oder Hämatome |
30 – 60 |
Injektion alle 24 Stunden wiederholen, für 3 – 4 Tage oder länger, bis Schmerzen und Behinderungen beseitigt sind. |
|
Lebensbedrohliche Blutungen |
60 – 100 |
Injektion alle 8 – 24 Stunden wiederholen, bis die Gefahr für den Patienten vorüber ist. |
|
Chirurgische Eingriffe | ||
|
Kleine Eingriffe, einschliesslich Zahnextraktionen |
30 – 60 |
Injektion alle 24 Stunden, mindestens 1 Tag, bis Heilung erreicht ist. |
|
Grosse Eingriffe |
80 – 100 |
Injektion alle 8 – 24 Stunden bis zur adäquaten Wundheilung wiederholen, danach Therapie für mindestens 7 weitere Tage fortsetzen, um eine Faktor IX-Aktivität von 30% – 60% (I.E./dl) aufrechtzuerhalten. |
Insbesondere bei grossen chirurgischen Eingriffen oder lebensbedrohlichen Blutungen ist eine genaue Überwachung der Substitutionstherapie unerlässlich.
Langzeitprophylaxe
RIXUBIS kann zur Langzeitprophylaxe von Blutungen bei Patienten mit schwerer und mittelschwerer Hämophilie B verabreicht werden. Die empfohlene Dosis bei vorbehandelten Patienten (PTP) ab 12 Jahren beträgt 40 bis 60 IE/kg zweimal wöchentlich, bei Kindern unter 12 Jahren 40 bis 80 IE/kg zweimal wöchentlich. In Abhängigkeit von Alter des Patienten, Phänotyp der Blutung und körperlicher Aktivität können kürzere Dosierungsintervalle oder höhere Dosen notwendig sein.
Aufgrund der Vielzahl an individuellen Unterschieden der Recovery wird empfohlen, die erforderliche Dosis anhand der individuellen Recovery des Patienten zu berechnen, die durch aufeinanderfolgende Faktor IX-Aktivitäts-Bestimmungen ermittelt wird.
Die Dosis unter Beachtung der klinischen Situation des Patienten und individuellen Pharmakokinetik, insbesondere der Recovery und Halbwertszeit, anpassen.
Zuvor unbehandelte Patienten
Es liegen keine Erfahrungen mit RIXUBIS vor bei zuvor noch nicht mit Faktor IX Präparaten behandelten Patienten (Previously Untreated Patients, PUPs).
Ältere Patienten
In klinische Studien mit RIXUBIS wurden keine älteren Patienten über 65 Jahre eingeschlossen. Es ist daher nicht bekannt, ob diese Patientengruppe unterschiedlich auf RIXUBIS reagiert als jüngere Patienten. Wie für alle Patienten, sollte die Dosis für ältere Patienten individuell angepasst werden.
Art der Verabreichung
Zur intravenösen Injektion nur nach Rekonstitution.
Die Anwendung von RIXUBIS erfolgt bei Raumtemperatur mit einer Verabreichungsgeschwindigkeit, die sich nach dem Befinden des Patienten richtet, wobei eine maximale Injektionsrate von 10 ml/min nicht überschritten werden sollte. RIXUBIS nicht als kontinuierliche Injektion verabreichen.
Dieses Produkt nur mit sterilen Einmalspritzen aus Kunststoff anwenden.
Kontraindikationen
RIXUBIS ist bei Patienten mit einer bekannten Überempfindlichkeit gegen den Wirkstoff, andere Bestandteile des Präparats oder Hamsterproteine kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Überempfindlichkeitsreaktionen
Es wurde über Überempfindlichkeit mit RIXUBIS berichtet. Anaphylaktische oder Überempfindlichkeitsreaktionen sind möglich. Siehe Abschnitt Unerwünschte Wirkungen. Die Patienten und/oder ihre Betreuungsperson müssen deshalb über frühe Anzeichen von Überempfindlichkeitsreaktionen aufgeklärt werden. Wenn solche Symptome auftreten, sollen die Patienten die Behandlung sofort abbrechen und ihren Arzt kontaktieren. Das höchste Risiko besteht in der Anfangsphase der Erstbehandlung mit Faktor IX Konzentraten bei zuvor unbehandelten Patienten, vor allem bei Patienten mit bestimmten FIX-Genmutationen, die mit einem hohen Risiko für das Auftreten eines Faktor IX-Inhibitors und /oder einer Überempfindlichkeitsreaktion auf Faktor IX-Präparate verbunden sind.
In der Literatur wurde über einen Zusammenhang zwischen dem Auftreten eines Faktor IX-Inhibitors und allergischen Reaktionen berichtet, insbesondere bei Patienten mit einem höheren Risiko einer Mutation des Faktor IX Gens. Deshalb sollten Patienten, die eine allergische Reaktion entwickeln auf die Anwesenheit eines Inhibitors untersucht werden. Im Falle eines Schocks soll eine Schocktherapie nach aktuellem medizinischem Standard durchgeführt werden.
Inhibitoren – Nephrotisches Syndrom
Patienten mit Hämophilie B können neutralisierende Antikörper (Inhibitoren) gegen Faktor IX bilden.
Patienten, die mit rekombinantem Faktor IX (rFIX) behandelt werden, sollten regelmässig klinisch und mit geeigneten Labortests hinsichtlich der Entwicklung von Inhibitoren überwacht werden.
Falls die erwarteten Faktor IX-Plasmaaktivitäten nicht erreicht werden oder wenn die Blutung mit der erwarteten Dosis nicht beherrscht wird, muss ein Assay, der die Faktor IX-Inhibitor Konzentration ermittelt, durchgeführt werden. Bei Patienten, die Inhibitoren gegen Faktor IX entwickeln, wird die Kontaktaufnahme mit einem spezialisiertem Hämophilie-Zentrum empfohlen. Da eine Therapie mit rFIX bei Patienten mit hohem Faktor IX-Inhibitor-Titern nicht effektiv sein kann, sollte eine andere Therapie in Betracht gezogen werden.
Patienten mit Faktor IX-Inhibitoren haben bei wiederholter Exposition mit Faktor IX ein erhöhtes Risiko eine schwere Überempfindlichkeitsreaktion oder Anaphylaxie zu entwickeln.
Es liegen Berichte über das Auftreten eines nephrotischen Syndroms nach versuchter Immuntoleranzinduktion bei Hämophilie B-Patienten mit Faktor IX-Inhibitoren vor. Die Sicherheit und Wirksamkeit von RIXUBIS zur Immuntoleranzinduktion wurde nicht nachgewiesen.
Thromboembolie, DIC, Fibrinolyse
Die Verwendung von Faktor IX-Konzentraten wird mit thromboembolischen Komplikationen (z.B. Lungenembolie, venöse und arterielle Thrombosen) in Zusammenhang gebracht. Daher können Faktor IX-haltige Produkte eine potentielle Gefährdung darstellen für Patienten, die unter Verbrauchskoagulopathie (DIC) leiden oder Anzeichen einer Fibrinolyse aufweisen. Wegen des Risikos thromboembolischer Komplikationen ist bei Patienten mit Lebererkrankungen, bei frisch operierten Patienten, bei Neugeborenen und bei Patienten, bei denen das Risiko thrombotischer Ereignisse oder einer Verbrauchskoagulopathie besteht, eine klinische Beobachtung mit geeigneten biologischen Testverfahren erforderlich, um Frühzeichen einer thrombotischen Komplikation oder einer Verbrauchskoagulopathie festzustellen. In den genannten Fällen muss der Vorteil einer Behandlung mit rFIX gegen die Risiken abgewogen werden.
Überwachende Laboruntersuchungen
·Überwachung des Faktor IX-Aktivitätsspiegels mittels eines Einstufen-Gerinnungstests um sicherzustellen, dass ein angemessener Faktor IX-Spiegel erreicht wurde und, wenn klinisch angezeigt aufrechterhalten wird [siehe Dosierung / Anwendung].
·Überprüfung einer Inhibitoren-Entwicklung, falls die erwarteten Faktor IX-Plasmaaktivitäten nicht erreicht werden oder wenn die Blutung mit der empfohlenen Dosis RIXUBIS nicht beherrscht wird. Um festzustellen ob Faktor IX-Inhibitoren vorliegen muss unter Verwendung geeigneter Assays eine Titration in Bethesda-Einheiten (B.U.) durchgeführt werden.
Dieses Arzneimittel enthält 19 mg Natrium pro Durchstechflasche. Dies muss bei Patienten, die einer natriumkontrollierten Diät unterliegen, berücksichtigt werden.
Im Interesse des Patienten wird empfohlen, bei jeder Anwendung von RIXUBIS, den Namen und die Chargennummer des Produktes zu registrieren.
Interaktionen
Es sind keine Wechselwirkungen von rekombinanten Blutgerinnungsfaktoren IX mit anderen Arzneimitteln bekannt.
Schwangerschaft, Stillzeit
Es wurden keine Reproduktionsstudien bei Tieren mit RIXUBIS durchgeführt. Es ist nicht bekannt ob eine Anwendung von RIXUBIS bei Schwangeren reproduktionstoxische Eigenschaften hat oder zu gesundheitsschädlichen Wirkungen beim ungeborenen Kind führt.
Falls notwendig kann RIXUBIS während der Schwangerschaft angewendet werden.
Es ist nicht bekannt ob dieser Wirkstoff in die Muttermilch übergeht. Da viele Wirkstoffe in die Muttermilch übergehen, sollte RIXUBIS bei stillenden Müttern nur mit Vorsicht verabreicht werden. Nur Anwenden wenn notwendig.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es liegen keine Hinweise darauf vor, dass RIXUBIS die Fahrtüchtigkeit oder das Bedienen von Geräten / Maschinen beeinträchtigen könnte.
Unerwünschte Wirkungen
Die folgenden Nebenwirkungen wurden während der klinischen Entwicklung von RIXUBIS aus 2 abgeschlossenen Studien sowie 2 noch laufenden Studien zusammengefasst, mit 99 einzelnen, männlichen, vorbehandelten Patienten mit Hämophilie B, die insgesamt 14018 Injektionen erhalten haben.
Innerhalb der Organsysteme sind die Nebenwirkungen nach ihrer Häufigkeit geordnet. Die Häufigkeiten sind auf einer Basis „je Injektion“ angegeben und mittels folgenden Kategorien beschrieben: häufig (<1/10, ≥1/100) gelegentlich (≥1/1000, <1/100), selten (≥1/10‘000, <1/1000), sehr selten (<1/10000)
Immunsystem
Einzelfälle: Überempfindlichkeit (einschliesslich Symptome wie Dyspnoe, Pruritus)
Nervensystem
Selten: Geschmacksstörungen
Muskelskelettsystem
Sehr selten: Schmerzen in den Extremitäten
Haut
Einzelfälle: Urtikaria, Ausschlag
Untersuchungen
Selten: positiver anti-Faktor IX Antikörpertest
Immunogenität
Während der klinischen Entwicklung von RIXUBIS an 99 vorbehandelten Patienten zeigte keiner der Patienten eine Inhibitor-Entwicklung. Es traten auch keine Antikörper mit totaler Bindungskapazität gegenüber Faktor IX auf, die mit der Behandlung in Zusammenhang standen sowie keine Antikörper gegen Proteine der Ovarial-Zelllinie des Chinesischen Hamsters.
Kinder und Jugendliche
Es liegen keine Daten über zuvor unbehandelte Patienten vor, da zu den klinischen Studien nur bereits behandelte Patienten zugelassen wurden. Bei dieser Risikopopulation wurde daher keine Immunogenitäts-Untersuchung zur Entwicklung von Inhibitoren durchgeführt.
Klasseneffekt
Disseminierte intravasale Gerinnung, thromboembolische Ereignisse (z.B. Lungenembolie, Venenthrombose, arterielle Thrombose). Anaphylaxie oder allergische Reaktionen (einschliesslich Symptome wie Angioödem, Engegefühl in der Brust, Hypotonie, Lethargie, Übelkeit, Erbrechen, Missempfindung, Ruhelosigkeit, Giemen, Atemnot).
Überdosierung
Es wurden keine Symptome der Überdosierung berichtet.
Eigenschaften/Wirkungen
ATC-Code: B02BD04
RIXUBIS enthält rekombinanten Gerinnungsfaktor IX (Nonacog gamma). Faktor IX ist ein einkettiges Glykoprotein mit einer Molekülmasse von ca. 68 000 Dalton. Es ist ein Vitamin-K-abhängiger Gerinnungsfaktor und wird in der Leber synthetisiert. Faktor IX wird durch Faktor XIa über den intrinsischen und durch den Faktor VII/Gewebefaktor-Komplex über den extrinsischen Weg der Blutgerinnung aktiviert. Aktivierter Faktor IX aktiviert zusammen mit aktiviertem Faktor VIII den Faktor X. Der aktivierte Faktor X wandelt Prothrombin in Thrombin um. Thrombin wiederum wandelt Fibrinogen zu Fibrin um, wodurch die Gerinnselbildung erfolgt.
Hämophilie B ist eine geschlechtsgebundene, erbliche Störung der Blutgerinnung aufgrund
erniedrigter Faktor-IX-Spiegel. Dies führt, entweder spontan oder in Folge unfallbedingter oder chirurgischer Traumata zu starken Blutungen in Gelenken, Muskeln oder inneren Organen. Durch die Substitutionstherapie werden die Faktor-IX-Plasmaspiegel erhöht, wodurch eine vorübergehende Korrektur des Faktor-IX-Mangels und der Blutungsneigung erfolgt.
Klinische Wirksamkeit
Patienten ≥ 12 Jahre
Die klinische Wirksamkeit von RIXUBIS wurde in einer prospektiven, unkontrollierten multicenter Open-Label-Studie gezeigt. 73 bereits zuvor behandelte Patienten zwischen 12 und 65 Jahren erhielten RIXUBIS entweder zur Prophylaxe oder zur Akut-Behandlung.
Als vorbehandelt galten Patienten, welche seit mindestens 150 Tagen eine Faktor IX Substitutionstherapie erhielten. Alle Patienten litten an schwerer (Faktor IX Spiegel <1%) oder mittelschwerer (Faktor IX-Spiegel ≤ 2%) Hämophilie B.
Die jährliche Blutungsrate unter Prophylaxe für alle Blutungen betrug 4.3, für spontane Blutungen 1.7, und für Gelenkblutungen 2.9.
Insgesamt wurden 249 Blutungsepisoden mit RIXUBIS behandelt, von welchen 197 Gelenkblutungen und 52 keine Gelenkblutungen (weiches Gewebe, Muskel, Körperhöhlen, intrakranielle Blutungen und andere) waren.
Von diesen waren 163 mittelschwer, 71 von geringerem Schweregrad und 15 schwerwiegend. In 211/249 Fällen (84.7%) konnten die Blutungen mit 1 bis 2 RIXUBIS Injektionen gestoppt werden.
In 96.0% aller behandelten Blutungsepisoden wurde die hämostatische Wirksamkeit bei einer Blutungsstillung als exzellent oder gut eingestuft.
Die Sicherheit und Wirksamkeit von RIXUBIS bei perioperativer Anwendung wurde in einer prospektiven, open-label, unkontrollierten, multicenter Phase-3-Studie an vorbehandelten männlichen Patienten mit schwerer oder mittelschwerer Hämophilie B getestet.
Die per-protocol Wirksamkeitsanalyse beinhaltet 37 Operationen bei 27 Patienten (zwischen 17 und 57 Jahre alt) welche grösseren oder kleineren chirurgischen, zahnärztlichen oder anderen chirurgischen invasiven Eingriffen unterzogen wurden. Zwanzig Eingriffe waren gross, einschliesslich 13 orthopädischen Operationen und 3 zahnärztlichen Operationen.
17 Eingriffe, einschliesslich 10 Zahnextraktionen wurden als kleine chirurgische Eingriffe eingestuft.
Sowohl bei den grösseren wie auch kleineren Eingriffen, entsprachen die intraoperativen Blutverluste den erwarteten, im Voraus spezifizierten Mengen, in keinem Fall kam es zu unüblich grossen Blutverlusten.
Bei keinem der Studienteilnehmer kam es zu thrombotischen Komplikationen.
Patienten < 12 Jahre
Die klinische Wirksamkeit von RIXUBIS wurde in einer kombinierten, Phase 2/3 Studie untersucht, in der 23 männliche zuvor behandelte Patienten zwischen 1.8 und 11.8 Jahren (Mittelwert 7.10 Jahre) darunter 11 Patienten < 6 Jahren, RIXUBIS entweder zur Prophylaxe oder für die Behandlung von Blutungsereignissen erhielten.
Alle Teilnehmer hatten eine schwere (Faktor IX Wert < 1 %) oder mittelschwere (Faktor IX Wert ≤ 2 %) Hämophilie B. Alle 23 Teilnehmer erhielten mindestens 3 Monate lang eine prophylaktische Behandlung mit RIXUBIS und wurden in die Wirksamkeitsbewertung für Prophylaxe aufgenommen.
Der Medianwert der jährlichen Blutungsrate betrug 2.0 für spontane Blutungen und für Gelenkblutungen 0.0.
Bei neun Teilnehmern (39.1 %) traten keine Blutungen auf.
Insgesamt wurden 26 Blutungsereignisse mit RIXUBIS behandelt, von denen 23 von Verletzungen herrührten, 2 spontan auftraten und eine unbekannter Ursache war. Neunzehn Blutungen traten ausserhalb von Gelenken auf (Weichteile, Muskeln, Körperhöhlen, intrakranial und andere Lokalisationen) und 7 waren Gelenkblutungen, davon 1 Blutung in ein Zielgelenk. Von den 26 Blutungsereignissen waren 15 leicht, 9 mittelschwer und 2 schwerwiegend. Die Behandlung erfolgte individuell nach Schweregrad, Ursache und Ort der Blutung. Die Mehrzahl (23; 88.5 %) wurden mit 1 bis 2 Injektionen behandelt. Die hämostatische Wirksamkeit bei einer Blutstillung wurde bei 96.2 % aller behandelten Blutungsepisoden als hervorragend oder gut eingestuft.
Pharmakokinetik
Die pharmakokinetischen Parameter wurden in der pivotalen Studie (Patienten ≥ 12 Jahre) und der pädiatrischen Studie (Patienten < 12 Jahren) aus Bestimmungen der Faktor IX Aktivität berechnet, die jeweils bis zu 72 Stunden nach der einzelnen Injektion von 75 IU/ml in Blutproben ermittelt wurden. In der pivotalen Studie, wurden die pharmakokinetischen Bestimmungen in Patienten welche Rixubis für 26 ± 1 (Mittel ± SD) Wochen erhielten und schlussendlich mindestens einer 30 tägigen Gabe von RIXUBIS ausgesetzt waren wiederholt.
|
RIXUBIS | |||||
|
Parameter |
≥ 12 Jahre, |
≥ 12 Jahre, |
< 6 Jahre |
6 - < 12 Jahre |
< 12 Jahre |
|
AUC0–Inf (IE·h/dL) |
1207.10 ± 242.26 |
1305.08 ± 299.95 |
723.7 ± 119.0 |
886.0 ± 133.66 |
808.4 ± 149.14 |
|
Inkrementelle Recovery bei Cmax |
0.87 ± 0.22 |
0.95 ± 0.25 |
Nicht bestimmt |
Nicht bestimmt |
Nicht bestimmt |
|
Inkrementelle Recovery bei 30 Minuten |
NA |
0.87±0.20 |
Siehe untenstehende Tabelle |
Siehe untenstehende Tabelle |
Siehe untenstehende Tabelle |
|
Halbwertszeit (h) |
26.70 ± 9.55 |
25.36 ± 6.86 |
27.67 ± 2.66 |
23.15 ± 1.58 |
25.31 ± 3.13 |
|
Cmax (IE/dL) |
66.22 ± 15.80 |
72.75 ± 19.73 |
Nicht bestimmt |
Nicht bestimmt |
Nicht bestimmt |
|
MRT (h) |
30.82 ± 7.26 |
29.88 ± 4.16 |
30.62 ± 3.27 |
25.31 ± 1.83 |
27.85 ± 3.73 |
|
VSS (dL/kg) |
2.02 ± 0.77 |
1.79 ± 0.45 |
3.22±0.52 |
2.21±0.32 |
2.7±0.67 |
|
Clearance (dL/[kg·h]) |
0.0644 ± 0.0133 |
0.0602 ± 0.0146 |
0.1058±0.01650 |
0.0874±0.01213 |
0.0962±0.01689 |
Die inkrementelle Recovery 30 Minuten nach Injektion wurde für alle Teilnehmer beider ersten pharmakokinetischen Untersuchung (Expositionstag 1), an ihren Terminen in Woche 5, 13 und 26 sowie bei Studienbeendigung oder Abbruch, wenn abweichend vom Termin in Woche 26, ermittelt.
|
Inkrementelle |
Expositions-tag 1 |
Woche 5 |
Woche 13 |
Woche 26 |
Bei Studienabschluss/Beendigung |
|
Patienten ≥ 12 Jahre | |||||
|
N |
73 |
71 |
68 |
55 |
23 |
|
Mittelwert ± SD |
0.79±0.20 |
0.83±0.21 |
0.85±0.25 |
0.89±0.12 |
0.87±0.20 |
|
Pädiatrische Patienten < 6 Jahre | |||||
|
N |
10 |
11 |
10 |
10 |
10* |
|
Mittelwert ± SD |
0.59 ± 0.13 |
0.63 ± 0.10 |
0.68 ± 0.12 |
0.65 ± 0.13 |
0.65 ± 0.13 |
|
Pädiatrische Patienten 6 - < 12 Jahre | |||||
|
N |
12 |
12 |
11 |
11 |
11* |
|
Mittelwert ± SD |
0.73 ± 0.16 |
0.73 ± 0.13 |
0.73 ± 0.14 |
0.8 ± 0.14 |
0.8 ± 0.14 |
|
Alle pädiatrischen Patienten < 12 Jahre | |||||
|
N |
22 |
23 |
21 |
21 |
21* |
|
Mittelwert ± SD |
0.67 ± 0.16 |
0.68 ± 0.12 |
0.71 ± 0.13 |
0.72 ± 0.15 |
0.72 ± 0.15 |
*Woche 26 entspricht dem Studienabschluss/Beendigung
Präklinische Daten
RIXUBIS begünstigte bei einer Dosis von 750 IE/kg in einem Kaninchen-Stase-Modell (Wessler-Test) keine Thrombosen.
RIXUBIS verursachte bis zu einer Dosis von 450 IE/kg keine klinischen, respiratorische der kardiavaskuläre Nebenwirkungen bei Javaneraffen.
Es wurden keine Untersuchungen zur Kanzerogenität, zur Beeinträchtigung der Fertilität und zur fetalen Entwicklung durchgeführt.
RIXUBIS wurde in einer Einzel- und Mehrfach-Dosis Toxizitätsstudie, welche in Mäusen, Ratten und Cynomolgus Affen durchgeführt wurde bis zu 7500 E/kg (Einzeldosis) und 750 E/kg (Mehrfachdosis) gut vertragen.
Sonstige Hinweise
Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf der Verpackung angegebenen, mit “Exp.” gekennzeichneten Verfalldatum verwendet werden.
Das rekonstituierte Produkt muss sofort verwendet werden aber auf keinen Fall später als 3 Stunden nach der Rekonstitution. Nicht verwendete rekonstituierte Lösung ist zu verwerfen.
Chemische und physikalische Stabilität während des Gebrauchs wurden bei einer Temperatur bis zu 30 °C für 3 Stunden nachgewiesen.
Besondere Lagerungshinweise
·Nicht über 30 °C lagern.
·Nicht einfrieren.
Hinweise für die Handhabung
Vor Anwendung sind Parenteralia sofern es der Behälter erlaubt, auf Partikel und Farbveränderungen zu untersuchen.
Die Lösung sollte klar und farblos sein. Ist dies nicht der Fall, darf die Lösung nicht verwendet werden.
Vorbereitung und Rekonstitution
Die unten beschriebene Vorgehensweise stellt nur eine Richtlinie für die Vorbereitung und Rekonstitution von RIXUBIS dar. Waschen Sie sich vor den folgenden Schritten immer die Hände und arbeiten Sie auf sauberen Flächen. Achten Sie während der Rekonstitution auf aseptische Arbeitsweise.
1.Falls das Produkt im Kühlschrank gelagert wurde, bringen Sie die Durchstechflasche mit dem Faktor-Konzentrat, sowie die Glasflasche mit dem sterilen Wasser für Injektionszwecke auf Raumtemperatur.
2.Nehmen sie die Schutzkappen von den Durchstechflaschen für das Faktor-Konzentrat und das Lösungsmittel ab.
3.Säubern Sie die Stopfen mit einer keimtötenden Lösung und lassen sie diese vor dem Gebrauch trocknen. Stellen Sie die Durchstechflaschen auf eine glatte Fläche.
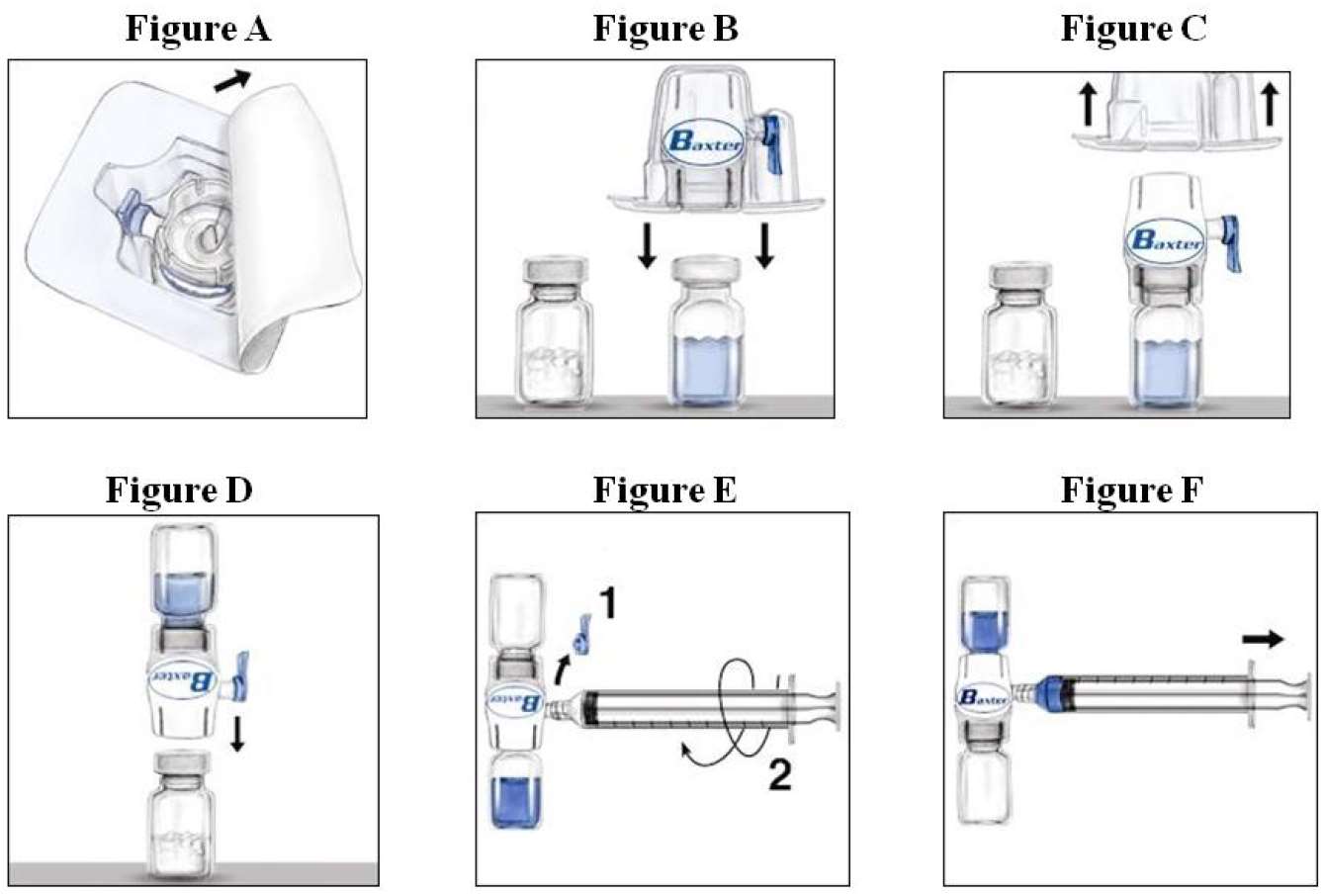
4. Öffnen Sie die Packung des BAXJECT II Gerätes durch Abziehen der Folie ohne dabei das Innere zu berühren (Fig. A). Nehmen Sie das Gerät nicht aus der Packung. Es ist zu beachten, dass der BAXJECT II nur für die Verwendung von einer einzigen Durchstechflasche RIXUBIS und sterilem Wasser für Injektionszwecke vorgesehen ist. Deshalb ist es nötig für eine weitere Rekonstitution und für ein weiteres Aufziehen der Spritze ein zweites BAXJECT II Gerät zu verwenden.
5.Drehen Sie die Packung um und drücken Sie nach unten um den klaren Plastikspike vollständig durch den Stopfen der Lösungsmittel-Durchstechflasche zu stechen (Fig. B).
6. Fassen Sie die Verpackung des BAXJECT II Gerätes an den Seiten und ziehen Sie sie vom Gerät herunter (Fig. C). Die blaue Kappe nicht vom BAXJECT II Gerät entfernen. Den freiliegenden weissen Plastikspike nicht berühren.
7.Drehen Sie das System so herum, dass die Lösungsmittel-Durchstechflasche nach oben zeigt. Den weissen Plastikspike schnell in den RIXUBIS-Durchstechflaschen-Stopfen drücken in dem man ihn direkt herunter drückt (Fig. D). Durch das Vakuum wird das Lösungsmittel in die RIXUBIS-Durchstechflasche gezogen.
8.Vorsichtig schütteln, bis RIXUBIS komplett gelöst ist. Nach Rekonstitution nicht einfrieren. Innerhalb von 3 Stunden nach Rekonstitution verwenden.
Verabreichung
1.Nehmen Sie die blaue Schutzkappe vom BAXJECT II Gerät herunter. Schliessen Sie die Spritze an das BAXJECT II Gerät an (Fig. E). Ziehen Sie keine Luft auf.
2.Drehen Sie das System einmal herum – die Faktor-Konzentrat-Glasfalsche ist nun oben. Überführen Sie nun das Faktor-Konzentrat in die Spritze indem sie den Kolben langsam zurückziehen (Fig. F).
3.Nehmen Sie die Spritze ab, setzen Sie eine passende Nadel auf und beginnen Sie mit der intravenösen Injektion. Wenn einem Patienten mehr als eine Durchstechflasche RIXUBIS injiziert werden muss, kann für diese Durchstechflaschen dieselbe Spritze verwendet werden.
4.Die maximale Injektionsrate beträgt 10 ml/min.
Zulassungsnummer
63123 (Swissmedic)
Packungen
Jede Packung von RIXUBIS enthält eine Durchstechflasche mit Lyophyllisat, 1 Durchstechflasche mit sterilem Wasser für Injektionszwecke und ein BAXJECT II Gerät.
RIXUBIS 250 (B)
Lyophilisat mit 250 IE rekombinantem Gerinnungsfaktor IX (Nonacog gamma) und 5 ml sterilem Wasser für Injektionszwecke.
RIXUBIS 500 (B)
Lyophilisat mit 500 IE rekombinantem Gerinnungsfaktor IX (Nonacog gamma) und 5 ml sterilem Wasser für Injektionszwecke.
RIXUBIS 1000 (B)
Lyophilisat mit 1000 IE rekombinantem Gerinnungsfaktor IX (Nonacog gamma) und 5 ml sterilem Wasser für Injektionszwecke.
RIXUBIS 2000 (B)
Lyophilisat mit 2000 IE rekombinantem Gerinnungsfaktor IX (Nonacog gamma) und 5 ml sterilem Wasser für Injektionszwecke.
RIXUBIS 3000 (B)
Lyophilisat mit 3000 IE rekombinantem Gerinnungsfaktor IX (Nonacog gamma) und 5 ml sterilem Wasser für Injektionszwecke.
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
Oktober 2016