Zusammensetzung
Wirkstoffe:
Insulin Degludec 100 Einheiten/ml* und Liraglutide 3.6 mg/ml* (* gentechnisch hergestellt aus rekombinanter DNA in Saccharomyces cerevisiae).
Hilfsstoffe:
Phenol, Glycerol, Zinkacetat-Dihydrat, Salzsäure, Natriumhydroxid (enthält maximal 0.0416 mmol/ml Natrium), Wasser für Injektionszwecke.
Indikationen/Anwendungsmöglichkeiten
Xultophy wird in Kombination mit blutzuckersenkenden Arzneimitteln zur Behandlung von Erwachsenen mit unzureichend kontrolliertem Typ 2 Diabetes mellitus ergänzend zu Diät und Bewegung angewendet (Für Studienergebnisse zu den in klinischen Studien untersuchten Kombinationen sowie die Effekte auf kardiovaskuläre Ereignisse siehe «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
Xultophy ist eine Kombination von Insulin Degludec und Liraglutide zur einmal täglichen subkutanen Verabreichung in einer Injektion. Xultophy wird einmal täglich verabreicht, möglichst immer zur gleichen Tageszeit.
Xultophy wird gemäss dem individuellen Bedarf des Patienten dosiert. Um die Blutzuckereinstellung zu optimieren, wird empfohlen, die Dosierung anhand des Nüchternblutzuckers anzupassen.
Wie bei allen Insulinpräparaten kann eine Dosisanpassung bei erhöhter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder Begleiterkrankungen notwendig sein.
Patienten, die eine Dosis vergessen haben, werden angewiesen, sich diese zu verabreichen, sobald sie es bemerken und anschliessend zu ihrem gewohnten einmal täglichen Dosierungsschema zurückzukehren. Ein Minimum von 8 Stunden zwischen den Injektionen muss jedoch immer eingehalten werden. Dies gilt auch, wenn der übliche Zeitpunkt der Injektion nicht möglich ist.
Die Dosiereinheit von Xultophy wird in Dosisschritten angegeben. Ein Dosisschritt enthält 1 Einheit Insulin Degludec und 0.036 mg Liraglutide. Der Fertigpen kann von 1 bis zu 50 Dosisschritte in einer Injektion, in 1er Dosisschritten, abgeben. Die maximale Tagesdosis von Xultophy beträgt 50 Dosisschritte (50 Einheiten Insulin Degludec/1.8 mg Liraglutide). Die Dosisanzeige auf dem Pen zeigt die Anzahl Dosisschritte an.
Hinzugabe zu oralen blutzuckersenkenden Arzneimitteln
Die empfohlene tägliche Anfangsdosis von Xultophy beträgt 10 Dosisschritte (10 Einheiten Insulin Degludec/0.36 mg Liraglutide).
Xultophy kann zu einer bereits bestehenden Behandlung mit Metformin oder mit Metformin plus einem Sulfonylharnstoff verabreicht werden. Wenn Xultophy zu einer Behandlung mit Sulfonylharnstoff verabreicht wird, sollte eine Reduktion der Dosierung des Sulfonylharnstoffs berücksichtigt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Umstellung von einem GLP-1-Rezeptoragonisten
Vor Beginn einer Xultophy-Behandlung sollte der GLP-1-Rezeptoragonist abgesetzt werden. Bei der Umstellung von einem GLP-1-Rezeptoragonist ist die empfohlene Anfangsdosis von Xultophy 16 Dosisschritte (16 Einheiten Insulin Degludec/0.6 mg Liraglutide) (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»). Die empfohlene Anfangsdosis sollte nicht überschritten werden. Bei Umstellung von einem langwirksamen GLP-1-Rezeptor-Agonisten (z. B. mit einmal wöchentlicher Gabe) sollte die verlängerte Wirkung berücksichtigt werden. Die Behandlung mit Xultophy sollte zu dem Zeitpunkt, zu dem die nächste Dosis des langwirksamen GLP-1-Rezeptor-Agonisten angewendet werden würde, begonnen werden. Eine engmaschige Überwachung des Blutzuckerspiegels während der Umstellung und in den darauffolgenden Wochen wird empfohlen.
Umstellung von jeglichem Insulinregime, das eine Basalinsulin-Komponente enthält
Eine Therapie mit einem anderen Insulinregime muss vor Aufnahme einer Xultophy Therapie abgesetzt werden. Bei der Umstellung von jeglichem anderen Insulinregime, das eine Basalinsulin-Komponente enthält, beträgt die empfohlene anfängliche Dosis von Xultophy 16 Dosisschritte (16 Einheiten Insulin Degludec und 0.6 mg Liraglutide) (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»). Die empfohlene Anfangsdosis sollte nicht überschritten werden. Eine engmaschige Überwachung des Blutzuckerspiegels während der Umstellung und in den darauffolgenden Wochen wird empfohlen.
Falls die benötigte Dosis zur Vermeidung von Hypoglykämien unter 16 Dosisschritte abgesenkt werden muss, sollte die Indikation für die kombinierte Behandlung überprüft werden.
Spezielle Dosierungsanweisungen
Ältere Patienten (≥65 Jahre alt)
Xultophy kann bei älteren Patienten angewendet werden. Die Blutzuckerkontrolle muss intensiviert und die Insulindosis individuell angepasst werden (siehe unter «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Anwendung von Xultophy bei Patienten mit milder, mittelschwerer oder schwerer Nierenfunktionsstörung muss die Blutzuckerkontrolle intensiviert und die Insulindosis individuell angepasst werden. Die Anwendung von Xultophy bei Patienten mit einer Nierenfunktionsstörung im Endstadium, kann nicht empfohlen werden (siehe unter «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Bei Anwendung von Xultophy bei Patienten mit Leberfunktionsstörungen muss die Blutzuckerkontrolle intensiviert und die Insulindosis individuell angepasst werden (siehe unter «Pharmakokinetik»).
Kinder und Jugendliche
Die Anwendung von Xultophy bei Kindern und Jugendlichen unter 18 Jahren wird nicht empfohlen. Es wurden keine Studien mit Patienten unter 18 Jahren durchgeführt.
Art der Anwendung
Xultophy ist ausschliesslich zur subkutanen Anwendung bestimmt. Xultophy darf nicht intravenös oder intramuskulär verabreicht werden.
Xultophy wird subkutan in den Oberschenkel, den Oberarm oder die Bauchdecke injiziert. Die Einstichstelle ist bei jeder Injektion innerhalb derselben Körperregion zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Für weitere Hinweise zur Handhabung siehe unter «Hinweise für die Handhabung» in «Sonstige Hinweise».
Kontraindikationen
Überempfindlichkeit gegenüber einem oder beiden Wirkstoffen oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Xultophy sollte nicht bei Patienten mit Typ 1 Diabetes mellitus oder zur Behandlung von diabetischer Ketoazidose angewendet werden.
Hypoglykämie
Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies kann die Aufmerksamkeit und insbesondere die Sicherheit beim Autofahren oder beim Bedienen von Maschinen beeinträchtigen. Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen, unter anderem auch zu Hypoglykämien kommen kann. Es muss darauf aufmerksam gemacht werden, dass eine Alkoholeinnahme diese Gefährdung zusätzlich erhöht (Hemmung der hepatischen Glukoneogenese). Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen. Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o. ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis bei sich haben.
Eine Hypoglykämie kann auftreten, wenn die Dosis von Xultophy höher als erforderlich ist. Das Weglassen einer Mahlzeit oder eine nicht geplante, anstrengende körperliche Aktivität können zu einer Hypoglykämie führen.
Bei einer Kombination mit Sulfonylharnstoffen kann das Hypoglykämierisiko durch eine Dosisreduktion des Sulfonylharnstoffs vermindert werden.
Begleiterkrankungen der Nieren, der Leber oder Krankheiten, die die Nebennieren, die Hypophyse oder die Schilddrüse in Mitleidenschaft ziehen, können Veränderungen der Xultophy Dosis erforderlich machen.
Patienten mit deutlich gebesserter Stoffwechsellage (z. B. aufgrund einer intensivierten Insulintherapie) können unter Umständen eine Veränderung der Hypoglykämie-Warnsymptome erfahren und sind entsprechend zu beraten. Bei schon lange von Diabetes betroffenen Patienten verschwinden möglicherweise die üblichen Warnsymptome.
Wie bei allen Basalinsulinen kann die verlängerte Wirkung von Xultophy die Erholung von einer Hypoglykämie verzögern.
β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen, bzw. maskieren. Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken. (Andere illegale Substanzen wurden nicht getestet; andere Interaktionen siehe «Interaktionen»).
Hyperglykämie
Eine nicht ausreichende Dosierung und/oder Unterbrechung der antidiabetischen Behandlung kann zu Hyperglykämie und möglicherweise zu hyperosmolarem Koma führen. Für den Fall, dass Xultophy abgesetzt wird sollte sichergestellt werden, dass Instruktionen für eine alternative antidiabetische Medikation erfolgen. Darüber hinaus können auch Begleiterkrankungen, insbesondere Infektionen zu Hyperglykämie führen und dadurch den Bedarf der antidiabetischen Behandlung erhöhen.
Die ersten Symptome einer Hyperglykämie entwickeln sich gewöhnlich langsam über Stunden bzw. Tage. Dazu gehören Durst, grosse Urinmengen, Übelkeit, Erbrechen, Müdigkeit, gerötete trockene Haut, Mundtrockenheit, Appetitlosigkeit sowie nach Aceton riechender Atem. Der Patient soll angewiesen werden, bei den ersten Anzeichen einer Überzuckerung sofort den Arzt aufzusuchen.
Bei schweren Hyperglykämien soll die Verabreichung von schnell wirkenden Insulinen in Betracht gezogen werden.
Unbehandelte hyperglykämische Reaktionen können zu hyperosmolarem Koma/diabetische Ketoazidose führen, die tödlich sein können.
Erkrankungen der Haut und des Unterhautzellgewebes
Patienten müssen angewiesen werden, die Injektionsstelle regelmässig zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren. Es besteht das potenzielle Risiko einer verzögerten Insulinresorption und einer schlechteren Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Bei einem plötzlichen Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich wurde darüber berichtet, dass dies zu Hypoglykämie führte. Nach einem Wechsel der Injektionsstelle von einem betroffenen zu einem nicht betroffenen Bereich wird eine Überwachung des Blutzuckers empfohlen und eine Dosisanpassung der Antidiabetika kann in Erwägung gezogen werden.
Kombination von Pioglitazon und Arzneimittel mit Insulin
Im Zusammenhang mit der Kombination von Pioglitazon und Arzneimitteln mit Insulin sind Fälle von Herzinsuffizienz berichtet worden, insbesondere bei Patienten mit Risikofaktoren für die Entwicklung einer Herzinsuffizienz. Dies sollte im Auge behalten werden, wenn eine kombinierte Behandlung mit Pioglitazon und Xultophy erwogen wird. Wenn eine kombinierte Behandlung angewendet wird, sollten die Patienten auf Anzeichen und Symptome von Herzinsuffizienz, Gewichtszunahme und Ödemen kontrolliert werden. Pioglitazon ist abzusetzen, wenn Anzeichen für eine Verschlechterung der Herzfunktion auftreten.
Augenerkrankungen
Die Intensivierung einer Therapie mit Insulin, ein Bestandteil von Xultophy, mit einer abrupten Verbesserung der Blutzuckereinstellung, kann zu einer vorübergehenden Verschlechterung einer diabetischen Retinopathie führen, während eine langfristig verbesserte Blutzuckereinstellung das Risiko der Progression einer diabetischen Retinopathie vermindert.
Antikörper
Die Verabreichung von Xultophy kann die Bildung von Antikörpern gegen Insulin Degludec und/oder Liraglutide verursachen. In seltenen Fällen kann das Vorhandensein solcher Antikörper eine Anpassung der Dosierung von Xultophy notwendig machen, um die Tendenz für Hyper- oder Hypoglykämien zu korrigieren. Sehr wenige Patienten entwickelten Insulin Degludec spezifische Antikörper, kreuzreagierende Antikörper gegen Humaninsulin oder Antikörper gegen Liraglutide bei der Behandlung mit Xultophy. Die Antikörperbildung war nicht mit einer reduzierten Wirksamkeit von Xultophy assoziiert.
Pankreatitis
Akute Pankreatitis wurde unter der Anwendung von GLP-1-Rezeptor Agonisten beobachtet. Patienten sollten über die charakteristischen Symptome einer akuten Pankreatitis informiert werden. Wird eine Pankreatitis vermutet, ist Xultophy abzusetzen; falls eine akute Pankreatitis bestätigt wird, ist die Behandlung mit Xultophy nicht wiederaufzunehmen. Eine isolierte Erhöhung der Pankreasenzyme unter der Behandlung mit Xultophy (ohne charakteristische Symptomatik) manifestiert nicht zwingend eine akute Pankreatitis (siehe «Unerwünschte Wirkungen»).
Schilddrüsenerkrankungen
In klinischen Studien mit GLP-1-Rezeptoragonisten, einschliesslich Liraglutide, wurde über unerwünschte Ereignisse in Zusammenhang mit der Schilddrüse (z. B. Struma) berichtet, insbesondere bei Patienten mit vorbestehender Schilddrüsenerkrankung. Xultophy sollte bei diesen Patienten deshalb mit Vorsicht eingesetzt werden.
Aspiration im Zusammenhang mit einer Vollnarkose oder tiefer Sedierung
Bei Patienten, die GLP-1-Rezeptor-Agonisten erhielten und die sich einer Vollnarkose oder einer tiefen Sedierung unterzogen, wurden Fälle von pulmonaler Aspiration berichtet, trotz der berichteten Einhaltung der präoperativen Nüchternempfehlungen. Daher sollte vor der Durchführung von Eingriffen unter Vollnarkose oder tiefer Sedierung das erhöhte Risiko für Restmageninhalt aufgrund einer verzögerten Magenentleerung berücksichtigt werden.
Entzündliche Darmerkrankung und diabetische Gastroparese
Es besteht keine Erfahrung von Xultophy bei Patienten mit entzündlicher Darmerkrankung und diabetischer Gastroparese. Aus diesem Grund kann die Anwendung von Xultophy bei diesen Patienten nicht empfohlen werden.
Dehydrierung
Anzeichen und Symptome einer Dehydrierung, einschliesslich Nierenfunktionsstörung und akutes Nierenversagen, wurden in klinischen Studien mit GLP-1-Rezeptoragonisten, einschliesslich Liraglutide, einem Bestandteil von Xultophy, berichtet. Patienten, welche mit Xultophy behandelt werden, sollten auf das Risiko einer Dehydrierung aufgrund von gastrointestinalen Nebenwirkungen hingewiesen werden und Vorsichtsmassnahmen treffen, um eine Austrocknung zu vermeiden.
Verhindern von Medikationsfehlern
Der Patient muss instruiert werden, vor jeder Injektion die Etikette des Pens zu überprüfen, um die versehentliche Verwechslung von Xultophy mit einem anderen Diabetesmedikament zur Injektion zu verhindern.
Nicht untersuchte Patientengruppen
Die Umstellung von einer Basalinsulin-Dosis <20 und >50 Einheiten auf Xultophy wurde nicht untersucht.
Bei Patienten mit Herzinsuffizienz der New York Heart Association (NYHA) Stadien I–II liegen nur begrenzte Erfahrungen vor und Xultophy sollte deshalb bei diesen Patienten mit Vorsicht eingesetzt werden. Es gibt keine klinischen Erfahrungen bei Patienten mit Herzinsuffizienz des NYHA (New York Heart Association) Stadiums IV, daher wird die Anwendung von Xultophy bei diesen Patienten nicht empfohlen.
Sonstige Bestandteile
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pharmakodynamische Interaktionen
Es wurden keine Interaktionsstudien mit Xultophy durchgeführt.
Der Glukosestoffwechsel wird von einigen Arzneimitteln beeinflusst.
1. Der Bedarf an Xultophy kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme/Anwendung von:
oralen Antidiabetika; ACE-Hemmern (z. B. Captopril und Enalapril); antiarrhythmischen Substanzen wie Disopyramid; α-Blockern und Clonidin; SSRI; Fenfluramine; MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie; gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z. B. Cotrimoxazol); Cimetidin und Ranitidin.
2. Der Bedarf an Xultophy kann erhöht sein bei gleichzeitiger Einnahme/Anwendung der folgenden Substanzen bzw. Substanzgruppen:
Orale Kontrazeptiva und andere Oestrogen- oder Progestagen-Präparate, Korticosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und -derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z. B. Thiazid-Diuretika, Indapamid und Furosemid); anti-retrovirale Substanzen; Immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus), atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Wirkung von Xultophy je nach Dosis verstärkt bzw. abgeschwächt werden:
Lanreotid, Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten)
β-Blocker können zu einer Verstärkung der Insulinresistenz aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Alkohol kann die blutzuckersenkende Wirkung von Xultophy verstärken oder vermindern.
Pharmakokinetische Interaktionen
In-vitro-Beurteilung von Arzneimittel-Wechselwirkungen mit Insulin Degludec
Die Bindung von Insulin Degludec an humanes Serumalbumin in therapeutischen/physiologisch relevanten Wirkstoffkonzentrationen wurde von den üblichen proteinbindenden Arzneimitteln, nicht beeinflusst.
In-vitro-Beurteilung von Arzneimittel-Wechselwirkungen mit Liraglutide
Das Potential von Liraglutide zur Beteiligung an pharmakokinetischen Wechselwirkungen mit anderen Wirkstoffen, die mit Cytochrom P450 (CYP) und der Bindung an Plasmaproteine in Zusammenhang stehen, hat sich als sehr gering erwiesen.
In-vivo-Beurteilung von Arzneimittel-Wechselwirkungen mit Liraglutide
Die durch Liraglutide verursachte geringe Verzögerung der Magenentleerung könnte die Absorption von gleichzeitig oral verabreichten Arzneimitteln beeinflussen. Interaktionsstudien zeigten keine klinisch relevante Verzögerung der Absorption.
Einige Patienten erleiden unter Liraglutide-Behandlung schwere Durchfälle. Diarrhö kann die Resorption gleichzeitig oral gegebener Arzneimittel beeinträchtigen
Antikoagulantien
Es wurden keine Interaktionsstudien durchgeführt. Eine klinisch relevante Interaktion mit Wirkstoffen, welche eine geringe Löslichkeit oder einen engen therapeutischen Index haben, wie zum Beispiel Warfarin, kann nicht ausgeschlossen werden. Bei Patienten, welche Antikoagulantien anwenden, wird bei Initiierung einer Xultophy-Behandlung eine häufigere Überwachung des INR (International Normalised Ratio) empfohlen.
Paracetamol
Nach einer Einzeldosis von 1000 mg Paracetamol führte Liraglutide zu keiner Änderung der Gesamtexposition von Paracetamol. Die Cmax von Paracetamol war um 31% verringert und die mittlere tmax um 15 Minuten verzögert. Bei gleichzeitiger Anwendung von Paracetamol ist keine Dosisanpassung erforderlich.
Atorvastatin
Nach Verabreichung einer Einzeldosis von 40 mg Atorvastatin führte Liraglutide zu keiner klinisch relevanten Änderung der Gesamtexposition von Atorvastatin. Es ist deshalb keine Dosisanpassung von Atorvastatin erforderlich, wenn es zusammen mit Liraglutide verabreicht wird. Mit Liraglutide war die Cmax von Atorvastatin um 38% verringert und die mittlere tmax um 1 bis 3 Stunden verzögert.
Griseofulvin
Nach Verabreichung einer Einzeldosis von 500 mg Griseofulvin führte Liraglutide zu keiner Änderung der Gesamtexposition von Griseofulvin. Die Cmax von Griseofulvin erhöhte sich um 37%, während die mittlere tmax unverändert blieb. Dosisanpassungen von Griseofulvin und anderen Präparaten mit geringer Löslichkeit und hoher Permeabilität sind nicht erforderlich.
Digoxin
Die Verabreichung von Liraglutide zusammen mit einer Einzeldosis von 1 mg Digoxin führte zu einer Verringerung der AUC von Digoxin um 16%. Die Cmax von Digoxin nahm um 31% ab und die mittlere tmax war um 1–1.5 Stunden verzögert. Ausgehend von diesen Ergebnissen ist keine Dosisanpassung von Digoxin erforderlich.
Lisinopril
Die Verabreichung von Liraglutide zusammen mit einer Einzeldosis von 20 mg Lisinopril führte zu einer Verringerung der AUC von Lisinopril um 15%. Die Cmax von Lisinopril nahm um 27% ab und die mittlere tmax war um 6–8 Stunden verzögert. Ausgehend von diesen Ergebnissen ist keine Dosisanpassung von Lisinopril erforderlich.
Orale Kontrazeptiva
Nach Verabreichung einer Einzeldosis eines oralen Kontrazeptivums senkte Liraglutide die Cmax von Ethinylestradiol und Levonorgestrel um 12 bzw. 13%. Die tmax war bei beiden Wirkstoffen um 1.5 Stunden verzögert. Es gab keine klinisch relevante Auswirkung auf die Gesamtexposition von Ethinylestradiol oder Levonorgestrel. Folglich ist zu erwarten, dass die kontrazeptive Wirkung bei gleichzeitiger Gabe von Liraglutide nicht beeinträchtigt wird.
Schwangerschaft, Stillzeit
Schwangerschaft
Es liegen keine klinischen Erfahrungen mit Xultophy, Insulin Degludec oder Liraglutide bei schwangeren Frauen vor. Xultophy sollte bei Frauen, die schwanger werden möchten oder schwanger geworden sind, abgesetzt werden.
Fortpflanzungsstudien an Tieren haben keine Unterschiede zwischen Insulin Degludec und Humaninsulin hinsichtlich Embryotoxizität und Teratogenität gezeigt (siehe «Präklinische Daten»). In Tierstudien mit Liraglutide zeigte sich eine Reproduktionstoxizität (siehe «Präklinische Daten»). Das mögliche Risiko für den Menschen ist nicht bekannt.
Stillzeit
Es gibt keine klinische Erfahrung mit Xultophy bei stillenden Frauen. Es ist nicht bekannt, ob Insulin Degludec oder Liraglutide in die Muttermilch übertritt.
Bei Ratten wurde Insulin Degludec in der Muttermilch nachgewiesen, allerdings in niedrigerer Konzentration als im Plasma. Tierexperimentelle Studien haben gezeigt, dass der Übergang von Liraglutide und strukturell eng verwandten Metaboliten in die Muttermilch gering ist. Aufgrund mangelnder Erfahrung soll Xultophy während der Stillzeit nicht angewendet werden.
Fertilität
Es existieren keine klinischen Erfahrungen mit Xultophy in Bezug auf die Fertilität. Wünscht die Patientin schwanger zu werden, soll die Xultophy Behandlung abgebrochen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Die Konzentrations- und die Reaktionsfähigkeit des Patienten können als Folge einer Hypoglykämie beeinträchtigt sein. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Autofahren oder Bedienen von Maschinen), ein Risiko darstellen.
Die Patienten müssen angewiesen werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien während des Fahrens zu treffen. Dies ist besonders wichtig bei Patienten mit verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnzeichen oder häufigen Hypoglykämie-Episoden. In diesen Fällen sollte überlegt werden, ob das Führen eines Fahrzeuges ratsam ist.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils:
Xultophy wurde im klinischen Entwicklungsprogramm an ungefähr 1'900 Patienten getestet und zeigte keine erhöhte Häufung von spezifischen unerwünschten Wirkungen verglichen mit den zwei Einzelkomponenten Insulin Degludec und Liraglutide.
Die am häufigsten berichteten Nebenwirkungen während der Behandlung mit Xultophy waren Hypoglykämien und gastrointestinale unerwünschte Ereignisse (siehe «Beschreibung ausgewählter Nebenwirkungen»).
Tabellarische Auflistung der Nebenwirkungen
Die unten in Tabelle 1 aufgeführten Nebenwirkungen sind nach MedDRA-Organklassen und Häufigkeiten zusammengefasst. Die Häufigkeitsklassen sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000), nicht bekannt (Häufigkeit auf Grundlage der bekannten Daten nicht abschätzbar).
Tabelle 1: Unerwünschte Wirkungen in den kontrollieren Phase 3 Studien und aus Postmarketing Berichten
|
Systemorganklassen gemäss MedDRA |
Häufigkeit |
Unerwünschte Wirkung |
|
Erkrankungen des Immunsystems |
Gelegentlich |
Urtikaria |
|
Gelegentlich |
Hypersensitivität | |
|
Selten* |
Anaphylaktische Reaktion | |
|
Selten* |
Angioödeme | |
|
Stoffwechsel- und Ernährungsstörungen |
Sehr häufig |
Hypoglykämie |
|
Häufig |
Appetitverlust | |
|
Gelegentlich |
Dehydrierung | |
|
Erkrankungen des Nervensystems |
Häufig |
Schwindelgefühl† |
|
Gelegentlich |
Dysgeusie | |
|
Erkrankungen des Gastrointestinaltrakts |
Häufig |
Übelkeit, Durchfall, Erbrechen, Obstipation, Dyspepsie, Gastritis, Bauchschmerzen, gastroösophaler Reflux |
|
Gelegentlich |
Ruktus, Flatulenz | |
|
Sehr selten* |
Pankreatitis (inkl. nekrotisierende Pankreatitis) | |
|
Nicht bekannt |
Verzögerte Magenentleerung† | |
|
Affektionen der Leber und Gallenblase |
Gelegentlich |
Cholelithiasis |
|
Nicht bekannt |
Anstiege von Leberenzymkonzentrationen†, Hyperbilirubinämie†, Cholestase†, Hepatitis† | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Gelegentlich |
Hautausschlag, Pruritus, erworbene Lipodystrophie |
|
Nicht bekannt |
Kutane Amyloidose† | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Reaktionen an der Injektionsstelle |
|
Einzelfälle |
Periphere Ödeme | |
|
Untersuchungen |
Häufig |
Erhöhte Lipase |
|
Häufig |
Erhöhte Amylase | |
|
Gelegentlich |
Erhöhte Herzfrequenz |
* Häufigkeit basierend auf den kontrollierten Phase-3a-Langzeitstudien mit Victoza, da keine Meldungen aus kontrollierten Phase-3-Studien mit Xultophy vorliegen
† Arzneimittelnebenwirkung aus Meldungen nach Markteinführung
a Die zusammengefasste Bezeichnung umfasst die unerwünschten Ereignisse Darmobstruktion, Ileus und Dünndarmobstruktion
Beschreibung ausgewählter Nebenwirkungen
Hypoglykämie
Eine Hypoglykämie kann auftreten, wenn die Xultophy Dosis höher als notwendig ist. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und zu vorübergehenden oder dauerhaften Störungen der Gehirnfunktion und sogar zum Tod führen. Die Symptome einer Hypoglykämie treten gewöhnlich plötzlich auf. Sie können beinhalten: kalter Schweiss, kalte blasse Haut, Erschöpfung, Nervosität oder Zittern, Angstgefühle, ungewöhnliche Müdigkeit oder Schwäche, Verwirrung, Konzentrationsschwierigkeiten, Benommenheit, grosser Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Herzklopfen.
Allergische Reaktionen
Allergische Reaktionen (die sich mit Anzeichen und Symptomen wie Urtikaria, Hautausschlag, Pruritus und/oder Schwellung des Gesichts manifestieren) wurden für Insulin Degludec und Liraglutide, den zwei Komponenten von Xultophy, berichtet.
Nur wenige Fälle von anaphylaktischen Reaktionen mit zusätzlichen Symptomen wie Blutdruckabfall, Palpitationen, Atemnot und Ödeme wurden nach der Markteinführung von Liraglutide gemeldet. Anaphylaktische Reaktionen können potentiell lebensbedrohlich sein.
Erkrankungen des Gastrointestinaltrakts
Gastrointestinale Nebenwirkungen wie Übelkeit, Durchfall, Erbrechen, Verstopfung, Dyspepsie, Gastritis, Bauchschmerzen, Ruktus, Flatulenz, Reflux, Blähungen und Appetitlosigkeit wurden bei mit Xultophy behandelten Patienten berichtet. Diese gastrointestinalen Nebenwirkungen können zu Beginn einer Xultophy-Therapie häufiger auftreten und verringern sich in der Regel innerhalb von wenigen Tagen oder Wochen bei fortgesetzter Behandlung.
Lipodystrophie
Lipodystrophie (einschliesslich Lipohypertrophie, Lipoatrophy) können an der Injektionsstelle auftreten. Ein ständiger Wechsel der Einstichstelle innerhalb der Injektionsregion kann helfen, das Risiko der Entwicklung dieser Reaktionen zu reduzieren.
Reaktionen an der Injektionsstelle
Bei Patienten, die mit Xultophy behandelt wurden, wurde über Reaktionen an der Injektionsstelle (einschliesslich Hämatome an der Injektionsstelle, Schmerzen, Blutungen, Rötungen, Knötchen, Schwellungen, Verfärbungen, Juckreiz und Wärme) berichtet. Diese Reaktionen sind in der Regel leicht und vorübergehend und verschwinden normalerweise im Laufe der Behandlung.
Erkrankungen der Haut und des Unterhautzellgewebes
Lipodystrophie (einschliesslich Lipohypertrophie, Lipoatrophie) und kutane Amyloidose können an der Injektionsstelle auftreten und die lokale Insulinresorption verzögern. Ein regelmässiges Wechseln der Injektionsstelle innerhalb des jeweiligen Injektionsbereichs kann helfen, diese Reaktionen zu reduzieren oder zu verhindern (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erhöhte Herzfrequenz
In klinischen Studien mit Xultophy wurde analog zu klinischen Studien mit seinem Bestandteil Liraglutide eine mittlere Erhöhung der Herzfrequenz von 2 bis 3 Schlägen pro Minute vom Ausgangswert wurde beobachtet. Eine gross angelegte Studie der kardiovaskulären Sicherheit (LEADER Studie) zeigte, dass der Liraglutide-vermittelte Anstieg der Herzfrequenz das Risiko kardiovaskulärer Ereignisse nicht erhöht.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es sind nur limitierte Daten einer Überdosierung mit Xultophy verfügbar.
Eine Hypoglykämie kann sich entwickeln, wenn die Dosis von Xultophy höher als der Bedarf ist.
·Milde Hypoglykämien können durch die orale Gabe von Glukose oder zuckerhaltigen Lebensmitteln behandelt werden. Es wird daher empfohlen, dass der Patient stets glukosehaltige Produkte auf sich trägt.
·Schwere Hypoglykämien, bei denen der Patient nicht in der Lage ist, sich selbst zu behandeln, können mit von einer geschulten Person intramuskulär, subkutan oder intranasal verabreichtem Glukagon oder mit von medizinischem Fachpersonal intravenös verabreichter Glukose behandelt werden. Wenn der Patient nicht innerhalb von 10 bis 15 Minuten auf Glukagon anspricht, ist Glukose intravenös zu verabreichen. Sobald der Patient wieder bei Bewusstsein ist, wird die orale Gabe von Kohlenhydraten empfohlen, um einen Rückfall zu verhindern.
Eigenschaften/Wirkungen
ATC-Code
A10AE56
Wirkungsmechanismus
Xultophy ist ein Kombinationspräparat bestehend aus Insulin Degludec und Liraglutide, mit einem sich ergänzenden Wirkmechanismus zur Verbesserung des Blutzuckerspiegels.
Insulin Degludec ist ein Basalinsulin, das nach subkutaner Injektion lösliche Multihexamere bildet, die ein Depot bilden, aus dem kontinuierlich und langsam Insulin Degludec in den Blutkreislauf abgegeben wird. Dies führt zu einer flachen und stabilen blutzuckersenkenden Wirkung von Insulin Degludec mit einer niedrigen Tag-zu-Tag Variabilität der Insulinwirkung.
Insulin Degludec bindet spezifisch an den Humaninsulin-Rezeptor und hat die gleiche pharmakologische Wirkung wie Humaninsulin.
Die blutzuckersenkende Wirkung von Insulin Degludec beruht auf der verbesserten Aufnahme von Glukose nach der Bindung des Insulins an die Insulin-Rezeptoren auf Muskel- und Fettzellen und der gleichzeitigen Hemmung der Freisetzung von Glukose aus der Leber.
Liraglutide ist ein Glucagon-ähnliches Peptid 1 (GLP-1) mit einer Sequenzhomologie von 97% zu humanem GLP-1, das an den GLP-1-Rezeptor (GLP-1R) bindet und diesen aktiviert. Das verzögerte Wirkprofil nach subkutaner Applikation basiert auf drei Mechanismen: Selbstassoziation, was zu einer langsameren Resorption führt, Bindung an Albumin sowie höhere enzymatische Stabilität gegenüber den Enzymen Dipeptidylpeptidase 4 (DPP-4) und neutralen Endopeptidase (NEP), was zu einer langen Plasmahalbwertszeit führt.
Die Wirkung von Liraglutide wird durch eine spezifische Interaktion mit GLP-1-Rezeptoren vermittelt, die zu einem Anstieg der cAMP-Konzentration führt. Liraglutide stimuliert die Insulinsekretion glucoseabhängig. Gleichzeitig dämpft Liraglutide ebenfalls glucoseabhängig eine überhöhte Glucagonsekretion. Bei hohem Blutzuckerspiegel wird demnach die Insulinsekretion stimuliert und die Glucagonsekretion vermindert. Umgekehrt reduziert Liraglutide bei Hypoglykämie die Insulinsekretion und lässt die Glucagonsekretion unbeeinträchtigt. Der Mechanismus der Blutzuckersenkung beinhaltet ausserdem eine geringe Verzögerung der Magenentleerung. Liraglutide führt über Mechanismen, die eine Verminderung des Hungergefühls und der Energieaufnahme umfassen, zu einer Abnahme des Körpergewichts und der Körperfettmasse.
GLP-1 ist ein physiologischer Regulator von Appetit und Nahrungsaufnahme. GLP-1-Rezeptoren (GLP-1R) kommen in verschiedenen Hirnregionen vor, die an der Appetitregulation beteiligt sind. Tierexperimentelle Studien zeigten, dass Liraglutide nach peripherer Verabreichung in Hirnregionen aufgenommen wird, die an der Regulation des Appetits beteiligt sind, wie z.B. den Hypothalamus. Die Aktivierung von GLP-1-Rezeptoren in diesen Hirnarealen verstärkte die Sättigung, verringerte Hungersignale und induzierte letztlich eine Abnahme des Körpergewichts.
GLP-1-Rezeptoren kommen ebenfalls an spezifischen Orten des Herzens, des Gefässsystems, des Immunsystems und der Nieren vor. Human- und Tierstudien haben aufgezeigt, dass die Aktivierung dieser Rezeptoren mit Liraglutide kardiovaskuläre und mikrovaskuläre Wirkungen, einschliesslich verminderter Entzündung, vermitteln kann. In Tierstudien führte Liraglutide zur Hemmung der Entwicklung von Atherosklerose.
Weiterhin zeigten tierexperimentelle Studien, dass Liraglutide eine deutliche Reduktion der Aorten Plaque-Läsionen induzierte. Jedoch zeigte Liraglutide keine Hemmung auf die Weiterbildung von Aorten Plaque bzw. eine Wirkung auf vorhandene Plaques. Zusätzlich induzierte Liraglutide eine Abnahme der Entzündung in umliegenden Geweben und hatte eine positive Wirkung auf die Plasmalipide.
Pharmakodynamik
Die Wirkdauer von Insulin Degludec und Liraglutide erlaubt die einmal tägliche Verabreichung von Xultophy zeitlich unabhängig von Mahlzeiten.
Xultophy verbessert die Blutzuckerkontrolle durch die anhaltende Senkung des Nüchtern- und postprandialen Blutzuckerspiegels nach allen Mahlzeiten. Diese Effekte bewirken eine ganztägige Abdeckung des Blutzuckerspiegels, einschliesslich der postprandialen Blutzuckerspitzen.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Xultophy wurde in sechs randomisierten, kontrollierten, Parallelgruppenstudien der Phase 3 bei Erwachsenen mit Diabetes mellitus Typ 2 und verschiedener antihyperglykämischer Vorbehandlung untersucht. Vergleichstherapien waren Basalinsulin, Therapie mit GLP-1-Rezeptor-Agonisten, Placebo und eine Basal-Bolus-Therapie. Die Studiendauer betrug ≥26 Wochen, mit 199 bis 833 Patienten im Xultophy Arm. Xultophy wurde in allen Studien zweimal wöchentlich titriert (siehe Tabelle 2). Der gleiche Titrationsalgorithmus wurde im Basalinsulin-Vergleichsarm angewendet.
Tabelle 2: Titration von Xultophy
|
Plasmaglucose vor dem Frühstück* |
Dosisanpassung | |
|
mmol/l |
mg/dl |
Xultophy (Dosisschritte) |
|
<4,0 |
<72 |
-2 |
|
4,0–5,0 |
72–90 |
0 |
|
>5,0 |
>90 |
+2 |
* Selbstgemessene Plasmaglukose
Anwendung von Xultophy zusätzlich zu Metformin
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Degludec und Liraglutide, alle einmal täglich verabreicht, wurden in einer 26-wöchigen randomisierten, kontrollierten, offenen, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes, mit einer Verlängerung um 26 Wochen, untersucht. Die Anfangsdosis von Xultophy und Insulin Degludec betrug 10 Dosisschritte bzw. 10 Einheiten, wobei die Dosis zweimal wöchentlich gemäss obenstehender Tabelle 2 titriert wurde.
Patienten unter Liraglutide befolgten eine fixe Dosissteigerung mit einer Anfangsdosis von 0.6 mg und eine wöchentliche Dosissteigerung um 0.6 mg bis die Erhaltungsdosis von 1.8 mg erreicht war. Die Maximaldosis von Xultophy betrug 50 Dosisschritte, während für Insulin Degludec keine Maximaldosis festgelegt wurde. Ein Teil (140/833) der Patienten erhielt zusätzlich zu Xultophy und Metformin noch Pioglitazon.
Die wichtigsten Resultate der Studie sind aufgelistet in Tabelle 3 und Abbildung 1.
Tabelle 3: Resultate einer 26-wöchigen Studie mit Xultophy bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin alleine oder in Kombination mit Pioglitazon
|
|
Vorgängige Behandlung mit Met ± Pioglitazon | ||
|
Xultophy |
Insulin Degludec |
Liraglutide | |
|
N |
833 |
413 |
414 |
|
HbA1c (%) |
|
|
|
|
Ausgangswert → Studienende |
8.3 → 6.4 |
8.3 → 6.9 |
8.3 → 7.0 |
|
Durchschnittliche Veränderung |
-1.91 |
-1.44 |
-1.28 |
|
Geschätzte Differenz |
|
-0.47AB |
-0.64AB |
|
Anzahl bestätigter Hypoglykämien* pro Patientenjahr unter Exposition (prozentualer Anteil Patienten) |
1.80 (31.9%) |
2.57 (38.6%) |
0.22 (6.8%) |
|
Geschätzte Anzahl |
|
0.68AC |
7.61B |
|
Körpergewicht (kg) |
|
|
|
|
Ausgangswert → Studienende |
87.2 → 86.7 |
87.4 → 89.0 |
87.4 → 84.4 |
|
Durchschnittliche Veränderung |
-0.5 |
1.6 |
-3,0 |
|
Geschätzte Differenz |
|
-2.22AB |
2.44B |
|
Postprandiale Glukoseerhöhung (mmol/L) Mahlzeitentest (Durchschnitt über 4 Stunden) |
|
|
|
|
Ausgangswert → Studienende |
4.11 → 3.22 |
4.12 → 3.95 |
4.12 → 3.36 |
|
Durchschnittliche Veränderung |
-0.87 |
-0.17 |
-0.78 |
|
Geschätzte Differenz |
|
-0.71AC |
-0.09 |
|
Dosis am Studienende |
|
|
|
|
Insulin Degludec (Einheiten) |
38 |
53 |
- |
|
Liraglutide (mg) |
1.4 |
- |
1.8 |
|
Geschätzte Differenz, Insulin Degludec Dosis |
|
-14.90AB |
|
Ausgangswert, Studienende und durchschnittliche Veränderung wurden als «Last observation carried forward» (LOCF) beobachtet. Der 95% confidence interval ist angegeben in «[]».
* Bestätigte Hypoglykämie definiert als schwere Hypoglykämie (Episode, welche die Hilfe einer anderen Person erforderlich macht) und/oder schwache Hypoglykämien (Plasmaglukose <3,1 mmol/L, unabhängig von Symptomen).
** Mahlzeit-Test wurde in einer Teilstudie mit 260 Patienten durchgeführt, die unzureichend mit Metformin ± Pioglitazon kontrolliert wurden (131 Patienten wurden mit Xultophy, 64 mit Insulin Degludec und 65 mit Liraglutide behandelt).
A Endpunkte mit bestätigter Überlegenheit von Xultophy vs. Komparator
B p <0.0001
C p <0.05
Der Anteil bestätigter Hypoglykämien war unabhängig von der Blutzuckerkontrolle niedriger mit Xultophy als mit Insulin Degludec, siehe Abbildung 1.
Abb. 1a
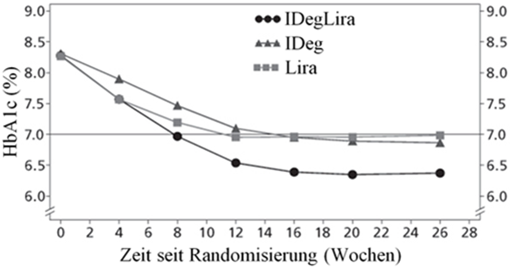
Abb. 1b
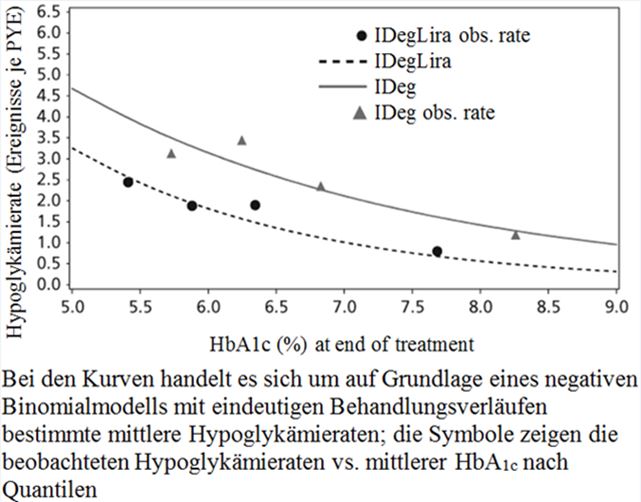
Abb. 1c
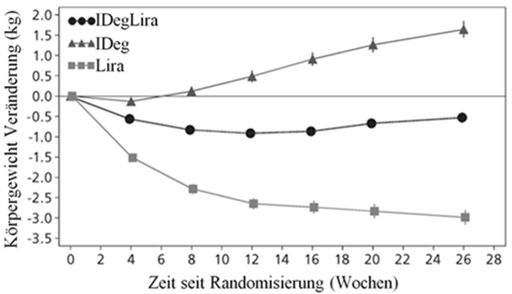
Abb. 1d
IDegLira = Xultophy, IDeg = Insulin Degludec, Lira = Liraglutide, obs. rate = beobachtete Rate, PYE = Patientenjahr Exposition.
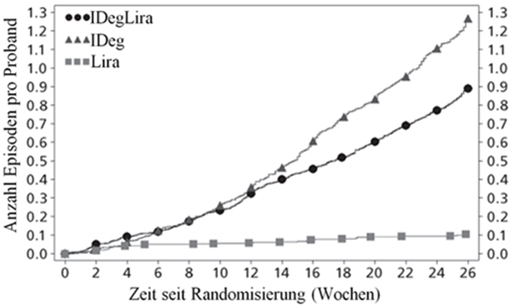
Abbildung 1 - Durchschnittliches HbA1c (%) nach Behandlungswochen (Abb. 1a), Anzahl bestätigte Hypoglykämien pro Patientenjahr Exposition gegenüber dem durchschnittlichen HbA1c (%) (Abb. 1b), durchschnittliche Veränderung des Körpergewichts nach Behandlungswochen (Abb. 1c) und die mittlere kumulative Anzahl an Hypoglykämie-Ereignissen nach Behandlungswochen (Abb. 1d).
Die Rate pro Patientenjahr unter Exposition (Prozent der Patienten) von schweren Hypoglykämien, definiert als Episode in welcher fremde Hilfe benötigt wurde, war 0.01 (2 Patienten von 825) für Xultophy, 0.01 (2 Patienten von 412) für Insulin Degludec und 0.00 (0 Patienten von 412) für Liraglutide. Die Rate der nächtlichen Hypoglykämien war ähnlich bei einer Behandlung mit Xultophy und Insulin Degludec trotz des niedrigeren HbA1c für Xultophy im Vergleich zu Insulin Degludec.
Patienten, die mit Xultophy behandelt wurden, hatten insgesamt weniger gastrointestinale Nebenwirkungen als Patienten unter einer Liraglutide-Behandlung, aber mehr als unter Insulin Degludec. Dies könnte durch eine langsamere Dosiserhöhung der Liraglutide Komponente während des Behandlungsbeginns mit Xultophy bedingt sein im Vergleich zu einer Therapie mit Liraglutide alleine.
Langzeit-Daten (52 Wochen)
Die Wirksamkeit und Sicherheit von Xultophy blieb bei einer Behandlung bis zu 52 Wochen aufrecht. Die Reduktion des HbA1c vom Ausgangswert bis nach 52 Wochen betrug mit Xultophy 1.84% mit einer geschätzten Behandlungsdifferenz von -0.65% [-0.76; -0.53]95%CI im Vergleich zu Liraglutide und -0.46% [-0.57; -0.34]95%CI im Vergleich zu Insulin Degludec. Das Körpergewicht wurde um 0.4 kg reduziert mit einem geschätzten Behandlungsunterschied zwischen Xultophy und Insulin Degludec von -2.80 kg. Die Rate der bestätigten Hypoglykämien betrug 1.8 Ereignissen pro Patientenjahr für Xultophy und 2.8 Ereignisse für Insulin Degludec mit einer geschätzten Behandlungsdifferenz von 0.63 [0.50; 0.79]95%CI.
Anwendung von Xultophy zusätzlich zu Sulfonylharnstoff alleine oder in Kombination mit Metformin
Die Wirksamkeit und Sicherheit von Xultophy bei Hinzugabe zu Sulfonylharnstoff alleine oder in Kombination mit Metformin wurden in einer 26-wöchigen randomisierten, Placebo-kontrollierten, doppelblinden, Treat-to-Target-Studie mit 435 Patienten untersucht, von denen 289 mit Xultophy behandelt wurden. 259/289 erhielten Xultophy plus Metformin plus Sulfonylharnstoffe, 30/289 Xultophy plus Sulfonylharnstoffe, ohne Metformin. Die Anfangsdosis von Xultophy betrug 10 Dosisschritte, und die Dosis wurde zweimal wöchentlich gemäss obenstehender Tabelle 2 mit einem Titrationsziel von 4-6 mmol/l titriert.
Die Reduktion des HbA1c-Ausgangswerts betrug -1.45% von 7.9% auf 6.4% mit Xultophy vs. einer Reduktion des HbA1c-Ausgangswerts um -0.46% von 7.9% auf 7.4% mit Placebo, mit einer geschätzten Behandlungsdifferenz von -1.02 [-1.18; -0.87] 95% CI (siehe Abbildung 2).
Abb. 2a
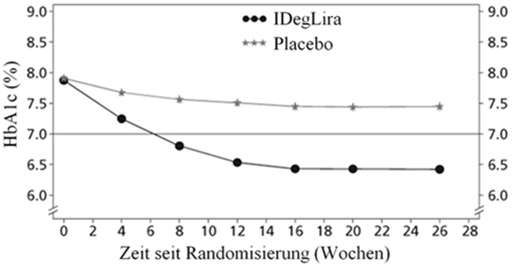
Abb. 2b
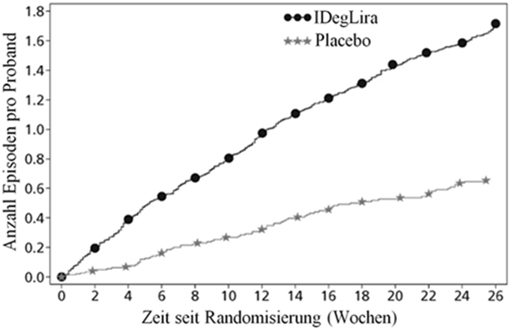
Abb. 2c
IDegLira = Xultophy
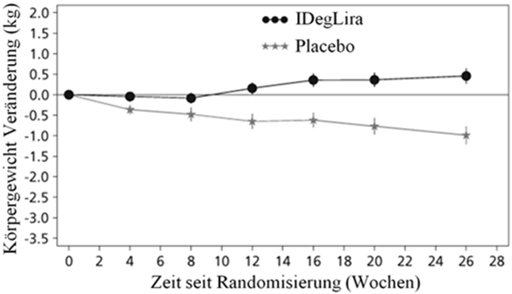
Abbildung 2 - Durchschnittliches HbA1c (%) nach Behandlungswochen (Abb. 2a), die mittlere kumulative Anzahl an Hypoglykämie-Ereignissen (Abb. 2b) und durchschnittliche Veränderung des Körpergewichts nach Behandlungswochen (Abb. 2c) bei Patienten mit unzureichender Blutzuckerkontrolle unter SU±Met.
41.7% der Patienten unter Xultophy und 17.1% der Patienten unter Placebo hatten mindestens einmal während der Studie eine bestätigte Hypoglykämie. Dies entspricht einer hochgerechneten Hypoglykämierate von 3.52 pro Patientenjahr unter Xultophy vs. 1.35 unter Placebo. Patienten, die mit Xultophy behandelt wurden, hatten eine mittlere Zunahme des Körpergewichts von 0.5 kg, während die Patienten der Placebogruppe einen mittleren Gewichtsverlust von 1.0 kg (geschätzter Behandlungsunterschied: 1.48; [0.90; 2.06]95%CI) hatten.
Die mittlere Dosis von Xultophy war am Ende der Studie bei 28 Dosisschritten entsprechend 28 Einheiten Insulin Degludec und 1.0 mg Liraglutide.
Zusatz zu SGLT2i allein oder in Kombination mit Metformin: Xultophy im Vergleich zu Insulin Glargin U100
In einer offenen Studie, in der die Wirksamkeit und die Sicherheit von Xultophy und Insulin Glargin U100 jeweils als Zusatz zu SGLT2i ± OAD verglichen wurden, war Xultophy Insulin Glargin überlegen hinsichtlich der Verminderung des durchschnittlichen HbA1c nach 26 Wochen. Unter Xultophy wurde eine Verminderung von 1.9% (von 8.2% auf 6.3%) und unter Insulin Glargin von 1.7% (von 8.4% auf 6.7%) erreicht, was einer geschätzten Behandlungsdifferenz von -0.36% [-0.50; -0.21] entspricht.
Unter Xultophy veränderte sich das durchschnittliche Körpergewicht im Vergleich zum Ausgangswert nicht, während es bei Patienten, die mit Insulin Glargin behandelt wurden, zu einer durchschnittlichen Gewichtszunahme von 2,0 kg kam (geschätzte Behandlungsdifferenz von -1.92 kg [95% KI: -2.64; -1.19]). In der Xultophy-Gruppe lag der Anteil der Patienten, bei denen es zu einer schweren oder mittels Blutzuckermessung bestätigten symptomatischen Hypoglykämie kam, bei 12.9% und in der Insulin Glargin-Gruppe bei 19.5% (geschätzte Behandlungsratio von 0.42 [95% KI: 0.23; 0.75]). Die durchschnittliche tägliche Insulindosis lag am Ende der Studie bei Patienten, die mit Xultophy behandelt wurden, bei 36 Einheiten und bei Patienten, die mit Insulin Glargin behandelt wurden, bei 54 Einheiten.
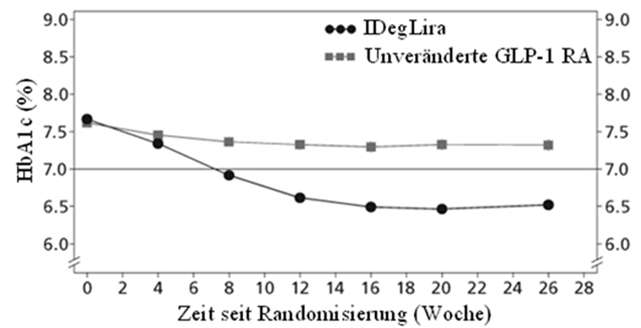
Umstellung von GLP-1-Rezeptoragonisten-Therapie auf Xultophy
Die Wirksamkeit und Sicherheit von Xultophy (einmal täglich) im Vergleich zu einer unveränderten GLP-1-Rezeptoragonisten-Therapie (Dosierung gemäss Label), wurden in einer 26-wöchigen randomisierten, open-label, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes mellitus untersucht, die unter einem GLP-1-Rezeptoragonisten und Metformin (Met) allein (74.2%) oder in Kombination mit Pioglitazon (2.5%), Sulfonylharnstoffen (21.2%) oder beiden eine unzureichende Blutzuckerkontrolle hatten.
Die Anfangsdosis von Xultophy und Insulin Degludec betrug 16 Dosisschritte (16 Einheiten Insulin Degludec und 0.6 mg Liraglutide) und die Dosis wurde zweimal wöchentlich gemäss Tabelle 2 titriert. Patienten im GLP-1-Rezeptoragonisten Arm führten ihre GLP-1-Rezeptoragonisten Behandlung analog fort wie vor der Studie.
Die Resultate der Studie sind, in Tabelle 4 und Abbildung 3 aufgeführt.
Tabelle 4: Resultate einer 26-wöchigen Studie mit Xultophy bei Patienten mit Typ 2 Diabetes mellitus mit unzureichender Blutzuckerkontrolle unter GLP-1-Rezeptoragonisten
|
|
Vorgängige Behandlung mit GLP-1-Rezeptoragonist | |
|
Xultophy |
GLP-1-Rezeptoragonist | |
|
N |
292 |
146 |
|
HbA1c (%) |
|
|
|
Ausgangswert → Studienende |
7.8→6.4 |
7.7→7.4 |
|
Durchschnittliche Veränderung |
-1.3 |
-0.3 |
|
Geschätzte Differenz |
|
-0.94AB |
|
Patienten (%) mit erreichtem HbA1c <7% |
|
|
|
Alle Patienten |
75.3 |
35.6 |
|
Geschätzte Odds-Ratio |
|
6.84B |
|
Patienten (%) mit erreichtem HbA1c <6.5% |
|
|
|
Alle Patienten |
63.0 |
22.6 |
|
Geschätzte Odds-Ratio |
|
7.53B |
|
Anzahl bestätigter Hypoglykämien* pro Patientenjahr unter Exposition (prozentualer Anteil Patienten) |
2.82 (32.0%) |
0.12 (2.8%) |
|
Geschätzte Anzahl |
|
25.36B |
|
Körpergewicht (kg) |
|
|
|
Ausgangswert → Studienende |
95.6 → 97.5 |
95.5 → 94.7 |
|
Durchschnittliche Veränderung |
2.0 |
-0.8 |
|
Geschätzte Differenz |
|
-2.89B |
|
FPG (mmol/l) |
|
|
|
Ausgangswert → Studienende |
9.0 → 6.0 |
9.4 → 8.8 |
|
Durchschnittliche Veränderung |
-2.98 |
-0.60 |
|
Geschätzte Differenz |
|
-2.64B |
|
Dosis am Studienende |
|
|
|
Insulin Degludec (Einheiten) |
43 |
Die Dosis des GLP-1-Rezeptoragonisten wurde unverändert vom Anfangswert weitergeführt |
|
Liraglutide (mg) |
1.6 | |
|
Geschätzte Differenz, Insulin Degludec Dosis |
| |
Ausgangswert, Studienende und durchschnittliche Veränderung wurden als «Last observation carried forward» (LOCF) beobachtet. Der 95% confidence interval ist angegeben in «[]».
* Bestätigte Hypoglykämie definiert als schwere Hypoglykämie (Episode, welche die Hilfe einer anderen Person erforderlich macht) und/oder schwache Hypoglykämien (Plasmaglukose <3,1 mmol/l, unabhängig von Symptomen).
A Endpunkte mit bestätigter Überlegenheit von Xultophy vs. Komparator
B p <0.001
IDegLira = Xultophy, GLP-1-RA = GLP-1-Rezeptoragonist
Abbildung 3 - Durchschnittliches HbA1c (%) nach Behandlungswochen bei Patienten mit Diabetes mellitus Typ 2 mit unzureichender Blutzuckerkontrolle unter GLP-1-Rezeptoragonisten.
Die Anzahl bestätigter schweren Hypoglykämien pro Patientenjahr unter Exposition (prozentualer Anteil Patienten) war 0.01 (1 Patient aus 291) für Xultophy und 0.00 (0 Patienten aus 199) für GLP-1-Rezeptoragonisten.
Intensivierung einer Basalinsulintherapie mittels Umstellung auf Xultophy
Vergleich mit Basal-Bolus-Therapie
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu einem Basal-/Bolusinsulin-Schemata bestehend aus Insulin Glargin U100 in Kombination mit mahlzeitenbezogenem Insulin Aspart zu Hauptmahlzeiten wurden im Rahmen einer 26-wöchigen randomisierten, offenen Treat-to-Target-Studie bei Patienten mit Diabetes mellitus Typ 2, deren Blutzuckereinstellung mit Insulin Glargin U100 (20 bis 50 Einheiten) und Metformin unzureichend war, untersucht. Die Anfangsdosis von Xultophy betrug 16 Dosisschritte. Im Basal-/Bolus-Studienarm entsprach die Anfangsdosis von Insulin Glargin U100 der Tagesdosis vor der Studie und die Anfangsdosis von mahlzeitenbezogenem Insulin Aspart betrug 4 Einheiten vor Hauptmahlzeiten. Die Dosen für Xultophy und Insulin Glargin U100 wurden zweimal in der Woche gemäss Tabelle 2 titriert, wogegen mahlzeitenbezogenes Insulin Aspart zweimal wöchentlich auf Basis der Selbstmessungen der Plasmaglukose (SMPG) in den drei vorangegangenen Tagen titriert wurde. Die maximale Tagesdosis für Xultophy betrug 50 Dosisschritte. Für Insulin Glargin U100 und Insulin Aspart bestand dagegen keine Maximaldosis.
Abbildung 4 und Tabelle 5 führen die wesentlichen Ergebnisse der Studie auf.
Im Xultophy- bzw. Basal-/Bolus-Arm erreichten nach 26-wöchiger Behandlung 57.6% bzw. 33.5% einen HbA1c-Zielwert <7% ohne schwere oder durch Blutzuckerwerte bestätigte, symptomatische, hypoglykämische Episoden (p<0.0001).
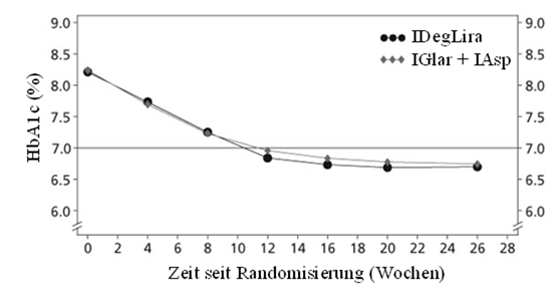
IDegLira = Xultophy, IGlar + IAsp = Insulin Glargin U100 + Insulin Aspart
Abbildung 4. Mittlerer HbA1c-Wert (%) nach Behandlungswoche bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin U100
Die Rate schwerer Hypoglykämien pro Patientenjahr der Exposition lag bei 0.02 (3 Patienten von 252) für Xultophy und bei 0.08 (4 Patienten von 253) für das Basal-/Bolusschemata.
Die Rate der nächtlichen schweren oder durch Blutzuckerwerte bestätigten, symptomatischen, hypoglykämischen Episoden war mit Xultophy statistisch signifikant niedriger als beim Basal-/Bolusschemata (geschätztes Behandlungsverhältnis 0.08, p <0.0001).
Tabelle 5. Ergebnisse einer 26-wöchigen Studie mit Xultophy bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin U100
|
|
Xultophy |
Basal-bolus (Insulin glargine + insulin aspart) |
|
n |
252 |
254 |
|
HbA1c (%) |
|
|
|
Ausgangswert → Studienende |
8.2→6.7 |
8.2→6.7 |
|
Änderung im Mittel |
-1.49 |
-1.48 |
|
Geschätzte Differenz |
|
-0.02A [-0.16; -0.12] |
|
Patienten (%), die HbA1c <7% erreichen |
|
|
|
Alle Patienten |
66.0 |
67.0 |
|
Geschätztes Odds-Verhältnis |
|
0.91 [0.62; 1.33] |
|
Patienten (%), die HbA1c <6,5% erreichen |
|
|
|
Alle Patienten |
49.6 |
44.6 |
|
Geschätztes Odds-Verhältnis |
|
1.26 [0.88; 1.82] |
|
Rate der Hypoglykämien* pro Patientenjahr der Exposition (Prozentsatz der Patienten) |
|
|
|
Geschätztes Verhältnis |
1.07 (19.8%) |
8.17 (52.6%) 0.11B [0.08; 0.17] |
|
Körpergewicht (kg) |
|
|
|
Ausgangswert → Studienende |
87.2→85.8 |
88.2→90.7 |
|
Änderung im Mittel |
-0.9 |
2.6 |
|
Geschätzte Differenz |
|
-3.57B [-4.19; -2.95] |
|
Nüchternplasmaglucose (mmol/l) |
|
|
|
Ausgangswert → Studienende |
8.5→6.1 |
8.3→6.4 |
|
Änderung im Mittel |
-2.35 |
-1.88 |
|
Geschätzte Differenz |
|
-0.31 [-0.67; 0.05] |
|
Dosis am Studienende |
|
|
|
Insulin degludec (Einheiten) |
40 |
|
|
Liraglutid (mg) |
1.4 |
|
|
Insulin glargin (Einheiten) |
|
52 |
|
Insulin aspart (Einheiten) |
|
32 |
|
Geschätzte Differenz, Gesamtinsulindosis |
|
-44.5 [-48.3; -40.7] |
|
Geschätzte Differenz, Basalinsulindosis |
|
-12.6 [-14.9; -10.3] |
Keine Anrechnung fehlender Daten. In eckigen Klammern „[]“: Angabe des 95%-Konfidenzintervalls
*Schwere oder durch Blutzuckerwerte bestätigte, symptomatische Hypoglykämie ist definiert als Episode, die die Hilfestellung einer anderen Person erfordert, die aktiv Kohlenhydrate oder Glucagon verabreicht oder andere korrektive Handlungen durchführt, oder als eine Episode, die durch einen Blutzuckerwert im Plasma von <3.1 mmol/l (56 mg/dl) bestätigt wird und mit für Hypoglykämie typischen Symptomen einhergeht.
A Nichtunterlegenheit von Xultophy gegenüber dem Vergleichspräparat bestätigender Endpunkt (Bereich 0.3%). p <0.0001
B Überlegenheit von Xultophy gegenüber dem Vergleichspräparat bestätigender Endpunkt. p <0.0001.
Vergleich mit optimierter Basalinsulintherapie
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Glargin, beide einmal täglich gegeben, wurden in einer 26-wöchigen, randomisierten, offenen Treat-to-Target-Studie bei Patienten mit Diabetes mellitus Typ 2, deren Blutzucker mit Insulin Glargin (20 – 50 Einheiten) und Metformin unzureichend eingestellt war, untersucht. Die Anfangsdosis von Xultophy betrug 16 Dosisschritte, und die Anfangsdosis von Insulin Glargin entsprach der täglichen Dosis vor der Studie. Die Dosen wurden in beiden Studienarmen zweimal wöchentlich entsprechend Tabelle 2 titriert. Die maximal erlaubte Dosis war 50 Dosisschritte für Xultophy, während es für Insulin Glargin keine Maximaldosis gab.
Tabelle 5 und Abbildung 5 führen die wesentlichen Ergebnisse der Studie auf.
54.3% der Patienten, die mit Xultophy behandelt wurden, erreichten einen HbA1c-Zielwert von <7% ohne bestätigte hypoglykämische Episoden gegenüber 29.4% der Patienten, die mit Insulin Glargin behandelt wurden (Odds-Verhältnis 3.24; p <0.001).
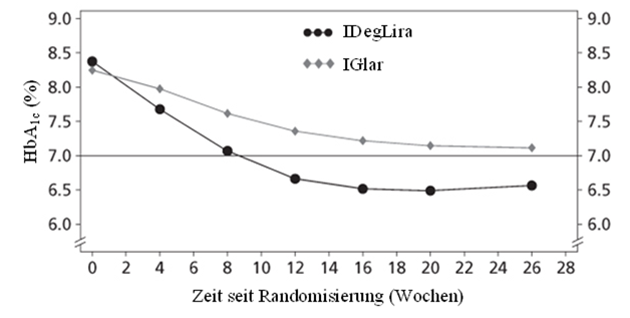
IDegLira = Xultophy, IGlar = Insulin Glargin
Abbildung 5. - Mittlerer HbA1c (%) nach Behandlungswoche bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin
Die Rate schwerer Hypoglykämien pro Patientenjahr der Exposition (Anteil der Patienten) betrug 0.00 (0 Patienten von 278) für Xultophy und 0.01 (1 Patient von 279) für Insulin Glargin. Die Rate der nächtlichen Hypoglykämien war mit Xultophy signifikant niedriger gegenüber Insulin Glargin (geschätztes Behandlungsverhältnis 0,17; p <0,001).
Die Wirksamkeit und Sicherheit von Xultophy im Vergleich zu Insulin Degludec, beide einmal täglich verabreicht, wurden in einer 26-wöchigen randomisierten, doppelblinden, Treat-to-Target-Studie bei Patienten mit Typ 2 Diabetes mellitus untersucht, die unter Basalinsulin (20–40 Einheiten) und Metformin (Met) allein oder in Kombination mit Sulfonylharnstoffen/Gliniden eine unzureichende Blutzuckerkontrolle hatten. Basalinsulin und Sulfonylharnstoffe/Glinide wurden bei der Randomisierung abgesetzt.
Die Anfangsdosis von Xultophy und Insulin Degludec betrug 16 Dosisschritte respektive 16 Einheiten, und die Dosis wurde zweimal wöchentlich gemäss Tabelle 2 titriert. Die zugelassene Maximaldosis betrug 50 Dosisschritte für Xultophy und 50 Einheiten für Insulin Degludec.
Die Resultate im Primärendpunkt der Studie sind, nebst Insulindosis und Hypoglykämieinzidenz in Tabelle 5 und Abbildung 6 zusammengefasst.
48.7% der Patienten erreichten einen HbA1c-Zielwert <7% ohne bestätigte hypoglykämische Episoden; dieser Anteil war signifikant höher als der bei den mit Insulin degludec behandelten Patienten (15.6%, Odds-Verhältnis 5.57; p <0.0001).
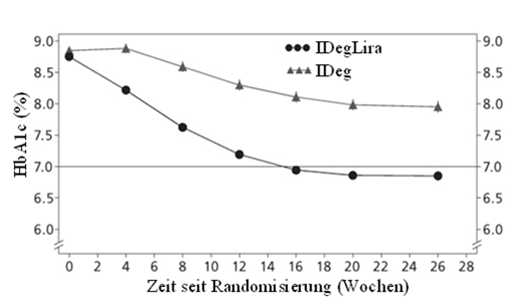
Abbildung 6 - Durchschnittliches HbA1c (%) nach Behandlungswochen bei Patienten mit unzureichender Blutzuckerkontrolle unter Basalinsulin.
Tabelle 6. - Ergebnisse von zwei 26-wöchigen Studien mit Xultophy bei Patienten mit Diabetes mellitus Typ 2 bei unzureichender Blutzuckereinstellung mit Insulin Glargin (links) oder Basalinsulin (rechts)
|
|
Vorherige Behandlung mit Insulin Glargin |
Vorherige Behandlung mit Basalinsulin (NPH, Insulin Detemir, Insulin Glargin) | ||
|
|
Xultophy |
Insulin Glargin, keine Dosisbeschränkung |
Xultophy |
Insulin Degludec, maximal 50 Einheiten erlaubt |
|
N |
278 |
279 |
199 |
199 |
|
HbA1c (%) |
|
|
|
|
|
Ausgangswert→Studienende |
8.4→6,6 |
8.2→7.1 |
8.7→6.9 |
8.8→8.0 |
|
Änderung im Mittel |
-1.81 |
-1.13 |
-1.90 |
-0.89 |
|
Geschätzte Differenz |
|
-0.59AB |
|
-1.05AB |
|
Patienten (%), die einen HbA1c-Wert <7% erreichen |
|
|
|
|
|
Alle Patienten |
71.6 |
47.0 |
|
|
|
Geschätztes Odds-Verhältnis |
|
3.45B |
|
|
|
Rate bestätigter Hypoglykämien* pro Patientenjahr der Exposition (Prozentsatz der Patienten) |
2.23 (28.4%) |
5.05 (49.1%) |
1.53 (24.1%) |
2.63 (24.6%) |
|
Geschätztes Verhältnis |
|
0.43AB |
|
0.66 |
|
Körpergewicht (kg) |
|
|
|
|
|
Ausgangswert→Studienende |
88.3→86.9 |
87.3→89.1 |
|
|
|
Änderung im Mittel |
-1.4 |
1.8 |
|
|
|
Geschätzte Differenz |
|
-3.20AB |
|
|
|
Nüchternplasmaglucose (mmol/l) |
|
|
|
|
|
Ausgangswert→Studienende |
8.9→6.1 |
8.9→6.1 |
|
|
|
Änderung im Mittel |
-2.83 |
-2.77 |
|
|
|
Geschätzte Differenz |
|
-0.01 |
|
|
|
Dosis am Studienende |
|
|
|
|
|
Insulin (Einheiten) |
41 |
66D |
45 |
45 |
|
Liraglutide (mg) |
1.5 |
- |
1.7 |
- |
|
Geschätzte Differenz, Basalinsulin Dosis |
|
-25.47B |
|
-0.02 |
Ausgangswert, Studienende und Veränderungswerte: LOCF-Werte (Last Observation Carried Forward). In eckigen Klammern «[]»: Angabe des 95%-Konfidenzintervalls
A Endpunkt mit bestätigter Überlegenheit von Xultophy gegenüber dem Vergleichspräparat
B p <0.0001
C p <0.05
D die durchschnittliche Dosis von Insulin Glargin vor der Studie war 32 Einheiten
Kardiovaskuläre Sicherheit
Es wurden keine kardiovaskulären (CV) Endpunktstudien eigens für das Kombinationspräparat Xultophy durchgeführt. Die kardiovaskuläre Sicherheit seiner beiden Komponenten wurde in den zugehörigen CV Endpunktstudien, LEADER und DEVOTE, demonstriert. Zusätzliche post-hoc Analysen untersuchten den Effekt in den Patienten dieser beiden Studien, welche gleichzeitig mit Liraglutide und einem langwirksamen Insulin (inklusive Insulin Degludec) behandelt wurden. Die Ergebnisse dieser post-hoc Analysen unterstützen die Übertragbarkeit der positiven Befunde von LEADER und DEVOTE auf Xultophy (kardiovaskuläre Sicherheit und kardiovaskulärer Nutzen).
Liraglutide (Victoza)
LEADER - Primäranalyse
Die LEADER Studie (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) untersuchte die Häufigkeit schwerer kardiovaskulärer Ereignisse (MACE: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall) in 9'340 Patienten mit Diabetes mellitus Typ 2 Diabetes und einem erhöhten kardiovaskulären Risiko. Randomisiert (1:1) wurden die Patienten zusätzlich zur Standardtherapie entweder mit bis zu 1.8 mg Liraglutide täglich (4'668) oder Placebo (4'672) behandelt (mediane Behandlungsdauer zirka 3.5 Jahre). Primärer Endpunkt war die Zeit bis zum ersten Auftreten eines MACE. Die geschätzte Hazard Ratio für die Zeit bis zur ersten MACE wurde durch Liraglutide in der untersuchten Dosierung signifikant reduziert (Hazard Ratio [95% KI]: 0.87 [0.78; 0.97]).
Eine Senkung des HbA1c-Wertes von Baseline zu Monat 36 wurde mit Liraglutid im Vergleich zu Placebo zusätzlich zur Standardtherapie beobachtet (-1.16% vs. -0.77%; geschätzte Behandlungsdifferenz [ETD] -0.40% [-0.45; -0.34]).
LEADER – Post-hoc-Analyse
Die LEADER-Primäranalyse wurde für 2'118 Patienten, die bei Baseline ein langwirksames Insulin erhielten, wiederholt, um die Anwendbarkeit des Ergebnisses der Primäranalyse für die Kombination aus Liraglutide und langwirksamem Insulin zu bestimmen. Die Baseline-Charakteristika dieser Subgruppe waren vergleichbar mit der der Gesamtpopulation. Die Ergebnisse der post-hoc-Analyse für die Zeit bis zum ersten MACE waren konsistent mit der LEADER-Primäranalyse (geschätzte HR [95% KI] in der Subgruppe: 0.82 [0.66; 1.03]).
Insulin Degludec (Tresiba)
DEVOTE – Primäranalyse
Bei der DEVOTE Studie (Trial Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events) handelte es sich um eine randomisierte, doppelblinde klinische Studie, bei der die kardiovaskuläre Sicherheit von Insulin Degludec mit derjenigen von Insulin Glargin (100 Einheiten/ml) bei 7'637 Patienten mit Typ 2 Diabetes mellitus und einem hohen Risiko für kardiovaskuläre Ereignisse verglichen wurde. Die Dauer der Studie war «ereignisgesteuert», d.h. sie dauerte bis ≥633 Ereignisse erreicht waren. Die Behandlungsdauer betrug im Median 1.83 Jahre, die Beobachtungszeit im Median 1.99 Jahre.
Gegenstand der Primäranalyse war die Zeit von der Randomisierung bis zum ersten Auftreten eines schweren kardiovaskulären Ereignisses (MACE: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall). Die Primäranalyse ergab eine geschätzte HR [95% KI] für Insulin Degludec im Vergleich zu Insulin Glargin von 0.91 [0.78; 1.06].
Der Ausgangswert von HbA1c betrug in beiden Behandlungsgruppen 8.4% und nach 2 Jahren lag der HbA1c bei 7.5% sowohl für Insulin Degludec als auch für Insulin Glargin.
DEVOTE – Post-hoc-Analyse
Um die Übertragbarkeit des Ergebnisses der Primäranalyse auf die Kombination eines langwirksamen Insulins (inklusive Insulin Degludec) mit Liraglutide zu ermitteln, wurde eine Post-hoc-Analysis für die Untergruppe von Patienten durchgeführt, welche bei Baseline bereits zusätzlich mit Liraglutide behandelt wurden.
Die Baseline-Charakteristika der 436 Patienten, die bei Baseline mit Liraglutide behandelt wurden, waren vergleichbar mit jenen der 7'201 Patienten, die bei Baseline nicht Liraglutide behandelt wurden. Die Post-hoc-Analyse der Zeit bis zum ersten MACE ergab eine geschätzte HR [95% KI] von 0.65 [0.45; 0.96] für die Liraglutide-behandelte Patienten im Vergleich zu Patienten, die nicht mit Liraglutide behandelt wurden.
Mikrovaskuläre Beurteilung
In der LEADER Studie umfassten mikrovaskuläre Ereignisse die Nephropathie und Retinopathie. Die Analyse der Zeit bis zum ersten mikrovaskulären Ereignis unter Liraglutide im Vergleich zum Placebo wies eine HR von 0.84 [0.73; 0.97] auf. Die HR für Liraglutide vs. Placebo betrug 0.78 [0.67; 0.92] hinsichtlich der Zeit bis zum ersten Auftreten der Nephropathie und 1.15 [0.87; 1.52] bis zum ersten Auftreten der Retinopathie.
Pharmakokinetik
Nachfolgend werden die pharmakokinetischen Eigenschaften von Xultophy erwähnt, ausgenommen der Daten, die die alleinige Verabreichung von Insulin Degludec oder Liraglutide präsentieren.
Absorption
Nach Verabreichung von Xultophy war die Gesamt-Exposition von Insulin Degludec äquivalent derer von Insulin Degludec alleine, während die Cmax um 12% höher war.
Nach Verabreichung von Xultophy war die Gesamt-Exposition von Liraglutide um 11% tiefer als die nach Verabreichung von Liraglutide alleine, während die Cmax um 23% tiefer war. Diese Unterschiede werden jedoch als klinisch nicht relevant angesehen, da die Therapie mit Xultophy nach den individuellen Blutzuckerzielwerten des Patienten initiiert und titriert wird.
Die Insulin Degludec- und die Liraglutide Exposition steigen proportional zur Dosis von Xultophy innerhalb des gesamten Dosierungsbereichs.
Das pharmakokinetische Profil von Xultophy ist übereinstimmend mit der einmal täglichen Dosierung und die Steady-State Konzentration von Insulin Degludec und Liraglutide wird nach 2–3 Tagen bei einer täglichen Dosisverabreichung erreicht.
Distribution
Insulin Degludec und Liraglutide werden in grossem Umfang an Plasmaproteine gebunden (>99% bzw. >98%).
Metabolismus
Insulin Degludec
Der Abbau von Insulin Degludec ist ähnlich dem von Humaninsulin; alle gebildeten Metaboliten sind inaktiv.
Liraglutide
Innerhalb eines Zeitraums von 24 Stunden nach Verabreichung einer Einzeldosis [3H]-Liraglutide bei gesunden Probanden lag im Plasma hauptsächlich intaktes Liraglutide vor. Es wurden zwei Nebenmetaboliten im Plasma nachgewiesen (≤9% und ≤5% der Gesamtradioaktivität im Plasma). Liraglutide wird in ähnlicher Weise wie grosse Proteine endogen metabolisiert, ohne dass ein bestimmtes Organ als Hauptweg für die Elimination verantwortlich ist.
Elimination
Die Halbwertszeit von Insulin Degludec beträgt ungefähr 25 Stunden und die von Liraglutide ungefähr 13 Stunden.
Kinetik spezieller Patientengruppen
Ältere Patienten
Das Alter hatte keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Insulin Degludec und Liraglutide nach Verabreichung von Xultophy.
Geschlecht
Das Geschlecht hatte keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Insulin Degludec und Liraglutide nach Verabreichung von Xultophy.
Ethnische Herkunft
Die ethnische Herkunft hatte keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Insulin Degludec und Liraglutide nach Verabreichung von Xultophy.
Nierenfunktionsstörungen
Insulin Degludec
Es gibt keinen Unterschied in der Pharmakokinetik von Insulin Degludec zwischen gesunden Probanden und Patienten mit eingeschränkter Nierenfunktion.
Liraglutide
Die Liraglutide Exposition war bei Patienten mit eingeschränkter Nierenfunktion im Vergleich zu Personen mit normaler Nierenfunktion reduziert. Die Liraglutide Exposition wurde um 33%, 14%, 27% und 26% gesenkt bei Patienten mit leichter (Kreatinin-Clearance, CrCl 50–80 ml/min), mässiger (CrCl 30–50 ml/min) und schwerer (CrCl <30 ml/min) Nierenfunktionsstörung und im Endstadium mit Dialyse.
Ebenso war in einer 26-wöchigen klinischen Studie bei Patienten mit Diabetes mellitus Typ 2 und mittelschwerer Einschränkung der Nierenfunktion (CrCl 30–59 ml/min) die Liraglutide-Exposition, im Vergleich zu Patienten einer separaten Studie mit Diabetes mellitus Typ 2 und normaler oder leichter Einschränkung der Nierenfunktion, um 26% reduziert.
Leberfunktionsstörungen
Insulin Degludec
Es gibt keinen Unterschied in der Pharmakokinetik von Insulin Degludec zwischen gesunden Probanden und Patienten mit eingeschränkter Leberfunktion.
Liraglutide
Die Pharmakokinetik von Liraglutide wurde bei Patienten mit unterschiedlichem Grad der Leberfunktion in einer Einzeldosis-Studie ausgewertet. Die Liraglutide Exposition wurde um 13-23% bei Patienten mit leichter bis mittelschwerer Einschränkung der Leberfunktion im Vergleich zu gesunden Probanden verringert. Die Exposition war signifikant niedriger (44%) bei Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Score >9).
Kinder und Jugendliche
Es wurden keine Studien mit Xultophy bei Kindern und Jugendlichen unter 18 Jahren durchgeführt.
Präklinische Daten
Das präklinische Entwicklungsprogramm für Insulin Degludec/Liraglutide beinhaltete pivotale Kombinations-Toxizitätstudien bis zu einer Dauer von 90 Tagen in einer einzigen relevanten Spezies (Wistar-Ratten). Die lokale Verträglichkeit wurde bei Kaninchen und Schweinen untersucht.
Präklinische Daten zur Sicherheit, basierend auf Toxizitätsstudien mit wiederholter Verabreichung, zeigen keine Sicherheitsbedenken für den Menschen.
Die lokalen Gewebereaktionen in den beiden Studien mit Kaninchen und Schweinen beschränkten sich jeweils auf milde Entzündungsreaktionen.
Es wurden keine Studien mit der Insulin Degludec/Liraglutide Kombination zur Bewertung der Kanzerogenität, Mutagenese oder Beeinträchtigung der Fertilität durchgeführt.
Die folgenden Daten beruhen auf einzeln mit Insulin Degludec und Liraglutide durchgeführte Studien.
Insulin Degludec
Präklinische Daten auf der Grundlage von Studien zur pharmakologischen Sicherheit, Toxizität bei wiederholter Gabe, Kanzerogenität und Reproduktionstoxizität ergaben keine Sicherheitsbedenken für Menschen.
Das Verhältnis von mitogener zu metabolischer Wirkung von Insulin Degludec entspricht dem von Humaninsulin.
Liraglutide
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe oder Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In zweijährigen Karzinogenitätsstudien an Ratten und Mäusen wurden nichtlethale C-Zelltumoren der Schilddrüse beobachtet. In Ratten konnte für diese Tumore kein NOAEL (no adverse effect level) bestimmt werden. Die Befunde bei Nagern werden durch einen nicht-genotoxischen, spezifischen, GLP-1-Rezeptor vermittelten Mechanismus verursacht, für den Nagetiere im Gegensatz zu Affen und Menschen besonders anfällig sind. Die Relevanz für den Menschen ist wahrscheinlich gering, kann jedoch nicht komplett ausgeschlossen werden. Im Zusammenhang mit der Behandlung wurden keine anderen Tumoren festgestellt.
Tierexperimentelle Studien zeigten keine direkt schädigende Wirkung hinsichtlich der Fertilität, jedoch eine leicht erhöhte Embryonensterblichkeit in frühen Stadien bei der höchsten Dosis. Eine Anwendung von Liraglutide während des mittleren Abschnitts der Tragzeit führte zu einer Reduktion des mütterlichen Gewichts und des Fötuswachstums mit nicht eindeutigen Auswirkungen auf die Rippen von Ratten und Skelettveränderungen bei Kaninchen. Unter Einwirkung von Liraglutide war bei Ratten das neonatale Wachstum reduziert. In der Gruppe mit der höchsten Dosis hielt dieser Effekt in der Zeit nach dem Abstillen an. Es ist nicht bekannt, ob das verminderte Wachstum der Jungtiere durch eine geringere Milchaufnahme aufgrund einer direkten GLP-1-Wirkung oder durch geringere Milchproduktion der Muttertiere aufgrund einer verminderten Kalorienaufnahme verursacht wird.
Sonstige Hinweise
Inkompatibilitäten
Das Hinzufügen von Substanzen zu Xultophy kann zur Degradierung der Wirkstoffe führen.
Xultophy darf nicht mit Infusionslösungen gemischt werden.
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
24 Monate. Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach der ersten Anwendung kann das Arzneimittel während 21 Tagen bei einer maximalen Temperatur von 30°C oder im Kühlschrank (2–8°C) aufbewahrt werden. Das Arzneimittel muss 21 Tage nach dem ersten Öffnen entsorgt werden. Bei Nichtgebrauch die Verschlusskappe auf dem Fertigpen aufgesetzt lassen, um den Inhalt vor Licht zu schützen.
Besondere Lagerungshinweise
Vor der ersten Anwendung: Im Kühlschrank (2–8°C) lagern. Vom Kühlelement fernhalten. Nicht einfrieren. Bei Nichtgebrauch die Verschlusskappe auf dem Fertigpen aufgesetzt lassen, um den Inhalt vor Licht zu schützen.
Ausser Reich- und Sichtweite von Kindern aufbewahren.
Hinweise für die Handhabung
Der Xultophy Fertigpen ist für die Anwendung mit NovoTwist® oder NovoFine®-Injektionsnadeln bis zu einer Länge von 8 mm und bis zu 32G dünn konzipiert.
Der Xultophy Fertigpen darf nur von einer einzigen Person verwendet werden.
Xultophy darf nicht verwendet werden, wenn die Lösung nicht klar und farblos aussieht.
Einmal gefrorenes Xultophy darf nicht mehr verwendet werden.
Der Patient soll die Nadel nach jeder Injektion entsorgen.
Nicht verwendete Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
Eine ausführliche Bedienungsanleitung finden Sie in der Packungsbeilage.
Zulassungsnummer
65041 (Swissmedic)
Packungen
3 Fertigpens (3× 3 ml). [B]
Zulassungsinhaberin
Novo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der Information
April 2025