Zusammensetzung
Wirkstoffe
Sacubitrilum et valsartanum ut complexus sacubitrili et valsartani natrii hydricus
Entresto enthält einen Salzkomplex der anionischen Formen von Sacubitril und Valsartan, Natriumkationen und Wassermoleküle im molaren Verhältnis 1:1:3:2,5. Nach oraler Verabreichung spaltet sich Entresto in Sacubitril (weiter zu LBQ657 metabolisiert) und Valsartan.
Hilfsstoffe
Filmtablette
Tablettenkern
Cellulosum microcristallinum, Hydroxypropylcellulosum substitum humile, Crospovidonum, Magnesii stearas, Talcum, Silica colloidalis anhydrica
Überzug
Hypromellosum, Macrogolum 4000, Talcum, Titanii dioxidum (E171), Ferrum oxidum rubrum (E 172)
100 mg Tablette: Ferrum oxidum flavum (E 172)
50 mg und 200 mg Tablette: Ferrum oxidum nigrum (E 172)
Natriumgehalt: max. 3.965 mg/50 mg Tablette, max. 7.93 mg Natrium/100 mg Tablette, max. 15.86 mg/200 mg Tablette
Filmüberzogenes Granulat
Granulatkern
Cellulosum microcristallinum, Hydroxypropylcellulosum substitum humile, Magnesii stearas, Silica colloidalis anhydrica, Talcum
Filmüberzug des Granulats
copolymerum methacrylatis butylati basicum, talcum, acidum stearicum, natrii laurilsulfas
Jede 6 mg/6 mg filmüberzogene Granulatkapsel enthält maximal 1.1 mg Natrium.
Jede 15 mg/16 mg filmüberzogene Granulatkapsel enthält maximal 2.6 mg Natrium.
Indikationen/Anwendungsmöglichkeiten
Herzinsuffizienz bei Erwachsenen
Entresto ist indiziert zur Reduktion des Risikos der kardiovaskulären Mortalität und Morbidität bei erwachsenen Patienten mit systolischer Herzinsuffizienz (NYHA-Klasse II-IV, LVEF ≤40%). Entresto wird in geeigneter Kombination mit anderen Therapien für Herzinsuffizienz (z.B. Betablocker, Diuretika und Mineralkortikoidantagonisten) anstelle eines ACE-Hemmers oder eines ARBs verabreicht (siehe «Eigenschaften/Wirkungen»).
Herzinsuffizienz bei Kindern und Jugendlichen
Entresto ist bei Kindern und Jugendlichen ab einem Jahr zur Behandlung der symptomatischen chronischen Herzinsuffizienz mit linksventrikulärer systolischer Dysfunktion angezeigt.
Dosierung/Anwendung
Herzinsuffizienz bei Erwachsenen
Die empfohlene Initialdosis von Entresto ist 100 mg zweimal täglich. Eine Initialdosis von 50 mg zweimal täglich wird bei Patienten empfohlen, die derzeit nicht mit einem ACE (Angiotensin-converting-enzyme)-Hemmer oder einem Angiotensin-II-Rezeptorblocker (ARB) behandelt werden, und sollte bei Patienten in Erwägung gezogen werden, die bislang mit einer niedrigen Dosis dieser Wirkstoffe behandelt wurden (siehe «Eigenschaften/Wirkungen»).
Die Dosis von Entresto sollte alle 2 - 4 Wochen je nach Verträglichkeit auf eine Zieldosis von täglich 2x 200 mg verdoppelt werden.
Die angestrebte Erhaltungsdosis von Entresto ist 200 mg zweimal täglich.
Die Behandlung mit Entresto darf frühestens 36 Stunden nach Absetzen eines ACE-Hemmers eingeleitet werden, da bei gleichzeitiger Anwendung mit einem ACE-Hemmer das Risiko der Entwicklung eines Angioödemes besteht (siehe «Kontraindikationen»). Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Patienten mit systolischem Blutdruck (systolic blood pressure, SBP) < 100 mmHg wurden nicht untersucht, weshalb Entresto bei diesen Patienten mit Vorsicht verwendet werden sollte.
Wenn es bei Patienten zu Problemen hinsichtlich der Verträglichkeit kommt (symptomatische Hypotonie, Hyperkaliämie, Nierenfunktionsstörungen), wird eine Anpassung von gleichzeitig angewendeter Medikation, eine vorübergehende Dosissenkung oder ein Absetzen von Entresto empfohlen.
Wenn eine Dosis ausgelassen wird, sollte der Patient die nächste Dosis zum vorgesehenen Zeitpunkt einnehmen.
Herzinsuffizienz bei Kindern und Jugendlichen
Tabelle 1 zeigt die empfohlene Dosis für pädiatrische Patienten, ausser in den unter der Tabelle beschriebenen Situationen. Die empfohlene Dosis sollte zweimal täglich oral eingenommen werden. Dabei sollte die Dosis alle 2-4 Wochen auf die Zieldosis erhöht werden, je nachdem, wie der Patient sie verträgt. Die niedrigste empfohlene Dosis beträgt 6 mg/6 mg. Dosen können auf die nächste Kombination von 6 mg/6 mg und/oder 15 mg/16 mg Kapseln auf- oder abgerundet werden. Beim Auf- oder Abrunden der Dosis während der Auftitrationsphase sollte darauf geachtet werden, dass eine schrittweise Erhöhung auf die Zieldosis gewährleistet ist.
Entresto Filmtabletten sind nicht für Kinder mit einem Körpergewicht unter 40 kg geeignet. Für diese Patienten ist Entresto filmüberzogenes Granulat erhältlich.
Tabelle 1 Empfohlene Dosistitration
|
Gewicht des Patienten |
|
Dosis des Titrationsschritts (zweimal täglich) | ||
|
Halbe Initialdosis* |
Initialdosis |
Zweite Dosis |
Zieldosis | |
|
Pädiatrische Patienten mit weniger als 40 kg Körpergewicht |
0,8 mg/kg# |
1,6 mg/kg# |
2,3 mg/kg# |
3,1 mg/kg# |
|
Pädiatrische Patienten mit mindestens 40 kg, aber weniger als 50 kg Körpergewicht |
0,8 mg/kg# |
24 mg/26 mg |
49 mg/51 mg |
72 mg/78 mg |
|
Pädiatrische Patienten mit mindestens 50 kg Körpergewicht |
24 mg/26 mg |
49 mg/51 mg |
72 mg/78 mg |
97 mg/103 mg |
* Die Hälfte der Initialdosis wird empfohlen für Patienten, die keinen ACE-Hemmer oder ARB einnehmen oder diese Arzneimittel in niedriger Dosierung einnehmen, sowie für Patienten mit Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate [eGFR] < 30 ml/min/1,73 m²) und für Patienten mit mittelschwerer Leberfunktionsstörung (siehe «Spezielle Patientengruppen»).
# 0,8 mg/kg, 1,6 mg/kg, 2,3 mg/kg und 3,1 mg/kg beziehen sich auf das kombinierte Gewicht von Sacubitril/Valsartan und sind als filmüberzogenes Granulat zu verabreichen.
Bei Patienten, die vor Beginn der Behandlung mit Entresto keinen ACE-Hemmer oder ARB eingenommen oder niedrige Dosen dieser Arzneimittel eingenommen haben, wird die Hälfte der Initialdosis empfohlen. Bei pädiatrischen Patienten mit einem Gewicht von mindestens 40 kg, die aber weniger als 50 kg wiegen, wird eine Initialdosis von 0,8 mg/kg zweimal täglich (als filmüberzogenes Granulat) empfohlen. Nach Behandlungsbeginn sollte die Dosis entsprechend der empfohlenen Dosistitration in Tabelle 1 erhöht und alle 3-4 Wochen angepasst werden.
Die Behandlung sollte nicht bei Patienten mit einem Serumkaliumspiegel > 5,3 mmol/l oder einem systolischen Blutdruck (SBP) < 5. Perzentil für das Alter des Patienten eingeleitet werden. Wenn bei Patienten Probleme mit der Verträglichkeit auftreten (SBP < 5. Perzentil für das Alter des Patienten, symptomatische Hypotonie, Hyperkaliämie, Nierenfunktionsstörung), wird eine Anpassung der Begleitarzneimittel, eine vorübergehende Herabsetzung der Dosierung oder das Absetzen von Entresto empfohlen.
Art der Anwendung
Entresto Filmtabletten
Entresto Filmtabletten kann unabhängig von den Mahlzeiten verabreicht werden (siehe «Eigenschaften/Wirkung»). Die Tabletten müssen mit einem Glas Wasser geschluckt werden. Das Teilen oder Zerkleinern der Tabletten wird nicht empfohlen.
Entresto filmüberzogenes Granulat
Entresto filmüberzogenes Granulat wird angewendet, indem die Kapsel geöffnet und der Inhalt auf eine kleine Menge weicher Nahrung (1 bis 2 Teelöffel) gestreut wird. Die Nahrung, die das Granulat enthält, muss sofort verzehrt werden. Die Patienten können entweder die 6 mg/6 mg (weisse Kappe) oder 15 mg/16 mg (gelbe Kappe) Kapseln oder beide erhalten, um die erforderliche Dosis zu erreichen. Die Kapsel darf nicht geschluckt werden. Die leeren Hüllen müssen nach dem Gebrauch weggeworfen und dürfen nicht geschluckt werden.
Spezielle Patientengruppen
Eingeschränkte Nierenfunktion
Bei Patienten mit leichter (eGFR 60 - 90 ml/min/1,73 m2) bis mittelschwerer (eGFR 30 - 60 ml/min/1,73 m²) Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Für Patienten mit schwerer Nierenfunktionsstörung (eGFR < 30 ml/min/1,73 m2) wird die Hälfte der Initialsdosis empfohlen. Bei einer Anwendung von Entresto bei dieser Patientengruppe ist Vorsicht geboten.
Entresto ist bei Patienten mit eGFR <10 ml/min/1.73m2 kontraindiziert (siehe «Kontraindikationen»).
Eingeschränkte Leberfunktion
Bei der Verabreichung von Entresto an Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klassifikation A) ist keine Dosisanpassung erforderlich.
Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klassifikation B) wird die Hälfte der Initialdosis Initialdosis empfohlen.
Es wurden keine Studien bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klassifikation C) durchgeführt. Daher wird die Anwendung von Entresto bei diesen Patienten nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkung»).
Bei pädiatrischen Patienten mit einem Körpergewicht von mindestens 40 kg, aber unter 50 kg, wird eine Initialdosis von 0,8 mg/kg Körpergewicht zweimal täglich empfohlen. Nach Beginn der Behandlung sollte die Dosis entsprechend der empfohlenen Dosistitration alle 2-4 Wochen erhöht werden.
Kinder und Jugendliche
Entresto ist nicht für die Anwendung bei Kindern unter 1 Jahr zugelassen, da Sicherheit und Wirksamkeit in dieser Population nicht erwiesen sind. Die derzeit verfügbaren Daten sind unter «Klinische Wirksamkeit» beschrieben. Es kann keine Dosierungsempfehlung gegeben werden.
Ältere Patienten (über 65 Jahre)
Bei Patienten über 65 Jahren ist keine Dosisanpassung erforderlich.
Kontraindikationen
·Überempfindlichkeit gegenüber einem der Wirkstoffe Sacubitril oder Valsartan, oder gegenüber einem der Hilfsstoffe.
·gleichzeitige Anwendung eines ACE-Hemmers (siehe «Warnhinweise und Vorsichtsmassnahmen», «Dosierung/Anwendung» und «Interaktionen»). Entresto darf frühestens 36 Stunden nach Absetzen einer ACE-Hemmer-Therapie verabreicht werden.
·Bekanntes Angioödem in der Vorgeschichte im Zusammenhang mit einer früheren Behandlung mit einem ACE-Hemmer oder ARB.
·Hereditäres Angioödem.
·Gleichzeitige Anwendung von Entresto mit Aliskiren-haltigen Arzneimitteln bei Patienten mit Diabetes mellitus oder eingeschränkter Nierenfunktion (GFR<60 ml/min/1,73m2) (s. Rubrik «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
·Schwere Nierenfunktionsstörung mit eGFR <10 ml/min/1,73m2 aufgrund mangelnder Daten.
·Schwangerschaft (siehe «Schwangerschaft/Stillzeit»)
Warnhinweise und Vorsichtsmassnahmen
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
·Entresto darf aufgrund des Angioödem-Risikos nicht zusammen mit einem ACE-Hemmer verabreicht werden. Eine Behandlung mit Entresto darf frühestens 36 Stunden nach Einnahme der letzten Dosis einer ACE-Hemmer-Therapie eingeleitet werden. Bei einem Absetzen von Entresto darf eine Behandlung mit einem ACE-Hemmer frühestens 36 Stunden nach der letzten Dosis von Entresto eingeleitet werden (siehe «Kontraindikationen», «Dosierung/Anwendung» und «Interaktionen»).
·Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Dosierung/Anwendung» und «Interaktionen»).
·Die gleichzeitige Anwendung von Entresto mit direkten Renin-Hemmern wie Aliskiren wird nicht empfohlen. (siehe «Kontraindikationen» und «Interaktionen»). Entresto darf bei Patienten mit Diabetes mellitus oder Patienten mit eingeschränkter Nierenfunktion (GFR<60 ml/min/1,73m2) nicht zusammen mit Aliskiren verabreicht werden (siehe «Kontraindikationen» und «Interaktionen»).
Arterielle Hypotonie
Fälle von symptomatischer Hypotonie wurden bei erwachsenen Patienten berichtet, die im Rahmen klinischer Studien mit Entresto behandelt wurden; insbesondere bei Patienten im Alter ≥65 Jahren, bei Patienten mit einer Nierenerkrankung und bei Patienten mit niedrigem SBP (< 112 mmHg).
Die Behandlung sollte nur dann eingeleitet werden, wenn der SBP bei erwachsenen Patienten ≥100 mmHg oder ≥5. Perzentil des SBP für das Alter der pädiatrischen Patienten beträgt. Patienten mit einem SBP unter diesen Werten wurden nicht untersucht (siehe «Klinische Wirksamkeit»).
Berichte über Hypotonie als unerwünschtes Ereignis traten häufiger mit Entresto (17,6 %) als mit Enalapril (12,0 %) auf. Bei Beginn einer Therapie mit Entresto oder während einer Dosisanpassung sollte der Blutdruck in angemessenen Intervallen, in Übereinstimmung mit der üblichen klinischen Praxis, überwacht werden. Bei Auftreten von Hypotonie wird eine vorübergehende Dosissenkung oder ein vorübergehendes Absetzen von Entresto empfohlen (siehe «Dosierung/Anwendung»). Eine Dosisanpassung von Diuretika, gleichzeitig angewendeten Blutdrucksenkern und eine Behandlung anderer Ursachen für die Hypotonie (z.B. Hypovolämie) sollten in Betracht gezogen werden. In der Regel ist ein dauerhaftes Absetzen der Behandlung nicht erforderlich. Die Wahrscheinlichkeit einer symptomatischen Hypotonie ist bei einer Volumendepletion des Patienten, z.B. durch eine Behandlung mit Diuretika, eingeschränkte Salzaufnahme mit der Nahrung, Diarrhoe oder Erbrechen, erhöht. Eine Natrium- und/oder Volumendepletion ist vor Einleitung einer Behandlung mit Entresto zu korrigieren.
Eingeschränkte Nierenfunktion
Wie bei allen Wirkstoffen, die auf das Renin-Angiotensin-Aldosteron-System wirken, kann eine Anwendung von Entresto mit einer verminderten Nierenfunktion einhergehen. In der Studie PARADIGM-HF war die Inzidenz klinisch relevanter Nierenfunktionsstörungen gering, und ein damit in Zusammenhang stehendes Absetzen der Behandlung wurde bei Patienten unter Entresto weniger häufig (0,65 %) beobachtet als unter Enalapril (1,28 %). Eine Dosissenkung von Entresto sollte bei Patienten mit einem klinisch signifikanten Rückgang der Nierenfunktion erwogen werden. Bei der Anwendung von Entresto bei Patienten mit stark eingeschränkter Nierenfunktion (eGFR < 30 ml/min/1,73 m2) ist mit Vorsicht vorzugehen (siehe «Dosierung/Anwendung» und «Eigenschaften/Wirkungen»). Entresto ist kontraindiziert bei eGFR < 10 ml/min/1,73 m2 (siehe «Kontraindikationen»).
Eingeschränkte Leberfunktion
Es wurden keine Studien bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klassifikation C) durchgeführt. Daher wird die Anwendung von Entresto bei diesen Patienten nicht empfohlen (siehe «Dosierung/Anwendung» und «Eigenschaften/Wirkung»).
Hyperkaliämie
Wie bei allen Wirkstoffen, die auf das Renin-Angiotensin-Aldosteron-System wirken, kann eine Anwendung von Entresto mit einem erhöhten Hyperkaliämie-Risiko einhergehen. In der Studie PARADIGM-HF war die Inzidenz klinisch relevanter Hyperkaliämien, welche zu einem Absetzen der Behandlung führten, gering (0,26 % der Patienten unter Entresto im Vergleich zu 0,35 % der Patienten unter Enalapril). Hyperkaliämien > 5,5 mmol/l traten bei je ca. 16 % der Patienten unter Entresto resp. unter Enalapril auf. Mit Hyperkaliämien assoziierte unerwünschte Ereignisse wurden bei 11,9 % der mit Entresto behandelten Patienten gegenüber 14,3 % der mit Enalapril behandelten Patienten berichtet (s. «Unerwünschte Wirkungen»). Arzneimittel, die bekanntermassen den Kaliumspiegel erhöhen (z.B. kaliumsparende Diuretika, Kalium-Ergänzungspräparate), sind bei einer gleichzeitigen Verabreichung mit Entresto mit Vorsicht anzuwenden. Bei Auftreten einer klinisch signifikanten Hyperkaliämie sind Massnahmen wie etwa eine Senkung des Kaliumanteils in der Nahrung oder eine Anpassung der Dosis gleichzeitig verabreichter Arzneimittel in Erwägung zu ziehen. Eine Überwachung des Serumkaliumspiegels wird insbesondere bei Patienten mit Risikofaktoren wie schwerer Nierenfunktionsstörung, Diabetes mellitus, Hypoaldosteronismus oder einer kaliumreichen Diät empfohlen (siehe «Dosierung/Anwendung»).
Angioödeme
Es liegen Berichte vor über Angioödeme bei Patienten, die mit Entresto behandelt wurden. Bei Auftreten eines Angioödems ist Entresto unverzüglich abzusetzen, und eine angemessene Therapie und Überwachung sind einzuleiten, bis die Anzeichen und Symptome vollständig und nachhaltig abgeklungen sind. Entresto darf nicht erneut verabreicht werden. Bei gesichertem Angioödem, bei dem Schwellungen auf Gesicht und Lippen beschränkt sind, ist dieses in der Regel ohne Behandlung abgeklungen. Antihistaminika haben sich jedoch zur Symptomlinderung als hilfreich erwiesen.
Ein mit einem Rachenödem einhergehendes Angioödem kann zum Tode führen. Bei einer Beteiligung von Zunge, Glottis oder Rachen, die wahrscheinlich zu einer Obstruktion der Atemwege führt, sind unverzüglich eine geeignete Behandlung, z.B. mit Epinephrin-/Adrenalinlösung 1:1000 (0,3 ml bis 0,5 ml) subkutan und/oder Massnahmen zur Gewährleistung offener Atemwege einzuleiten.
Patienten mit Angioödem in der Vorgeschichte wurden nicht untersucht. Da diese Patienten ein höheres Angioödem-Risiko aufweisen können, ist bei einer Anwendung von Entresto bei dieser Patientengruppe Vorsicht geboten. Entresto darf bei Patienten mit anamnestisch bekanntem Angioödem im Zusammenhang mit einer früheren Therapie mit ACE-Hemmern oder ARB oder bei Patienten mit hereditärem Angioödem nicht angewendet werden (siehe «Kontraindikationen»).
Patienten schwarzer Hautfarbe können eine erhöhte Neigung zu Angioödemen aufweisen.
Intestinales Angioödem
Bei Patienten, die mit Angiotensin-II-Rezeptor-Antagonisten, einschliesslich Valsartan, behandelt wurden, wurde über intestinale Angioödeme berichtet (siehe «Unerwünschte Wirkungen»). Bei diesen Patienten traten Bauchschmerzen, Übelkeit, Erbrechen und Durchfall auf. Die Symptome klangen nach dem Absetzen von Angiotensin-II-Rezeptor-Antagonisten ab. Wenn ein intestinales Angioödem diagnostiziert wird, sollte Entresto abgesetzt und eine angemessene Überwachung eingeleitet werden, bis die Symptome vollständig verschwunden sind.
Patienten mit Nierenarterienstenose
Ähnlich wie andere Arzneimittel, die das Renin-Angiotensin-Aldosteron-System beeinflussen, kann Entresto bei Patienten mit beidseitiger oder einseitiger Nierenarterienstenose den Blutharnstoff und den Serumkreatininspiegel erhöhen. Bei Patienten mit Nierenarterienstenose ist Vorsicht angezeigt, und eine Überwachung der Nierenfunktion wird empfohlen
Biomarker
Bei mit Entresto behandelten Patienten ist das natriuretische Peptid Typ B (BNP) kein geeigneter Biomarker für Herzinsuffizienz, da BNP ein Neprilysinsubstrat ist (siehe «Eigenschaften/Wirkungen»).
Die durch Entresto erzeugte Wirkung der Neprilysin-Inhibition auf die Expression von CD10 in normalen und neoplastischen Zellen wurde nicht untersucht und ist nicht bekannt.
Psychiatrische Störungen
Psychiatrische Ereignisse wie Halluzinationen, Paranoia und Schlafstörungen, im Zusammenhang mit psychotischen Ereignissen, wurden mit der Anwendung von Sacubitril/Valsartan in Verbindung gebracht. Wenn ein Patient solche Ereignisse wahrnimmt, sollte ein Abbruch der Behandlung mit Sacubitril/Valsartan erwogen werden.
Diese Arzneimittel enthält weniger als 1 mmol Natrium (23mg) pro 97/103mg Dosis, d.h. es ist nahezu «natriumfrei».
Interaktionen
Erwartete Wechselwirkungen, die in einer Kontraindikation resultieren
ACE-Hemmer: Die gleichzeitige Anwendung von Entresto mit ACE-Hemmern ist kontraindiziert, da die gleichzeitige Hemmung von Neprilysin (NEP) und eine ACE-Hemmer-Therapie das Angioödem-Risiko erhöhen können. Eine Behandlung mit Entresto darf frühestens 36 Stunden nach Einnahme der letzten Dosis einer ACE-Hemmer-Therapie eingeleitet werden. Eine Behandlung mit einem ACE-Hemmer darf frühestens 36 Stunden nach der letzten Dosis von Entresto eingeleitet werden (siehe «Kontraindikationen» und «Dosierung/Anwendung»).
Aliskiren: Die gleichzeitige Anwendung von Entresto und Aliskiren ist bei Patienten mit Diabetes mellitus oder bei Patienten mit eingeschränkter Nierenfunktion (eGFR < 60 ml/min/1,73 m2) kontraindiziert (siehe «Kontraindikationen» und «Warnhinwiese und Vorsichtsmassnahmen»).
Erwartete Wechselwirkungen, die darin resultieren, dass eine gleichzeitige Anwendung nicht empfohlen wird
Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Zu berücksichtigende beobachtete Wechselwirkungen
Statine: In-vitro-Daten lassen darauf schliessen, dass Sacubitril die Transporter OATP1B1 und OATP1B3 hemmt. Daher kann Entresto die systemische Exposition gegenüber OATP1B1- und OATP1B3-Substraten wie Statinen erhöhen.
Die gleichzeitige Anwendung von Entresto erhöhte Cmax von Atorvastatin und seiner Metaboliten um das bis zu Zweifache und die AUC um das bis zu 1,3-Fache. Bei einer gleichzeitigen Anwendung von Entresto mit Statinen ist mit Vorsicht vorzugehen. Keine klinisch relevante Arzneimittelwechselwirkung wurde bei der gleichzeitigen Verabreichung von Entresto und Simvastatin beobachtet.
Sildenafil: Eine zusätzliche Einmalgabe von Sildenafil zu Entresto im Steady-state bei Patienten mit Hypertonie ging mit einer stärkeren Blutdrucksenkung einher als die Verabreichung von Entresto allein. Daher ist bei Einleitung einer Therapie mit Sildenafil oder einem anderen PDE-5-Hemmer bei Patienten unter Entresto Vorsicht geboten.
Zu berücksichtigende erwartete Wechselwirkungen
Kalium: Die gleichzeitige Anwendung von kaliumsparenden Diuretika (z.B. Triamteren, Amilorid), Mineralokortikoid-Antagonisten (z.B. Spironolacton, Eplerenon), Kaliumergänzungen oder einer kaliumhaltigen Salzsubstitution kann zu einem Anstieg des Serumkaliums und des Serumkreatinins führen. Bei einer gleichzeitigen Verabreichung von Entresto mit diesen Substanzen wird eine Überwachung des Serumkaliums empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nicht-steroidale anti-inflammatorische Arzneimittel (NSAIDs) einschliesslich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer): Bei älteren Patienten, Patienten mit Volumendepletion (einschliesslich Patienten unter Diuretika) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von Entresto und NSAR zu einem erhöhten Risiko einer Verschlechterung der Nierenfunktion führen. Daher wird bei der Einleitung oder Anpassung einer Behandlung bei Patienten unter Entresto, die gleichzeitig mit NSAIDs behandelt werden, eine Überwachung der Nierenfunktion empfohlen.
Lithium: Das Potenzial für eine Wechselwirkung zwischen Entresto und Lithium wurde nicht untersucht. Unter der gemeinsamen Verabreichung von Lithium und ACE-Hemmern oder Angiotensin-II-Rezeptor-Antagonisten wurde ein reversibler Anstieg der Lithium-Serumspiegel und Toxizität beschrieben. Daher wird während einer gleichzeitigen Anwendung mit Entresto eine sorgfältige Überwachung des Lithium-Serumspiegels empfohlen. Wird zudem ein Diuretikum angewendet, kann das Risiko für eine Lithiumtoxizität weiter erhöht sein.
Transporter: Der aktive Metabolit von Sacubitril (LBQ657) und von Valsartan sind OATP1B1-, OATP1B3-, OAT1- und OAT3-Substrate; Valsartan ist darüber hinaus ein MRP2-Substrat. Daher kann die gleichzeitige Verabreichung von Entresto mit Inhibitoren von OATP1B1, OATP1B3, OAT3 (z.B. Rifampicin/ Rifampin, Cyclosporin), OAT1 (z.B. Tenofovir, Cidofovir) oder MRP2 (z.B. Ritonavir) die systemische Exposition gegenüber LBQ657 bzw. Valsartan erhöhen. Bei der Einleitung oder Beendigung einer gleichzeitigen Behandlung mit diesen Wirkstoffen ist mit entsprechender Vorsicht vorzugehen.
Keine signifikanten Wechselwirkungen
Keine klinisch bedeutsamen Arzneimittel-Wechselwirkungen wurden bei gleichzeitiger Verabreichung von Entresto und Furosemid, Digoxin, Warfarin, Hydrochlorothiazid, Amlodipin, Metformin, Omeprazol, Carvedilol, intravenösem Nitroglycerin oder Levonorgestrel/Ethinylestradiol in Kombination beobachtet. Wechselwirkungen mit Atenolol, Indomethacin, Glyburid oder Cimetidin sind nicht zu erwarten.
CYP-450-bezogene Wechselwirkungen: In-vitro-Stoffwechselstudien lassen darauf schliessen, dass das Potenzial für CYP-450-basierte Arzneimittel-Wechselwirkungen aufgrund der begrenzten Metabolisierung von Entresto über CYP-450-Enzyme gering ist. CYP-450-Enzyme werden durch Entresto weder induziert noch inhibiert.
Schwangerschaft, Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung mit Entresto sowie bis eine Woche nach der letzten Dosis eine Verhütungsmethode anwenden.
Schwangerschaft
Ebenso wie andere Wirkstoffe, die direkt auf das RAAS wirken, darf Entresto während der Schwangerschaft nicht angewendet werden (siehe «Kontraindikationen»). Entresto wirkt unter anderem über einen Angiotensin-II-Antagonismus; daher kann ein Risiko für den Fetus nicht ausgeschlossen werden. Für die Einnahme von Valsartan während der Schwangerschaft liegen Berichte über Schädigungen des sich entwickelnden Fetus (z.B. Spontanabort, Oligohydramnie und Nierenfunktionsstörungen beim Neugeborenen) vor. In einigen tierexperimentellen Studien wurde Reproduktionstoxizität beobachtet (siehe «Präklinische Daten»). Wird während der Therapie eine Schwangerschaft nachgewiesen, ist Entresto so rasch wie möglich abzusetzen.
Stillzeit
Begrenzte Daten zeigen, dass Sacubitril und sein aktiver Metabolit LBQ657 in sehr geringen Mengen in die Muttermilch ausgeschieden werden, mit einer geschätzten relativen Säuglingsdosis von 0,01 % für Sacubitril und 0,46 % für den aktiven Metaboliten LBQ657, wenn sie stillenden Frauen in einer Dosis von 24 mg/26 mg Sacubitril/ Valsartan zweimal täglich verabreicht wurden. Bei denselben Daten lag Valsartan unter der Nachweisgrenze. Es gibt nur ungenügende Informationen darüber, ob Sacubitril/Valsartan Auswirkungen auf Neugeborene/Kinder hat. Aufgrund des möglichen Risikos für Nebenwirkungen bei gestillten Neugeborenen/Kindern wird Entresto für stillende Frauen nicht empfohlen.
Die Bestandteile von Entresto, Sacubitril und Valsartan, wurden über die Milch laktierender Ratten ausgeschieden (siehe «Präklinische Daten»).
Fertilität
Über die Wirkung von Entresto auf die menschliche Fertilität liegen keine Daten vor. In Untersuchungen mit Entresto an männlichen und weiblichen Ratten wurde keine Beeinträchtigung der Fertilität nachgewiesen (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt. Beim Führen von Fahrzeugen und Bedienen von Maschinen wird zur Vorsicht geraten, da durch die Einnahme des Präparates Schwindelgefühl und Müdigkeit auftreten können.
Unerwünschte Wirkungen
Die Sicherheit von Entresto bei erwachsenen Patienten mit chronischer Herzinsuffizienz wurde in der pivotalen Phase-3-Studie PARADIGM-HF beurteilt, bei der zweimal täglich mit Entresto 200 mg (n=4.203) oder Enalapril 10 mg (n=4.229) behandelte Patienten verglichen wurden. Die Patienten, die Entresto erhielten, wurden über bis zu 4,3 Jahre mit einer medianen Expositionsdauer von 24 Monaten behandelt; 3271 Patienten wurden länger als ein Jahr behandelt.
Zu einem Absetzen der Therapie aufgrund einer unerwünschten Wirkung während der Doppelblindphase der Studie PARADIGM-HF kam es bei 450 Patienten unter Entresto (10,71 %) und bei 516 Patienten unter Enalapril (12,20 %). Die am häufigsten mit einer Dosisanpassung oder einer Behandlungsunterbrechung im Zusammenhang stehenden Ereignisse waren Hypotonie, Hyperkaliämie und eingeschränkte Nierenfunktion.
Die Gesamtinzidenz unerwünschter Arzneimittelwirkungen (UAW) von Entresto bei Patienten mit Herzinsuffizienz war mit derjenigen von Enalapril vergleichbar. Das Muster der UAW steht im Einklang mit den pharmakologischen Eigenschaften von Entresto und den Grunderkrankungen der Patienten.
Die Gesamthäufigkeit der unerwünschten Wirkungen war unabhängig von Geschlecht, Alter oder ethnischer Zugehörigkeit.
Die unerwünschten Arzneimittelwirkungen sind nach Systemorganklasse und dann entsprechend ihrer Häufigkeit – die am häufigsten auftretenden zuerst – gemäss der folgenden Konvention aufgeführt: Sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1'000, < 1/100); selten (≥1/10'000, < 1/1'000), sehr selten (< 1/10'000), einschliesslich Einzelberichten. Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen in absteigender Reihenfolge des Schweregrads angegeben.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anämie
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hyperkaliämie
Häufig: Hypokaliämie, Hypoglykämie
Gelegentlich: Hyponatriämie
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerz
Gelegentlich: Schwindel orthostatisch
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo
Gefässerkrankungen
Sehr häufig: Hypotonie
Häufig: Synkope, Hypotonie orthostatisch
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten
Erkrankungen des Gastrointestinaltrakts
Häufig: Durchfall, Übelkeit
Sehr selten: intestinales Angioödem
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Angioödeme, Pruritus, Hautausschlag
Erkrankungen der Nieren und Harnwege
Sehr häufig: Eingeschränkte Nierenfunktion
Häufig: Nierenversagen (Niereninsuffizienz, akutes Nierenversagen)
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit (inkl. Anaphylaxie)
Psychiatrische Erkrankungen
Selten: Halluzinationen und Schlafstörung
Sehr selten: Paranoia
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Ermüdung, Asthenie
Tabelle 2 Unerwünschte Arzneimittelwirkungen in der Studie PARADIGM-HF, Sicherheitspopulation
|
Unerwünschte Arzneimittelwirkungen |
Entresto 200 mg zweimal täglich (%)* |
Enalapril |
Häufigkeits-kategorie | |
|
Erkrankungen des Blutes und des Lymphsystems | ||||
|
Anämie |
4,00 |
4,75 |
Häufig | |
|
Stoffwechsel- und Ernährungsstörungen | ||||
|
Hyperkaliämie** |
11,61 |
14,00 |
Sehr häufig | |
|
Hypokaliämie |
3,31 |
2,53 |
Häufig | |
|
Erkrankungen des Nervensystems | ||||
|
Schwindel |
6,33 |
4,87 |
Häufig | |
|
Schwindel orthostatisch |
0,57 |
0,28 |
Gelegentlich | |
|
Kopfschmerz |
2,45 |
2,51 |
Häufig | |
|
Erkrankungen des Ohrs und des Labyrinths | ||||
|
Vertigo |
1,45 |
1,40 |
Häufig | |
|
Gefässerkrankungen | ||||
|
Hypotonie |
17,61 |
11,97 |
Sehr häufig | |
|
Synkope |
2,24 |
2,70 |
Häufig | |
|
Hypotonie orthostatisch |
1,52 |
0,80 |
Häufig | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | ||||
|
Husten |
8,78 |
12,60 |
Häufig | |
|
Erkrankungen des Gastrointestinaltrakts | ||||
|
Durchfall |
4,62 |
4,47 |
Häufig | |
|
Übelkeit |
2,09 |
2,36 |
Häufig | |
|
Erkrankungen der Haut und des Unterhautzellgewebes | ||||
|
Angioödeme |
0,45 |
0,24 |
Gelegentlich | |
|
Erkrankungen der Nieren und Harnwege | ||||
|
Eingeschränkte Nierenfunktion |
10,14 |
11,52 |
Sehr häufig | |
|
Nierenversagen |
4,76 |
5,30 |
Häufig | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | ||||
|
Ermüdung |
2,97 |
3,05 |
Häufig | |
|
Asthenie |
2,09 |
1,84 |
Häufig | |
* Sicherheitspopulation
** Mit Hyperkaliämien assoziierte unerwünschte Ereignisse wurden bei 11,9 % der mit Entresto behandelten Patienten gegenüber 14,3 % der mit Enalapril behandelten Patienten berichtet (s. «Warnhinweisen und Vorsichtsmassnahmen»).
Kognitive Funktion
Neprilysin ist eines von zahlreichen Enzymen, die an der Clearance von Amyloid-β (Aβ) aus dem Gehirn und der Zerebrospinalflüssigkeit (ZSF) beteiligt sind. Die Verabreichung von 400 mg Entresto einmal täglich über 2 Wochen an gesunde Probanden zeigte keine Veränderungen der Konzentration von Aβ 1-40 und 1-42 in der ZSF, ging allerdings mit einem Anstieg von Aβ 1-38 in der ZSF im Vergleich zum Placebo einher. Die klinische Relevanz dieser Befunde ist nicht bekannt (siehe «Eigenschaften/Wirkungen»). In der Studie PARADIGM-HF erwies sich die Gesamtinzidenz von unerwünschten Ereignissen in Zusammenhang mit Demenz als niedrig und vergleichbar zwischen den Behandlungsgruppen (0.3% in der Gruppe mit Entresto und 0.4% in jener mit Enalapril). Patienten mit MCI (mild cognitive impairment) oder mit vorbestehender Demenz wurden nicht gesondert untersucht.
Die potenzielle Wirkung von Entresto auf die kognitive Funktion und die Amyloid-β-Ablagerung im Gehirn wurde in Studien an Patienten mit Herzinsuffizienz evaluiert. Diese Studien zeigten keinen Hinweis auf ein erhöhtes Risiko einer kognitiven Beeinträchtigung mit Entresto. Die Post-Marketing-Daten stimmten mit den klinischen Studiendaten überein.
Pädiatrische Population
In der PANORAMA-HF-Studie wurde die Sicherheit von Sacubitril/Valsartan in einer randomisierten, aktiv kontrollierten, 52-wöchigen Studie mit 375 pädiatrischen Patienten mit Herzinsuffizienz im Alter von 1 Monat bis < 18 Jahren im Vergleich zu Enalapril untersucht. Die 215 Patienten, die in die offene Langzeit-Verlängerungsstudie (PANORAMA-HF OLE) aufgenommen wurden, wurden im Median 2,5 Jahre lang und insgesamt bis zu 4,5 Jahre lang behandelt. Das in beiden Studien beobachtete Sicherheitsprofil war ähnlich wie das bei erwachsenen Patienten. Sicherheitsdaten bei Patienten im Alter von 1 Monat bis < 1 Jahr waren begrenzt.
Bei pädiatrischen Patienten mit mittelschwerer Leberfunktionsstörung oder mittelschwerer bis schwerer Nierenfunktionsstörung liegen begrenzte Sicherheitsdaten vor.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Für den Menschen liegen begrenzte Daten über eine Überdosierung von Entresto bei Probanden vor. Bei gesunden erwachsenen Freiwilligen wurde die einmalige Anwendung von 1200 mg und die wiederholte Anwendung von 900 mg (14 Tage) Entresto untersucht. Die Anwendungen wurden gut vertragen.
Aufgrund der blutdrucksenkenden Wirkung von Entresto ist Hypotonie das wahrscheinlichste Symptom einer Überdosierung. Eine symptomatische Behandlung ist einzuleiten.
Aufgrund der weitreichenden Proteinbindung ist eine Entfernung von Entresto durch Hämodialyse unwahrscheinlich.
Eigenschaften/Wirkungen
ATC-Code
C09DX04
Wirkungsmechanismus
Entresto enthält einen Salzkomplex, bestehend aus Sacubitril und Valsartan. LBQ657 ist der aktive Metabolit von Sacubitril und hemmt Neprilysin (neutrale Endopeptidase, NEP). Valsartan blockiert den Angiotensin-II-Typ-1 (AT1) Rezeptor. Die Kombination dieser beiden Hemmer wird als Angiotensin-Rezeptor-Neprilysin-Hemmer (ARNI) bezeichnet.
Die kardiovaskulären und die renalen Wirkungen von Entresto bei Patienten mit Herzinsuffizienz werden auf einen dualen Wirkmechanismus zurückgeführt: Einerseits kommt es über eine Hemmung des Abbaus zu einer Anreicherung von Peptiden (etwa natriuretische Peptide, NP) durch den Neprilysin-Hemmer LBQ657 und anderseits, durch Valsartan, zur gleichzeitigen Hemmung der schädlichen Wirkungen von Angiotensin II. NP wirken über eine Aktivierung der membrangebundenen Guanylylcyclase-gekoppelten Rezeptoren, was zu erhöhten Konzentrationen von zyklischem Guanosinmonophosphat (cGMP) als «second messenger» führt. Dies wiederum fördert eine Vasodilatation, Natriurese und Diurese, erhöht die glomeruläre Filtrationsrate und renale Durchblutung, hemmt die Renin- und Aldosteronfreisetzung, senkt die Sympathikusaktivität und induziert antihypertrophe und antifibrotische Wirkungen. Eine anhaltende Aktivierung des Renin-Angiotensin-Aldosteron-Systems führt zu Vasokonstriktion, renaler Natrium- und Flüssigkeitsretention, einer Aktivierung von Zellwachstum und -proliferation sowie in der Folge zu maladaptiven kardiovaskulären Remodeling-Prozessen. Valsartan hemmt die schädlichen kardiovaskulären und renalen Wirkungen von Angiotensin II durch selektive Blockade des AT1-Rezeptors und hemmt ausserdem die Angiotensin-II-abhängige Aldosteronfreisetzung.
Pharmakodynamik
Die pharmakodynamischen Wirkungen von Entresto wurden nach einmaliger und wiederholter Verabreichung bei gesunden Probanden und bei Patienten mit Herzinsuffizienz untersucht. Sie sind konsistent mit einer gleichzeitigen Neprilysinhemmung und RAAS-Blockade. Im Rahmen einer siebentägigen Valsartan-kontrollierten Studie bei Patienten mit verminderter Auswurffraktion (HFrEF) führte Entresto im Vergleich zu Valsartan zu einem signifikanten, nicht nachhaltigen Anstieg der Natriurese, erhöhtem cGMP im Urin und vermindertem MR-proANP und NT-proBNP im Plasma. Im Rahmen einer 21-tägigen Studie mit HFrEF-Patienten erhöhte Entresto verglichen mit Baseline das ANP und cGMP im Urin und das cGMP im Plasma und senkte das NT-proBNP, Aldosteron und Endothelin-1 im Plasma. Darüber hinaus blockierte Entresto den AT1-Rezeptor, was durch eine erhöhte Plasma-Renin-Aktivität und erhöhte Renin-Plasmaspiegel nachgewiesen wurde. Im Rahmen der Studie PARADIGM-HF senkte Entresto im Vergleich zu Enalapril das NT-proBNP im Plasma und erhöhte das BNP im Plasma und das cGMP im Urin. In der PANORAMA-HF-Studie wurde in den Wochen 4 und 12 für Sacubitril/Valsartan (40,2 % und 49,8 %) und Enalapril (18,0 % und 44,9 %) ein Rückgang des NT proBNP im Vergleich zum Ausgangswert beobachtet. Die NT proBNP-Werte sanken während der gesamten Studiendauer weiter, wobei in Woche 52 im Vergleich zum Ausgangswert ein Rückgang von 65,1 % für Sacubitril/Valsartan und 61,6 % für Enalapril zu verzeichnen war. Während es sich bei BNP um ein Neprilysinsubstrat handelt, ist dies bei NT-proBNP nicht der Fall.
BNP ist deshalb kein geeigneter Biomarker für Herzinsuffizienz bei mit Entresto behandelten Patienten (siehe «Warnhinweise und Vorsichtsmassnahmen»). NT-proBNP ist kein Neprilysin Substrat und ist daher besser als Biomarker geeignet.
In einer speziell dafür geplanten klinischen Studie mit gesunden männlichen Probanden zeigte die einmalige Verabreichung von 400 mg und 1200 mg Entresto keinerlei Wirkungen auf die kardiale Repolarisation.
Neprilysin ist eines von zahlreichen Enzymen, die an der Clearance von Amyloid-β (Aβ) aus dem Gehirn und der Zerebrospinalflüssigkeit (ZSF) beteiligt sind. Die Verabreichung von 400 mg Entresto einmal täglich über 2 Wochen an gesunde Probanden zeigte keine Veränderungen der Konzentration von Aβ 1-40 und Aβ 1-42 in der ZSF, ging allerdings mit einem Anstieg von Aβ 1-38 in der ZSF im Vergleich zu Placebo einher. Die klinische Bedeutung dieser Befunde ist nicht bekannt (siehe «Präklinische Daten»), da strukturelle und funktionelle Veränderungen im ZNS nicht untersucht wurden. Eine Studie an Patienten mit Herzinsuffizienz wird potenzielle Wirkungen von Entresto auf die kognitive Funktion und Amyloid-β-Ablagerung im Gehirn untersuchen.
Klinische Wirksamkeit
PARADIGM-HF
Bei PARADIGM-HF handelte es sich um eine multinationale, randomisierte Doppelblindstudie mit 8'442 Patienten, bei der Entresto mit Enalapril verglichen wurde. Die Arzneimittel wurden erwachsenen Patienten mit chronischer Herzinsuffizienz (NYHA-Klasse II – IV) und systolischer Dysfunktion (linksventrikuläre Auswurffraktion ≤40 %) zusätzlich zu anderen Therapien (>90% Betablocker, ca 80% Diuretika, ca. 50% Mineralokortikoidantagonisten) bei Herzinsuffizienz verabreicht. Der zusammengesetzte primäre Endpunkt bestand aus kardiovaskulär (KV) bedingtem Tod oder Hospitalisation aufgrund einer Herzinsuffizienz (HF).
Vor der Studienteilnahme waren die Patienten durch eine Therapie entsprechend dem Versorgungsstandard, u.a. mit ACE-Hemmern/ARB (> 99 %), Betablockern (94 %), Mineralokortikoidantagonisten (58 %) und Diuretika (83 %), gut eingestellt. Die mediane Beobachtungsdauer betrug 27 Monate, und die Patienten wurden über maximal 4,3 Jahre behandelt. Patienten mit einem systolischen BD <100mmHg wurden nicht in die Studie aufgenommen.
Die Patienten mussten ihre bestehende ACE-Hemmer- oder ARB-Therapie absetzen und wurden in eine sequenzielle, einfach verblindete Run-in-Phase eingeschlossen, während der sie mit Enalapril 10 mg zweimal täglich behandelt wurden. Die Anschlussbehandlung erfolgte mit einer Dosis von 100 mg Entresto zweimal täglich, die nach 1 bis 2 Wochen auf 200 mg zweimal täglich erhöht wurde. Patienten, die die Run-in-Behandlungen gut vertragen haben, wurden anschliessend randomisiert zu Entresto oder zu Enalapril. In der Doppelblindphase der Studie erhielten die Patienten 200 mg Entresto oder 10 mg Enalapril je zweimal täglich [Entresto (n=4'209); Enalapril (n=4'233)].
Das Durchschnittsalter des untersuchten Patientenkollektivs betrug 64 Jahre; 19 % waren 75 Jahre oder älter. Bei der Randomisierung wurden 70 % der Patienten in NYHA-Klasse II und 25 % in Klasse III/IV eingestuft.
In der Gruppe unter Entresto erhielten 76 % der Patienten bis zum Ende der Studie die angestrebte Dosis von 200 mg zweimal täglich (mittlere Tagesdosis 375 mg). In der Gruppe unter Enalapril erhielten 75 % der Patienten bis zum Ende der Studie die angestrebte Dosis von 10 mg zweimal täglich (mittlere Tagesdosis 18,9 mg).
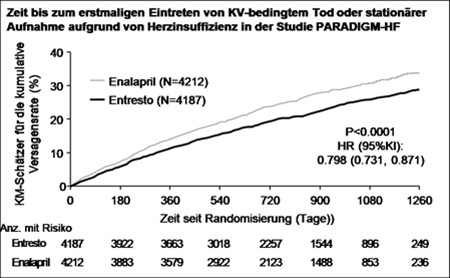
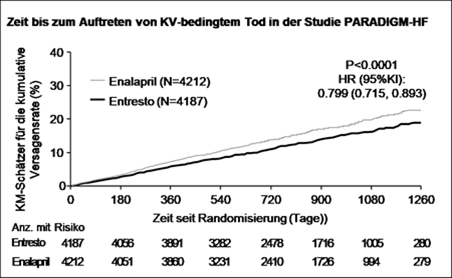
Entresto senkte gegenüber Enalapril statistisch signifikant das Risiko für kardiovaskulären Tod bzw. eine stationäre Aufnahme aufgrund von Herzinsuffizienz um 20 % (Hazard Ratio [HR]: 0,80, 95-%-KI [0,73 - 0,87]. Die absolute Risikoreduktion betrug 4,69 %. Diese Wirkung wurde frühzeitig beobachtet und wurde über die Dauer der Studie aufrechterhalten. Es wurde ein statistisch signifikanter Rückgang der kardiovaskulär-bedingten Todesfälle und der ersten Herzinsuffizienz-bedingten stationären Aufnahme beobachtet (KV-bedingter Tod: RRR 20 %, HR 0,80; 95-%-KI [0,71 - 0,89],3.13% absolute Risikoreduktion; Herzinsuffizienz-bedingte stationäre Aufnahme: RRR 21 %; HR 0,79; 95-%-KI [0,71 - 0,89], absolute Risikoreduktion 2.80%); siehe Tabelle 3. Plötzlicher Herztod war die Ursache bei 45 % der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 20 % gesenkt (HR 0,80;95% KI [0,68; 0,94]). Ein Ausfall der Pumpfunktion war die Ursache bei 26 % der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 21 % gesenkt (HR 0,79; 95% KI [0,64; 0,98]).
Diese Risikoreduktion wurde in verschiedenen Untergruppen, u.a. bezüglich Alter, Geschlecht, ethnischer Zugehörigkeit, geografischer Herkunft, NYHA-Klasse, Auswurffraktion, Nierenfunktion, Diabetes oder Hypertonie in der Anamnese, frühere Behandlung bei Herzinsuffizienz und Vorhofflimmern, übereinstimmend beobachtet.
Darüber hinaus senkte Entresto im Vergleich zu Enalapril signifikant die Gesamtsterblichkeit um 16 % (RRR 16 %, HR 0,84; 95-%-KI [0,76 - 0,93]) (Tabelle 3). Die absolute Risikoreduktion betrug 2,84 %.
Tabelle 3 Behandlungswirkung auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Gesamtsterblichkeit
|
|
Entresto |
Enalapril |
Hazard Ratio (95-%-KI) |
Relative Risiko-reduktion |
Absolute Risiko-reduktion |
|
Zusammengesetzter primärer Endpunkt bestehend aus KV-bedingtem Tod und stationärer Aufnahme aufgrund von Herzinsuffizienz* |
914 (21,83) |
1'117 (26,52) |
0,80 (0,73 - 0,87) |
20 % |
4,69% |
|
Einzelne Komponenten des zusammengesetzten primären Endpunkts | |||||
|
KV-bedingter Tod ** |
558 (13,33) |
693 (16,45) |
0,80 (0,71 - 0,89) |
20 % |
3,13% |
|
Erste stationäre Aufnahme aufgrund von Herzinsuffizienz |
537 (12,83) |
658 (15,62) |
0,79 (0,71 - 0,89) |
21 % |
2,80% |
|
Sekundärer Endpunkt | |||||
|
Gesamtsterblichkeit |
711 (16,98) |
835 (19,82) |
0,84 (0,76 - 0,93) |
16 % |
2,84% |
*Der primäre Endpunkt war als Zeit bis zum ersten Ereignis definiert.
** KV-bedingte Todesfälle beinhalteten alle Patienten, die bis zum Stichtag unabhängig von einer früheren stationären Aufnahme verstarben.
# Vollständige Analysepopulation
Abbildung 1 Kaplan-Meier-Kurven für den zusammengesetzten primären Endpunkt und die Komponente «KV-bedingter Tod»
Eine geringere Anzahl von Patienten zeigte laut Beurteilung anhand des KCCQ-Fragebogens (Kansas City Cardiomyopathy Questionnaire) im Vergleich zu Enalapril eine Verschlechterung der HF-Symptome, einschliesslich Dyspnoe und Erschöpfung und körperlicher Einschränkungen.
PANORAMA-HF
PANORAMA-HF, eine Phase-3-Studie, war eine multinationale, randomisierte, doppelblinde Studie zum Vergleich von Sacubitril/Valsartan und Enalapril bei 375 pädiatrischen Patienten im Alter von 1 Monat bis < 18 Jahren mit Herzinsuffizienz aufgrund einer systemischen linksventrikulären systolischen Dysfunktion (links-ventrikuläre Auswurffraktion (Left Ventricular Ejection Fraction, LVEF) ≤45 % oder fraktioneller Verkürzung ≤22,5 %). Das primäre Ziel bestand darin, festzustellen, ob Sacubitril/Valsartan bei pädiatrischen Patienten mit Herzinsuffizienz über eine Behandlungsdauer von 52 Wochen auf der Grundlage eines «Global Rank»-Endpunkts Enalapril überlegen war. Der primäre «Global Rank»-Endpunkt wurde durch eine Rangfolge der Patienten (schlechtestes bis bestes Ergebnis) auf der Grundlage von klinischen Ereignissen wie Tod, Einleitung mechanischer Lebenserhaltung, Einstufung für eine dringende Herztransplantation, Verschlechterung der Herzinsuffizienz, Messungen der funktionellen Kapazität (NYHA/ROSS-Scores) und von den Patienten berichtete HF-Symptome (auf der Patient Global Impression of Severity [PGI-S]) abgeleitet. Patienten mit systemischen rechten Ventrikeln oder Einzelventrikeln und Patienten mit restriktiver oder hypertropher Kardiomyopathie wurden von der Studie ausgeschlossen. Die angestrebte Erhaltungsdosis von Sacubitril/Valsartan betrug 2,3 mg/kg Körpergewicht zweimal täglich bei pädiatrischen Patienten im Alter von 1 Monat bis < 1 Jahr und 3,1 mg/kg Körpergewicht zweimal täglich bei Patienten im Alter von 1 bis < 18 Jahren mit einer Höchstdosis von 200 mg zweimal täglich. Die angestrebte Erhaltungsdosis von Enalapril betrug 0,15 mg/kg Körpergewicht zweimal täglich bei pädiatrischen Patienten im Alter von 1 Monat bis < 1 Jahr und 0,2 mg/kg Körpergewicht zweimal täglich bei Patienten im Alter von 1 bis < 18 Jahren mit einer Höchstdosis von 10 mg zweimal täglich.
In der Studie waren 9 Patienten 1 Monat bis < 1 Jahr alt, 61 Patienten waren 1 Jahr bis < 2 Jahre alt, 85 Patienten waren 2 bis < 6 Jahre alt und 220 Patienten waren 6 bis < 18 Jahre alt. Zu Studienbeginn gehörten 15,7 % der Patienten zur NYHA/ROSS-Klasse I, 69,3 % zur Klasse II, 14,4 % zur Klasse III und 0,5 % zur Klasse IV. Die mittlere LVEF betrug 32 %. Die häufigste Ursache für die Herzinsuffizienz war eine Kardiomyopathie (63,5 %). Vor der Teilnahme an der Studie wurden die Patienten am häufigsten mit ACE-Hemmern/Angiotensin-Rezeptor-Blockern (ARB) (93 %), Betablockern (70 %), Aldosteron-Antagonisten (70 %) und Diuretika (84 %) behandelt.
Die Mann-Whitney-Odds für den primären «Global Rank»-Endpunkt lagen bei 0,907 (p=0,424) und damit numerisch zugunsten von Sacubitril/Valsartan (siehe Tabelle 4). Sacubitril/Valsartan und Enalapril zeigten vergleichbare klinisch relevante Verbesserungen bei den sekundären Endpunkten NYHA/ROSS-Klasse und PGIS-Score-Veränderung im Vergleich zum Ausgangswert. In Woche 52 waren die Veränderungen der NYHA/ROSS-Funktionsklasse gegenüber dem Ausgangswert bei Sacubitril/Valsartan und Enalapril Folgende: verbessert bei 37,7 % bzw. 34,0 %, unverändert bei 50,6 % bzw. 56,6 % und verschlechtert bei 11,7 % bzw. 9,4 % der Patienten. In ähnlicher Weise verhielten sich die Veränderungen des PGIS-Scores gegenüber dem Ausgangswert: verbessert bei 35,5 % und 34,8 %; unverändert bei 48,0 % und 47,5 %; verschlechtert bei 16,5 % und 17,7 % der Patienten unter Sacubitril/Valsartan bzw. Enalapril. Das NT-proBNP wurde in beiden Behandlungsgruppen gegenüber dem Ausgangswert erheblich gesenkt. Das Ausmass der NT-proBNP-Reduktion war vergleichbar mit dem, das bei erwachsenen Patienten mit Herzinsuffizienz in PARADIGM-HF beobachtet wurde. Da Sacubitril/Valsartan in der PARADIGM-HF-Studie die Behandlungsergebnisse verbesserte und das NT-proBNP reduzierte, wurde der Rückgang des NT-proBNP in Verbindung mit den in der PANORAMA-HF-Studie beobachteten symptomatischen und funktionellen Verbesserungen gegenüber dem Ausgangswert als vernünftige Grundlage für die Ableitung eines klinischen Nutzens bei Patienten mit pädiatrischer Herzinsuffizienz angesehen. Die Ergebnisse waren in allen Altersgruppen konsistent. Es nahmen zu wenige Patienten im Alter von unter 1 Jahr an der Studie teil, um die Wirksamkeit von Sacubitril/Valsartan in dieser Altersgruppe beurteilen zu können. Klinische Daten von pädiatrischen Patienten (PANORAMA-HF-Studie) ergaben keine Hinweise darauf, dass Entresto einen Einfluss auf Körpergewicht, Körpergrösse, Kopfumfang und Frakturrate hat. Die Knochendichte wurde in der Studie nicht gemessen. Langzeitdaten aus der PANORAMA-HF OLE-Studie ergaben keine Hinweise auf nachteilige Auswirkungen von Sacubitril/Valsartan auf das (Knochen-)Wachstum oder die Frakturrate.
Tabelle 4 Behandlungseffekt für den primären «Global Rank»-Endpunkt in der Studie PANORAMA-HF
|
|
Sacubitril/Valsartan N=187 |
Enalapril N=188 |
Behandlungseffekt |
|
Primärer «Global Rank»-Endpunkt |
% der Wins* |
% der Wins* |
Odds** (95% CI) |
|
52,4 |
47,6 |
0.907 (0,72; 1,14) p-Wert 0,424 |
*Der Prozentsatz der Wins wurde auf der Grundlage von Vergleichen des globalen Rank Scores für jeden Patienten der mit Sacubitril und Valsartan und mit Enalapril behandelten Patienten berechnet (jede höhere Punktzahl zählt als ein Win und jede gleiche Punktzahl zählt als ein halber Win).
** Die Mann-Whitney-Odds wurden berechnet, indem der Prozentsatz der Wins für Enalapril durch den Prozentsatz der Wins für Sacubitril/Valsartan geteilt wurde, mit Odds (Quoten) <1 zugunsten von Sacubitril/Valsartan und >1 zugunsten von Enalapril.
Pharmakokinetik
Absorption
Nach oraler Verabreichung spaltet sich Entresto in Sacubitril, das weiter zu LBQ657 verstoffwechselt wird, und in Valsartan auf. Die Spitzenplasmakonzentrationen werden nach 0,5 Stunden, 2 Stunden bzw. 1,5 Stunden erreicht. Die absolute orale Bioverfügbarkeit von Sacubitril und Valsartan wird auf ≥60 % bzw. 23 % geschätzt.
Das in Entresto enthaltene Valsartan weist eine höhere Bioverfügbarkeit als das Valsartan in anderen vermarkteten Tablettenformulierungen auf; 25.7 mg, 51.4 mg bzw. 102.8 mg Valsartan in Entresto entsprechen jeweils 40 mg, 80 mg bzw. 160 mg Valsartan in anderen auf dem Markt erhältlichen Tablettenformulierungen.
Nach zweimal täglicher Gabe von Entresto werden die Steady-state von Sacubitril, LBQ657 und Valsartan nach 3 Tagen erreicht. Im Steady-state kommt es zu keiner signifikanten Akkumulation von Sacubitril und Valsartan, während sich LBQ657 um das 1,6-Fache akkumuliert.
Die Verabreichung von Entresto mit Nahrung hat keine klinisch signifikanten Auswirkungen auf die systemische Exposition gegenüber Sacubitril, LBQ657 und Valsartan. Auch wenn es bei einer Verabreichung von Entresto mit Nahrung zu einer Verringerung der Exposition gegenüber Valsartan kommt, ist dieser Rückgang nicht mit einer klinisch signifikanten Minderung der therapeutischen Wirkung assoziiert. Entresto kann daher unabhängig von den Mahlzeiten verabreicht werden.
Distribution
Entresto bindet zu einem hohen Anteil an Plasmaproteine (94 % - 97 %). Ein Vergleich der Plasma- und ZSF-Exposition ergab, dass LBQ657 die Blut-Hirn-Schranke in begrenztem Ausmass (0,28 %) überwindet. Das scheinbare Verteilungsvolumen von Entresto liegt zwischen 107,8 l und 157,4 l.
Metabolismus
Sacubitril wird durch Esterasenaktivität rasch zu LBQ657 umgewandelt, wobei LBQ657 nicht in bedeutendem Umfang weiter metabolisiert wird. Valsartan wird minimal metabolisiert, da lediglich ca. 20 % der Dosis als Metaboliten wiedergewonnen werden. Im Plasma wurde ein Hydroxylmetabolit in geringer Konzentration (< 10 %) nachgewiesen. Da die Metabolisierung von Sacubitril und Valsartan nur zu einem geringen Teil über das CYP-450-Enzymsystem erfolgt, sind bei einer gleichzeitigen Verabreichung mit Wirkstoffen, die das CYP-450-Enzymsystem beeinflussen, keine Wirkungen auf die Pharmakokinetik zu erwarten.
Elimination
Nach oraler Verabreichung wird Sacubitril zu 52 - 68 % (hauptsächlich als LBQ657) und Valsartan und seine Metaboliten zu ~13 % über den Urin ausgeschieden; 37 - 48 % von Sacubitril (hauptsächlich LBQ657) und 86 % von Valsartan und seinen Metaboliten werden über die Fäzes ausgeschieden.
Sacubitril, LBQ657 und Valsartan werden aus dem Plasma mit einer mittleren Eliminationshalbwertzeit (T1/2) von ca. 1,43 Stunden, 11,48 Stunden bzw. 9,90 Stunden eliminiert.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Sacubitril, LBQ657 und Valsartan ist im untersuchten Dosierungsbereich (50 - 400 mg Entresto) linear.
Kinetik spezieller Patientengruppen
Ältere Patienten (über 65 Jahre)
Die LBQ657- und Valsartan-Exposition ist bei älteren Patienten im Vergleich zu jüngeren Patienten um 42 % bzw. 30 % erhöht. Allerdings ist diese Erhöhung nicht mit klinisch relevanten Wirkungen verbunden, und eine Dosisanpassung ist somit nicht erforderlich.
Kinder und Jugendliche (≥18 Jahre)
Die Pharmakokinetik von Sacubitril/Valsartan wurde bei pädiatrischen Patienten mit Herzinsuffizienz im Alter von 1 Monat bis < 1 Jahr und 1 Jahr bis < 18 Jahren untersucht und ergab, dass das pharmakokinetische Profil von Sacubitril/Valsartan bei pädiatrischen und erwachsenen Patienten ähnlich ist (siehe «Eigenschaften/Wirkungen»).
Eingeschränkte Nierenfunktion
Es wurde eine Korrelation zwischen der Nierenfunktion und der systemischen Exposition gegenüber LBQ657, nicht jedoch gegenüber Valsartan beobachtet. Bei Patienten mit leichter (60 mL/min/1.73 m2 ≤eGFR<90 mL/min/1.73 m2) bis mittelschwerer (30 ml/min/1,73 m2 ≤ eGFR < 60 ml/min/1,73 m2) Nierenfunktionsstörung war die AUC für LBQ657 um bis zu das 2-Fache erhöht. Bei Patienten mit leichten oder mässigen Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Eine Erhöhung der AUC für LBQ657 um das 2,7-Fache wurde bei Patienten mit schwerer Nierenfunktionsstörung beobachtet (eGFR <30ml/min/1,73m2). Bei diesen Patienten wird eine Initialdosis von 50 mg zweimal täglich empfohlen. Bei einer Verabreichung von Entresto bei diesen Patienten ist Vorsicht geboten.
Bei eGFR <10 ml/min/1,73m2 ist Entresto kontraindiziert (siehe «Kontraindikationen»).
Bei dialysepflichtigen Patienten wurden keine Untersuchungen durchgeführt. Da LBQ657 und Valsartan jedoch in hohem Masse an Plasmaproteine binden, ist eine effektive Entfernung durch Dialyse unwahrscheinlich.
Eingeschränkte Leberfunktion
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung war die Sacubitril-Exposition im Vergleich zu entsprechenden gesunden Probanden um das 1,5- bzw. 3,4-Fache, die LBQ657-Exposition um das 1,5- bzw. 1,9-Fache und die Valsartan-Exposition um das 1,2- bzw. 2,1-Fache erhöht. Bei der Verabreichung von Entresto an Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klassifikation A), einschliesslich Patienten mit Gallenobstruktionserkrankung, ist keine Dosisanpassung erforderlich. Für Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klassifikation B) wird aufgrund begrenzter klinischer Erfahrungen eine Initialdosis von 50 mg zweimal täglich empfohlen.
Entresto wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht. Daher wird die Anwendung bei Patienten mit schwerer Leberfunktionsstörung nicht empfohlen.
Ethnische Gruppen
Die Pharmakokinetik von Entresto (Sacubitril, LBQ657 und Valsartan) ist bei verschiedenen Rassen und ethnischen Gruppen (Weisse, Schwarze, Asiaten, Japanern und anderen) vergleichbar.
Geschlecht
Die Pharmakokinetik von Entresto (Sacubitril, LBQ657 und Valsartan) ist bei Männern und Frauen vergleichbar.
Präklinische Daten
Basierend auf den konventionellen Studien (inklusive Studien mit Sacubitril- und Valsartan-Komponenten und/oder Sacubitril/Valsartan) zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, zum kanzerogenen Potential und zur Fertilität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Kanzerogenität, Mutagenese und genetische Toxizität
Studien zur Kanzerogenität an Mäusen und Ratten mit Sacubitril und Valsartan ergaben für Entresto kein kanzerogenes Potenzial. Die untersuchten Sacubitril-Dosen (hohe Dosis 1'200 bzw. 400 mg/kg/Tag bei Mäusen bzw. Ratten) entsprachen dem ca. 29- bzw. 19-Fachen der empfohlenen Höchstdosis beim Menschen (MRHD) auf einer mg/m2-Basis. Die untersuchten Valsartan-Dosen (hohe Dosis 160 bzw. 200 mg/kg/Tag bei Mäusen bzw. Ratten) entsprachen dem ca. 4- bzw. 10-Fachen der empfohlenen Höchstdosis beim Menschen auf einer mg/m2-Basis.
In Studien zur Mutagenität (Ames-Test) und Klastogenität (Chromosomenaberration (humane periphere Blutlymphozyten oder CHO [Chinese hamster ovary]-Zellen in vitro und in vivo Mikrokern-Test) mit Entresto zeigten Sacubitril und Valsartan weder auf Gen- noch Chromosomenebene Wirkungen.
Fertilität, Reproduktion und Entwicklung
Entresto zeigte bei Ratten in einer Dosis von bis zu 150 mg/kg/Tag (≤1,0-fache bzw. ≤0,18-Fache der MRHD auf der Basis der Valsartan- bzw. LBQ657-AUC) keine Wirkungen auf die Fertilität oder die frühe embryonale Entwicklung.
Die Behandlung mit Entresto während der Organogenese führte zu einer erhöhten embryo-fetalen Letalität bei Ratten in Dosen ≥100 mg/kg/Tag [≤0,72-fache MRHD auf AUC-Basis] und bei Kaninchen in Dosen ≥10 mg/kg/Tag [2-fache bzw. 0,03-fache MRHD auf Basis der Valsartan- bzw. LBQ657-AUC]. Entresto ist basierend auf einer niedrigen Inzidenz fetaler Hydrozephalie assoziiert mit maternal toxischen Dosen, die bei Kaninchen unter Entresto in einer Dosis von ≥10 mg/kg/Tag beobachtet wurde, teratogen.
Bei Kaninchen führte eine Sacubitril-Behandlung assoziiert mit maternal toxischen Dosen (500 mg/kg/Tag; 5,7-fache MRHD auf Basis der LBQ657 AUC) während der Organogenese zu embryo-fetaler Letalität und embryo-fetaler Toxizität (geringeres fetales Körpergewicht und verzögerte fetale Ossifikation). Sacubitril wirkt bei Ratten und Kaninchen nicht teratogen. Bei mit Sacubitril behandelten Ratten gab es keine Hinweise auf eine embryo-fetale Toxizität oder Teratogenizität. Der embryo-fetale No-observed-adverse-effect level (NOAEL) betrug für Sacubitril bei Ratten mindestens 750 mg/kg/Tag und bei Kaninchen 200 mg/kg/Tag (2,2-fache MRHD auf Basis der LBQ657 AUC).
Studien zur prä- und postnatalen Entwicklung bei der Ratte mit Sacubitril in Dosen von bis zu 750 mg/kg/Tag [2,2-fache MRHD auf AUC-Basis] in Dosen von bis zu 600 mg/kg/Tag [0,86-fache MRHD auf AUC-Basis] lassen darauf schliessen, dass eine Behandlung mit Entresto während Organogenese, Trächtigkeit und Laktationsphase die Entwicklung und das Überleben der Nachkommen beeinflussen kann.
Weitere präklinische Ergebnisse
Sacubitril / Valsartan
Die Wirkungen von Entresto auf Amyloid-β-Konzentrationen in der Zerebrospinalflüssigkeit (ZSF) und in Hirngewebe wurden bei jungen (2 - 4 Jahre alten) Cynomolgus-Affen, die zwei Wochen lang mit Entresto (50 mg/kg/Tag) behandelt wurden, beurteilt. In dieser Studie zeigte Entresto bei Cynomolgus-Affen eine pharmakodynamische Wirkung auf die Aβ-Clearance aus der ZSF, was zu einem Anstieg von Aβ 1-40, 1-42 und 1-38 in der ZSF führte; ein entsprechender Anstieg der Aβ-Werte im Gehirn wurde nicht beobachtet. Darüber hinaus fand sich in einer Studie zur Toxikologie bei Cynomolgus-Affen, die über 39 Wochen mit 300 mg Entresto/kg/Tag behandelt wurden (resultierend in einer höheren systemischen Exposition als der mit 200mg BID beim Menschen erreichten), keine Amyloid-β-Akkumulierung im Gehirn.
Toxizitätsprüfungen mit juvenilen Tieren
Sacubitril
Bei mit Sacubitril behandelten juvenilen Ratten (postnatal, Tage 7-70) kam es zu einer verringerten altersbedingten Entwicklung der Knochenmasse und -verlängerung bei einer etwa 2-fachen AUC-Exposition gegenüber dem aktiven Metaboliten von Sacubitril, LBQ657, bei einer pädiatrischen klinischen Sacubitril/Valsartan-Dosis von 3,1 mg/kg zweimal täglich. Der Mechanismus für diese Ergbnisse bei juvenilen Ratten und folglich die Relevanz für die pädiatrische Population beim Menschen sind nicht bekannt. Eine Studie mit adulten Ratten zeigte eine nur minimale transiente Beeinträchtigung bei der Knochenmineraldichte; andere für das Knochenwachstum relevante Parameter wurden nicht beeinflusst, was darauf hindeutet, dass Sacubitril bei erwachsenen Patientenpopulationen unter normalen Bedingungen keine relevanten Auswirkungen auf die Knochen hat. Eine leichte vorübergehende Beeinträchtigung der frühen Phase der Frakturheilung bei Erwachsenen durch Sacubitril kann jedoch nicht ausgeschlossen werden.
Valsartan
Bei juvenilen Ratten, die mit Valsartan behandelt wurden (postnatal, Tage 7-70), führten bereits Dosen von 1 mg/kg/Tag (ungefähr das 0,2-fache der Valsartan-AUC-Exposition einer zweimal täglichen Dosis von 3,1 mg/kg Sacubitril/Valsartan) zu anhaltenden irreversiblen Nierenveränderungen, insbesondere kam es zu tubulärer Nephropathie (manchmal begleitet von tubulärer Epithelnekrose) und Beckendilatation. Diese Nierenveränderungen stellen eine erwartete übersteigerte pharmakologische Wirkung von Angiotensin-Converting-Enzym-Hemmern und Angiotensin-II-Typ-1-Blockern dar; solche Wirkungen werden beobachtet, wenn Ratten während der ersten 13 Lebenstage behandelt werden. Dieser Zeitraum deckt sich mit der 36. Schwangerschaftswoche beim Menschen, die sich beim Menschen gelegentlich auf bis zu 44 Wochen nach der Empfängnis erstrecken kann. Die funktionelle Reifung der Nieren ist ein fortlaufender Prozess innerhalb des ersten Lebensjahres beim Menschen. Daher kann eine klinische Relevanz bei Kindern unter 1 Jahr nicht ausgeschlossen werden, die präklinischen Daten deuten aber auf keine Sicherheitsbedenken für Kinder über 1 Jahr hin.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, vor Feuchtigkeit geschützt und nicht über 30 °C aufbewahren.
Arzneimittel für Kinder unerreichbar aufbewahren.
Spezielle Vorsichtsmassnahmen für die Entsorgung
Jedes nicht verwendete Produkt oder Abfallmaterial sollte entsprechend den lokalen Anforderungen fachgerecht entsorgt werden.
Zulassungsnummer
65673 (Swissmedic)
69255 (Swissmedic)
Packungen
Entresto 50 mg: Packungen à 28 und 56 Filmtabletten [B]
Entresto 100 mg: Packungen à 56 und 168 Filmtabletten[B]
Entresto 200 mg: Packungen à 56 und 168 Filmtabletten [B]
Entresto 6 mg/6 mg filmüberzogenes Granulat: Packungen à 60 Kapseln [B]
Entresto 15 mg/16 mg filmüberzogenes Granulat: Packungen à 60 Kapseln [B]
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz
Stand der Information
September 2025
Gebrauchs- und Handhabungshinweise - Entresto Filmüberzogenes Granulat
Um sicherzustellen, dass Sie Entresto Granulat für Ihr Kind richtig anwenden, ist es wichtig, dass Sie diese Anweisungen befolgen. Ihr Arzt, Apotheker oder Gesundheitsdienstleister wird Ihnen zeigen, wie das geht.
|
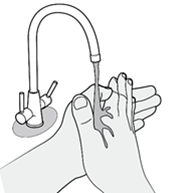
Schritt 1 |
·Waschen Sie die Hände und trocknen Sie sie ab. |
|
|
|
Schritt 2 |
·Legen Sie die folgenden Hilfsmittel auf eine saubere, flache Oberfläche: |
|
|
|
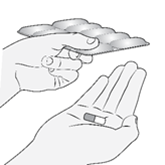
Schritt 3 |
·Drücken Sie auf den/die Blister, um die Kapsel(n) herauszunehmen. |
|
|
|
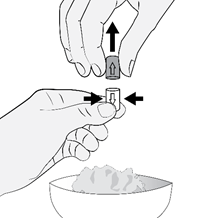
Schritt 4 |
So öffnen Sie die Kapsel: |
|
|
|
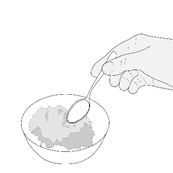
Schritt 5 |
·Streuen Sie das gesamte Granulat aus der Kapsel auf die Nahrung. |
|
|
|
Schritt 6 |
Geben Sie Ihrem Kind die Nahrung mit dem Granulat sofort ohne Verzögerung und achten Sie darauf, dass es alles aufisst. |
|
|
|
Schritt 7 |
Werfen Sie die leeren Kapselteile weg. |
|
|