Zusammensetzung
Wirkstoff: Etanerceptum.
Hilfsstoffe:
Erelzi Injektionslösung und Erelzi SensoReady
Acidum citricum anhydricum, natrii citras dihydricus, natrii chloridum, saccharum, lysini hydrochloridum, aqua ad iniectabilia q.s. ad solutionem.
Galenische Form und Wirkstoffmenge pro Einheit
Erelzi Injektionslösung
Fertigspritzen zu 25 mg/0,5 ml oder 50 mg/1 ml Etanercept.
Erelzi SensoReady
Fertigpen zu 50 mg/1 ml Etanercept.
Indikationen/Anwendungsmöglichkeiten
Rheumatoide Arthritis
Erelzi ist indiziert zur Behandlung der aktiven rheumatoiden Arthritis (Erwachsene), wenn die vorausgegangene antirheumatische Standardtherapie mit krankheitsmodifizierenden Antirheumatika (DMARDs) unzulänglich war. Erelzi kann in Kombination mit Methotrexat verwendet werden für Patienten, die auf Methotrexat alleine ungenügend angesprochen haben.
Des Weiteren ist Erelzi indiziert zur Behandlung von schwerer aktiver und progressiver Formen der rheumatoiden Arthritis bei Erwachsenen, die zuvor nicht mit Methotrexat behandelt worden sind. Durch Röntgenuntersuchungen wurde gezeigt, dass Erelzi bei dieser Patientenpopulation die Progression der durch die Krankheit hervorgerufenen strukturellen Schädigungen verlangsamt.
Juvenile idiopathische Arthritis
Erelzi ist indiziert zur Behandlung der Polyarthritis (Rheumafaktor-positiv oder -negativ) und der erweiterten (extended) Oligoarthritis bei Kindern und Jugendlichen (ab dem Alter von 2 Jahren), die unzureichend auf eine Methotrexat-Behandlung angesprochen haben oder eine Methotrexat-Behandlung nicht vertragen.
Behandlung der Psoriasis-Arthritis (Arthritis psoriatica) bei Jugendlichen ab dem Alter von 12 Jahren, die unzureichend auf eine Methotrexat-Behandlung angesprochen haben oder eine Methotrexat-Behandlung nicht vertragen.
Behandlung der Enthesitis-assoziierten Arthritis bei Jugendlichen ab dem Alter von 12 Jahren, die unzureichend auf eine konventionelle Therapie angesprochen haben oder eine konventionelle Therapie nicht vertragen.
Etanercept wurde bei Kindern unter 2 Jahren nicht geprüft. Etanercept in Kombination mit Methotrexat wurde bei Kindern untersucht, nicht aber in Kombination mit anderen DMARDs.
Psoriasis-Arthritis
Behandlung der aktiven und progressiven Psoriasis-Arthritis bei Erwachsenen, wenn das Ansprechen auf eine vorhergehende Therapie mit krankheitsmodifizierenden Antirheumatika unzulänglich war. Erelzi verbessert die körperliche Funktionsfähigkeit bei Patienten mit Psoriasis-Arthritis und verhindert das Fortschreiten der radiologisch nachweisbaren strukturellen Schädigungen der peripheren Gelenke bei Patienten mit polyartikulären symmetrischen Subtypen der Erkrankung.
Morbus Bechterew (Ankylosierende Spondylitis)
Erelzi ist indiziert zur Reduktion der Anzeichen und Symptome und zur Verbesserung der körperlichen Funktionsfähigkeit bei erwachsenen Patienten mit schwerem aktivem Morbus Bechterew, die auf konventionelle Therapie nicht angesprochen haben.
Plaque-Psoriasis
Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis.
Plaque-Psoriasis bei Kindern und Jugendlichen
Behandlung der chronischen schweren Plaque-Psoriasis bei Kindern und Jugendlichen ab dem Alter von 6 Jahren, die unzureichend auf eine andere systemische Therapie oder Lichttherapie angesprochen haben oder sie nicht vertragen.
Dosierung/Anwendung
Erelzi soll nur von Ärzten verordnet werden mit Erfahrung in der Betreuung von Patienten mit aktiver, refraktärer rheumatoider Arthritis, aktiver juveniler idiopathischer Arthritis mit polyartikulärem Verlauf, Psoriasis-Arthritis, Morbus Bechterew, Plaque-Psoriasis oder Plaque-Psoriasis bei Kindern und Jugendlichen.
Erelzi SensoReady, Injektionslösung im Fertigpen ist in der Dosierungsstärke 50 mg erhältlich. Erelzi, Injektionslösung in Fertigspritzen ist in den Stärken 25 mg und 50 mg verfügbar.
Ausführliche Hinweise zur Anwendung sind in der Packungsbeilage unter «Hinweise zur Verabreichung einer Injektion» ersichtlich.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Erwachsene
Rheumatoide Arthritis
Die empfohlene Dosierung beträgt 25 mg Erelzi zweimal wöchentlich verabreicht als subkutane Injektion im Abstand von 72−96 h.
Als Alternative zeigte sich, dass 50 mg Erelzi einmal wöchentlich gegeben sicher und wirksam ist (siehe «Eigenschaften/Wirkungen»).
Eine vorbestehende Therapie mit Methotrexat, Glukokortikoiden, Salicylaten, NSAIDs oder Analgetika kann während der Erelzi-Therapie fortgesetzt werden. Komedikation mit anderen DMARDs als Methotrexat ist nicht untersucht worden. Höhere Dosen von Etanercept sind nicht untersucht worden.
Psoriasis-Arthritis und Morbus Bechterew
Die empfohlene Dosierung beträgt 25 mg Erelzi, verabreicht zweimal wöchentlich im Abstand von 3 bis 4 Tagen, oder 50 mg Erelzi verabreicht einmal wöchentlich.
Plaque Psoriasis
Bei der Plaque-Psoriasis liegt die Dosierung bei 50 mg Erelzi pro Woche (verabreicht in zwei einzelnen Injektionen zu 25 mg im Abstand von 3 bis 4 Tagen oder als eine einzelne Injektion zu 50 mg) bis zum Erreichen der Remission über einen Zeitraum von bis zu 24 Wochen.
Als Alternative können 50 mg 2-mal wöchentlich während bis zu 12 Wochen gegeben werden, und anschliessend, falls nötig, gefolgt von einer Dosis von 25 mg 2-mal wöchentlich oder 50 mg einmal pro Woche.
Für erwachsene Patienten, welche gemäss Beurteilung des Arztes gut auf Erelzi ansprechen, aber jeweils kurze Zeit nach Absetzen zu Rezidiven neigen, kann eine kontinuierliche Therapie über 24 Wochen hinaus eingesetzt werden (siehe «Eigenschaften/Wirkungen, Klinische Wirksamkeit»).
Falls bei Patienten, welche auf eine initiale Behandlung angesprochen haben, eine erneute Behandlung mit Erelzi angezeigt ist, sollte dieselbe beschriebene Anleitung für die Behandlungsdauer befolgt werden. Die Dosis sollte 2-mal wöchentlich 25 mg oder einmal wöchentlich 50 mg betragen.
Kinder und Jugendliche
Die Dosierung richtet sich bei pädiatrischen Patienten nach dem Körpergewicht. Erelzi steht in fixen Einmaldosen von 25 mg und 50 mg zur Behandlung von Kindern und Jugendlichen mit einem Körpergewicht von ≥62,5 kg zur Verfügung. Patienten mit einem Körpergewicht von weniger als 62,5 kg sollten mit einem anderen Etanercept-Produkt angemessen auf einer mg/kg KG Basis dosiert werden. Patienten mit einem Körpergewicht von 62,5 kg oder mehr können mit einer fixen Einmaldosis mittels Erelzi, Injektionslösung in Fertigspritzen oder Injektionslösung im Fertigpen behandelt werden.
Juvenile idiopathische Arthritis
0,4 mg/kg KG (bis zu maximal 25 mg pro Dosis) zweimal wöchentlich als subkutane Injektion, im Abstand von 72−96 h oder einmal wöchentlich 0,8 mg/kg KG (bis zu maximal 50 mg pro Dosis). Bei Patienten, die nach 4 Monaten nicht auf die Behandlung angesprochen haben, sollte ein Abbruch der Behandlung in Betracht gezogen werden.
Bei Kindern im Alter von 2−3 Jahren wurden keine formalen klinischen Studien durchgeführt. Limitierte Registerdaten (die Erfahrungen in dieser Altersgruppe von 2−3 Jahren basieren auf 47 Patienten) legen nahe, dass das Sicherheitsprofil bei Kindern im Alter von 2−3 Jahren mit dem von Erwachsenen und Kindern ab dem Alter von 4 Jahren bei einer Dosis von 0,8 mg/kg KG einmal wöchentlich vergleichbar ist («Eigenschaften/Wirkungen»).
Plaque-Psoriasis bei Kindern und Jugendlichen (ab 6 Jahren)
0,8 mg/kg KG (bis zu maximal 50 mg pro Dosis) einmal wöchentlich für bis zu 24 Wochen. Bei Patienten, die nach 12 Wochen nicht angesprochen haben, sollte die Behandlung abgebrochen werden.
Falls eine erneute Behandlung mit Etanercept indiziert ist, sollte die oben beschriebene Anleitung zur Behandlungsdauer befolgt werden. Die Dosis sollte einmal wöchentlich 0,8 mg/kg Körpergewicht (bis zu einer Maximaldosis von 50 mg) betragen.
Eine vorbestehende Therapie mit Glukokortikoiden, NSAIDs oder Analgetika kann während der Erelzi-Therapie fortgesetzt werden. Etanercept in Kombination mit Methotrexat wurde bei Kindern mit JIA untersucht, nicht aber in Kombination mit anderen DMARDs. Höhere Dosen von Etanercept sind nicht untersucht worden.
Ältere Patienten
Eine Dosisanpassung ist nicht erforderlich.
Nieren- und Leberfunktionsstörung: Eine Dosisanpassung ist nicht erforderlich.
Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Sepsis oder Risiko einer Sepsis.
Eine Behandlung mit Erelzi sollte bei Patienten mit aktiven Infektionen, einschliesslich chronischer oder lokalisierter Infektionen, nicht begonnen werden.
Warnhinweise und Vorsichtsmassnahmen
Infektionen
Patienten sollten vor, während und nach einer Behandlung mit Erelzi auf Infektionen hin untersucht werden, wobei die durchschnittliche Eliminationshalbwertszeit von Etanercept mit ca. 70 h (von 7 bis 300 h zu berücksichtigen ist).
Unter Anwendung von Etanercept wurden schwerwiegende Infektionen, Sepsis, Tuberkulose und opportunistische Infektionen (einschliesslich invasiver Pilzinfektionen, Listeriose und Legionellose) beobachtet (siehe «Unerwünschte Wirkungen»). Diese Infektionen wurden durch Bakterien, Mycobakterien, Pilze, Viren und Parasiten (einschliesslich Protozoen) verursacht. In einigen Fällen, insbesondere bei Pilz- und anderen opportunistischen Infektionen, wurde die Infektion nicht erkannt. Dies führte zu einer Verzögerung einer geeigneten Behandlung und manchmal zum Tod. Bei der Untersuchung auf Infektionen sollte das Risiko für Patienten hinsichtlich relevanter opportunistischer Infektionen (z.B. Exposition gegenüber endemischen Mykosen) in Betracht gezogen werden.
Patienten, die während der Erelzi-Behandlung eine neue Infektion entwickeln, sollten engmaschig beobachtet werden. Die Anwendung von Erelzi sollte abgebrochen werden, wenn der Patient eine schwerwiegende Infektion oder Sepsis entwickelt. Eine Behandlung mit Erelzi sollte bei Patienten mit aktiven Infektionen, einschliesslich chronischen oder lokalisierten Infektionen, nicht begonnen werden. Erelzi sollte nur unter sorgfältiger ärztlicher Überwachung angewendet werden bei Patienten mit wiederkehrenden Infektionen in der Vorgeschichte oder zugrundeliegenden Erkrankungen, die Infektionen begünstigen können, wie z.B. fortgeschrittenem oder schwer kontrollierbarem Diabetes.
Tuberkulose
Bei mit Etanercept behandelten Patienten wurden Fälle von aktiver Tuberkulose einschliesslich Miliartuberkulose und extrapulmonärer Tuberkulose beobachtet.
Vor Beginn einer Behandlung mit Erelzi müssen alle Patienten sowohl auf eine aktive, als auch auf eine inaktive (latente) Tuberkulose hin untersucht werden. Diese Untersuchung sollte eine eingehende Anamnese mit einer persönlichen Tuberkulosevorerkrankung, möglichen früheren Tuberkulose-Kontakten und einer früheren bzw. derzeitigen Behandlung mit Immunsuppressiva einschliessen. Bei allen Patienten sollten entsprechende Voruntersuchungen, d.h. Tuberkulin-Hauttest und Röntgen-Thorax-Aufnahme durchgeführt werden. Verordnende Ärzte sollen das Risiko falsch-negativer Ergebnisse der Tuberkulin-Hauttests, insbesondere bei schwer erkrankten oder immunsupprimierten Patienten, berücksichtigen.
Wird eine aktive Tuberkulose diagnostiziert, darf eine Erelzi-Therapie nicht eingeleitet werden. Wird eine inaktive (latente) Tuberkulose diagnostiziert, muss die Anti-Tuberkulose-Therapie vor der ersten Gabe von Erelzi durchgeführt werden. In diesem Fall sollte das Nutzen-Risiko-Verhältnis einer Erelzi-Therapie sehr sorgfältig abgewogen werden.
Alle Patienten sind darüber zu informieren, ärztlichen Rat einzuholen, falls während oder nach einer Erelzi-Therapie Symptome auftreten, die auf eine Tuberkulose hinweisen (z.B. anhaltender Husten, Kräfteschwund/Gewichtsverlust, leicht erhöhte Körpertemperatur).
Hepatitis-B-Reaktivierung
Bei Patienten, die vorgängig mit dem Hepatitis-B-Virus (HBV) infiziert waren und gleichzeitig TNF-Antagonisten einschliesslich Etanercept erhielten, wurde eine Reaktivierung der Hepatitis-B beobachtet. Patienten mit dem Risiko einer HBV-Infektion sollten vor Einleitung einer Erelzi-Therapie auf Anzeichen einer stattgefundenen HBV-Infektion hin evaluiert werden. Vorsicht ist geboten, wenn Erelzi bei Patienten angewendet wird, welche vorgängig mit HBV infiziert waren. Diese Patienten sollten auf Anzeichen und Symptome einer aktiven HBV-Infektion hin überprüft werden. Falls nötig sollte eine geeignete Therapie eingeleitet werden.
Verschlechterung einer Hepatitis C
Bei mit Etanercept behandelten Patienten wurde von einer Verschlechterung der Hepatitis C berichtet.
Gleichzeitige Behandlung mit Erelzi und Anakinra
Im Vergleich zur Etanercept-Monotherapie wurde die gleichzeitige Anwendung von Etanercept und Anakinra mit einem erhöhten Risiko von schwerwiegenden Infektionen und Neutropenie in Zusammenhang gebracht. Diese Kombination zeigte keinen erhöhten klinischen Nutzen. Daher wird die kombinierte Anwendung von Erelzi und Anakinra nicht empfohlen (siehe «Unerwünschte Wirkungen» und «Interaktionen»).
Kongestive Herzinsuffizienz
Der Arzt sollte Erelzi bei Patienten mit einer kongestiven Herzinsuffizienz mit Vorsicht anwenden. Berichte nach Markteinführung zeigten bei mit Etanercept behandelten Patienten eine Verschlechterung der dekompensierten Herzinsuffizienz mit und ohne nachweisbare prädisponierende Faktoren. Weiterhin gab es seltene Berichte (<0,1%) über Neuentstehungen von kongestiver Herzinsuffizienz, inklusive kongestiver Herzinsuffizienz in Patienten ohne bekannte vorbestehende kardiovaskuläre Krankheiten. Einige dieser Patienten waren unter 50 Jahre. Zwei gross angelegte klinische Studien, welche die Anwendung von Etanercept bei der Behandlung der kongestiven Herzinsuffizienz bewerten sollten, wurden frühzeitig aufgrund fehlender Wirksamkeit beendet. Obwohl nicht eindeutig belegbar, deuten die Daten einer der Studien auf eine mögliche Verschlechterung der kongestiven Herzinsuffizienz bei mit Etanercept behandelten Patienten hin.
Zudem wurde eine klinische Studie mit Infliximab (einem monoklonalen Antikörper, der an TNF-alpha bindet) bei der Behandlung der Herzinsuffizienz frühzeitig beendet, da eine erhöhte Mortalität bei den mit Infliximab behandelten Patienten festgestellt wurde. Etanercept sollte deswegen bei Patienten, die an Herzinsuffizienz leiden, mit Vorsicht angewendet werden.
Allergische Reaktionen
In klinischen Studien wurden im Zusammenhang mit der Anwendung von Etanercept häufig allergische Reaktionen beobachtet. Gemäss Erfahrungen seit Markteinführung wurde über allergische Reaktionen, einschliesslich Angioödem und Urtikaria sowie schwerwiegenden Reaktionen, berichtet.
Beim Auftreten von schwerwiegenden allergischen oder anaphylaktischen Reaktionen sollte die Erelzi-Therapie unverzüglich abgebrochen und eine geeignete Therapie eingeleitet werden.
Immunsuppression
Es ist möglich, dass Anti-TNF-Therapien, einschliesslich der Anwendung von Etanercept, die Wirts-Abwehr von Infektionen und Malignomen beeinflussen, da TNF der Mediator für Entzündungsprozesse ist und zelluläre Immunantworten verändert. Berichte über maligne Erkrankungen (einschliesslich Brust- und Lungenkarzinom sowie Lymphom) wurden in der Zeit nach Markteinführung bekannt. In einer Studie mit 49 mit Etanercept behandelten RA-Patienten wurde weder eine Schwächung der verzögert auftretenden Überempfindlichkeit, noch eine Herabsetzung der Immunglobulin-Spiegel oder eine Grössenänderung der Effektor-Zell-Population festgestellt. Zwei Patienten mit juveniler idiopathischer Arthritis entwickelten eine Varizellen-Infektion und die Anzeichen und Symptome einer aseptischen Meningitis, die ohne Spätfolgen abheilten. Patienten mit einer starken Exposition gegenüber Varizella-Viren sollten die Erelzi-Behandlung vorübergehend unterbrechen, und es sollte eine Prophylaxe mit Varizella-Zoster-Immunglobulin erwogen werden. Innerhalb kontrollierter Studien wurden bei Patienten unter TNF-Antagonisten im Vergleich zu Kontrollpatienten mehr Fälle von Lymphomen beobachtet. Allerdings war das Auftreten selten, und die Nachverfolgungsperiode von Placebo-Patienten war kürzer als die von Patienten mit einer TNF-Antagonisten-Therapie. Darüber hinaus wird die Risikoeinschätzung dadurch erschwert, dass bei Patienten mit langjährig bestehender rheumatoider Arthritis und hoch aktiver, entzündlicher Erkrankung ein erhöhtes Grundrisiko für Lymphome besteht. Nach dem derzeitigen Kenntnisstand kann ein mögliches Risiko für die Entwicklung von Lymphomen oder anderen malignen Erkrankungen bei Patienten, die mit TNF-Antagonisten behandelt werden, nicht ausgeschlossen werden.
Die Sicherheit und Wirksamkeit von Etanercept bei Patienten mit Immunsuppression oder chronischen Infektionen wurde nicht untersucht.
Maligne lymphoproliferative Erkrankungen
Solide Tumore (ausgenommen Hautkarzinome) und hämatopoetische maligne Erkrankungen, Leukämie
Bei Patienten, die mit TNFα-Inhibitoren einschliesslich Etanercept behandelt wurden, sind Lymphome beobachtet worden. Während der kontrollierten Phasen von Etanercept-Studien wurden bei den 4509 mit Etanercept behandelten Patienten 3 Lymphome beobachtet gegenüber 0 Lymphomen bei 2040 Kontrollpatienten (die Dauer der kontrollierten Behandlung lag zwischen 3 und 24 Monaten). In den kontrollierten und offenen Phasen klinischer Studien zu Etanercept wurden bei 5723 Patienten über rund 11'201 Patientenjahre Behandlung 9 Lymphome beobachtet. Dies entspricht dem Dreifachen der für die allgemeine Bevölkerung erwarteten Anzahl. Patienten mit rheumatoider Arthritis oder Psoriasis, insbesondere in der hochaktiven Phase der Erkrankung, könnten einem grösseren Risiko (bis zu einem Mehrfachen) für die Entwicklung von Lymphomen ausgesetzt sein.
Bei Kindern und Jugendlichen, die mit TNF-Inhibitoren (einschliesslich Etanercept) behandelt wurden, hat man über Malignome berichtet (insbesondere Hodgkin- und Non Hodgkin-Lymphom), die teilweise einen tödlichen Ausgang nahmen. Die meisten dieser Patienten erhielten gleichzeitig Immunsuppressiva.
Ausgehend vom heutigen Erkenntnisstand kann man ein mögliches Risiko für die Entwicklung von Lymphomen bzw. anderen hämatopoetischen oder soliden malignen Tumoren bei Patienten, die eine Behandlung mit TNF-Antagonisten erhalten, nicht ausschliessen (siehe «Unerwünschte Wirkungen, Malignome»).
Nach der Markteinführung wurden Fälle von akuter oder chronischer Leukämie im Zusammenhang mit der Anwendung von TNF-Blockern bei rheumatoider Arthritis und anderen Indikationen berichtet. Auch ohne Behandlung mit einem TNF-Blocker kann bei Patienten mit rheumatoider Arthritis ein gegenüber der Allgemeinbevölkerung erhöhtes Risiko (circa 2-fach) für Leukämie bestehen.
Hautkrebs
Bei Patienten, die mit TNF-Antagonisten, einschliesslich Etanercept, behandelt wurden, wurde über melanozytären und nicht-melanozytären Hautkrebs (NMSC) berichtet.
Die «standardized incidence ratio» bei in Studien mit Etanercept beobachteten Melanomen (Verhältnis von beobachteten zu in der Allgemeinbevölkerung zu erwartenden Erkrankungsfällen) betrug in den Studien bei Patienten mit RA 1,6 (KI: 0,5−3,8), bei Patienten mit Psoriasis 3,2 (KI: 0,67−9,43) und bei allen Patienten zusammen 2,1 (KI: 0,95−3,9).
Bei 3306 erwachsenen Rheumatologie-Patienten (RA, PsA, AS), die mit Etanercept in kontrollierten klinischen Studien behandelt wurden − entspricht etwa 2669 Patientenjahren unter Therapie − betrug die beobachtete Rate von NMSC 0,41 Ereignisse pro 100 Patientenjahre gegenüber 0,37 Ereignissen pro 100 Patientenjahre bei 1521 Patienten in der Kontrollgruppe, was 1077 Patientenjahren entspricht. Bei 1245 erwachsenen Psoriasis-Patienten, die mit Etanercept in kontrollieren klinischen Studien behandelt wurden − entspricht etwa 283 Patientenjahren unter Therapie − betrug die beobachtete Rate von NMSC 3,54 Ereignisse pro 100 Patientenjahre gegenüber 1,28 Ereignissen pro 100 Patientenjahre bei 720 Patienten in der Kontrollgruppe, was 156 Patientenjahren entspricht.
Es wurde über post-marketing Fälle von Merkel-Zell-Karzinomen bei Patienten, welche mit Etanercept behandelt wurden, berichtet. Unter Behandlung mit Etanercept werden regelmässige Hautuntersuchungen empfohlen. Die Zusammenfassung der Ergebnisse Placebo- und Wirkstoff-kontrollierter klinischer Studien mit Etanercept ergaben mehr Fälle von NMSC bei mit Etanercept behandelten Patienten als bei den Kontrollpatienten - insbesondere bei Patienten mit Psoriasis.
Impfungen
Lebendimpfstoffe sollten nicht während der Therapie mit Erelzi angewendet werden. Es sind keine Daten vorhanden zur Sekundärübertragung von Infektionen durch Lebendimpfstoffe bei mit Etanercept behandelten Patienten.
Es wird empfohlen, dass der Impfstatus von pädiatrischen Patienten wenn möglich vor der Behandlung mit Erelzi gemäss den aktuellen Leitlinien zur Immunisierung auf den neuesten Stand gebracht wird. Zwei Patienten mit juveniler idiopathischer Arthritis entwickelten eine Varizellainfektion und Symptome einer aseptischen Meningitis, die ohne Folgen abklangen. Patienten, die dem Varizellavirus in erheblichem Umfang ausgesetzt sind, sollten Erelzi vorübergehend absetzen; bei diesen Patienten sollte eine prophylaktische Behandlung mit Varizella-Zoster-Immunglobulin in Betracht gezogen werden.
Autoantikörperbildung/Autoimmunerkrankungen
Die Behandlung mit Erelzi kann die Bildung von Autoantikörpern hervorrufen (siehe «Unerwünschte Wirkungen»).
Bei Patienten, einschliesslich mit Rheumafaktor-positiver RA, wurde in postmarketing Berichten in seltenen Fällen über Autoantikörper im Zusammenhang mit Ausschlägen, die sich klinisch oder bioptisch als subakuter Hautlupus oder diskoidem Lupus präsentierten, berichtet. Zudem wurden Fälle von Lupus-ähnlichem Syndrom berichtet.
Hämatologische Reaktionen
Bei Patienten, die mit Etanercept behandelt wurden, wurde in seltenen Fällen über das Auftreten von Panzytopenien und in Einzelfällen über aplastische Anämien, einige mit tödlichem Ausgang, berichtet. Daher sollte Erelzi bei Patienten mit Blutdyskrasie in der Anamnese mit Vorsicht angewendet werden. Alle Patienten und Eltern/Pflegepersonen sollten darauf hingewiesen werden, dass sie sofort den Arzt kontaktieren sollten, wenn beim Patienten während der Erelzi-Therapie Anzeichen und Symptome auftreten, die auf eine Blutdyskrasie oder Infektion hindeuten (z.B. anhaltendes Fieber, Halsentzündung, Blutergüsse, Blutungen, Blässe). Diese Patienten sollten umgehend untersucht werden, einschliesslich des kompletten Blutbildes; falls hierdurch Blutdyskrasien bestätigt werden, sollte Erelzi abgesetzt werden.
Neurologische Störungen
In seltenen Fällen wurde über entmyelinisierende Erkrankungen des ZNS bei mit Etanercept behandelten erwachsenen Patienten berichtet. Ausserdem gab es Berichte von peripheren demyelisierenden Neuropathien (Guillain Barré Syndrom, demyelinisierende Polyneuropathien, chronisch entzündlich demyelinisierende Polyneuropathien, multifokale motorische Neuropathien und andere), von Querschnittsmyelitis und Opticusneuritis (siehe «Unerwünschte Wirkungen»). Ein kausaler Zusammenhang mit der Etanercept-Therapie ist jedoch unklar.
Bei Patienten mit vorbestehender oder jüngst neu aufgetretener peripherer oder zentraler demyelinisierender Erkrankung oder bei Patienten, bei denen in Betracht gezogen werden muss, dass ein erhöhtes Risiko für die Entwicklung einer peripheren oder zentralen demyelinisierender Erkrankung besteht, sollte Erelzi daher nur nach sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses, einschliesslich einer neurologischen Untersuchung, angewendet werden.
Alkohol-Hepatitis
In einer randomisierten, Placebo-kontrollierten Phase II-Studie mit 48 hospitalisierten Patienten, die entweder Etanercept oder Placebo zur Behandlung der mittelschweren bis schweren Alkohol-Hepatitis erhielten, war Etanercept nicht wirksam, wobei die Sterblichkeitsrate bei mit Etanercept behandelten Patienten nach 6 Monaten signifikant höher war. Folglich darf Etanercept nicht bei Patienten zur Behandlung einer Alkohol-Hepatitis angewendet werden. Ärzte sollten Etanercept mit Vorsicht bei Patienten anwenden, die auch an mittelschwerer bis schwerer Alkohol-Hepatitis leiden.
Wegener's Granulomatose
In einer placebokontrollierten Studie, in der 89 erwachsene Patienten mit Etanercept zusätzlich zur Standardtherapie (einschliesslich Cyclophosphamid oder Methotrexat, und Glukokortikoide) für eine mediane Dauer von 25 Monaten behandelt wurden, erwies sich Etanercept nicht als wirksame Behandlung bei Wegener's Granulomatose. Die Häufigkeit von nicht-kutanen Malignomen verschiedener Typen war signifikant höher bei mit Etanercept behandelten Patienten als bei der Kontrollgruppe. Etanercept wird nicht empfohlen zur Behandlung bei Wegener's Granulomatose.
Hypoglykämie bei Patienten unter einer Diabetes-Behandlung
Über Hypoglykämie nach Behandlungsbeginn mit Etanercept wurde bei Patienten berichtet, die Antidiabetika erhielten; bei einigen von ihnen war eine Reduktion der antidiabetischen Behandlung notwendig.
Chronisch-entzündliche Darmerkrankung (IBD) und Uveitis in Patienten mit juveniler idiopathischer Arthritis (JIA) und Morbus Crohn bei Kindern mit Psoriasis
Es wurde über Fälle von IBD (inklusive Morbus Crohn) und Uveitis in Patienten mit juveniler idiopathischer Arthritis (JIA) und von Morbus Crohn bei Kindern mit Psoriasis berichtet, die mit Etanercept behandelt wurden. Klinisch manifeste Darmentzündungen wurden auch in nicht behandelten JIA Patienten beobachtet.
Gleichzeitige Anwendung von TNF-α-Inhibitoren und Abatacept
In klinischen Studien führte die gleichzeitige Anwendung von Abatacept und Etanercept zu einem vermehrten Auftreten von schwerwiegenden Nebenwirkungen, einschliesslich schwerwiegender Infektionen. Diese Kombination zeigte keinen zusätzlichen klinischen Nutzen. Daher wird diese Anwendung nicht empfohlen.
Interaktionen
Methotrexat hat keinen Einfluss auf die Pharmakokinetik von Etanercept. Obwohl es unwahrscheinlich ist, kann ein Einfluss von Etanercept auf die Pharmakokinetik und Sicherheit von Methotrexat nicht ausgeschlossen werden. In klinischen Studien wurden bei der gleichzeitigen Anwendung von Etanercept und Glucocorticoiden, Salicylaten, nichtsteroidalen Antirheumatika (NSARs), Analgetika oder Methotrexat keine Wechselwirkungen festgestellt.
Wechselwirkungen zwischen Etanercept und anderen Wirkstoffen sind nicht durch gezielte klinische Studien untersucht worden.
Gleichzeitige Behandlung mit Erelzi und Sulfasalazin
Bei Kombination von Etanercept und Sulfasalazin wurde über Leukopenie berichtet.
In einer klinischen Studie erhielten erwachsene Patienten übliche Sulfasalazin-Dosen und zusätzlich Etanercept. Im Vergleich zu den nur mit Etanercept bzw. Sulfasalazin behandelten Patientengruppen entwickelten die Patienten in der Kombinationsgruppe im Durchschnitt einen statistisch signifikanten Abfall der mittleren Anzahl weisser Blutkörperchen. Die klinische Signifikanz dieser Wechselwirkung ist nicht bekannt.
Wechselwirkungen mit Digoxin und Warfarin
Eine PK-Studie ergab, dass bei Komedikation von Etanercept und Digoxin die Exposition zu diesen Wirkstoffen geringgradig reduziert wird. In einer PK-Studie mit single-dose Warfarin und Etanercept konnte gezeigt werden, dass es zu keiner wechselseitigen Beeinflussung der Exposition zu diesen Wirkstoffen gekommen ist.
Gleichzeitige Behandlung mit Erelzi und Anakinra
Bei erwachsenen Patienten, die gleichzeitig mit Anakinra und Etanercept behandelt wurden, wurde eine höhere Anzahl von schwerwiegenden Infektionen beobachtet im Vergleich zu Patienten, die entweder nur mit Etanercept oder Anakinra behandelt wurden (historische Daten).
Ausserdem wurde in einer doppelblinden, Placebo-kontrollierten Studie mit erwachsenen Patienten, die Methotrexat als Basistherapie erhielten, beobachtet, dass bei Patienten, die gleichzeitig mit Etanercept und Anakinra behandelt wurden, eine höhere Anzahl von schwerwiegenden Infektionen (7%) und Neutropenie auftrat als bei Patienten, die mit Etanercept-Monotherapie behandelt wurden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Kombination von Etanercept und Anakinra zeigte keinen erhöhten klinischen Nutzen und wird deshalb nicht empfohlen.
Schwangerschaft/Stillzeit
Es wurden keine Studien mit Etanercept an schwangeren Frauen durchgeführt.
Mittels einem Etanercept Schwangerschaftsregister wurden die Raten schwerer Geburtsfehler lebendgeborener Säuglinge von Müttern mit rheumatoider Erkrankungen oder Psoriasis, welche im ersten Trimester Etanercept erhalten haben (n=319) mit jenen von Müttern, welche während der Schwangerschaft kein Etanercept erhalten haben (n=144) verglichen. Das alles umfassende angepasste Quotenverhältnis für schwere Geburtsfehler lag bei 2,77 (95% CI 1,04−7,35), und bei 2,49 (95% CI 0,92−6,68) wenn chromosomale und bekannte Erbgutschäden ausgeschlossen wurden. Die Ergebnisse zeigten keinen Anstieg in der Rate für geringfügige Fehlbildungen und keine Muster für schwerwiegende oder geringfügige Fehlbildungen. Ausserdem wurde kein Anstieg in der Rate von intrauterinen oder postnatalen Wachstumsstörungen oder verzögerter postnataler Entwicklung beobachtet.
Entwicklungs-Toxizitätsstudien an Ratten und Kaninchen ergaben keine Hinweise auf Schädigungen des Fetus bzw. der neugeborenen Ratte durch Etanercept. Präklinische Daten zur peri- und postnatalen Toxizität von Etanercept sowie zum Einfluss von Etanercept auf die Fertilität und die allgemeine Fortpflanzungsfähigkeit liegen nicht vor. Erelzi sollte während der Schwangerschaft nicht angewendet werden, es sei denn es ist klar notwendig. Frauen im gebärfähigen Alter sollten angewiesen werden, während der Erelzi-Behandlung nicht schwanger zu werden.
Es wurde berichtet, dass Etanercept nach subkutaner Anwendung in die Muttermilch übergeht. Da viele Arzneimittel und Immunoglobuline in die Muttermilch übergehen, sollte das Stillen oder die Behandlung während der Stillzeit unterbrochen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt.
Unerwünschte Wirkungen
Die Anwendung von Etanercept wurde bei 2680 Patienten mit rheumatoider Arthritis in Studien mit doppelblindem und offenem Design untersucht. Die Untersuchungsergebnisse stammen aus 2 Placebo-kontrollierten Studien (349 mit Etanercept und 152 mit Placebo behandelte Patienten) und zwei Wirkstoff-kontrollierten Studien: einer Wirkstoff-kontrollierten Studie, in der Etanercept mit Methotrexat verglichen wurde (415 mit Etanercept und 217 mit Methotrexat behandelte Patienten) und einer weiteren Wirkstoff-kontrollierten Studie, in der Etanercept (223 Patienten), Methotrexat (228 Patienten) und Etanercept in Kombination mit Methotrexat (231 Patienten) verglichen wurden. Der Patientenanteil, der aufgrund von unerwünschten Ereignissen die Behandlung abgebrochen hat, war für die mit Etanercept oder mit Placebo behandelten Gruppen gleich; in der ersten Wirkstoff-kontrollierten Studie war die Drop-out-Rate für Methotrexat (10%) signifikant höher als für Etanercept (5%). In der zweiten Wirkstoff-kontrollierten Studie war die Abbruchrate nach zweijähriger Behandlung aufgrund unerwünschter Ereignisse innerhalb der drei Behandlungsgruppen Etanercept (16%), Methotrexat (21%) und Etanercept in Kombination mit Methotrexat (17%) ähnlich. Ausserdem wurde Etanercept in zwei doppelblinden Placebo-kontrollierten Studien sowie einer offenen Folgestudie bei 240 Patienten mit Psoriasis-Arthritis untersucht.
In vier doppelblinden, Placebo-kontrollierten Studien wurden 508 Patienten, die an Morbus Bechterew erkrankt waren, mit Etanercept behandelt.
Etanercept wurde zudem im Rahmen von 5 doppelblinden, Placebo-kontrollierten Studien bei 1492 Patienten mit Plaque-Psoriasis über einen Zeitraum von bis zu 6 Monaten untersucht. Bei Patienten mit Plaque-Psoriasis, die in Placebo-kontrollierten Studien behandelt wurden, betrug die Häufigkeit der schwerwiegenden unerwünschten Ereignisse etwa 1,4% von 1341 mit Etanercept behandelten Patienten im Vergleich zu 1,4% von 766 mit Placebo behandelten Patienten.
Die nachfolgend aufgeführten Nebenwirkungen basieren auf Beobachtungen aus klinischen Studien bei Erwachsenen sowie auf Berichten nach Markteinführung.
Die Nebenwirkungen sind nach Organsystemen und entsprechend ihrer Häufigkeiten (Anzahl von Patienten, bei denen eine Reaktion erwartet wird) in folgende Kategorien eingeteilt: «Sehr häufig»: ≥10%, «Häufig»: ≥1% und <10%, «Gelegentlich»: ≥0,1% und <1%, «Selten»: ≥0,01% und <0,1%, «Sehr selten»: <0,01%, «Nicht bekannt»: Häufigkeit konnte nicht genau auf Grundlage klinischer Studien abgeschätzt werden.
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen (29%) (einschliesslich Infektionen der oberen Atemwege, Bronchitis, Zystitis, Hautinfektionen)*.
Gelegentlich: Schwere Infektionen (einschliesslich Pneumonie, Phlegmone, septische Arthritis, Sepsis und parasitäre Infektionen)*.
Selten: Tuberkulose, opportunistische Infektionen (einschliesslich invasiver Pilz-, Protozoen-, Bakterien-, atypischer Mycobakterien-, Virus-Infektionen und Legionella).
Nicht bekannt: Listeria, Hepatitis-B-Reaktivierung.
Gutartige, bösartige und unspezifische Neubildungen (einschliesslich Zysten und Polypen)
Gelegentlich: Nicht-Melanom-Hautkarzinome*.
Selten: Lymphome, Hautkrebs*.
Nicht bekannt: Merkel-Zell-Karzinom* (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytopenie.
Selten: Anämie, Leukopenie, Neutropenie, Panzytopenie*.
Sehr selten: Aplastische Anämie*.
Einige Fälle von Panzytopenie und aplastischer Anämie verliefen tödlich (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Immunsystems
Häufig: Allergische Reaktionen (siehe «Haut und Unterhautgewebe»), Bildung von Autoantikörpern*.
Gelegentlich: Systemische Vaskulitis (inklusive anti-neutrophile cytoplasmatische Antikörper-positive Vaskulitis).
Selten: Schwere allergische/anaphylaktische Reaktionen (einschliesslich Angioödem, Bronchospasmus), Sarkoidose.
Nicht bekannt: Makrophagen-Aktivierungs-Syndrom*, Verschlechterung der Symptome einer Dermatomyositis.
Stoffwechsel- und Ernährungsstörungen
Nicht bekannt: Hypoglykämie bei Patienten unter Diabetesbehandlung (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Nervensystems
Selten: Konvulsionen; ZNS-Demyelinisierungsstörungen, die auf Multiple Sklerose oder lokale Demyelinisierungsstörungen, wie optische Neuritis und Querschnittsmyelitis, hindeuten.
Sehr selten: Periphere demyelinisierende Erkrankungen (einschliesslich Guillain Barré Syndrom, chronisch entzündliche demyelinisierende Polyneuropathie, demyelinisierende Polyneuropathie und multifokale motorische Neuropathie) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Augenerkrankungen
Gelegentlich: Uveitis, Skleritis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Interstitielle Lungenerkrankungen (einschliesslich pulmonale Fibrose und Pneumonitis).
Leber und Gallenerkrankungen
Selten: Erhöhte Leberenzyme, autoimmune Hepatitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Pruritus.
Gelegentlich: Angioödem, Urtikaria, Hautausschlag, psoriasisartiger Hautausschlag, Psoriasis (einschliesslich Erstmanifestationen oder Verschlimmerung und pustulöse Formen, primär Handflächen und Fusssohlen).
Selten: Kutane Vaskulitis (einschliesslich leukozytoklastischer Vaskulitis), Stevens-Johnson-Syndrom, Erythema multiforme.
Sehr selten: Toxische epidermale Nekrolyse.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Subakuter kutaner Lupus erythematodes, diskoider Lupus erythematodes, Lupus-ähnliches Syndrom.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle (37%) (einschliesslich Blutung, Bluterguss, Erythem, Juckreiz, Schmerz, Schwellung)*.
Häufig: Fieber*.
Herzerkrankungen
Selten: kongestive Herzinsuffizienz (siehe «Warnhinweise und Vorsichtsmassnahmen»).
* siehe unten «Zusätzliche Informationen».
Zusätzliche Informationen:
Reaktionen an der Injektionsstelle
Im Vergleich zu Placebo traten bei mit Etanercept behandelten Patienten mit rheumatischen Erkrankungen signifikant häufiger Reaktionen an der Injektionsstelle auf (36% vs. 9%). Alle Reaktionen an der Einstichstelle (Erythem und/oder Juckreiz, Schmerz oder Schwellung) traten gewöhnlich innerhalb des ersten Behandlungsmonats auf; danach liess die Häufigkeit nach. Sie gingen nach durchschnittlich 4 Tagen zurück. In den meisten Fällen wurden die Reaktionen an der Einstichstelle in der Etanercept-Behandlungsgruppe nicht behandelt. Die Mehrheit der behandelten Patienten erhielt topische Präparate, wie z.B. Corticosteroide, oder orale Antihistaminika. Des Weiteren kam es bei einigen Patienten zu «Recall»-Reaktionen an der Einstichstelle, die durch Hautreaktionen an der zuletzt verwendeten Injektionsstelle mit gleichzeitigem Auftreten von Reaktionen an zuvor verwendeten Injektionsstellen gekennzeichnet waren. Diese Reaktionen waren im Allgemeinen vorübergehend und traten während der Behandlung nicht erneut auf.
In kontrollierten Studien an Patienten mit Plaque-Psoriasis zeigten rund 13,6% der mit Etanercept behandelten Patienten innerhalb der ersten 12 Wochen der Behandlung Reaktionen an der Injektionsstelle gegenüber 3,4% der Patienten, die ein Placebo erhalten hatten.
Infektionen
In klinischen Studien waren Infektionen der oberen Atemwege (Erkältungen) und Sinusitis die am häufigsten auftretenden Infektionen bei Patienten, die Etanercept oder Placebo erhielten. In Placebo-kontrollierten Studien traten Infektionen der oberen Atemwege mit einer Häufigkeit von 17% in der Placebo-Gruppe und von 22% in der Etanercept-Gruppe auf. Bei Patienten mit rheumatoider Arthritis, die an den Placebo-kontrollierten Studien teilnahmen, entsprach dies 0,68 Ereignisse pro Patientenjahr in der Placebo-Gruppe und 0,82 Ereignissen pro Patientenjahr in der Etanercept-Gruppe, unter Berücksichtigung der längeren Beobachtungsdauer der Etanercept-Patienten. In Placebo-kontrollierten Studien wurde für Etanercept keine Zunahme der Häufigkeit von schwerwiegenden Infektionen beobachtet (1,3% für Placebo, 0,9% für Etanercept). Bei den mit Etanercept über eine Dauer von bis zu 48 Monaten behandelten Patienten mit rheumatoider Arthritis wurden bei 6,3% schwerwiegende Infektionen beobachtet, einschliesslich Abszesse (verschiedener Lokationen), Bakteriämie, Bronchitis, Bursitis, Zellulitis, Cholezystitis, Diarrhö, Divertikulitis, Endokarditis (vermutet), Gastroenteritis, Hepatitis B, Herpes Zoster, Beinulcera, Mundinfektionen, Osteomyelitis, Otitis, Peritonitis, Pneumonie, Pyelonephritis, Sepsis, septische Arthritis, Sinusitis, Hautinfektionen, Hautulcera, Infektionen des Harntraktes, Vaskulitis und Wundinfektionen. In der zweijährigen Wirkstoff-kontrollierten Studie, in der Patienten entweder mit Etanercept als Monotherapie, Methotrexat als Monotherapie oder Etanercept in Kombination mit Methotrexat behandelt wurden, waren die Raten der schwerwiegenden Infektionen innerhalb der Behandlungsgruppen vergleichbar. Jedoch kann nicht ausgeschlossen werden, dass die Kombination von Etanercept und Methotrexat mit einem Anstieg der Infektionsrate einhergeht.
In Placebo-kontrollierten Studien zu Psoriasis-Arthritis gab es keine Unterschiede bei den Infektionsraten zwischen der mit Etanercept und der mit Placebo behandelten Patientengruppe. Ausserdem traten in diesen Studien bei den mit Etanercept behandelten Patienten keine schweren Infektionen auf.
In Placebo-kontrollierten Studien zu Morbus Bechterew, Psoriasis-Arthritis und Plaque-Psoriasis gab es keine Unterschiede bei den Infektionsraten zwischen der mit Etanercept und der mit Placebo behandelten Patientengruppe.
In den doppelblinden und offenen Studien zur Psoriasis Arthritis wurde über 1 Patienten mit einer schwerwiegenden Infektion berichtet (Pneumonie).
In den doppelblinden und offenen Studien zur Plaque Psoriasis mit einer Dauer von bis zu 15 Monaten wurden bei den mit Etanercept behandelten Patienten schwere Infektionen, wie z.B. Zellulitis, Gastroenteritis, Pneumonie, Cholezystitis, Osteomyelitis sowie Abszesse beobachtet.
Über schwerwiegende Nebenwirkungen einschliesslich Sepsis und Todesfälle wurde auch bei der Anwendung von Etanercept nach Markteinführung berichtet. Davon traten einige innerhalb weniger Wochen nach Beginn der Behandlung mit Etanercept bei Patienten auf, bei denen neben ihrer rheumatoiden Arthritis noch zugrundeliegende Erkrankungen vorlagen (z.B. Diabetes, Blutandrang erzeugende Herzinsuffizienz, aktive oder chronische Infektionen in der Vorgeschichte) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Daten einer klinischen Studie zur Sepsis, die nicht spezifisch mit Patienten mit rheumatoider Arthritis durchgeführt wurde, weisen darauf hin, dass eine Behandlung mit Etanercept die Mortalität bei Patienten mit bestehender Sepsis erhöhen kann.
Im Zusammenhang mit Etanercept wurden opportunistische Infektionen, einschliesslich invasiver Pilz-, Protozoen-, Virus- (einschliesslich Herpes Zoster), Bakterien- (einschliesslich Listeria und Legionella) und atypischer Mycobakterien-Infektionen, gemeldet. In den gepoolten Datensätzen von den 15'402 mit Etanercept in klinischen Prüfungen behandelten Patienten betrug die Inzidenz aller opportunistischen Infektionen 0,09%. Die expositionsbereinigte Rate betrug 0,06 Ereignisse pro 100 Patientenjahre.
Nach Markteinführung waren etwa die Hälfte aller weltweit gemeldeten Fälle von opportunistischen Infektionen invasive Pilzinfektionen. Die am häufigsten gemeldeten invasiven Pilzinfektionen waren Candida-, Pneumocystis-, Aspergillus- und Histoplasma-Infektionen. Bei den Patienten, die opportunistische Infektionen entwickelten, waren invasive Pilzinfektionen für mehr als die Hälfte der Todesfälle verantwortlich. Die Mehrzahl der Berichte mit tödlichem Ausgang stammten von Patienten mit Pneumocystis-Pneumonie, unspezifischen systemischen Pilzinfektionen und Aspergillose (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Reaktivierung von Hepatitis B: Wie auch bei anderen Immunsuppressiva wurde über Hepatitis B Virus (HBV) Reaktivierung bei Patienten berichtet, die chronische Träger dieses Virus waren (z.B. Oberflächenantigen positiv) und mit anti-TNF-Substanzen (einschliesslich Etanercept) behandelt wurden. Ein direkter Kausalzusammenhang mit Etanercept wurde nicht festgestellt. Patienten mit Verdacht auf eine HBV Infektion sollten vor Beginn einer anti-TNF-Behandlung auf einen Hinweis einer HBV Infektion in der Anamnese abgeklärt werden. Diejenigen Patienten, die als chronische Träger (z.B. Oberflächenantigen positiv) identifiziert wurden, sollten während der Dauer der Behandlung sowie mehreren Monaten nach Beendigung der Therapie auf Anzeichen und Symptome einer aktiven HBV Infektion überwacht werden.
Malignome
Bei 4114 RA-Patienten, die in klinischen Studien über einen Zeitraum von bis zu 6 Jahren mit Etanercept behandelt wurden, einschliesslich 231 Patienten, die in der zweijährigen Wirkstoff-kontrollierten Studie mit Etanercept in Kombination mit Methotrexat behandelt wurden, traten 129 neue Malignome unterschiedlichen Typs auf. Die beobachteten Häufigkeiten und Prozentsätze entsprechen in etwa denen, die für die untersuchte Bevölkerung erwartet werden. Insgesamt wurden in klinischen Prüfungen über einen Zeitraum von etwa 2 Jahre bei 240 mit Etanercept behandelten, an Psoriasis-Arthritis erkrankten Patienten 2 maligne Erkrankungen gemeldet.
In klinischen Prüfungen, die in einem Zeitraum von mehr als 2 Jahren mit 351 an Morbus Bechterew erkrankten und mit Etanercept behandelten Patienten durchgeführt worden sind, wurden 6 maligne Erkrankungen gemeldet. In doppelblinden und offenen Studien über einen Zeitraum von bis zu 2,5 Jahren traten in einer Gruppe von 2711 mit Etanercept behandelte Plaque-Psoriasis Patienten 30 maligne Erkrankungen und 43 Fälle von nicht-melanozytärem Hautkrebs auf.
In klinischen Prüfungen wurden in einer Gruppe von 7416 an rheumatoider Arthritis, Psoriasis-Arthritis, Morbus Bechterew und Psoriasis erkrankten und mit Etanercept behandelten Patienten 18 Lymphome gemeldet.
In der post-marketing Periode wurden über verschiedene Malignome berichtet, v.a. Lymphome (s. unter «Warnhinweise und Vorsichtsmassnahmen»).
Autoantikörper
Zu mehreren Zeitpunkten wurden Serumproben von erwachsenen Patienten auf die Entwicklung von Autoantikörpern untersucht. Bei den Patienten mit rheumatoider Arthritis, die auf antinukleäre Antikörper (ANA) untersucht wurden, war der Prozentsatz von Patienten mit neuen positiven ANA (≥1:40) bei den mit Etanercept behandelten Patienten (11%) höher als bei den mit Placebo behandelten Patienten (5%). Ebenso wurde eine vermehrte Bildung von neuen positiven Antikörpern gegen die doppelsträngige DNA mit Hilfe des Radioimmunoassays (15% bei Etanercept vs. 4% bei Placebo) und mit dem Crithidia luciliae-Assay (3% bei Etanercept vs. 0 bei Placebo) festgestellt. Die Entwicklung von Antikardiolipin-Antikörpern war in der Etanercept-Gruppe ähnlich erhöht wie in der Placebo-Gruppe.
Der Einfluss einer Langzeitbehandlung mit Etanercept auf die Entstehung von Autoimmunkrankheiten ist unbekannt.
Bei Patienten, einschliesslich solchen mit Rheuma-Faktor-positiver RA, wurde in postmarketing Berichten in seltenen Fällen über Autoantikörper im Zusammenhang mit Ausschlägen, die sich klinisch oder bioptisch als subakuter Hautlupus oder scheibenförmiger Lupus präsentierten, berichtet. Zudem wurden Fälle von Lupus-ähnlichem Syndrom berichtet.
Etanercept-Antikörper
In den Sera einiger mit Etanercept behandelter Patienten wurden Antikörper nachgewiesen. Diese Antikörper waren alle nicht-neutralisierend und traten im Allgemeinen vorübergehend auf. Es scheint keinen Zusammenhang zwischen der Antikörperbildung und dem klinischen Ansprechen oder Nebenwirkungen zu bestehen.
In klinischen Studien, in denen Patienten über einen Zeitraum von bis zu 12 Monaten mit zugelassenen Etanercept-Dosierungen behandelt wurden, lag die Gesamtzahl der Antikörperraten gegen Etanercept bei ungefähr 6% bei Patienten mit rheumatoider Arthritis, 7,5% bei Patienten mit Psoriasis-Arthritis, 2% bei Patienten mit Morbus Bechterew, 7% bei Patienten mit Psoriasis (9,7% bei Kindern und Jugendlichen mit Psoriasis) und 4,8% bei Patienten mit juveniler idiopathischer Arthritis.
Der Anteil von Patienten, die in länger andauernden Studien (mit einer Dauer von bis zu 3,5 Jahren) Antikörper gegen Etanercept entwickelten, stieg mit der Zeit erwartungsgemäss an. Dennoch lag die Häufigkeit der bei jeder Auswertung nachgewiesenen Antikörper aufgrund ihres nur vorübergehenden Auftretens üblicherweise bei unter 7% bei Patienten mit rheumatoider Arthritis und denen mit Psoriasis.
In einer Langzeitstudie zu Psoriasis, in der Patienten zweimal wöchentlich 50 mg Etanercept über einen längeren Zeitraum von 96 Wochen erhielten, traten bei jeder Kontrolle Antikörper mit einer Häufigkeit von bis zu etwa 9% der Patienten auf.
In der klinischen Studie von Erelzi mit dem Etanercept-Vergleichspräparat in Patienten mit mittelschwerer bis schwerer Psoriasis wurde für beide Präparate eine vergleichbar geringe Immunogenität beobachtet.
Interstitielle Lungenerkrankung
Es gab PMS-Berichte (Post Marketing Surveillance) von interstitiellen Lungenerkrankungen (einschliesslich Pneumonitis und Lungenfibrose), in einem Teil dieser Fälle mit tödlichem Verlauf.
Laboruntersuchungen
Basierend auf den Ergebnissen der klinischen Prüfungen sind normalerweise keine speziellen Laboruntersuchungen erforderlich, die über die sorgfältige medizinische Betreuung und Beobachtung der Patienten hinausgehen.
Unter den RA-Patienten, die in den kontrollierten klinischen Studien behandelt wurden, traten bei 4% der 349 mit Etanercept behandelten Patienten schwerwiegende Nebenwirkungen auf, verglichen mit 5% der 152 mit Placebo behandelten Patienten. In der ersten Wirkstoff-kontrollierten Studie traten bei 6% der 415 mit Etanercept behandelten Patienten schwerwiegende Nebenwirkungen auf im Vergleich zu 8% der 217 mit Methotrexat behandelten Patienten. In der zweiten Wirkstoff-kontrollierten Studie war die Rate der schwerwiegenden unerwünschten Ereignisse nach zweijähriger Behandlung innerhalb der drei Behandlungsgruppen Etanercept 16%, Methotrexat 15% und Etanercept in Kombination mit Methotrexat 17% ähnlich.
Bei den im Rahmen von Placebo-kontrollierten Studien behandelten Patienten mit Plaque-Psoriasis lag die Häufigkeit von unerwünschten Wirkungen bei den mit Etanercept behandelten 933 Patienten bei 1% gegenüber 1% bei den 414 Patienten, die ein Placebo erhalten hatten.
Gleichzeitige Behandlung mit Etanercept und Anakinra
In klinischen Studien, in denen erwachsene Patienten gleichzeitig mit Etanercept und Anakinra behandelt wurden, wurde eine höhere Anzahl von schwerwiegenden Infektionen beobachtet, als wenn sie nur mit Etanercept behandelt wurden. 2% der Patienten (3/139) entwickelten eine Neutropenie (absolute Anzahl der neutrophilen Granulozyten <1000/mm3). Bei einem Patienten mit Neutropenie entwickelte sich eine Entzündung des Unterhautgewebes, die sich nach stationärer Behandlung wieder zurückbildete (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte Wirkungen bei pädiatrischen Patienten mit juveniler idiopathischer Arthritis
Die unerwünschten Ereignisse bei pädiatrischen Patienten waren im Allgemeinen bezüglich Häufigkeit und Art denjenigen bei Erwachsenen vergleichbar. Unterschiede gegenüber Erwachsenen und andere spezielle Aspekte werden in den folgenden Abschnitten erläutert.
Schwere unerwünschte Wirkungen, die bei 69 Patienten mit juveniler idiopathischer Arthritis im Alter von 2−18 Jahren beschrieben wurden, umfassten Varizellainfektion mit Symptomen einer aseptischen Meningitis, die ohne Folgen abklang (siehe «Warnhinweise und Vorsichtsmassnahmen»), Gastroenteritis, Depression/Persönlichkeitsstörungen, Hautgeschwüre und Ösophagitis/Gastritis, septischen Schock hervorgerufen durch Gruppe A Streptokokken, Type I Diabetes mellitus, Weichteilinfektion und postoperative Wundinfektion.
Bei 43 von 69 (62%) Kindern mit juveniler idiopathischer Arthritis kam es unter der Einnahme von Etanercept während der 3-monatigen Studie (Phase 1 offenes Design) zu einer Infektion. Die Häufigkeit und Schwere der Infektionen war gleich bei den 58 Patienten, die 12 Monate an der unverblindeten Fortführung der Studie teilnahmen. Die bei Patienten mit juveniler idiopathischer Arthritis beschriebenen Infektionen waren im Allgemeinen leicht und mit denjenigen vergleichbar, die normalerweise bei ambulanten pädiatrischen Patienten zu beobachten sind. Die Art und Häufigkeit anderer unerwünschter Reaktionen bei Patienten mit juveniler idiopathischer Arthritis war mit denjenigen vergleichbar, die bei Etanercept-Studien mit Erwachsenen mit rheumatoider Arthritis beobachtet wurden; diese Reaktionen waren überwiegend leicht. Einige unerwünschte Ereignisse wurden bei den 69 Patienten mit juveniler idiopathischer Arthritis, die über 3 Monate mit Etanercept behandelt wurden, im Vergleich zu den 349 Erwachsenen mit chronischer Polyarthritis beobachtet. Hierzu gehörten Kopfschmerzen (19% der Patienten, 1,7 Ereignisse pro Patientenjahr), Nausea (9%, 1,0 Ereignisse pro Patientenjahr), Bauchschmerzen (19%, 0,74 Ereignisse pro Patientenjahr) und Erbrechen (13%, 0,74 Ereignisse pro Patientenjahr).
Es lagen 4 Berichte über ein Makrophagen-Aktivierungs-Syndrom in klinischen Studien zu polyartikulärer juveniler idiopathischer Arthritis vor.
Post-marketing Quellen berichten über Fälle von chronisch-entzündlichen Darmerkrankungen (inklusive Morbus Crohn) und Uveitis in Patienten mit juveniler idiopathischer Arthritis (JIA), die mit Etanercept behandelt wurden, einschliesslich Fälle, die eine positive Rechallenge aufweisen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte Wirkungen bei Kindern und Jugendlichen mit Plaque-Psoriasis
In einer 48-wöchigen Studie mit 211 Kindern und Jugendlichen im Alter von 4 bis 17 Jahren mit Plaque-Psoriasis, waren die berichteten Nebenwirkungen denjenigen ähnlich, die in vorangegangenen Studien bei Erwachsenen mit Plaque-Psoriasis beobachtet wurden.
Morbus Crohn wurde sowohl in klinischen Studien bei mit Etanercept behandelten pädiatrischen Patienten mit Plaque Psoriasis (alle mit Psoriasis-Arthritis in der Vorgeschichte), als auch bei JIA Patienten mit manifester Psoriasis aus Post-marketing Quellen beobachtet.
Überdosierung
Die subkutane Gabe von Einzeldosen von 2000 mg Etanercept/kg oder die intravenöse Einzelgabe von 1000 mg Etanercept/kg rief in Mäusen oder Ratten keine Letalität oder sichtbaren Anzeichen von Toxizität hervor. Nach zweimal wöchentlicher subkutaner Gabe von Dosierungen (15 mg/kg), die, bezogen auf AUC, zu Serumspiegeln führten, die mehr als 27-fach höher waren als bei RA-Patienten nach Gabe der empfohlenen Dosis von 25 mg, über 4 oder 26 Wochen wurde keine Dosis-begrenzende oder Zielorgan-Toxizität durch Etanercept in Cynomolgus-Affen hervorgerufen. Auch in RA-Patienten wurde während der klinischen Studien keine Dosis-begrenzende Toxizität beobachtet. Die höchste untersuchte Dosis war die intravenöse Gabe von 32 mg/m² gefolgt von zweimal wöchentlichen subkutanen Gaben von 16 mg/m². Ein RA-Patient verabreichte sich selber versehentlich zweimal wöchentlich 62 mg Etanercept über einen Zeitraum von 3 Wochen, ohne Auftreten von unerwarteten Nebenwirkungen. Ein Antidot für Etanercept ist nicht bekannt.
Eigenschaften/Wirkungen
ATC-Code: L04AB01
Erelzi ist ein Etanercept Biosimilar. Die Biosimilarität zum Etanercept-Vergleichspräparat wurde in Studien zur Vergleichbarkeit der pharmazeutischen Qualität und biologischen Aktivität, sowie in präklinischen und klinischen Vergleichbarkeitsstudien untersucht.
Die klinische Studie mit Erelzi ist am Schluss des Kapitels zur klinischen Wirksamkeit aufgeführt.
Etanercept ist ein menschliches Tumornekrosefaktor-Rezeptor-p75-Fc-Fusionsprotein, das durch rekombinante DNA-Technologie über Genexpression an der Eierstockzelllinie des Chinesischen Hamsters (CHO) gewonnen wird. Etanercept ist ein Dimer eines chimären Proteins, das durch Verschmelzung der extrazellulären Ligandenbindungsdomäne des menschlichen Tumornekrosefaktor-Rezeptor-2 (TNFR2/p75) mit der Fc-Domäne des menschlichen IgG1 gentechnisch hergestellt wird. Diese Fc-Komponente enthält die Scharnier-, CH2- und CH3-Regionen, nicht aber die CH1-Region des IgG1. Etanercept enthält 934 Aminosäuren und hat ein Molekulargewicht von ca. 150 Kilodalton. Die Aktivität wird bestimmt durch Messung der Fähigkeit von Etanercept, die von TNFα hervorgerufene Wachstumshemmung von A375-Zellen zu neutralisieren. Die spezifische Aktivität von Etanercept beträgt 1,7× 106 Einheiten/mg.
Tumornekrosefaktor (TNF) ist ein dominantes Zytokin im Entzündungsprozess der rheumatoiden Arthritis (RA). Erhöhte TNF-Spiegel wurden ebenfalls in der Synovialis und den psoriatischen Plaques von Patienten mit Psoriasis-Arthritis sowie im Serum und im synovialen Gewebe von Patienten mit Morbus Bechterew gefunden.
Bei der Plaque-Psoriasis führt die Einwanderung von Entzündungszellen – darunter T-Zellen – im Vergleich zu nicht betroffenen Hautarealen zu erhöhten TNF-Spiegeln in psoriatischen Läsionen.
Etanercept ist ein kompetitiver Inhibitor der Bindung von TNF an seine Zelloberflächen-Rezeptoren und hemmt dadurch die biologische Aktivität von TNF.
TNF und Lymphotoxin sind pro-inflammatorische Zytokine, die an zwei unterschiedliche Zelloberflächen-Rezeptoren binden: die 55 Kilodalton (p55) und 75 Kilodalton (p75) Tumornekrosefaktor-Rezeptoren (TNFRs). Beide TNFRs kommen natürlich in Membran-gebundener und löslicher Form vor. Es wird angenommen, dass die löslichen TNFRs die biologische Aktivität von TNF regulieren.
TNF und Lymphotoxin kommen überwiegend als Homotrimere vor, deren biologische Aktivität abhängig ist von der Quervernetzung der Zelloberflächen-TNFRs. Dimere, lösliche Rezeptoren, wie Etanercept, haben eine höhere Affinität zu TNF als monomere Rezeptoren und sind deshalb stärkere kompetitive Inhibitoren der TNF-Bindung an Zellrezeptoren. Des Weiteren führt die Verwendung einer Immunglobulin Fc Region als Bindungselement bei der Bildung dimerer Rezeptoren zu einer verlängerten Serum-Halbwertszeit.
Etanercept kann auch biologische Reaktionen verändern, die durch zusätzliche Moleküle der Entzündungskaskade (z.B. Zytokine, Adhäsionsmoleküle oder Proteinasen) kontrolliert und durch TNF hervorgerufen oder gesteuert werden.
Klinische Wirksamkeit
In diesem Abschnitt werden Daten aus vier randomisierten, kontrollierten Studien und zwei zusätzlichen Studien mit offenem Design (V und VI) bei erwachsenen Patienten mit rheumatoider Arthritis, drei Studien zur juvenilen idiopathischen Arthritis, einer Studie bei erwachsenen Patienten mit Psoriasis-Arthritis, vier Studien bei erwachsenen Patienten mit Morbus Bechterew, einer Studie bei pädiatrischen Patienten mit Plaque-Psoriasis sowie vier Studien mit offenem Design bei erwachsenen Patienten mit Plaque-Psoriasis dargelegt.
Adulte rheumatoide Arthritis
Die Wirksamkeit und Sicherheit von Etanercept wurde in 2680 Patienten mit aktiver rheumatoider Arthritis (RA) untersucht.
Die Sicherheit und Wirksamkeit von Etanercept wurde in vier randomisierten, doppelblinden, Placebo-kontrollierten Studien und zwei zusätzlichen Studien (V und VI) untersucht.
Die erste Studie beurteilte 234 Patienten mit aktiver RA, die ≥18 Jahre alt waren, deren Therapie mit mindestens einem aber nicht mehr als vier krankheitsmodifizierenden Antirheumatika (DMARD, z.B. Hydroxychloroquin, orales oder injizierbares Gold, Methotrexat, Azathioprin, D-Penicillamin, Sulfasalazin) versagt hatte und die ≥12 schmerzhafte Gelenke, ≥10 geschwollene Gelenke und entweder eine BSG ≥28 mm/h, CRP >2,0 mg/dl oder eine Morgensteifigkeit für ≥45 Minuten hatten. Dosen von 10 mg oder 25 mg Etanercept oder Placebo wurden 6 Monate lang zweimal wöchentlich subkutan verabreicht.
Die Ergebnisse der kontrollierten Studie wurden als prozentuale Besserung der RA gemäss den Ansprechkriterien des American College of Rheumatology (ACR) angegeben. Der primäre Endpunkt war das Erreichen eines Ansprechens von ACR 20 nach 3 Monaten. Definitionsgemäss wird ein ACR 20 erreicht, wenn ein Patient eine 20%ige Besserung der Anzahl seiner schmerzhaften Gelenke und der Anzahl seiner geschwollenen Gelenke plus ≥20% Besserung in mindestens drei der folgenden fünf Kriterien erreicht: (1) Schmerzbeurteilung durch den Patienten, (2) globale Beurteilung durch den Patienten, (3) globale Beurteilung durch den Arzt, (4) Selbstbeurteilung der Funktionseinschränkung durch den Patienten und (5) Akute-Phase-Reaktion (BSG oder CRP). Die Ansprechgrade ACR 50 und 70 sind gemäss denselben Kriterien als 50%ige bzw. 70%ige Besserung definiert.
Nach 3 und 6 Monaten waren die ACR 20- und ACR 50-Ansprechraten bei den mit Etanercept behandelten Patienten höher als bei Patienten, die mit Placebo behandelt wurden (ACR 20: Etanercept 62% und 59%, Placebo 23% und 11% jeweils nach 3 und 6 Monaten; ACR 50: Etanercept 41% und 40%, Placebo 8% und 5% jeweils nach 3 und 6 Monaten; p<0,01 Etanercept gegenüber Placebo zu jedem Zeitpunkt sowohl für ACR 20- als auch für ACR 50-Ansprechraten).
Etwa 15% der Patienten, die Etanercept erhielten, erreichten einen Ansprechgrad von ACR 70 nach 3 Monaten und nach 6 Monaten im Vergleich zu weniger als 5% der Patienten in den Placebo-Armen.
Bei den Patienten, die Etanercept erhielten, trat die klinische Besserung im Allgemeinen innerhalb von 1 bis 2 Wochen nach Therapiebeginn und fast in allen Fällen nach 3 Monaten ein. Es wurde beobachtet, dass das Ansprechen von der verabreichten Dosis abhing; Ergebnisse mit 10 mg lagen zwischen den mit Placebo und mit 25 mg erhaltenen Ergebnissen. Etanercept war signifikant besser als Placebo in allen Komponenten der ACR-Kriterien sowie anderen Messgrössen der Krankheitsaktivität, die nicht in den ACR-Ansprechkriterien enthalten sind, wie zum Beispiel die Morgensteifigkeit. Ein Gesundheitsfragebogen (Health Assessment Questionnaire = HAQ) mit den Teilbereichen Behinderung, Vitalität, geistige Gesundheit, allgemeiner Gesundheitszustand und arthritisbezogener Gesundheitszustand wurde während der Studie alle 3 Monate ausgefüllt. Alle Teilbereiche des HAQ besserten sich bei den mit Etanercept behandelten Patienten im Vergleich zu den Kontrollen nach 3 und 6 Monaten.
Nach Absetzen von Etanercept kehrten die Arthritis-Symptome im Allgemeinen innerhalb eines Monates wieder zurück. Der Wiederbeginn der Behandlung mit Etanercept nach Absetzen von bis zu 24 Monaten führte zu demselben Grad des Ansprechens wie bei Patienten, die Erelzi ohne Therapieunterbrechung erhielten, wie Ergebnisse offener Studien zeigten. In offenen Verlängerungsstudien, in denen die Patienten Etanercept ohne Unterbrechung erhielten, wurde ein dauerhaftes Ansprechen auf die Behandlung bis zu 10 Jahre beobachtet.
In einer randomisierten, Wirkstoff-kontrollierten Studie mit verblindeter röntgenologischer Auswertung als primärem Endpunkt wurde die Wirksamkeit von Etanercept mit der nach oraler Gabe von Methotrexat verglichen. In die Studie eingeschlossen waren 632 erwachsene Patienten mit aktiver rheumatoider Arthritis (<3 Jahre seit Krankheitsbeginn), die zuvor nicht mit Methotrexat behandelt worden waren. Die Einschlusskriterien waren >12 druckempfindliche Gelenke, >10 geschwollene Gelenke, und entweder eine Blutsenkgeschwindigkeit von >28 mm/h, eine Serumkonzentration von C-reaktivem Protein von >2,0 mg/dl oder aber eine Morgensteifigkeit über >45 Minuten. Dosierungen von 10 mg oder 25 mg Etanercept wurden über eine Dauer von bis zu 24 Monaten zweimal wöchentlich subkutan verabreicht. Die Methotrexat-Dosen wurden von 7,5 mg/Woche bis maximal 20 mg/Woche innerhalb der ersten 8 Studienwochen erhöht und danach für eine Dauer von bis zu 24 Monaten beibehalten. Die mit 25 mg Etanercept erzielte klinische Besserung sowie das Ansprechen auf die Therapie innerhalb von 2 Wochen entsprachen den Beobachtungen in den vorherigen Studien und hielten über die Dauer von bis zu 24 Monaten an. Durch die Gabe von 25 mg Etanercept wurde ein im Vergleich zu Methotrexat schneller Wirkungseintritt erzielt. Bei Studienbeginn war die Bewegungsfreiheit der Patienten mittelmässig eingeschränkt, mit einem mittleren HAQ Score von 1,4−1,5. Die Behandlung mit 25 mg Etanercept führte nach 12 Monaten zu einer erheblichen Verbesserung. Dabei erzielten etwa 44% der Patienten einen Wert im Normbereich (HAQ Score <0,5). Dieser Erfolg hielt auch im zweiten Studienjahr an.
In dieser Studie wurde die Schädigung der Gelenkstruktur röntgenologisch beurteilt und als Änderung des TSS (Total Sharp Score) und seiner Komponenten «Ausmass der Erosionen» und «Ausmass der Verkleinerung des Gelenkspaltes (Joint space narrowing score, JSN)» ausgedrückt. Röntgenbilder von Händen/Handgelenken und Füssen wurden zu Studienbeginn und nach einer Behandlungsdauer von 6, 12 und 24 Monaten ausgewertet. Dabei hatte die Gabe von 10 mg Etanercept durchgehend weniger Wirkung auf die Gelenkschäden als 25 mg Etanercept. In der 24-monatigen Studie waren 25 mg Etanercept der Methotrexat-Behandlung bezüglich TSS und dem Ausmass der Erosionen signifikant überlegen. Die Ergebnisse der Röntgenuntersuchungen sind nachfolgend grafisch dargestellt.
Röntgenologische Entwicklung: Vergleich von Etanercept vs. Methotrexat bei Patienten mit rheumatioder Arthritis von <3-jähriger Erkrankungsdauer
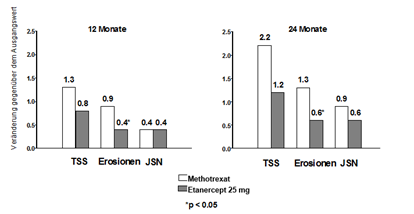
In einer weiteren Wirkstoff-kontrollierten, doppelblinden, randomisierten Studie wurden die klinische Wirksamkeit, die Unbedenklichkeit und die röntgenologische Progression bei Patienten mit rheumatoider Arthritis, die mit Etanercept als Monotherapie (25 mg zweimal wöchentlich), Methotrexat als Monotherapie (7,5 bis 20 mg wöchentlich, Dosis im Median 20 mg) behandelt wurden, und die gleichzeitig gestartete Kombinationstherapie von Etanercept und Methotrexat verglichen. In die Studie waren 682 erwachsene Patienten mit aktiver rheumatoider Arthritis (6-monatige bis 20-jährige Dauer; Median 5 Jahre) eingeschlossen, die ein weniger als zufriedenstellendes Ansprechen auf mindestens 1 Basistherapeutikum (DMARD), ausser Methotrexat, aufwiesen.
Patienten unter Kombinationstherapie mit Etanercept und Methotrexat zeigten bedeutend bessere ACR 20-, ACR 50-, ACR 70-Ansprechraten und eine Verbesserung des Disease Activity Score (DAS) und des HAQ-Score nach 24 und 52 Wochen als Patienten einer der einzelnen Therapiegruppen (Ergebnisse siehe nachfolgende Tabelle). Nach 24 Monaten wurden ebenfalls signifikante Vorteile einer Kombinationstherapie mit Etanercept und Methotrexat gegenüber einer Monotherapie mit Etanercept oder Methotrexat beobachtet.
Ergebnisse der klinischen Wirksamkeit nach 12 Monaten: Vergleich von Etanercept vs. Methotrexat vs. Etanercept in Kombination mit Methotrexat bei Patienten mit rheumatoider Arthritis von 6-monatiger bis 20-jähriger Erkrankungsdauer
|
Endpunkt |
Methotrexat |
Etanercept |
Etanercept + Methotrexat |
|
ACR-Ansprechena | |||
|
ACR 20 |
58,8% |
65,5% |
74,5%†,φ |
|
ACR 50 |
36,4% |
43,0% |
63,2%†,φ |
|
ACR 70 |
16,7% |
22,0% |
39,8%†,φ |
|
DAS | |||
|
Ausgangswertb |
5,5 |
5,7 |
5,5 |
|
Woche 52b |
3,0 |
3,0 |
2,3†,φ |
|
Remissionc |
14% |
18% |
37%†,φ |
|
HAQ | |||
|
Ausgangswert |
1,7 |
1,7 |
1,8 |
|
Woche 52 |
1,1 |
1,0 |
0,8†,φ |
a: Patienten, die die 12 Monate in der Studie nicht beendeten, wurden als Non-Responder angesehen.
b: Werte für DAS sind Mittelwerte.
c: Remission wird definiert als DAS <1,6.
Paarweiser Vergleich der p-Werte:
†: p<0,05 für den Vergleich von Etanercept + Methotrexat vs. Methotrexat.
φ: p<0,05 für den Vergleich von Etanercept + Methotrexat vs. Etanercept.
Nach 12 Monaten war die röntgenologische Progression in der Etanercept -Gruppe signifikant geringer als in der Methotrexat-Gruppe, während die Kombinationstherapie bei der Verlangsamung der röntgenologischen Progression signifikant besser war als beide Monotherapien (siehe unten stehende Grafik).
Röntgenologische Progression: Vergleich von Etanercept vs. Methotrexat vs. Etanercept in Kombination mit Methotrexat bei Patienten mit rheumatoider Arthritis von 6-monatiger bis 20-jähriger Erkrankungsdauer (12-Monats-Ergebnisse)
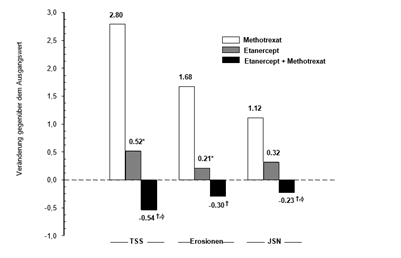
Paarweiser Vergleich der p-Werte:
*: p<0,05 für den Vergleich von Etanercept vs. Methotrexat.
†: p<0,05 für den Vergleich von Etanercept + Methotrexat vs. Methotrexat.
φ: p<0,05 für den Vergleich von Etanercept + Methotrexat vs. Etanercept.
Nach 24 Monaten wurden ebenfalls signifikante Vorteile der Kombinationstherapie mit Etanercept und Methotrexat gegenüber einer Monotherapie mit Etanercept oder Methotrexat beobachtet. In ähnlicher Weise wurden nach 24 Monaten auch signifikante Vorteile einer Monotherapie mit Etanercept im Vergleich zu einer Monotherapie mit Methotrexat beobachtet.
In der Analyse wurden alle Patienten, die die Studie aus irgend einem Grund abbrachen, als Patienten mit Progression angesehen, wobei der Prozentsatz an Patienten ohne Progression (TSS Änderung ≤0,5) nach 24 Monaten in den mit Etanercept in Kombination mit Methotrexat behandelten Patientengruppen im Vergleich zu denen, die nur mit Etanercept oder nur mit Methotrexat behandelt wurden (62%, 50% bzw. 36%; p<0,05), grösser war. Der Unterschied zwischen einer Monotherapie mit Etanercept oder Methotrexat war ebenfalls signifikant (p<0,05). Bei Patienten, die die gesamte Therapie von 24 Monaten absolvierten, lagen die Nicht-Progressionsraten bei jeweils 78%, 70% bzw. 61%.
Die Unbedenklichkeit und Wirksamkeit von 50 mg Etanercept (zwei subkutane Injektionen zu je 25 mg) wurden in einer doppelblinden, Placebo-kontrollierten Studie bei 420 Patienten mit aktiver rheumatoider Arthritis bewertet. In dieser Studie erhielten 53 Patienten Placebo, 214 Patienten einmal wöchentlich 50 mg Etanercept sowie 153 Patienten zweimal wöchentlich 25 mg Etanercept. Die Sicherheits- und Wirksamkeitsprofile der beiden Behandlungsregime für Etanercept waren in der achten Woche bezüglich des Effektes auf Zeichen und Symptome der rheumatoiden Arthritis vergleichbar.
Nach 16 Wochen Behandlung ergab sich jedoch keine Äquivalenz zwischen beiden Dosierungen, bei einem nicht-signifikanten Trend zugunsten der häufigeren Gabe von Etanercept.
Eine Einzel-Injektion von 50 mg/ml Etanercept war bioäquivalent mit zwei zum gleichen Zeitpunkt verabreichten Injektionen zu je 25 mg.
Die Studie V untersuchte 89 Patienten mit ähnlichen Einschlusskriterien wie in der zuerst aufgeführten Studie, ausser dass die Patienten in Studie V zusätzlich mindestens 6 Monate lang Methotrexat mit einer stabilen Dosis (12,5 bis 25 mg/Woche) für mindestens 4 Wochen erhalten hatten und mindestens 6 schmerzhafte Gelenke hatten. Die Patienten erhielten zusätzlich zu ihrer stabilen Dosis von Methotrexat 6 Monate lang eine Dosis von 25 mg Etanercept oder Placebo zweimal wöchentlich subkutan.
In der Studie VI schliesslich wurden 559 Patienten untersucht, die ähnliche Einschlusskriterien wie in der zuerst aufgeführten Studie erfüllten. Die Patienten wurden bis zu 6 Monate lang mit einem von vier Dosierungsschemata von Etanercept (10 mg einmal wöchentlich, 10 mg zweimal wöchentlich, 25 mg einmal wöchentlich oder 25 mg zweimal wöchentlich) behandelt.
Die Ergebnisse der kontrollierten Studien V und VI wurden als prozentuale Besserung der RA gemäss den Ansprechkriterien des American College of Rheumatology (ACR) angegeben. In der Studie V war der primäre Endpunkt war das Erreichen eines Ansprechens von ACR 20 nach 6 Monaten. Definitionsgemäss wird ein ACR 20 erreicht, wenn ein Patient eine 20%ige Besserung der Anzahl seiner schmerzhaften Gelenke und der Anzahl seiner geschwollenen Gelenke plus ≥20% Besserung in mindestens drei der folgenden fünf Kriterien erreicht: (1) Schmerzbeurteilung durch den Patienten, (2) globale Beurteilung durch den Patienten, (3) globale Beurteilung durch den Arzt, (4) Selbstbeurteilung der Funktionseinschränkung durch den Patienten und (5) Akute-Phase-Reaktion (BSG oder CRP). Die Ansprechgrade ACR 50 und 70 sind gemäss denselben Kriterien als 50%ige bzw. 70%ige Besserung definiert. In der Studie VI war der primäre Endpunkt die prozentuale Besserung der schmerzhaften und geschwollenen Gelenke nach 3 Monaten.
Der Grad des Ansprechens war bei den mit Etanercept behandelten Patienten nach 3 und 6 Monaten in den Studien V und VI höher.
In der Studie V erreichten etwa 15% der Patienten, die Etanercept erhielten, einen Ansprechgrad von ACR 70 nach 3 Monaten und nach 6 Monaten im Vergleich zu weniger als 5% der Patienten in den Placebo-Armen. Bei den Patienten, die Etanercept erhielten, trat die klinische Besserung im Allgemeinen innerhalb von 1 bis 2 Wochen nach Therapiebeginn und fast in allen Fällen nach 3 Monaten ein.
Kinder und Jugendliche mit juveniler idiopathischer Arthritis
Die Sicherheit und Wirksamkeit von Etanercept wurde in einer zweiphasigen Studie bei 69 Kindern mit polyartikulär verlaufender juveniler idiopathischer Arthritis untersucht, bei denen die Erkrankung in unterschiedlichen Formen (Polyarthritis, Oligoarthritis, systemischer Beginn) einsetzte. In die Studie wurden Patienten im Alter zwischen 4 und 17 Jahren mit mässiger bis schwerer aktiver, polyartikulär verlaufender juveniler idiopathischer Arthritis aufgenommen, die nicht auf eine Behandlung mit Methotrexat ansprachen oder bei denen eine Methotrexatintoleranz bestand. Die Patienten erhielten weiterhin eine stabile Dosis eines einzelnen nichtsteroidalen Antirheumatikums und/oder Prednisolon (<0,2 mg/kg/Tag bzw. maximal 10 mg). In der ersten Phase der Studie erhielten alle Patienten 0,4 mg/kg Etanercept (maximal 25 mg pro Dosis) subkutan zweimal wöchentlich. In der zweiten Phase wurden die Patienten mit einer klinischen Reaktion an Tag 90 über vier Monate in die Behandlungsarme Etanercept oder Placebo randomisiert und auf ein Aufflammen der Erkrankung überwacht. Das Ansprechen wurde anhand des American College of Rheumatology Pedatric (ACR Pedi) 30-Score beurteilt. Diese wird als eine Verbesserung von ≥30% bei mindestens drei von sechs und einer Verschlechterung von ≥30% bei nicht mehr als einem von sechs JRA-Schlüsselkriterien definiert, u.a. die Anzahl der aktiven Gelenke, Bewegungseinschränkung, Gesamtbeurteilung durch Arzt und Patient/Eltern, funktionale Beurteilung und Blutsenkungsreaktion (BSR). Ein Aufflammen der Erkrankung wurde als eine Verschlechterung von ≥30% bei drei von sechs JRA-Schlüsselkriterien, eine Verbesserung von ≥30% bei nicht mehr als einem der sechs JRA-Schlüsselkriterien sowie ein Minimum von zwei aktiven Gelenken definiert.
In Phase 1 der Studie zeigten 51 von 69 Patienten (74%) eine klinische Reaktion und wurden in Phase 2 aufgenommen. In dieser zweiten Phase kam es bei 6 von 25 Patienten (24%), die weiterhin Etanercept erhielten, zu einem Aufflammen der Erkrankung im Vergleich zu 20 von 26 Patienten (77%), die Placebo erhielten (p=0,007). Vom Beginn der zweiten Phase an betrug die mittlere Zeit bis zum Aufflammen ≥116 Tage bei Patienten, die Etanercept erhielten und 26 Tage bei Patienten unter Placebo. Jede Komponente der JRA-Schlüsselkriterien verschlimmerte sich im Behandlungsarm Placebo und blieb im Behandlungsarm Etanercept stabil bzw. verbesserte sich sogar. Die Daten legten die Möglichkeit einer höheren Aufflammrate unter Patienten mit einer höheren BSR zur Baseline nahe. Von den Patienten, die an Tag 90 eine klinische Reaktion aufwiesen und in Phase 2 der Studie aufgenommen wurden, zeigten einige der Patienten, die weiterhin Etanercept erhielten, von Monat 3 bis Monat 7 weitere Verbesserungen, während jene, die Placebo erhielten, keine Verbesserungen aufwiesen.
Bei 58 pädiatrischen Patienten (Alter bei Studieneinschluss ab 4 Jahre) aus der oben beschriebenen Studie wurde die Behandlung mit Etanercept bis zu 10 Jahre in einer offenen Langzeitstudie zur Prüfung der Sicherheit fortgesetzt. Die Häufigkeit von schwerwiegenden Nebenwirkungen und schwerwiegenden Infektionen nahm während der Langzeitanwendung nicht zu.
Die Langzeitsicherheit einer Etanercept-Monotherapie (n=103), Etanercept in Kombination mit Methotrexat (n=294) oder einer Methotrexat-Monotherapie (n=197) wurde in einer Registerstudie über 3 Jahre an 594 Kindern im Alter von 2−18 Jahren mit juveniler idiopathischer Arthritis untersucht. Davon waren 39 Kinder im Alter von 2−3 Jahren. Bei Patienten, die mit Etanercept im Vergleich zu Methotrexat alleine behandelt wurden, wurden allgemein häufiger Infektionen berichtet (3,8 versus 2%) und die mit der Anwendung von Etanercept assoziierten Infektionen waren von schwerwiegenderer Art.
In einer anderen offenen, einarmigen Studie wurden 60 Patienten mit erweiterter (extended) Oligoarthritis (15 Patienten im Alter von 2−4, 23 Patienten im Alter von 5−11 und 22 Patienten im Alter von 12−17 Jahren), 38 Patienten mit Enthesitis-assoziierter Arthritis (12−17 Jahre alt) und 29 Patienten mit Psoriasis-Arthritis 12−17 Jahre alt) über 12 Wochen mit einer wöchentlichen Dosis von 0,8 mg/kg KG Etanercept (bis zu einer Maximaldosis von 50 mg) behandelt. In jedem JIA-Subtyp erfüllte die Mehrheit der Patienten die ACR-Pedi-30-Kriterien und zeigten klinische Verbesserungen in sekundären Endpunkten wie Anzahl schmerzhafter Gelenke und Gesamtbeurteilung des Arztes. Das Sicherheitsprofil war mit demjenigen aus anderen JIA-Studien konsistent.
Es wurden keine Studien an Patienten mit juveniler idiopathischer Arthritis durchgeführt, um den Einfluss einer kontinuierlichen Etanercept-Behandlung bei Patienten zu beurteilen, die nicht innerhalb von 3 Monaten nach Therapiebeginn auf Etanercept ansprechen. Es wurden ebenfalls keine Studien bei Patienten mit JIA durchgeführt, um die Auswirkungen eines Absetzens oder einer Reduktion der empfohlenen Etanercept-Dosis nach Langzeitanwendung zu untersuchen.
Erwachsene Patienten mit Psoriasis-Arthritis
Die Wirksamkeit von Etanercept wurde in einer randomisierten, doppelblinden, Placebo-kontrollierten Studie bei 205 Patienten mit Psoriasis-Arthritis untersucht. Die Patienten waren in einem Alter von 18 bis 70 Jahren und hatten eine aktive Psoriasis-Arthritis (≥3 geschwollene Gelenke, ≥3 druckempfindliche Gelenke) in mindestens einer der folgenden Verlaufsformen: (1) Befall der distalen Interphalangealgelenke (DIP); (2) polyartikuläre Arthritis (Fehlen von Rheumaknoten und Vorliegen einer Psoriasis); (3) Arthritis mutilans; (4) asymmetrische Psoriasis-Arthritis; oder (5) Spondylitis-ähnliche Ankylose. Die Patienten hatten auch Psoriasis (Plaque-Typ), bei der die charakteristische Zielläsion einen Durchmesser von ≥2 cm aufwies. Die Patienten waren zuvor mit nicht-steroidalen Antirheumatika (86%), Basistherapeutika (80%) und Kortikosteroiden (24%) behandelt worden. Die Patienten, die gleichzeitig mit Methotrexat behandelt wurden (konstante Dosis für ≥2 Monate), konnten die Methotrexat-Therapie mit der eingestellten Dosis von ≤25 mg Methotrexat/Woche fortsetzen. Etanercept in einer Dosierung von 25 mg (basierend auf Dosis-Findungsstudien bei Patienten mit rheumatoider Arthritis) oder Placebo wurden zweimal wöchentlich subkutan über eine Dauer von 6 Monaten verabreicht. Am Ende der doppelblinden Studie konnten die Patienten an einer offenen Langzeit-Fortsetzungsstudie mit einer Gesamtlaufzeit von bis zu 2 Jahren teilnehmen.
Das klinische Ansprechen wurde als Prozentsätze der Patienten, die eine Ansprechrate von ACR 20, 50 oder 70 erreichten, und als Prozentsätze der Patienten mit einer Besserung der Psoriasis-Arthritis-Ansprechkriterien (Psoriatic Arthritis Response Criteria, PsARC) ausgedrückt. Die Ergebnisse sind in der nachfolgenden Tabelle zusammengefasst.
Ansprechraten der Patienten mit Psoriasis-Arthritis in Placebo-kontrollierten Studien
|
|
Prozentsatz der Patienten | |
|
Placebo |
Etanercept a | |
|
Ansprechen der Psoriasis-Arthritis |
n=104 |
n=101 |
|
ACR 20 | ||
|
Monat 3 |
15 |
59b |
|
Monat 6 |
13 |
50b |
|
ACR 50 | ||
|
Monat 3 |
4 |
38b |
|
Monat 6 |
4 |
37b |
|
ACR 70 | ||
|
Monat 3 |
0 |
11b |
|
Monat 6 |
1 |
9c |
|
PsARC | ||
|
Monat 3 |
31 |
72b |
|
Monat 6 |
23 |
70b |
a: 25 mg Etanercept subkutan zweimal wöchentlich
b: p<0,001, Etanercept im Vergleich zu Placebo.
c: p<0,01, Etanercept im Vergleich zu Placebo.
Bei den Patienten mit Psoriasis-Arthritis, die mit Etanercept behandelt wurden, war das klinische Ansprechen bereits beim ersten Besuch (nach 4 Wochen) feststellbar und hielt über die gesamte Therapiedauer von 6 Monaten an. Etanercept war signifikant besser als Placebo in allen Parametern der Krankheitsaktivität (p<0,001). Die Ansprechraten waren mit und ohne Methotrexat als Begleitmedikation miteinander vergleichbar. Die Lebensqualität der Patienten mit Psoriasis-Arthritis wurde zu jedem Zeitpunkt mit Hilfe der im HAQ aufgeführten Fragen zu physischen Einschränkungen ermittelt. Im Vergleich zu Placebo zeigte sich bei den mit Etanercept behandelten Patienten zu allen Zeitpunkten eine signifikante Besserung der Parameter zu physischen Einschränkungen (p<0,001).
In der Studie zur Psoriasis-Arthritis wurden röntgenologische Veränderungen bewertet. Röntgenbilder von Händen und Handgelenken wurden zu Studienbeginn und nach einer Behandlungsdauer von 6, 12 und 24 Monaten ausgewertet. Der modifizierte Total Sharp Score (TSS) nach 12 Monaten wird in der nachfolgenden Tabelle aufgeführt:
Mittlere jährliche Abweichung des Total Sharp Score vom Ausgangswert
|
|
Placebo |
Etanercept |
|
Monat 12 |
1,00 (0,29) |
-0,03 (0,09)a |
a: p=0,0001, im Vergleich zu Placebo.
Die Etanercept-Behandlung führte zu einer Besserung der körperlichen Funktionsfähigkeit während der doppelblinden Phase, die während des längeren Behandlungszeitraums von bis zu 2 Jahren anhielt.
Aufgrund der geringen untersuchten Patientenzahl gibt es nur unzureichende Indizien zur Wirksamkeit von Etanercept bei Patienten mit einer der ankylosierenden Spondylitis ähnlichen Verlaufsform der Psoriasis-Arthritis.
Es wurde keine Studie bei Patienten mit Psoriasis Arthritis unter Anwendung des Dosierungsschemas von 50 mg Etanercept einmal wöchentlich durchgeführt. Die Evidenz zur Wirksamkeit dieses Verabreichungsschemas bei Patienten mit Psoriasis Arthritis stützt sich auf die Resultate einer Studie bei Patienten mit Morbus Bechterew.
Erwachsene Patienten mit Morbus Bechterew
Die Wirksamkeit von Etanercept bei Morbus Bechterew wurde in vier randomisierten, doppelblinden Studien bei 401 Patienten mit Morbus Bechterew untersucht, indem die 2-mal wöchentliche Gabe von 25 mg Etanercept verglichen wurde mit Placebo. Insgesamt wurden 401 Patienten in die Studie aufgenommen, von denen 203 mit Etanercept behandelt wurden. Die umfangreichste Studie schloss Patienten (n=277) im Alter von 18 bis 70 Jahren mit aktivem Morbus Bechterew ein. Der aktive Morbus Bechterew war definiert durch jeweils ≥30 Punkte auf den visuellen Analogskalen (VAS) für die jeweils durchschnittliche Dauer und Intensität der Morgensteifigkeit sowie mit einem VAS-Wert ≥30 bei mindestens 2 der folgenden 3 Parametern: globale Einschätzung durch den Patienten, durchschnittliche VAS-Werte für nächtliche und globale Rückenschmerzen, Durchschnittswert aus den 10 Fragen des Bath Ankylosing Spondylitis Functional Index (BASFI). Patienten, die auf Basistherapeutika, nicht-steroidale Antirheumatika oder Kortikosteroide eingestellt waren, konnten diese in unveränderter Dosierung fortführen. Patienten mit vollständiger Ankylose der Wirbelsäule wurden nicht in die Studie aufgenommen. Etanercept in einer Dosierung von 25 mg (basierend auf Dosisfindungsstudien bei Patienten mit rheumatoider Arthritis) oder Placebo wurde für die Dauer von 6 Monaten zweimal wöchentlich subkutan verabreicht.
Die primäre Messung der Wirksamkeit bestand in einer 20%igen Verbesserung gemäss Assessment in Ankylosing Spondylitis-Ansprechkriterien (ASAS 20). Schon 2 Wochen nach Therapiebeginn führte die Behandlung mit Etanercept im Vergleich zu Placebo zu einer signifikanten Verbesserung der ASAS 20, ASAS 50 und ASAS 70 Kriterien (siehe nachfolgende Tabelle).
Ansprechraten bei Patienten mit Morbus Bechterew in einer Placebo-kontrollierten Studie
|
|
Prozentsatz der Patienten | |
|
Ansprechrate des Morbus Bechterew |
Placebo |
Etanercept |
|
ASAS 20 | ||
|
2 Wochen |
22 |
46a |
|
3 Monate |
27 |
60a |
|
6 Monate |
23 |
58a |
|
ASAS 50 | ||
|
2 Wochen |
7 |
24a |
|
3 Monate |
13 |
45a |
|
6 Monate |
10 |
42a |
|
ASAS 70 | ||
|
2 Wochen |
2 |
12b |
|
3 Monate |
7 |
29b |
|
6 Monate |
5 |
28b |
a : p<0,001, Etanercept im Vergleich zu Placebo.
b : p=0,002, Etanercept im Vergleich zu Placebo.
Eine signifikante Verbesserung wurde ausserdem bei anderen Parametern zur Bestimmung der Krankheitsaktivität bei Patienten mit Morbus Bechterew beobachtet. Im Vergleich zu Placebo zeigte Etanercept eine signifikante Verbesserung aller Parameter der ASAS-Kriterien (globale Einschätzung durch den Patienten, nächtliche und globale Rückenschmerzen, BASFI und Entzündung), C-reaktives Protein und Blutsenkungsgeschwindigkeit, globale Einschätzung durch den Arzt sowie Beweglichkeit der Wirbelsäule (Schober-Test, Thoraxexpansion, Hinterkopf-Wand-Abstand).
Unter den mit Etanercept behandelten Patienten mit Morbus Bechterew traten die klinischen Ansprechraten zum Zeitpunkt des ersten Besuchs (nach 2 Wochen) auf und blieben während der 6-monatigen Therapie gleich. Die Ansprechraten waren bei den Patienten vergleichbar, unabhängig davon, ob sie zum Zeitpunkt der Baseline-Visite eine Begleitbehandlung erhielten.
In den zwei kleineren klinischen Studien bei Morbus Bechterew wurden ähnliche Ergebnisse erzielt.
In einer vierten Untersuchung wurde in einer doppelblinden, Placebo-kontrollierten Studie mit 356 Patienten mit Morbus Bechterew die Sicherheit und Wirksamkeit von 50 mg Etanercept (2 subkutane Injektionen zu 25 mg) verabreicht 1-mal wöchentlich versus 25 mg Etanercept verabreicht 2-mal wöchentlich geprüft. Das Sicherheits- und Wirksamkeitsprofil der beiden Verabreichungsschematas (50 mg 1-mal wöchentlich oder 25 mg 2-mal wöchentlich) waren ähnlich.
Erwachsene Patienten mit Plaque-Psoriasis
Die Sicherheit und Wirksamkeit von Etanercept wurde in vier randomisierten, doppelblinden, Placebo-kontrollierten Studien ermittelt.
Psoriasis-Erkrankte in der Bevölkerung, die «nicht angesprochen haben», sind definiert durch ein unzureichendes Ansprechen (PASI <50 oder PGA, Patient Global Assessment, weniger als gut) oder eine Verschlechterung der Erkrankung während der Behandlung. Dabei mussten die Patienten für eine ausreichend lange Dauer adäquat dosiert sein, um ein Ansprechen auf mindestens jede der drei massgeblichen verfügbaren systemischen Therapien beurteilen zu können.
Die Wirksamkeit von Etanercept im Vergleich zu anderen systemischen Therapien bei Patienten mit mittelschwerer bis schwerer Psoriasis (Ansprechen auf andere systemische Therapien) wurde im Rahmen von Studien, die Etanercept konkret mit anderen systemischen Therapien vergleichen, nicht untersucht. Stattdessen wurde die Unbedenklichkeit und Wirksamkeit von Etanercept in vier randomisierten, doppelblinden, Placebo-kontrollierten Studien untersucht. Der primäre Endpunkt für die Wirksamkeit in allen vier Studien war der Anteil an Patienten in jedem Behandlungsarm, der nach 12 Wochen PASI 75 (d.h. eine Verbesserung von mindestens 75% bezogen auf den PASI-Ausgangswert) erreicht hatte.
Bei der Studie 1 handelte es sich um eine Phase-2-Studie mit Patienten im Alter von ≥18 Jahren mit einer aktiven, aber klinisch stabilen Plaque-Psoriasis, von der ≥10% der Körperoberfläche betroffen war. 112 Patienten wurden randomisiert und erhielten entweder zweimal in der Woche eine Etanercept-Dosis von 25 mg (n=57) oder zweimal in der Woche Placebo (n=55) für einen Zeitraum von 24 Wochen.
In Studie 2 wurden 652 Patienten mit chronischer Plaque-Psoriasis beurteilt; die Einschlusskriterien waren mit denen der Studie 1 identisch. Zusätzlich musste ein Psoriasis Area and Severity Index (PASI) von mindestens 10 während der Screeningphase vorliegen. Etanercept wurde subkutan in einer Dosierung von 25 mg einmal wöchentlich, 25 mg zweimal wöchentlich oder 50 mg zweimal wöchentlich über einen Zeitraum von 6 Monate verabreicht. In den ersten 12 Wochen des doppelblinden Behandlungszeitraums erhielten die Patienten Placebo oder Etanercept in einer der drei oben genannten Dosierungen. Nach einer Behandlungsdauer von 12 Wochen wurde bei den Patienten der Placebogruppe verblindet mit der Etanercept -Behandlung begonnen (25 mg zweimal wöchentlich); die Patienten der aktiven Behandlungsgruppen fuhren bis Woche 24 mit der Behandlung in der bei der Randomisierung festgelegten Dosierung fort.
In Studie 3 wurden 583 Patienten beurteilt; die Einschlusskriterien waren mit denen der Studie 2 identisch. Den Patienten in dieser Studie wurde Etanercept in einer Dosierung von 25 mg oder 50 mg oder Placebo zweimal wöchentlich für einen Zeitraum von 12 Wochen subkutan verabreicht. Anschliessend erhielten alle Patienten offen 25 mg Etanercept zweimal wöchentlich für einen Zeitraum von weiteren 24 Wochen.
In Studie 4 wurden 142 Patienten untersucht, die Einschlusskriterien waren ähnlich zu Studie 1 und 2. Den Patienten in dieser Studie wurde Etanercept in einer Dosierung von 50 mg oder Placebo einmal pro Woche für einen Zeitraum von 12 Wochen verabreicht. Anschliessend erhielten alle Patienten offen 50 mg Etanercept einmal wöchentlich für einen Zeitraum von weiteren 12 Wochen.
In Studie 1 wies die Gruppe der Patienten, die mit Etanercept behandelt worden war, in Woche 12 eine signifikant höhere PASI 75-Ansprechrate (30%) auf als die mit Placebo behandelte Gruppe (2%) (p<0,0001). Nach 24 Wochen hatten 56% der Patienten in der mit Etanercept behandelten Gruppe den PASI 75 erreicht, im Vergleich zu 5% der mit Placebo behandelten Patienten. Die wichtigsten Ergebnisse der Studien 2, 3 und 4 sind unten aufgeführt.
Ansprechraten bei Patienten mit Psoriasis in Studie 2, 3 und 4
|
|
Studie 2 |
Studie 3 |
Studie 4 | ||||||||
|
Placebo |
Etanercept |
Placebo |
Etanercept |
Placebo |
Etanercept | ||||||
|
25 mg |
50 mg |
25 mg |
50 mg |
50 mg einmal |
50 mg | ||||||
|
n=166 |
n=162 |
n=162 |
n=164 |
n=164 |
n=193 |
n=196 |
n=196 |
n=46 |
n=96 |
n=90 | |
|
Ansprechen |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
Woche |
|
PASI 50 [%] |
14 |
58* |
70 |
74* |
77 |
9 |
64* |
77* |
9 |
69* |
83 |
|
PASI 75 [%] |
4 |
34* |
44 |
49* |
59 |
3 |
34* |
49* |
2 |
38* |
71 |
|
DSGAb, befallsfrei bzw. nahezu befallsfrei [%] |
5 |
34* |
39 |
49* |
55 |
4 |
39* |
57* |
4 |
39* |
64 |
*: p≤0,0001 im Vergleich zu Placebo.
a: In Studie 2 und 4 wurden in Woche 24 keine statistischen Vergleiche zu Placebo durchgeführt, weil die ursprüngliche Placebo-Gruppe von Woche 13 bis Woche 24 Etanercept in einer Dosierung von 25 mg zweimal wöchentlich oder 50 mg einmal wöchentlich erhalten hatte.
b: Dermatologist Static Global Assessment. Befallsfrei bzw. nahezu befallsfrei, definiert als 0 oder 1 auf einer Skala von 0 bis 5.
Bei den Patienten mit Plaque-Psoriasis, die Etanercept erhielten, zeigten sich im Vergleich zu Placebo bereits zum Zeitpunkt des ersten Besuches (nach 2 Wochen) signifikante Ansprechraten, die während der 24-wöchigen Behandlung aufrecht erhalten wurden.
Bei Studie 2 gab es zudem einen Absetz-Zeitraum, innerhalb dessen die Behandlung bei Patienten mit einem PASI-Ansprechen von mindestens 50% in Woche 24 beendet wurde. In der behandlungsfreien Zeit wurde bei den Patienten das Auftreten von Rebounds (PASI ≥150% des Ausgangswertes) und die Zeit bis zum Rezidiv (definiert als Verschlechterung um mindestens die Hälfte des Wertes, der zwischen Baseline und Woche 24 erreicht worden war) beobachtet. Während des Absetz-Zeitraums kehrten die Symptome der Psoriasis allmählich zurück; bis zum Rezidiv der Erkrankung vergingen median 3 Monate. Es wurden weder ein Rebound-Effekt noch Psoriasis-bedingte schwerwiegende unerwünschte Ereignisse beobachtet. Der Nutzen einer erneuten Etanercept-Behandlung bei Patienten, die ursprünglich auf die Behandlung angesprochen hatten, konnte belegt werden.
In Studie 3 blieb bei der Mehrzahl der Patienten (77%), die ursprünglich in die Gruppe mit zweimal wöchentlich 50 mg randomisiert worden waren und deren Etanercept-Dosis in Woche 12 auf zweimal wöchentlich 25 mg verringert wurde, die PASI 75-Ansprechrate bis Woche 36 gleich. Bei den Patienten, die während der gesamten Studie zweimal wöchentlich 25 mg erhielten, verbesserte sich die PASI 75-Ansprechrate stetig zwischen Woche 12 und 36.
In Studie 4 wies in Woche 12 die Gruppe der mit Etanercept behandelten Patienten einen höheren Anteil an Patienten mit PASI-75-Rate auf (38%), verglichen mit der mit Placebo behandelten Gruppe (2%) (p<0,0001). Bei den Patienten, die während der ganzen Studie 50 mg einmal wöchentlich verabreicht erhielten, verbesserte sich die Wirksamkeit weiter, in Woche 24 erreichten 71% eine PASI-75-Rate.
In offenen Langzeitstudien (bis zu 34 Monate), in denen Patienten ohne Unterbruch Etanercept erhielten, war das klinische Ansprechen anhaltend und die Sicherheit war vergleichbar mit der in kürzeren Studien.
Eine Analyse der Daten aus klinischen Studien zeigte keine Krankheits-Charakteristika zu Beginn der Behandlung auf, die Ärzte bei der Auswahl der geeignetsten Dosierungsoption (intermittierend oder kontinuierlich) unterstützen würden. Demzufolge sollte die Therapiewahl (ob intermittierend oder kontinuierlich) basierend auf der individuellen Behandlungserfahrung des Patienten erfolgen.
Kinder und Jugendliche mit Plaque-Psoriasis
Die Wirksamkeit von Etanercept wurde in einer randomisierten, doppelblinden, placebo-kontrollierten Studie mit 211 Kindern und Jugendlichen im Alter von 4 bis 17 Jahren mit mittelschwerer bis schwerer Plaque-Psoriasis (definiert durch einen sPGA-Score von ≥3, einschliesslich ≥10% an betroffener Körperoberfläche (BSA) und einem PASI von ≥12) untersucht. Geeignete Patienten hatten in der Vergangenheit eine Lichttherapie oder eine systemische Therapie erhalten oder hatten unzureichend auf eine topische Therapie angesprochen.
Die Patienten erhielten für einen Zeitraum von 12 Wochen einmal wöchentlich 0,8 mg Etanercept /kg Körpergewicht (bis zu 50 mg) bzw. Placebo. In Woche 12 zeigten mehr der in der Etanercept-Gruppe randomisierten Patienten ein positives Ansprechen bzgl. der Wirksamkeit (z.B. PASI 75) als die randomisierten Patienten der Placebo-Gruppe.
Ergebnisse nach 12 Wochen bei Kindern und Jugendlichen mit Plaque-Psoriasis
|
|
Etanercept |
Placebo |
|
PASI 75, n (%) |
60 (57%)a |
12 (11%) |
|
PASI 50, n (%) |
79 (75%)a |
24 (23%) |
|
sPGA befallsfrei bzw. minimal, n (%) |
56 (53%)a |
14 (13%) |
Abkürzung: sPGA-static Physician Global Assessment.
a: p<0,0001 im Vergleich zu Placebo.
Nach 12 Wochen der doppelblinden Behandlungs-Phase erhielten alle Patienten einmal wöchentlich 0,8 mg Etanercept /kg Körpergewicht (bis zu 50 mg) für weitere 24 Wochen. Die jeweils beobachteten Ansprechraten der offenen und der doppelblinden Studienphasen waren vergleichbar.
Im Vergleich mit den Patienten, die wieder zu der Etanercept-Gruppe randomisiert worden waren, entwickelten während einer randomisierten Absetzphase signifikant mehr Patienten einen Krankheitsrückfall (Verlust des PASI 75-Ansprechens), die wieder zu der Placebo-Gruppe randomisiert worden waren. Bei kontinuierlicher Therapie blieben die Ansprechraten für bis zu 48 Wochen erhalten.
Die über die oben erwähnte 48 Wochen Studie hinaus anhaltende Sicherheit und Wirksamkeit von Etanercept 0,8 mg/kg Körpergewicht (bis zu einer Maximaldosis von 50 mg) einmal wöchentlich wurde in einer offenen Erweiterungsstudie mit 181 pädiatrischen Patienten mit Plaque Psoriasis bis zu einer Dauer von 2 Jahren beurteilt. Die Langzeitanwendung von Etanercept zeigte keine neuen Sicherheitsaspekte. Das gesamte Nutzen-Risiko Profil blieb positiv und vergleichbar mit den ursprünglichen 48 Wochen Studienergebnissen.
Vergleichende klinische Studie mit Erelzi
Die Vergleichbarkeit von Erelzi zum Etanercept-Vergleichspräparat wurde in einer randomisierten, doppelblinden, multizentrischen Studie bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis gezeigt. Die Patienten erhielten entweder 50 mg Erelzi (264 Patienten) oder das Etanercept Vergleichspräparat (267 Patienten) zweimal wöchentlich. Der Primärendpunkt war die PASI75-Ansprechrate in Woche 12. Die klinische Äquivalenz von Erelzi und dem Etanercept-Vergleichspräparat wurde für den primären Endpunkt PASI75 in Woche 12 gezeigt:
Der Behandlungsunterschied zwischen Erelzi und dem Etanercept-Vergleichspräparat betrug -2,3% (95%-Konfidenzintervall -9,85%, +5,30%). Das 95%-Konfidenzintervall lag innerhalb der vordefinierten Äquivalenzgrenzen von -18%, +18%).
Zusammenfassend bestätigt die klinische Studie bei Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, dass die therapeutische Wirksamkeit von Erelzi vergleichbar ist mit dem Etanercept-Vergleichspräparat.
Pharmakokinetik
Absorption
Etanercept wird langsam von der Einstichstelle der subkutanen Injektion resorbiert, wobei eine maximale Konzentration nach ca. 48 h nach Gabe einer Einzeldosis erreicht wird. Die absolute Bioverfügbarkeit liegt bei 76%. Es ist zu erwarten, dass bei zweimal wöchentlicher Gabe die Steady-State-Konzentrationen ungefähr doppelt so hoch sind wie die Konzentrationen nach Gabe einer Einzeldosis. Nach subkutaner Einzelgabe von 25 mg Etanercept wurden in gesunden Probanden durchschnittliche maximale Serumkonzentrationen von 1,65±0,66 µg/ml festgestellt; die Fläche unter der Konzentrations-Zeit-Kurve betrug 235±96,6 µg × h/ml. Die Dosisproportionalität wurde nicht gezielt bestimmt, jedoch wurde innerhalb des Dosierungsbereiches keine Sättigung der Clearance festgestellt.
Distribution
Die Konzentrations-Zeit-Kurve von Etanercept verläuft biexponentiell. Für Etanercept beträgt das zentrale Verteilungsvolumen 7,6 l, wogegen das Verteilungsvolumen unter Steady-State-Bedingungen bei 10,4 l liegt.
Im Steady State betrugen die Mittelwerte des Serumkonzentrationsprofils bei Patienten mit rheumatoider Arthritis: Cmax: 2,4 mg/l vs. 2,6 mg/l, Cmin: 1,2 mg/l vs. 1,4 mg/l; die partielle AUC betrug 297 mg × h/l vs. 316 mg × h/l [Angaben für 50 mg Etanercept einmal wöchentlich (n=21) versus 25 mg Etanercept zweimal wöchentlich (n=16)]. In einer offenen «single-dose»- und «cross-over»-Studie mit zwei Behandlungsarmen bei gesunden Probanden zeigte sich, dass die Gabe einer einzigen Injektion von 50 mg Etanercept pro ml bioäquivalent zu zwei Simultan-Injektionen mit je 25 mg Etanercept pro ml war.
In einer populationspharmakokinetischen Analyse bei Patienten mit Morbus Bechterew betrug der AUC Wert im Steady State 466 µg × h/ml nach Verabreichung von 50 mg Etanercept einmal wöchentlich (n=154) beziehungsweise 474 µg × h/ml bei der Gabe von 25 mg Etanercept zweimal wöchentlich (n=148).
Elimination
Etanercept wird langsam aus dem Körper ausgeschieden. Die Halbwertszeit ist lang und liegt bei etwa 70 h. Bei Patienten mit rheumatoider Arthritis beträgt die Clearance ungefähr 0,066 l/h und liegt damit ein wenig unterhalb des in gesunden Probanden bestimmten Wertes von 0,11 l/h.
Die pharmakokinetischen Eigenschaften von Etanercept bei Patienten mit rheumatoider Arthritis, Morbus Bechterew und Plaque-Psoriasis sind ähnlich.
Kinetik spezieller Patientengruppen
Obwohl nach Verabreichung von radioaktiv markiertem Etanercept an Patienten und Probanden eine Elimination der Radioaktivität im Urin festgestellt wurde, wurden bei Patienten mit akutem Nieren- oder Leberversagen keine erhöhten Etanercept-Konzentrationen festgestellt. Bei bestehender Nieren- oder Leberinsuffizienz sollte eine Dosisanpassung nicht erforderlich sein. Ein Unterschied in der Pharmakokinetik bei Männern und Frauen wurde nicht beobachtet.
Kombinationstherapie mit Methotrexat
Methotrexat hat keinen Einfluss auf die Pharmakokinetik von Etanercept. Obwohl es unwahrscheinlich ist, kann ein Einfluss von Etanercept auf die Pharmakokinetik und Sicherheit von Methotrexat nicht ausgeschlossen werden.
Alter
In einer Populations-Pharmakokinetik-Studie wurde der Einfluss des fortgeschrittenen Alters auf die Etanercept-Serumkonzentrationen untersucht. Die geschätzte Clearance und das geschätzte Verteilungsvolumen waren für Patienten zwischen 65 und 87 Jahren ähnlich wie die Schätzungen für Patienten unter 65.
Kinder und Jugendliche mit juveniler idiopathischer Arthritis
In einer Etanercept -Studie zu polyartikulär verlaufender juveniler idiopathischer Arthritis erhielten 69 Patienten (im Alter von 4 bis 17 Jahren) 0,4 mg Etanercept/kg zweimal wöchentlich über drei Monate. Die Serumkonzentrationsprofile waren mit denjenigen bei Erwachsenen mit rheumatoider Arthritis vergleichbar.
Kinder und Jugendliche mit Plaque-Psoriasis
Kinder und Jugendliche mit Plaque-Psoriasis (im Alter von 4 bis 17 Jahren) erhielten einmal wöchentlich 0,8 mg Etanercept/kg Körpergewicht (bis zu einer Maximaldosis von 50 mg pro Woche) für bis zu 48 Wochen. Im Steady State reichten die mittleren Serum-Talspiegel von 1,6 bis 2,1 µg/ml in Woche 12, 24 und 48. Bei Kindern und Jugendlichen mit Plaque-Psoriasis und Patienten mit juveniler idiopathischer Arthritis (die zweimal wöchentlich 0,4 mg Etanercept/kg Körpergewicht bis zu einer Maximaldosis von 50 mg pro Woche erhielten) waren diese mittleren Konzentrationen vergleichbar. Das gleiche gilt für erwachsene Patienten mit Plaque-Psoriasis, die zweimal wöchentlich 25 mg Etanercept erhielten.
Präklinische Daten
In Studien zur Toxikologie von Etanercept wurde keine Dosis-begrenzende oder Zielorgan-Toxizität festgestellt. Aufgrund der Ergebnisse einer Vielzahl von in vitro und in vivo Studien wird Etanercept für nicht-mutagen befunden. Bedingt durch die Entwicklung von neutralisierenden Antikörpern in Nagetieren wurden mit Etanercept keine Kanzerogenitätsstudien sowie Standarduntersuchungen zur Fertilität und postnatalen Toxizität durchgeführt.
Die subkutane Gabe von Einzeldosen von 2000 mg Etanercept/kg KG oder die intravenöse Einzelgabe von 1000 mg Etanercept/kg KG rief in Mäusen oder Ratten keine Letalität oder sichtbaren Anzeichen von Toxizität hervor. Nach zweimal wöchentlicher subkutaner Gabe von Dosierungen (15 mg/kg KG), die, bezogen auf AUC, zu Serumspiegeln führten, die mehr als 27-fach höher waren als bei Patienten mit rheumatoider Arthritis nach Gabe der empfohlenen Dosis von 25 mg, über 4 oder 26 aufeinanderfolgende Wochen wurde keine Dosis-begrenzende oder Zielorgan-Toxizität durch Etanercept in Cynomolgus-Affen hervorgerufen.
Die präklinischen Studien, die mit Erelzi durchgeführt wurden, ergaben keine zusätzlichen sicherheitsrelevanten Befunde.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Erelzi darf nur bis zu dem auf der Packung mit «EXP» angegebenen Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, im Kühlschrank (2−8 °C) und ausser Reichweite von Kindern lagern. Nicht einfrieren.
Erelzi Injektionslösung in Fertigspritze bzw. Fertigpen kann während einer einzelnen Zeitperiode von bis zu 4 Wochen bei Raumtemperatur (bis zu einem Maximum von 25 °C) gelagert werden. Erelzi Injektionslösung in Fertigspritze bzw. Fertigpen, welches nicht innerhalb von vier Wochen nach Entnahme aus dem Kühlschrank und Lagerung bei 15–25 °C verwendet wurde, muss verworfen werden und darf nicht mehr gekühlt werden.
Der Patientin/dem Patienten sollte empfohlen werden, sich das Datum, an welchem sie/er Erelzi aus dem Kühlschrank entnommen hat und das Datum, nach welchem Erelzi nicht mehr verwendet werden darf auf der Faltschachtel zu notieren.
Injektionslösung in der Fertigspritze bzw. im Fertigpen
Das Arzneimittel in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
Injektionslösung in der Fertigspritze
Vor der Verabreichung der Injektion sollte die Fertigspritze auf Raumtemperatur gebracht werden, weshalb sie ca. 15−30 Minuten vorher aus dem Kühlschrank zu entnehmen ist. Die Nadelschutzkappe bleibt während dieser Zeit aufgesetzt. Die Fertigspritze darf nicht geschüttelt werden.
Die Lösung sollte klar oder leicht schillernd, farblos bis leicht gelblich sein und kann kleine durchscheinende oder weisse Proteinpartikel enthalten. Wenn sie verfärbt ist, die Flüssigkeit trübe erscheint oder Klumpen, Flocken oder andere als die beschriebenen Partikel enthält, darf sie nicht verwendet werden.
Injektionslösung im Fertigpen
Vor der Verabreichung der Injektion sollte der mit Erelzi vorgefüllte Einweg-Pen SensoReady auf Raumtemperatur gebracht werden, weshalb er ca. 15−30 Minuten vorher aus dem Kühlschrank zu entnehmen ist. Die Nadelschutzkappe bleibt während dieser Zeit aufgesetzt. Prüfen Sie die Lösung durch das Sichtfenster; sie sollte klar oder schillernd, farblos bis leicht gelblich sein und kann kleine durchscheinende oder weisse Proteinpartikel enthalten. Wenn sie verfärbt, trübe ist oder Klumpen, Flocken oder andere als die beschriebenen Partikel enthält, darf sie nicht verwendet werden.
Nicht verwendete Arzneimittel oder Abfallmaterial sind zu entsorgen.
Zulassungsnummer
66175, 66176 (Swissmedic).
Packungen
Injektionslösung in Fertigspritze
Erelzi 25 mg/0,5 ml: Packungen zu 1, 2 und 4 Fertigspritzen. [B]
Erelzi 25 mg/0,5 ml: Bündelpackungen zu 12 Fertigspritzen (3 Packungen zu 4 Fertigspritzen). [B]
Erelzi 50 mg/1,0 ml: Packungen zu 1, 2 und 4 Fertigspritzen. [B]
Erelzi 50 mg/1,0 ml: Bündelpackungen zu 12 Fertigspritzen (3 Packungen zu 4 Fertigspritzen). [B]
Injektionslösung im Fertigpen
Erelzi SensoReady 50 mg/1,0 ml: Packungen zu 1, 2 und 4 Fertigpens. [B]
Erelzi SensoReady 50 mg/1,0 ml: Bündelpackungen zu 12 Fertigpens (3 Packungen zu 4 Fertigpens). [B]
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz.
Stand der Information
Dezember 2017.