Zusammensetzung
Wirkstoffe
Mercaptamin (Cysteamin)
Hilfsstoffe
Benzalkoniumchlorid (0.1 mg/ml Lösung), Natriumedetat, Carmellose-Natrium, Citronensäure-Monohydrat, Natriumhydroxid (zur pH-Anpassung), Salzsäure (zur pH-Anpassung), Wasser für Injektionszwecke.
Indikationen/Anwendungsmöglichkeiten
Cystadrops ist zur Behandlung von Cystinablagerungen in der Hornhaut bei Erwachsenen und Kindern ab 2 Jahren mit Cystinose indiziert.
Dosierung/Anwendung
Die Einleitung der Behandlung mit Cystadrops muss unter Aufsicht eines Arztes oder einer Ärztin erfolgen, der/die über Erfahrung in der Behandlung von Cystinose verfügt.
Dosierung
Die empfohlene Dosis beträgt 4-mal täglich einen Tropfen pro Auge während der Wachstunden. Der empfohlene Abstand zwischen den einzelnen Einträufelungen beträgt 4 Stunden. Die Dosis kann in Abhängigkeit vom Ergebnis der Augenuntersuchung (wie z. B. Beurteilung der Cystinablagerungen in der Hornhaut, Photophobie) schrittweise (auf eine tägliche Mindestdosis von 1 Tropfen pro Auge) verringert werden.
Wenn der Patient bzw. die Patientin die Anwendung der Augentropfen einmal vergisst, ist er/sie anzuweisen, die Behandlung mit der nächsten Einträufelung fortzusetzen.
Die Dosis von 4 Tropfen täglich pro Auge darf nicht überschritten werden.
Wird die Behandlung mit Cystadrops unterbrochen, nimmt die Ansammlung von Cystinkristallen in der Hornhaut zu. Die Behandlung darf nicht abgebrochen werden.
Kinder und Jugendliche
Cystadrops kann bei Kindern ab 2 Jahren mit der gleichen Dosis wie bei Erwachsenen angewendet werden (siehe Abschnitt «klinische Wirksamkkeit und Sicherheit»).
Die Sicherheit und Wirksamkeit von Cystadrops bei Kindern im Alter von unter 2 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Zur Anwendung am Auge.
Um die Anwendung zu erleichtern, sollte dem Patienten/der Patientin mitgeteilt werden, dass er/sie Cystadrops vor der ersten Anwendung zunächst auf Raumtemperatur bringen sollte. Dem Patienten/der Patientin sollte mitgeteilt werden, das er/sie die Tropfer-Flasche nach dem ersten Öffnen bei Raumtemperatur aufbewahren soll.
Um verklebte Augen am Morgen zu vermeiden, sollte der Patient/die Patientin die letzte Anwendung der Augentropfen mindestens 30 Minuten vor dem Zubettgehen vornehmen.
Um eine Kontamination der Tropferspitze und der Lösung zu vermeiden, ist darauf zu achten, dass die Augenlider, die umgebenden Bereiche sowie andere Oberflächen nicht mit der Spitze der Tropfer-Flasche in Berührung kommen.
Der Patient/die Patientin ist anzuweisen, die Tropfer-Flasche nach 7 Tagen Anwendung zu entsorgen.
Bei einer Begleittherapie mit anderen topischen Arzneimitteln zur Anwendung am Auge sollte zwischen den aufeinanderfolgenden Anwendungen ein zeitlicher Abstand von zehn Minuten liegen. Augensalben sind zuletzt anzuwenden.
Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt «Zusammensetzung, Hilfsstoffe» genannten sonstigen Bestandteile.
Warnhinweise und Vorsichtsmassnahmen
Cystadrops enthält Benzalkoniumchlorid.
Es liegen Berichte vor, dass Benzalkoniumchlorid Reizungen am Auge und trockene Augen hervorrufen und den Tränenfilm und die Hornhautoberfläche beeinträchtigen kann. Es sollte bei Patienten mit trockenen Augen und bei Patienten mit geschädigter Hornhaut mit Vorsicht angewendet werden.
Bei längerer Anwendung sollten die Patienten überwacht werden.
Kontaktlinsen
Benzalkoniumchlorid verfärbt bekanntermassen weiche Kontaktlinsen. Daher sollte der Kontakt mit weichen Kontaktlinsen vermieden werden. Patienten sind anzuweisen, Kontaktlinsen vor der Anwendung der Augentropfen zu entfernen und diese nach der Anwendung frühestens nach 15 Minuten wieder einzusetzen.
Interaktionen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Da die empfohlene Gesamttagesdosis der Mercaptamin (Cysteamin)-Grundsubstanz maximal ca. 0,4 % der empfohlenen oralen Höchstdosis der Mercaptamin (Cysteamin)-Grundsubstanz in allen Altersgruppen beträgt, sind keine Wechselwirkungen mit oral angewendeten Arzneimitteln zu erwarten.
Schwangerschaft, Stillzeit
Die empfohlene Gesamttagesdosis von Mercaptamin (Cysteamin) bei Anwendung am Auge liegt bei maximal ca. 0,4 % der empfohlenen oralen Höchstdosis von Mercaptamin in allen Altersgruppen. Die systemische Exposition mit Mercaptamin nach Anwendung am Auge ist daher geringer als nach Einnahme. Obgleich keine Wirkungen während der Schwangerschaft und Stillzeit erwartet werden, weil eine systemische Belastung mit Mercaptamin vernachlässigbar ist, sollten bei einer Begleittherapie mit oralem Mercaptamin Vorsichtsmassnahmen ergriffen werden.
Schwangerschaft
Es liegen keine adäquaten Daten zur Anwendung von Mercaptamin (Cysteamin) bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität einschliesslich Teratogenese gezeigt (siehe Abschnitt «Präklinische Daten»). Das mögliche Risiko für den Menschen ist nicht bekannt. Auswirkungen einer unbehandelten Cystinose auf eine Schwangerschaft sind ebenfalls nicht bekannt.
Daher sollte Mercaptamin während der Schwangerschaft, insbesondere während des ersten Trimesters, nicht oral angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Wenn eine Schwangerschaft festgestellt wird oder geplant ist, sollte eine Behandlung sorgfältig abgewogen und die Patientin über das mögliche Risiko einer Teratogenese bei Behandlung mit Mercaptamin informiert werden.
Stillzeit
Es ist nicht bekannt, ob Mercaptamin (Cysteamin) in die Muttermilch ausgeschieden wird. Aufgrund der Erkenntnisse aus Studien an säugenden Muttertieren und neugeborenen Tieren (siehe Abschnitt «Präklinische Daten») sollten Mütter Mercaptamin während der Stillzeit nicht oral anwenden.
Fertilität
Es liegen keine Daten zur Wirkung von Mercaptamin (Cysteamin) auf die Fertilität beim Menschen vor. Bei Studien an Tieren wurde eine verringerte Reproduktion festgestellt (siehe Abschnitt «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Cystadrops kann einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben.
Ein zeitweiliges (durchschnittlich weniger als 1 Minute) verschwommenes Sehen oder andere Sehstörungen können die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Wenn das verschwommene Sehen bei der Einträufelung auftritt, muss der Patient/die Patientin warten, bis er/sie wieder klar sehen kann, bevor er/sie ein Fahrzeug fährt oder Maschinen bedient.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Zu den häufigsten Nebenwirkungen gehören Augenschmerzen, okuläre Hyperämie, Augenjucken, verstärkte Tränensekretion, verschwommenes Sehen oder Augenreizung. Die meisten dieser Nebenwirkungen treten vorübergehend und überwiegend in leichter oder mässiger Form auf.
Tabellarische Liste der Nebenwirkungen
Die folgenden Nebenwirkungen wurden im Rahmen von klinischen Studien sowie dem französischem NPU-Programm (Named Patient Use-Programm) mit Cystadrops berichtet. Die beobachteten Nebenwirkungen sind nachstehend nach Systemorganklasse und Häufigkeit (pro Patient) aufgeführt.
Häufigkeit ist wie folgt definiert: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1‘000, < 1/100), selten (≥ 1/10‘000, < 1/1‘000), sehr selten (< 1/10‘000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Augenerkrankungen
Sehr häufig: Augenschmerzen, verschwommenes Sehen, Augenreizung, okuläre Hyperämie, Augenjucken, verstärkte Tränensekretion, Ablagerungen in den Augen
Häufig: gestörte Sinnesempfindung im Auge, trockenes Auge, Fremdkörpergefühl im Auge, Augenlidödem, Reizung des Augenlids, Sehstörung, Hordeolum
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Beschwerden am Ort der Einträufelung (hauptsächlich verklebte Augen und Augenwimpern)
Häufig: Schmerzen am Ort der Einträufelung
Kinder und Jugendliche
Häufigkeit, Art und Schweregrad der Nebenwirkungen sind bei Kindern und Erwachsenen identisch.
Im Rahmen klinischer Studien und des französischen NPU-Programmes wurden 69 Kinder beobachtet. Davon waren 19 Patienten jünger als 6 Jahre, 21 zwischen 6 und 12 Jahre und 29 zwischen 12 und 18 Jahre alt.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei einer Anwendung am Auge ist eine Überdosierung unwahrscheinlich.
Im Falle einer versehentlichen Einnahme ist der Patient/die Patientin zu überwachen und symptomatisch zu behandeln.
Eigenschaften/Wirkungen
ATC-Code
S01XA21
Pharmakotherapeutische Gruppe: Ophthalmologika, andere Ophthalmologika
Wirkungsmechanismus
Mercaptamin (Cysteamin) verringert die Ansammlung von Cystinkristallen in der Hornhaut. Es wirkt Cystin-senkend, indem es Cystin in Cystein und Cystein-Cysteamin Komplexe (gemischte Disulfide) umwandelt.
Pharmakodynamik
keine Angaben
Klinische Wirksamkeit
Es wurden zwei klinische Studien zu Cystadrops durchgeführt: eine einarmige klinische Studie mit 8 Kindern und Erwachsenen (OCT-1-Studie) und eine randomisierte, multizentrische, offene, aktiv kontrollierte klinische Phase-III-Studie (CHOC-Studie) mit 32 Patienten.
OCT-1-Studie
In dieser Studie wurden die Sicherheit und Wirksamkeit von Cystadrops über einen Zeitraum von 5 Jahren untersucht. Die Anpassung der Dosis erfolgte nach Augenuntersuchung. Während des 5-jährigen Nachbeobachtungszeitraums hat keiner der Patienten die Behandlung abgebrochen.
Die Wirksamkeit wurde anhand der im Rahmen der konfokalen In-vivo-Mikroskopie ermittelten Gesamtpunktzahl (IVCM-Score), für die die Cystinkristalle in den 7 Schichten der Hornhaut quantifiziert wurden, beurteilt. Nach 30-tägiger Behandlung und einer medianen Häufigkeit von 4 Einträufelungen pro Tag wurde eine 30%ige Abnahme des IVCM-Gesamt-Scores beobachtet. Bei 7 der 8 Patienten wurde mit einem medianen Dosierungsschema von 3 Tropfen/Auge/Tag (Bereich 1 bis 3 Tropfen) eine mittlere Abnahme der Cystinablagerungen in der Hornhaut um 30 % im Vergleich zum Ausgangswert aufrechterhalten. Die Photophobie tendierte im Zeitverlauf zu einer Besserung.
CHOC-Studie
Hierbei handelte es sich um eine randomisierte, Studie zur Beurteilung des Wirksamkeits- und Sicherheitsprofils von Cystadrops (verglichen mit demjenigen von Mercaptamin hydrochlorid 0.10 %) nach einer 90-tägigen Behandlung mit einem Dosierungsschema von viermal täglich 1 Tropfen Cystadrops bzw. Mercaptaminhydrochlorid 0,10 % in jedes Auge. Der primäre Wirksamkeitsendpunkt war der IVCM-Gesamt-Score. 15 Patienten erhielten Cystadrops, 17 Patienten erhielten Mercaptaminhydrochlorid 0.10 %. Der mittlere IVCM-Gesamt-Score wurde für je 11 Patienten (Cystadrops-Behandlungsarm und Mercaptaminhydrochlorid 0,10 %-Kontrollarm) berechnet. An Tag 30 wurde für den Cystadrops-Behandlungsarm ein Trend zu einem niedrigeren IVCM-Gesamt-Score beobachtet. Die mittlere Abnahme um 40 % im Cystadrops-Behandlungsarm (und die mittlere Abnahme um 0.7% im Mercaptaminhydrochlorid 0,10 %-Kontrollarm) wurde an Tag 90 bestätigt. Die Überlegenheit von Cystadrops gegenüber dem Kontrollarm (Mercaptaminhydrochlorid 0,10 %; p < 0,001, 95 % KI [2,11; 5,58]) mit einem Dosierungsschema von 4-mal täglich 1 Tropfen Cystadrops bzw. Mercaptaminhydrochlorid 0,10 % in jedes Auge wurde nachgewiesen. Ebenso wurde, bei 4mal täglicher Applikation von Cystadrops bzw. Mercaptamin hydrochlorid 0.10 % in der Kontrollgruppe, die Überlegenheit von Cystadrops gegenüber dem Kontrollarm (Mercaptaminhydrochlorid 0,10 %; p < 0,048, 95 % KI [0,23; 1,14]) in Bezug auf die vom Prüfarzt/von der Prüfärztin beurteilte Photophobie nachgewiesen.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Im Rahmen der beiden klinischen Studien (OCT-1- und CHOC-Studien) wurden klinische Daten zu Sicherheit und Wirksamkeit erhoben. Insgesamt 15 Kinder erhielten Cystadrops, von denen 3 (u. a. ein 2- und ein 3-jähriges Kind) jünger als 6 Jahre waren. Die Ergebnisse für Wirksamkeit und Sicherheit sind in der Kinder- und Erwachsenenpopulation identisch.
Die Europäische Arzneimittel-Agentur hat für Cystadrops eine Zurückstellung der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen bezüglich der Behandlung von Cystinablagerungen in der Hornhaut bei Cystinose-Patienten (siehe Abschnitt «Dosierung/Anwendung» bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen) gewährt.
Pharmakokinetik
Eine pharmakokinetische Beurteilung beim Menschen nach Anwendung von Cystadrops am Auge wurde nicht vorgenommen.
Absorption
Ähnlich wie bei anderen topisch angewendeten Augenarzneimitteln ist auch hier eine systemische Resorption wahrscheinlich.
Es ist zu beachten, dass die empfohlene Tagesdosis von Mercaptamin (Cysteamin)-Augentropfen nicht mehr als ca. 0,4 % der empfohlenen oralen Höchstdosis von Mercaptamin (Cysteamin) in allen Altersgruppen beträgt.
Distribution
nicht anwendbar
Metabolismus
nicht anwendbar
Elimination
nicht anwendbar
Präklinische Daten
Es wird eine geringe systemische Exposition nach Anwendung am Auge erwartet. Bei gleichzeitiger okularer und oraler Mercaptamin (Cysteamin)-Behandlung wird der Beitrag der okularen Anwendung zum systemischen Risiko als vernachlässigbar betrachtet.
Präklinische Daten zum oralen Mercaptamin (Cysteamin):
Es wurden Studien zur Genotoxizität durchgeführt. Eine Studie berichtete über eine Induktion von Chromosomaberrationen in kultivierten eukaryotischen Zelllinien. Spezifische Studien zu Mercaptamin zeigten im Ames-Test keine erbgutverändernde Wirkung bzw. im Maus-Mikronukleus-Test keine clastogene Wirkung.
Reproduktionstoxizität
Reproduktionsstudien zu Mercaptamin ergaben bei Ratten (Dosisstufe 100 mg/kg/Tag) und Kaninchen (Dosisstufe 50 mg/kg/Tag) toxische Wirkungen auf Embryo und Fötus (Resorptionen und Postimplantationsverluste). Für Ratten wurden teratogene Wirkungen beschrieben, wenn Mercaptamin während der Organbildungsphase mit einer Dosis von 100 mg/kg/Tag verabreichtet wurde.
Dies entspricht 0,6 g/m2/Tag bei Ratten und beträgt weniger als die Hälfte der empfohlenen klinischen Erhaltungsdosis von Mercaptamin, d. h. 1,30 g/m2/Tag. Bei einer Dosis von 375 mg/kg/Tag, bei der die Gewichtszunahme verzögert war, wurde bei Ratten eine verringerte Fertilität beobachtet. Bei dieser Dosis waren auch die Gewichtszunahme und Überlebensrate des Nachwuchses während der Säugephase verringert. Hohe Mercaptamin-Dosen beeinträchtigen die Fähigkeit der Muttertiere, ihren Nachwuchs zu säugen. Einzeldosen des Arzneimittels hemmen die Prolaktinsekretion bei Tieren.
Die Verabreichung von Mercaptamin bei neugeborenen Ratten hat zu Katarakten geführt.
Hohe Mercaptamin-Dosen, oral oder parenteral verabreicht, rufen Duodenalgeschwüre bei Ratten und Mäusen, jedoch nicht bei Affen hervor. Die experimentelle Verabreichung von Arzneimitteln verursacht eine Verringerung von Somatostatin bei verschiedenen Tierarten. Die Bedeutung dieser Erkenntnisse für die klinische Anwendung des Arzneimittels ist nicht bekannt.
Es wurden keine Studien zur Karzinogenität von Mercaptamin durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Vor dem ersten Öffnen: Im Kühlschrank (2°C - 8°C) aufbewahren.
Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Ausser Reichweite von Kindern aufbewahren.
Haltbarkeit nach Anbruch
Nach dem ersten Öffnen: 7 Tage haltbar. Nicht über 25 °C lagern. Nicht im Kühlschrank (2°C – 8°C) lagern. Flasche fest verschlossen halten und im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
5 ml Lösung in einer 10-ml-Flasche aus braunem Glas, mit einem Brombutyl-Stopfen verschlossen und einer abziehbaren Aluminiumkappe versiegelt. Ein PVC-Tropfer mit HDPE-Verschluss ist separat verpackt und in jeder Schachtel enthalten.
Jede Schachtel enthält 1 Flasche und 1 Verschluss mit Tropfer.
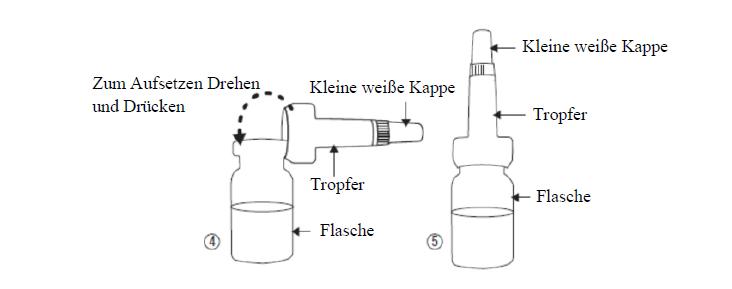
Der Patient/die Patientin ist anzuweisen, für das Öffnen der Flasche und dem Aufsetzen des Tropfers die untenstehenden Anweisungen zu befolgen:
·Waschen Sie sich gründlich die Hände, um eine mikrobiologische Kontamination des Inhalts der Flasche zu vermeiden.
·Nehmen Sie die grüne Schutzkappe ab (Abbildung 1).
·Entfernen Sie das Metallsiegel (Abbildung 2).
·Entfernen Sie den grauen Stopfen (Abbildung 3) von der Flasche.
·Nach dem Abnehmen des Stopfens darf die Öffnung des Fläschchens nicht mehr berührt werden.
·Nehmen Sie den Verschluss mit Tropfer aus dem Beutel, ohne die Seite zu berühren, die auf die Flasche aufgesetzt wird. Setzen Sie den Verschluss mit Tropfer auf die Flasche auf (Abbildung 4) und belassen Sie ihn dort.
·Bewahren Sie die kleine weisse Kappe (Abbildung 5) auf, die werksseitig auf dem Tropfer aufgesetzt ist.
Zulassungsnummer
67380 (Swissmedic).
Packungen
Packungen mit 1 Flasche à 5 ml und 1 Verschluss mit Tropfer (B).
Zulassungsinhaberin
Recordati AG, 4057 Basel
Stand der Information
September 2020